
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
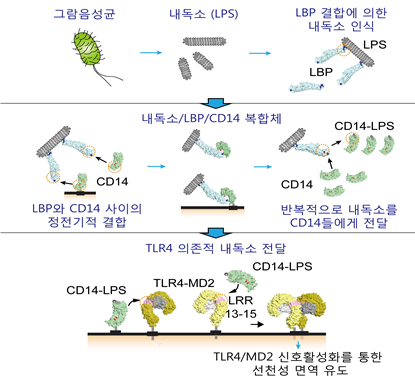
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
-
연구 심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉 우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다. 이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다. 심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy
2019-08-13 -
연구 김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉 우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다. 연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다. 연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다. 박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다. 폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을
2019-04-01 -
연구 김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다. 김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다. 김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다. 이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
2017-04-25 -
행사 의과학대학원, 연세대 의과대학과 교류협약서 체결
우리학교 의과학대학원(원장 유욱준)은 지난 22일(화) 교내 의과학연구센터에서 연세대학교 의과대학(학장 윤주헌)과 의과학 연구의 활성화를 위한 ‘포괄적 협력 교류 협약서’를 체결했다. 양 기관의 의과학 연구의 활성화와 기초 및 중개 의과학 분야의 연구능력 향상을 위한 상호 협력 및 교류를 목적으로 체결된 이번 협약에 따라 양 기관은 협력위원회를 설치하고 공동 연구, 인력 양성, 인적 교류, 학술 및 기술정보 교류, 공동 세미나 및 심포지엄 개최 등 다양한 협력 사업을 진행할 예정이다. 대표자들은 협약식 체결에 앞서 축사를 통해 “본 협약은 유명무실하고 형식적인 협약이 아닌, 실질적이고 실제적인 협약으로, 향후 KAIST 의과학대학원과 연세대학교 의과대학이 함께 세계적 의과학 연구기관으로 발전할 수 있는 기틀을 마련할 것”이라는 뜻을 전달했다. 이번 협약의 세부적인 실행 방안 및 협력 사업의 구체적 내용은 추후 설치될 협력
2011-02-23 -
연구 가상세포 이용해 병원균 잡는 항생제 개발
교육과학기술부는 미래기반기술개발사업(시스템생물학 연구)으로 지원한 우리학교 이상엽 교수팀(전남대 이준행교수, 생명(연), 화학(연) 공동연구)이 항생제에 내성을 가진 병원균 퇴치를 위해 시스템생물학을 기반으로 한 신약발굴 방법론을 개발했다고 밝혔다. 이 교수팀은 병원균이 항생제의 오남용으로 인해 치유가 쉽지 않은 점을 감안하여 내성 병원균의 가상세포를 만들어서 이에 대한 특성을 분석하여 제어하는 방법으로 효과를 입증했다. 이번 연구의 대상은 오염된 어패류에 의해 감염되는 패혈증의 병원균인 비브리오 불니피쿠스(Vibrio vulnificus, 이하 비브리오균) 중 내성균 2개이며, 이에 대한 게놈정보와 생물정보를 토대로 가상세포를 구축하였다. 이러한 가상세포가 생존하기 위해 필요한 화학물질은 193개로 분석되었으며, 이중에서 결정적 역할을 수행하는 5개의 화학물질을 추출하였으며, 이에 관여하는 유전자를 제거함으로써 내성 비브리오균의 성장이 억제되는 효과를 증명하였다. 이 교수팀
2011-01-19