
〈 정인경 교수, 이정운 박사과정 〉
우리 대학 생명과학과 정인경 교수와 美 루드윅 암 연구소(Ludwig Institute of Cancer Research) 빙 렌 (Bing Ren) 교수 공동 연구팀이 인체 조직의 3차원 게놈 지도를 해독하는 데 성공했다.
연구팀은 인체의 27개 부위 조직의 3차원 게놈 지도를 분석해 치매, 심혈관계 질환 등을 포함한 2만 7천여 개 이상의 복합 질환 관련 유전 변이 기능을 예측했다.
정인경 교수, 빙 렌 교수가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 제네틱스(Nature Genetics) 9월 10일 자 온라인판에 게재됐다. (논문명 : A compendium of promoter-centered long-range chromatin interactions in the human genome)
현재까지 수많은 연구를 통해 알츠하이머병, 파킨슨병, 자가면역질환 등 다양한 복합 질환의 원인을 규명하려는 시도가 이뤄지면서 실제 다수의 질환과 관련한 중요 유전변이가 발견됐다.
하지만 이들 대부분의 유전변이는 DNA가 단백질을 생성하지 않는 비전사 지역에 존재하기 때문에 1차원적 DNA 서열 분석에 기반한 유전체 연구로는 모든 기능을 규명하는 데 한계가 있다.
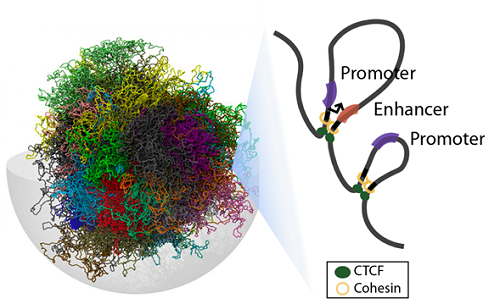
이에 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비전사 지역에 존재하는 유전변이도 3차원 게놈 구조에 의해 형성되는 염색질 고리 구조(chromatin loop)를 통해 멀리 떨어진 유전자를 조절할 수 있다는 모델을 제시했다.
그러나 이러한 3차원 게놈 구조 연구는 몇 가지 세포주를 대상으로만 국한돼 있고, 질환과 직접 연관이 있는 각 인체 조직을 표적으로 한 게놈 3차 구조는 규명되지 않았다.
연구팀은 인체 내의 27개 조직을 대상으로 이들 게놈의 3차원 구조를 규명하기 위해 전사촉진 부위만 선택적으로 분석하는 ‘표적 염색질 3차 구조 포착법(promoter-capture Hi-C)’이라 불리는 신규 실험 기법을 활용해 고해상도의 3차원 게놈 참조 지도를 작성했다.
그 결과 인간 게놈에 존재하는 약 90만 개의 게놈 3차원 염색질 고리 구조를 발굴하고, 이들 중 상당수가 각 인체 조직 특이적으로 존재한다는 사실도 규명했다.
연구팀은 3차원 게놈 구조를 기반으로 지금까지 기능이 명확하게 정의되지 않은 2만 7천여 개 이상의 질환 연관 유전 변이의 표적 유전자를 정의해 이들 변이의 기능을 예측했다. 나아가 각 질환의 표적 유전자 유사도에 기반해 질환과 질환 사이의 신규 관계를 규명했고, 이를 바탕으로 여러 질환에 공통으로 관여하는 신규 분자 기전을 제시했다.
정 교수는 “복합 질환 기전 규명을 위해 비전사 게놈의 중요성을 강조하고 존재하는 다수의 중요 유전변이를 3차원 게놈 구조 해독을 통해 규명 가능함을 보였다”라며 “이번 결과는 퇴행성 뇌 질환을 포함 다양한 복합 질환의 신규 기전 규명 및 표적 발굴에 활용될 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업, 보건복지부 질환극복기술개발사업, 서경배 과학재단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 3차원 게놈 구조 모식도 (modified from Stefano et al., 2016)
-
연구 미토콘드리아 DNA 돌연변이를 밝혀내다
우리 몸의 세포는 평생 동안 DNA 돌연변이를 지속적으로 축적하며, 이는 세포 간의 유전적 다양성(모자이시즘) 및 세포 노화를 초래한다. 한국 연구진이 세포소기관 미토콘드리아 DNA의 인체 내 모자이시즘 현상을 최초로 규명했다. 우리 대학 의과학대학원 주영석 교수 연구팀 안지송 박사과정이 미토콘드리아 DNA 돌연변이 연구를 주도해 국제 과학학술지 ‘네이처 지네틱스(Nature Genetics)’ 7월 22일 字 온라인판에 게재했다고 24일 밝혔다. (논문명: Mitochondrial DNA mosaicism in normal human somatic cells). 이번 연구에는 서울대학교 의과대학, 연세대학교 의과대학, 고려대학교 의과대학, 국립암센터, 그리고 KAIST 교원창업기업 이노크라스의 연구자들도 참여했다. 미토콘드리아는 세포 에너지 대사 및 사멸에 관여하는 세포소기관으로, 세포핵과 독립적으로 자체 DNA를 가지고 있으며 돌연변이도
2024-07-24 -
연구 항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다. 우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다. 최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는
2023-05-17 -
연구 세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr) 공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다. 정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome
2020-12-28 -
행사 이정호 교수, 아산의학상 젊은 의학자 부문상 수상
우리 학교 의과학대학원 이정호 교수가 제6회 아산의학상 젊은 의학자 부문상을 수상했다. 이 교수에게는 상패와 상금 5000만원이 주어진다. 이정호 교수는 뇌 발달 장애의 발병 메커니즘을 규명하는 연구 활동을 수행해왔다. 이를 통해 세계적인 학술지에 연구 성과들을 발표해 차세대 의학자로 주목받고 있다. 이 교수는 차세대 염기서열분석법을 이용해 국소 대뇌 피질 발달 장애를 일으키는 돌연변이를 발견해 소아 난치성 뇌전증 치료를 위한 새로운 장을 마련했다. 국소 대뇌 피질 발달 장애는 소아 난치성 뇌전증의 가장 흔한 원인으로 알려져 있다. 이 연구결과는 지난 2012년 6월 유전학 분야의 세계 최고 권위 학술지 "네이처 지네틱스(Nature Genetics)"에 게재됐다. 아산의학상은 정몽준 아산사회복지재단 이사장이 인류의 건강증진을 위해 기초의학 및 임상의학 분야에서 뛰어난 업적을 이룬 국내 의과학자를 격려하기 위해 지난 2007년 제정했다. 아산재단은 지난해 6월부터
2013-01-21 -
연구 뇌신경 보호유전자 세계 첫 발견
KAIST 생명과학과 김재섭 교수(43세)팀은 지나친 자극으로부터 신경세포를 보호하는 유전자를 세계 최초로 발견하고, 이 유전자를 열병을 뜻하는 파이렉시아(Pyrexia)라고 명명했다. 이 유전자는 채널 단백질을 만들며, 이 채널은 섭씨 39도 이상의 고온에 의해 작동된다. 특히 이제까지 온도에 의해 작동되는 채널 단백질들은 여러 종류 발견되었으나, 자극으로부터 신경을 보호하는 채널은 파이렉시아가 처음이다. 이 유전자는 신경세포가 고온에 대해 과민하게 흥분하여 스트레스성 반응을 보이고 이로 인해 기능이 손상되는 것을 방지한다. 또한 이 유전자의 기능이 약화되면 섭씨 40도 고온에서 수분 내에 신경기능이 마비되지만, 이 유전자의 기능이 강화되면 이러한 고온에서도 신경세포의 기능이 손상되지 않고 정상적으로 작동한다. KAIST 김재섭 교수는 "파이렉시아 채널을 인위적으로 작동시키는 약(화합물)을 개발할 경우, 상습적 마약 복용 등으로 신경이 과도하게 자극되어 뇌기능이 손
2005-01-31