%EB%A9%94%EB%94%94%EC%8B%A0
-
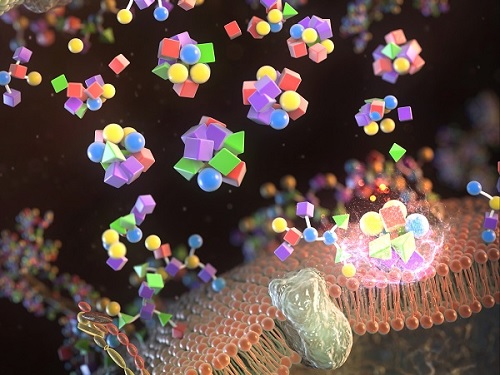 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 12101
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 12101 -
 주의력결핍 과잉행동장애의 유전적 요인 규명
- 네이처 메디신 온라인 판에 4월 18일 게재
- “새로운 주의력결핍 과잉행동장애 치료법 개발의 가능성 열어”
우리학교 생명과학과 김은준 교수와 강창원 교수의 공동연구팀이 주의력결핍 과잉행동장애(ADHD)가 뇌의 신경 시냅스 단백질(GIT1)이 부족해서 발생한다는 것을 세계 최초로 밝혔다.
전 세계 취학아동의 5% 정도가 겪고 있는 ADHD(Attention Deficit Hyperactivity Disorder)는 주의가 산만하고 지나친 행동을 하면서 충동적 성향을 보이는 성장기 아동의 뇌 발달 장애다.
연구팀은 이 증상이 있는 아동들과 없는 아동들의 유전자형을 비교하는 유전역학 연구를 통해 GIT1 유전자의 염기 한 개가 달라서, 이 단백질이 적게 만들어지는 아동들에서 ADHD의 발병 빈도가 현저히 높다는 것을 발견했다.
또한, 생쥐 실험에서 GIT1의 유전자를 제거해 이 단백질을 합성하지 못하게 하면 ADHD 증상을 보인다는 것을 동물행동 분석 및 신경과학 실험을 통해 밝힘으로써 GIT1과 ADHD의 인과관계를 뒷받침했다.
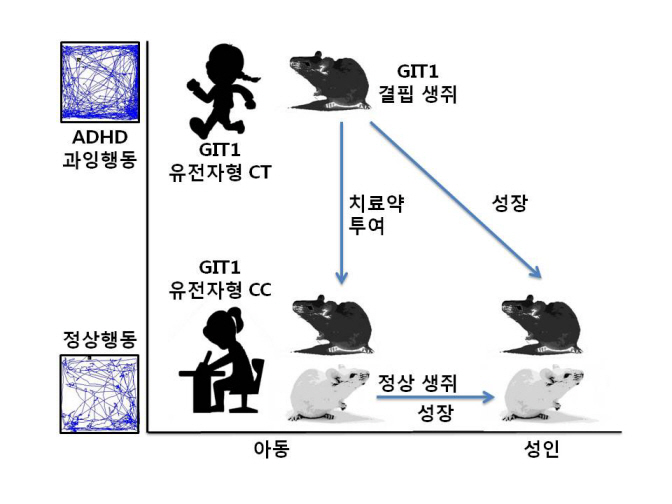
GIT1 결핍 생쥐들이 사람의 ADHD처럼 과잉행동을 보이고, 학습능력이 떨어지며 비정상적인 특이 뇌파를 내는 것을 확인한 것이다. 아울러 이런 생쥐에 ADHD 치료약을 투여하면 ADHD 증상들이 사라지는 것도 확인됐다.
ADHD 아동이 성인이 되면 과잉행동이 없어지는데, GIT1 결핍 생쥐도 2개월째에는 보이던 과잉행동이 7개월(사람의 20-30세에 해당)이 되면 사라지는 것을 확인했다.
KAIST 생명과학과 김은준 교수는 “신경세포를 흥분시키는 기작과 진정시키는 기작이 균형을 이뤄야 하는데, GIT1이 부족하면 진정 기작이 취약해서 과잉행동을 억제하지 못하는 것으로 추정한다”고 말했다.
또한, 같은 학과의 강창원 교수는 “이번 연구 성과는 ADHD 발병기작을 연구하거나 신약을 개발하는 데 GIT1 결핍 생쥐를 모델생물로 사용할 수 있게 돼 새로운 ADHD 치료법 개발의 가능성을 열었다는 평가를 받고 있다”고 말했다.
이번 연구 성과는 의약학계 세계 최고 학술지인 네이처 메디신(Nature Medicine, Impact Factor 27.136)의 4월 18일자 온라인 판에 게재됐다. 특히, 이 학술지에 게재된 논문 중 그 중요성을 인정받아 전 세계 언론에 특별히 소개됐다.
한편, 이번 연구는 한국연구재단의 창의적연구진흥사업을 수행하는 김은준 교수 연구실의 원혜정, 마원 박사과정 학생과 핵심연구지원사업을 수행하는 강창원 교수 연구실의 김은진 박사가 주도했다.
이외에도 김대수(KAIST 생명과학과), 정재승(KAIST 바이오및뇌공학과), 조수철, 김재원(서울대병원 소아정신과), 최세영(서울대 치대 생리학교실) 교수의 연구팀들이 참여했으며, 신경생물학, 유전체학, 신경유전학, 신경생리학, 뇌공학, 소아정신과 등 여러 분야 전문가들이 협업해 성공한 모범적 사례다.
※ 그림 설명
GIT1 결핍 생쥐가 ADHD 아동처럼 어려서는 과잉행동을 보이다가 성장하면 정상이 되고, ADHD 치료약을 투여해도 정상이 된다.
2011.04.18 조회수 20146
주의력결핍 과잉행동장애의 유전적 요인 규명
- 네이처 메디신 온라인 판에 4월 18일 게재
- “새로운 주의력결핍 과잉행동장애 치료법 개발의 가능성 열어”
우리학교 생명과학과 김은준 교수와 강창원 교수의 공동연구팀이 주의력결핍 과잉행동장애(ADHD)가 뇌의 신경 시냅스 단백질(GIT1)이 부족해서 발생한다는 것을 세계 최초로 밝혔다.
전 세계 취학아동의 5% 정도가 겪고 있는 ADHD(Attention Deficit Hyperactivity Disorder)는 주의가 산만하고 지나친 행동을 하면서 충동적 성향을 보이는 성장기 아동의 뇌 발달 장애다.
연구팀은 이 증상이 있는 아동들과 없는 아동들의 유전자형을 비교하는 유전역학 연구를 통해 GIT1 유전자의 염기 한 개가 달라서, 이 단백질이 적게 만들어지는 아동들에서 ADHD의 발병 빈도가 현저히 높다는 것을 발견했다.
또한, 생쥐 실험에서 GIT1의 유전자를 제거해 이 단백질을 합성하지 못하게 하면 ADHD 증상을 보인다는 것을 동물행동 분석 및 신경과학 실험을 통해 밝힘으로써 GIT1과 ADHD의 인과관계를 뒷받침했다.
GIT1 결핍 생쥐들이 사람의 ADHD처럼 과잉행동을 보이고, 학습능력이 떨어지며 비정상적인 특이 뇌파를 내는 것을 확인한 것이다. 아울러 이런 생쥐에 ADHD 치료약을 투여하면 ADHD 증상들이 사라지는 것도 확인됐다.
ADHD 아동이 성인이 되면 과잉행동이 없어지는데, GIT1 결핍 생쥐도 2개월째에는 보이던 과잉행동이 7개월(사람의 20-30세에 해당)이 되면 사라지는 것을 확인했다.
KAIST 생명과학과 김은준 교수는 “신경세포를 흥분시키는 기작과 진정시키는 기작이 균형을 이뤄야 하는데, GIT1이 부족하면 진정 기작이 취약해서 과잉행동을 억제하지 못하는 것으로 추정한다”고 말했다.
또한, 같은 학과의 강창원 교수는 “이번 연구 성과는 ADHD 발병기작을 연구하거나 신약을 개발하는 데 GIT1 결핍 생쥐를 모델생물로 사용할 수 있게 돼 새로운 ADHD 치료법 개발의 가능성을 열었다는 평가를 받고 있다”고 말했다.
이번 연구 성과는 의약학계 세계 최고 학술지인 네이처 메디신(Nature Medicine, Impact Factor 27.136)의 4월 18일자 온라인 판에 게재됐다. 특히, 이 학술지에 게재된 논문 중 그 중요성을 인정받아 전 세계 언론에 특별히 소개됐다.
한편, 이번 연구는 한국연구재단의 창의적연구진흥사업을 수행하는 김은준 교수 연구실의 원혜정, 마원 박사과정 학생과 핵심연구지원사업을 수행하는 강창원 교수 연구실의 김은진 박사가 주도했다.
이외에도 김대수(KAIST 생명과학과), 정재승(KAIST 바이오및뇌공학과), 조수철, 김재원(서울대병원 소아정신과), 최세영(서울대 치대 생리학교실) 교수의 연구팀들이 참여했으며, 신경생물학, 유전체학, 신경유전학, 신경생리학, 뇌공학, 소아정신과 등 여러 분야 전문가들이 협업해 성공한 모범적 사례다.
※ 그림 설명
GIT1 결핍 생쥐가 ADHD 아동처럼 어려서는 과잉행동을 보이다가 성장하면 정상이 되고, ADHD 치료약을 투여해도 정상이 된다.
2011.04.18 조회수 20146 -
 강정구 교수연구팀, 코어/쉘 구조 나노입자-나노튜브 혼성체 개발
- 어드밴스트 펑셔널 머터리얼 표지 논문 게재 -
우리대학 강정구 교수팀은 질소가 포함된 카본나노튜브를 이용한 코어/쉘 형태의 화학적으로 안정한 초상자성(자성입자의 크기가 작아지면서 수많은 전자스핀들이 하나같이 움직이는 거대자성 상태) 나노입자-나노튜브 혼성체를 합성하는 기술을 개발하였다.
이번 연구는 교육과학기술부와 한국연구재단이 지원하는 중견연구자지원사업(구 국가지정연구실사업)의 지원을 받아 KAIST 강정구(姜正九, 41세) 교수 연구팀(이정우 연구원(박사 4년))의 연구 성과로서, 연구 결과는 어드밴스트 펑셔널 머터리얼즈(Advanced Functional Materials) 인쇄판 표지논문으로 7월 24일 게재될 예정이다. 강 교수는 2008년 12월 앙게반테 케미(Angewandte Chemie) 표지 게재에 연이은 7개월 만의 주목할 만한 연구 실적이다.
현재까지 자성 나노입자의 크기를 제어하여 촉매, 바이오 메디신, 데이터 저장체 등에 상당히 효율적으로 이용할 수 있는 기술을 개발해 왔으나, 상당히 복잡한 공정을 통해 제조되어 균일한 크기의 나노입자 제조에 어려움이 있었다.
또한, 자성 나노입자는 합성 후 외부 화학적 분위기에 의해 자성특성이 변화하여 원하는 특성을 유지하기 힘든 문제점이 있다.
기존에는 나노입자를 카본나노튜브에 부착(attachment) 시키기 위해서는, 먼저 카본나노튜브를 산처리 등을 통해 표면에 결함을 생성시켜 용액 내에서 카본 나노튜브를 분산한 다음 나노입자를 나노튜브 표면에서 성장시키는 과정을 사용하였다.
하지만 강 교수 연구팀은 나노튜브의 표면에 결함을 생성시키지 않고도 이종원소가 핵생성에 중요한 역할을 하는 사실에 착안하였다. 먼저 질소가 포함된 카본나이트라이드(Carbon Nitride) 나노튜브를 성장시킨 후 균일한 크기의 마그네타이트 나노입자를 부착시킨 나노입자-나노튜브 혼성체를 합성하였다. 다시 이러한 나노입자-나노튜브 혼성체 위에 실리카 보호막을 코팅하여 화학적 분위기에서 자성특성이 안정적으로 유지되도록 하였다. 그 결과, 실리카 보호막을 코팅한 나노입자-나노튜브 혼성체는 수중에서도 0.4%의 자화도 변화만 발생하였다.
또한, 방사광 가속기를 통한 X선 흡수분광(X-ray Absorption Spectroscopy) 분석과 더불어 카본나이트라이드 포함된 질소가 균일한 크기의 나노입자 합성에 중요한 역할을 하며, 원하는 자성특성을 얻을 수 있다는 것을 밝혔다.
강 교수는 “동 연구 성과가 갖는 의미는 질소가 치환된 카본나노튜브를 이용해서 균일한 특성을 갖는 초상자성 마그네타이트 나노입자 혼성체를 합성하고 마그네타이트 나노입자 표면에 실리카 보호막을 코팅하여 자성특성을 외부 화학적 분위기에 대해 안정적으로 유지하는 기술을 개발한 것이다.”라고 언급했으며,
“실험 및 이론적 분석을 통해 카본나노튜브 내 질소의 역할을 밝혔다는 점에서 중요한 의미가 있다. 이 기술은 현재 국내 특허 출원 중이고, 미국 특허는 출원 신청하고 있다. 실리카 보호막엔 다른 물질들을 치환시키기 쉬워 형·발광 응용에 가능하고 혼성체 또한 향후 촉매, 바이오 메디신, 데이타 저장체 등으로 활용을 위한 다양한 응용 분야에 적용 가능할 것으로 전망된다.”라고 덧붙였다.
2009.07.27 조회수 22562
강정구 교수연구팀, 코어/쉘 구조 나노입자-나노튜브 혼성체 개발
- 어드밴스트 펑셔널 머터리얼 표지 논문 게재 -
우리대학 강정구 교수팀은 질소가 포함된 카본나노튜브를 이용한 코어/쉘 형태의 화학적으로 안정한 초상자성(자성입자의 크기가 작아지면서 수많은 전자스핀들이 하나같이 움직이는 거대자성 상태) 나노입자-나노튜브 혼성체를 합성하는 기술을 개발하였다.
이번 연구는 교육과학기술부와 한국연구재단이 지원하는 중견연구자지원사업(구 국가지정연구실사업)의 지원을 받아 KAIST 강정구(姜正九, 41세) 교수 연구팀(이정우 연구원(박사 4년))의 연구 성과로서, 연구 결과는 어드밴스트 펑셔널 머터리얼즈(Advanced Functional Materials) 인쇄판 표지논문으로 7월 24일 게재될 예정이다. 강 교수는 2008년 12월 앙게반테 케미(Angewandte Chemie) 표지 게재에 연이은 7개월 만의 주목할 만한 연구 실적이다.
현재까지 자성 나노입자의 크기를 제어하여 촉매, 바이오 메디신, 데이터 저장체 등에 상당히 효율적으로 이용할 수 있는 기술을 개발해 왔으나, 상당히 복잡한 공정을 통해 제조되어 균일한 크기의 나노입자 제조에 어려움이 있었다.
또한, 자성 나노입자는 합성 후 외부 화학적 분위기에 의해 자성특성이 변화하여 원하는 특성을 유지하기 힘든 문제점이 있다.
기존에는 나노입자를 카본나노튜브에 부착(attachment) 시키기 위해서는, 먼저 카본나노튜브를 산처리 등을 통해 표면에 결함을 생성시켜 용액 내에서 카본 나노튜브를 분산한 다음 나노입자를 나노튜브 표면에서 성장시키는 과정을 사용하였다.
하지만 강 교수 연구팀은 나노튜브의 표면에 결함을 생성시키지 않고도 이종원소가 핵생성에 중요한 역할을 하는 사실에 착안하였다. 먼저 질소가 포함된 카본나이트라이드(Carbon Nitride) 나노튜브를 성장시킨 후 균일한 크기의 마그네타이트 나노입자를 부착시킨 나노입자-나노튜브 혼성체를 합성하였다. 다시 이러한 나노입자-나노튜브 혼성체 위에 실리카 보호막을 코팅하여 화학적 분위기에서 자성특성이 안정적으로 유지되도록 하였다. 그 결과, 실리카 보호막을 코팅한 나노입자-나노튜브 혼성체는 수중에서도 0.4%의 자화도 변화만 발생하였다.
또한, 방사광 가속기를 통한 X선 흡수분광(X-ray Absorption Spectroscopy) 분석과 더불어 카본나이트라이드 포함된 질소가 균일한 크기의 나노입자 합성에 중요한 역할을 하며, 원하는 자성특성을 얻을 수 있다는 것을 밝혔다.
강 교수는 “동 연구 성과가 갖는 의미는 질소가 치환된 카본나노튜브를 이용해서 균일한 특성을 갖는 초상자성 마그네타이트 나노입자 혼성체를 합성하고 마그네타이트 나노입자 표면에 실리카 보호막을 코팅하여 자성특성을 외부 화학적 분위기에 대해 안정적으로 유지하는 기술을 개발한 것이다.”라고 언급했으며,
“실험 및 이론적 분석을 통해 카본나노튜브 내 질소의 역할을 밝혔다는 점에서 중요한 의미가 있다. 이 기술은 현재 국내 특허 출원 중이고, 미국 특허는 출원 신청하고 있다. 실리카 보호막엔 다른 물질들을 치환시키기 쉬워 형·발광 응용에 가능하고 혼성체 또한 향후 촉매, 바이오 메디신, 데이타 저장체 등으로 활용을 위한 다양한 응용 분야에 적용 가능할 것으로 전망된다.”라고 덧붙였다.
2009.07.27 조회수 22562