-
 미토콘드리아 DNA 돌연변이를 밝혀내다
우리 몸의 세포는 평생 동안 DNA 돌연변이를 지속적으로 축적하며, 이는 세포 간의 유전적 다양성(모자이시즘) 및 세포 노화를 초래한다. 한국 연구진이 세포소기관 미토콘드리아 DNA의 인체 내 모자이시즘 현상을 최초로 규명했다.
우리 대학 의과학대학원 주영석 교수 연구팀 안지송 박사과정이 미토콘드리아 DNA 돌연변이 연구를 주도해 국제 과학학술지 ‘네이처 지네틱스(Nature Genetics)’ 7월 22일 字 온라인판에 게재했다고 24일 밝혔다. (논문명: Mitochondrial DNA mosaicism in normal human somatic cells).
이번 연구에는 서울대학교 의과대학, 연세대학교 의과대학, 고려대학교 의과대학, 국립암센터, 그리고 KAIST 교원창업기업 이노크라스의 연구자들도 참여했다.
미토콘드리아는 세포 에너지 대사 및 사멸에 관여하는 세포소기관으로, 세포핵과 독립적으로 자체 DNA를 가지고 있으며 돌연변이도 발생할 수 있다. 하지만 이러한 돌연변이를 정밀하게 찾아내는 데 필수적인 단일세포 전장유전체(whole-genome sequencing) 기술의 한계로 그동안 미토콘드리아 DNA 돌연변이 및 모자이시즘에 대한 연구는 미흡했다.
연구팀은 31명의 정상 대장 상피 조직, 섬유아세포, 혈액에서 확보한 총 2,096개 단일세포의 전장 유전체 서열을 생명정보학 기법으로 분석해 세계 최대 규모의 연구를 수행했다. 세포 사이에서는 평균적으로 3개의 유의미한 미토콘드리아 DNA 차이가 존재했으며, 대부분은 노화 과정에서 생성됐으나 약 6%의 차이는 모계로부터 이형상태(헤테로플라스미; heteroplasmy)로 전달됨이 확인됐다.
또한, 암 발생 과정에서 돌연변이 수가 유의미하게 증가했으며, 이들 변이 중 일부는 미토콘드리아 RNA 불안정성에 기여한다는 사실도 확인했다. 관찰된 데이터를 바탕으로 연구팀은 인간의 배아 발생단계부터 노화 및 발암 과정에서의 미토콘드리아 발생 및 진화 과정을 이해할 수 있는 모델을 구축했다.
이번 연구는 사람의 정상 세포에서 발생하는 미토콘드리아 DNA 돌연변이의 형성 메커니즘을 체계적으로 밝혀내, 향후 미토콘드리아 DNA가 노화와 질병 발생에 미치는 영향을 이해하는 데 중요한 초석을 제공할 수 있을 것으로 기대된다.
의과학대학원 주영석 교수는 “전장유전체 빅데이터를 체계적으로 활용함으로써 미지의 영역이었던 생명과학 현상을 규명할 수 있다”며, “암 발생 과정뿐만 아니라 인간의 배아 발생과정 및 노화과정에서 나타나는 미토콘드리아 DNA의 변화를 체계적으로 이해할 수 있는 방법을 처음으로 수립했다” 라고 연구의 중요성을 설명했다.
한편 이번 연구는 한국연구재단 리더연구, 선도연구센터 및 서경배과학재단 신진과학자 연구지원 사업의 지원을 받아 수행됐다.
미토콘드리아 DNA 돌연변이를 밝혀내다
우리 몸의 세포는 평생 동안 DNA 돌연변이를 지속적으로 축적하며, 이는 세포 간의 유전적 다양성(모자이시즘) 및 세포 노화를 초래한다. 한국 연구진이 세포소기관 미토콘드리아 DNA의 인체 내 모자이시즘 현상을 최초로 규명했다.
우리 대학 의과학대학원 주영석 교수 연구팀 안지송 박사과정이 미토콘드리아 DNA 돌연변이 연구를 주도해 국제 과학학술지 ‘네이처 지네틱스(Nature Genetics)’ 7월 22일 字 온라인판에 게재했다고 24일 밝혔다. (논문명: Mitochondrial DNA mosaicism in normal human somatic cells).
이번 연구에는 서울대학교 의과대학, 연세대학교 의과대학, 고려대학교 의과대학, 국립암센터, 그리고 KAIST 교원창업기업 이노크라스의 연구자들도 참여했다.
미토콘드리아는 세포 에너지 대사 및 사멸에 관여하는 세포소기관으로, 세포핵과 독립적으로 자체 DNA를 가지고 있으며 돌연변이도 발생할 수 있다. 하지만 이러한 돌연변이를 정밀하게 찾아내는 데 필수적인 단일세포 전장유전체(whole-genome sequencing) 기술의 한계로 그동안 미토콘드리아 DNA 돌연변이 및 모자이시즘에 대한 연구는 미흡했다.
연구팀은 31명의 정상 대장 상피 조직, 섬유아세포, 혈액에서 확보한 총 2,096개 단일세포의 전장 유전체 서열을 생명정보학 기법으로 분석해 세계 최대 규모의 연구를 수행했다. 세포 사이에서는 평균적으로 3개의 유의미한 미토콘드리아 DNA 차이가 존재했으며, 대부분은 노화 과정에서 생성됐으나 약 6%의 차이는 모계로부터 이형상태(헤테로플라스미; heteroplasmy)로 전달됨이 확인됐다.
또한, 암 발생 과정에서 돌연변이 수가 유의미하게 증가했으며, 이들 변이 중 일부는 미토콘드리아 RNA 불안정성에 기여한다는 사실도 확인했다. 관찰된 데이터를 바탕으로 연구팀은 인간의 배아 발생단계부터 노화 및 발암 과정에서의 미토콘드리아 발생 및 진화 과정을 이해할 수 있는 모델을 구축했다.
이번 연구는 사람의 정상 세포에서 발생하는 미토콘드리아 DNA 돌연변이의 형성 메커니즘을 체계적으로 밝혀내, 향후 미토콘드리아 DNA가 노화와 질병 발생에 미치는 영향을 이해하는 데 중요한 초석을 제공할 수 있을 것으로 기대된다.
의과학대학원 주영석 교수는 “전장유전체 빅데이터를 체계적으로 활용함으로써 미지의 영역이었던 생명과학 현상을 규명할 수 있다”며, “암 발생 과정뿐만 아니라 인간의 배아 발생과정 및 노화과정에서 나타나는 미토콘드리아 DNA의 변화를 체계적으로 이해할 수 있는 방법을 처음으로 수립했다” 라고 연구의 중요성을 설명했다.
한편 이번 연구는 한국연구재단 리더연구, 선도연구센터 및 서경배과학재단 신진과학자 연구지원 사업의 지원을 받아 수행됐다.
2024.07.24
조회수 7319
-
 극미량 돌연변이 세포로도 뇌질환 발생한다
뇌를 포함한 모든 신체 기관은 세포 분열 과정에서 발생하는 돌연변이(모자이시즘)을 피할 수 없다. 그렇다면 과연 몇 개의 신경세포에 질병 유발 돌연변이가 생겨났을 때부터 전체 뇌신경 회로를 망가트려 뇌 기능 이상을 일으킬 수 있을까?
우리 대학 의과학대학원 이정호 교수팀이 뇌세포 특이적 돌연변이(뇌 체성 모자이시즘)에 의한 소아 난치성 뇌전증 동물 모델과 환자 뇌 조직 연구를 통해 0.1퍼센트 이하 비율의 극미량 돌연변이 신경세포에 의해서도 뇌 전체 기능 이상을 유발해 뇌전증 발작이 발생할 수 있음을 규명했다고 9일 밝혔다.
이를 통해 난치성 뇌전증의 돌연변이 유전자 진단에 있어 새로운 기준을 마련하는 한편, 극미량의 돌연변이 신경세포가 다양한 뇌 질환 유발에 관여할 수 있음을 밝혔다. 이번 연구의 결과는 세계적 신경 의학 학술지 `브레인(Brain)'에 지난 6월 25일 字 게재됐다.
연구팀은 이번 연구에서 과연 얼마나 적은 수의 세포에서 특정 유전자 모자이시즘이 누적됐을 때 이것이 전체 뇌 기능 이상을 유도하는 뇌 질환 발생으로 이어질 것인가라는 질문에 대답하고자, 마우스 질병 모델과 인체 조직을 이용한 중개의학적 연구를 수행했다.
연구팀은 실험용 쥐의 뇌 조직에 뇌전증 유발 체성 모자이시즘*을 최소 수백 개에서 최대 수만 개의 세포에 유발했다. 이때 고작 8천에서 9천 개 수준의 돌연변이 신경세포가 나타날 때부터, 실험용 쥐가 뇌전증 발작을 일으키고, 관련된 병리가 나타남을 관찰했다. 더 나아가, 난치성 뇌전증 환자 뇌 조직에서 대용량 유전정보 증폭 시퀀싱을 수행해(ultra-high depth amplicon sequencing) 정확한 변이 모자이시즘 비율을 측정했고, 최소 0.07%에 이르는 뇌전증 유발 체성 모자이시즘을 관찰했다.
*체성 모자이시즘(Somatic Mosaicism): 하나의 수정란에서 분열 및 분화를 통해 우리 몸을 이루는 약 30조 개의 세포들이 만들어지는 과정에서 세포마다 돌연변이가 발생할 수 있다는 것으로 암의 진화뿐만 아니라 비암성 질환에서도 중요한 질병 원인으로 최근 주목을 받고 있음.
이 발견은 약물 치료에 반응하지 않아 수술에 이르게 되는 난치성 뇌전증의 유전적 정밀 진단에 도움을 줄 수 있으며, 또한 아직 원인이 밝혀지지 않은 수많은 난치성 신경 정신의학적 질환들이 뇌의 발생과 분화 과정에서 일어나는 극소량의 미세 돌연변이들과 밀접한 관련이 있음을 시사한다.
이번 연구는 국소 피질이형성증*의 진단법 향상 및 체성 모자이시즘에 의한 뇌 질환 원인 발견에 있어서 중요한 기초를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜(대표 박철원, 김병태)을 통해 난치성 뇌전증 환자의 체성 모자이시즘 변이를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
*국소 피질이형성증: 뇌 발달 과정 중 대뇌 피질에 국소적으로 신경세포이상이 발생하는 질환으로 기존 항뇌전증 약물에 전혀 반응하지 않는 소아 난치성 뇌전증을 일으키는 가장 중요한 원인으로 알려져 있다.
우리 대학 의과학대학원 졸업생 의사과학자이자 논문의 제1 저자 김진태 박사는 "극미량의 체성 돌연변이라도 뇌의 기능 이상을 유발할 수 있음이 알려졌고, 이를 통해 난치성 뇌전증 등의 유전적 진단과 치료제 개발에 도움이 될 수 있기를 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원 사업의 지원을 받아 수행됐다.
극미량 돌연변이 세포로도 뇌질환 발생한다
뇌를 포함한 모든 신체 기관은 세포 분열 과정에서 발생하는 돌연변이(모자이시즘)을 피할 수 없다. 그렇다면 과연 몇 개의 신경세포에 질병 유발 돌연변이가 생겨났을 때부터 전체 뇌신경 회로를 망가트려 뇌 기능 이상을 일으킬 수 있을까?
우리 대학 의과학대학원 이정호 교수팀이 뇌세포 특이적 돌연변이(뇌 체성 모자이시즘)에 의한 소아 난치성 뇌전증 동물 모델과 환자 뇌 조직 연구를 통해 0.1퍼센트 이하 비율의 극미량 돌연변이 신경세포에 의해서도 뇌 전체 기능 이상을 유발해 뇌전증 발작이 발생할 수 있음을 규명했다고 9일 밝혔다.
이를 통해 난치성 뇌전증의 돌연변이 유전자 진단에 있어 새로운 기준을 마련하는 한편, 극미량의 돌연변이 신경세포가 다양한 뇌 질환 유발에 관여할 수 있음을 밝혔다. 이번 연구의 결과는 세계적 신경 의학 학술지 `브레인(Brain)'에 지난 6월 25일 字 게재됐다.
연구팀은 이번 연구에서 과연 얼마나 적은 수의 세포에서 특정 유전자 모자이시즘이 누적됐을 때 이것이 전체 뇌 기능 이상을 유도하는 뇌 질환 발생으로 이어질 것인가라는 질문에 대답하고자, 마우스 질병 모델과 인체 조직을 이용한 중개의학적 연구를 수행했다.
연구팀은 실험용 쥐의 뇌 조직에 뇌전증 유발 체성 모자이시즘*을 최소 수백 개에서 최대 수만 개의 세포에 유발했다. 이때 고작 8천에서 9천 개 수준의 돌연변이 신경세포가 나타날 때부터, 실험용 쥐가 뇌전증 발작을 일으키고, 관련된 병리가 나타남을 관찰했다. 더 나아가, 난치성 뇌전증 환자 뇌 조직에서 대용량 유전정보 증폭 시퀀싱을 수행해(ultra-high depth amplicon sequencing) 정확한 변이 모자이시즘 비율을 측정했고, 최소 0.07%에 이르는 뇌전증 유발 체성 모자이시즘을 관찰했다.
*체성 모자이시즘(Somatic Mosaicism): 하나의 수정란에서 분열 및 분화를 통해 우리 몸을 이루는 약 30조 개의 세포들이 만들어지는 과정에서 세포마다 돌연변이가 발생할 수 있다는 것으로 암의 진화뿐만 아니라 비암성 질환에서도 중요한 질병 원인으로 최근 주목을 받고 있음.
이 발견은 약물 치료에 반응하지 않아 수술에 이르게 되는 난치성 뇌전증의 유전적 정밀 진단에 도움을 줄 수 있으며, 또한 아직 원인이 밝혀지지 않은 수많은 난치성 신경 정신의학적 질환들이 뇌의 발생과 분화 과정에서 일어나는 극소량의 미세 돌연변이들과 밀접한 관련이 있음을 시사한다.
이번 연구는 국소 피질이형성증*의 진단법 향상 및 체성 모자이시즘에 의한 뇌 질환 원인 발견에 있어서 중요한 기초를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜(대표 박철원, 김병태)을 통해 난치성 뇌전증 환자의 체성 모자이시즘 변이를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
*국소 피질이형성증: 뇌 발달 과정 중 대뇌 피질에 국소적으로 신경세포이상이 발생하는 질환으로 기존 항뇌전증 약물에 전혀 반응하지 않는 소아 난치성 뇌전증을 일으키는 가장 중요한 원인으로 알려져 있다.
우리 대학 의과학대학원 졸업생 의사과학자이자 논문의 제1 저자 김진태 박사는 "극미량의 체성 돌연변이라도 뇌의 기능 이상을 유발할 수 있음이 알려졌고, 이를 통해 난치성 뇌전증 등의 유전적 진단과 치료제 개발에 도움이 될 수 있기를 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원 사업의 지원을 받아 수행됐다.
2024.07.09
조회수 5471
-
 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18
조회수 7607
-
 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15
조회수 7405
-
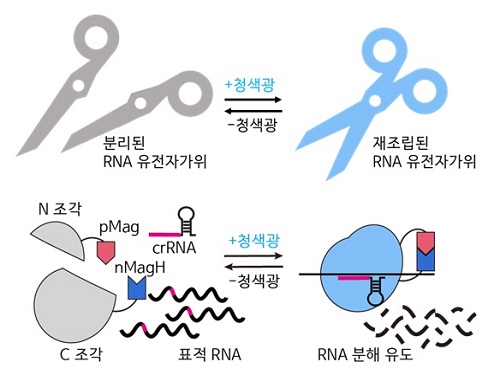 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07
조회수 10181
-
 난치성 뇌전증 80%까지 유전자 진단 성공
우리 대학 의과학대학원 이정호 교수팀이 소아 난치성 뇌전증인 국소피질이형성증 환자 뇌 조직 연구를 통해 극미량의 뇌세포에 존재하는 돌연변이 검출하는 방법을 개발하고, 이를 통해 질병 발생의 메커니즘을 이해하고 치료의 초석을 마련했다고 15일 밝혔다.
이번 연구내용은 세계적 신경의학 학술지 `신경학 연보(Annals of Neurology)'에 지난 1월 26일 字 게재됐다.
뇌전증은 반복적인 발작을 특징으로 하는 신경질환이다. 뇌전증 유병률은약 0.5~1%로, 전세계적으로 5000만명이 넘는 환자가 있고, 국내에서는 30~40만명 정도로 치매, 뇌졸중 다음으로 많은 신경질환이다. 뇌전증 발작을 억제시키는 FDA(미국 식품의약국)에서 허가받은 항경련제가 20개가 넘는데도 불구하고, 발작이 조절되지 않아 일상생활에 지장을 초래하는 난치성 뇌전증 환자의 비율이 전체 뇌전증 환자의 30%에 이른다. 기존 항경련제는 뇌의 과도한 흥분을 억제해 발작 증상을 예방, 조절할 뿐, 질환의 원인, 질환 자체에는 영향을 주지는 못하고 있고, 뇌전증 발생 원인은 유전적 요인, 뇌염, 뇌종양 등 다양하지만 아직도 뇌전증 환자의 과반수 이상은 정확한 원인을 모르기 때문이다. 특히, 소아 난치성 뇌전증의 경우, 발작이 조절되지 않으면 뇌손상으로 이어져 지적장애, 발달장애로 인해 평생 장애를 갖고 살아가야 될 수 있으며 그들을 케어할 사회적 비용 또한 높아 치료제 개발이 절실하다.
국소피질이형성증은 태아의 뇌 발달과정 중에 생긴 이상으로 대뇌 피질이 국소적으로 비정상적인 구조를 띄며 뇌전증 발작을 동반하는 대표적인 소아 난치성 뇌전증 질환이다. 국소피질이형성증 난치성 뇌전증은 치료제가 없으며, 뇌절제술이 현재로서는 유일한 치료법이지만, 수술 후에도 재발하는 환자 비율이 30~40%로 높고, 수술이 불가능한 환자도 적지 않다.
연구팀은 기존에 전혀 원인을 알지 못했던 국소피질이형성증이 엠토르(이하 mTOR)* 경로 관련 유전자들에 뇌 세포 특이적으로 돌연변이가 생겨 발작이 발생된다는 사실을 2015년 네이쳐 메디슨 (Nature Medicine)에 세계 최초로 보고한 바 있다. 국제 뇌전증 협회 (ILAE)는 이를 반영하여 국소피질이형성증의 새로운 진단 기준을 2022년 개정하였다. 그러나 기존 뇌 돌연변이 분석 방법으로는 약 50%의 환자에게서만 유전적 진단이 가능하다는 한계를 갖고 있다.
* 엠토르(mTOR): 세포의 성장과 분열을 조절하는 신호전달 단백질
연구팀은 동물 실험 연구에서 전체 뇌세포의 1% 이하에 해당하는 극미량의 뇌세포만 해당 유전변이를 가져도 뇌 전체 발작 활성도를 변화시켜 발작을 초래한다는 것을 이미 확인한 바 있다. 이를 착안해 연구팀은 기존 뇌 조직 유전자 진단에서는 음성이 나온 환자 뇌조직에서 mTOR 경로의 발현 이상을 갖는 뇌 신경세포만 선택적으로 수집하는 방식으로 기존의 진단 방법의 한계를 극복하고자 했다.
기존방법으로 원인을 찾지 못한 국소피질이형성증 19명 환자 뇌 신경세포의 mTOR 활성화 신호를 표시하여 유세포 분석기를 통해 수집했고 유전체 염기서열 분석을 진행했다. (그림 1) 이 중 30%의 환자는 극미량의 돌연변이를 갖고 있었으며, 20%의 환자는 mTOR의 억제 유전자인 GATOR1 복합체의 생식세포 돌연변이를 갖고 있음을 밝혔다. 네덜란드 뇌 은행으로부터 공여받은 3명의 환자 뇌 조직에서 연구팀의 방법을 통해 3명 모두에서 유전적 진단이 가능했다.
이러한 진단적 접근은 기존 방식과 비교해 돌연변이를 약 34배까지 민감하게 검출하는 것과 동시에 전체 국소피질이형성증 환자의 유전적 진단율을 80%까지 끌어올릴 수 있었다. (그림 2) 이는 국소피질이형성증의 근본 원인을 규명하는 새로운 접근법을 제시하고, 난치성 뇌전증의 치료에 주요한 전기를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜을 통해 국소피질이형성증 환자의 정확한 유전자 진단을 돕고 해당 환자에서 돌연변이 유전자를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
KAIST 의과학대학원 졸업생으로 현재 서울 아산병원 소아청소년과에 근무하고 있는 의사과학자인 논문의 제1 저자 김자혜 박사는 "극미량의 체성돌연변이를 검출하는 새로운 접근을 통해 국소피질이형성증 발생의 정확한 원인을 이해하고, 이를 바탕으로 난치성 뇌전증 치료제 개발을 위한 작은 발판이 되길 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
난치성 뇌전증 80%까지 유전자 진단 성공
우리 대학 의과학대학원 이정호 교수팀이 소아 난치성 뇌전증인 국소피질이형성증 환자 뇌 조직 연구를 통해 극미량의 뇌세포에 존재하는 돌연변이 검출하는 방법을 개발하고, 이를 통해 질병 발생의 메커니즘을 이해하고 치료의 초석을 마련했다고 15일 밝혔다.
이번 연구내용은 세계적 신경의학 학술지 `신경학 연보(Annals of Neurology)'에 지난 1월 26일 字 게재됐다.
뇌전증은 반복적인 발작을 특징으로 하는 신경질환이다. 뇌전증 유병률은약 0.5~1%로, 전세계적으로 5000만명이 넘는 환자가 있고, 국내에서는 30~40만명 정도로 치매, 뇌졸중 다음으로 많은 신경질환이다. 뇌전증 발작을 억제시키는 FDA(미국 식품의약국)에서 허가받은 항경련제가 20개가 넘는데도 불구하고, 발작이 조절되지 않아 일상생활에 지장을 초래하는 난치성 뇌전증 환자의 비율이 전체 뇌전증 환자의 30%에 이른다. 기존 항경련제는 뇌의 과도한 흥분을 억제해 발작 증상을 예방, 조절할 뿐, 질환의 원인, 질환 자체에는 영향을 주지는 못하고 있고, 뇌전증 발생 원인은 유전적 요인, 뇌염, 뇌종양 등 다양하지만 아직도 뇌전증 환자의 과반수 이상은 정확한 원인을 모르기 때문이다. 특히, 소아 난치성 뇌전증의 경우, 발작이 조절되지 않으면 뇌손상으로 이어져 지적장애, 발달장애로 인해 평생 장애를 갖고 살아가야 될 수 있으며 그들을 케어할 사회적 비용 또한 높아 치료제 개발이 절실하다.
국소피질이형성증은 태아의 뇌 발달과정 중에 생긴 이상으로 대뇌 피질이 국소적으로 비정상적인 구조를 띄며 뇌전증 발작을 동반하는 대표적인 소아 난치성 뇌전증 질환이다. 국소피질이형성증 난치성 뇌전증은 치료제가 없으며, 뇌절제술이 현재로서는 유일한 치료법이지만, 수술 후에도 재발하는 환자 비율이 30~40%로 높고, 수술이 불가능한 환자도 적지 않다.
연구팀은 기존에 전혀 원인을 알지 못했던 국소피질이형성증이 엠토르(이하 mTOR)* 경로 관련 유전자들에 뇌 세포 특이적으로 돌연변이가 생겨 발작이 발생된다는 사실을 2015년 네이쳐 메디슨 (Nature Medicine)에 세계 최초로 보고한 바 있다. 국제 뇌전증 협회 (ILAE)는 이를 반영하여 국소피질이형성증의 새로운 진단 기준을 2022년 개정하였다. 그러나 기존 뇌 돌연변이 분석 방법으로는 약 50%의 환자에게서만 유전적 진단이 가능하다는 한계를 갖고 있다.
* 엠토르(mTOR): 세포의 성장과 분열을 조절하는 신호전달 단백질
연구팀은 동물 실험 연구에서 전체 뇌세포의 1% 이하에 해당하는 극미량의 뇌세포만 해당 유전변이를 가져도 뇌 전체 발작 활성도를 변화시켜 발작을 초래한다는 것을 이미 확인한 바 있다. 이를 착안해 연구팀은 기존 뇌 조직 유전자 진단에서는 음성이 나온 환자 뇌조직에서 mTOR 경로의 발현 이상을 갖는 뇌 신경세포만 선택적으로 수집하는 방식으로 기존의 진단 방법의 한계를 극복하고자 했다.
기존방법으로 원인을 찾지 못한 국소피질이형성증 19명 환자 뇌 신경세포의 mTOR 활성화 신호를 표시하여 유세포 분석기를 통해 수집했고 유전체 염기서열 분석을 진행했다. (그림 1) 이 중 30%의 환자는 극미량의 돌연변이를 갖고 있었으며, 20%의 환자는 mTOR의 억제 유전자인 GATOR1 복합체의 생식세포 돌연변이를 갖고 있음을 밝혔다. 네덜란드 뇌 은행으로부터 공여받은 3명의 환자 뇌 조직에서 연구팀의 방법을 통해 3명 모두에서 유전적 진단이 가능했다.
이러한 진단적 접근은 기존 방식과 비교해 돌연변이를 약 34배까지 민감하게 검출하는 것과 동시에 전체 국소피질이형성증 환자의 유전적 진단율을 80%까지 끌어올릴 수 있었다. (그림 2) 이는 국소피질이형성증의 근본 원인을 규명하는 새로운 접근법을 제시하고, 난치성 뇌전증의 치료에 주요한 전기를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜을 통해 국소피질이형성증 환자의 정확한 유전자 진단을 돕고 해당 환자에서 돌연변이 유전자를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
KAIST 의과학대학원 졸업생으로 현재 서울 아산병원 소아청소년과에 근무하고 있는 의사과학자인 논문의 제1 저자 김자혜 박사는 "극미량의 체성돌연변이를 검출하는 새로운 접근을 통해 국소피질이형성증 발생의 정확한 원인을 이해하고, 이를 바탕으로 난치성 뇌전증 치료제 개발을 위한 작은 발판이 되길 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2023.02.15
조회수 8591
-
 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19
조회수 12769
-
 건강한 장수를 유도하는 돌연변이 유전자 발굴
우리 대학 생명과학과 노화분자유전학 실험실 이승재 교수 연구팀이 가늘고 길게 사는 돌연변이체에 종양 억제 유전자 `PTEN'의 특정 돌연변이를 도입해 건강한 장수를 유도할 수 있다는 연구결과를 발표했다고 6일 밝혔다.
초고령화 사회에 도입한 우리나라의 가장 시급한 문제 중 하나는 단순히 수명을 늘리는 것이 아닌 건강하게 장수하는 방법을 개발하는 것이다. 노화가 건강에 부정적인 영향을 미치기 시작하기 전 시기를 건강 수명이라고 하며, 최근 노화 연구의 주요 목표 중 하나는 건강 수명을 늘리는 것이다.
인슐린 및 인슐린 유사 성장인자는 진화적으로 잘 보존이 된 수명 조절 호르몬인데, 이의 적절한 감소는 수명을 늘리지만 건강 수명(운동성, 성장, 생식능력, 발달 등)은 오히려 악화시킨다.
이승재 교수 연구팀은 노화 연구에서 많이 사용되고 수명이 3주 정도로 짧은 예쁜꼬마선충을 이용해 인슐린과 인슐린 유사 성장인자가 감소된 상황에서 종양 억제 유전자인 PTEN의 유전자 서열 하나만 바꾸면 장수와 건강을 모두 얻을 수 있음을 발견했다.
연구진이 발굴한 변이는 탈인산화 효소인 PTEN 단백질의 기능 중 지질 탈인산화 효소 활성은 감소시키지만, 단백질 탈인산화 효소 활성은 일부를 유지하는 방식으로 장수는 감소시키지 않으면서 건강은 유지하도록 생명체의 기능을 재조정했다.
그 결과, 장수 조절 유도인자인 FOXO의 활성은 유지하지만 과자극 시 건강에 해로운 전사인자인 NRF2의 활성을 적절히 억제해 긴 수명과 노화된 개체에서의 건강을 모두 획득했다.
연구팀은 이번 연구를 통해 장수 유도 신호전달 경로에서 효소 하나의 활성을 세심하게 조정해 장수 유지뿐 아니라 건강 수명을 늘릴 수 있다는 매우 획기적인 가능성을 제시했다.
특히, 인간을 비롯한 포유류에도 보존이 잘 돼 있는 종양 억제 유전자 PTEN이 건강한 장수유도에 중요하다는 것을 보여줬기에, PTEN 활성의 적절한 조절을 통해 인간의 건강 장수를 유도해 초고령화 사회의 문제 해소 가능성을 제시한 것에 의의가 있다.
생명과학과 박혜은 학생, 함석진 박사, 김은아 박사와 POSTECH 황우선 박사가 공동 제1 저자로 참여한 이번 연구는 한국연구재단 리더연구과제의 지원을 받아 수행됐으며 세계적인 과학 국제학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 2021년 9월 24일 날짜로 게재됐다.
(논문명: A PTEN variant uncouples longevity from impaired fitness in Caenorhabditis elegans with reduced insulin/IGF-1 signaling)
건강한 장수를 유도하는 돌연변이 유전자 발굴
우리 대학 생명과학과 노화분자유전학 실험실 이승재 교수 연구팀이 가늘고 길게 사는 돌연변이체에 종양 억제 유전자 `PTEN'의 특정 돌연변이를 도입해 건강한 장수를 유도할 수 있다는 연구결과를 발표했다고 6일 밝혔다.
초고령화 사회에 도입한 우리나라의 가장 시급한 문제 중 하나는 단순히 수명을 늘리는 것이 아닌 건강하게 장수하는 방법을 개발하는 것이다. 노화가 건강에 부정적인 영향을 미치기 시작하기 전 시기를 건강 수명이라고 하며, 최근 노화 연구의 주요 목표 중 하나는 건강 수명을 늘리는 것이다.
인슐린 및 인슐린 유사 성장인자는 진화적으로 잘 보존이 된 수명 조절 호르몬인데, 이의 적절한 감소는 수명을 늘리지만 건강 수명(운동성, 성장, 생식능력, 발달 등)은 오히려 악화시킨다.
이승재 교수 연구팀은 노화 연구에서 많이 사용되고 수명이 3주 정도로 짧은 예쁜꼬마선충을 이용해 인슐린과 인슐린 유사 성장인자가 감소된 상황에서 종양 억제 유전자인 PTEN의 유전자 서열 하나만 바꾸면 장수와 건강을 모두 얻을 수 있음을 발견했다.
연구진이 발굴한 변이는 탈인산화 효소인 PTEN 단백질의 기능 중 지질 탈인산화 효소 활성은 감소시키지만, 단백질 탈인산화 효소 활성은 일부를 유지하는 방식으로 장수는 감소시키지 않으면서 건강은 유지하도록 생명체의 기능을 재조정했다.
그 결과, 장수 조절 유도인자인 FOXO의 활성은 유지하지만 과자극 시 건강에 해로운 전사인자인 NRF2의 활성을 적절히 억제해 긴 수명과 노화된 개체에서의 건강을 모두 획득했다.
연구팀은 이번 연구를 통해 장수 유도 신호전달 경로에서 효소 하나의 활성을 세심하게 조정해 장수 유지뿐 아니라 건강 수명을 늘릴 수 있다는 매우 획기적인 가능성을 제시했다.
특히, 인간을 비롯한 포유류에도 보존이 잘 돼 있는 종양 억제 유전자 PTEN이 건강한 장수유도에 중요하다는 것을 보여줬기에, PTEN 활성의 적절한 조절을 통해 인간의 건강 장수를 유도해 초고령화 사회의 문제 해소 가능성을 제시한 것에 의의가 있다.
생명과학과 박혜은 학생, 함석진 박사, 김은아 박사와 POSTECH 황우선 박사가 공동 제1 저자로 참여한 이번 연구는 한국연구재단 리더연구과제의 지원을 받아 수행됐으며 세계적인 과학 국제학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 2021년 9월 24일 날짜로 게재됐다.
(논문명: A PTEN variant uncouples longevity from impaired fitness in Caenorhabditis elegans with reduced insulin/IGF-1 signaling)
2021.10.06
조회수 12223
-
 3개 학과 공동연구팀, 다학제적 접근 통해 뇌전증 발병 기전 규명
우리 대학 의과학대학원 이정호 교수, 바이오및뇌공학과 백세범 교수, 생명과학과 손종우 교수 공동 연구팀이 MTOR 유전자 돌연변이에 의해 약물 저항성이 높은 뇌전증이 발병하는 메커니즘을 규명했다고 25일 밝혔다.
이번 연구 결과는 극소수의 신경세포에 발생한 돌연변이가 신경망의 과다 활동(hyperactivity) 상태로 이어지는 구체적인 메커니즘을 밝혀, 뇌전증의 발병 원인 및 치료법 개발에 대한 새로운 시각을 제공한다.
특히 3개 학과간 공동 연구팀의 다학제적인 접근을 통해 세포 내 유전학적인 관점에서부터 단일 신경세포의 전기생리학, 이로부터 근접한 거리에 있는 뇌조직의 네트워크, 그리고 뇌 전체 수준에서의 신경망 수준으로 이어지는 다양한 실험 및 시뮬레이션 연구가 이루어져, 뇌전증의 복잡한 발병 메커니즘을 전반적으로 설명하는 성과를 얻었다.
국소피질 이형성증은 대뇌발달 과정에서 일부 신경줄기세포의 mTOR 경로상의 체성유전변이(MTOR, TSC, DEPDC5) 로 발생하는 질환으로, 흔한 뇌전증의 원인 중 하나이며 항뇌전증제 약물 치료에 잘 반응하지 않아 치료가 어렵다. 이에 연구팀은 국소피질 이형성증 환자의 실제 조직과 같은 질환을 가진 동물 모델을 이용한 실험을 통해, 개별 신경세포의 체성유전변이가 신경망 수준의 발작도로 이어지는 구체적인 원리를 규명했다.
먼저 연구팀은 이러한 체성유전변이는 뇌 조직의 5% 이하인 적은 수의 신경세포에서 발생하며, 해당 신경세포들의 전기적 성질이 정상 세포와는 다르게 변화하는 것을 발견했다. 하지만 대다수 정상 세포를 포함한 전반적인 신경망 활동의 시뮬레이션 결과, 이러한 돌연변이는 매우 적은 비율의 신경세포에만 국한돼 있어, 이 세포들 자체의 전기적 성질 변화만으로는 전체 신경망의 비정상적인 활동으로 이어지지 않았고, 이로 인해 뇌전증에서 보이는 신경망 수준의 발작 활성도가 발생하는 이유를 설명할 수 없었다.
이에 연구팀은 후속 실험을 통해, 뇌전증 발작을 유도할 수 있는 활성도가 MTOR 체성 유전변이를 가진 신경세포가 아니라 그 세포들 주변의 변이가 없는 신경세포에 의해 발생하는 것을 발견했다. 이는 유전자 변이를 가진 신경세포의 활성도가 뇌전증의 직접적인 원인이 되는 것이 아니라, 이들 세포가 주변 대다수 비변이 신경세포에 특정 변화를 유도하고 이로 인해 전체 신경망 수준의 발작 활성도가 발생한다는 뜻으로, 뇌 체성유전변이로 인한 비세포 자율성 활성도(non-cell autonomous hyperexcitability)를 보여주는 한 예가 된다.
이에 착안해 추가적인 동물실험과 수술 후 환자 뇌 조직을 이용한 연구를 통해 MTOR 체성유전변이를 가진 세포에서는 ADK(adenosine kinase, 아데노신 키나제) 유전자가 과발현되는 것을 발견했다. 또한, 이로부터 주변 대다수 비변이 신경세포의 네트워크 체계가 교란돼 과활성도가 유도되고, 더 나아가 전체 신경망 수준의 과다 활동으로까지 이어지는 것을 확인했다.
의과학대학원 고현용 박사, 바이오및뇌공학과 장재선 박사, 생명과학과 주상현 학생이 공동 제1 저자로 참여한 이번 연구는 신경학 분야의 국제 학술지 `애널스 오브 뉴롤로지 (Annals of Neurology)' 7월 29일 字에 게재됐다. (논문명: Non-cell autonomous epileptogenesis in focal cortical dysplasia)
이정호, 백세범, 손종우 교수는 "약물 저항성이 높아 기존에 효과적으로 대처할 수 없었던 뇌전증의 발병 원인에 대해 한층 더 깊은 통찰을 제공하는 연구ˮ라며 "한 분야의 실험이나 연구 기법만으로는 해결하기 어려운 문제에 대해, 유전체학, 신경생물학, 계산뇌과학에 걸친 다학제적 접근으로 해결책을 제시한 효과적인 공동연구의 좋은 예시였다ˮ라고 언급했다.
한편 이번 연구는 한국연구재단 이공분야기초연구사업의 리더연구자지원사업 및 중견연구자지원사업, 보건복지부의 질환극복기술개발사업, 서경배 과학재단, 그리고 소바젠의 지원을 받아 수행됐다.
3개 학과 공동연구팀, 다학제적 접근 통해 뇌전증 발병 기전 규명
우리 대학 의과학대학원 이정호 교수, 바이오및뇌공학과 백세범 교수, 생명과학과 손종우 교수 공동 연구팀이 MTOR 유전자 돌연변이에 의해 약물 저항성이 높은 뇌전증이 발병하는 메커니즘을 규명했다고 25일 밝혔다.
이번 연구 결과는 극소수의 신경세포에 발생한 돌연변이가 신경망의 과다 활동(hyperactivity) 상태로 이어지는 구체적인 메커니즘을 밝혀, 뇌전증의 발병 원인 및 치료법 개발에 대한 새로운 시각을 제공한다.
특히 3개 학과간 공동 연구팀의 다학제적인 접근을 통해 세포 내 유전학적인 관점에서부터 단일 신경세포의 전기생리학, 이로부터 근접한 거리에 있는 뇌조직의 네트워크, 그리고 뇌 전체 수준에서의 신경망 수준으로 이어지는 다양한 실험 및 시뮬레이션 연구가 이루어져, 뇌전증의 복잡한 발병 메커니즘을 전반적으로 설명하는 성과를 얻었다.
국소피질 이형성증은 대뇌발달 과정에서 일부 신경줄기세포의 mTOR 경로상의 체성유전변이(MTOR, TSC, DEPDC5) 로 발생하는 질환으로, 흔한 뇌전증의 원인 중 하나이며 항뇌전증제 약물 치료에 잘 반응하지 않아 치료가 어렵다. 이에 연구팀은 국소피질 이형성증 환자의 실제 조직과 같은 질환을 가진 동물 모델을 이용한 실험을 통해, 개별 신경세포의 체성유전변이가 신경망 수준의 발작도로 이어지는 구체적인 원리를 규명했다.
먼저 연구팀은 이러한 체성유전변이는 뇌 조직의 5% 이하인 적은 수의 신경세포에서 발생하며, 해당 신경세포들의 전기적 성질이 정상 세포와는 다르게 변화하는 것을 발견했다. 하지만 대다수 정상 세포를 포함한 전반적인 신경망 활동의 시뮬레이션 결과, 이러한 돌연변이는 매우 적은 비율의 신경세포에만 국한돼 있어, 이 세포들 자체의 전기적 성질 변화만으로는 전체 신경망의 비정상적인 활동으로 이어지지 않았고, 이로 인해 뇌전증에서 보이는 신경망 수준의 발작 활성도가 발생하는 이유를 설명할 수 없었다.
이에 연구팀은 후속 실험을 통해, 뇌전증 발작을 유도할 수 있는 활성도가 MTOR 체성 유전변이를 가진 신경세포가 아니라 그 세포들 주변의 변이가 없는 신경세포에 의해 발생하는 것을 발견했다. 이는 유전자 변이를 가진 신경세포의 활성도가 뇌전증의 직접적인 원인이 되는 것이 아니라, 이들 세포가 주변 대다수 비변이 신경세포에 특정 변화를 유도하고 이로 인해 전체 신경망 수준의 발작 활성도가 발생한다는 뜻으로, 뇌 체성유전변이로 인한 비세포 자율성 활성도(non-cell autonomous hyperexcitability)를 보여주는 한 예가 된다.
이에 착안해 추가적인 동물실험과 수술 후 환자 뇌 조직을 이용한 연구를 통해 MTOR 체성유전변이를 가진 세포에서는 ADK(adenosine kinase, 아데노신 키나제) 유전자가 과발현되는 것을 발견했다. 또한, 이로부터 주변 대다수 비변이 신경세포의 네트워크 체계가 교란돼 과활성도가 유도되고, 더 나아가 전체 신경망 수준의 과다 활동으로까지 이어지는 것을 확인했다.
의과학대학원 고현용 박사, 바이오및뇌공학과 장재선 박사, 생명과학과 주상현 학생이 공동 제1 저자로 참여한 이번 연구는 신경학 분야의 국제 학술지 `애널스 오브 뉴롤로지 (Annals of Neurology)' 7월 29일 字에 게재됐다. (논문명: Non-cell autonomous epileptogenesis in focal cortical dysplasia)
이정호, 백세범, 손종우 교수는 "약물 저항성이 높아 기존에 효과적으로 대처할 수 없었던 뇌전증의 발병 원인에 대해 한층 더 깊은 통찰을 제공하는 연구ˮ라며 "한 분야의 실험이나 연구 기법만으로는 해결하기 어려운 문제에 대해, 유전체학, 신경생물학, 계산뇌과학에 걸친 다학제적 접근으로 해결책을 제시한 효과적인 공동연구의 좋은 예시였다ˮ라고 언급했다.
한편 이번 연구는 한국연구재단 이공분야기초연구사업의 리더연구자지원사업 및 중견연구자지원사업, 보건복지부의 질환극복기술개발사업, 서경배 과학재단, 그리고 소바젠의 지원을 받아 수행됐다.
2021.08.26
조회수 13630
-
 난치성 뇌전증의 새로운 진단법 개발
우리 대학 의과학대학원 이정호 교수 연구팀이 프랑스 파리 소르본 대학교(Sorbonne University) 뇌연구센터 스테파니 볼락(Stéphanie Baulac) 교수 연구팀과 공동연구를 통해 다양한 난치성 뇌전증 환자의 뇌 특이적 체성 돌연변이 유전자를 뇌척수액에서 검출했다고 26일 밝혔다.
의과학대학원 김세연 석박사통합과정 학생이 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `신경학회보(Annals of Neurology)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Detection of Brain Somatic Mutations in Cerebrospinal Fluid from Refractory Epilepsy Patients)
난치성 뇌전증은 많은 경우 발생 과정 중 뇌 신경세포에만 국소 특이적으로 생긴 체성 돌연변이(somatic mutation)에 의해 일어난다. 최근 들어 혈장과 같은 체액에 세포가 괴사해 생기는 세포 유리 DNA(circulating cell -free DNA)를 활용해 비침습적(noninvasive) 진단과 예후를 밝히려는 시도가 활발했다.
하지만, 뇌는 다른 장기와는 다르게 뇌혈관 장벽으로 막혀있기 때문에 병인 돌연변이를 포함한 세포 유리 DNA가 혈장에서는 검출되지 않는다. 그래서 난치성 뇌전증 환자들은 원인 유전자를 찾기 위해 뇌수술로 병변 부위를 도려내어 병인 돌연변이를 알아냈으며, 뇌척수액을 통해 세포 유리 DNA를 검출하려는 시도 자체가 없었다.
이에 연구팀은 난치성 뇌전증 환자의 뇌척수액에 존재하는 미량의 세포 유리 DNA에도 병인 돌연변이가 존재할 가능성을 주목했다.
연구팀은 난치성 뇌전증 환자 12명의 뇌척수액에서 극미량으로 존재하는 세포 유리 DNA를 정제하고 증폭해 병변 부위에서 이미 검출한 돌연변이가 존재하는지 디지털 중합효소연쇄반응(digital droplet PCR)로 분석 진행했다. 그 결과 3명의 난치성 뇌전증 환자에서 평균 0.57%로 존재하는 병인 유발 돌연변이 유전자를 검출했다.
논문의 주저자인 김세연 석박사통합과정 학생은 "난치성 뇌전증의 원인 유전자 검출은 수술을 통해 조직을 얻어야만 가능했는데 뇌척수액만을 채취해 돌연변이를 검출할 수 있고, 이 검출법이 새로운 진단법으로 쓰이길 기대한다ˮ고 말했다.
연구팀은 이를 통해 악성 뇌종양이 아닌 난치성 뇌전증 환자의 뇌척수액에서 병인 유발 돌연변이를 검출할 수 있음을 밝히고 나아가 수술 없이 척추 주사를 통해 최소 침습적인 방식으로 병인 돌연변이를 진단할 수 있는 틀을 마련했다. 또한, 진단뿐만 아니라 같은 방식을 통해 치료 후 환자의 예후를 지켜볼 수 있을 것으로 기대한다.
연구팀은 이번 연구 결과를 바탕으로 우리 대학 교원창업 기업(소바젠, 대표 김병태)을 통해 난치성 뇌전증의 치료제 개발과 더불어 진단법 활용을 개발할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 한국연구재단의 지원을 받아 수행했다.
난치성 뇌전증의 새로운 진단법 개발
우리 대학 의과학대학원 이정호 교수 연구팀이 프랑스 파리 소르본 대학교(Sorbonne University) 뇌연구센터 스테파니 볼락(Stéphanie Baulac) 교수 연구팀과 공동연구를 통해 다양한 난치성 뇌전증 환자의 뇌 특이적 체성 돌연변이 유전자를 뇌척수액에서 검출했다고 26일 밝혔다.
의과학대학원 김세연 석박사통합과정 학생이 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `신경학회보(Annals of Neurology)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Detection of Brain Somatic Mutations in Cerebrospinal Fluid from Refractory Epilepsy Patients)
난치성 뇌전증은 많은 경우 발생 과정 중 뇌 신경세포에만 국소 특이적으로 생긴 체성 돌연변이(somatic mutation)에 의해 일어난다. 최근 들어 혈장과 같은 체액에 세포가 괴사해 생기는 세포 유리 DNA(circulating cell -free DNA)를 활용해 비침습적(noninvasive) 진단과 예후를 밝히려는 시도가 활발했다.
하지만, 뇌는 다른 장기와는 다르게 뇌혈관 장벽으로 막혀있기 때문에 병인 돌연변이를 포함한 세포 유리 DNA가 혈장에서는 검출되지 않는다. 그래서 난치성 뇌전증 환자들은 원인 유전자를 찾기 위해 뇌수술로 병변 부위를 도려내어 병인 돌연변이를 알아냈으며, 뇌척수액을 통해 세포 유리 DNA를 검출하려는 시도 자체가 없었다.
이에 연구팀은 난치성 뇌전증 환자의 뇌척수액에 존재하는 미량의 세포 유리 DNA에도 병인 돌연변이가 존재할 가능성을 주목했다.
연구팀은 난치성 뇌전증 환자 12명의 뇌척수액에서 극미량으로 존재하는 세포 유리 DNA를 정제하고 증폭해 병변 부위에서 이미 검출한 돌연변이가 존재하는지 디지털 중합효소연쇄반응(digital droplet PCR)로 분석 진행했다. 그 결과 3명의 난치성 뇌전증 환자에서 평균 0.57%로 존재하는 병인 유발 돌연변이 유전자를 검출했다.
논문의 주저자인 김세연 석박사통합과정 학생은 "난치성 뇌전증의 원인 유전자 검출은 수술을 통해 조직을 얻어야만 가능했는데 뇌척수액만을 채취해 돌연변이를 검출할 수 있고, 이 검출법이 새로운 진단법으로 쓰이길 기대한다ˮ고 말했다.
연구팀은 이를 통해 악성 뇌종양이 아닌 난치성 뇌전증 환자의 뇌척수액에서 병인 유발 돌연변이를 검출할 수 있음을 밝히고 나아가 수술 없이 척추 주사를 통해 최소 침습적인 방식으로 병인 돌연변이를 진단할 수 있는 틀을 마련했다. 또한, 진단뿐만 아니라 같은 방식을 통해 치료 후 환자의 예후를 지켜볼 수 있을 것으로 기대한다.
연구팀은 이번 연구 결과를 바탕으로 우리 대학 교원창업 기업(소바젠, 대표 김병태)을 통해 난치성 뇌전증의 치료제 개발과 더불어 진단법 활용을 개발할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 한국연구재단의 지원을 받아 수행했다.
2021.05.27
조회수 48040
-
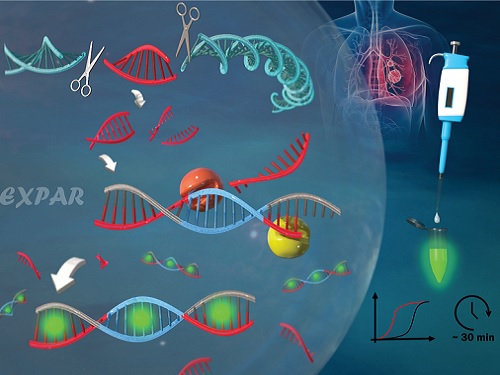 유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11
조회수 33813
-
 조현병의 새로운 원인을 규명했다
우리 대학 의과학대학원 이정호 교수 연구팀이 미국 스탠리 의학 연구원(Stanley Medical Research Institute) 김상현 박사팀과 공동연구를 통해 후천적으로 발생한 뇌 특이적 체성 유전변이가 조현병(舊 정신분열증) 발병에 크게 기여하고 있음을 규명했다고 11일 밝혔다.
의과학대학원 김명희 박사, 김일빈 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `생물 정신의학회지(Biological Psychiatry)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Low-level brain somatic mutations are implicated in schizophrenia)
조현병은 전 세계적으로 100명당 1명의 높은 비율로 발병되는 질환이지만, 근본적인 원인은 분명히 규명되지 않고 있다. 기존의 연구들은 조현병의 유전적 원인 규명을 위해 주로 환자의 말초조직인 혈액이나 침에서 돌연변이 연구를 진행했으나, 혈액이나 침에서는 조현병의 분자 유전학적 원인을 완벽하게 밝혀내지 못하고 있었다.
이에 연구팀은 혈액이나 침에서 검출되지 않는, 환자 뇌에서만 존재하는 뇌 특이 체성 유전변이(Somatic mutation)가 조현병의 병리에 영향을 미칠 가능성을 주목했다.
연구팀은 27명의 조현병 환자에게서 얻은 사후 뇌 조직에 `전장 엑솜 유전체 서열(Whole-exome sequencing) 기법'을 적용해 조현병 환자의 뇌에 존재하는 뇌 특이 체성 유전변이를 찾아냈다. 이를 위해 연구팀은 고심도 전장 엑솜 유전체 서열 분석기법을 통해 저빈도의 체성 유전변이를 정확히 찾아내기 위한 독자적 분석 파이프라인을 구축했다.
또한 조현병 환자의 뇌 조직에서 발견된 뇌 특이적 체성 유전변이가 뇌 신경 정보 교환 및 신경 발달에 중요한 역할을 하는 유전자상에 주로 분포하는 것을 발견, 환자의 뇌 체성 유전변이가 뇌 신경회로를 망가뜨려 조현병의 원인이 될 수 있음을 보였다.
논문의 주저자인 김명희 박사는 "우리 주변에서 흔히 발견되지만, 원인이 분명하지 않아 배척돼 온 조현병의 원인 규명에 한 발짝 다가갈 수 있어 기쁘다ˮ며 "이번 연구를 기반으로 조현병의 발병 원인이 더 분명해져 환자뿐 아니라 그 주변 사람들까지 질병으로 인한 고통에서 벗어날 수 있게 되면 좋겠다ˮ라고 말했다.
연구팀의 발견은 조현병의 발병에 체성 유전변이가 중요한 역할을 하고 있음을 밝혀내 조현병의 새로운 발병 원리를 규명함과 동시에, 조현병 연구에 새로운 틀을 제시함으로써 향후 다른 신경정신질환의 연구에도 크게 기여할 수 있을 것으로 기대된다. 또한 연구팀은 우리 대학 교원 창업 기업인 소바젠(대표 김병태)과 협력을 통해 뇌 체성 돌연변이 연관 조현병 환자 진단과 치료법 개발을 진행할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 스탠리 의학 연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
조현병의 새로운 원인을 규명했다
우리 대학 의과학대학원 이정호 교수 연구팀이 미국 스탠리 의학 연구원(Stanley Medical Research Institute) 김상현 박사팀과 공동연구를 통해 후천적으로 발생한 뇌 특이적 체성 유전변이가 조현병(舊 정신분열증) 발병에 크게 기여하고 있음을 규명했다고 11일 밝혔다.
의과학대학원 김명희 박사, 김일빈 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `생물 정신의학회지(Biological Psychiatry)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Low-level brain somatic mutations are implicated in schizophrenia)
조현병은 전 세계적으로 100명당 1명의 높은 비율로 발병되는 질환이지만, 근본적인 원인은 분명히 규명되지 않고 있다. 기존의 연구들은 조현병의 유전적 원인 규명을 위해 주로 환자의 말초조직인 혈액이나 침에서 돌연변이 연구를 진행했으나, 혈액이나 침에서는 조현병의 분자 유전학적 원인을 완벽하게 밝혀내지 못하고 있었다.
이에 연구팀은 혈액이나 침에서 검출되지 않는, 환자 뇌에서만 존재하는 뇌 특이 체성 유전변이(Somatic mutation)가 조현병의 병리에 영향을 미칠 가능성을 주목했다.
연구팀은 27명의 조현병 환자에게서 얻은 사후 뇌 조직에 `전장 엑솜 유전체 서열(Whole-exome sequencing) 기법'을 적용해 조현병 환자의 뇌에 존재하는 뇌 특이 체성 유전변이를 찾아냈다. 이를 위해 연구팀은 고심도 전장 엑솜 유전체 서열 분석기법을 통해 저빈도의 체성 유전변이를 정확히 찾아내기 위한 독자적 분석 파이프라인을 구축했다.
또한 조현병 환자의 뇌 조직에서 발견된 뇌 특이적 체성 유전변이가 뇌 신경 정보 교환 및 신경 발달에 중요한 역할을 하는 유전자상에 주로 분포하는 것을 발견, 환자의 뇌 체성 유전변이가 뇌 신경회로를 망가뜨려 조현병의 원인이 될 수 있음을 보였다.
논문의 주저자인 김명희 박사는 "우리 주변에서 흔히 발견되지만, 원인이 분명하지 않아 배척돼 온 조현병의 원인 규명에 한 발짝 다가갈 수 있어 기쁘다ˮ며 "이번 연구를 기반으로 조현병의 발병 원인이 더 분명해져 환자뿐 아니라 그 주변 사람들까지 질병으로 인한 고통에서 벗어날 수 있게 되면 좋겠다ˮ라고 말했다.
연구팀의 발견은 조현병의 발병에 체성 유전변이가 중요한 역할을 하고 있음을 밝혀내 조현병의 새로운 발병 원리를 규명함과 동시에, 조현병 연구에 새로운 틀을 제시함으로써 향후 다른 신경정신질환의 연구에도 크게 기여할 수 있을 것으로 기대된다. 또한 연구팀은 우리 대학 교원 창업 기업인 소바젠(대표 김병태)과 협력을 통해 뇌 체성 돌연변이 연관 조현병 환자 진단과 치료법 개발을 진행할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 스탠리 의학 연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
2021.03.11
조회수 100787
 미토콘드리아 DNA 돌연변이를 밝혀내다
우리 몸의 세포는 평생 동안 DNA 돌연변이를 지속적으로 축적하며, 이는 세포 간의 유전적 다양성(모자이시즘) 및 세포 노화를 초래한다. 한국 연구진이 세포소기관 미토콘드리아 DNA의 인체 내 모자이시즘 현상을 최초로 규명했다.
우리 대학 의과학대학원 주영석 교수 연구팀 안지송 박사과정이 미토콘드리아 DNA 돌연변이 연구를 주도해 국제 과학학술지 ‘네이처 지네틱스(Nature Genetics)’ 7월 22일 字 온라인판에 게재했다고 24일 밝혔다. (논문명: Mitochondrial DNA mosaicism in normal human somatic cells).
이번 연구에는 서울대학교 의과대학, 연세대학교 의과대학, 고려대학교 의과대학, 국립암센터, 그리고 KAIST 교원창업기업 이노크라스의 연구자들도 참여했다.
미토콘드리아는 세포 에너지 대사 및 사멸에 관여하는 세포소기관으로, 세포핵과 독립적으로 자체 DNA를 가지고 있으며 돌연변이도 발생할 수 있다. 하지만 이러한 돌연변이를 정밀하게 찾아내는 데 필수적인 단일세포 전장유전체(whole-genome sequencing) 기술의 한계로 그동안 미토콘드리아 DNA 돌연변이 및 모자이시즘에 대한 연구는 미흡했다.
연구팀은 31명의 정상 대장 상피 조직, 섬유아세포, 혈액에서 확보한 총 2,096개 단일세포의 전장 유전체 서열을 생명정보학 기법으로 분석해 세계 최대 규모의 연구를 수행했다. 세포 사이에서는 평균적으로 3개의 유의미한 미토콘드리아 DNA 차이가 존재했으며, 대부분은 노화 과정에서 생성됐으나 약 6%의 차이는 모계로부터 이형상태(헤테로플라스미; heteroplasmy)로 전달됨이 확인됐다.
또한, 암 발생 과정에서 돌연변이 수가 유의미하게 증가했으며, 이들 변이 중 일부는 미토콘드리아 RNA 불안정성에 기여한다는 사실도 확인했다. 관찰된 데이터를 바탕으로 연구팀은 인간의 배아 발생단계부터 노화 및 발암 과정에서의 미토콘드리아 발생 및 진화 과정을 이해할 수 있는 모델을 구축했다.
이번 연구는 사람의 정상 세포에서 발생하는 미토콘드리아 DNA 돌연변이의 형성 메커니즘을 체계적으로 밝혀내, 향후 미토콘드리아 DNA가 노화와 질병 발생에 미치는 영향을 이해하는 데 중요한 초석을 제공할 수 있을 것으로 기대된다.
의과학대학원 주영석 교수는 “전장유전체 빅데이터를 체계적으로 활용함으로써 미지의 영역이었던 생명과학 현상을 규명할 수 있다”며, “암 발생 과정뿐만 아니라 인간의 배아 발생과정 및 노화과정에서 나타나는 미토콘드리아 DNA의 변화를 체계적으로 이해할 수 있는 방법을 처음으로 수립했다” 라고 연구의 중요성을 설명했다.
한편 이번 연구는 한국연구재단 리더연구, 선도연구센터 및 서경배과학재단 신진과학자 연구지원 사업의 지원을 받아 수행됐다.
2024.07.24 조회수 7319
미토콘드리아 DNA 돌연변이를 밝혀내다
우리 몸의 세포는 평생 동안 DNA 돌연변이를 지속적으로 축적하며, 이는 세포 간의 유전적 다양성(모자이시즘) 및 세포 노화를 초래한다. 한국 연구진이 세포소기관 미토콘드리아 DNA의 인체 내 모자이시즘 현상을 최초로 규명했다.
우리 대학 의과학대학원 주영석 교수 연구팀 안지송 박사과정이 미토콘드리아 DNA 돌연변이 연구를 주도해 국제 과학학술지 ‘네이처 지네틱스(Nature Genetics)’ 7월 22일 字 온라인판에 게재했다고 24일 밝혔다. (논문명: Mitochondrial DNA mosaicism in normal human somatic cells).
이번 연구에는 서울대학교 의과대학, 연세대학교 의과대학, 고려대학교 의과대학, 국립암센터, 그리고 KAIST 교원창업기업 이노크라스의 연구자들도 참여했다.
미토콘드리아는 세포 에너지 대사 및 사멸에 관여하는 세포소기관으로, 세포핵과 독립적으로 자체 DNA를 가지고 있으며 돌연변이도 발생할 수 있다. 하지만 이러한 돌연변이를 정밀하게 찾아내는 데 필수적인 단일세포 전장유전체(whole-genome sequencing) 기술의 한계로 그동안 미토콘드리아 DNA 돌연변이 및 모자이시즘에 대한 연구는 미흡했다.
연구팀은 31명의 정상 대장 상피 조직, 섬유아세포, 혈액에서 확보한 총 2,096개 단일세포의 전장 유전체 서열을 생명정보학 기법으로 분석해 세계 최대 규모의 연구를 수행했다. 세포 사이에서는 평균적으로 3개의 유의미한 미토콘드리아 DNA 차이가 존재했으며, 대부분은 노화 과정에서 생성됐으나 약 6%의 차이는 모계로부터 이형상태(헤테로플라스미; heteroplasmy)로 전달됨이 확인됐다.
또한, 암 발생 과정에서 돌연변이 수가 유의미하게 증가했으며, 이들 변이 중 일부는 미토콘드리아 RNA 불안정성에 기여한다는 사실도 확인했다. 관찰된 데이터를 바탕으로 연구팀은 인간의 배아 발생단계부터 노화 및 발암 과정에서의 미토콘드리아 발생 및 진화 과정을 이해할 수 있는 모델을 구축했다.
이번 연구는 사람의 정상 세포에서 발생하는 미토콘드리아 DNA 돌연변이의 형성 메커니즘을 체계적으로 밝혀내, 향후 미토콘드리아 DNA가 노화와 질병 발생에 미치는 영향을 이해하는 데 중요한 초석을 제공할 수 있을 것으로 기대된다.
의과학대학원 주영석 교수는 “전장유전체 빅데이터를 체계적으로 활용함으로써 미지의 영역이었던 생명과학 현상을 규명할 수 있다”며, “암 발생 과정뿐만 아니라 인간의 배아 발생과정 및 노화과정에서 나타나는 미토콘드리아 DNA의 변화를 체계적으로 이해할 수 있는 방법을 처음으로 수립했다” 라고 연구의 중요성을 설명했다.
한편 이번 연구는 한국연구재단 리더연구, 선도연구센터 및 서경배과학재단 신진과학자 연구지원 사업의 지원을 받아 수행됐다.
2024.07.24 조회수 7319 극미량 돌연변이 세포로도 뇌질환 발생한다
뇌를 포함한 모든 신체 기관은 세포 분열 과정에서 발생하는 돌연변이(모자이시즘)을 피할 수 없다. 그렇다면 과연 몇 개의 신경세포에 질병 유발 돌연변이가 생겨났을 때부터 전체 뇌신경 회로를 망가트려 뇌 기능 이상을 일으킬 수 있을까?
우리 대학 의과학대학원 이정호 교수팀이 뇌세포 특이적 돌연변이(뇌 체성 모자이시즘)에 의한 소아 난치성 뇌전증 동물 모델과 환자 뇌 조직 연구를 통해 0.1퍼센트 이하 비율의 극미량 돌연변이 신경세포에 의해서도 뇌 전체 기능 이상을 유발해 뇌전증 발작이 발생할 수 있음을 규명했다고 9일 밝혔다.
이를 통해 난치성 뇌전증의 돌연변이 유전자 진단에 있어 새로운 기준을 마련하는 한편, 극미량의 돌연변이 신경세포가 다양한 뇌 질환 유발에 관여할 수 있음을 밝혔다. 이번 연구의 결과는 세계적 신경 의학 학술지 `브레인(Brain)'에 지난 6월 25일 字 게재됐다.
연구팀은 이번 연구에서 과연 얼마나 적은 수의 세포에서 특정 유전자 모자이시즘이 누적됐을 때 이것이 전체 뇌 기능 이상을 유도하는 뇌 질환 발생으로 이어질 것인가라는 질문에 대답하고자, 마우스 질병 모델과 인체 조직을 이용한 중개의학적 연구를 수행했다.
연구팀은 실험용 쥐의 뇌 조직에 뇌전증 유발 체성 모자이시즘*을 최소 수백 개에서 최대 수만 개의 세포에 유발했다. 이때 고작 8천에서 9천 개 수준의 돌연변이 신경세포가 나타날 때부터, 실험용 쥐가 뇌전증 발작을 일으키고, 관련된 병리가 나타남을 관찰했다. 더 나아가, 난치성 뇌전증 환자 뇌 조직에서 대용량 유전정보 증폭 시퀀싱을 수행해(ultra-high depth amplicon sequencing) 정확한 변이 모자이시즘 비율을 측정했고, 최소 0.07%에 이르는 뇌전증 유발 체성 모자이시즘을 관찰했다.
*체성 모자이시즘(Somatic Mosaicism): 하나의 수정란에서 분열 및 분화를 통해 우리 몸을 이루는 약 30조 개의 세포들이 만들어지는 과정에서 세포마다 돌연변이가 발생할 수 있다는 것으로 암의 진화뿐만 아니라 비암성 질환에서도 중요한 질병 원인으로 최근 주목을 받고 있음.
이 발견은 약물 치료에 반응하지 않아 수술에 이르게 되는 난치성 뇌전증의 유전적 정밀 진단에 도움을 줄 수 있으며, 또한 아직 원인이 밝혀지지 않은 수많은 난치성 신경 정신의학적 질환들이 뇌의 발생과 분화 과정에서 일어나는 극소량의 미세 돌연변이들과 밀접한 관련이 있음을 시사한다.
이번 연구는 국소 피질이형성증*의 진단법 향상 및 체성 모자이시즘에 의한 뇌 질환 원인 발견에 있어서 중요한 기초를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜(대표 박철원, 김병태)을 통해 난치성 뇌전증 환자의 체성 모자이시즘 변이를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
*국소 피질이형성증: 뇌 발달 과정 중 대뇌 피질에 국소적으로 신경세포이상이 발생하는 질환으로 기존 항뇌전증 약물에 전혀 반응하지 않는 소아 난치성 뇌전증을 일으키는 가장 중요한 원인으로 알려져 있다.
우리 대학 의과학대학원 졸업생 의사과학자이자 논문의 제1 저자 김진태 박사는 "극미량의 체성 돌연변이라도 뇌의 기능 이상을 유발할 수 있음이 알려졌고, 이를 통해 난치성 뇌전증 등의 유전적 진단과 치료제 개발에 도움이 될 수 있기를 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원 사업의 지원을 받아 수행됐다.
2024.07.09 조회수 5471
극미량 돌연변이 세포로도 뇌질환 발생한다
뇌를 포함한 모든 신체 기관은 세포 분열 과정에서 발생하는 돌연변이(모자이시즘)을 피할 수 없다. 그렇다면 과연 몇 개의 신경세포에 질병 유발 돌연변이가 생겨났을 때부터 전체 뇌신경 회로를 망가트려 뇌 기능 이상을 일으킬 수 있을까?
우리 대학 의과학대학원 이정호 교수팀이 뇌세포 특이적 돌연변이(뇌 체성 모자이시즘)에 의한 소아 난치성 뇌전증 동물 모델과 환자 뇌 조직 연구를 통해 0.1퍼센트 이하 비율의 극미량 돌연변이 신경세포에 의해서도 뇌 전체 기능 이상을 유발해 뇌전증 발작이 발생할 수 있음을 규명했다고 9일 밝혔다.
이를 통해 난치성 뇌전증의 돌연변이 유전자 진단에 있어 새로운 기준을 마련하는 한편, 극미량의 돌연변이 신경세포가 다양한 뇌 질환 유발에 관여할 수 있음을 밝혔다. 이번 연구의 결과는 세계적 신경 의학 학술지 `브레인(Brain)'에 지난 6월 25일 字 게재됐다.
연구팀은 이번 연구에서 과연 얼마나 적은 수의 세포에서 특정 유전자 모자이시즘이 누적됐을 때 이것이 전체 뇌 기능 이상을 유도하는 뇌 질환 발생으로 이어질 것인가라는 질문에 대답하고자, 마우스 질병 모델과 인체 조직을 이용한 중개의학적 연구를 수행했다.
연구팀은 실험용 쥐의 뇌 조직에 뇌전증 유발 체성 모자이시즘*을 최소 수백 개에서 최대 수만 개의 세포에 유발했다. 이때 고작 8천에서 9천 개 수준의 돌연변이 신경세포가 나타날 때부터, 실험용 쥐가 뇌전증 발작을 일으키고, 관련된 병리가 나타남을 관찰했다. 더 나아가, 난치성 뇌전증 환자 뇌 조직에서 대용량 유전정보 증폭 시퀀싱을 수행해(ultra-high depth amplicon sequencing) 정확한 변이 모자이시즘 비율을 측정했고, 최소 0.07%에 이르는 뇌전증 유발 체성 모자이시즘을 관찰했다.
*체성 모자이시즘(Somatic Mosaicism): 하나의 수정란에서 분열 및 분화를 통해 우리 몸을 이루는 약 30조 개의 세포들이 만들어지는 과정에서 세포마다 돌연변이가 발생할 수 있다는 것으로 암의 진화뿐만 아니라 비암성 질환에서도 중요한 질병 원인으로 최근 주목을 받고 있음.
이 발견은 약물 치료에 반응하지 않아 수술에 이르게 되는 난치성 뇌전증의 유전적 정밀 진단에 도움을 줄 수 있으며, 또한 아직 원인이 밝혀지지 않은 수많은 난치성 신경 정신의학적 질환들이 뇌의 발생과 분화 과정에서 일어나는 극소량의 미세 돌연변이들과 밀접한 관련이 있음을 시사한다.
이번 연구는 국소 피질이형성증*의 진단법 향상 및 체성 모자이시즘에 의한 뇌 질환 원인 발견에 있어서 중요한 기초를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜(대표 박철원, 김병태)을 통해 난치성 뇌전증 환자의 체성 모자이시즘 변이를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
*국소 피질이형성증: 뇌 발달 과정 중 대뇌 피질에 국소적으로 신경세포이상이 발생하는 질환으로 기존 항뇌전증 약물에 전혀 반응하지 않는 소아 난치성 뇌전증을 일으키는 가장 중요한 원인으로 알려져 있다.
우리 대학 의과학대학원 졸업생 의사과학자이자 논문의 제1 저자 김진태 박사는 "극미량의 체성 돌연변이라도 뇌의 기능 이상을 유발할 수 있음이 알려졌고, 이를 통해 난치성 뇌전증 등의 유전적 진단과 치료제 개발에 도움이 될 수 있기를 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원 사업의 지원을 받아 수행됐다.
2024.07.09 조회수 5471 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7607
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7607 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7405
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7405 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 10181
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 10181 난치성 뇌전증 80%까지 유전자 진단 성공
우리 대학 의과학대학원 이정호 교수팀이 소아 난치성 뇌전증인 국소피질이형성증 환자 뇌 조직 연구를 통해 극미량의 뇌세포에 존재하는 돌연변이 검출하는 방법을 개발하고, 이를 통해 질병 발생의 메커니즘을 이해하고 치료의 초석을 마련했다고 15일 밝혔다.
이번 연구내용은 세계적 신경의학 학술지 `신경학 연보(Annals of Neurology)'에 지난 1월 26일 字 게재됐다.
뇌전증은 반복적인 발작을 특징으로 하는 신경질환이다. 뇌전증 유병률은약 0.5~1%로, 전세계적으로 5000만명이 넘는 환자가 있고, 국내에서는 30~40만명 정도로 치매, 뇌졸중 다음으로 많은 신경질환이다. 뇌전증 발작을 억제시키는 FDA(미국 식품의약국)에서 허가받은 항경련제가 20개가 넘는데도 불구하고, 발작이 조절되지 않아 일상생활에 지장을 초래하는 난치성 뇌전증 환자의 비율이 전체 뇌전증 환자의 30%에 이른다. 기존 항경련제는 뇌의 과도한 흥분을 억제해 발작 증상을 예방, 조절할 뿐, 질환의 원인, 질환 자체에는 영향을 주지는 못하고 있고, 뇌전증 발생 원인은 유전적 요인, 뇌염, 뇌종양 등 다양하지만 아직도 뇌전증 환자의 과반수 이상은 정확한 원인을 모르기 때문이다. 특히, 소아 난치성 뇌전증의 경우, 발작이 조절되지 않으면 뇌손상으로 이어져 지적장애, 발달장애로 인해 평생 장애를 갖고 살아가야 될 수 있으며 그들을 케어할 사회적 비용 또한 높아 치료제 개발이 절실하다.
국소피질이형성증은 태아의 뇌 발달과정 중에 생긴 이상으로 대뇌 피질이 국소적으로 비정상적인 구조를 띄며 뇌전증 발작을 동반하는 대표적인 소아 난치성 뇌전증 질환이다. 국소피질이형성증 난치성 뇌전증은 치료제가 없으며, 뇌절제술이 현재로서는 유일한 치료법이지만, 수술 후에도 재발하는 환자 비율이 30~40%로 높고, 수술이 불가능한 환자도 적지 않다.
연구팀은 기존에 전혀 원인을 알지 못했던 국소피질이형성증이 엠토르(이하 mTOR)* 경로 관련 유전자들에 뇌 세포 특이적으로 돌연변이가 생겨 발작이 발생된다는 사실을 2015년 네이쳐 메디슨 (Nature Medicine)에 세계 최초로 보고한 바 있다. 국제 뇌전증 협회 (ILAE)는 이를 반영하여 국소피질이형성증의 새로운 진단 기준을 2022년 개정하였다. 그러나 기존 뇌 돌연변이 분석 방법으로는 약 50%의 환자에게서만 유전적 진단이 가능하다는 한계를 갖고 있다.
* 엠토르(mTOR): 세포의 성장과 분열을 조절하는 신호전달 단백질
연구팀은 동물 실험 연구에서 전체 뇌세포의 1% 이하에 해당하는 극미량의 뇌세포만 해당 유전변이를 가져도 뇌 전체 발작 활성도를 변화시켜 발작을 초래한다는 것을 이미 확인한 바 있다. 이를 착안해 연구팀은 기존 뇌 조직 유전자 진단에서는 음성이 나온 환자 뇌조직에서 mTOR 경로의 발현 이상을 갖는 뇌 신경세포만 선택적으로 수집하는 방식으로 기존의 진단 방법의 한계를 극복하고자 했다.
기존방법으로 원인을 찾지 못한 국소피질이형성증 19명 환자 뇌 신경세포의 mTOR 활성화 신호를 표시하여 유세포 분석기를 통해 수집했고 유전체 염기서열 분석을 진행했다. (그림 1) 이 중 30%의 환자는 극미량의 돌연변이를 갖고 있었으며, 20%의 환자는 mTOR의 억제 유전자인 GATOR1 복합체의 생식세포 돌연변이를 갖고 있음을 밝혔다. 네덜란드 뇌 은행으로부터 공여받은 3명의 환자 뇌 조직에서 연구팀의 방법을 통해 3명 모두에서 유전적 진단이 가능했다.
이러한 진단적 접근은 기존 방식과 비교해 돌연변이를 약 34배까지 민감하게 검출하는 것과 동시에 전체 국소피질이형성증 환자의 유전적 진단율을 80%까지 끌어올릴 수 있었다. (그림 2) 이는 국소피질이형성증의 근본 원인을 규명하는 새로운 접근법을 제시하고, 난치성 뇌전증의 치료에 주요한 전기를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜을 통해 국소피질이형성증 환자의 정확한 유전자 진단을 돕고 해당 환자에서 돌연변이 유전자를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
KAIST 의과학대학원 졸업생으로 현재 서울 아산병원 소아청소년과에 근무하고 있는 의사과학자인 논문의 제1 저자 김자혜 박사는 "극미량의 체성돌연변이를 검출하는 새로운 접근을 통해 국소피질이형성증 발생의 정확한 원인을 이해하고, 이를 바탕으로 난치성 뇌전증 치료제 개발을 위한 작은 발판이 되길 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2023.02.15 조회수 8591
난치성 뇌전증 80%까지 유전자 진단 성공
우리 대학 의과학대학원 이정호 교수팀이 소아 난치성 뇌전증인 국소피질이형성증 환자 뇌 조직 연구를 통해 극미량의 뇌세포에 존재하는 돌연변이 검출하는 방법을 개발하고, 이를 통해 질병 발생의 메커니즘을 이해하고 치료의 초석을 마련했다고 15일 밝혔다.
이번 연구내용은 세계적 신경의학 학술지 `신경학 연보(Annals of Neurology)'에 지난 1월 26일 字 게재됐다.
뇌전증은 반복적인 발작을 특징으로 하는 신경질환이다. 뇌전증 유병률은약 0.5~1%로, 전세계적으로 5000만명이 넘는 환자가 있고, 국내에서는 30~40만명 정도로 치매, 뇌졸중 다음으로 많은 신경질환이다. 뇌전증 발작을 억제시키는 FDA(미국 식품의약국)에서 허가받은 항경련제가 20개가 넘는데도 불구하고, 발작이 조절되지 않아 일상생활에 지장을 초래하는 난치성 뇌전증 환자의 비율이 전체 뇌전증 환자의 30%에 이른다. 기존 항경련제는 뇌의 과도한 흥분을 억제해 발작 증상을 예방, 조절할 뿐, 질환의 원인, 질환 자체에는 영향을 주지는 못하고 있고, 뇌전증 발생 원인은 유전적 요인, 뇌염, 뇌종양 등 다양하지만 아직도 뇌전증 환자의 과반수 이상은 정확한 원인을 모르기 때문이다. 특히, 소아 난치성 뇌전증의 경우, 발작이 조절되지 않으면 뇌손상으로 이어져 지적장애, 발달장애로 인해 평생 장애를 갖고 살아가야 될 수 있으며 그들을 케어할 사회적 비용 또한 높아 치료제 개발이 절실하다.
국소피질이형성증은 태아의 뇌 발달과정 중에 생긴 이상으로 대뇌 피질이 국소적으로 비정상적인 구조를 띄며 뇌전증 발작을 동반하는 대표적인 소아 난치성 뇌전증 질환이다. 국소피질이형성증 난치성 뇌전증은 치료제가 없으며, 뇌절제술이 현재로서는 유일한 치료법이지만, 수술 후에도 재발하는 환자 비율이 30~40%로 높고, 수술이 불가능한 환자도 적지 않다.
연구팀은 기존에 전혀 원인을 알지 못했던 국소피질이형성증이 엠토르(이하 mTOR)* 경로 관련 유전자들에 뇌 세포 특이적으로 돌연변이가 생겨 발작이 발생된다는 사실을 2015년 네이쳐 메디슨 (Nature Medicine)에 세계 최초로 보고한 바 있다. 국제 뇌전증 협회 (ILAE)는 이를 반영하여 국소피질이형성증의 새로운 진단 기준을 2022년 개정하였다. 그러나 기존 뇌 돌연변이 분석 방법으로는 약 50%의 환자에게서만 유전적 진단이 가능하다는 한계를 갖고 있다.
* 엠토르(mTOR): 세포의 성장과 분열을 조절하는 신호전달 단백질
연구팀은 동물 실험 연구에서 전체 뇌세포의 1% 이하에 해당하는 극미량의 뇌세포만 해당 유전변이를 가져도 뇌 전체 발작 활성도를 변화시켜 발작을 초래한다는 것을 이미 확인한 바 있다. 이를 착안해 연구팀은 기존 뇌 조직 유전자 진단에서는 음성이 나온 환자 뇌조직에서 mTOR 경로의 발현 이상을 갖는 뇌 신경세포만 선택적으로 수집하는 방식으로 기존의 진단 방법의 한계를 극복하고자 했다.
기존방법으로 원인을 찾지 못한 국소피질이형성증 19명 환자 뇌 신경세포의 mTOR 활성화 신호를 표시하여 유세포 분석기를 통해 수집했고 유전체 염기서열 분석을 진행했다. (그림 1) 이 중 30%의 환자는 극미량의 돌연변이를 갖고 있었으며, 20%의 환자는 mTOR의 억제 유전자인 GATOR1 복합체의 생식세포 돌연변이를 갖고 있음을 밝혔다. 네덜란드 뇌 은행으로부터 공여받은 3명의 환자 뇌 조직에서 연구팀의 방법을 통해 3명 모두에서 유전적 진단이 가능했다.
이러한 진단적 접근은 기존 방식과 비교해 돌연변이를 약 34배까지 민감하게 검출하는 것과 동시에 전체 국소피질이형성증 환자의 유전적 진단율을 80%까지 끌어올릴 수 있었다. (그림 2) 이는 국소피질이형성증의 근본 원인을 규명하는 새로운 접근법을 제시하고, 난치성 뇌전증의 치료에 주요한 전기를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜을 통해 국소피질이형성증 환자의 정확한 유전자 진단을 돕고 해당 환자에서 돌연변이 유전자를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
KAIST 의과학대학원 졸업생으로 현재 서울 아산병원 소아청소년과에 근무하고 있는 의사과학자인 논문의 제1 저자 김자혜 박사는 "극미량의 체성돌연변이를 검출하는 새로운 접근을 통해 국소피질이형성증 발생의 정확한 원인을 이해하고, 이를 바탕으로 난치성 뇌전증 치료제 개발을 위한 작은 발판이 되길 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2023.02.15 조회수 8591 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12769
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12769 건강한 장수를 유도하는 돌연변이 유전자 발굴
우리 대학 생명과학과 노화분자유전학 실험실 이승재 교수 연구팀이 가늘고 길게 사는 돌연변이체에 종양 억제 유전자 `PTEN'의 특정 돌연변이를 도입해 건강한 장수를 유도할 수 있다는 연구결과를 발표했다고 6일 밝혔다.
초고령화 사회에 도입한 우리나라의 가장 시급한 문제 중 하나는 단순히 수명을 늘리는 것이 아닌 건강하게 장수하는 방법을 개발하는 것이다. 노화가 건강에 부정적인 영향을 미치기 시작하기 전 시기를 건강 수명이라고 하며, 최근 노화 연구의 주요 목표 중 하나는 건강 수명을 늘리는 것이다.
인슐린 및 인슐린 유사 성장인자는 진화적으로 잘 보존이 된 수명 조절 호르몬인데, 이의 적절한 감소는 수명을 늘리지만 건강 수명(운동성, 성장, 생식능력, 발달 등)은 오히려 악화시킨다.
이승재 교수 연구팀은 노화 연구에서 많이 사용되고 수명이 3주 정도로 짧은 예쁜꼬마선충을 이용해 인슐린과 인슐린 유사 성장인자가 감소된 상황에서 종양 억제 유전자인 PTEN의 유전자 서열 하나만 바꾸면 장수와 건강을 모두 얻을 수 있음을 발견했다.
연구진이 발굴한 변이는 탈인산화 효소인 PTEN 단백질의 기능 중 지질 탈인산화 효소 활성은 감소시키지만, 단백질 탈인산화 효소 활성은 일부를 유지하는 방식으로 장수는 감소시키지 않으면서 건강은 유지하도록 생명체의 기능을 재조정했다.
그 결과, 장수 조절 유도인자인 FOXO의 활성은 유지하지만 과자극 시 건강에 해로운 전사인자인 NRF2의 활성을 적절히 억제해 긴 수명과 노화된 개체에서의 건강을 모두 획득했다.
연구팀은 이번 연구를 통해 장수 유도 신호전달 경로에서 효소 하나의 활성을 세심하게 조정해 장수 유지뿐 아니라 건강 수명을 늘릴 수 있다는 매우 획기적인 가능성을 제시했다.
특히, 인간을 비롯한 포유류에도 보존이 잘 돼 있는 종양 억제 유전자 PTEN이 건강한 장수유도에 중요하다는 것을 보여줬기에, PTEN 활성의 적절한 조절을 통해 인간의 건강 장수를 유도해 초고령화 사회의 문제 해소 가능성을 제시한 것에 의의가 있다.
생명과학과 박혜은 학생, 함석진 박사, 김은아 박사와 POSTECH 황우선 박사가 공동 제1 저자로 참여한 이번 연구는 한국연구재단 리더연구과제의 지원을 받아 수행됐으며 세계적인 과학 국제학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 2021년 9월 24일 날짜로 게재됐다.
(논문명: A PTEN variant uncouples longevity from impaired fitness in Caenorhabditis elegans with reduced insulin/IGF-1 signaling)
2021.10.06 조회수 12223
건강한 장수를 유도하는 돌연변이 유전자 발굴
우리 대학 생명과학과 노화분자유전학 실험실 이승재 교수 연구팀이 가늘고 길게 사는 돌연변이체에 종양 억제 유전자 `PTEN'의 특정 돌연변이를 도입해 건강한 장수를 유도할 수 있다는 연구결과를 발표했다고 6일 밝혔다.
초고령화 사회에 도입한 우리나라의 가장 시급한 문제 중 하나는 단순히 수명을 늘리는 것이 아닌 건강하게 장수하는 방법을 개발하는 것이다. 노화가 건강에 부정적인 영향을 미치기 시작하기 전 시기를 건강 수명이라고 하며, 최근 노화 연구의 주요 목표 중 하나는 건강 수명을 늘리는 것이다.
인슐린 및 인슐린 유사 성장인자는 진화적으로 잘 보존이 된 수명 조절 호르몬인데, 이의 적절한 감소는 수명을 늘리지만 건강 수명(운동성, 성장, 생식능력, 발달 등)은 오히려 악화시킨다.
이승재 교수 연구팀은 노화 연구에서 많이 사용되고 수명이 3주 정도로 짧은 예쁜꼬마선충을 이용해 인슐린과 인슐린 유사 성장인자가 감소된 상황에서 종양 억제 유전자인 PTEN의 유전자 서열 하나만 바꾸면 장수와 건강을 모두 얻을 수 있음을 발견했다.
연구진이 발굴한 변이는 탈인산화 효소인 PTEN 단백질의 기능 중 지질 탈인산화 효소 활성은 감소시키지만, 단백질 탈인산화 효소 활성은 일부를 유지하는 방식으로 장수는 감소시키지 않으면서 건강은 유지하도록 생명체의 기능을 재조정했다.
그 결과, 장수 조절 유도인자인 FOXO의 활성은 유지하지만 과자극 시 건강에 해로운 전사인자인 NRF2의 활성을 적절히 억제해 긴 수명과 노화된 개체에서의 건강을 모두 획득했다.
연구팀은 이번 연구를 통해 장수 유도 신호전달 경로에서 효소 하나의 활성을 세심하게 조정해 장수 유지뿐 아니라 건강 수명을 늘릴 수 있다는 매우 획기적인 가능성을 제시했다.
특히, 인간을 비롯한 포유류에도 보존이 잘 돼 있는 종양 억제 유전자 PTEN이 건강한 장수유도에 중요하다는 것을 보여줬기에, PTEN 활성의 적절한 조절을 통해 인간의 건강 장수를 유도해 초고령화 사회의 문제 해소 가능성을 제시한 것에 의의가 있다.
생명과학과 박혜은 학생, 함석진 박사, 김은아 박사와 POSTECH 황우선 박사가 공동 제1 저자로 참여한 이번 연구는 한국연구재단 리더연구과제의 지원을 받아 수행됐으며 세계적인 과학 국제학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 2021년 9월 24일 날짜로 게재됐다.
(논문명: A PTEN variant uncouples longevity from impaired fitness in Caenorhabditis elegans with reduced insulin/IGF-1 signaling)
2021.10.06 조회수 12223 3개 학과 공동연구팀, 다학제적 접근 통해 뇌전증 발병 기전 규명
우리 대학 의과학대학원 이정호 교수, 바이오및뇌공학과 백세범 교수, 생명과학과 손종우 교수 공동 연구팀이 MTOR 유전자 돌연변이에 의해 약물 저항성이 높은 뇌전증이 발병하는 메커니즘을 규명했다고 25일 밝혔다.
이번 연구 결과는 극소수의 신경세포에 발생한 돌연변이가 신경망의 과다 활동(hyperactivity) 상태로 이어지는 구체적인 메커니즘을 밝혀, 뇌전증의 발병 원인 및 치료법 개발에 대한 새로운 시각을 제공한다.
특히 3개 학과간 공동 연구팀의 다학제적인 접근을 통해 세포 내 유전학적인 관점에서부터 단일 신경세포의 전기생리학, 이로부터 근접한 거리에 있는 뇌조직의 네트워크, 그리고 뇌 전체 수준에서의 신경망 수준으로 이어지는 다양한 실험 및 시뮬레이션 연구가 이루어져, 뇌전증의 복잡한 발병 메커니즘을 전반적으로 설명하는 성과를 얻었다.
국소피질 이형성증은 대뇌발달 과정에서 일부 신경줄기세포의 mTOR 경로상의 체성유전변이(MTOR, TSC, DEPDC5) 로 발생하는 질환으로, 흔한 뇌전증의 원인 중 하나이며 항뇌전증제 약물 치료에 잘 반응하지 않아 치료가 어렵다. 이에 연구팀은 국소피질 이형성증 환자의 실제 조직과 같은 질환을 가진 동물 모델을 이용한 실험을 통해, 개별 신경세포의 체성유전변이가 신경망 수준의 발작도로 이어지는 구체적인 원리를 규명했다.
먼저 연구팀은 이러한 체성유전변이는 뇌 조직의 5% 이하인 적은 수의 신경세포에서 발생하며, 해당 신경세포들의 전기적 성질이 정상 세포와는 다르게 변화하는 것을 발견했다. 하지만 대다수 정상 세포를 포함한 전반적인 신경망 활동의 시뮬레이션 결과, 이러한 돌연변이는 매우 적은 비율의 신경세포에만 국한돼 있어, 이 세포들 자체의 전기적 성질 변화만으로는 전체 신경망의 비정상적인 활동으로 이어지지 않았고, 이로 인해 뇌전증에서 보이는 신경망 수준의 발작 활성도가 발생하는 이유를 설명할 수 없었다.
이에 연구팀은 후속 실험을 통해, 뇌전증 발작을 유도할 수 있는 활성도가 MTOR 체성 유전변이를 가진 신경세포가 아니라 그 세포들 주변의 변이가 없는 신경세포에 의해 발생하는 것을 발견했다. 이는 유전자 변이를 가진 신경세포의 활성도가 뇌전증의 직접적인 원인이 되는 것이 아니라, 이들 세포가 주변 대다수 비변이 신경세포에 특정 변화를 유도하고 이로 인해 전체 신경망 수준의 발작 활성도가 발생한다는 뜻으로, 뇌 체성유전변이로 인한 비세포 자율성 활성도(non-cell autonomous hyperexcitability)를 보여주는 한 예가 된다.
이에 착안해 추가적인 동물실험과 수술 후 환자 뇌 조직을 이용한 연구를 통해 MTOR 체성유전변이를 가진 세포에서는 ADK(adenosine kinase, 아데노신 키나제) 유전자가 과발현되는 것을 발견했다. 또한, 이로부터 주변 대다수 비변이 신경세포의 네트워크 체계가 교란돼 과활성도가 유도되고, 더 나아가 전체 신경망 수준의 과다 활동으로까지 이어지는 것을 확인했다.
의과학대학원 고현용 박사, 바이오및뇌공학과 장재선 박사, 생명과학과 주상현 학생이 공동 제1 저자로 참여한 이번 연구는 신경학 분야의 국제 학술지 `애널스 오브 뉴롤로지 (Annals of Neurology)' 7월 29일 字에 게재됐다. (논문명: Non-cell autonomous epileptogenesis in focal cortical dysplasia)
이정호, 백세범, 손종우 교수는 "약물 저항성이 높아 기존에 효과적으로 대처할 수 없었던 뇌전증의 발병 원인에 대해 한층 더 깊은 통찰을 제공하는 연구ˮ라며 "한 분야의 실험이나 연구 기법만으로는 해결하기 어려운 문제에 대해, 유전체학, 신경생물학, 계산뇌과학에 걸친 다학제적 접근으로 해결책을 제시한 효과적인 공동연구의 좋은 예시였다ˮ라고 언급했다.
한편 이번 연구는 한국연구재단 이공분야기초연구사업의 리더연구자지원사업 및 중견연구자지원사업, 보건복지부의 질환극복기술개발사업, 서경배 과학재단, 그리고 소바젠의 지원을 받아 수행됐다.
2021.08.26 조회수 13630
3개 학과 공동연구팀, 다학제적 접근 통해 뇌전증 발병 기전 규명
우리 대학 의과학대학원 이정호 교수, 바이오및뇌공학과 백세범 교수, 생명과학과 손종우 교수 공동 연구팀이 MTOR 유전자 돌연변이에 의해 약물 저항성이 높은 뇌전증이 발병하는 메커니즘을 규명했다고 25일 밝혔다.
이번 연구 결과는 극소수의 신경세포에 발생한 돌연변이가 신경망의 과다 활동(hyperactivity) 상태로 이어지는 구체적인 메커니즘을 밝혀, 뇌전증의 발병 원인 및 치료법 개발에 대한 새로운 시각을 제공한다.
특히 3개 학과간 공동 연구팀의 다학제적인 접근을 통해 세포 내 유전학적인 관점에서부터 단일 신경세포의 전기생리학, 이로부터 근접한 거리에 있는 뇌조직의 네트워크, 그리고 뇌 전체 수준에서의 신경망 수준으로 이어지는 다양한 실험 및 시뮬레이션 연구가 이루어져, 뇌전증의 복잡한 발병 메커니즘을 전반적으로 설명하는 성과를 얻었다.
국소피질 이형성증은 대뇌발달 과정에서 일부 신경줄기세포의 mTOR 경로상의 체성유전변이(MTOR, TSC, DEPDC5) 로 발생하는 질환으로, 흔한 뇌전증의 원인 중 하나이며 항뇌전증제 약물 치료에 잘 반응하지 않아 치료가 어렵다. 이에 연구팀은 국소피질 이형성증 환자의 실제 조직과 같은 질환을 가진 동물 모델을 이용한 실험을 통해, 개별 신경세포의 체성유전변이가 신경망 수준의 발작도로 이어지는 구체적인 원리를 규명했다.
먼저 연구팀은 이러한 체성유전변이는 뇌 조직의 5% 이하인 적은 수의 신경세포에서 발생하며, 해당 신경세포들의 전기적 성질이 정상 세포와는 다르게 변화하는 것을 발견했다. 하지만 대다수 정상 세포를 포함한 전반적인 신경망 활동의 시뮬레이션 결과, 이러한 돌연변이는 매우 적은 비율의 신경세포에만 국한돼 있어, 이 세포들 자체의 전기적 성질 변화만으로는 전체 신경망의 비정상적인 활동으로 이어지지 않았고, 이로 인해 뇌전증에서 보이는 신경망 수준의 발작 활성도가 발생하는 이유를 설명할 수 없었다.
이에 연구팀은 후속 실험을 통해, 뇌전증 발작을 유도할 수 있는 활성도가 MTOR 체성 유전변이를 가진 신경세포가 아니라 그 세포들 주변의 변이가 없는 신경세포에 의해 발생하는 것을 발견했다. 이는 유전자 변이를 가진 신경세포의 활성도가 뇌전증의 직접적인 원인이 되는 것이 아니라, 이들 세포가 주변 대다수 비변이 신경세포에 특정 변화를 유도하고 이로 인해 전체 신경망 수준의 발작 활성도가 발생한다는 뜻으로, 뇌 체성유전변이로 인한 비세포 자율성 활성도(non-cell autonomous hyperexcitability)를 보여주는 한 예가 된다.
이에 착안해 추가적인 동물실험과 수술 후 환자 뇌 조직을 이용한 연구를 통해 MTOR 체성유전변이를 가진 세포에서는 ADK(adenosine kinase, 아데노신 키나제) 유전자가 과발현되는 것을 발견했다. 또한, 이로부터 주변 대다수 비변이 신경세포의 네트워크 체계가 교란돼 과활성도가 유도되고, 더 나아가 전체 신경망 수준의 과다 활동으로까지 이어지는 것을 확인했다.
의과학대학원 고현용 박사, 바이오및뇌공학과 장재선 박사, 생명과학과 주상현 학생이 공동 제1 저자로 참여한 이번 연구는 신경학 분야의 국제 학술지 `애널스 오브 뉴롤로지 (Annals of Neurology)' 7월 29일 字에 게재됐다. (논문명: Non-cell autonomous epileptogenesis in focal cortical dysplasia)
이정호, 백세범, 손종우 교수는 "약물 저항성이 높아 기존에 효과적으로 대처할 수 없었던 뇌전증의 발병 원인에 대해 한층 더 깊은 통찰을 제공하는 연구ˮ라며 "한 분야의 실험이나 연구 기법만으로는 해결하기 어려운 문제에 대해, 유전체학, 신경생물학, 계산뇌과학에 걸친 다학제적 접근으로 해결책을 제시한 효과적인 공동연구의 좋은 예시였다ˮ라고 언급했다.
한편 이번 연구는 한국연구재단 이공분야기초연구사업의 리더연구자지원사업 및 중견연구자지원사업, 보건복지부의 질환극복기술개발사업, 서경배 과학재단, 그리고 소바젠의 지원을 받아 수행됐다.
2021.08.26 조회수 13630 난치성 뇌전증의 새로운 진단법 개발
우리 대학 의과학대학원 이정호 교수 연구팀이 프랑스 파리 소르본 대학교(Sorbonne University) 뇌연구센터 스테파니 볼락(Stéphanie Baulac) 교수 연구팀과 공동연구를 통해 다양한 난치성 뇌전증 환자의 뇌 특이적 체성 돌연변이 유전자를 뇌척수액에서 검출했다고 26일 밝혔다.
의과학대학원 김세연 석박사통합과정 학생이 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `신경학회보(Annals of Neurology)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Detection of Brain Somatic Mutations in Cerebrospinal Fluid from Refractory Epilepsy Patients)
난치성 뇌전증은 많은 경우 발생 과정 중 뇌 신경세포에만 국소 특이적으로 생긴 체성 돌연변이(somatic mutation)에 의해 일어난다. 최근 들어 혈장과 같은 체액에 세포가 괴사해 생기는 세포 유리 DNA(circulating cell -free DNA)를 활용해 비침습적(noninvasive) 진단과 예후를 밝히려는 시도가 활발했다.
하지만, 뇌는 다른 장기와는 다르게 뇌혈관 장벽으로 막혀있기 때문에 병인 돌연변이를 포함한 세포 유리 DNA가 혈장에서는 검출되지 않는다. 그래서 난치성 뇌전증 환자들은 원인 유전자를 찾기 위해 뇌수술로 병변 부위를 도려내어 병인 돌연변이를 알아냈으며, 뇌척수액을 통해 세포 유리 DNA를 검출하려는 시도 자체가 없었다.
이에 연구팀은 난치성 뇌전증 환자의 뇌척수액에 존재하는 미량의 세포 유리 DNA에도 병인 돌연변이가 존재할 가능성을 주목했다.
연구팀은 난치성 뇌전증 환자 12명의 뇌척수액에서 극미량으로 존재하는 세포 유리 DNA를 정제하고 증폭해 병변 부위에서 이미 검출한 돌연변이가 존재하는지 디지털 중합효소연쇄반응(digital droplet PCR)로 분석 진행했다. 그 결과 3명의 난치성 뇌전증 환자에서 평균 0.57%로 존재하는 병인 유발 돌연변이 유전자를 검출했다.
논문의 주저자인 김세연 석박사통합과정 학생은 "난치성 뇌전증의 원인 유전자 검출은 수술을 통해 조직을 얻어야만 가능했는데 뇌척수액만을 채취해 돌연변이를 검출할 수 있고, 이 검출법이 새로운 진단법으로 쓰이길 기대한다ˮ고 말했다.
연구팀은 이를 통해 악성 뇌종양이 아닌 난치성 뇌전증 환자의 뇌척수액에서 병인 유발 돌연변이를 검출할 수 있음을 밝히고 나아가 수술 없이 척추 주사를 통해 최소 침습적인 방식으로 병인 돌연변이를 진단할 수 있는 틀을 마련했다. 또한, 진단뿐만 아니라 같은 방식을 통해 치료 후 환자의 예후를 지켜볼 수 있을 것으로 기대한다.
연구팀은 이번 연구 결과를 바탕으로 우리 대학 교원창업 기업(소바젠, 대표 김병태)을 통해 난치성 뇌전증의 치료제 개발과 더불어 진단법 활용을 개발할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 한국연구재단의 지원을 받아 수행했다.
2021.05.27 조회수 48040
난치성 뇌전증의 새로운 진단법 개발
우리 대학 의과학대학원 이정호 교수 연구팀이 프랑스 파리 소르본 대학교(Sorbonne University) 뇌연구센터 스테파니 볼락(Stéphanie Baulac) 교수 연구팀과 공동연구를 통해 다양한 난치성 뇌전증 환자의 뇌 특이적 체성 돌연변이 유전자를 뇌척수액에서 검출했다고 26일 밝혔다.
의과학대학원 김세연 석박사통합과정 학생이 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `신경학회보(Annals of Neurology)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Detection of Brain Somatic Mutations in Cerebrospinal Fluid from Refractory Epilepsy Patients)
난치성 뇌전증은 많은 경우 발생 과정 중 뇌 신경세포에만 국소 특이적으로 생긴 체성 돌연변이(somatic mutation)에 의해 일어난다. 최근 들어 혈장과 같은 체액에 세포가 괴사해 생기는 세포 유리 DNA(circulating cell -free DNA)를 활용해 비침습적(noninvasive) 진단과 예후를 밝히려는 시도가 활발했다.
하지만, 뇌는 다른 장기와는 다르게 뇌혈관 장벽으로 막혀있기 때문에 병인 돌연변이를 포함한 세포 유리 DNA가 혈장에서는 검출되지 않는다. 그래서 난치성 뇌전증 환자들은 원인 유전자를 찾기 위해 뇌수술로 병변 부위를 도려내어 병인 돌연변이를 알아냈으며, 뇌척수액을 통해 세포 유리 DNA를 검출하려는 시도 자체가 없었다.
이에 연구팀은 난치성 뇌전증 환자의 뇌척수액에 존재하는 미량의 세포 유리 DNA에도 병인 돌연변이가 존재할 가능성을 주목했다.
연구팀은 난치성 뇌전증 환자 12명의 뇌척수액에서 극미량으로 존재하는 세포 유리 DNA를 정제하고 증폭해 병변 부위에서 이미 검출한 돌연변이가 존재하는지 디지털 중합효소연쇄반응(digital droplet PCR)로 분석 진행했다. 그 결과 3명의 난치성 뇌전증 환자에서 평균 0.57%로 존재하는 병인 유발 돌연변이 유전자를 검출했다.
논문의 주저자인 김세연 석박사통합과정 학생은 "난치성 뇌전증의 원인 유전자 검출은 수술을 통해 조직을 얻어야만 가능했는데 뇌척수액만을 채취해 돌연변이를 검출할 수 있고, 이 검출법이 새로운 진단법으로 쓰이길 기대한다ˮ고 말했다.
연구팀은 이를 통해 악성 뇌종양이 아닌 난치성 뇌전증 환자의 뇌척수액에서 병인 유발 돌연변이를 검출할 수 있음을 밝히고 나아가 수술 없이 척추 주사를 통해 최소 침습적인 방식으로 병인 돌연변이를 진단할 수 있는 틀을 마련했다. 또한, 진단뿐만 아니라 같은 방식을 통해 치료 후 환자의 예후를 지켜볼 수 있을 것으로 기대한다.
연구팀은 이번 연구 결과를 바탕으로 우리 대학 교원창업 기업(소바젠, 대표 김병태)을 통해 난치성 뇌전증의 치료제 개발과 더불어 진단법 활용을 개발할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 한국연구재단의 지원을 받아 수행했다.
2021.05.27 조회수 48040 유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 33813
유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 33813 조현병의 새로운 원인을 규명했다
우리 대학 의과학대학원 이정호 교수 연구팀이 미국 스탠리 의학 연구원(Stanley Medical Research Institute) 김상현 박사팀과 공동연구를 통해 후천적으로 발생한 뇌 특이적 체성 유전변이가 조현병(舊 정신분열증) 발병에 크게 기여하고 있음을 규명했다고 11일 밝혔다.
의과학대학원 김명희 박사, 김일빈 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `생물 정신의학회지(Biological Psychiatry)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Low-level brain somatic mutations are implicated in schizophrenia)
조현병은 전 세계적으로 100명당 1명의 높은 비율로 발병되는 질환이지만, 근본적인 원인은 분명히 규명되지 않고 있다. 기존의 연구들은 조현병의 유전적 원인 규명을 위해 주로 환자의 말초조직인 혈액이나 침에서 돌연변이 연구를 진행했으나, 혈액이나 침에서는 조현병의 분자 유전학적 원인을 완벽하게 밝혀내지 못하고 있었다.
이에 연구팀은 혈액이나 침에서 검출되지 않는, 환자 뇌에서만 존재하는 뇌 특이 체성 유전변이(Somatic mutation)가 조현병의 병리에 영향을 미칠 가능성을 주목했다.
연구팀은 27명의 조현병 환자에게서 얻은 사후 뇌 조직에 `전장 엑솜 유전체 서열(Whole-exome sequencing) 기법'을 적용해 조현병 환자의 뇌에 존재하는 뇌 특이 체성 유전변이를 찾아냈다. 이를 위해 연구팀은 고심도 전장 엑솜 유전체 서열 분석기법을 통해 저빈도의 체성 유전변이를 정확히 찾아내기 위한 독자적 분석 파이프라인을 구축했다.
또한 조현병 환자의 뇌 조직에서 발견된 뇌 특이적 체성 유전변이가 뇌 신경 정보 교환 및 신경 발달에 중요한 역할을 하는 유전자상에 주로 분포하는 것을 발견, 환자의 뇌 체성 유전변이가 뇌 신경회로를 망가뜨려 조현병의 원인이 될 수 있음을 보였다.
논문의 주저자인 김명희 박사는 "우리 주변에서 흔히 발견되지만, 원인이 분명하지 않아 배척돼 온 조현병의 원인 규명에 한 발짝 다가갈 수 있어 기쁘다ˮ며 "이번 연구를 기반으로 조현병의 발병 원인이 더 분명해져 환자뿐 아니라 그 주변 사람들까지 질병으로 인한 고통에서 벗어날 수 있게 되면 좋겠다ˮ라고 말했다.
연구팀의 발견은 조현병의 발병에 체성 유전변이가 중요한 역할을 하고 있음을 밝혀내 조현병의 새로운 발병 원리를 규명함과 동시에, 조현병 연구에 새로운 틀을 제시함으로써 향후 다른 신경정신질환의 연구에도 크게 기여할 수 있을 것으로 기대된다. 또한 연구팀은 우리 대학 교원 창업 기업인 소바젠(대표 김병태)과 협력을 통해 뇌 체성 돌연변이 연관 조현병 환자 진단과 치료법 개발을 진행할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 스탠리 의학 연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
2021.03.11 조회수 100787
조현병의 새로운 원인을 규명했다
우리 대학 의과학대학원 이정호 교수 연구팀이 미국 스탠리 의학 연구원(Stanley Medical Research Institute) 김상현 박사팀과 공동연구를 통해 후천적으로 발생한 뇌 특이적 체성 유전변이가 조현병(舊 정신분열증) 발병에 크게 기여하고 있음을 규명했다고 11일 밝혔다.
의과학대학원 김명희 박사, 김일빈 박사과정 연구원이 공동 제1 저자로 참여한 이번 연구내용은 정신의학 분야 국제 학술지 `생물 정신의학회지(Biological Psychiatry)'에 지난달 4일 字 온라인 게재됐다. (논문명 : Low-level brain somatic mutations are implicated in schizophrenia)
조현병은 전 세계적으로 100명당 1명의 높은 비율로 발병되는 질환이지만, 근본적인 원인은 분명히 규명되지 않고 있다. 기존의 연구들은 조현병의 유전적 원인 규명을 위해 주로 환자의 말초조직인 혈액이나 침에서 돌연변이 연구를 진행했으나, 혈액이나 침에서는 조현병의 분자 유전학적 원인을 완벽하게 밝혀내지 못하고 있었다.
이에 연구팀은 혈액이나 침에서 검출되지 않는, 환자 뇌에서만 존재하는 뇌 특이 체성 유전변이(Somatic mutation)가 조현병의 병리에 영향을 미칠 가능성을 주목했다.
연구팀은 27명의 조현병 환자에게서 얻은 사후 뇌 조직에 `전장 엑솜 유전체 서열(Whole-exome sequencing) 기법'을 적용해 조현병 환자의 뇌에 존재하는 뇌 특이 체성 유전변이를 찾아냈다. 이를 위해 연구팀은 고심도 전장 엑솜 유전체 서열 분석기법을 통해 저빈도의 체성 유전변이를 정확히 찾아내기 위한 독자적 분석 파이프라인을 구축했다.
또한 조현병 환자의 뇌 조직에서 발견된 뇌 특이적 체성 유전변이가 뇌 신경 정보 교환 및 신경 발달에 중요한 역할을 하는 유전자상에 주로 분포하는 것을 발견, 환자의 뇌 체성 유전변이가 뇌 신경회로를 망가뜨려 조현병의 원인이 될 수 있음을 보였다.
논문의 주저자인 김명희 박사는 "우리 주변에서 흔히 발견되지만, 원인이 분명하지 않아 배척돼 온 조현병의 원인 규명에 한 발짝 다가갈 수 있어 기쁘다ˮ며 "이번 연구를 기반으로 조현병의 발병 원인이 더 분명해져 환자뿐 아니라 그 주변 사람들까지 질병으로 인한 고통에서 벗어날 수 있게 되면 좋겠다ˮ라고 말했다.
연구팀의 발견은 조현병의 발병에 체성 유전변이가 중요한 역할을 하고 있음을 밝혀내 조현병의 새로운 발병 원리를 규명함과 동시에, 조현병 연구에 새로운 틀을 제시함으로써 향후 다른 신경정신질환의 연구에도 크게 기여할 수 있을 것으로 기대된다. 또한 연구팀은 우리 대학 교원 창업 기업인 소바젠(대표 김병태)과 협력을 통해 뇌 체성 돌연변이 연관 조현병 환자 진단과 치료법 개발을 진행할 계획이다.
한편 이번 연구는 서경배 과학재단, 보건복지부 및 스탠리 의학 연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
2021.03.11 조회수 100787