%EC%88%98%EC%A7%80%EC%83%81%EC%84%B8%ED%8F%AC
-
 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
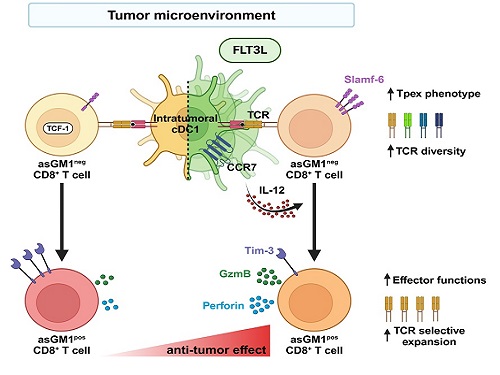
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3741
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3741 -
 이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11 조회수 28821
이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11 조회수 28821 -
 이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
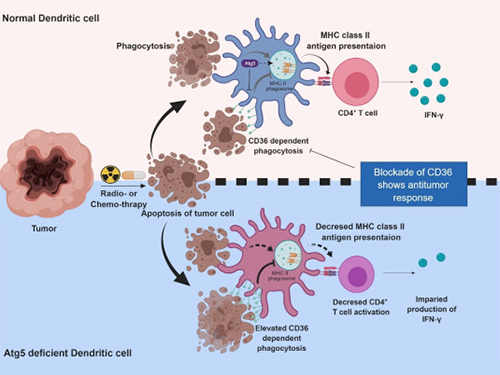
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
2019.04.02 조회수 17765
이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
2019.04.02 조회수 17765 -
 김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21661
김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21661