-
 이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16
조회수 21157
-
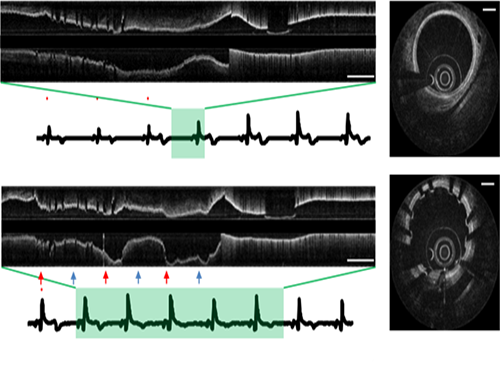 오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04
조회수 18002
-
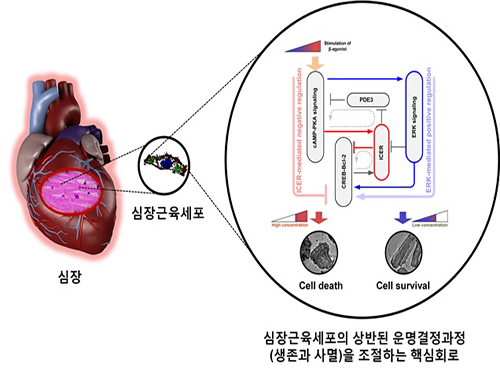 심장세포의 핵심 신호전달경로 스위치 규명
심장근육세포내 베타수용체 신호전달경로의 자극 세기에 따라 세포의 생존과 사멸이라는 상반된 운명이 어떻게 결정되는지 그 근본원리가 우리 학교 연구진에 의해 규명되었다. 향후 심부전을 비롯한 다양한 심장질환의 치료에 활용될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 신성영 박사(제1저자), 이호성 박사과정학생, 강준혁 박사과정학생이 참여하였으며, 광주과학기술원 생명과학부 김도한 교수팀이 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약/전략연구)과 바이오·의료기술개발사업 및 KAIST 미래형 시스템헬스케어사업의 지원으로 수행되었고, 연구결과는 네이처(Nature) 자매지인 네이처 커뮤니케이션스(Nature Communications)지에 12월 17일자로 게재되었다. * (논문명) The switching role of β-adrenergic receptor signalling in cell survival or death decision of cardiomyocytes
베타수용체 신호전달경로는 심장근육세포의 생존을 촉진(베타2수용체 매개)하지만 동시에 심장근육세포의 사멸을 유도하기도 하여 심장독성을 유발(베타1수용체 매개)함으로써 심부전 등 다양한 심장질환을 일으킨다. 지금까지 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정(생존 혹은 사멸)에 대한 근본 원리를 밝히고자 하는 많은 시도가 있어왔으나 아직 밝혀지지 않았다. ※ 베타수용체(β-adrenergic receptor): 심장근육세포의 세포막에 존재하는 단백질로서 에피네프린이나 노르에피네프린 등의 신경호르몬에 의해 자극받으면 심장근육세포가 더 강하고 빠르게 수축하도록 촉진하는 신호를 전달한다.
연구팀은 대규모 컴퓨터시뮬레이션 분석과 세포생물학 실험의 융합연구인 시스템생물학 연구를 통하여 ERK* 신호전달경로와 ICER** 신호전달경로가 매개하는 피드포워드회로가 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치임을 밝혀냈다.
* ERK(Extracellular signal-regulated kinases): 세포생존에 관여하는 신호전달분자 ** ICER(Inducible cAMP early repressor): 세포사멸에 관여하는 신호전달분자
약한 베타수용체의 자극에 대해서는 ERK 신호전달경로가 활성화되고 이로 인하여 Bcl-2*** 단백질의 발현량이 증가되어 심장근육세포의 생존이 촉진되지만, 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로가 활성화되고 Bcl-2 단백질의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발되는 것이다. *** Bcl-2(B-cell lymphoma 2): 세포생존 촉진에 핵심적인 역할을 하는 신호전달분자
또한 연구팀은 시스템생물학적 접근을 통해 실제 심부전 환자에게 널리 사용되는 약물인 베타차단제(β-blocker)****의 작동원리를 밝혀내었다. 심장근육세포에 베타1차단제를 처리하였을 때 강한 베타수용체 자극에서의 Bcl-2 발현량이 증가하고 이로 인하여 심장근육세포의 생존율이 향상되어 세포보호효과가 일어난다는 것을 발견함으로써, 베타차단제의 근본약리기전을 신호전달경로 수준에서 규명하였다. **** 베타차단제(β-blocker): 베타수용체의 활성화를 저해하는 약물이며, 심부전의 진행을 억제시키는 효과가 있어서 임상에서 가장 널리 처방되는 심부전 치료약물이다.
조광현 교수는 “정보기술(IT)과 생명과학(BT)의 융합연구인 시스템생물학 연구를 통해 지금껏 밝혀지지 않았던 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정에 대한 핵심 원리를 성공적으로 규명한 것으로 향후 심장근육세포운명의 제어 및 이를 통한 심부전 등의 다양한 심장질환 치료에 널리 활용될 것으로 기대된다.”고 밝혔다.
조광현 교수 연구팀은 IT와 BT가 융합된 시스템생물학 분야를 세계 최초로 개척해왔으며 특히 인체의 복잡한 질병과 관련된 신호전달네트워크의 모델링과 시뮬레이션 분석, 실험적 증명에 관한 혁신적인 연구를 수행해오고 있다. 지금까지 140여편의 국제저널논문을 게재하였으며, 2014년에는 Cell, Science, Nature 자매지에 연이어 연구성과를 게재하였다.
심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명 및 제어기술 개발: 수학모델링과 대규모 컴퓨터시뮬레이션 분석을 통해 규명된 심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명. ERK 신호전달경로와 ICER 신호전달경로가 매개하는 피드포워드회로는 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치이다. 약한 베타수용체의 자극에 대해서는 ERK 신호전달경로(파란색 화살표)가 활성화되고 이로 인하여 Bcl-2의 발현량이 증가되어 결과적으로 심장근육세포의 생존이 촉진된다. 반면 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로(빨간색 화살표)가 활성화되고, 이로 인해 Bcl-2의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발된다. 이로서 심장근육세포의 사멸을 방지하면서 심장박동의 기능을 유지시킬 수 있는 원천제어기술의 토대가 마련되었다.
심장세포의 핵심 신호전달경로 스위치 규명
심장근육세포내 베타수용체 신호전달경로의 자극 세기에 따라 세포의 생존과 사멸이라는 상반된 운명이 어떻게 결정되는지 그 근본원리가 우리 학교 연구진에 의해 규명되었다. 향후 심부전을 비롯한 다양한 심장질환의 치료에 활용될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 신성영 박사(제1저자), 이호성 박사과정학생, 강준혁 박사과정학생이 참여하였으며, 광주과학기술원 생명과학부 김도한 교수팀이 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약/전략연구)과 바이오·의료기술개발사업 및 KAIST 미래형 시스템헬스케어사업의 지원으로 수행되었고, 연구결과는 네이처(Nature) 자매지인 네이처 커뮤니케이션스(Nature Communications)지에 12월 17일자로 게재되었다. * (논문명) The switching role of β-adrenergic receptor signalling in cell survival or death decision of cardiomyocytes
베타수용체 신호전달경로는 심장근육세포의 생존을 촉진(베타2수용체 매개)하지만 동시에 심장근육세포의 사멸을 유도하기도 하여 심장독성을 유발(베타1수용체 매개)함으로써 심부전 등 다양한 심장질환을 일으킨다. 지금까지 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정(생존 혹은 사멸)에 대한 근본 원리를 밝히고자 하는 많은 시도가 있어왔으나 아직 밝혀지지 않았다. ※ 베타수용체(β-adrenergic receptor): 심장근육세포의 세포막에 존재하는 단백질로서 에피네프린이나 노르에피네프린 등의 신경호르몬에 의해 자극받으면 심장근육세포가 더 강하고 빠르게 수축하도록 촉진하는 신호를 전달한다.
연구팀은 대규모 컴퓨터시뮬레이션 분석과 세포생물학 실험의 융합연구인 시스템생물학 연구를 통하여 ERK* 신호전달경로와 ICER** 신호전달경로가 매개하는 피드포워드회로가 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치임을 밝혀냈다.
* ERK(Extracellular signal-regulated kinases): 세포생존에 관여하는 신호전달분자 ** ICER(Inducible cAMP early repressor): 세포사멸에 관여하는 신호전달분자
약한 베타수용체의 자극에 대해서는 ERK 신호전달경로가 활성화되고 이로 인하여 Bcl-2*** 단백질의 발현량이 증가되어 심장근육세포의 생존이 촉진되지만, 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로가 활성화되고 Bcl-2 단백질의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발되는 것이다. *** Bcl-2(B-cell lymphoma 2): 세포생존 촉진에 핵심적인 역할을 하는 신호전달분자
또한 연구팀은 시스템생물학적 접근을 통해 실제 심부전 환자에게 널리 사용되는 약물인 베타차단제(β-blocker)****의 작동원리를 밝혀내었다. 심장근육세포에 베타1차단제를 처리하였을 때 강한 베타수용체 자극에서의 Bcl-2 발현량이 증가하고 이로 인하여 심장근육세포의 생존율이 향상되어 세포보호효과가 일어난다는 것을 발견함으로써, 베타차단제의 근본약리기전을 신호전달경로 수준에서 규명하였다. **** 베타차단제(β-blocker): 베타수용체의 활성화를 저해하는 약물이며, 심부전의 진행을 억제시키는 효과가 있어서 임상에서 가장 널리 처방되는 심부전 치료약물이다.
조광현 교수는 “정보기술(IT)과 생명과학(BT)의 융합연구인 시스템생물학 연구를 통해 지금껏 밝혀지지 않았던 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정에 대한 핵심 원리를 성공적으로 규명한 것으로 향후 심장근육세포운명의 제어 및 이를 통한 심부전 등의 다양한 심장질환 치료에 널리 활용될 것으로 기대된다.”고 밝혔다.
조광현 교수 연구팀은 IT와 BT가 융합된 시스템생물학 분야를 세계 최초로 개척해왔으며 특히 인체의 복잡한 질병과 관련된 신호전달네트워크의 모델링과 시뮬레이션 분석, 실험적 증명에 관한 혁신적인 연구를 수행해오고 있다. 지금까지 140여편의 국제저널논문을 게재하였으며, 2014년에는 Cell, Science, Nature 자매지에 연이어 연구성과를 게재하였다.
심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명 및 제어기술 개발: 수학모델링과 대규모 컴퓨터시뮬레이션 분석을 통해 규명된 심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명. ERK 신호전달경로와 ICER 신호전달경로가 매개하는 피드포워드회로는 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치이다. 약한 베타수용체의 자극에 대해서는 ERK 신호전달경로(파란색 화살표)가 활성화되고 이로 인하여 Bcl-2의 발현량이 증가되어 결과적으로 심장근육세포의 생존이 촉진된다. 반면 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로(빨간색 화살표)가 활성화되고, 이로 인해 Bcl-2의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발된다. 이로서 심장근육세포의 사멸을 방지하면서 심장박동의 기능을 유지시킬 수 있는 원천제어기술의 토대가 마련되었다.
2014.12.26
조회수 21182
-
 심장질환 원인신호전달메커니즘 규명
- 신약개발 및 심장질환 응용연구의 중요한 발판 마련
- IT와 BT를 융합한 시스템생물학 연구 통해 규명
우리학교 바이오및뇌공학과 조광현 교수팀과 생명과학과 허원도 교수팀이 시스템생물학 융합연구를 통해 심장질환 원인신호전달경로의 숨겨진 메커니즘을 규명했다.
심근비대증은 다양한 병인에 의해 심근세포가 비대해지는 병리학적 현상으로써 심부전증과 부정맥 등을 수반하는 주요 심장질환이다.
칼시뉴린-엔팻(calcineurin-NFAT) 신호전달경로는 이러한 심근비대증의 유발에 매우 중요한 역할을 하는 것으로 알려져 있다.
하지만 이 신호전달경로의 주요 조절단백질로 알려진 알캔(RCAN1)의 기능에 대해 많은 논쟁이 이어져 왔고 현재까지 그 구체적인 조절메커니즘이 밝혀지지 않았다.
조광현 교수 융합연구팀은 이러한 복잡한 현상에 대해 수학 모델링과 대규모 컴퓨터시뮬레이션, 그리고 단일세포 분자 이미징 기술을 동원한 시스템생물학 융합연구를 통해 어크(ERK)와 지에스케이(GSK3)로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 새롭게 규명했다.
특히 이 연구에서는 알캔이 세포내 농도가 낮을 때 칼시뉴린(calcineurin)의 기능을 저해하는 억제자로서 기능하지만, 그 농도가 증가하면 어크와 지에스케이에 의한 크로스토크를 통해 칼시뉴린 신호를 오히려 증가시키는 촉진자로서 기능 하도록 세포내 조절회로가 진화적으로 설계되어 있음을 최초로 밝혔다.
지금까지 많은 연구에서 알캔의 상반된 신호조절 역할이 보고되어 학계에서는 과연 무엇이 진실인가에 관한 논쟁이 이어졌다.
또한, 어떻게 동일한 분자가 그와 같이 서로 다른 기능을 보이는 것인지, 이를 유발하는 근본적인 메커니즘은 과연 무엇인지 등이 모두 수수께끼로 남아 있었다.
이번 연구를 통해 학계의 이러한 오랜 질문에 대한 해답이 제시됐으며, 알캔과 칼시뉴린-엔팻 신호전달경로의 근원적인 조절메커니즘이 시스템차원에서 최초로 규명됨으로써 앞으로 이를 표적으로 하는 신약개발 및 관련 심장질환 응용연구의 중요한 발판을 마련하게 되었다.
또한 기존의 실험적 접근만으로는 해결할 수 없는 복잡한 생명현상을 대상으로 IT와 BT의 융합연구인 생체시스템모델링 및 바이오시뮬레이션 연구를 통해 새로운 해결책을 찾을 수 있는 가능성을 제시하게 됐다.
이 연구는 교육과학기술부가 지원하는 한국연구재단의 기초연구실육성사업과 도약연구사업, 그리고 칼슘대사시스템생물학사업의 일환으로 수행됐으며, 연구 결과는 <저널오브셀사이언스(Journal of Cell Science)>의 표지논문으로 선정되어 2011년 1월 1일자(온라인판은 2010년 12월 13일자)에 게재된다.
심장질환 원인신호전달메커니즘 규명
- 신약개발 및 심장질환 응용연구의 중요한 발판 마련
- IT와 BT를 융합한 시스템생물학 연구 통해 규명
우리학교 바이오및뇌공학과 조광현 교수팀과 생명과학과 허원도 교수팀이 시스템생물학 융합연구를 통해 심장질환 원인신호전달경로의 숨겨진 메커니즘을 규명했다.
심근비대증은 다양한 병인에 의해 심근세포가 비대해지는 병리학적 현상으로써 심부전증과 부정맥 등을 수반하는 주요 심장질환이다.
칼시뉴린-엔팻(calcineurin-NFAT) 신호전달경로는 이러한 심근비대증의 유발에 매우 중요한 역할을 하는 것으로 알려져 있다.
하지만 이 신호전달경로의 주요 조절단백질로 알려진 알캔(RCAN1)의 기능에 대해 많은 논쟁이 이어져 왔고 현재까지 그 구체적인 조절메커니즘이 밝혀지지 않았다.
조광현 교수 융합연구팀은 이러한 복잡한 현상에 대해 수학 모델링과 대규모 컴퓨터시뮬레이션, 그리고 단일세포 분자 이미징 기술을 동원한 시스템생물학 융합연구를 통해 어크(ERK)와 지에스케이(GSK3)로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 새롭게 규명했다.
특히 이 연구에서는 알캔이 세포내 농도가 낮을 때 칼시뉴린(calcineurin)의 기능을 저해하는 억제자로서 기능하지만, 그 농도가 증가하면 어크와 지에스케이에 의한 크로스토크를 통해 칼시뉴린 신호를 오히려 증가시키는 촉진자로서 기능 하도록 세포내 조절회로가 진화적으로 설계되어 있음을 최초로 밝혔다.
지금까지 많은 연구에서 알캔의 상반된 신호조절 역할이 보고되어 학계에서는 과연 무엇이 진실인가에 관한 논쟁이 이어졌다.
또한, 어떻게 동일한 분자가 그와 같이 서로 다른 기능을 보이는 것인지, 이를 유발하는 근본적인 메커니즘은 과연 무엇인지 등이 모두 수수께끼로 남아 있었다.
이번 연구를 통해 학계의 이러한 오랜 질문에 대한 해답이 제시됐으며, 알캔과 칼시뉴린-엔팻 신호전달경로의 근원적인 조절메커니즘이 시스템차원에서 최초로 규명됨으로써 앞으로 이를 표적으로 하는 신약개발 및 관련 심장질환 응용연구의 중요한 발판을 마련하게 되었다.
또한 기존의 실험적 접근만으로는 해결할 수 없는 복잡한 생명현상을 대상으로 IT와 BT의 융합연구인 생체시스템모델링 및 바이오시뮬레이션 연구를 통해 새로운 해결책을 찾을 수 있는 가능성을 제시하게 됐다.
이 연구는 교육과학기술부가 지원하는 한국연구재단의 기초연구실육성사업과 도약연구사업, 그리고 칼슘대사시스템생물학사업의 일환으로 수행됐으며, 연구 결과는 <저널오브셀사이언스(Journal of Cell Science)>의 표지논문으로 선정되어 2011년 1월 1일자(온라인판은 2010년 12월 13일자)에 게재된다.
2010.12.20
조회수 17149
-
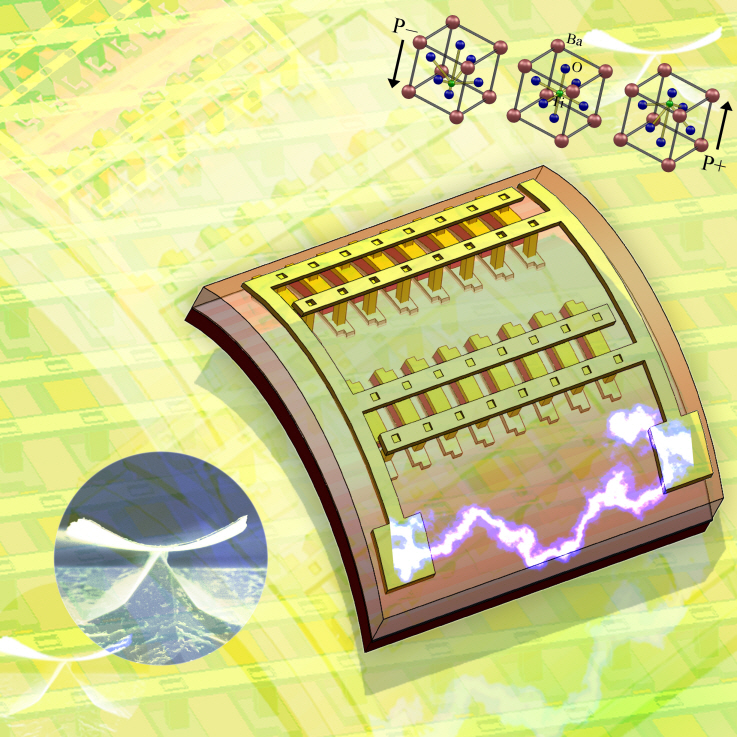 유연한 나노신소재 발전기술 개발
휴대폰이나 심장에 이식한 미세 로봇이 배터리 충전 없이 영구적으로 작동할 수는 없을까?
공상과학 영화에서나 나올 법한 이런 일들이 머지않아 가능할 것으로 보인다.
우리학교 신소재공학과 이건재 교수팀은 압전특성이 우수한 세라믹 박막물질을 이용하여 심장 박동, 혈액 흐름과 같은 미세한 움직임으로도 전기를 만들 수 있는 새로운 형태의 유연한 나노발전기술을 개발했다.
압전특성이란, 가스레인지의 점화스위치 작동원리와 같이, 압력이나 구부러짐의 힘이 가해질 때 전기가 발생되는 특성을 말하는 데, ‘페로브스카이트(perovskite)’ 구조를 가지는 세라믹 물질들이 높은 효율을 나타내지만 깨지기 쉬운 성질을 가지고 있어 유연한 전자 장치로의 활용이 불가능했다.
이 교수팀은 높은 압전특성을 가지면서 깨지지 않고 자유롭게 구부릴 수 있는 세라믹 나노박막물질을 만들어 바이오-환경 친화적인 고효율 나노발전기술 개발에 세계 최초로 성공한 것이다.
나노기술과 압전체가 만나 만들어지는 나노발전기술은 전선과 배터리 없이도 발전이 가능해, 휴대용 전자제품 뿐만 아니라 몸속에 집어넣는 센서나 로봇의 에너지원으로도 사용이 가능하기 때문에, 그 활용영역은 응용기술 여하에 따라 얼마든지 넓어질 수 있을 것으로 보고 있다.
미세한 바람, 진동, 소리와 같이 자연에서 발생되는 에너지원과 심장 박동, 혈액 흐름, 근육 수축·이완과 같이 사람 몸에서 발생되는 생체역학적인 힘을 통해 전기를 생산할 수 있게 됨으로써 꿈의 무공해·무한 에너지원이 될 수 있는 것이다.
이번에 개발한 나노발전기술은 이 교수가 2004년 세계 최초로 공동발명한 ‘고성능 단결정 휘어지는 전자소자’를 토대로, 세라믹 나노박막물질을 유연한 플라스틱 기판 위에 옮겨, 외적인 힘이 주어질 때마다 신소재 압전물질로부터 전기를 얻는 데 성공한 것이 핵심이다. 또한 이 나노발전기술의 회로구조를 변형하면 LED발광도 이루어 질 수 있다고 이 교수는 말했다.
이 연구 결과는 나노과학기술(NT) 분야의 세계적 권위지인 "나노 레터스(Nano Letters)" 11월호 온라인 판에 게재됐고, 국내·외에 특허 출원되었으며, 논문의 공동저자로 참여한 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수팀과 동물 이식형 나노발전기 생체실험을 후속 연구로 진행하고 있다.
<관련동영상>
외부적인 힘에 의해 나노발전기에서 전기가 발생되는 동영상
http://www.youtube.com/watch?v=sWdopmi0B7U
<그림설명>
구부러지는 유연한 나노박막물질에서 전기가 발생되고 있다.
유연한 나노신소재 발전기술 개발
휴대폰이나 심장에 이식한 미세 로봇이 배터리 충전 없이 영구적으로 작동할 수는 없을까?
공상과학 영화에서나 나올 법한 이런 일들이 머지않아 가능할 것으로 보인다.
우리학교 신소재공학과 이건재 교수팀은 압전특성이 우수한 세라믹 박막물질을 이용하여 심장 박동, 혈액 흐름과 같은 미세한 움직임으로도 전기를 만들 수 있는 새로운 형태의 유연한 나노발전기술을 개발했다.
압전특성이란, 가스레인지의 점화스위치 작동원리와 같이, 압력이나 구부러짐의 힘이 가해질 때 전기가 발생되는 특성을 말하는 데, ‘페로브스카이트(perovskite)’ 구조를 가지는 세라믹 물질들이 높은 효율을 나타내지만 깨지기 쉬운 성질을 가지고 있어 유연한 전자 장치로의 활용이 불가능했다.
이 교수팀은 높은 압전특성을 가지면서 깨지지 않고 자유롭게 구부릴 수 있는 세라믹 나노박막물질을 만들어 바이오-환경 친화적인 고효율 나노발전기술 개발에 세계 최초로 성공한 것이다.
나노기술과 압전체가 만나 만들어지는 나노발전기술은 전선과 배터리 없이도 발전이 가능해, 휴대용 전자제품 뿐만 아니라 몸속에 집어넣는 센서나 로봇의 에너지원으로도 사용이 가능하기 때문에, 그 활용영역은 응용기술 여하에 따라 얼마든지 넓어질 수 있을 것으로 보고 있다.
미세한 바람, 진동, 소리와 같이 자연에서 발생되는 에너지원과 심장 박동, 혈액 흐름, 근육 수축·이완과 같이 사람 몸에서 발생되는 생체역학적인 힘을 통해 전기를 생산할 수 있게 됨으로써 꿈의 무공해·무한 에너지원이 될 수 있는 것이다.
이번에 개발한 나노발전기술은 이 교수가 2004년 세계 최초로 공동발명한 ‘고성능 단결정 휘어지는 전자소자’를 토대로, 세라믹 나노박막물질을 유연한 플라스틱 기판 위에 옮겨, 외적인 힘이 주어질 때마다 신소재 압전물질로부터 전기를 얻는 데 성공한 것이 핵심이다. 또한 이 나노발전기술의 회로구조를 변형하면 LED발광도 이루어 질 수 있다고 이 교수는 말했다.
이 연구 결과는 나노과학기술(NT) 분야의 세계적 권위지인 "나노 레터스(Nano Letters)" 11월호 온라인 판에 게재됐고, 국내·외에 특허 출원되었으며, 논문의 공동저자로 참여한 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수팀과 동물 이식형 나노발전기 생체실험을 후속 연구로 진행하고 있다.
<관련동영상>
외부적인 힘에 의해 나노발전기에서 전기가 발생되는 동영상
http://www.youtube.com/watch?v=sWdopmi0B7U
<그림설명>
구부러지는 유연한 나노박막물질에서 전기가 발생되고 있다.
2010.11.08
조회수 22654
-
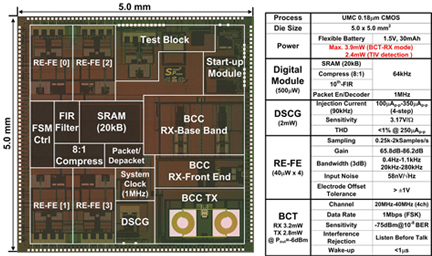 유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
2010.02.10
조회수 24989
 이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16 조회수 21157
이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16 조회수 21157 오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04 조회수 18002
오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04 조회수 18002 심장세포의 핵심 신호전달경로 스위치 규명
심장근육세포내 베타수용체 신호전달경로의 자극 세기에 따라 세포의 생존과 사멸이라는 상반된 운명이 어떻게 결정되는지 그 근본원리가 우리 학교 연구진에 의해 규명되었다. 향후 심부전을 비롯한 다양한 심장질환의 치료에 활용될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 신성영 박사(제1저자), 이호성 박사과정학생, 강준혁 박사과정학생이 참여하였으며, 광주과학기술원 생명과학부 김도한 교수팀이 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약/전략연구)과 바이오·의료기술개발사업 및 KAIST 미래형 시스템헬스케어사업의 지원으로 수행되었고, 연구결과는 네이처(Nature) 자매지인 네이처 커뮤니케이션스(Nature Communications)지에 12월 17일자로 게재되었다. * (논문명) The switching role of β-adrenergic receptor signalling in cell survival or death decision of cardiomyocytes
베타수용체 신호전달경로는 심장근육세포의 생존을 촉진(베타2수용체 매개)하지만 동시에 심장근육세포의 사멸을 유도하기도 하여 심장독성을 유발(베타1수용체 매개)함으로써 심부전 등 다양한 심장질환을 일으킨다. 지금까지 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정(생존 혹은 사멸)에 대한 근본 원리를 밝히고자 하는 많은 시도가 있어왔으나 아직 밝혀지지 않았다. ※ 베타수용체(β-adrenergic receptor): 심장근육세포의 세포막에 존재하는 단백질로서 에피네프린이나 노르에피네프린 등의 신경호르몬에 의해 자극받으면 심장근육세포가 더 강하고 빠르게 수축하도록 촉진하는 신호를 전달한다.
연구팀은 대규모 컴퓨터시뮬레이션 분석과 세포생물학 실험의 융합연구인 시스템생물학 연구를 통하여 ERK* 신호전달경로와 ICER** 신호전달경로가 매개하는 피드포워드회로가 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치임을 밝혀냈다.
* ERK(Extracellular signal-regulated kinases): 세포생존에 관여하는 신호전달분자 ** ICER(Inducible cAMP early repressor): 세포사멸에 관여하는 신호전달분자
약한 베타수용체의 자극에 대해서는 ERK 신호전달경로가 활성화되고 이로 인하여 Bcl-2*** 단백질의 발현량이 증가되어 심장근육세포의 생존이 촉진되지만, 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로가 활성화되고 Bcl-2 단백질의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발되는 것이다. *** Bcl-2(B-cell lymphoma 2): 세포생존 촉진에 핵심적인 역할을 하는 신호전달분자
또한 연구팀은 시스템생물학적 접근을 통해 실제 심부전 환자에게 널리 사용되는 약물인 베타차단제(β-blocker)****의 작동원리를 밝혀내었다. 심장근육세포에 베타1차단제를 처리하였을 때 강한 베타수용체 자극에서의 Bcl-2 발현량이 증가하고 이로 인하여 심장근육세포의 생존율이 향상되어 세포보호효과가 일어난다는 것을 발견함으로써, 베타차단제의 근본약리기전을 신호전달경로 수준에서 규명하였다. **** 베타차단제(β-blocker): 베타수용체의 활성화를 저해하는 약물이며, 심부전의 진행을 억제시키는 효과가 있어서 임상에서 가장 널리 처방되는 심부전 치료약물이다.
조광현 교수는 “정보기술(IT)과 생명과학(BT)의 융합연구인 시스템생물학 연구를 통해 지금껏 밝혀지지 않았던 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정에 대한 핵심 원리를 성공적으로 규명한 것으로 향후 심장근육세포운명의 제어 및 이를 통한 심부전 등의 다양한 심장질환 치료에 널리 활용될 것으로 기대된다.”고 밝혔다.
조광현 교수 연구팀은 IT와 BT가 융합된 시스템생물학 분야를 세계 최초로 개척해왔으며 특히 인체의 복잡한 질병과 관련된 신호전달네트워크의 모델링과 시뮬레이션 분석, 실험적 증명에 관한 혁신적인 연구를 수행해오고 있다. 지금까지 140여편의 국제저널논문을 게재하였으며, 2014년에는 Cell, Science, Nature 자매지에 연이어 연구성과를 게재하였다.
심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명 및 제어기술 개발: 수학모델링과 대규모 컴퓨터시뮬레이션 분석을 통해 규명된 심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명. ERK 신호전달경로와 ICER 신호전달경로가 매개하는 피드포워드회로는 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치이다. 약한 베타수용체의 자극에 대해서는 ERK 신호전달경로(파란색 화살표)가 활성화되고 이로 인하여 Bcl-2의 발현량이 증가되어 결과적으로 심장근육세포의 생존이 촉진된다. 반면 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로(빨간색 화살표)가 활성화되고, 이로 인해 Bcl-2의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발된다. 이로서 심장근육세포의 사멸을 방지하면서 심장박동의 기능을 유지시킬 수 있는 원천제어기술의 토대가 마련되었다.
2014.12.26 조회수 21182
심장세포의 핵심 신호전달경로 스위치 규명
심장근육세포내 베타수용체 신호전달경로의 자극 세기에 따라 세포의 생존과 사멸이라는 상반된 운명이 어떻게 결정되는지 그 근본원리가 우리 학교 연구진에 의해 규명되었다. 향후 심부전을 비롯한 다양한 심장질환의 치료에 활용될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 신성영 박사(제1저자), 이호성 박사과정학생, 강준혁 박사과정학생이 참여하였으며, 광주과학기술원 생명과학부 김도한 교수팀이 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약/전략연구)과 바이오·의료기술개발사업 및 KAIST 미래형 시스템헬스케어사업의 지원으로 수행되었고, 연구결과는 네이처(Nature) 자매지인 네이처 커뮤니케이션스(Nature Communications)지에 12월 17일자로 게재되었다. * (논문명) The switching role of β-adrenergic receptor signalling in cell survival or death decision of cardiomyocytes
베타수용체 신호전달경로는 심장근육세포의 생존을 촉진(베타2수용체 매개)하지만 동시에 심장근육세포의 사멸을 유도하기도 하여 심장독성을 유발(베타1수용체 매개)함으로써 심부전 등 다양한 심장질환을 일으킨다. 지금까지 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정(생존 혹은 사멸)에 대한 근본 원리를 밝히고자 하는 많은 시도가 있어왔으나 아직 밝혀지지 않았다. ※ 베타수용체(β-adrenergic receptor): 심장근육세포의 세포막에 존재하는 단백질로서 에피네프린이나 노르에피네프린 등의 신경호르몬에 의해 자극받으면 심장근육세포가 더 강하고 빠르게 수축하도록 촉진하는 신호를 전달한다.
연구팀은 대규모 컴퓨터시뮬레이션 분석과 세포생물학 실험의 융합연구인 시스템생물학 연구를 통하여 ERK* 신호전달경로와 ICER** 신호전달경로가 매개하는 피드포워드회로가 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치임을 밝혀냈다.
* ERK(Extracellular signal-regulated kinases): 세포생존에 관여하는 신호전달분자 ** ICER(Inducible cAMP early repressor): 세포사멸에 관여하는 신호전달분자
약한 베타수용체의 자극에 대해서는 ERK 신호전달경로가 활성화되고 이로 인하여 Bcl-2*** 단백질의 발현량이 증가되어 심장근육세포의 생존이 촉진되지만, 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로가 활성화되고 Bcl-2 단백질의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발되는 것이다. *** Bcl-2(B-cell lymphoma 2): 세포생존 촉진에 핵심적인 역할을 하는 신호전달분자
또한 연구팀은 시스템생물학적 접근을 통해 실제 심부전 환자에게 널리 사용되는 약물인 베타차단제(β-blocker)****의 작동원리를 밝혀내었다. 심장근육세포에 베타1차단제를 처리하였을 때 강한 베타수용체 자극에서의 Bcl-2 발현량이 증가하고 이로 인하여 심장근육세포의 생존율이 향상되어 세포보호효과가 일어난다는 것을 발견함으로써, 베타차단제의 근본약리기전을 신호전달경로 수준에서 규명하였다. **** 베타차단제(β-blocker): 베타수용체의 활성화를 저해하는 약물이며, 심부전의 진행을 억제시키는 효과가 있어서 임상에서 가장 널리 처방되는 심부전 치료약물이다.
조광현 교수는 “정보기술(IT)과 생명과학(BT)의 융합연구인 시스템생물학 연구를 통해 지금껏 밝혀지지 않았던 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정에 대한 핵심 원리를 성공적으로 규명한 것으로 향후 심장근육세포운명의 제어 및 이를 통한 심부전 등의 다양한 심장질환 치료에 널리 활용될 것으로 기대된다.”고 밝혔다.
조광현 교수 연구팀은 IT와 BT가 융합된 시스템생물학 분야를 세계 최초로 개척해왔으며 특히 인체의 복잡한 질병과 관련된 신호전달네트워크의 모델링과 시뮬레이션 분석, 실험적 증명에 관한 혁신적인 연구를 수행해오고 있다. 지금까지 140여편의 국제저널논문을 게재하였으며, 2014년에는 Cell, Science, Nature 자매지에 연이어 연구성과를 게재하였다.
심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명 및 제어기술 개발: 수학모델링과 대규모 컴퓨터시뮬레이션 분석을 통해 규명된 심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명. ERK 신호전달경로와 ICER 신호전달경로가 매개하는 피드포워드회로는 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치이다. 약한 베타수용체의 자극에 대해서는 ERK 신호전달경로(파란색 화살표)가 활성화되고 이로 인하여 Bcl-2의 발현량이 증가되어 결과적으로 심장근육세포의 생존이 촉진된다. 반면 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로(빨간색 화살표)가 활성화되고, 이로 인해 Bcl-2의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발된다. 이로서 심장근육세포의 사멸을 방지하면서 심장박동의 기능을 유지시킬 수 있는 원천제어기술의 토대가 마련되었다.
2014.12.26 조회수 21182 심장질환 원인신호전달메커니즘 규명
- 신약개발 및 심장질환 응용연구의 중요한 발판 마련
- IT와 BT를 융합한 시스템생물학 연구 통해 규명
우리학교 바이오및뇌공학과 조광현 교수팀과 생명과학과 허원도 교수팀이 시스템생물학 융합연구를 통해 심장질환 원인신호전달경로의 숨겨진 메커니즘을 규명했다.
심근비대증은 다양한 병인에 의해 심근세포가 비대해지는 병리학적 현상으로써 심부전증과 부정맥 등을 수반하는 주요 심장질환이다.
칼시뉴린-엔팻(calcineurin-NFAT) 신호전달경로는 이러한 심근비대증의 유발에 매우 중요한 역할을 하는 것으로 알려져 있다.
하지만 이 신호전달경로의 주요 조절단백질로 알려진 알캔(RCAN1)의 기능에 대해 많은 논쟁이 이어져 왔고 현재까지 그 구체적인 조절메커니즘이 밝혀지지 않았다.
조광현 교수 융합연구팀은 이러한 복잡한 현상에 대해 수학 모델링과 대규모 컴퓨터시뮬레이션, 그리고 단일세포 분자 이미징 기술을 동원한 시스템생물학 융합연구를 통해 어크(ERK)와 지에스케이(GSK3)로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 새롭게 규명했다.
특히 이 연구에서는 알캔이 세포내 농도가 낮을 때 칼시뉴린(calcineurin)의 기능을 저해하는 억제자로서 기능하지만, 그 농도가 증가하면 어크와 지에스케이에 의한 크로스토크를 통해 칼시뉴린 신호를 오히려 증가시키는 촉진자로서 기능 하도록 세포내 조절회로가 진화적으로 설계되어 있음을 최초로 밝혔다.
지금까지 많은 연구에서 알캔의 상반된 신호조절 역할이 보고되어 학계에서는 과연 무엇이 진실인가에 관한 논쟁이 이어졌다.
또한, 어떻게 동일한 분자가 그와 같이 서로 다른 기능을 보이는 것인지, 이를 유발하는 근본적인 메커니즘은 과연 무엇인지 등이 모두 수수께끼로 남아 있었다.
이번 연구를 통해 학계의 이러한 오랜 질문에 대한 해답이 제시됐으며, 알캔과 칼시뉴린-엔팻 신호전달경로의 근원적인 조절메커니즘이 시스템차원에서 최초로 규명됨으로써 앞으로 이를 표적으로 하는 신약개발 및 관련 심장질환 응용연구의 중요한 발판을 마련하게 되었다.
또한 기존의 실험적 접근만으로는 해결할 수 없는 복잡한 생명현상을 대상으로 IT와 BT의 융합연구인 생체시스템모델링 및 바이오시뮬레이션 연구를 통해 새로운 해결책을 찾을 수 있는 가능성을 제시하게 됐다.
이 연구는 교육과학기술부가 지원하는 한국연구재단의 기초연구실육성사업과 도약연구사업, 그리고 칼슘대사시스템생물학사업의 일환으로 수행됐으며, 연구 결과는 <저널오브셀사이언스(Journal of Cell Science)>의 표지논문으로 선정되어 2011년 1월 1일자(온라인판은 2010년 12월 13일자)에 게재된다.
2010.12.20 조회수 17149
심장질환 원인신호전달메커니즘 규명
- 신약개발 및 심장질환 응용연구의 중요한 발판 마련
- IT와 BT를 융합한 시스템생물학 연구 통해 규명
우리학교 바이오및뇌공학과 조광현 교수팀과 생명과학과 허원도 교수팀이 시스템생물학 융합연구를 통해 심장질환 원인신호전달경로의 숨겨진 메커니즘을 규명했다.
심근비대증은 다양한 병인에 의해 심근세포가 비대해지는 병리학적 현상으로써 심부전증과 부정맥 등을 수반하는 주요 심장질환이다.
칼시뉴린-엔팻(calcineurin-NFAT) 신호전달경로는 이러한 심근비대증의 유발에 매우 중요한 역할을 하는 것으로 알려져 있다.
하지만 이 신호전달경로의 주요 조절단백질로 알려진 알캔(RCAN1)의 기능에 대해 많은 논쟁이 이어져 왔고 현재까지 그 구체적인 조절메커니즘이 밝혀지지 않았다.
조광현 교수 융합연구팀은 이러한 복잡한 현상에 대해 수학 모델링과 대규모 컴퓨터시뮬레이션, 그리고 단일세포 분자 이미징 기술을 동원한 시스템생물학 융합연구를 통해 어크(ERK)와 지에스케이(GSK3)로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 새롭게 규명했다.
특히 이 연구에서는 알캔이 세포내 농도가 낮을 때 칼시뉴린(calcineurin)의 기능을 저해하는 억제자로서 기능하지만, 그 농도가 증가하면 어크와 지에스케이에 의한 크로스토크를 통해 칼시뉴린 신호를 오히려 증가시키는 촉진자로서 기능 하도록 세포내 조절회로가 진화적으로 설계되어 있음을 최초로 밝혔다.
지금까지 많은 연구에서 알캔의 상반된 신호조절 역할이 보고되어 학계에서는 과연 무엇이 진실인가에 관한 논쟁이 이어졌다.
또한, 어떻게 동일한 분자가 그와 같이 서로 다른 기능을 보이는 것인지, 이를 유발하는 근본적인 메커니즘은 과연 무엇인지 등이 모두 수수께끼로 남아 있었다.
이번 연구를 통해 학계의 이러한 오랜 질문에 대한 해답이 제시됐으며, 알캔과 칼시뉴린-엔팻 신호전달경로의 근원적인 조절메커니즘이 시스템차원에서 최초로 규명됨으로써 앞으로 이를 표적으로 하는 신약개발 및 관련 심장질환 응용연구의 중요한 발판을 마련하게 되었다.
또한 기존의 실험적 접근만으로는 해결할 수 없는 복잡한 생명현상을 대상으로 IT와 BT의 융합연구인 생체시스템모델링 및 바이오시뮬레이션 연구를 통해 새로운 해결책을 찾을 수 있는 가능성을 제시하게 됐다.
이 연구는 교육과학기술부가 지원하는 한국연구재단의 기초연구실육성사업과 도약연구사업, 그리고 칼슘대사시스템생물학사업의 일환으로 수행됐으며, 연구 결과는 <저널오브셀사이언스(Journal of Cell Science)>의 표지논문으로 선정되어 2011년 1월 1일자(온라인판은 2010년 12월 13일자)에 게재된다.
2010.12.20 조회수 17149 유연한 나노신소재 발전기술 개발
휴대폰이나 심장에 이식한 미세 로봇이 배터리 충전 없이 영구적으로 작동할 수는 없을까?
공상과학 영화에서나 나올 법한 이런 일들이 머지않아 가능할 것으로 보인다.
우리학교 신소재공학과 이건재 교수팀은 압전특성이 우수한 세라믹 박막물질을 이용하여 심장 박동, 혈액 흐름과 같은 미세한 움직임으로도 전기를 만들 수 있는 새로운 형태의 유연한 나노발전기술을 개발했다.
압전특성이란, 가스레인지의 점화스위치 작동원리와 같이, 압력이나 구부러짐의 힘이 가해질 때 전기가 발생되는 특성을 말하는 데, ‘페로브스카이트(perovskite)’ 구조를 가지는 세라믹 물질들이 높은 효율을 나타내지만 깨지기 쉬운 성질을 가지고 있어 유연한 전자 장치로의 활용이 불가능했다.
이 교수팀은 높은 압전특성을 가지면서 깨지지 않고 자유롭게 구부릴 수 있는 세라믹 나노박막물질을 만들어 바이오-환경 친화적인 고효율 나노발전기술 개발에 세계 최초로 성공한 것이다.
나노기술과 압전체가 만나 만들어지는 나노발전기술은 전선과 배터리 없이도 발전이 가능해, 휴대용 전자제품 뿐만 아니라 몸속에 집어넣는 센서나 로봇의 에너지원으로도 사용이 가능하기 때문에, 그 활용영역은 응용기술 여하에 따라 얼마든지 넓어질 수 있을 것으로 보고 있다.
미세한 바람, 진동, 소리와 같이 자연에서 발생되는 에너지원과 심장 박동, 혈액 흐름, 근육 수축·이완과 같이 사람 몸에서 발생되는 생체역학적인 힘을 통해 전기를 생산할 수 있게 됨으로써 꿈의 무공해·무한 에너지원이 될 수 있는 것이다.
이번에 개발한 나노발전기술은 이 교수가 2004년 세계 최초로 공동발명한 ‘고성능 단결정 휘어지는 전자소자’를 토대로, 세라믹 나노박막물질을 유연한 플라스틱 기판 위에 옮겨, 외적인 힘이 주어질 때마다 신소재 압전물질로부터 전기를 얻는 데 성공한 것이 핵심이다. 또한 이 나노발전기술의 회로구조를 변형하면 LED발광도 이루어 질 수 있다고 이 교수는 말했다.
이 연구 결과는 나노과학기술(NT) 분야의 세계적 권위지인 "나노 레터스(Nano Letters)" 11월호 온라인 판에 게재됐고, 국내·외에 특허 출원되었으며, 논문의 공동저자로 참여한 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수팀과 동물 이식형 나노발전기 생체실험을 후속 연구로 진행하고 있다.
<관련동영상>
외부적인 힘에 의해 나노발전기에서 전기가 발생되는 동영상
http://www.youtube.com/watch?v=sWdopmi0B7U
<그림설명>
구부러지는 유연한 나노박막물질에서 전기가 발생되고 있다.
2010.11.08 조회수 22654
유연한 나노신소재 발전기술 개발
휴대폰이나 심장에 이식한 미세 로봇이 배터리 충전 없이 영구적으로 작동할 수는 없을까?
공상과학 영화에서나 나올 법한 이런 일들이 머지않아 가능할 것으로 보인다.
우리학교 신소재공학과 이건재 교수팀은 압전특성이 우수한 세라믹 박막물질을 이용하여 심장 박동, 혈액 흐름과 같은 미세한 움직임으로도 전기를 만들 수 있는 새로운 형태의 유연한 나노발전기술을 개발했다.
압전특성이란, 가스레인지의 점화스위치 작동원리와 같이, 압력이나 구부러짐의 힘이 가해질 때 전기가 발생되는 특성을 말하는 데, ‘페로브스카이트(perovskite)’ 구조를 가지는 세라믹 물질들이 높은 효율을 나타내지만 깨지기 쉬운 성질을 가지고 있어 유연한 전자 장치로의 활용이 불가능했다.
이 교수팀은 높은 압전특성을 가지면서 깨지지 않고 자유롭게 구부릴 수 있는 세라믹 나노박막물질을 만들어 바이오-환경 친화적인 고효율 나노발전기술 개발에 세계 최초로 성공한 것이다.
나노기술과 압전체가 만나 만들어지는 나노발전기술은 전선과 배터리 없이도 발전이 가능해, 휴대용 전자제품 뿐만 아니라 몸속에 집어넣는 센서나 로봇의 에너지원으로도 사용이 가능하기 때문에, 그 활용영역은 응용기술 여하에 따라 얼마든지 넓어질 수 있을 것으로 보고 있다.
미세한 바람, 진동, 소리와 같이 자연에서 발생되는 에너지원과 심장 박동, 혈액 흐름, 근육 수축·이완과 같이 사람 몸에서 발생되는 생체역학적인 힘을 통해 전기를 생산할 수 있게 됨으로써 꿈의 무공해·무한 에너지원이 될 수 있는 것이다.
이번에 개발한 나노발전기술은 이 교수가 2004년 세계 최초로 공동발명한 ‘고성능 단결정 휘어지는 전자소자’를 토대로, 세라믹 나노박막물질을 유연한 플라스틱 기판 위에 옮겨, 외적인 힘이 주어질 때마다 신소재 압전물질로부터 전기를 얻는 데 성공한 것이 핵심이다. 또한 이 나노발전기술의 회로구조를 변형하면 LED발광도 이루어 질 수 있다고 이 교수는 말했다.
이 연구 결과는 나노과학기술(NT) 분야의 세계적 권위지인 "나노 레터스(Nano Letters)" 11월호 온라인 판에 게재됐고, 국내·외에 특허 출원되었으며, 논문의 공동저자로 참여한 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수팀과 동물 이식형 나노발전기 생체실험을 후속 연구로 진행하고 있다.
<관련동영상>
외부적인 힘에 의해 나노발전기에서 전기가 발생되는 동영상
http://www.youtube.com/watch?v=sWdopmi0B7U
<그림설명>
구부러지는 유연한 나노박막물질에서 전기가 발생되고 있다.
2010.11.08 조회수 22654 유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
2010.02.10 조회수 24989
유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
2010.02.10 조회수 24989