%EC%95%94%EC%B9%98%EB%A3%8C
-
 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 900
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 900 -
 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 6586
면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 6586 -
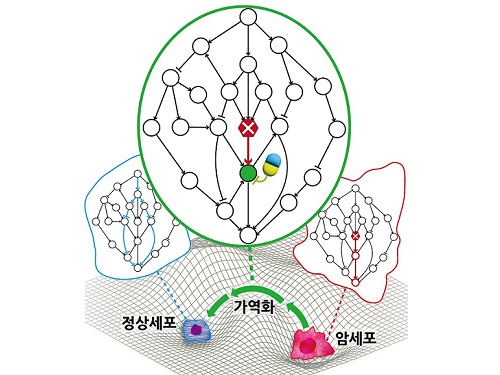 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 8599
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 8599 -
 암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 11738
암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 11738 -
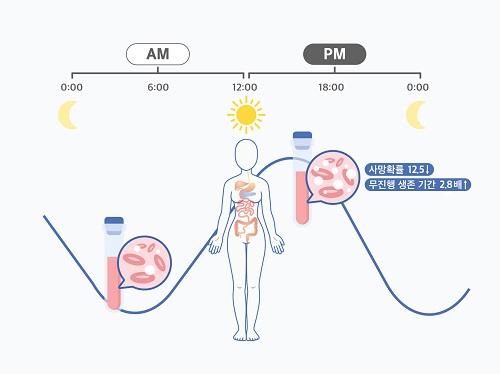 여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
2022.12.15 조회수 7350
여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
2022.12.15 조회수 7350 -
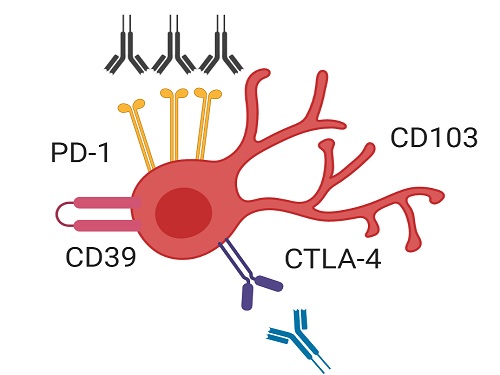 유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14 조회수 7967
유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14 조회수 7967 -
 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 10304
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 10304 -
 개인 맞춤형 암 치료에 한 발짝 다가서
우리 연구진이 급성골수성백혈병(Acute myeloid leukemia)과 골수이형성증후군(Myelodysplastic syndromes) 치료에 사용되는 항암 화학 치료제 중 하나인 데시타빈(decitabine)의 인체 내 작용 메커니즘을 규명해 항암제 효과가 있는 환자와 없는 환자를 구별해 낼 수 있는 유전자 발굴에 성공했다.
이번 연구를 통해 환자별로 적합한 치료를 받을 수 있게 되면 환자들이 치료에 드는 경제적 지출과 시간적 소비 또한 확연하게 줄일 수 있을 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 서울대병원 혈액암센터 홍준식 교수 공동 연구팀이 항암 화학치료에서 작용하는 주요 인자를 찾아냈다고 7일 밝혔다.
생명화학공학과 박사과정에 재학 중인 구용석 학생, 서울대병원 박주환 연구원 그리고 우리 대학 조령은 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 3월 30일 字에 게재됐다. (논문명: Noncanonical immune response to the inhibition of DNA methylation via stabilization of endogenous retrovirus dsRNAs)
데시타빈과 같은 DNA 탈메틸화제(DNA demethylating agent)는 DNA 복제과정에 참여하고 DNA상에 존재하는 메틸기(-CH₃)를 제거해 유전자 발현을 조절한다. 특히 암세포에는 일반 세포보다 많은 양의 DNA가 메틸화돼 있으며, 이는 DNA에서 RNA를 생성하는 전사 과정을 억제하는 역할을 한다. 세포에 탈메틸화제 처리를 하면 DNA상에 메틸기가 제거돼 세포 내에 수많은 종류의 RNA들이 생성된다.
이렇게 데시타빈에 의해 조절되는 RNA 중에는 이중나선 RNA (double-stranded RNA, 이하 dsRNA)가 있다. 원래 dsRNA는 바이러스에 감염된 세포에서 많이 생산되며, 인간 세포는 바이러스에서 유래된 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다.
특이하게도 dsRNA를 인지하는 인간의 선천성 면역반응 시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 형태와 같은 구조적 특징을 이용해 dsRNA와 반응한다. 이와 같은 특징 때문에 꼭 바이러스에서 유래된 dsRNA가 아니라 체내에서 생성된 dsRNA 또한 외부 물질로 오인돼 비정상적인 면역반응을 일으킬 수 있다. 암 치료에서는 DNA 탈메틸화제 처리로 dsRNA의 발현량을 증가시키고 이는 dsRNA에 의한 면역 활성으로 이어져 암세포만의 세포사멸이 일어나게 된다.
연구팀은 이러한 데시타빈에 의한 dsRNA 발현증가 그리고 dsRNA에 의한 세포사멸을 조절하는 유전자를 연구했다. 특히, DNA 탈메틸화제를 투여받은 환자 중 많은 수의 환자가 약물의 효과를 보지 못한다는 점에 착안해 dsRNA와 상호작용하는 다양한 dsRNA 결합 단백질을 분석했다.
그 결과로 dsRNA와 직접 결합해 dsRNA의 안정성을 조절하는 단백질인 `스타우펜1(이하 Staufen1)'이 데시타빈에 의한 세포 반응에 중요한 기능을 한다는 것을 최초로 규명했다. Staufen1의 발현이 억제된 세포에서는 dsRNA가 빠르게 제거돼 하위 면역반응이 일어나지 않았으며 암세포의 사멸도 관찰되지 않았다.
연구팀은 데시타빈 뿐만 아니라 아자시티딘(azacitidine)과 같은 DNA 탈메틸화제를 투여받은 급성골수성백혈병과 골수이형성증후군 환자 46명의 골수추출액에서 Staufen1 유전자의 발현양상을 분석했고, 그 결과 약물의 효과를 보지 못한 환자에게서는 Staufen1의 발현이 유의미하게 감소해 있다는 것을 확인했다. 또한, Staufen1의 발현이 낮은 환자는 생존율(overall survival)과 무진행 생존율(progression-free survival)이 모두 낮아 환자의 예후가 좋지 않다는 것을 확인했다.
생명화학공학과 김유식 교수는 "이번 연구에서는 단순 데시타빈 항암제의 작용기전 규명을 넘어서 실제 데시타빈을 투여받은 환자의 검체에서도 그 효과를 검증했다ˮ면서 "추후 이번에 찾은 유전자의 바이오마커화를 통해 데시타빈과 아자시티딘과 같은 DNA 탈메틸화제의 효과를 예측할 수 있어 효과적인 맞춤형 암 치료전략을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원을 받아 수행됐다.
2021.04.07 조회수 78831
개인 맞춤형 암 치료에 한 발짝 다가서
우리 연구진이 급성골수성백혈병(Acute myeloid leukemia)과 골수이형성증후군(Myelodysplastic syndromes) 치료에 사용되는 항암 화학 치료제 중 하나인 데시타빈(decitabine)의 인체 내 작용 메커니즘을 규명해 항암제 효과가 있는 환자와 없는 환자를 구별해 낼 수 있는 유전자 발굴에 성공했다.
이번 연구를 통해 환자별로 적합한 치료를 받을 수 있게 되면 환자들이 치료에 드는 경제적 지출과 시간적 소비 또한 확연하게 줄일 수 있을 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 서울대병원 혈액암센터 홍준식 교수 공동 연구팀이 항암 화학치료에서 작용하는 주요 인자를 찾아냈다고 7일 밝혔다.
생명화학공학과 박사과정에 재학 중인 구용석 학생, 서울대병원 박주환 연구원 그리고 우리 대학 조령은 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 3월 30일 字에 게재됐다. (논문명: Noncanonical immune response to the inhibition of DNA methylation via stabilization of endogenous retrovirus dsRNAs)
데시타빈과 같은 DNA 탈메틸화제(DNA demethylating agent)는 DNA 복제과정에 참여하고 DNA상에 존재하는 메틸기(-CH₃)를 제거해 유전자 발현을 조절한다. 특히 암세포에는 일반 세포보다 많은 양의 DNA가 메틸화돼 있으며, 이는 DNA에서 RNA를 생성하는 전사 과정을 억제하는 역할을 한다. 세포에 탈메틸화제 처리를 하면 DNA상에 메틸기가 제거돼 세포 내에 수많은 종류의 RNA들이 생성된다.
이렇게 데시타빈에 의해 조절되는 RNA 중에는 이중나선 RNA (double-stranded RNA, 이하 dsRNA)가 있다. 원래 dsRNA는 바이러스에 감염된 세포에서 많이 생산되며, 인간 세포는 바이러스에서 유래된 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다.
특이하게도 dsRNA를 인지하는 인간의 선천성 면역반응 시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 형태와 같은 구조적 특징을 이용해 dsRNA와 반응한다. 이와 같은 특징 때문에 꼭 바이러스에서 유래된 dsRNA가 아니라 체내에서 생성된 dsRNA 또한 외부 물질로 오인돼 비정상적인 면역반응을 일으킬 수 있다. 암 치료에서는 DNA 탈메틸화제 처리로 dsRNA의 발현량을 증가시키고 이는 dsRNA에 의한 면역 활성으로 이어져 암세포만의 세포사멸이 일어나게 된다.
연구팀은 이러한 데시타빈에 의한 dsRNA 발현증가 그리고 dsRNA에 의한 세포사멸을 조절하는 유전자를 연구했다. 특히, DNA 탈메틸화제를 투여받은 환자 중 많은 수의 환자가 약물의 효과를 보지 못한다는 점에 착안해 dsRNA와 상호작용하는 다양한 dsRNA 결합 단백질을 분석했다.
그 결과로 dsRNA와 직접 결합해 dsRNA의 안정성을 조절하는 단백질인 `스타우펜1(이하 Staufen1)'이 데시타빈에 의한 세포 반응에 중요한 기능을 한다는 것을 최초로 규명했다. Staufen1의 발현이 억제된 세포에서는 dsRNA가 빠르게 제거돼 하위 면역반응이 일어나지 않았으며 암세포의 사멸도 관찰되지 않았다.
연구팀은 데시타빈 뿐만 아니라 아자시티딘(azacitidine)과 같은 DNA 탈메틸화제를 투여받은 급성골수성백혈병과 골수이형성증후군 환자 46명의 골수추출액에서 Staufen1 유전자의 발현양상을 분석했고, 그 결과 약물의 효과를 보지 못한 환자에게서는 Staufen1의 발현이 유의미하게 감소해 있다는 것을 확인했다. 또한, Staufen1의 발현이 낮은 환자는 생존율(overall survival)과 무진행 생존율(progression-free survival)이 모두 낮아 환자의 예후가 좋지 않다는 것을 확인했다.
생명화학공학과 김유식 교수는 "이번 연구에서는 단순 데시타빈 항암제의 작용기전 규명을 넘어서 실제 데시타빈을 투여받은 환자의 검체에서도 그 효과를 검증했다ˮ면서 "추후 이번에 찾은 유전자의 바이오마커화를 통해 데시타빈과 아자시티딘과 같은 DNA 탈메틸화제의 효과를 예측할 수 있어 효과적인 맞춤형 암 치료전략을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원을 받아 수행됐다.
2021.04.07 조회수 78831 -
 암 환자들이 겪는 섭식장애 원인 찾아
국내 연구진이 암 환자들이 겪는 섭식장애 원인을 규명했다. 암 환자의 섭식장애 개선을 통한 항암치료 부작용을 개선할 수 있을 것으로 기대된다.
우리 대학 의과학대학원 서재명 교수 연구팀이 한국생명공학연구원 유권 질환표적구조연구센터장과 이규선 바이오나노연구센터장 연구팀, 김송철 서울아산병원 교수 연구팀과 공동연구를 통해 암세포에서 특이적으로 분비되는 특정 단백질이 뇌신경세포의 특정 수용체를 통해 식욕조절 호르몬을 조절하는 원리를 발견했다고 18일 밝혔다. 연구결과는 국제학술지 ‘네이처 세포생물학’ 2월 9일자 온라인판에 게재됐다.
암 환자의 대표적인 합병증인 ‘암 악액질 증후군’은 심각한 섭식장애와 지속적인 체중 감소 현상을 동반한다. 암환자 생존율과 항암치료에도 좋지 않은 영향을 주는 것으로 알려져 있지만 암 환자 섭식장애 원인은 아직 규명되지 않았다.
연구팀은 초파리 암 모델과 RNA 전사체 분석으로 암 세포에서 유래된 특정 단백질(Dilp8 펩타이드)의 발현과 분비가 현저하게 증가된다는 사실을 확인했다. 특정 단백질은 뇌신경세포 수용체를 통해 식욕 조절에 관여하는 신경펩타이드 호르몬 발현을 변화시켜 초파리 모델에서 섭식장애를 유도한다는 사실을 알아냈다.
이같은 연구결과를 바탕으로 우리 대학 의과학대학원 서재명 교수 연구팀은 암을 유발한 쥐 모델에서도 특정 단백질과 상동인자인 ‘INSL3’가 현저하게 증가돼 섭식장애를 유발한다는 사실을 확인했다. 특히 암 세포에서 분비되는 단백질 INSL3을 쥐 뇌에 직접 주입할 경우 먹이 섭취량과 체중이 감소했다.
김송철 서울아산병원 연구팀은 암 악액질 증후군 발생 빈도가 가장 높은 췌장암 환자를 대상으로 임상 연관성 연구를 진행했다. 그 결과 섭식장애가 나타는 췌장암 환자에서 INSL3의 농도가 높게 나타났다.
암 세포에서 분비되는 단백질(INSL3)이 뇌신경계의 식욕 조절에 관여하는 신경세포에 작용해 암 환자의 식욕을 감소시킨 것이다. INSL3 단백질이 암 환자 섭식장애를 유발하는 중요한 신호인자라는 사실을 규명했다.
유권 생명연 책임연구원은 “초파리 실험모델에서 발견한 기초·원천 연구결과를 쥐에서 확인했고 암 환자 임상 연구에서 재확인한 연구 사례”라며 “규명된 단백질 진단과 조절로 암 환자의 섭식장애를 해결하는 치료 전략이 개발되면 암 환자의 항암치료 보조제 뿐만 아니라 일반인 대상 대사질환 치료제 개발에도 활용될 수 있을 것”이라고 밝혔다.
2021.03.02 조회수 91656
암 환자들이 겪는 섭식장애 원인 찾아
국내 연구진이 암 환자들이 겪는 섭식장애 원인을 규명했다. 암 환자의 섭식장애 개선을 통한 항암치료 부작용을 개선할 수 있을 것으로 기대된다.
우리 대학 의과학대학원 서재명 교수 연구팀이 한국생명공학연구원 유권 질환표적구조연구센터장과 이규선 바이오나노연구센터장 연구팀, 김송철 서울아산병원 교수 연구팀과 공동연구를 통해 암세포에서 특이적으로 분비되는 특정 단백질이 뇌신경세포의 특정 수용체를 통해 식욕조절 호르몬을 조절하는 원리를 발견했다고 18일 밝혔다. 연구결과는 국제학술지 ‘네이처 세포생물학’ 2월 9일자 온라인판에 게재됐다.
암 환자의 대표적인 합병증인 ‘암 악액질 증후군’은 심각한 섭식장애와 지속적인 체중 감소 현상을 동반한다. 암환자 생존율과 항암치료에도 좋지 않은 영향을 주는 것으로 알려져 있지만 암 환자 섭식장애 원인은 아직 규명되지 않았다.
연구팀은 초파리 암 모델과 RNA 전사체 분석으로 암 세포에서 유래된 특정 단백질(Dilp8 펩타이드)의 발현과 분비가 현저하게 증가된다는 사실을 확인했다. 특정 단백질은 뇌신경세포 수용체를 통해 식욕 조절에 관여하는 신경펩타이드 호르몬 발현을 변화시켜 초파리 모델에서 섭식장애를 유도한다는 사실을 알아냈다.
이같은 연구결과를 바탕으로 우리 대학 의과학대학원 서재명 교수 연구팀은 암을 유발한 쥐 모델에서도 특정 단백질과 상동인자인 ‘INSL3’가 현저하게 증가돼 섭식장애를 유발한다는 사실을 확인했다. 특히 암 세포에서 분비되는 단백질 INSL3을 쥐 뇌에 직접 주입할 경우 먹이 섭취량과 체중이 감소했다.
김송철 서울아산병원 연구팀은 암 악액질 증후군 발생 빈도가 가장 높은 췌장암 환자를 대상으로 임상 연관성 연구를 진행했다. 그 결과 섭식장애가 나타는 췌장암 환자에서 INSL3의 농도가 높게 나타났다.
암 세포에서 분비되는 단백질(INSL3)이 뇌신경계의 식욕 조절에 관여하는 신경세포에 작용해 암 환자의 식욕을 감소시킨 것이다. INSL3 단백질이 암 환자 섭식장애를 유발하는 중요한 신호인자라는 사실을 규명했다.
유권 생명연 책임연구원은 “초파리 실험모델에서 발견한 기초·원천 연구결과를 쥐에서 확인했고 암 환자 임상 연구에서 재확인한 연구 사례”라며 “규명된 단백질 진단과 조절로 암 환자의 섭식장애를 해결하는 치료 전략이 개발되면 암 환자의 항암치료 보조제 뿐만 아니라 일반인 대상 대사질환 치료제 개발에도 활용될 수 있을 것”이라고 밝혔다.
2021.03.02 조회수 91656 -
 항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 31643
항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 31643 -
 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 23243
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 23243 -
 조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 19149
조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 19149