-
 세계 최초 플라빈 빛 파장 설계 성공, 의료·환경 혁신
플라빈은 우리 몸 등 생명체 내의 에너지 생산과 생화학 반응에 관여하는 중요한 조효소이자 특정 색의 빛을 방출하는 형광 분자다. 하지만 자연계의 플라빈은 대부분 파란색에서 초록색 영역까지 짧은 파장의 빛을 낼 수 있어, 그보다 긴 파장인 적외선 영역까지는 확장되기 어렵다. KAIST 연구진이 기존 한계를 극복하고 플라빈이 내뿜는 형광 파장을 근적외선까지 확장하여 의료·환경·에너지 분야의 새로운 가능성을 제시했다.
우리 대학 화학과 백윤정 교수 연구팀은 근적외선 파장에서 발광이 가능한 5개의 고리 구조를 가진 새로운 오환형 플라빈 분자를 세계 최초로 개발하는 데 성공했다.
백윤정 교수 연구팀은 전통적으로 세 개의 고리를 갖는 플라빈 구조에서 플라빈의 핵심 구조를 5개의 고리로 확장하고, 여기에 산소 및 황 등 이종 원자를 정교하게 도입함으로써 분자의 전자 구조를 정밀하게 조절하는 새로운 합성 전략을 제시했다.
특히 이번에 개발된 분자는 적외선에 가까운 짙은 붉은색 및 근적외선 영역의 빛을 낼 수 있어, 기존 플라빈 색소가 낼 수 있었던 색의 범위를 획기적으로 확장했다는 평가를 받고 있다.
그 결과, 황이 포함된 구조체는 772 nm에 달하는 근적외선 영역에서 발광하며, 이는 지금까지 보고된 플라빈 유도체 중 가장 긴 파장이다. 또한 이 분자는 기존의 플라빈에서 드물게 관찰되던 준가역적인 산화 특성을 나타내어 전기화학적 기능성까지 동시에 갖춘 다기능성 분자 플랫폼으로 주목받고 있다.
연구팀은 분자의 구조를 미세하게 조절함으로써, 빛을 어떻게 흡수하고 방출할지를 원하는 대로 설계할 수 있게 되었고, 전기 신호를 전달하거나 변환하는 능력 또한 함께 제어할 수 있음을 입증했다.
이번 연구는 기존 플라빈의 한계를 뛰어넘어 빛의 파장을 바꿈으로서 활용 기술과 응용 범위를 넓힐 수 있다는 것을 보여줬다. 예를 들어, 근적외선(NIR) 같은 긴 파장의 빛을 통해 몸 속 더 깊이 정확하게 진단·치료하게 하며, 오염이나 독성물질이 특정 빛에 반응하도록 설계도 가능하며, 긴 파장의 빛을 흡수해서 친환경 에너지로 만들게 하는 등 발광 파장과 전자 특성을 정밀하게 제어하는 새로운 플랫폼을 제시하였다.
백윤정 교수는 “플라빈의 빛 파장을 바꿀 수 있다는 것은 우리가 원하는 상황에 맞게 빛을 자유롭게 설계하고 활용할 수 있다는 뜻으로, 앞으로 우리 손으로 원하는 색과 성질을 가진 분자를 정밀하게 디자인하고 만들수 있다는 가능성을 보여준 것”이라며, “이는 의료, 환경, 에너지 등 빛 기반 기술이 적용되는 수많은 분야에서 게임 체인저가 될 수 있는 기반 기술이 될 것”이라고 말했다.
해당 성과는 세계적인 국제 학술지 Nature사가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 4월 15일자로 게재되었다.
※ 논문명 : Expanding the Chemical Space of Flavins with Pentacyclic architecture
※ 저자 정보 : 서다영 (KAIST, 제1 저자), 권성연 (기초과학연구원, 공동 제2 저자), 윤가혜 (KAIST, 공동 제2 저자), 손태일 (KAIST, 공동 제2 저자), 원창현 (KAIST, 제3 저자), Neetu Singh (KAIST, 제4 저자), 김동욱 (기초과학연구원, 제5 저자) 및 백윤정 (KAIST, 교신저자) 포함 총 8 명 DOI: 10.1038/s41467-025-58957-2
한편, 이번 연구는 과기정통부가 지원하는 개인기초연구사업의‘우수신진연구’와 산업통상자원부가 지원하는‘소재부품개발사업’과제의 지원을 받아 수행됐다.
세계 최초 플라빈 빛 파장 설계 성공, 의료·환경 혁신
플라빈은 우리 몸 등 생명체 내의 에너지 생산과 생화학 반응에 관여하는 중요한 조효소이자 특정 색의 빛을 방출하는 형광 분자다. 하지만 자연계의 플라빈은 대부분 파란색에서 초록색 영역까지 짧은 파장의 빛을 낼 수 있어, 그보다 긴 파장인 적외선 영역까지는 확장되기 어렵다. KAIST 연구진이 기존 한계를 극복하고 플라빈이 내뿜는 형광 파장을 근적외선까지 확장하여 의료·환경·에너지 분야의 새로운 가능성을 제시했다.
우리 대학 화학과 백윤정 교수 연구팀은 근적외선 파장에서 발광이 가능한 5개의 고리 구조를 가진 새로운 오환형 플라빈 분자를 세계 최초로 개발하는 데 성공했다.
백윤정 교수 연구팀은 전통적으로 세 개의 고리를 갖는 플라빈 구조에서 플라빈의 핵심 구조를 5개의 고리로 확장하고, 여기에 산소 및 황 등 이종 원자를 정교하게 도입함으로써 분자의 전자 구조를 정밀하게 조절하는 새로운 합성 전략을 제시했다.
특히 이번에 개발된 분자는 적외선에 가까운 짙은 붉은색 및 근적외선 영역의 빛을 낼 수 있어, 기존 플라빈 색소가 낼 수 있었던 색의 범위를 획기적으로 확장했다는 평가를 받고 있다.
그 결과, 황이 포함된 구조체는 772 nm에 달하는 근적외선 영역에서 발광하며, 이는 지금까지 보고된 플라빈 유도체 중 가장 긴 파장이다. 또한 이 분자는 기존의 플라빈에서 드물게 관찰되던 준가역적인 산화 특성을 나타내어 전기화학적 기능성까지 동시에 갖춘 다기능성 분자 플랫폼으로 주목받고 있다.
연구팀은 분자의 구조를 미세하게 조절함으로써, 빛을 어떻게 흡수하고 방출할지를 원하는 대로 설계할 수 있게 되었고, 전기 신호를 전달하거나 변환하는 능력 또한 함께 제어할 수 있음을 입증했다.
이번 연구는 기존 플라빈의 한계를 뛰어넘어 빛의 파장을 바꿈으로서 활용 기술과 응용 범위를 넓힐 수 있다는 것을 보여줬다. 예를 들어, 근적외선(NIR) 같은 긴 파장의 빛을 통해 몸 속 더 깊이 정확하게 진단·치료하게 하며, 오염이나 독성물질이 특정 빛에 반응하도록 설계도 가능하며, 긴 파장의 빛을 흡수해서 친환경 에너지로 만들게 하는 등 발광 파장과 전자 특성을 정밀하게 제어하는 새로운 플랫폼을 제시하였다.
백윤정 교수는 “플라빈의 빛 파장을 바꿀 수 있다는 것은 우리가 원하는 상황에 맞게 빛을 자유롭게 설계하고 활용할 수 있다는 뜻으로, 앞으로 우리 손으로 원하는 색과 성질을 가진 분자를 정밀하게 디자인하고 만들수 있다는 가능성을 보여준 것”이라며, “이는 의료, 환경, 에너지 등 빛 기반 기술이 적용되는 수많은 분야에서 게임 체인저가 될 수 있는 기반 기술이 될 것”이라고 말했다.
해당 성과는 세계적인 국제 학술지 Nature사가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 4월 15일자로 게재되었다.
※ 논문명 : Expanding the Chemical Space of Flavins with Pentacyclic architecture
※ 저자 정보 : 서다영 (KAIST, 제1 저자), 권성연 (기초과학연구원, 공동 제2 저자), 윤가혜 (KAIST, 공동 제2 저자), 손태일 (KAIST, 공동 제2 저자), 원창현 (KAIST, 제3 저자), Neetu Singh (KAIST, 제4 저자), 김동욱 (기초과학연구원, 제5 저자) 및 백윤정 (KAIST, 교신저자) 포함 총 8 명 DOI: 10.1038/s41467-025-58957-2
한편, 이번 연구는 과기정통부가 지원하는 개인기초연구사업의‘우수신진연구’와 산업통상자원부가 지원하는‘소재부품개발사업’과제의 지원을 받아 수행됐다.
2025.04.23
조회수 1578
-
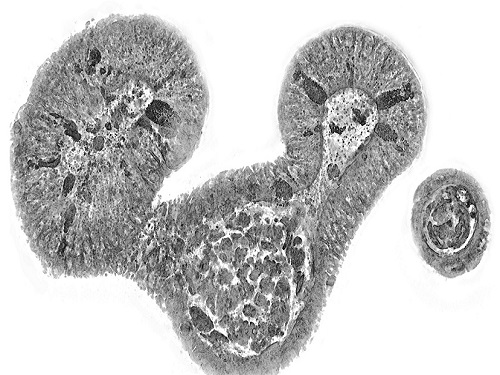 홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
2024.07.30
조회수 7580
-
 사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23
조회수 5334
-
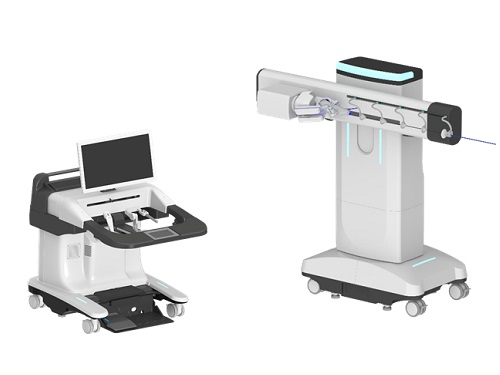 교원창업기업 (주)로엔서지컬, 신장결석 수술로봇 보건복지부 혁신의료기술 지정으로 시장 진입 가시화
우리 대학 교원창업 스타트업인 ㈜로엔서지컬(대표이사 기계공학과 권동수 교수)에서 국내최초로 개발한 신장결석 수술로봇을 사용하는 연성신요관 경하 결석제거술이 보건복지부의 혁신의료기술로 지정받았다고 밝혔다.
해당 기술은 요로결석으로 인해 연성신요관경하 결석제거술이 필요한 환자를 대상으로 요로를 통해 삽입한 수술기구를 로봇 팔에 부착하여 요로결석을 제거하는 기술로 안전성 및 잠재성이 있는 혁신의료기술로 인정받은 만큼 안전하고 효과가 검증된 치료법을 뜻한다고 로엔서지컬 측은 설명했다.
지난 20일 보건복지부 고시 제2023-175호 ‘신의료기술의 안전성, 유효성 평가결과 고시’에 따르면 요로결석 제거를 위해 로봇 보조 연성신요관경하 결석제거술 기술을 이용하여 결석제거술이 필요한 환자를 대상으로 병원에서 치료가 가능해짐에 따라, 신장결석 수술로봇의 조기 시장진입이 가능하게 되었다.
이에 따라, ㈜로엔서지컬은 혁신의료기술 실시 준비를 위한 임상시험과 국내 병원 판매 계약 등을 준비중에 있다고 밝혔다. 2024년 4월 부터는 최대 3년간 의료현장에서 비급여로 사용될 수 있다.
㈜로엔서지컬은 지난 2018년 2월에 KAIST 교원 및 학생창업을 통해 유연내시경 수술로봇을 개발하고 있는 회사로 환부를 개복하지 않고 인체의 자연개구부를 통해 신장내 결석을 제거하는 신장결석 수술로봇등의 유연내시경 수술로봇을 개발하는 회사로 2021.12월 식약처 제17호 혁신의료기기 지정, 2022.10월 식약처 제조허가 획득에 이어 올해 9월에 보건복지부 혁신의료기술로 인정받게 되어, 수술로봇 개발의 독보적인 기술 우수성을 다시 입증함에 따라, 시장진입에 의미있는 계기가 마련되었다고 밝혔다.
교원창업기업 (주)로엔서지컬, 신장결석 수술로봇 보건복지부 혁신의료기술 지정으로 시장 진입 가시화
우리 대학 교원창업 스타트업인 ㈜로엔서지컬(대표이사 기계공학과 권동수 교수)에서 국내최초로 개발한 신장결석 수술로봇을 사용하는 연성신요관 경하 결석제거술이 보건복지부의 혁신의료기술로 지정받았다고 밝혔다.
해당 기술은 요로결석으로 인해 연성신요관경하 결석제거술이 필요한 환자를 대상으로 요로를 통해 삽입한 수술기구를 로봇 팔에 부착하여 요로결석을 제거하는 기술로 안전성 및 잠재성이 있는 혁신의료기술로 인정받은 만큼 안전하고 효과가 검증된 치료법을 뜻한다고 로엔서지컬 측은 설명했다.
지난 20일 보건복지부 고시 제2023-175호 ‘신의료기술의 안전성, 유효성 평가결과 고시’에 따르면 요로결석 제거를 위해 로봇 보조 연성신요관경하 결석제거술 기술을 이용하여 결석제거술이 필요한 환자를 대상으로 병원에서 치료가 가능해짐에 따라, 신장결석 수술로봇의 조기 시장진입이 가능하게 되었다.
이에 따라, ㈜로엔서지컬은 혁신의료기술 실시 준비를 위한 임상시험과 국내 병원 판매 계약 등을 준비중에 있다고 밝혔다. 2024년 4월 부터는 최대 3년간 의료현장에서 비급여로 사용될 수 있다.
㈜로엔서지컬은 지난 2018년 2월에 KAIST 교원 및 학생창업을 통해 유연내시경 수술로봇을 개발하고 있는 회사로 환부를 개복하지 않고 인체의 자연개구부를 통해 신장내 결석을 제거하는 신장결석 수술로봇등의 유연내시경 수술로봇을 개발하는 회사로 2021.12월 식약처 제17호 혁신의료기기 지정, 2022.10월 식약처 제조허가 획득에 이어 올해 9월에 보건복지부 혁신의료기술로 인정받게 되어, 수술로봇 개발의 독보적인 기술 우수성을 다시 입증함에 따라, 시장진입에 의미있는 계기가 마련되었다고 밝혔다.
2023.09.22
조회수 4792
-
 염증없이 체내·외 측정 가능한 전자 신소재 개발
생체전자 의료기기는 체내에서 발생하는 신호를 읽어 생물학적 활동을 감지하거나, 조직을 자극해 질병 등을 치료하는 데 사용된다. 하지만 의료기기에 사용되는 전극 물질은 딱딱한 물성을 가지고 있어 체내에 염증반응을 일으키고 조직에 다량의 손상으로 이어질 수 있다. 따라서 조직과 같이 부드러운 성질을 가지면서도 전도성을 띠는 하이드로겔과 같은 연성 물질에 생체적합성이 높은 전도성 고분자를 체내 전극으로 사용하는 연구들이 활발하게 진행되고 있다.
우리 대학 신소재공학과 강지형 교수와 바이오및뇌공학과 박성준 교수 공동연구팀이 기존에 없었던 고전도성, 유사 조직 접착성 하이드로겔이란 신소재를 개발해 고성능 생체전자 기기를 구현했다고 4일 밝혔다.
대부분 전기 전도도가 높을수록 전도성 도메인들의 결정성이 높아지는 원리에 의해, 전도성이 높은 하이드로겔은 딱딱해지고, 부드러운 하이드로겔은 전도성이 낮을 수밖에 없다는 한계를 가진다. 이에 따라 전도성 고분자를 사용하는 하이드로겔 중, 전기 전도도가 높으면서도(10 S/cm 이상) 부드러운 물성(100 kPa 이하)을 가진 하이드로겔은 지금까지 보고된 바 없었다.
강지형 교수 연구팀은 기존에 없었던 고전도성, 유사 조직 물성 하이드로겔을 개발했다. 이 하이드로겔은 보고된 전도성 고분자 하이드로겔 중 가장 높은 전기 전도도(247 S/cm)를 띄며, 조직과 비슷한 물성(탄성율 = 60 kPa, 파괴변형률 = 410%)을 갖는다. 또한, 본 재료는 지속적인 움직임과 팽창, 수축이 있는 심장, 위와 같은 조직에서 안정적으로 기기가 작동하기 위해 필수조건인 조직에 쉽게 접착되는 장점을 가지고 있다.
공동연구팀은 원하는 생체 조직에 맞게 조정하고 그 형태에 맞추는 주형의 그물 구조에 따라 높은 질서도를 가지는 고분자 주형 네트워크를 도입했다.
따라서 주형에 맞추어 형성된 그물 네트워크는 기존 네트워크 대비 100배 이상 높은 전기 전도도를 보이며, 동시에 주형 고분자의 부드러운 특성 때문에 조직과 비슷한 물성을 지니게 된다. 변형에도 저항이 바뀌지 않아 생체전극으로서 최적의 성능을 갖는다.
또한 연구팀은 개발한 하이드로겔을 전극을 기반으로 한 높은 전기 전도도를 가진 다양한 고성능 생체전자 기기를 제작, 그 기능성을 검증했다. 높은 전기 전도도를 가진 특성으로 좌골신경 자극을 대상으로 하는 디바이스의 경우, 매우 낮은 전압(40 mV)에서 다리 근육의 움직임을 성공적으로 유도할 수 있었다. 또한 심전도 측정(ECG)을 위한 디바이스의 경우에도 매우 높은 신호 대 잡음 비(61 dB)로 신호를 측정하는 데 성공함으로써, 초고품질 생체 신호 측정을 위한 연성 기기 개발 가능성을 입증하였다.
이번 연구를 주도한 강지형 교수는 "이번 연구는 고전도성을 갖고 생체조직과 유사한 기계적 물성을 갖는 하이드로겔 개발을 위한 합성 방향을 새롭게 제시했다는 점에서 의미가 있다고 하면서, "이번에 개발된 전도성 하이드로겔은 급속도로 성장하고 있는 전자약 시장에 게임 체인저가 될 것으로 기대된다고 말했다.
우리 대학 신소재공학과 정주은 박사과정과 바이오및뇌공학과 성창훈 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션스 (Nature Communications)’에 4월 18일 게재됐다. (논문명: Highly conductive tissue-like hydrogel interface through template-directed assembly)
한편 이번 연구는 한국연구재단의 나노소재기술개발 미래기술연구실 사업을 받아 수행됐다.
염증없이 체내·외 측정 가능한 전자 신소재 개발
생체전자 의료기기는 체내에서 발생하는 신호를 읽어 생물학적 활동을 감지하거나, 조직을 자극해 질병 등을 치료하는 데 사용된다. 하지만 의료기기에 사용되는 전극 물질은 딱딱한 물성을 가지고 있어 체내에 염증반응을 일으키고 조직에 다량의 손상으로 이어질 수 있다. 따라서 조직과 같이 부드러운 성질을 가지면서도 전도성을 띠는 하이드로겔과 같은 연성 물질에 생체적합성이 높은 전도성 고분자를 체내 전극으로 사용하는 연구들이 활발하게 진행되고 있다.
우리 대학 신소재공학과 강지형 교수와 바이오및뇌공학과 박성준 교수 공동연구팀이 기존에 없었던 고전도성, 유사 조직 접착성 하이드로겔이란 신소재를 개발해 고성능 생체전자 기기를 구현했다고 4일 밝혔다.
대부분 전기 전도도가 높을수록 전도성 도메인들의 결정성이 높아지는 원리에 의해, 전도성이 높은 하이드로겔은 딱딱해지고, 부드러운 하이드로겔은 전도성이 낮을 수밖에 없다는 한계를 가진다. 이에 따라 전도성 고분자를 사용하는 하이드로겔 중, 전기 전도도가 높으면서도(10 S/cm 이상) 부드러운 물성(100 kPa 이하)을 가진 하이드로겔은 지금까지 보고된 바 없었다.
강지형 교수 연구팀은 기존에 없었던 고전도성, 유사 조직 물성 하이드로겔을 개발했다. 이 하이드로겔은 보고된 전도성 고분자 하이드로겔 중 가장 높은 전기 전도도(247 S/cm)를 띄며, 조직과 비슷한 물성(탄성율 = 60 kPa, 파괴변형률 = 410%)을 갖는다. 또한, 본 재료는 지속적인 움직임과 팽창, 수축이 있는 심장, 위와 같은 조직에서 안정적으로 기기가 작동하기 위해 필수조건인 조직에 쉽게 접착되는 장점을 가지고 있다.
공동연구팀은 원하는 생체 조직에 맞게 조정하고 그 형태에 맞추는 주형의 그물 구조에 따라 높은 질서도를 가지는 고분자 주형 네트워크를 도입했다.
따라서 주형에 맞추어 형성된 그물 네트워크는 기존 네트워크 대비 100배 이상 높은 전기 전도도를 보이며, 동시에 주형 고분자의 부드러운 특성 때문에 조직과 비슷한 물성을 지니게 된다. 변형에도 저항이 바뀌지 않아 생체전극으로서 최적의 성능을 갖는다.
또한 연구팀은 개발한 하이드로겔을 전극을 기반으로 한 높은 전기 전도도를 가진 다양한 고성능 생체전자 기기를 제작, 그 기능성을 검증했다. 높은 전기 전도도를 가진 특성으로 좌골신경 자극을 대상으로 하는 디바이스의 경우, 매우 낮은 전압(40 mV)에서 다리 근육의 움직임을 성공적으로 유도할 수 있었다. 또한 심전도 측정(ECG)을 위한 디바이스의 경우에도 매우 높은 신호 대 잡음 비(61 dB)로 신호를 측정하는 데 성공함으로써, 초고품질 생체 신호 측정을 위한 연성 기기 개발 가능성을 입증하였다.
이번 연구를 주도한 강지형 교수는 "이번 연구는 고전도성을 갖고 생체조직과 유사한 기계적 물성을 갖는 하이드로겔 개발을 위한 합성 방향을 새롭게 제시했다는 점에서 의미가 있다고 하면서, "이번에 개발된 전도성 하이드로겔은 급속도로 성장하고 있는 전자약 시장에 게임 체인저가 될 것으로 기대된다고 말했다.
우리 대학 신소재공학과 정주은 박사과정과 바이오및뇌공학과 성창훈 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션스 (Nature Communications)’에 4월 18일 게재됐다. (논문명: Highly conductive tissue-like hydrogel interface through template-directed assembly)
한편 이번 연구는 한국연구재단의 나노소재기술개발 미래기술연구실 사업을 받아 수행됐다.
2023.05.04
조회수 10061
-
 상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
2022.10.24
조회수 9538
-
 KPC4IR, 보건의료 분야 인공지능 활용 가이드 개발
우리 대학이 ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드(Using Artificial Intelligence to Support Healthcare Decisions: A Guide for Society)ʼ를 국제 공동연구를 통해 개발했다. 코로나 19의 세계적인 대유행은 인공지능 기술의 빠른 상용화를 촉진했다. 일례로, 영국의 인공지능 스타트업인 베네볼런트AI(BenevolentAI)는 신종 질병 치료약물을 식별하기 위해 통상적으로 8년이 걸리던 기간을 인공지능 기술을 활용해 단 1주일로 단축시켰다. 이처럼 인공지능 기술은 경제·산업·사회·문화 등 전방위로 확산되면서 엄청난 부가가치와 생활의 편익을 창출하고 있다. 하지만, 급속한 기술 도입이 데이터의 편향이나 오·남용 등의 맹점을 함께 가져왔다는 우려도 중요하게 대두되고 있다. 특히, 보건의료 분야는 인공지능을 뒷받침하는 데이터의 품질과 검증 여부가 생명과 직결되기 때문에 인공지능 기술의 타당성과 안전성이 무엇보다도 우선시 되어야 한다. KAIST 한국4차산업혁명정책센터(센터장 김소영, 이하 KPC4IR)는 보건의료 분야에 적용되고 있는 인공지능 기술의 신뢰성을 확보하기 위해 보다 많은 사람이 인공지능 기술의 책임성에 관한 질문을 던져야 한다는 문제의식을 바탕으로 이번 가이드를 제작했다. 연구진이 말하는 책임성이란 인공지능 기술이 데이터의 편향성으로 현존하는 불평등을 악화시키지 않도록 주의하고 데이터의 정확성을 확보해 결과의 오류를 최소화하는 등의 노력이다.
KPC4IR은 이번 가이드 개발을 위해 싱가포르국립대학교의 리스크공공이해연구소(National University of Singapore Lloyd’s Register Foundation Institute for the Public Understanding of Risk), 영국의 대표적인 과학 기술 비영리 기관인 센스 어바웃 사이언스(Sense about Science)와 함께 지난 1년 간 국제 공동연구를 수행했다.
연구진은 의료영상 분석 및 진단의 효과성 제고와 빅데이터를 활용한 질병 예측 및 임상적 의사결정, 신약 개발 분야 시간 단축 등 의료 분야에 인공지능 기술을 적용한 국내·외 사례를 이번 가이드에 담았다.
또한, 학습 데이터에 누락되거나 제외된 정보가 있다면 인공지능이 편향성을 나타낼 수 있으며, 원래와는 다른 용도로 사용할 경우 변수 간의 연관 관계나 심지어는 결과까지도 잘못 판단할 수 있다는 점도 강조했다. 독일에서는 피부의 병변을 감지해 암 발생 가능성을 진단하는 인공지능을 개발해 실제 의사들의 진단 소견과 비교하는 실험을 진행했다. 동일한 병변 이미지를 인공지능과 다양한 국적을 가진 피부과 전문의 58명에게 보여준 결과 인공지능은 87%의 정확도로 병변 의심 사례를 식별해냈다. 79%의 정확도를 보인 의사들의 정확도를 앞지른 것이다. 인공지능이 의사가 환자를 치료하며 결정을 내리는 과정에서 도움이 될 수 있다는 것을 보여준 사례다. 그러나 인공지능이 옅은 피부색을 가진 사람들로부터 수집한 데이터를 주로 활용해 학습한다면 짙은 피부색을 가진 환자들의 병변은 제대로 진단하지 못할 가능성이 커진다. 인공지능을 ʻ지능적ʼ이라고 하는 이유는 데이터를 단순히 검색하는 수준에 머무는 것이 아니라 데이터에 숨어 있는 특정 패턴을 분석해 유의미한 자료로 추출하기 때문이다. 그래서 사람들은 인공지능의 의사결정이 냉철하고 객관적일 것이라고 생각하지만, 인공지능은 현실에 존재하는 데이터들 바탕으로 학습한다. 우리가 가진 사회적 편견과 편향, 위험한 가정들을 그대로 내재한 결과가 도출될 수도 있다는 뜻이다.연구진은 인공지능 기술을 보건의료 분야에 활용하는 데 있어 가장 중요한 요소 중 하나인 신뢰성(reliability)을 중심으로 데이터의 품질·변수 등과 관련된 공정성 문제를 파악하고 기술의 정확성을 점검할 수 있는 다섯 가지 기준을 이번 가이드에 담았다. ▴출처가 정확한 데이터 사용 ▴사용 목적에 맞는 데이터의 수집 또는 선택 ▴제한 사항과 가정의 정확한 언급 ▴데이터의 편향성 명시 ▴실제 환경에서의 적절한 테스트 등이 이행되었는지 점검하기 위해 우리 사회가 이와 관련한 적극적인 질문을 던져야 한다고 강조했다.
연구를 총괄한 김소영 KPC4IR 센터장은 "보건의료 분야의 인공지능 기술이 충분히 견고한지를 검증하는 질문들이 우리 사회에서 활발하게 논의된다면, 궁극적으로 인공지능 기술의 역량을 끌어올리는 것과 동시에 신뢰할 수 있는 기준을 마련할 수 있을 것ˮ이라고 말했다.
이어, 김 센터장은 "인공지능 기술에 대한 국민의 이해도를 높여 한계점과 개선 사항을 인식해나가는 과정에서 이번 가이드가 중요한 역할을 해 줄 것으로 기대하고 있다ˮ라고 덧붙였다. KPC4IR의 이번 연구는 유럽과 아시아를 아우르는 국제 공동 연구자들이 보건의료라는 특정 분야에서 인공지능 기술의 가이드를 제시한 세계 최초의 사례다. 이를 위해 싱가포르국립대학교·테크놀로지기업 어피니디(Affinidi), 스페인 마드리드 카를로스 3세 대학교, 영국 로이드 선급 재단·가이 앤드 세인트 토마스 국가보건서비스 재단 등에 소속된 전문가들이 자문과 인터뷰, 워크숍 등의 방식으로 참여했다. 국내에서는 서울아산병원, 분당서울대병원 등을 비롯한 의료계와 KAIST AI대학원·바이오및뇌공학과, 과학기술정책연구원, 정보통신정책연구원, 인공지능 솔루션 기업 뷰노 등 다수의 산·학·연 관계자들이 함께했다. KPC4IR은 이번 성과를 국제적으로 공유하기 위해 8월 15일 오전 10시부터 온라인으로 열린 ʻ2021 KDD 국제 워크숍ʼ에서 연구 내용을 발표했다. ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드ʼ의 전체 내용은 KAIST 한국4차산업혁명정책센터 (https://kpc4ir.kaist.ac.kr/)와 싱가포르국립대 리스크공공이해연구소(https://ipur.nus.edu.sg/)의 홈페이지에서 확인할 수 있다.
KPC4IR, 보건의료 분야 인공지능 활용 가이드 개발
우리 대학이 ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드(Using Artificial Intelligence to Support Healthcare Decisions: A Guide for Society)ʼ를 국제 공동연구를 통해 개발했다. 코로나 19의 세계적인 대유행은 인공지능 기술의 빠른 상용화를 촉진했다. 일례로, 영국의 인공지능 스타트업인 베네볼런트AI(BenevolentAI)는 신종 질병 치료약물을 식별하기 위해 통상적으로 8년이 걸리던 기간을 인공지능 기술을 활용해 단 1주일로 단축시켰다. 이처럼 인공지능 기술은 경제·산업·사회·문화 등 전방위로 확산되면서 엄청난 부가가치와 생활의 편익을 창출하고 있다. 하지만, 급속한 기술 도입이 데이터의 편향이나 오·남용 등의 맹점을 함께 가져왔다는 우려도 중요하게 대두되고 있다. 특히, 보건의료 분야는 인공지능을 뒷받침하는 데이터의 품질과 검증 여부가 생명과 직결되기 때문에 인공지능 기술의 타당성과 안전성이 무엇보다도 우선시 되어야 한다. KAIST 한국4차산업혁명정책센터(센터장 김소영, 이하 KPC4IR)는 보건의료 분야에 적용되고 있는 인공지능 기술의 신뢰성을 확보하기 위해 보다 많은 사람이 인공지능 기술의 책임성에 관한 질문을 던져야 한다는 문제의식을 바탕으로 이번 가이드를 제작했다. 연구진이 말하는 책임성이란 인공지능 기술이 데이터의 편향성으로 현존하는 불평등을 악화시키지 않도록 주의하고 데이터의 정확성을 확보해 결과의 오류를 최소화하는 등의 노력이다.
KPC4IR은 이번 가이드 개발을 위해 싱가포르국립대학교의 리스크공공이해연구소(National University of Singapore Lloyd’s Register Foundation Institute for the Public Understanding of Risk), 영국의 대표적인 과학 기술 비영리 기관인 센스 어바웃 사이언스(Sense about Science)와 함께 지난 1년 간 국제 공동연구를 수행했다.
연구진은 의료영상 분석 및 진단의 효과성 제고와 빅데이터를 활용한 질병 예측 및 임상적 의사결정, 신약 개발 분야 시간 단축 등 의료 분야에 인공지능 기술을 적용한 국내·외 사례를 이번 가이드에 담았다.
또한, 학습 데이터에 누락되거나 제외된 정보가 있다면 인공지능이 편향성을 나타낼 수 있으며, 원래와는 다른 용도로 사용할 경우 변수 간의 연관 관계나 심지어는 결과까지도 잘못 판단할 수 있다는 점도 강조했다. 독일에서는 피부의 병변을 감지해 암 발생 가능성을 진단하는 인공지능을 개발해 실제 의사들의 진단 소견과 비교하는 실험을 진행했다. 동일한 병변 이미지를 인공지능과 다양한 국적을 가진 피부과 전문의 58명에게 보여준 결과 인공지능은 87%의 정확도로 병변 의심 사례를 식별해냈다. 79%의 정확도를 보인 의사들의 정확도를 앞지른 것이다. 인공지능이 의사가 환자를 치료하며 결정을 내리는 과정에서 도움이 될 수 있다는 것을 보여준 사례다. 그러나 인공지능이 옅은 피부색을 가진 사람들로부터 수집한 데이터를 주로 활용해 학습한다면 짙은 피부색을 가진 환자들의 병변은 제대로 진단하지 못할 가능성이 커진다. 인공지능을 ʻ지능적ʼ이라고 하는 이유는 데이터를 단순히 검색하는 수준에 머무는 것이 아니라 데이터에 숨어 있는 특정 패턴을 분석해 유의미한 자료로 추출하기 때문이다. 그래서 사람들은 인공지능의 의사결정이 냉철하고 객관적일 것이라고 생각하지만, 인공지능은 현실에 존재하는 데이터들 바탕으로 학습한다. 우리가 가진 사회적 편견과 편향, 위험한 가정들을 그대로 내재한 결과가 도출될 수도 있다는 뜻이다.연구진은 인공지능 기술을 보건의료 분야에 활용하는 데 있어 가장 중요한 요소 중 하나인 신뢰성(reliability)을 중심으로 데이터의 품질·변수 등과 관련된 공정성 문제를 파악하고 기술의 정확성을 점검할 수 있는 다섯 가지 기준을 이번 가이드에 담았다. ▴출처가 정확한 데이터 사용 ▴사용 목적에 맞는 데이터의 수집 또는 선택 ▴제한 사항과 가정의 정확한 언급 ▴데이터의 편향성 명시 ▴실제 환경에서의 적절한 테스트 등이 이행되었는지 점검하기 위해 우리 사회가 이와 관련한 적극적인 질문을 던져야 한다고 강조했다.
연구를 총괄한 김소영 KPC4IR 센터장은 "보건의료 분야의 인공지능 기술이 충분히 견고한지를 검증하는 질문들이 우리 사회에서 활발하게 논의된다면, 궁극적으로 인공지능 기술의 역량을 끌어올리는 것과 동시에 신뢰할 수 있는 기준을 마련할 수 있을 것ˮ이라고 말했다.
이어, 김 센터장은 "인공지능 기술에 대한 국민의 이해도를 높여 한계점과 개선 사항을 인식해나가는 과정에서 이번 가이드가 중요한 역할을 해 줄 것으로 기대하고 있다ˮ라고 덧붙였다. KPC4IR의 이번 연구는 유럽과 아시아를 아우르는 국제 공동 연구자들이 보건의료라는 특정 분야에서 인공지능 기술의 가이드를 제시한 세계 최초의 사례다. 이를 위해 싱가포르국립대학교·테크놀로지기업 어피니디(Affinidi), 스페인 마드리드 카를로스 3세 대학교, 영국 로이드 선급 재단·가이 앤드 세인트 토마스 국가보건서비스 재단 등에 소속된 전문가들이 자문과 인터뷰, 워크숍 등의 방식으로 참여했다. 국내에서는 서울아산병원, 분당서울대병원 등을 비롯한 의료계와 KAIST AI대학원·바이오및뇌공학과, 과학기술정책연구원, 정보통신정책연구원, 인공지능 솔루션 기업 뷰노 등 다수의 산·학·연 관계자들이 함께했다. KPC4IR은 이번 성과를 국제적으로 공유하기 위해 8월 15일 오전 10시부터 온라인으로 열린 ʻ2021 KDD 국제 워크숍ʼ에서 연구 내용을 발표했다. ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드ʼ의 전체 내용은 KAIST 한국4차산업혁명정책센터 (https://kpc4ir.kaist.ac.kr/)와 싱가포르국립대 리스크공공이해연구소(https://ipur.nus.edu.sg/)의 홈페이지에서 확인할 수 있다.
2021.08.17
조회수 13860
-
 생물학적 무기 나노재료의 종류와 응용 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 생물학적으로 합성된 무기 나노재료의 종류와 응용을 총망라해 최신의 연구내용과 흐름을 한눈에 파악할 수 있도록 전략을 정리한 `미생물과 박테리오파지를 이용한 생물학적 무기 나노재료의 합성 및 응용' 논문을 발표했다고 4일 밝혔다.
금속 물질 등이 주된 무기 나노재료(inorganic nanomaterial)는 물리·화학적 합성법들에 따라 얻어지며, 고온·고압의 조건에서 반응이 이뤄지고, 유독한 유기용매 및 고액의 촉매가 필요해 환경오염의 문제를 일으키는 단점이 있다.
생물학적 무기 나노재료 합성법은 친환경 및 단순한 공정으로 경제적인 효과는 물론 생물학적 무기 나노재료의 높은 생체 적합성을 장점으로 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 바이오 의료 분야 등 폭넓게 적용될 수 있을 것으로 기대된다.
연구팀은 미생물과 박테리오파지를 이용해 55개 주기율표 원소 기반 단일 또는 두 가지 원소 조합으로 146개의 무기 나노재료가 생물학적으로 합성 가능함을 보였다.
생물학적 무기 나노재료 합성에는 박테리아, 곰팡이, 조류, 박테리오파지가 주로 이용됨을 정리했다. 이들의 합성 메커니즘에는 효소·비효소 단백질, 펩타이드, 전자 수송경로의 구성 요소 등이 주요 역할을 담당하고 있다.
특히 연구팀은 유전적으로 조작된 미생물과 박테리오파지들을 이용하면 생물학적 무기 나노재료의 합성 수율을 높일 수 있다고 밝혔다. 유전적으로 조작된 미생물들은 무기 이온에 대한 결합력을 높이고 무기 이온의 생물학적 환원을 증가시키는 한편 무기 이온의 생물체에 대한 독성을 줄이기 위한 전략으로도 도입된다.
이번 연구에는 미생물과 박테리오파지를 이용한 무기 나노재료의 생산 가능성과 크기, 모양, 결정성을 조절하기 위한 전략들이 포함됐다.
연구팀은 결정질 무기 나노재료를 생물학적으로 합성하기 위해 물질의 열역학적 안정성을 나타내주는 푸베이 다이어그램 분석을 활용한 전략도 제시했다.
또한 연구팀은 생물학적 나노재료의 합성 시 고려해야 하는 사항을 정리한 10단계의 흐름도를 제시했다. 현재 생물학적으로 합성된 무기 나노재료들은 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 의생명 분야의 응용에 적용됐다.
이상엽 특훈교수는 "생물학적 나노재료들이 추후 바이오 의료 분야의 재료, 바이오 전자기기, 친환경 화학물질 생산 등에 새롭게 적용될 수 있을 것ˮ이라고 기대감을 내비쳤다.
이번 연구 성과는 과학기술정보통신부와 한국연구재단이 추진하는 기후변화대응사업의 바이오리파이너리를 위한 시스템대사공학 연구과제 지원으로 수행됐으며, KAIST 생명화학공학과 최유진 박사가 제1 저자로 참여한 논문은 우수성을 인정받아 국제학술지 `네이처 리뷰 케미스트리(Nature Reviews Chemistry)'에 12월호 표지논문으로 게재됐다.
생물학적 무기 나노재료의 종류와 응용 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 생물학적으로 합성된 무기 나노재료의 종류와 응용을 총망라해 최신의 연구내용과 흐름을 한눈에 파악할 수 있도록 전략을 정리한 `미생물과 박테리오파지를 이용한 생물학적 무기 나노재료의 합성 및 응용' 논문을 발표했다고 4일 밝혔다.
금속 물질 등이 주된 무기 나노재료(inorganic nanomaterial)는 물리·화학적 합성법들에 따라 얻어지며, 고온·고압의 조건에서 반응이 이뤄지고, 유독한 유기용매 및 고액의 촉매가 필요해 환경오염의 문제를 일으키는 단점이 있다.
생물학적 무기 나노재료 합성법은 친환경 및 단순한 공정으로 경제적인 효과는 물론 생물학적 무기 나노재료의 높은 생체 적합성을 장점으로 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 바이오 의료 분야 등 폭넓게 적용될 수 있을 것으로 기대된다.
연구팀은 미생물과 박테리오파지를 이용해 55개 주기율표 원소 기반 단일 또는 두 가지 원소 조합으로 146개의 무기 나노재료가 생물학적으로 합성 가능함을 보였다.
생물학적 무기 나노재료 합성에는 박테리아, 곰팡이, 조류, 박테리오파지가 주로 이용됨을 정리했다. 이들의 합성 메커니즘에는 효소·비효소 단백질, 펩타이드, 전자 수송경로의 구성 요소 등이 주요 역할을 담당하고 있다.
특히 연구팀은 유전적으로 조작된 미생물과 박테리오파지들을 이용하면 생물학적 무기 나노재료의 합성 수율을 높일 수 있다고 밝혔다. 유전적으로 조작된 미생물들은 무기 이온에 대한 결합력을 높이고 무기 이온의 생물학적 환원을 증가시키는 한편 무기 이온의 생물체에 대한 독성을 줄이기 위한 전략으로도 도입된다.
이번 연구에는 미생물과 박테리오파지를 이용한 무기 나노재료의 생산 가능성과 크기, 모양, 결정성을 조절하기 위한 전략들이 포함됐다.
연구팀은 결정질 무기 나노재료를 생물학적으로 합성하기 위해 물질의 열역학적 안정성을 나타내주는 푸베이 다이어그램 분석을 활용한 전략도 제시했다.
또한 연구팀은 생물학적 나노재료의 합성 시 고려해야 하는 사항을 정리한 10단계의 흐름도를 제시했다. 현재 생물학적으로 합성된 무기 나노재료들은 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 의생명 분야의 응용에 적용됐다.
이상엽 특훈교수는 "생물학적 나노재료들이 추후 바이오 의료 분야의 재료, 바이오 전자기기, 친환경 화학물질 생산 등에 새롭게 적용될 수 있을 것ˮ이라고 기대감을 내비쳤다.
이번 연구 성과는 과학기술정보통신부와 한국연구재단이 추진하는 기후변화대응사업의 바이오리파이너리를 위한 시스템대사공학 연구과제 지원으로 수행됐으며, KAIST 생명화학공학과 최유진 박사가 제1 저자로 참여한 논문은 우수성을 인정받아 국제학술지 `네이처 리뷰 케미스트리(Nature Reviews Chemistry)'에 12월호 표지논문으로 게재됐다.
2020.12.04
조회수 43913
-
 이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
2019.07.03
조회수 22811
-
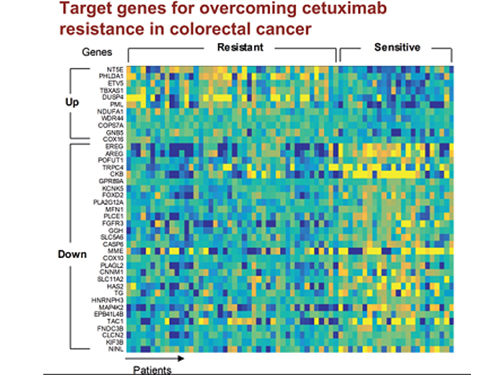 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07
조회수 22377
-
 조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10
조회수 21587
-
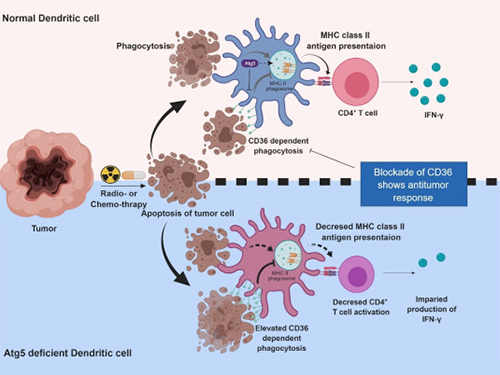 이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
2019.04.02
조회수 16355
 세계 최초 플라빈 빛 파장 설계 성공, 의료·환경 혁신
플라빈은 우리 몸 등 생명체 내의 에너지 생산과 생화학 반응에 관여하는 중요한 조효소이자 특정 색의 빛을 방출하는 형광 분자다. 하지만 자연계의 플라빈은 대부분 파란색에서 초록색 영역까지 짧은 파장의 빛을 낼 수 있어, 그보다 긴 파장인 적외선 영역까지는 확장되기 어렵다. KAIST 연구진이 기존 한계를 극복하고 플라빈이 내뿜는 형광 파장을 근적외선까지 확장하여 의료·환경·에너지 분야의 새로운 가능성을 제시했다.
우리 대학 화학과 백윤정 교수 연구팀은 근적외선 파장에서 발광이 가능한 5개의 고리 구조를 가진 새로운 오환형 플라빈 분자를 세계 최초로 개발하는 데 성공했다.
백윤정 교수 연구팀은 전통적으로 세 개의 고리를 갖는 플라빈 구조에서 플라빈의 핵심 구조를 5개의 고리로 확장하고, 여기에 산소 및 황 등 이종 원자를 정교하게 도입함으로써 분자의 전자 구조를 정밀하게 조절하는 새로운 합성 전략을 제시했다.
특히 이번에 개발된 분자는 적외선에 가까운 짙은 붉은색 및 근적외선 영역의 빛을 낼 수 있어, 기존 플라빈 색소가 낼 수 있었던 색의 범위를 획기적으로 확장했다는 평가를 받고 있다.
그 결과, 황이 포함된 구조체는 772 nm에 달하는 근적외선 영역에서 발광하며, 이는 지금까지 보고된 플라빈 유도체 중 가장 긴 파장이다. 또한 이 분자는 기존의 플라빈에서 드물게 관찰되던 준가역적인 산화 특성을 나타내어 전기화학적 기능성까지 동시에 갖춘 다기능성 분자 플랫폼으로 주목받고 있다.
연구팀은 분자의 구조를 미세하게 조절함으로써, 빛을 어떻게 흡수하고 방출할지를 원하는 대로 설계할 수 있게 되었고, 전기 신호를 전달하거나 변환하는 능력 또한 함께 제어할 수 있음을 입증했다.
이번 연구는 기존 플라빈의 한계를 뛰어넘어 빛의 파장을 바꿈으로서 활용 기술과 응용 범위를 넓힐 수 있다는 것을 보여줬다. 예를 들어, 근적외선(NIR) 같은 긴 파장의 빛을 통해 몸 속 더 깊이 정확하게 진단·치료하게 하며, 오염이나 독성물질이 특정 빛에 반응하도록 설계도 가능하며, 긴 파장의 빛을 흡수해서 친환경 에너지로 만들게 하는 등 발광 파장과 전자 특성을 정밀하게 제어하는 새로운 플랫폼을 제시하였다.
백윤정 교수는 “플라빈의 빛 파장을 바꿀 수 있다는 것은 우리가 원하는 상황에 맞게 빛을 자유롭게 설계하고 활용할 수 있다는 뜻으로, 앞으로 우리 손으로 원하는 색과 성질을 가진 분자를 정밀하게 디자인하고 만들수 있다는 가능성을 보여준 것”이라며, “이는 의료, 환경, 에너지 등 빛 기반 기술이 적용되는 수많은 분야에서 게임 체인저가 될 수 있는 기반 기술이 될 것”이라고 말했다.
해당 성과는 세계적인 국제 학술지 Nature사가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 4월 15일자로 게재되었다.
※ 논문명 : Expanding the Chemical Space of Flavins with Pentacyclic architecture
※ 저자 정보 : 서다영 (KAIST, 제1 저자), 권성연 (기초과학연구원, 공동 제2 저자), 윤가혜 (KAIST, 공동 제2 저자), 손태일 (KAIST, 공동 제2 저자), 원창현 (KAIST, 제3 저자), Neetu Singh (KAIST, 제4 저자), 김동욱 (기초과학연구원, 제5 저자) 및 백윤정 (KAIST, 교신저자) 포함 총 8 명 DOI: 10.1038/s41467-025-58957-2
한편, 이번 연구는 과기정통부가 지원하는 개인기초연구사업의‘우수신진연구’와 산업통상자원부가 지원하는‘소재부품개발사업’과제의 지원을 받아 수행됐다.
2025.04.23 조회수 1578
세계 최초 플라빈 빛 파장 설계 성공, 의료·환경 혁신
플라빈은 우리 몸 등 생명체 내의 에너지 생산과 생화학 반응에 관여하는 중요한 조효소이자 특정 색의 빛을 방출하는 형광 분자다. 하지만 자연계의 플라빈은 대부분 파란색에서 초록색 영역까지 짧은 파장의 빛을 낼 수 있어, 그보다 긴 파장인 적외선 영역까지는 확장되기 어렵다. KAIST 연구진이 기존 한계를 극복하고 플라빈이 내뿜는 형광 파장을 근적외선까지 확장하여 의료·환경·에너지 분야의 새로운 가능성을 제시했다.
우리 대학 화학과 백윤정 교수 연구팀은 근적외선 파장에서 발광이 가능한 5개의 고리 구조를 가진 새로운 오환형 플라빈 분자를 세계 최초로 개발하는 데 성공했다.
백윤정 교수 연구팀은 전통적으로 세 개의 고리를 갖는 플라빈 구조에서 플라빈의 핵심 구조를 5개의 고리로 확장하고, 여기에 산소 및 황 등 이종 원자를 정교하게 도입함으로써 분자의 전자 구조를 정밀하게 조절하는 새로운 합성 전략을 제시했다.
특히 이번에 개발된 분자는 적외선에 가까운 짙은 붉은색 및 근적외선 영역의 빛을 낼 수 있어, 기존 플라빈 색소가 낼 수 있었던 색의 범위를 획기적으로 확장했다는 평가를 받고 있다.
그 결과, 황이 포함된 구조체는 772 nm에 달하는 근적외선 영역에서 발광하며, 이는 지금까지 보고된 플라빈 유도체 중 가장 긴 파장이다. 또한 이 분자는 기존의 플라빈에서 드물게 관찰되던 준가역적인 산화 특성을 나타내어 전기화학적 기능성까지 동시에 갖춘 다기능성 분자 플랫폼으로 주목받고 있다.
연구팀은 분자의 구조를 미세하게 조절함으로써, 빛을 어떻게 흡수하고 방출할지를 원하는 대로 설계할 수 있게 되었고, 전기 신호를 전달하거나 변환하는 능력 또한 함께 제어할 수 있음을 입증했다.
이번 연구는 기존 플라빈의 한계를 뛰어넘어 빛의 파장을 바꿈으로서 활용 기술과 응용 범위를 넓힐 수 있다는 것을 보여줬다. 예를 들어, 근적외선(NIR) 같은 긴 파장의 빛을 통해 몸 속 더 깊이 정확하게 진단·치료하게 하며, 오염이나 독성물질이 특정 빛에 반응하도록 설계도 가능하며, 긴 파장의 빛을 흡수해서 친환경 에너지로 만들게 하는 등 발광 파장과 전자 특성을 정밀하게 제어하는 새로운 플랫폼을 제시하였다.
백윤정 교수는 “플라빈의 빛 파장을 바꿀 수 있다는 것은 우리가 원하는 상황에 맞게 빛을 자유롭게 설계하고 활용할 수 있다는 뜻으로, 앞으로 우리 손으로 원하는 색과 성질을 가진 분자를 정밀하게 디자인하고 만들수 있다는 가능성을 보여준 것”이라며, “이는 의료, 환경, 에너지 등 빛 기반 기술이 적용되는 수많은 분야에서 게임 체인저가 될 수 있는 기반 기술이 될 것”이라고 말했다.
해당 성과는 세계적인 국제 학술지 Nature사가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 4월 15일자로 게재되었다.
※ 논문명 : Expanding the Chemical Space of Flavins with Pentacyclic architecture
※ 저자 정보 : 서다영 (KAIST, 제1 저자), 권성연 (기초과학연구원, 공동 제2 저자), 윤가혜 (KAIST, 공동 제2 저자), 손태일 (KAIST, 공동 제2 저자), 원창현 (KAIST, 제3 저자), Neetu Singh (KAIST, 제4 저자), 김동욱 (기초과학연구원, 제5 저자) 및 백윤정 (KAIST, 교신저자) 포함 총 8 명 DOI: 10.1038/s41467-025-58957-2
한편, 이번 연구는 과기정통부가 지원하는 개인기초연구사업의‘우수신진연구’와 산업통상자원부가 지원하는‘소재부품개발사업’과제의 지원을 받아 수행됐다.
2025.04.23 조회수 1578 홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
2024.07.30 조회수 7580
홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
2024.07.30 조회수 7580 사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 5334
사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 5334 교원창업기업 (주)로엔서지컬, 신장결석 수술로봇 보건복지부 혁신의료기술 지정으로 시장 진입 가시화
우리 대학 교원창업 스타트업인 ㈜로엔서지컬(대표이사 기계공학과 권동수 교수)에서 국내최초로 개발한 신장결석 수술로봇을 사용하는 연성신요관 경하 결석제거술이 보건복지부의 혁신의료기술로 지정받았다고 밝혔다.
해당 기술은 요로결석으로 인해 연성신요관경하 결석제거술이 필요한 환자를 대상으로 요로를 통해 삽입한 수술기구를 로봇 팔에 부착하여 요로결석을 제거하는 기술로 안전성 및 잠재성이 있는 혁신의료기술로 인정받은 만큼 안전하고 효과가 검증된 치료법을 뜻한다고 로엔서지컬 측은 설명했다.
지난 20일 보건복지부 고시 제2023-175호 ‘신의료기술의 안전성, 유효성 평가결과 고시’에 따르면 요로결석 제거를 위해 로봇 보조 연성신요관경하 결석제거술 기술을 이용하여 결석제거술이 필요한 환자를 대상으로 병원에서 치료가 가능해짐에 따라, 신장결석 수술로봇의 조기 시장진입이 가능하게 되었다.
이에 따라, ㈜로엔서지컬은 혁신의료기술 실시 준비를 위한 임상시험과 국내 병원 판매 계약 등을 준비중에 있다고 밝혔다. 2024년 4월 부터는 최대 3년간 의료현장에서 비급여로 사용될 수 있다.
㈜로엔서지컬은 지난 2018년 2월에 KAIST 교원 및 학생창업을 통해 유연내시경 수술로봇을 개발하고 있는 회사로 환부를 개복하지 않고 인체의 자연개구부를 통해 신장내 결석을 제거하는 신장결석 수술로봇등의 유연내시경 수술로봇을 개발하는 회사로 2021.12월 식약처 제17호 혁신의료기기 지정, 2022.10월 식약처 제조허가 획득에 이어 올해 9월에 보건복지부 혁신의료기술로 인정받게 되어, 수술로봇 개발의 독보적인 기술 우수성을 다시 입증함에 따라, 시장진입에 의미있는 계기가 마련되었다고 밝혔다.
2023.09.22 조회수 4792
교원창업기업 (주)로엔서지컬, 신장결석 수술로봇 보건복지부 혁신의료기술 지정으로 시장 진입 가시화
우리 대학 교원창업 스타트업인 ㈜로엔서지컬(대표이사 기계공학과 권동수 교수)에서 국내최초로 개발한 신장결석 수술로봇을 사용하는 연성신요관 경하 결석제거술이 보건복지부의 혁신의료기술로 지정받았다고 밝혔다.
해당 기술은 요로결석으로 인해 연성신요관경하 결석제거술이 필요한 환자를 대상으로 요로를 통해 삽입한 수술기구를 로봇 팔에 부착하여 요로결석을 제거하는 기술로 안전성 및 잠재성이 있는 혁신의료기술로 인정받은 만큼 안전하고 효과가 검증된 치료법을 뜻한다고 로엔서지컬 측은 설명했다.
지난 20일 보건복지부 고시 제2023-175호 ‘신의료기술의 안전성, 유효성 평가결과 고시’에 따르면 요로결석 제거를 위해 로봇 보조 연성신요관경하 결석제거술 기술을 이용하여 결석제거술이 필요한 환자를 대상으로 병원에서 치료가 가능해짐에 따라, 신장결석 수술로봇의 조기 시장진입이 가능하게 되었다.
이에 따라, ㈜로엔서지컬은 혁신의료기술 실시 준비를 위한 임상시험과 국내 병원 판매 계약 등을 준비중에 있다고 밝혔다. 2024년 4월 부터는 최대 3년간 의료현장에서 비급여로 사용될 수 있다.
㈜로엔서지컬은 지난 2018년 2월에 KAIST 교원 및 학생창업을 통해 유연내시경 수술로봇을 개발하고 있는 회사로 환부를 개복하지 않고 인체의 자연개구부를 통해 신장내 결석을 제거하는 신장결석 수술로봇등의 유연내시경 수술로봇을 개발하는 회사로 2021.12월 식약처 제17호 혁신의료기기 지정, 2022.10월 식약처 제조허가 획득에 이어 올해 9월에 보건복지부 혁신의료기술로 인정받게 되어, 수술로봇 개발의 독보적인 기술 우수성을 다시 입증함에 따라, 시장진입에 의미있는 계기가 마련되었다고 밝혔다.
2023.09.22 조회수 4792 염증없이 체내·외 측정 가능한 전자 신소재 개발
생체전자 의료기기는 체내에서 발생하는 신호를 읽어 생물학적 활동을 감지하거나, 조직을 자극해 질병 등을 치료하는 데 사용된다. 하지만 의료기기에 사용되는 전극 물질은 딱딱한 물성을 가지고 있어 체내에 염증반응을 일으키고 조직에 다량의 손상으로 이어질 수 있다. 따라서 조직과 같이 부드러운 성질을 가지면서도 전도성을 띠는 하이드로겔과 같은 연성 물질에 생체적합성이 높은 전도성 고분자를 체내 전극으로 사용하는 연구들이 활발하게 진행되고 있다.
우리 대학 신소재공학과 강지형 교수와 바이오및뇌공학과 박성준 교수 공동연구팀이 기존에 없었던 고전도성, 유사 조직 접착성 하이드로겔이란 신소재를 개발해 고성능 생체전자 기기를 구현했다고 4일 밝혔다.
대부분 전기 전도도가 높을수록 전도성 도메인들의 결정성이 높아지는 원리에 의해, 전도성이 높은 하이드로겔은 딱딱해지고, 부드러운 하이드로겔은 전도성이 낮을 수밖에 없다는 한계를 가진다. 이에 따라 전도성 고분자를 사용하는 하이드로겔 중, 전기 전도도가 높으면서도(10 S/cm 이상) 부드러운 물성(100 kPa 이하)을 가진 하이드로겔은 지금까지 보고된 바 없었다.
강지형 교수 연구팀은 기존에 없었던 고전도성, 유사 조직 물성 하이드로겔을 개발했다. 이 하이드로겔은 보고된 전도성 고분자 하이드로겔 중 가장 높은 전기 전도도(247 S/cm)를 띄며, 조직과 비슷한 물성(탄성율 = 60 kPa, 파괴변형률 = 410%)을 갖는다. 또한, 본 재료는 지속적인 움직임과 팽창, 수축이 있는 심장, 위와 같은 조직에서 안정적으로 기기가 작동하기 위해 필수조건인 조직에 쉽게 접착되는 장점을 가지고 있다.
공동연구팀은 원하는 생체 조직에 맞게 조정하고 그 형태에 맞추는 주형의 그물 구조에 따라 높은 질서도를 가지는 고분자 주형 네트워크를 도입했다.
따라서 주형에 맞추어 형성된 그물 네트워크는 기존 네트워크 대비 100배 이상 높은 전기 전도도를 보이며, 동시에 주형 고분자의 부드러운 특성 때문에 조직과 비슷한 물성을 지니게 된다. 변형에도 저항이 바뀌지 않아 생체전극으로서 최적의 성능을 갖는다.
또한 연구팀은 개발한 하이드로겔을 전극을 기반으로 한 높은 전기 전도도를 가진 다양한 고성능 생체전자 기기를 제작, 그 기능성을 검증했다. 높은 전기 전도도를 가진 특성으로 좌골신경 자극을 대상으로 하는 디바이스의 경우, 매우 낮은 전압(40 mV)에서 다리 근육의 움직임을 성공적으로 유도할 수 있었다. 또한 심전도 측정(ECG)을 위한 디바이스의 경우에도 매우 높은 신호 대 잡음 비(61 dB)로 신호를 측정하는 데 성공함으로써, 초고품질 생체 신호 측정을 위한 연성 기기 개발 가능성을 입증하였다.
이번 연구를 주도한 강지형 교수는 "이번 연구는 고전도성을 갖고 생체조직과 유사한 기계적 물성을 갖는 하이드로겔 개발을 위한 합성 방향을 새롭게 제시했다는 점에서 의미가 있다고 하면서, "이번에 개발된 전도성 하이드로겔은 급속도로 성장하고 있는 전자약 시장에 게임 체인저가 될 것으로 기대된다고 말했다.
우리 대학 신소재공학과 정주은 박사과정과 바이오및뇌공학과 성창훈 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션스 (Nature Communications)’에 4월 18일 게재됐다. (논문명: Highly conductive tissue-like hydrogel interface through template-directed assembly)
한편 이번 연구는 한국연구재단의 나노소재기술개발 미래기술연구실 사업을 받아 수행됐다.
2023.05.04 조회수 10061
염증없이 체내·외 측정 가능한 전자 신소재 개발
생체전자 의료기기는 체내에서 발생하는 신호를 읽어 생물학적 활동을 감지하거나, 조직을 자극해 질병 등을 치료하는 데 사용된다. 하지만 의료기기에 사용되는 전극 물질은 딱딱한 물성을 가지고 있어 체내에 염증반응을 일으키고 조직에 다량의 손상으로 이어질 수 있다. 따라서 조직과 같이 부드러운 성질을 가지면서도 전도성을 띠는 하이드로겔과 같은 연성 물질에 생체적합성이 높은 전도성 고분자를 체내 전극으로 사용하는 연구들이 활발하게 진행되고 있다.
우리 대학 신소재공학과 강지형 교수와 바이오및뇌공학과 박성준 교수 공동연구팀이 기존에 없었던 고전도성, 유사 조직 접착성 하이드로겔이란 신소재를 개발해 고성능 생체전자 기기를 구현했다고 4일 밝혔다.
대부분 전기 전도도가 높을수록 전도성 도메인들의 결정성이 높아지는 원리에 의해, 전도성이 높은 하이드로겔은 딱딱해지고, 부드러운 하이드로겔은 전도성이 낮을 수밖에 없다는 한계를 가진다. 이에 따라 전도성 고분자를 사용하는 하이드로겔 중, 전기 전도도가 높으면서도(10 S/cm 이상) 부드러운 물성(100 kPa 이하)을 가진 하이드로겔은 지금까지 보고된 바 없었다.
강지형 교수 연구팀은 기존에 없었던 고전도성, 유사 조직 물성 하이드로겔을 개발했다. 이 하이드로겔은 보고된 전도성 고분자 하이드로겔 중 가장 높은 전기 전도도(247 S/cm)를 띄며, 조직과 비슷한 물성(탄성율 = 60 kPa, 파괴변형률 = 410%)을 갖는다. 또한, 본 재료는 지속적인 움직임과 팽창, 수축이 있는 심장, 위와 같은 조직에서 안정적으로 기기가 작동하기 위해 필수조건인 조직에 쉽게 접착되는 장점을 가지고 있다.
공동연구팀은 원하는 생체 조직에 맞게 조정하고 그 형태에 맞추는 주형의 그물 구조에 따라 높은 질서도를 가지는 고분자 주형 네트워크를 도입했다.
따라서 주형에 맞추어 형성된 그물 네트워크는 기존 네트워크 대비 100배 이상 높은 전기 전도도를 보이며, 동시에 주형 고분자의 부드러운 특성 때문에 조직과 비슷한 물성을 지니게 된다. 변형에도 저항이 바뀌지 않아 생체전극으로서 최적의 성능을 갖는다.
또한 연구팀은 개발한 하이드로겔을 전극을 기반으로 한 높은 전기 전도도를 가진 다양한 고성능 생체전자 기기를 제작, 그 기능성을 검증했다. 높은 전기 전도도를 가진 특성으로 좌골신경 자극을 대상으로 하는 디바이스의 경우, 매우 낮은 전압(40 mV)에서 다리 근육의 움직임을 성공적으로 유도할 수 있었다. 또한 심전도 측정(ECG)을 위한 디바이스의 경우에도 매우 높은 신호 대 잡음 비(61 dB)로 신호를 측정하는 데 성공함으로써, 초고품질 생체 신호 측정을 위한 연성 기기 개발 가능성을 입증하였다.
이번 연구를 주도한 강지형 교수는 "이번 연구는 고전도성을 갖고 생체조직과 유사한 기계적 물성을 갖는 하이드로겔 개발을 위한 합성 방향을 새롭게 제시했다는 점에서 의미가 있다고 하면서, "이번에 개발된 전도성 하이드로겔은 급속도로 성장하고 있는 전자약 시장에 게임 체인저가 될 것으로 기대된다고 말했다.
우리 대학 신소재공학과 정주은 박사과정과 바이오및뇌공학과 성창훈 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션스 (Nature Communications)’에 4월 18일 게재됐다. (논문명: Highly conductive tissue-like hydrogel interface through template-directed assembly)
한편 이번 연구는 한국연구재단의 나노소재기술개발 미래기술연구실 사업을 받아 수행됐다.
2023.05.04 조회수 10061 상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
2022.10.24 조회수 9538
상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
2022.10.24 조회수 9538 KPC4IR, 보건의료 분야 인공지능 활용 가이드 개발
우리 대학이 ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드(Using Artificial Intelligence to Support Healthcare Decisions: A Guide for Society)ʼ를 국제 공동연구를 통해 개발했다. 코로나 19의 세계적인 대유행은 인공지능 기술의 빠른 상용화를 촉진했다. 일례로, 영국의 인공지능 스타트업인 베네볼런트AI(BenevolentAI)는 신종 질병 치료약물을 식별하기 위해 통상적으로 8년이 걸리던 기간을 인공지능 기술을 활용해 단 1주일로 단축시켰다. 이처럼 인공지능 기술은 경제·산업·사회·문화 등 전방위로 확산되면서 엄청난 부가가치와 생활의 편익을 창출하고 있다. 하지만, 급속한 기술 도입이 데이터의 편향이나 오·남용 등의 맹점을 함께 가져왔다는 우려도 중요하게 대두되고 있다. 특히, 보건의료 분야는 인공지능을 뒷받침하는 데이터의 품질과 검증 여부가 생명과 직결되기 때문에 인공지능 기술의 타당성과 안전성이 무엇보다도 우선시 되어야 한다. KAIST 한국4차산업혁명정책센터(센터장 김소영, 이하 KPC4IR)는 보건의료 분야에 적용되고 있는 인공지능 기술의 신뢰성을 확보하기 위해 보다 많은 사람이 인공지능 기술의 책임성에 관한 질문을 던져야 한다는 문제의식을 바탕으로 이번 가이드를 제작했다. 연구진이 말하는 책임성이란 인공지능 기술이 데이터의 편향성으로 현존하는 불평등을 악화시키지 않도록 주의하고 데이터의 정확성을 확보해 결과의 오류를 최소화하는 등의 노력이다.
KPC4IR은 이번 가이드 개발을 위해 싱가포르국립대학교의 리스크공공이해연구소(National University of Singapore Lloyd’s Register Foundation Institute for the Public Understanding of Risk), 영국의 대표적인 과학 기술 비영리 기관인 센스 어바웃 사이언스(Sense about Science)와 함께 지난 1년 간 국제 공동연구를 수행했다.
연구진은 의료영상 분석 및 진단의 효과성 제고와 빅데이터를 활용한 질병 예측 및 임상적 의사결정, 신약 개발 분야 시간 단축 등 의료 분야에 인공지능 기술을 적용한 국내·외 사례를 이번 가이드에 담았다.
또한, 학습 데이터에 누락되거나 제외된 정보가 있다면 인공지능이 편향성을 나타낼 수 있으며, 원래와는 다른 용도로 사용할 경우 변수 간의 연관 관계나 심지어는 결과까지도 잘못 판단할 수 있다는 점도 강조했다. 독일에서는 피부의 병변을 감지해 암 발생 가능성을 진단하는 인공지능을 개발해 실제 의사들의 진단 소견과 비교하는 실험을 진행했다. 동일한 병변 이미지를 인공지능과 다양한 국적을 가진 피부과 전문의 58명에게 보여준 결과 인공지능은 87%의 정확도로 병변 의심 사례를 식별해냈다. 79%의 정확도를 보인 의사들의 정확도를 앞지른 것이다. 인공지능이 의사가 환자를 치료하며 결정을 내리는 과정에서 도움이 될 수 있다는 것을 보여준 사례다. 그러나 인공지능이 옅은 피부색을 가진 사람들로부터 수집한 데이터를 주로 활용해 학습한다면 짙은 피부색을 가진 환자들의 병변은 제대로 진단하지 못할 가능성이 커진다. 인공지능을 ʻ지능적ʼ이라고 하는 이유는 데이터를 단순히 검색하는 수준에 머무는 것이 아니라 데이터에 숨어 있는 특정 패턴을 분석해 유의미한 자료로 추출하기 때문이다. 그래서 사람들은 인공지능의 의사결정이 냉철하고 객관적일 것이라고 생각하지만, 인공지능은 현실에 존재하는 데이터들 바탕으로 학습한다. 우리가 가진 사회적 편견과 편향, 위험한 가정들을 그대로 내재한 결과가 도출될 수도 있다는 뜻이다.연구진은 인공지능 기술을 보건의료 분야에 활용하는 데 있어 가장 중요한 요소 중 하나인 신뢰성(reliability)을 중심으로 데이터의 품질·변수 등과 관련된 공정성 문제를 파악하고 기술의 정확성을 점검할 수 있는 다섯 가지 기준을 이번 가이드에 담았다. ▴출처가 정확한 데이터 사용 ▴사용 목적에 맞는 데이터의 수집 또는 선택 ▴제한 사항과 가정의 정확한 언급 ▴데이터의 편향성 명시 ▴실제 환경에서의 적절한 테스트 등이 이행되었는지 점검하기 위해 우리 사회가 이와 관련한 적극적인 질문을 던져야 한다고 강조했다.
연구를 총괄한 김소영 KPC4IR 센터장은 "보건의료 분야의 인공지능 기술이 충분히 견고한지를 검증하는 질문들이 우리 사회에서 활발하게 논의된다면, 궁극적으로 인공지능 기술의 역량을 끌어올리는 것과 동시에 신뢰할 수 있는 기준을 마련할 수 있을 것ˮ이라고 말했다.
이어, 김 센터장은 "인공지능 기술에 대한 국민의 이해도를 높여 한계점과 개선 사항을 인식해나가는 과정에서 이번 가이드가 중요한 역할을 해 줄 것으로 기대하고 있다ˮ라고 덧붙였다. KPC4IR의 이번 연구는 유럽과 아시아를 아우르는 국제 공동 연구자들이 보건의료라는 특정 분야에서 인공지능 기술의 가이드를 제시한 세계 최초의 사례다. 이를 위해 싱가포르국립대학교·테크놀로지기업 어피니디(Affinidi), 스페인 마드리드 카를로스 3세 대학교, 영국 로이드 선급 재단·가이 앤드 세인트 토마스 국가보건서비스 재단 등에 소속된 전문가들이 자문과 인터뷰, 워크숍 등의 방식으로 참여했다. 국내에서는 서울아산병원, 분당서울대병원 등을 비롯한 의료계와 KAIST AI대학원·바이오및뇌공학과, 과학기술정책연구원, 정보통신정책연구원, 인공지능 솔루션 기업 뷰노 등 다수의 산·학·연 관계자들이 함께했다. KPC4IR은 이번 성과를 국제적으로 공유하기 위해 8월 15일 오전 10시부터 온라인으로 열린 ʻ2021 KDD 국제 워크숍ʼ에서 연구 내용을 발표했다. ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드ʼ의 전체 내용은 KAIST 한국4차산업혁명정책센터 (https://kpc4ir.kaist.ac.kr/)와 싱가포르국립대 리스크공공이해연구소(https://ipur.nus.edu.sg/)의 홈페이지에서 확인할 수 있다.
2021.08.17 조회수 13860
KPC4IR, 보건의료 분야 인공지능 활용 가이드 개발
우리 대학이 ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드(Using Artificial Intelligence to Support Healthcare Decisions: A Guide for Society)ʼ를 국제 공동연구를 통해 개발했다. 코로나 19의 세계적인 대유행은 인공지능 기술의 빠른 상용화를 촉진했다. 일례로, 영국의 인공지능 스타트업인 베네볼런트AI(BenevolentAI)는 신종 질병 치료약물을 식별하기 위해 통상적으로 8년이 걸리던 기간을 인공지능 기술을 활용해 단 1주일로 단축시켰다. 이처럼 인공지능 기술은 경제·산업·사회·문화 등 전방위로 확산되면서 엄청난 부가가치와 생활의 편익을 창출하고 있다. 하지만, 급속한 기술 도입이 데이터의 편향이나 오·남용 등의 맹점을 함께 가져왔다는 우려도 중요하게 대두되고 있다. 특히, 보건의료 분야는 인공지능을 뒷받침하는 데이터의 품질과 검증 여부가 생명과 직결되기 때문에 인공지능 기술의 타당성과 안전성이 무엇보다도 우선시 되어야 한다. KAIST 한국4차산업혁명정책센터(센터장 김소영, 이하 KPC4IR)는 보건의료 분야에 적용되고 있는 인공지능 기술의 신뢰성을 확보하기 위해 보다 많은 사람이 인공지능 기술의 책임성에 관한 질문을 던져야 한다는 문제의식을 바탕으로 이번 가이드를 제작했다. 연구진이 말하는 책임성이란 인공지능 기술이 데이터의 편향성으로 현존하는 불평등을 악화시키지 않도록 주의하고 데이터의 정확성을 확보해 결과의 오류를 최소화하는 등의 노력이다.
KPC4IR은 이번 가이드 개발을 위해 싱가포르국립대학교의 리스크공공이해연구소(National University of Singapore Lloyd’s Register Foundation Institute for the Public Understanding of Risk), 영국의 대표적인 과학 기술 비영리 기관인 센스 어바웃 사이언스(Sense about Science)와 함께 지난 1년 간 국제 공동연구를 수행했다.
연구진은 의료영상 분석 및 진단의 효과성 제고와 빅데이터를 활용한 질병 예측 및 임상적 의사결정, 신약 개발 분야 시간 단축 등 의료 분야에 인공지능 기술을 적용한 국내·외 사례를 이번 가이드에 담았다.
또한, 학습 데이터에 누락되거나 제외된 정보가 있다면 인공지능이 편향성을 나타낼 수 있으며, 원래와는 다른 용도로 사용할 경우 변수 간의 연관 관계나 심지어는 결과까지도 잘못 판단할 수 있다는 점도 강조했다. 독일에서는 피부의 병변을 감지해 암 발생 가능성을 진단하는 인공지능을 개발해 실제 의사들의 진단 소견과 비교하는 실험을 진행했다. 동일한 병변 이미지를 인공지능과 다양한 국적을 가진 피부과 전문의 58명에게 보여준 결과 인공지능은 87%의 정확도로 병변 의심 사례를 식별해냈다. 79%의 정확도를 보인 의사들의 정확도를 앞지른 것이다. 인공지능이 의사가 환자를 치료하며 결정을 내리는 과정에서 도움이 될 수 있다는 것을 보여준 사례다. 그러나 인공지능이 옅은 피부색을 가진 사람들로부터 수집한 데이터를 주로 활용해 학습한다면 짙은 피부색을 가진 환자들의 병변은 제대로 진단하지 못할 가능성이 커진다. 인공지능을 ʻ지능적ʼ이라고 하는 이유는 데이터를 단순히 검색하는 수준에 머무는 것이 아니라 데이터에 숨어 있는 특정 패턴을 분석해 유의미한 자료로 추출하기 때문이다. 그래서 사람들은 인공지능의 의사결정이 냉철하고 객관적일 것이라고 생각하지만, 인공지능은 현실에 존재하는 데이터들 바탕으로 학습한다. 우리가 가진 사회적 편견과 편향, 위험한 가정들을 그대로 내재한 결과가 도출될 수도 있다는 뜻이다.연구진은 인공지능 기술을 보건의료 분야에 활용하는 데 있어 가장 중요한 요소 중 하나인 신뢰성(reliability)을 중심으로 데이터의 품질·변수 등과 관련된 공정성 문제를 파악하고 기술의 정확성을 점검할 수 있는 다섯 가지 기준을 이번 가이드에 담았다. ▴출처가 정확한 데이터 사용 ▴사용 목적에 맞는 데이터의 수집 또는 선택 ▴제한 사항과 가정의 정확한 언급 ▴데이터의 편향성 명시 ▴실제 환경에서의 적절한 테스트 등이 이행되었는지 점검하기 위해 우리 사회가 이와 관련한 적극적인 질문을 던져야 한다고 강조했다.
연구를 총괄한 김소영 KPC4IR 센터장은 "보건의료 분야의 인공지능 기술이 충분히 견고한지를 검증하는 질문들이 우리 사회에서 활발하게 논의된다면, 궁극적으로 인공지능 기술의 역량을 끌어올리는 것과 동시에 신뢰할 수 있는 기준을 마련할 수 있을 것ˮ이라고 말했다.
이어, 김 센터장은 "인공지능 기술에 대한 국민의 이해도를 높여 한계점과 개선 사항을 인식해나가는 과정에서 이번 가이드가 중요한 역할을 해 줄 것으로 기대하고 있다ˮ라고 덧붙였다. KPC4IR의 이번 연구는 유럽과 아시아를 아우르는 국제 공동 연구자들이 보건의료라는 특정 분야에서 인공지능 기술의 가이드를 제시한 세계 최초의 사례다. 이를 위해 싱가포르국립대학교·테크놀로지기업 어피니디(Affinidi), 스페인 마드리드 카를로스 3세 대학교, 영국 로이드 선급 재단·가이 앤드 세인트 토마스 국가보건서비스 재단 등에 소속된 전문가들이 자문과 인터뷰, 워크숍 등의 방식으로 참여했다. 국내에서는 서울아산병원, 분당서울대병원 등을 비롯한 의료계와 KAIST AI대학원·바이오및뇌공학과, 과학기술정책연구원, 정보통신정책연구원, 인공지능 솔루션 기업 뷰노 등 다수의 산·학·연 관계자들이 함께했다. KPC4IR은 이번 성과를 국제적으로 공유하기 위해 8월 15일 오전 10시부터 온라인으로 열린 ʻ2021 KDD 국제 워크숍ʼ에서 연구 내용을 발표했다. ʻ사회를 위한 보건의료 분야 인공지능 활용 가이드ʼ의 전체 내용은 KAIST 한국4차산업혁명정책센터 (https://kpc4ir.kaist.ac.kr/)와 싱가포르국립대 리스크공공이해연구소(https://ipur.nus.edu.sg/)의 홈페이지에서 확인할 수 있다.
2021.08.17 조회수 13860 생물학적 무기 나노재료의 종류와 응용 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 생물학적으로 합성된 무기 나노재료의 종류와 응용을 총망라해 최신의 연구내용과 흐름을 한눈에 파악할 수 있도록 전략을 정리한 `미생물과 박테리오파지를 이용한 생물학적 무기 나노재료의 합성 및 응용' 논문을 발표했다고 4일 밝혔다.
금속 물질 등이 주된 무기 나노재료(inorganic nanomaterial)는 물리·화학적 합성법들에 따라 얻어지며, 고온·고압의 조건에서 반응이 이뤄지고, 유독한 유기용매 및 고액의 촉매가 필요해 환경오염의 문제를 일으키는 단점이 있다.
생물학적 무기 나노재료 합성법은 친환경 및 단순한 공정으로 경제적인 효과는 물론 생물학적 무기 나노재료의 높은 생체 적합성을 장점으로 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 바이오 의료 분야 등 폭넓게 적용될 수 있을 것으로 기대된다.
연구팀은 미생물과 박테리오파지를 이용해 55개 주기율표 원소 기반 단일 또는 두 가지 원소 조합으로 146개의 무기 나노재료가 생물학적으로 합성 가능함을 보였다.
생물학적 무기 나노재료 합성에는 박테리아, 곰팡이, 조류, 박테리오파지가 주로 이용됨을 정리했다. 이들의 합성 메커니즘에는 효소·비효소 단백질, 펩타이드, 전자 수송경로의 구성 요소 등이 주요 역할을 담당하고 있다.
특히 연구팀은 유전적으로 조작된 미생물과 박테리오파지들을 이용하면 생물학적 무기 나노재료의 합성 수율을 높일 수 있다고 밝혔다. 유전적으로 조작된 미생물들은 무기 이온에 대한 결합력을 높이고 무기 이온의 생물학적 환원을 증가시키는 한편 무기 이온의 생물체에 대한 독성을 줄이기 위한 전략으로도 도입된다.
이번 연구에는 미생물과 박테리오파지를 이용한 무기 나노재료의 생산 가능성과 크기, 모양, 결정성을 조절하기 위한 전략들이 포함됐다.
연구팀은 결정질 무기 나노재료를 생물학적으로 합성하기 위해 물질의 열역학적 안정성을 나타내주는 푸베이 다이어그램 분석을 활용한 전략도 제시했다.
또한 연구팀은 생물학적 나노재료의 합성 시 고려해야 하는 사항을 정리한 10단계의 흐름도를 제시했다. 현재 생물학적으로 합성된 무기 나노재료들은 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 의생명 분야의 응용에 적용됐다.
이상엽 특훈교수는 "생물학적 나노재료들이 추후 바이오 의료 분야의 재료, 바이오 전자기기, 친환경 화학물질 생산 등에 새롭게 적용될 수 있을 것ˮ이라고 기대감을 내비쳤다.
이번 연구 성과는 과학기술정보통신부와 한국연구재단이 추진하는 기후변화대응사업의 바이오리파이너리를 위한 시스템대사공학 연구과제 지원으로 수행됐으며, KAIST 생명화학공학과 최유진 박사가 제1 저자로 참여한 논문은 우수성을 인정받아 국제학술지 `네이처 리뷰 케미스트리(Nature Reviews Chemistry)'에 12월호 표지논문으로 게재됐다.
2020.12.04 조회수 43913
생물학적 무기 나노재료의 종류와 응용 전략 총정리
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 생물학적으로 합성된 무기 나노재료의 종류와 응용을 총망라해 최신의 연구내용과 흐름을 한눈에 파악할 수 있도록 전략을 정리한 `미생물과 박테리오파지를 이용한 생물학적 무기 나노재료의 합성 및 응용' 논문을 발표했다고 4일 밝혔다.
금속 물질 등이 주된 무기 나노재료(inorganic nanomaterial)는 물리·화학적 합성법들에 따라 얻어지며, 고온·고압의 조건에서 반응이 이뤄지고, 유독한 유기용매 및 고액의 촉매가 필요해 환경오염의 문제를 일으키는 단점이 있다.
생물학적 무기 나노재료 합성법은 친환경 및 단순한 공정으로 경제적인 효과는 물론 생물학적 무기 나노재료의 높은 생체 적합성을 장점으로 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 바이오 의료 분야 등 폭넓게 적용될 수 있을 것으로 기대된다.
연구팀은 미생물과 박테리오파지를 이용해 55개 주기율표 원소 기반 단일 또는 두 가지 원소 조합으로 146개의 무기 나노재료가 생물학적으로 합성 가능함을 보였다.
생물학적 무기 나노재료 합성에는 박테리아, 곰팡이, 조류, 박테리오파지가 주로 이용됨을 정리했다. 이들의 합성 메커니즘에는 효소·비효소 단백질, 펩타이드, 전자 수송경로의 구성 요소 등이 주요 역할을 담당하고 있다.
특히 연구팀은 유전적으로 조작된 미생물과 박테리오파지들을 이용하면 생물학적 무기 나노재료의 합성 수율을 높일 수 있다고 밝혔다. 유전적으로 조작된 미생물들은 무기 이온에 대한 결합력을 높이고 무기 이온의 생물학적 환원을 증가시키는 한편 무기 이온의 생물체에 대한 독성을 줄이기 위한 전략으로도 도입된다.
이번 연구에는 미생물과 박테리오파지를 이용한 무기 나노재료의 생산 가능성과 크기, 모양, 결정성을 조절하기 위한 전략들이 포함됐다.
연구팀은 결정질 무기 나노재료를 생물학적으로 합성하기 위해 물질의 열역학적 안정성을 나타내주는 푸베이 다이어그램 분석을 활용한 전략도 제시했다.
또한 연구팀은 생물학적 나노재료의 합성 시 고려해야 하는 사항을 정리한 10단계의 흐름도를 제시했다. 현재 생물학적으로 합성된 무기 나노재료들은 촉매, 에너지 수확 및 저장, 전자기기, 항균물질, 의생명 분야의 응용에 적용됐다.
이상엽 특훈교수는 "생물학적 나노재료들이 추후 바이오 의료 분야의 재료, 바이오 전자기기, 친환경 화학물질 생산 등에 새롭게 적용될 수 있을 것ˮ이라고 기대감을 내비쳤다.
이번 연구 성과는 과학기술정보통신부와 한국연구재단이 추진하는 기후변화대응사업의 바이오리파이너리를 위한 시스템대사공학 연구과제 지원으로 수행됐으며, KAIST 생명화학공학과 최유진 박사가 제1 저자로 참여한 논문은 우수성을 인정받아 국제학술지 `네이처 리뷰 케미스트리(Nature Reviews Chemistry)'에 12월호 표지논문으로 게재됐다.
2020.12.04 조회수 43913 이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
2019.07.03 조회수 22811
이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
2019.07.03 조회수 22811 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 22377
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 22377 조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 21587
조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 21587 이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
2019.04.02 조회수 16355
이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
2019.04.02 조회수 16355