%EC%A0%80%ED%95%AD%EC%84%B1
-
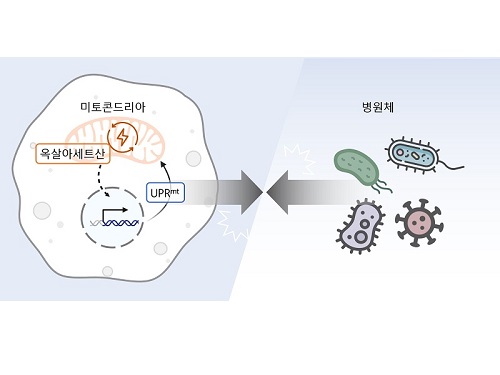 생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 8083
생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 8083 -
 전성윤 교수, 8시간 안에 항생제 조합 성능 확인하는 기술 개발
〈 김승규 연구원, 전성윤 교수 〉
우리 대학 기계공학과 전성윤 교수 연구팀(바이오미세유체 연구실)이 미세유체 칩을 이용해 두 개의 항생제 간 시너지 효과를 8시간 만에 검사할 수 있는 기술을 개발했다.
이번 연구는 항생제의 시너지 효과 검사에 최소 24시간 소요돼 활용이 어려웠던 기존 기술을 크게 개선한 것으로, 향후 환자들에게 적절한 항생제 조합치료를 할 수 있는 기반 기술이 될 것으로 기대된다.
김승규 석박사통합과정이 1 저자로 참여하고 생명과학과 정현정 교수 연구팀과 공동으로 수행한 이번 연구는 영국 왕립화학회(Royal Society of Chemistry)에서 발행하는 ‘랩온어칩(Lab on a Chip)’ 3월 21일 자 뒤표지 논문으로 게재됐다. (논문명 : On-chip phenotypic investigation of combinatory antibiotic effects by generating orthogonal concentration gradients, 직교 농도구배 형성을 통한 칩 상 항생제 조합 효과 검사)
항생제에 매우 높은 저항성을 갖는 ‘슈퍼박테리아’의 등장은 세계적으로 병원 및 관련 기관에 큰 위협으로 떠오르고 있다. 지난 2014년에는 세계보건기구(WHO)가 병원균의 항생제에 대한 내성이 심각한 수준에 도달했다고 공식적으로 처음 보고하기도 했다.
이러한 항생제 저항성 병원균을 효과적으로 억제하기 위해 두 종류 이상의 항생제를 섞어 처리하는 ‘항생제 조합 치료’가 주목받고 있지만, 항생제의 종류와 적정한 농도 범위가 큰 영향을 미쳐 정확한 조합을 해야 할뿐더러 치료가 항상 효과적이지는 않다는 문제점이 있다.
따라서 미지의 항생제 저항성 병원균을 대상으로 체외 항생제 조합 검사를 통해 적합한 항생제 조합과 농도 범위를 찾는 것은 매우 중요한 과정이다. 하지만 기존 검사 방식은 항생제 희석 및 샘플 준비 과정이 불편하고 결과 도출까지 24시간 이상이 걸려 대부분 경험적 치료에 의존하고 있다.
연구팀은 문제 해결을 위해 필요한 샘플 양이 수십 마이크로리터에 불과한 미세유체 칩을 이용했다. 머리카락 굵기 수준의 좁은 미세채널에서 유체 흐름을 제어할 수 있는 시스템인 미세유체 칩을 통해 두 개의 항생제 간 농도조합 121개를 단 35분 만에 자동으로 형성했다.
연구팀은 박테리아 샘플을 아가로스 젤과 섞어 미세채널에 주입해 굳힌 뒤 이를 둘러싸는 미세채널들에 각 항생제가 포함된 시약과 항생제가 포함되지 않은 시약을 주입했다.
항생제가 첨가된 채널로부터 항생제가 없는 채널로 항생제 분자들의 확산이 이뤄지고 결국 두 항생제의 조합이 박테리아가 굳혀있는 아가로스 젤에 35분 만에 형성된다. 연구팀은 이후 6시간 동안 억제되는 박테리아의 성장을 현미경을 통해 관찰했다.
연구팀은 서로 다른 항균 원리를 갖는 다섯 종류의 항생제를 두 개씩 조합해 녹농균(Pseudomonas aeruginosa)을 대상으로 항생제 조합 효능 검사를 시행했다. 그 결과 항생제 짝에 따라 각기 다른 항균효과를 확인할 수 있었고 검사한 항생제 짝의 시너지 관계를 분류할 수 있었다.
연구팀의 미세유체 칩 기반의 검사 방식은 번거로운 희석과정과 긴 검사 시간으로 인해 불편했던 기존 검사 방식을 크게 개선했다.
이전에도 전 교수 연구팀은 ‘미세유체 칩 기반의 항생제 효능 신속검사 기술’을 개발해 지난 2월 5일 ‘바이오마이크로플루이딕스(Biomicrofluidics)’지에 피처 기사로 게재한 바 있다. 이번 논문은 그 후속 연구로 미세유체 칩이 차세대 약물 검사 플랫폼으로 활용될 가능성을 제시했다는 의의가 있다.
연구책임자인 전 교수는 “미세유체 칩의 약물 검사 플랫폼으로써의 발전 가능성은 무궁무진하다”라며 “개발한 미세유체 칩이 상용화돼 실제 현장에서 항생제 조합치료를 위해 활용되기를 기대한다”라고 말했다.
이번 연구는 EEWS 기후변화연구허브사업과 교육부 이공분야기초연구사업 및 BK21 플러스프로그램의 지원을 받아 수행됐다.
그림 설명
그림1. Lab on a Chip 표지 이미지
그림2. 본 연구의 미세유체 칩과 분석결과 예시
2019.04.05 조회수 25616
전성윤 교수, 8시간 안에 항생제 조합 성능 확인하는 기술 개발
〈 김승규 연구원, 전성윤 교수 〉
우리 대학 기계공학과 전성윤 교수 연구팀(바이오미세유체 연구실)이 미세유체 칩을 이용해 두 개의 항생제 간 시너지 효과를 8시간 만에 검사할 수 있는 기술을 개발했다.
이번 연구는 항생제의 시너지 효과 검사에 최소 24시간 소요돼 활용이 어려웠던 기존 기술을 크게 개선한 것으로, 향후 환자들에게 적절한 항생제 조합치료를 할 수 있는 기반 기술이 될 것으로 기대된다.
김승규 석박사통합과정이 1 저자로 참여하고 생명과학과 정현정 교수 연구팀과 공동으로 수행한 이번 연구는 영국 왕립화학회(Royal Society of Chemistry)에서 발행하는 ‘랩온어칩(Lab on a Chip)’ 3월 21일 자 뒤표지 논문으로 게재됐다. (논문명 : On-chip phenotypic investigation of combinatory antibiotic effects by generating orthogonal concentration gradients, 직교 농도구배 형성을 통한 칩 상 항생제 조합 효과 검사)
항생제에 매우 높은 저항성을 갖는 ‘슈퍼박테리아’의 등장은 세계적으로 병원 및 관련 기관에 큰 위협으로 떠오르고 있다. 지난 2014년에는 세계보건기구(WHO)가 병원균의 항생제에 대한 내성이 심각한 수준에 도달했다고 공식적으로 처음 보고하기도 했다.
이러한 항생제 저항성 병원균을 효과적으로 억제하기 위해 두 종류 이상의 항생제를 섞어 처리하는 ‘항생제 조합 치료’가 주목받고 있지만, 항생제의 종류와 적정한 농도 범위가 큰 영향을 미쳐 정확한 조합을 해야 할뿐더러 치료가 항상 효과적이지는 않다는 문제점이 있다.
따라서 미지의 항생제 저항성 병원균을 대상으로 체외 항생제 조합 검사를 통해 적합한 항생제 조합과 농도 범위를 찾는 것은 매우 중요한 과정이다. 하지만 기존 검사 방식은 항생제 희석 및 샘플 준비 과정이 불편하고 결과 도출까지 24시간 이상이 걸려 대부분 경험적 치료에 의존하고 있다.
연구팀은 문제 해결을 위해 필요한 샘플 양이 수십 마이크로리터에 불과한 미세유체 칩을 이용했다. 머리카락 굵기 수준의 좁은 미세채널에서 유체 흐름을 제어할 수 있는 시스템인 미세유체 칩을 통해 두 개의 항생제 간 농도조합 121개를 단 35분 만에 자동으로 형성했다.
연구팀은 박테리아 샘플을 아가로스 젤과 섞어 미세채널에 주입해 굳힌 뒤 이를 둘러싸는 미세채널들에 각 항생제가 포함된 시약과 항생제가 포함되지 않은 시약을 주입했다.
항생제가 첨가된 채널로부터 항생제가 없는 채널로 항생제 분자들의 확산이 이뤄지고 결국 두 항생제의 조합이 박테리아가 굳혀있는 아가로스 젤에 35분 만에 형성된다. 연구팀은 이후 6시간 동안 억제되는 박테리아의 성장을 현미경을 통해 관찰했다.
연구팀은 서로 다른 항균 원리를 갖는 다섯 종류의 항생제를 두 개씩 조합해 녹농균(Pseudomonas aeruginosa)을 대상으로 항생제 조합 효능 검사를 시행했다. 그 결과 항생제 짝에 따라 각기 다른 항균효과를 확인할 수 있었고 검사한 항생제 짝의 시너지 관계를 분류할 수 있었다.
연구팀의 미세유체 칩 기반의 검사 방식은 번거로운 희석과정과 긴 검사 시간으로 인해 불편했던 기존 검사 방식을 크게 개선했다.
이전에도 전 교수 연구팀은 ‘미세유체 칩 기반의 항생제 효능 신속검사 기술’을 개발해 지난 2월 5일 ‘바이오마이크로플루이딕스(Biomicrofluidics)’지에 피처 기사로 게재한 바 있다. 이번 논문은 그 후속 연구로 미세유체 칩이 차세대 약물 검사 플랫폼으로 활용될 가능성을 제시했다는 의의가 있다.
연구책임자인 전 교수는 “미세유체 칩의 약물 검사 플랫폼으로써의 발전 가능성은 무궁무진하다”라며 “개발한 미세유체 칩이 상용화돼 실제 현장에서 항생제 조합치료를 위해 활용되기를 기대한다”라고 말했다.
이번 연구는 EEWS 기후변화연구허브사업과 교육부 이공분야기초연구사업 및 BK21 플러스프로그램의 지원을 받아 수행됐다.
그림 설명
그림1. Lab on a Chip 표지 이미지
그림2. 본 연구의 미세유체 칩과 분석결과 예시
2019.04.05 조회수 25616