-
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18
조회수 4763
-
 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08
조회수 5649
-
 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08
조회수 9982
-
 생체 내 조직 특이적 분비 단백질 표지 기법 개발
우리 대학 의과학대학원 서재명 교수 연구팀이 서울대학교 화학부 이현우 교수, 서울대학교 생명과학부 김종서 교수 연구팀과 공동연구를 통해 생체 내 조직 특이적 분비 단백질 표지 기법을 개발했다고 13일 밝혔다.
공동연구팀은 근접 표지 효소를 활용해 생쥐의 혈장 내에서 특정 조직이 분비하는 단백질만을 분리할 수 있는 기법을 개발했다. 이러한 체내 표지 기법은 지금까지의 체외 세포주 실험의 한계를 뛰어넘어 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
의과학대학원 김광은 석박사통합과정, 서울대학교 화학부 박이삭 석박사통합과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션즈(Nature Communications)' 9월 1일 字 온라인판에 출판됐다. (논문명 : Dynamic tracking and identification of tissue-specific secretory proteins in the circulation of live mice).
분비 단백질은 세포 및 조직 간의 신호 전달을 매개해 생리학적 기능을 조절하는 주요한 인자이며 질병 치료제의 주요 표적으로도 활용되고 있어 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다.
현재까지 대부분의 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다.
이를 극복하기 위해서는 체내 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다.
공동연구팀은 문제 해결을 위해 근접 표지 효소를 활용해 소포체 내강을 통하는 분비 단백질을 바이오틴으로 표지했다. 표지된 단백질은 스트렙타비딘을 이용해 손쉽게 검출하거나 분리할 수 있었다.
이 효소를 생쥐의 간에 전달한 후 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있음을 확인했다.
나아가 공동연구팀은 이 기법을 질병 모델에서 검증하기 위해 인슐린 저항성 생쥐 모델에 적용했고, 그 결과 인슐린 저항성과 관련이 있는 것으로 보고된 단백질들을 성공적으로 검출할 수 있었다.
공동연구팀은 추후 이 기법을 체내의 다양한 조직에 적용하거나 질환 모델과 결합해 질병의 진행 과정과 관련된 단백질을 검출할 수 있을 것으로 예상했다.
공동 제1 저자인 김광은 석박사통합과정은 "체내에서 간이 분비하는 단백질들은 세포주의 결과와는 크게 달랐고, 이는 기존 세포주를 이용한 분비 단백질 연구의 한계와 그 한계를 극복할 수 있는 이번 기법의 차별성을 보여주는 결과다ˮ라며 "체내 생리학적 상태를 더 온전하게 반영할 수 있는 바이오마커 및 치료 표적 발굴에 활용될 수 있을 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단, KAIST 중점연구소(융합연구단), 기초과학연구원의 지원을 받아 수행됐다.
생체 내 조직 특이적 분비 단백질 표지 기법 개발
우리 대학 의과학대학원 서재명 교수 연구팀이 서울대학교 화학부 이현우 교수, 서울대학교 생명과학부 김종서 교수 연구팀과 공동연구를 통해 생체 내 조직 특이적 분비 단백질 표지 기법을 개발했다고 13일 밝혔다.
공동연구팀은 근접 표지 효소를 활용해 생쥐의 혈장 내에서 특정 조직이 분비하는 단백질만을 분리할 수 있는 기법을 개발했다. 이러한 체내 표지 기법은 지금까지의 체외 세포주 실험의 한계를 뛰어넘어 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
의과학대학원 김광은 석박사통합과정, 서울대학교 화학부 박이삭 석박사통합과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션즈(Nature Communications)' 9월 1일 字 온라인판에 출판됐다. (논문명 : Dynamic tracking and identification of tissue-specific secretory proteins in the circulation of live mice).
분비 단백질은 세포 및 조직 간의 신호 전달을 매개해 생리학적 기능을 조절하는 주요한 인자이며 질병 치료제의 주요 표적으로도 활용되고 있어 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다.
현재까지 대부분의 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다.
이를 극복하기 위해서는 체내 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다.
공동연구팀은 문제 해결을 위해 근접 표지 효소를 활용해 소포체 내강을 통하는 분비 단백질을 바이오틴으로 표지했다. 표지된 단백질은 스트렙타비딘을 이용해 손쉽게 검출하거나 분리할 수 있었다.
이 효소를 생쥐의 간에 전달한 후 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있음을 확인했다.
나아가 공동연구팀은 이 기법을 질병 모델에서 검증하기 위해 인슐린 저항성 생쥐 모델에 적용했고, 그 결과 인슐린 저항성과 관련이 있는 것으로 보고된 단백질들을 성공적으로 검출할 수 있었다.
공동연구팀은 추후 이 기법을 체내의 다양한 조직에 적용하거나 질환 모델과 결합해 질병의 진행 과정과 관련된 단백질을 검출할 수 있을 것으로 예상했다.
공동 제1 저자인 김광은 석박사통합과정은 "체내에서 간이 분비하는 단백질들은 세포주의 결과와는 크게 달랐고, 이는 기존 세포주를 이용한 분비 단백질 연구의 한계와 그 한계를 극복할 수 있는 이번 기법의 차별성을 보여주는 결과다ˮ라며 "체내 생리학적 상태를 더 온전하게 반영할 수 있는 바이오마커 및 치료 표적 발굴에 활용될 수 있을 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단, KAIST 중점연구소(융합연구단), 기초과학연구원의 지원을 받아 수행됐다.
2021.09.13
조회수 13284
-
 자연에 없는 고감도 단백질 센서 제작 플랫폼 개발
우리 대학 생명과학과 오병하 교수가 미국 워싱턴주립대학 (University of Washington)과 국제 공동연구를 수행해 고감도의 단백질 센서 플랫폼을 개발했다고 5일 밝혔다.
단백질 센서들은 질병의 진단, 치료 경과의 추적, 병원 미생물의 감지 등에 널리 사용되고 있다. 상용되고 있는 단백질 센서들은 자연계에 존재하는 단백질이거나 이를 약간 변형한 형태이며 개발에는 많은 시간이 소요된다.
공동연구팀은 자연에 존재하는 단백질에 의존하지 않고 계산적 단백질 디자인 방법으로 인공적인 골격 단백질을 창출했으며 이를 두 부분으로 나누고 심해 새우가 만드는 발광 단백질과 재조합해 단백질을 감지하는 기능을 부여했다. 이렇게 만들어진 두 요소(two-component) 단백질 시스템은 그 자체로는 발광하지 않다가 감지하려는 표적 단백질이 존재하면 이와 결합하고 결과적으로 발광하도록 디자인돼있다.
그리고 그 발광 정도는 표적 단백질의 농도에 비례해 빛을 발생하기 때문에 발광의 세기를 측정함으로써 표적 단백질의 존재와 그 농도를 감지할 수 있다. 발생하는 빛은 시료의 전처리 없이도 감지할 수 있고, 발광 반응은 즉각적이며 1시간 안에 종료되기 때문에 기존 발색 반응의 측정보다 쉽다는 장점이 있다.
연구진이 창출한 단백질 시스템은 마치 레고 블록처럼 사용돼 여러 다양한 단백질 센서를 용이하게 제작하는데 쓸 수 있는 플랫폼을 제공한다. 실제로 발표된 논문에는 B형 간염 바이러스 단백질 센서, 코로나바이러스 단백질 센서 등 8개의 고감도 단백질 센서를 실제로 제작해 이 단백질 센서 플랫폼의 높은 응용성을 보여준다.
한편 이 단백질 센서의 작동 방식은 자연계에서는 그 예를 찾을 수 없어 자연의 모방을 넘어 자연에 존재하지 않는 단백질과 기능을 창출할 수 있다는 예를 보여준다.
이번 연구는 LG연암문화재단의 지원으로 오병하 교수가 미국 워싱턴 주립대학 데이비드 베이커(David Baker) 교수 실험실에 1년간 방문한 공동연구로 진행됐으며, 생명과학과 이한솔 박사와 강원대학교 홍효정 교수가 참여했다. 수행된 이번 연구 결과는 연구의 우수성을 인정받아 종합 과학 분야의 국제학술지 `네이처(Nature)'에 1월 27일 字 게재됐다. (논문명 : De novo design of modular and tunable protein biosensors)
자연에 없는 고감도 단백질 센서 제작 플랫폼 개발
우리 대학 생명과학과 오병하 교수가 미국 워싱턴주립대학 (University of Washington)과 국제 공동연구를 수행해 고감도의 단백질 센서 플랫폼을 개발했다고 5일 밝혔다.
단백질 센서들은 질병의 진단, 치료 경과의 추적, 병원 미생물의 감지 등에 널리 사용되고 있다. 상용되고 있는 단백질 센서들은 자연계에 존재하는 단백질이거나 이를 약간 변형한 형태이며 개발에는 많은 시간이 소요된다.
공동연구팀은 자연에 존재하는 단백질에 의존하지 않고 계산적 단백질 디자인 방법으로 인공적인 골격 단백질을 창출했으며 이를 두 부분으로 나누고 심해 새우가 만드는 발광 단백질과 재조합해 단백질을 감지하는 기능을 부여했다. 이렇게 만들어진 두 요소(two-component) 단백질 시스템은 그 자체로는 발광하지 않다가 감지하려는 표적 단백질이 존재하면 이와 결합하고 결과적으로 발광하도록 디자인돼있다.
그리고 그 발광 정도는 표적 단백질의 농도에 비례해 빛을 발생하기 때문에 발광의 세기를 측정함으로써 표적 단백질의 존재와 그 농도를 감지할 수 있다. 발생하는 빛은 시료의 전처리 없이도 감지할 수 있고, 발광 반응은 즉각적이며 1시간 안에 종료되기 때문에 기존 발색 반응의 측정보다 쉽다는 장점이 있다.
연구진이 창출한 단백질 시스템은 마치 레고 블록처럼 사용돼 여러 다양한 단백질 센서를 용이하게 제작하는데 쓸 수 있는 플랫폼을 제공한다. 실제로 발표된 논문에는 B형 간염 바이러스 단백질 센서, 코로나바이러스 단백질 센서 등 8개의 고감도 단백질 센서를 실제로 제작해 이 단백질 센서 플랫폼의 높은 응용성을 보여준다.
한편 이 단백질 센서의 작동 방식은 자연계에서는 그 예를 찾을 수 없어 자연의 모방을 넘어 자연에 존재하지 않는 단백질과 기능을 창출할 수 있다는 예를 보여준다.
이번 연구는 LG연암문화재단의 지원으로 오병하 교수가 미국 워싱턴 주립대학 데이비드 베이커(David Baker) 교수 실험실에 1년간 방문한 공동연구로 진행됐으며, 생명과학과 이한솔 박사와 강원대학교 홍효정 교수가 참여했다. 수행된 이번 연구 결과는 연구의 우수성을 인정받아 종합 과학 분야의 국제학술지 `네이처(Nature)'에 1월 27일 字 게재됐다. (논문명 : De novo design of modular and tunable protein biosensors)
2021.02.05
조회수 77368
-
 항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25
조회수 33780
-
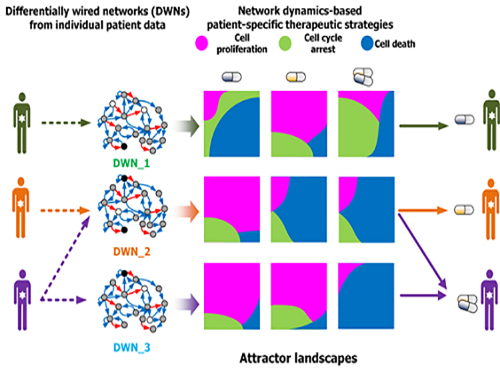 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07
조회수 25033
-
 조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07
조회수 25507
-
 박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06
조회수 20442
-
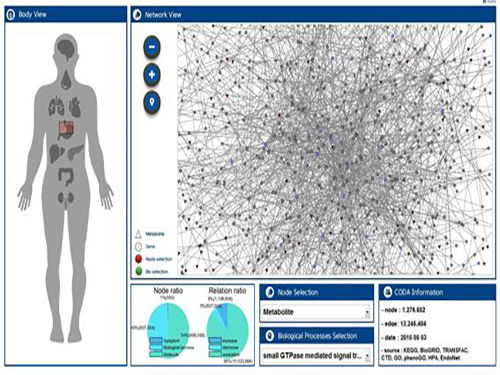 복합 처방된 약물의 부작용 예측 기술 개발
〈이 도 헌 교수〉
우리 대학 바이오및뇌공학과 이도헌 교수(유전자동의보감사업단장, 제 1저자 박경현 연구원) 연구팀이 복합 처방된 약물들의 인체 내 간섭현상을 컴퓨터 가상인체로 분석해 부작용을 예측할 수 있는 기술을 개발했다.
이번 연구결과는 미국 공공과학도서관 학술지 플러스 원(PLOS ONE) 10월 15일자에 게재됐다.
의료 현장에서는 여러 약물을 함께 처방받아 복약하는 경우가 많다. 이러한 복합처방은 모든 가능성을 미리 시험할 수 없기 때문에 널리 알려진 대표적 위험사례를 제외하면 완벽한 사전시험이 불가능하다.
기존에는 부작용 사례를 의약품 적정사용평가(DUR)에 등재시켜 의료현장에서 활용하는 사후 추적만이 최선의 방법이었다. 따라서 복합처방으로 인한 의료 사고를 막기 어려웠고 부작용 예측에도 한계가 있었다.
문제 해결을 위해 연구팀은 발생 가능한 상황을 사전에 컴퓨터 가상인체로 예측함으로써 위험을 미리 파악할 수 있는 기술을 개발했다.
연구팀은 컴퓨터 가상인체에서 랜덤워크 알고리즘을 이용해 약물 표적의 생체 내 분자 신호전파를 시뮬레이션 했다. 약물이 투여됨으로써 신체에 영향을 끼치는 정도를 측정한 것인데, 이를 통해 두 개의 약물이 서로 어느 정도의 영향을 주는지 정량화에 성공했다.
따라서 만약 두 약물 간 간섭이 심해 서로 많은 영향을 준다면 부작용이 발생할 가능성이 높기 때문에 신중한 처방을 해야한다는 결론을 얻을 수 있다.
기존 예측 기술들이 단백질 상호작용 네트워크에서 약물 표적사이의 근거리 간섭만을 고려했다면 이 교수 연구팀은 약물 표적의 생체 내 분자 신호전파 시뮬레이션을 통해 원거리 간섭까지 고려해 정확도를 높였다.
연구팀은 이 기술이 다수의 표적을 갖는 복합 천연물의 신호 전파도 분석해 약물과 천연물 사이의 상호작용 예측에도 활용될 것이라고 예상했다.
이 교수는 “이번 기술은 자체 개발한 대규모 컴퓨터 가상인체 시스템을 통해 진행됐다”며 “약물 복합처방의 부작용을 예측할 수 있는 새로운 방법을 제시했다는 의의를 갖는다”고 말했다.
□ 그림 설명
그림 1. 연구팀이 개발한 컴퓨터 가상인체 시스템
그림 2 . 처방된 복합 약물 사이의 신호전파 간섭 예시
복합 처방된 약물의 부작용 예측 기술 개발
〈이 도 헌 교수〉
우리 대학 바이오및뇌공학과 이도헌 교수(유전자동의보감사업단장, 제 1저자 박경현 연구원) 연구팀이 복합 처방된 약물들의 인체 내 간섭현상을 컴퓨터 가상인체로 분석해 부작용을 예측할 수 있는 기술을 개발했다.
이번 연구결과는 미국 공공과학도서관 학술지 플러스 원(PLOS ONE) 10월 15일자에 게재됐다.
의료 현장에서는 여러 약물을 함께 처방받아 복약하는 경우가 많다. 이러한 복합처방은 모든 가능성을 미리 시험할 수 없기 때문에 널리 알려진 대표적 위험사례를 제외하면 완벽한 사전시험이 불가능하다.
기존에는 부작용 사례를 의약품 적정사용평가(DUR)에 등재시켜 의료현장에서 활용하는 사후 추적만이 최선의 방법이었다. 따라서 복합처방으로 인한 의료 사고를 막기 어려웠고 부작용 예측에도 한계가 있었다.
문제 해결을 위해 연구팀은 발생 가능한 상황을 사전에 컴퓨터 가상인체로 예측함으로써 위험을 미리 파악할 수 있는 기술을 개발했다.
연구팀은 컴퓨터 가상인체에서 랜덤워크 알고리즘을 이용해 약물 표적의 생체 내 분자 신호전파를 시뮬레이션 했다. 약물이 투여됨으로써 신체에 영향을 끼치는 정도를 측정한 것인데, 이를 통해 두 개의 약물이 서로 어느 정도의 영향을 주는지 정량화에 성공했다.
따라서 만약 두 약물 간 간섭이 심해 서로 많은 영향을 준다면 부작용이 발생할 가능성이 높기 때문에 신중한 처방을 해야한다는 결론을 얻을 수 있다.
기존 예측 기술들이 단백질 상호작용 네트워크에서 약물 표적사이의 근거리 간섭만을 고려했다면 이 교수 연구팀은 약물 표적의 생체 내 분자 신호전파 시뮬레이션을 통해 원거리 간섭까지 고려해 정확도를 높였다.
연구팀은 이 기술이 다수의 표적을 갖는 복합 천연물의 신호 전파도 분석해 약물과 천연물 사이의 상호작용 예측에도 활용될 것이라고 예상했다.
이 교수는 “이번 기술은 자체 개발한 대규모 컴퓨터 가상인체 시스템을 통해 진행됐다”며 “약물 복합처방의 부작용을 예측할 수 있는 새로운 방법을 제시했다는 의의를 갖는다”고 말했다.
□ 그림 설명
그림 1. 연구팀이 개발한 컴퓨터 가상인체 시스템
그림 2 . 처방된 복합 약물 사이의 신호전파 간섭 예시
2015.10.22
조회수 12166
-
 시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12
조회수 26938
-
 신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
2011.06.29
조회수 18265
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4763
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4763 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5649
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5649 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9982
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9982 생체 내 조직 특이적 분비 단백질 표지 기법 개발
우리 대학 의과학대학원 서재명 교수 연구팀이 서울대학교 화학부 이현우 교수, 서울대학교 생명과학부 김종서 교수 연구팀과 공동연구를 통해 생체 내 조직 특이적 분비 단백질 표지 기법을 개발했다고 13일 밝혔다.
공동연구팀은 근접 표지 효소를 활용해 생쥐의 혈장 내에서 특정 조직이 분비하는 단백질만을 분리할 수 있는 기법을 개발했다. 이러한 체내 표지 기법은 지금까지의 체외 세포주 실험의 한계를 뛰어넘어 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
의과학대학원 김광은 석박사통합과정, 서울대학교 화학부 박이삭 석박사통합과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션즈(Nature Communications)' 9월 1일 字 온라인판에 출판됐다. (논문명 : Dynamic tracking and identification of tissue-specific secretory proteins in the circulation of live mice).
분비 단백질은 세포 및 조직 간의 신호 전달을 매개해 생리학적 기능을 조절하는 주요한 인자이며 질병 치료제의 주요 표적으로도 활용되고 있어 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다.
현재까지 대부분의 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다.
이를 극복하기 위해서는 체내 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다.
공동연구팀은 문제 해결을 위해 근접 표지 효소를 활용해 소포체 내강을 통하는 분비 단백질을 바이오틴으로 표지했다. 표지된 단백질은 스트렙타비딘을 이용해 손쉽게 검출하거나 분리할 수 있었다.
이 효소를 생쥐의 간에 전달한 후 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있음을 확인했다.
나아가 공동연구팀은 이 기법을 질병 모델에서 검증하기 위해 인슐린 저항성 생쥐 모델에 적용했고, 그 결과 인슐린 저항성과 관련이 있는 것으로 보고된 단백질들을 성공적으로 검출할 수 있었다.
공동연구팀은 추후 이 기법을 체내의 다양한 조직에 적용하거나 질환 모델과 결합해 질병의 진행 과정과 관련된 단백질을 검출할 수 있을 것으로 예상했다.
공동 제1 저자인 김광은 석박사통합과정은 "체내에서 간이 분비하는 단백질들은 세포주의 결과와는 크게 달랐고, 이는 기존 세포주를 이용한 분비 단백질 연구의 한계와 그 한계를 극복할 수 있는 이번 기법의 차별성을 보여주는 결과다ˮ라며 "체내 생리학적 상태를 더 온전하게 반영할 수 있는 바이오마커 및 치료 표적 발굴에 활용될 수 있을 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단, KAIST 중점연구소(융합연구단), 기초과학연구원의 지원을 받아 수행됐다.
2021.09.13 조회수 13284
생체 내 조직 특이적 분비 단백질 표지 기법 개발
우리 대학 의과학대학원 서재명 교수 연구팀이 서울대학교 화학부 이현우 교수, 서울대학교 생명과학부 김종서 교수 연구팀과 공동연구를 통해 생체 내 조직 특이적 분비 단백질 표지 기법을 개발했다고 13일 밝혔다.
공동연구팀은 근접 표지 효소를 활용해 생쥐의 혈장 내에서 특정 조직이 분비하는 단백질만을 분리할 수 있는 기법을 개발했다. 이러한 체내 표지 기법은 지금까지의 체외 세포주 실험의 한계를 뛰어넘어 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
의과학대학원 김광은 석박사통합과정, 서울대학교 화학부 박이삭 석박사통합과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션즈(Nature Communications)' 9월 1일 字 온라인판에 출판됐다. (논문명 : Dynamic tracking and identification of tissue-specific secretory proteins in the circulation of live mice).
분비 단백질은 세포 및 조직 간의 신호 전달을 매개해 생리학적 기능을 조절하는 주요한 인자이며 질병 치료제의 주요 표적으로도 활용되고 있어 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다.
현재까지 대부분의 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다.
이를 극복하기 위해서는 체내 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다.
공동연구팀은 문제 해결을 위해 근접 표지 효소를 활용해 소포체 내강을 통하는 분비 단백질을 바이오틴으로 표지했다. 표지된 단백질은 스트렙타비딘을 이용해 손쉽게 검출하거나 분리할 수 있었다.
이 효소를 생쥐의 간에 전달한 후 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있음을 확인했다.
나아가 공동연구팀은 이 기법을 질병 모델에서 검증하기 위해 인슐린 저항성 생쥐 모델에 적용했고, 그 결과 인슐린 저항성과 관련이 있는 것으로 보고된 단백질들을 성공적으로 검출할 수 있었다.
공동연구팀은 추후 이 기법을 체내의 다양한 조직에 적용하거나 질환 모델과 결합해 질병의 진행 과정과 관련된 단백질을 검출할 수 있을 것으로 예상했다.
공동 제1 저자인 김광은 석박사통합과정은 "체내에서 간이 분비하는 단백질들은 세포주의 결과와는 크게 달랐고, 이는 기존 세포주를 이용한 분비 단백질 연구의 한계와 그 한계를 극복할 수 있는 이번 기법의 차별성을 보여주는 결과다ˮ라며 "체내 생리학적 상태를 더 온전하게 반영할 수 있는 바이오마커 및 치료 표적 발굴에 활용될 수 있을 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단, KAIST 중점연구소(융합연구단), 기초과학연구원의 지원을 받아 수행됐다.
2021.09.13 조회수 13284 자연에 없는 고감도 단백질 센서 제작 플랫폼 개발
우리 대학 생명과학과 오병하 교수가 미국 워싱턴주립대학 (University of Washington)과 국제 공동연구를 수행해 고감도의 단백질 센서 플랫폼을 개발했다고 5일 밝혔다.
단백질 센서들은 질병의 진단, 치료 경과의 추적, 병원 미생물의 감지 등에 널리 사용되고 있다. 상용되고 있는 단백질 센서들은 자연계에 존재하는 단백질이거나 이를 약간 변형한 형태이며 개발에는 많은 시간이 소요된다.
공동연구팀은 자연에 존재하는 단백질에 의존하지 않고 계산적 단백질 디자인 방법으로 인공적인 골격 단백질을 창출했으며 이를 두 부분으로 나누고 심해 새우가 만드는 발광 단백질과 재조합해 단백질을 감지하는 기능을 부여했다. 이렇게 만들어진 두 요소(two-component) 단백질 시스템은 그 자체로는 발광하지 않다가 감지하려는 표적 단백질이 존재하면 이와 결합하고 결과적으로 발광하도록 디자인돼있다.
그리고 그 발광 정도는 표적 단백질의 농도에 비례해 빛을 발생하기 때문에 발광의 세기를 측정함으로써 표적 단백질의 존재와 그 농도를 감지할 수 있다. 발생하는 빛은 시료의 전처리 없이도 감지할 수 있고, 발광 반응은 즉각적이며 1시간 안에 종료되기 때문에 기존 발색 반응의 측정보다 쉽다는 장점이 있다.
연구진이 창출한 단백질 시스템은 마치 레고 블록처럼 사용돼 여러 다양한 단백질 센서를 용이하게 제작하는데 쓸 수 있는 플랫폼을 제공한다. 실제로 발표된 논문에는 B형 간염 바이러스 단백질 센서, 코로나바이러스 단백질 센서 등 8개의 고감도 단백질 센서를 실제로 제작해 이 단백질 센서 플랫폼의 높은 응용성을 보여준다.
한편 이 단백질 센서의 작동 방식은 자연계에서는 그 예를 찾을 수 없어 자연의 모방을 넘어 자연에 존재하지 않는 단백질과 기능을 창출할 수 있다는 예를 보여준다.
이번 연구는 LG연암문화재단의 지원으로 오병하 교수가 미국 워싱턴 주립대학 데이비드 베이커(David Baker) 교수 실험실에 1년간 방문한 공동연구로 진행됐으며, 생명과학과 이한솔 박사와 강원대학교 홍효정 교수가 참여했다. 수행된 이번 연구 결과는 연구의 우수성을 인정받아 종합 과학 분야의 국제학술지 `네이처(Nature)'에 1월 27일 字 게재됐다. (논문명 : De novo design of modular and tunable protein biosensors)
2021.02.05 조회수 77368
자연에 없는 고감도 단백질 센서 제작 플랫폼 개발
우리 대학 생명과학과 오병하 교수가 미국 워싱턴주립대학 (University of Washington)과 국제 공동연구를 수행해 고감도의 단백질 센서 플랫폼을 개발했다고 5일 밝혔다.
단백질 센서들은 질병의 진단, 치료 경과의 추적, 병원 미생물의 감지 등에 널리 사용되고 있다. 상용되고 있는 단백질 센서들은 자연계에 존재하는 단백질이거나 이를 약간 변형한 형태이며 개발에는 많은 시간이 소요된다.
공동연구팀은 자연에 존재하는 단백질에 의존하지 않고 계산적 단백질 디자인 방법으로 인공적인 골격 단백질을 창출했으며 이를 두 부분으로 나누고 심해 새우가 만드는 발광 단백질과 재조합해 단백질을 감지하는 기능을 부여했다. 이렇게 만들어진 두 요소(two-component) 단백질 시스템은 그 자체로는 발광하지 않다가 감지하려는 표적 단백질이 존재하면 이와 결합하고 결과적으로 발광하도록 디자인돼있다.
그리고 그 발광 정도는 표적 단백질의 농도에 비례해 빛을 발생하기 때문에 발광의 세기를 측정함으로써 표적 단백질의 존재와 그 농도를 감지할 수 있다. 발생하는 빛은 시료의 전처리 없이도 감지할 수 있고, 발광 반응은 즉각적이며 1시간 안에 종료되기 때문에 기존 발색 반응의 측정보다 쉽다는 장점이 있다.
연구진이 창출한 단백질 시스템은 마치 레고 블록처럼 사용돼 여러 다양한 단백질 센서를 용이하게 제작하는데 쓸 수 있는 플랫폼을 제공한다. 실제로 발표된 논문에는 B형 간염 바이러스 단백질 센서, 코로나바이러스 단백질 센서 등 8개의 고감도 단백질 센서를 실제로 제작해 이 단백질 센서 플랫폼의 높은 응용성을 보여준다.
한편 이 단백질 센서의 작동 방식은 자연계에서는 그 예를 찾을 수 없어 자연의 모방을 넘어 자연에 존재하지 않는 단백질과 기능을 창출할 수 있다는 예를 보여준다.
이번 연구는 LG연암문화재단의 지원으로 오병하 교수가 미국 워싱턴 주립대학 데이비드 베이커(David Baker) 교수 실험실에 1년간 방문한 공동연구로 진행됐으며, 생명과학과 이한솔 박사와 강원대학교 홍효정 교수가 참여했다. 수행된 이번 연구 결과는 연구의 우수성을 인정받아 종합 과학 분야의 국제학술지 `네이처(Nature)'에 1월 27일 字 게재됐다. (논문명 : De novo design of modular and tunable protein biosensors)
2021.02.05 조회수 77368 항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 33780
항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 33780 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 25033
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 25033 조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 25507
조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 25507 박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06 조회수 20442
박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06 조회수 20442 복합 처방된 약물의 부작용 예측 기술 개발
〈이 도 헌 교수〉
우리 대학 바이오및뇌공학과 이도헌 교수(유전자동의보감사업단장, 제 1저자 박경현 연구원) 연구팀이 복합 처방된 약물들의 인체 내 간섭현상을 컴퓨터 가상인체로 분석해 부작용을 예측할 수 있는 기술을 개발했다.
이번 연구결과는 미국 공공과학도서관 학술지 플러스 원(PLOS ONE) 10월 15일자에 게재됐다.
의료 현장에서는 여러 약물을 함께 처방받아 복약하는 경우가 많다. 이러한 복합처방은 모든 가능성을 미리 시험할 수 없기 때문에 널리 알려진 대표적 위험사례를 제외하면 완벽한 사전시험이 불가능하다.
기존에는 부작용 사례를 의약품 적정사용평가(DUR)에 등재시켜 의료현장에서 활용하는 사후 추적만이 최선의 방법이었다. 따라서 복합처방으로 인한 의료 사고를 막기 어려웠고 부작용 예측에도 한계가 있었다.
문제 해결을 위해 연구팀은 발생 가능한 상황을 사전에 컴퓨터 가상인체로 예측함으로써 위험을 미리 파악할 수 있는 기술을 개발했다.
연구팀은 컴퓨터 가상인체에서 랜덤워크 알고리즘을 이용해 약물 표적의 생체 내 분자 신호전파를 시뮬레이션 했다. 약물이 투여됨으로써 신체에 영향을 끼치는 정도를 측정한 것인데, 이를 통해 두 개의 약물이 서로 어느 정도의 영향을 주는지 정량화에 성공했다.
따라서 만약 두 약물 간 간섭이 심해 서로 많은 영향을 준다면 부작용이 발생할 가능성이 높기 때문에 신중한 처방을 해야한다는 결론을 얻을 수 있다.
기존 예측 기술들이 단백질 상호작용 네트워크에서 약물 표적사이의 근거리 간섭만을 고려했다면 이 교수 연구팀은 약물 표적의 생체 내 분자 신호전파 시뮬레이션을 통해 원거리 간섭까지 고려해 정확도를 높였다.
연구팀은 이 기술이 다수의 표적을 갖는 복합 천연물의 신호 전파도 분석해 약물과 천연물 사이의 상호작용 예측에도 활용될 것이라고 예상했다.
이 교수는 “이번 기술은 자체 개발한 대규모 컴퓨터 가상인체 시스템을 통해 진행됐다”며 “약물 복합처방의 부작용을 예측할 수 있는 새로운 방법을 제시했다는 의의를 갖는다”고 말했다.
□ 그림 설명
그림 1. 연구팀이 개발한 컴퓨터 가상인체 시스템
그림 2 . 처방된 복합 약물 사이의 신호전파 간섭 예시
2015.10.22 조회수 12166
복합 처방된 약물의 부작용 예측 기술 개발
〈이 도 헌 교수〉
우리 대학 바이오및뇌공학과 이도헌 교수(유전자동의보감사업단장, 제 1저자 박경현 연구원) 연구팀이 복합 처방된 약물들의 인체 내 간섭현상을 컴퓨터 가상인체로 분석해 부작용을 예측할 수 있는 기술을 개발했다.
이번 연구결과는 미국 공공과학도서관 학술지 플러스 원(PLOS ONE) 10월 15일자에 게재됐다.
의료 현장에서는 여러 약물을 함께 처방받아 복약하는 경우가 많다. 이러한 복합처방은 모든 가능성을 미리 시험할 수 없기 때문에 널리 알려진 대표적 위험사례를 제외하면 완벽한 사전시험이 불가능하다.
기존에는 부작용 사례를 의약품 적정사용평가(DUR)에 등재시켜 의료현장에서 활용하는 사후 추적만이 최선의 방법이었다. 따라서 복합처방으로 인한 의료 사고를 막기 어려웠고 부작용 예측에도 한계가 있었다.
문제 해결을 위해 연구팀은 발생 가능한 상황을 사전에 컴퓨터 가상인체로 예측함으로써 위험을 미리 파악할 수 있는 기술을 개발했다.
연구팀은 컴퓨터 가상인체에서 랜덤워크 알고리즘을 이용해 약물 표적의 생체 내 분자 신호전파를 시뮬레이션 했다. 약물이 투여됨으로써 신체에 영향을 끼치는 정도를 측정한 것인데, 이를 통해 두 개의 약물이 서로 어느 정도의 영향을 주는지 정량화에 성공했다.
따라서 만약 두 약물 간 간섭이 심해 서로 많은 영향을 준다면 부작용이 발생할 가능성이 높기 때문에 신중한 처방을 해야한다는 결론을 얻을 수 있다.
기존 예측 기술들이 단백질 상호작용 네트워크에서 약물 표적사이의 근거리 간섭만을 고려했다면 이 교수 연구팀은 약물 표적의 생체 내 분자 신호전파 시뮬레이션을 통해 원거리 간섭까지 고려해 정확도를 높였다.
연구팀은 이 기술이 다수의 표적을 갖는 복합 천연물의 신호 전파도 분석해 약물과 천연물 사이의 상호작용 예측에도 활용될 것이라고 예상했다.
이 교수는 “이번 기술은 자체 개발한 대규모 컴퓨터 가상인체 시스템을 통해 진행됐다”며 “약물 복합처방의 부작용을 예측할 수 있는 새로운 방법을 제시했다는 의의를 갖는다”고 말했다.
□ 그림 설명
그림 1. 연구팀이 개발한 컴퓨터 가상인체 시스템
그림 2 . 처방된 복합 약물 사이의 신호전파 간섭 예시
2015.10.22 조회수 12166 시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26938
시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26938 신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
2011.06.29 조회수 18265
신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
2011.06.29 조회수 18265