-
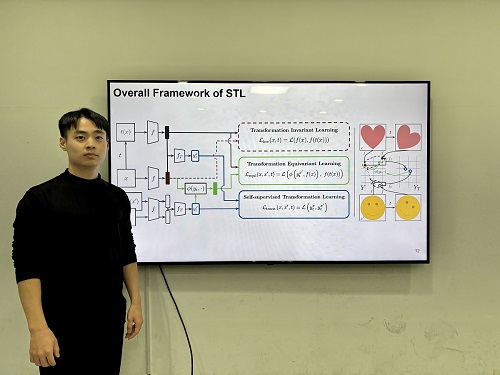 인간의 인지 방식과 유사한 AI 모델 개발
우리 연구진이 인간의 인지 방식을 모방해 이미지 변화를 이해하고, 시각적 일반화와 특정성을 동시에 확보하는 인공지능 기술을 개발했다. 이 기술은 의료 영상 분석, 자율주행, 로보틱스 등 다양한 분야에서 이미지를 이해하여 객체를 분류, 탐지하는 데 활용될 전망이다.
우리 대학 전기및전자공학부 김준모 교수 연구팀이 변환 레이블(transformational labels) 없이도 스스로 변환 민감 특징(transformation-sensitive features)을 학습할 수 있는 새로운 시각 인공지능 모델 STL(Self-supervised Transformation Learning)을 개발했다고 13일 밝혔다.
연구팀이 개발한 시각 인공지능 모델 STL은 스스로 이미지의 변환을 학습하여, 이미지 변환의 종류를 인간이 직접 알려주면서 학습하는 기존 방법들보다 높은 시각 정보 이해 능력을 보였다. 특히, 기존 방법론들을 통해 학습한 모델이 이해할 수 없는 세부적인 특징까지도 학습하여 기존 방법 대비 최대 42% 우수한 성능을 보여줬다.
컴퓨터 비전에서 이미지 변환을 통한 데이터 증강을 활용해 강건한 시각 표현을 학습하는 방식은 일반화 능력을 갖추는 데 효과적이지만, 변환에 따른 시각적 세부 사항을 무시하는 경향이 있어 범용 시각 인공지능 모델로서 한계가 있다.
연구팀이 제안한 STL은 변환 라벨 없이 변환 정보를 학습할 수 있도록 설계된 새로운 학습 기법으로, 라벨 없이 변환 민감 특징을 학습할 수 있다. 또한, 기존 학습 방법 대비 학습 복잡도를 유지한 채로 효율적인 최적화할 수 있는 방법을 제안했다.
실험 결과, STL은 정확하게 객체를 분류하고 탐지 실험에서 가장 낮은 오류율을 기록했다. 또한, STL이 생성한 표현 공간은 변환의 강도와 유형에 따라 명확히 군집화되어 변환 간 관계를 잘 반영하는 것으로 나타났다.
김준모 교수는 "이번에 개발한 STL은 복잡한 변환 패턴을 학습하고 이를 표현 공간에서 효과적으로 반영하는 능력을 통해 변환 민감 특징 학습의 새로운 가능성을 제시했다”며, "라벨 없이도 변환 정보를 학습할 수 있는 기술은 다양한 AI 응용 분야에서 핵심적인 역할을 할 것”이라고 말했다.
우리 대학 전기및전자공학부 유재명 박사과정이 제1 저자로 참여한 이번 연구는 최고 권위 국제 학술지 ‘신경정보처리시스템학회(NeurIPS) 2024’에서 올 12월 발표될 예정이다.(논문명: Self-supervised Transformation Learning for Equivariant Representations)
한편 이번 연구는 이 논문은 2024년도 정부(과학기술정보통신부)의 재원으로 정보통신기획평가원의 지원을 받아 수행된 연구 성과물(No.RS-2024-00439020, 지속가능한 실시간 멀티모달 인터렉티브 생성 AI 개발, SW스타랩) 이다.
인간의 인지 방식과 유사한 AI 모델 개발
우리 연구진이 인간의 인지 방식을 모방해 이미지 변화를 이해하고, 시각적 일반화와 특정성을 동시에 확보하는 인공지능 기술을 개발했다. 이 기술은 의료 영상 분석, 자율주행, 로보틱스 등 다양한 분야에서 이미지를 이해하여 객체를 분류, 탐지하는 데 활용될 전망이다.
우리 대학 전기및전자공학부 김준모 교수 연구팀이 변환 레이블(transformational labels) 없이도 스스로 변환 민감 특징(transformation-sensitive features)을 학습할 수 있는 새로운 시각 인공지능 모델 STL(Self-supervised Transformation Learning)을 개발했다고 13일 밝혔다.
연구팀이 개발한 시각 인공지능 모델 STL은 스스로 이미지의 변환을 학습하여, 이미지 변환의 종류를 인간이 직접 알려주면서 학습하는 기존 방법들보다 높은 시각 정보 이해 능력을 보였다. 특히, 기존 방법론들을 통해 학습한 모델이 이해할 수 없는 세부적인 특징까지도 학습하여 기존 방법 대비 최대 42% 우수한 성능을 보여줬다.
컴퓨터 비전에서 이미지 변환을 통한 데이터 증강을 활용해 강건한 시각 표현을 학습하는 방식은 일반화 능력을 갖추는 데 효과적이지만, 변환에 따른 시각적 세부 사항을 무시하는 경향이 있어 범용 시각 인공지능 모델로서 한계가 있다.
연구팀이 제안한 STL은 변환 라벨 없이 변환 정보를 학습할 수 있도록 설계된 새로운 학습 기법으로, 라벨 없이 변환 민감 특징을 학습할 수 있다. 또한, 기존 학습 방법 대비 학습 복잡도를 유지한 채로 효율적인 최적화할 수 있는 방법을 제안했다.
실험 결과, STL은 정확하게 객체를 분류하고 탐지 실험에서 가장 낮은 오류율을 기록했다. 또한, STL이 생성한 표현 공간은 변환의 강도와 유형에 따라 명확히 군집화되어 변환 간 관계를 잘 반영하는 것으로 나타났다.
김준모 교수는 "이번에 개발한 STL은 복잡한 변환 패턴을 학습하고 이를 표현 공간에서 효과적으로 반영하는 능력을 통해 변환 민감 특징 학습의 새로운 가능성을 제시했다”며, "라벨 없이도 변환 정보를 학습할 수 있는 기술은 다양한 AI 응용 분야에서 핵심적인 역할을 할 것”이라고 말했다.
우리 대학 전기및전자공학부 유재명 박사과정이 제1 저자로 참여한 이번 연구는 최고 권위 국제 학술지 ‘신경정보처리시스템학회(NeurIPS) 2024’에서 올 12월 발표될 예정이다.(논문명: Self-supervised Transformation Learning for Equivariant Representations)
한편 이번 연구는 이 논문은 2024년도 정부(과학기술정보통신부)의 재원으로 정보통신기획평가원의 지원을 받아 수행된 연구 성과물(No.RS-2024-00439020, 지속가능한 실시간 멀티모달 인터렉티브 생성 AI 개발, SW스타랩) 이다.
2024.12.15
조회수 4715
-
 흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21
조회수 6373
-
 체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26
조회수 9322
-
 김준 교수, 난치성 유전질환인 섬모병증 치료제 후보 발굴
〈 김준 교수, 김용준 박사과정 〉
우리 대학 의과학대학원 김준 교수가 연세대학교 생명공학과 권호정 교수 연구팀과의 공동 연구를 통해 난치성 유전질환인 섬모병증의 치료제 후보를 개발했다.
이번 연구 결과는 섬모병증 치료제 개발을 위한 기반이 될 것으로 기대되며 유사한 난치성 유전질환에 대한 저분자 화합물 약물 개발 플랫폼으로도 활용 가능할 것으로 예상된다.
김용준 박사과정이 1저자로 참여하고 정인지, 김성수, 정유주 연구원이 공동 저자로 참여한 이번 연구는 의, 과학 분야 국제 학술지 ‘저널 오브 클리니컬 인베스티게이션(Journal of Clinical Investigation)’ 7월 23일자 온라인 판에 게재됐다.(논문명 Eupatilin rescues ciliary transition zone defects to ameliorate ciliopathy-related phenotypes)
세포 소기관인 일차섬모는 배아가 발생하는 과정에서 세포 간 신호전달에 관여하고 망막 광수용체 세포가 기능하는 역할을 하는 등 인체에 중요한 기관이다.
섬모병증은 이러한 섬모의 형성에 필수적인 유전자들의 돌연변이로 인해 발생되며 소뇌발달 및 신장 이상, 망막 퇴행 등의 증상을 보인다.
현재 섬모병증을 치료하는 약물은 개발되지 않았다. 섬모병증 뿐 아니라 기능손실 유전자 돌연변이가 원인이 되는 대부분의 희귀유전질환은 유전자 치료를 제외하고는 치료 약물의 개발이 이뤄지지 않았다.
연구팀은 문제 해결을 위해 섬모병증 원인의 하나인 CEP290 유전자 돌연변이를 유전자 편집기법으로 모사한 세포를 구축한 뒤 화합물 라이브러리 스크리닝 기법을 통해 섬모병증에서 나타나는 섬모형성 부진 현상을 극복할 수 있는 천연 저분자 화합물을 발굴했다.
발굴된 화합물은 CEP290 단백질과 복합체를 이뤄 섬모형성과 기능에 관여하는 단백질(NPHP5)에 작용하는 것으로 밝혀졌다. CEP290 단백질이 유전자 돌연변이로 인해 만들어지지 않는 경우 NPHP5 단백질도 정상적으로 작용하지 못하는데 이 화합물은 NPHP5의 기능을 정상화시켜 복합체가 담당하던 기능의 일부를 회복함을 확인했다.
또한 연구팀은 발굴한 화합물을 섬모병증 증상을 갖는 동물 모델에 주입했고 망막 퇴행 현상을 지연시키는 효과를 입증했다.
1저자인 김용준 박사과정은 “이번 연구는 기능손실 유전자 돌연변이로 인해 발생하는 유전질환도 저분자 화합물 약물로 치료가 가능함을 규명했다는 의미를 갖는다”고 말했다.
김준 교수는 “발굴된 후보약물의 효과를 동물실험을 통해 확인했기 때문에 인체에서의 효과 또한 증명하는 후속 연구를 진행할 예정이다”고 말했다.
이번 연구는 보건복지부 희귀질환연구센터지원사업, 한국연구재단 바이오의료기술개발사업, 글로벌연구실 사업의 지원으로 수행됐다.
□ 그림 설명
그림1.섬모형성 이상을 회복시키는 약물 발굴
그림2. 발굴된 약물에 의해 섬모병증 모델 생쥐의 망막퇴행이 지연되는 효과 확인
김준 교수, 난치성 유전질환인 섬모병증 치료제 후보 발굴
〈 김준 교수, 김용준 박사과정 〉
우리 대학 의과학대학원 김준 교수가 연세대학교 생명공학과 권호정 교수 연구팀과의 공동 연구를 통해 난치성 유전질환인 섬모병증의 치료제 후보를 개발했다.
이번 연구 결과는 섬모병증 치료제 개발을 위한 기반이 될 것으로 기대되며 유사한 난치성 유전질환에 대한 저분자 화합물 약물 개발 플랫폼으로도 활용 가능할 것으로 예상된다.
김용준 박사과정이 1저자로 참여하고 정인지, 김성수, 정유주 연구원이 공동 저자로 참여한 이번 연구는 의, 과학 분야 국제 학술지 ‘저널 오브 클리니컬 인베스티게이션(Journal of Clinical Investigation)’ 7월 23일자 온라인 판에 게재됐다.(논문명 Eupatilin rescues ciliary transition zone defects to ameliorate ciliopathy-related phenotypes)
세포 소기관인 일차섬모는 배아가 발생하는 과정에서 세포 간 신호전달에 관여하고 망막 광수용체 세포가 기능하는 역할을 하는 등 인체에 중요한 기관이다.
섬모병증은 이러한 섬모의 형성에 필수적인 유전자들의 돌연변이로 인해 발생되며 소뇌발달 및 신장 이상, 망막 퇴행 등의 증상을 보인다.
현재 섬모병증을 치료하는 약물은 개발되지 않았다. 섬모병증 뿐 아니라 기능손실 유전자 돌연변이가 원인이 되는 대부분의 희귀유전질환은 유전자 치료를 제외하고는 치료 약물의 개발이 이뤄지지 않았다.
연구팀은 문제 해결을 위해 섬모병증 원인의 하나인 CEP290 유전자 돌연변이를 유전자 편집기법으로 모사한 세포를 구축한 뒤 화합물 라이브러리 스크리닝 기법을 통해 섬모병증에서 나타나는 섬모형성 부진 현상을 극복할 수 있는 천연 저분자 화합물을 발굴했다.
발굴된 화합물은 CEP290 단백질과 복합체를 이뤄 섬모형성과 기능에 관여하는 단백질(NPHP5)에 작용하는 것으로 밝혀졌다. CEP290 단백질이 유전자 돌연변이로 인해 만들어지지 않는 경우 NPHP5 단백질도 정상적으로 작용하지 못하는데 이 화합물은 NPHP5의 기능을 정상화시켜 복합체가 담당하던 기능의 일부를 회복함을 확인했다.
또한 연구팀은 발굴한 화합물을 섬모병증 증상을 갖는 동물 모델에 주입했고 망막 퇴행 현상을 지연시키는 효과를 입증했다.
1저자인 김용준 박사과정은 “이번 연구는 기능손실 유전자 돌연변이로 인해 발생하는 유전질환도 저분자 화합물 약물로 치료가 가능함을 규명했다는 의미를 갖는다”고 말했다.
김준 교수는 “발굴된 후보약물의 효과를 동물실험을 통해 확인했기 때문에 인체에서의 효과 또한 증명하는 후속 연구를 진행할 예정이다”고 말했다.
이번 연구는 보건복지부 희귀질환연구센터지원사업, 한국연구재단 바이오의료기술개발사업, 글로벌연구실 사업의 지원으로 수행됐다.
□ 그림 설명
그림1.섬모형성 이상을 회복시키는 약물 발굴
그림2. 발굴된 약물에 의해 섬모병증 모델 생쥐의 망막퇴행이 지연되는 효과 확인
2018.07.30
조회수 15828
 인간의 인지 방식과 유사한 AI 모델 개발
우리 연구진이 인간의 인지 방식을 모방해 이미지 변화를 이해하고, 시각적 일반화와 특정성을 동시에 확보하는 인공지능 기술을 개발했다. 이 기술은 의료 영상 분석, 자율주행, 로보틱스 등 다양한 분야에서 이미지를 이해하여 객체를 분류, 탐지하는 데 활용될 전망이다.
우리 대학 전기및전자공학부 김준모 교수 연구팀이 변환 레이블(transformational labels) 없이도 스스로 변환 민감 특징(transformation-sensitive features)을 학습할 수 있는 새로운 시각 인공지능 모델 STL(Self-supervised Transformation Learning)을 개발했다고 13일 밝혔다.
연구팀이 개발한 시각 인공지능 모델 STL은 스스로 이미지의 변환을 학습하여, 이미지 변환의 종류를 인간이 직접 알려주면서 학습하는 기존 방법들보다 높은 시각 정보 이해 능력을 보였다. 특히, 기존 방법론들을 통해 학습한 모델이 이해할 수 없는 세부적인 특징까지도 학습하여 기존 방법 대비 최대 42% 우수한 성능을 보여줬다.
컴퓨터 비전에서 이미지 변환을 통한 데이터 증강을 활용해 강건한 시각 표현을 학습하는 방식은 일반화 능력을 갖추는 데 효과적이지만, 변환에 따른 시각적 세부 사항을 무시하는 경향이 있어 범용 시각 인공지능 모델로서 한계가 있다.
연구팀이 제안한 STL은 변환 라벨 없이 변환 정보를 학습할 수 있도록 설계된 새로운 학습 기법으로, 라벨 없이 변환 민감 특징을 학습할 수 있다. 또한, 기존 학습 방법 대비 학습 복잡도를 유지한 채로 효율적인 최적화할 수 있는 방법을 제안했다.
실험 결과, STL은 정확하게 객체를 분류하고 탐지 실험에서 가장 낮은 오류율을 기록했다. 또한, STL이 생성한 표현 공간은 변환의 강도와 유형에 따라 명확히 군집화되어 변환 간 관계를 잘 반영하는 것으로 나타났다.
김준모 교수는 "이번에 개발한 STL은 복잡한 변환 패턴을 학습하고 이를 표현 공간에서 효과적으로 반영하는 능력을 통해 변환 민감 특징 학습의 새로운 가능성을 제시했다”며, "라벨 없이도 변환 정보를 학습할 수 있는 기술은 다양한 AI 응용 분야에서 핵심적인 역할을 할 것”이라고 말했다.
우리 대학 전기및전자공학부 유재명 박사과정이 제1 저자로 참여한 이번 연구는 최고 권위 국제 학술지 ‘신경정보처리시스템학회(NeurIPS) 2024’에서 올 12월 발표될 예정이다.(논문명: Self-supervised Transformation Learning for Equivariant Representations)
한편 이번 연구는 이 논문은 2024년도 정부(과학기술정보통신부)의 재원으로 정보통신기획평가원의 지원을 받아 수행된 연구 성과물(No.RS-2024-00439020, 지속가능한 실시간 멀티모달 인터렉티브 생성 AI 개발, SW스타랩) 이다.
2024.12.15 조회수 4715
인간의 인지 방식과 유사한 AI 모델 개발
우리 연구진이 인간의 인지 방식을 모방해 이미지 변화를 이해하고, 시각적 일반화와 특정성을 동시에 확보하는 인공지능 기술을 개발했다. 이 기술은 의료 영상 분석, 자율주행, 로보틱스 등 다양한 분야에서 이미지를 이해하여 객체를 분류, 탐지하는 데 활용될 전망이다.
우리 대학 전기및전자공학부 김준모 교수 연구팀이 변환 레이블(transformational labels) 없이도 스스로 변환 민감 특징(transformation-sensitive features)을 학습할 수 있는 새로운 시각 인공지능 모델 STL(Self-supervised Transformation Learning)을 개발했다고 13일 밝혔다.
연구팀이 개발한 시각 인공지능 모델 STL은 스스로 이미지의 변환을 학습하여, 이미지 변환의 종류를 인간이 직접 알려주면서 학습하는 기존 방법들보다 높은 시각 정보 이해 능력을 보였다. 특히, 기존 방법론들을 통해 학습한 모델이 이해할 수 없는 세부적인 특징까지도 학습하여 기존 방법 대비 최대 42% 우수한 성능을 보여줬다.
컴퓨터 비전에서 이미지 변환을 통한 데이터 증강을 활용해 강건한 시각 표현을 학습하는 방식은 일반화 능력을 갖추는 데 효과적이지만, 변환에 따른 시각적 세부 사항을 무시하는 경향이 있어 범용 시각 인공지능 모델로서 한계가 있다.
연구팀이 제안한 STL은 변환 라벨 없이 변환 정보를 학습할 수 있도록 설계된 새로운 학습 기법으로, 라벨 없이 변환 민감 특징을 학습할 수 있다. 또한, 기존 학습 방법 대비 학습 복잡도를 유지한 채로 효율적인 최적화할 수 있는 방법을 제안했다.
실험 결과, STL은 정확하게 객체를 분류하고 탐지 실험에서 가장 낮은 오류율을 기록했다. 또한, STL이 생성한 표현 공간은 변환의 강도와 유형에 따라 명확히 군집화되어 변환 간 관계를 잘 반영하는 것으로 나타났다.
김준모 교수는 "이번에 개발한 STL은 복잡한 변환 패턴을 학습하고 이를 표현 공간에서 효과적으로 반영하는 능력을 통해 변환 민감 특징 학습의 새로운 가능성을 제시했다”며, "라벨 없이도 변환 정보를 학습할 수 있는 기술은 다양한 AI 응용 분야에서 핵심적인 역할을 할 것”이라고 말했다.
우리 대학 전기및전자공학부 유재명 박사과정이 제1 저자로 참여한 이번 연구는 최고 권위 국제 학술지 ‘신경정보처리시스템학회(NeurIPS) 2024’에서 올 12월 발표될 예정이다.(논문명: Self-supervised Transformation Learning for Equivariant Representations)
한편 이번 연구는 이 논문은 2024년도 정부(과학기술정보통신부)의 재원으로 정보통신기획평가원의 지원을 받아 수행된 연구 성과물(No.RS-2024-00439020, 지속가능한 실시간 멀티모달 인터렉티브 생성 AI 개발, SW스타랩) 이다.
2024.12.15 조회수 4715 흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21 조회수 6373
흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21 조회수 6373 체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 9322
체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 9322 김준 교수, 난치성 유전질환인 섬모병증 치료제 후보 발굴
〈 김준 교수, 김용준 박사과정 〉
우리 대학 의과학대학원 김준 교수가 연세대학교 생명공학과 권호정 교수 연구팀과의 공동 연구를 통해 난치성 유전질환인 섬모병증의 치료제 후보를 개발했다.
이번 연구 결과는 섬모병증 치료제 개발을 위한 기반이 될 것으로 기대되며 유사한 난치성 유전질환에 대한 저분자 화합물 약물 개발 플랫폼으로도 활용 가능할 것으로 예상된다.
김용준 박사과정이 1저자로 참여하고 정인지, 김성수, 정유주 연구원이 공동 저자로 참여한 이번 연구는 의, 과학 분야 국제 학술지 ‘저널 오브 클리니컬 인베스티게이션(Journal of Clinical Investigation)’ 7월 23일자 온라인 판에 게재됐다.(논문명 Eupatilin rescues ciliary transition zone defects to ameliorate ciliopathy-related phenotypes)
세포 소기관인 일차섬모는 배아가 발생하는 과정에서 세포 간 신호전달에 관여하고 망막 광수용체 세포가 기능하는 역할을 하는 등 인체에 중요한 기관이다.
섬모병증은 이러한 섬모의 형성에 필수적인 유전자들의 돌연변이로 인해 발생되며 소뇌발달 및 신장 이상, 망막 퇴행 등의 증상을 보인다.
현재 섬모병증을 치료하는 약물은 개발되지 않았다. 섬모병증 뿐 아니라 기능손실 유전자 돌연변이가 원인이 되는 대부분의 희귀유전질환은 유전자 치료를 제외하고는 치료 약물의 개발이 이뤄지지 않았다.
연구팀은 문제 해결을 위해 섬모병증 원인의 하나인 CEP290 유전자 돌연변이를 유전자 편집기법으로 모사한 세포를 구축한 뒤 화합물 라이브러리 스크리닝 기법을 통해 섬모병증에서 나타나는 섬모형성 부진 현상을 극복할 수 있는 천연 저분자 화합물을 발굴했다.
발굴된 화합물은 CEP290 단백질과 복합체를 이뤄 섬모형성과 기능에 관여하는 단백질(NPHP5)에 작용하는 것으로 밝혀졌다. CEP290 단백질이 유전자 돌연변이로 인해 만들어지지 않는 경우 NPHP5 단백질도 정상적으로 작용하지 못하는데 이 화합물은 NPHP5의 기능을 정상화시켜 복합체가 담당하던 기능의 일부를 회복함을 확인했다.
또한 연구팀은 발굴한 화합물을 섬모병증 증상을 갖는 동물 모델에 주입했고 망막 퇴행 현상을 지연시키는 효과를 입증했다.
1저자인 김용준 박사과정은 “이번 연구는 기능손실 유전자 돌연변이로 인해 발생하는 유전질환도 저분자 화합물 약물로 치료가 가능함을 규명했다는 의미를 갖는다”고 말했다.
김준 교수는 “발굴된 후보약물의 효과를 동물실험을 통해 확인했기 때문에 인체에서의 효과 또한 증명하는 후속 연구를 진행할 예정이다”고 말했다.
이번 연구는 보건복지부 희귀질환연구센터지원사업, 한국연구재단 바이오의료기술개발사업, 글로벌연구실 사업의 지원으로 수행됐다.
□ 그림 설명
그림1.섬모형성 이상을 회복시키는 약물 발굴
그림2. 발굴된 약물에 의해 섬모병증 모델 생쥐의 망막퇴행이 지연되는 효과 확인
2018.07.30 조회수 15828
김준 교수, 난치성 유전질환인 섬모병증 치료제 후보 발굴
〈 김준 교수, 김용준 박사과정 〉
우리 대학 의과학대학원 김준 교수가 연세대학교 생명공학과 권호정 교수 연구팀과의 공동 연구를 통해 난치성 유전질환인 섬모병증의 치료제 후보를 개발했다.
이번 연구 결과는 섬모병증 치료제 개발을 위한 기반이 될 것으로 기대되며 유사한 난치성 유전질환에 대한 저분자 화합물 약물 개발 플랫폼으로도 활용 가능할 것으로 예상된다.
김용준 박사과정이 1저자로 참여하고 정인지, 김성수, 정유주 연구원이 공동 저자로 참여한 이번 연구는 의, 과학 분야 국제 학술지 ‘저널 오브 클리니컬 인베스티게이션(Journal of Clinical Investigation)’ 7월 23일자 온라인 판에 게재됐다.(논문명 Eupatilin rescues ciliary transition zone defects to ameliorate ciliopathy-related phenotypes)
세포 소기관인 일차섬모는 배아가 발생하는 과정에서 세포 간 신호전달에 관여하고 망막 광수용체 세포가 기능하는 역할을 하는 등 인체에 중요한 기관이다.
섬모병증은 이러한 섬모의 형성에 필수적인 유전자들의 돌연변이로 인해 발생되며 소뇌발달 및 신장 이상, 망막 퇴행 등의 증상을 보인다.
현재 섬모병증을 치료하는 약물은 개발되지 않았다. 섬모병증 뿐 아니라 기능손실 유전자 돌연변이가 원인이 되는 대부분의 희귀유전질환은 유전자 치료를 제외하고는 치료 약물의 개발이 이뤄지지 않았다.
연구팀은 문제 해결을 위해 섬모병증 원인의 하나인 CEP290 유전자 돌연변이를 유전자 편집기법으로 모사한 세포를 구축한 뒤 화합물 라이브러리 스크리닝 기법을 통해 섬모병증에서 나타나는 섬모형성 부진 현상을 극복할 수 있는 천연 저분자 화합물을 발굴했다.
발굴된 화합물은 CEP290 단백질과 복합체를 이뤄 섬모형성과 기능에 관여하는 단백질(NPHP5)에 작용하는 것으로 밝혀졌다. CEP290 단백질이 유전자 돌연변이로 인해 만들어지지 않는 경우 NPHP5 단백질도 정상적으로 작용하지 못하는데 이 화합물은 NPHP5의 기능을 정상화시켜 복합체가 담당하던 기능의 일부를 회복함을 확인했다.
또한 연구팀은 발굴한 화합물을 섬모병증 증상을 갖는 동물 모델에 주입했고 망막 퇴행 현상을 지연시키는 효과를 입증했다.
1저자인 김용준 박사과정은 “이번 연구는 기능손실 유전자 돌연변이로 인해 발생하는 유전질환도 저분자 화합물 약물로 치료가 가능함을 규명했다는 의미를 갖는다”고 말했다.
김준 교수는 “발굴된 후보약물의 효과를 동물실험을 통해 확인했기 때문에 인체에서의 효과 또한 증명하는 후속 연구를 진행할 예정이다”고 말했다.
이번 연구는 보건복지부 희귀질환연구센터지원사업, 한국연구재단 바이오의료기술개발사업, 글로벌연구실 사업의 지원으로 수행됐다.
□ 그림 설명
그림1.섬모형성 이상을 회복시키는 약물 발굴
그림2. 발굴된 약물에 의해 섬모병증 모델 생쥐의 망막퇴행이 지연되는 효과 확인
2018.07.30 조회수 15828