%EA%B9%80%EC%A7%84%EC%9A%B0
-
 손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 9954
손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 9954 -
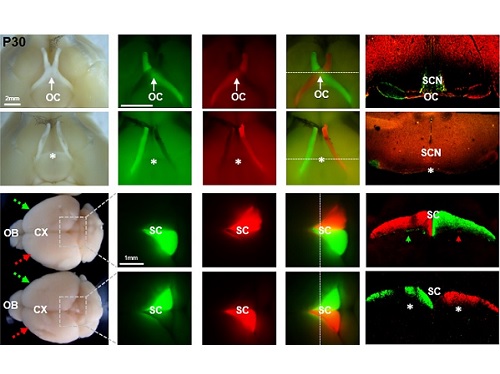 왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 9047
왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 9047 -
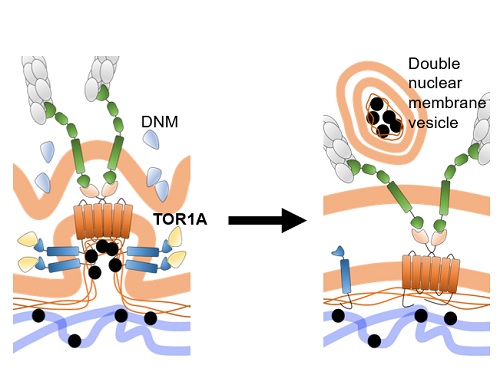 새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 9789
새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 9789 -
 생명과학과 김진우 교수, 노인성 망막퇴행질환 발생 원인 발견
생명과학과 김진우 교수팀이 미국 및 캐나다 연구팀과의 공동연구로 "PTEN 단백질의 불활성화가 노인성 망막퇴행질환의 핵심 기전" 이라는 사실을 규명했다.
김 교수팀은 이 연구에서 그 동안 종양억제 유전자로 널리 알려져 있던 PTEN 단백질이 안구 내 망막색소상피세포* 사이의 결합을 유지시켜 망막조직의 형태 및 항상성 유지에 중요한 역할을 함으로써 망막퇴행질환을 억제한다는 사실을 생쥐 실험을 통해 증명하였다.
우리 인간을 포함한 동물의 안구 내에는 멜라닌 색소를 다량 함유하고 있는 망막색소상피세포층이 망막을 덮고 있는데, 이 층의 세포들은 강한 세포 간 접합체로 연결되어 안구 내에서 혈관과 망막 사이의 장벽을 제공해 준다.
그러나, 장기간 흡연이나 망막이 강한 빛에 장시간 노출되는 등의 스트레스 상황에서는 망막색소상피세포층이 점차 파괴되고, 그 결과 이 세포층에 생긴 틈으로 망막 외부 모세혈관에 있던 백혈구 세포들이 망막으로 침투하면서 망막세포에 염증반응을 일으켜 망막퇴행을 유발한다.
이러한 현상은 많은 망막퇴행질환들에서 관찰이 되는데, 특히 노령 인구에서 높은 빈도로 일어나는 노인성 황반퇴행질환 (Age-related macular degeneration)*에서 빈번하게 나타나는 현상으로 잘 알려져 있다.
김 교수팀은 망막색소상피세포 간 접합부에 집중되어 나타나는 PTEN 단백질의 기능을 검증하기 위해 PTEN 유전자를 인위적으로 생쥐의 망막색소상피세포에서 제거하였고, 그 결과 이 생쥐들에서 노인성 황반퇴행에서 나타나는 형태적 특징을 관찰할 수 있었다.
연구팀은 더 나아가 기존 노인성 황반퇴행질환 생쥐의 망막색소상피세포에서 인산화에 의한 불활성화를 통해 PTEN 단백질이 세포 간 접합체에서 이탈된다는 사실까지 밝힘으로써, PTEN 단백질이 망막색소상피세포의 구조 유지를 통해 망막퇴행을 억제하는 핵심 단백질이라는 사실을 규명하였다.
노인성 황반퇴행질환은 미국 내에만 2006년 통계로 100 만명 이상의 환자가 보고되었고, 국내에서도 최근 급격한 노령화에 따라 환자 수가 급증하고 있는 노인성 망막퇴행질환으로, 시력 상실로도 이어질 수 있는 심각한 신경 질환이다.
노인성 황반퇴행질환은 약 15% 정도는 망막 내 신생혈관의 급격한 형성으로 발생하는 습성 (wet-type)이고, 약 85% 이상은 망막색소상피세포의 이상 등으로 시작해 만성으로 진행되는 건성 (dry-type)으로 분류된다.
심각한 병증과 많은 환자 수에도 불구하고, 그 동안 건성 황반퇴행질환 치료제 개발이 진척을 보이지 못한 이유 중의 하나는 이 질환이 시작되는 망막색소상피세포의 퇴행에 대한 분자적 기전이 정확히 알려지지 않아 치료제의 타겟이 될 세포 내 현상 및 단백질들을 설정하는데 어려움이 있었다는 것이다.
이번 논문의 교신 저자인 김 교수는 “이번 논문을 통해 알려진 망막색소상피세포 퇴행 억제 핵심 단백질인 PTEN과 그 영향을 받는 하부 신호전달체계의 정체는 향후 노인성 황반퇴행질환의 치료제 개발을 위한 타겟을 설정하는데도 유용한 정보로 사용될 수 있다”고 말했다.
김진우 교수팀의 이번 연구는 교육과학기술부가 지원하는 바이오기술개발사업의 일환으로 수행되었고, 연구 결과는 세계적인 저명학술지인 ‘유전자와 발생’(Genes & Development) 11월 15일판에 게재되었다.
2008.11.18 조회수 21283
생명과학과 김진우 교수, 노인성 망막퇴행질환 발생 원인 발견
생명과학과 김진우 교수팀이 미국 및 캐나다 연구팀과의 공동연구로 "PTEN 단백질의 불활성화가 노인성 망막퇴행질환의 핵심 기전" 이라는 사실을 규명했다.
김 교수팀은 이 연구에서 그 동안 종양억제 유전자로 널리 알려져 있던 PTEN 단백질이 안구 내 망막색소상피세포* 사이의 결합을 유지시켜 망막조직의 형태 및 항상성 유지에 중요한 역할을 함으로써 망막퇴행질환을 억제한다는 사실을 생쥐 실험을 통해 증명하였다.
우리 인간을 포함한 동물의 안구 내에는 멜라닌 색소를 다량 함유하고 있는 망막색소상피세포층이 망막을 덮고 있는데, 이 층의 세포들은 강한 세포 간 접합체로 연결되어 안구 내에서 혈관과 망막 사이의 장벽을 제공해 준다.
그러나, 장기간 흡연이나 망막이 강한 빛에 장시간 노출되는 등의 스트레스 상황에서는 망막색소상피세포층이 점차 파괴되고, 그 결과 이 세포층에 생긴 틈으로 망막 외부 모세혈관에 있던 백혈구 세포들이 망막으로 침투하면서 망막세포에 염증반응을 일으켜 망막퇴행을 유발한다.
이러한 현상은 많은 망막퇴행질환들에서 관찰이 되는데, 특히 노령 인구에서 높은 빈도로 일어나는 노인성 황반퇴행질환 (Age-related macular degeneration)*에서 빈번하게 나타나는 현상으로 잘 알려져 있다.
김 교수팀은 망막색소상피세포 간 접합부에 집중되어 나타나는 PTEN 단백질의 기능을 검증하기 위해 PTEN 유전자를 인위적으로 생쥐의 망막색소상피세포에서 제거하였고, 그 결과 이 생쥐들에서 노인성 황반퇴행에서 나타나는 형태적 특징을 관찰할 수 있었다.
연구팀은 더 나아가 기존 노인성 황반퇴행질환 생쥐의 망막색소상피세포에서 인산화에 의한 불활성화를 통해 PTEN 단백질이 세포 간 접합체에서 이탈된다는 사실까지 밝힘으로써, PTEN 단백질이 망막색소상피세포의 구조 유지를 통해 망막퇴행을 억제하는 핵심 단백질이라는 사실을 규명하였다.
노인성 황반퇴행질환은 미국 내에만 2006년 통계로 100 만명 이상의 환자가 보고되었고, 국내에서도 최근 급격한 노령화에 따라 환자 수가 급증하고 있는 노인성 망막퇴행질환으로, 시력 상실로도 이어질 수 있는 심각한 신경 질환이다.
노인성 황반퇴행질환은 약 15% 정도는 망막 내 신생혈관의 급격한 형성으로 발생하는 습성 (wet-type)이고, 약 85% 이상은 망막색소상피세포의 이상 등으로 시작해 만성으로 진행되는 건성 (dry-type)으로 분류된다.
심각한 병증과 많은 환자 수에도 불구하고, 그 동안 건성 황반퇴행질환 치료제 개발이 진척을 보이지 못한 이유 중의 하나는 이 질환이 시작되는 망막색소상피세포의 퇴행에 대한 분자적 기전이 정확히 알려지지 않아 치료제의 타겟이 될 세포 내 현상 및 단백질들을 설정하는데 어려움이 있었다는 것이다.
이번 논문의 교신 저자인 김 교수는 “이번 논문을 통해 알려진 망막색소상피세포 퇴행 억제 핵심 단백질인 PTEN과 그 영향을 받는 하부 신호전달체계의 정체는 향후 노인성 황반퇴행질환의 치료제 개발을 위한 타겟을 설정하는데도 유용한 정보로 사용될 수 있다”고 말했다.
김진우 교수팀의 이번 연구는 교육과학기술부가 지원하는 바이오기술개발사업의 일환으로 수행되었고, 연구 결과는 세계적인 저명학술지인 ‘유전자와 발생’(Genes & Development) 11월 15일판에 게재되었다.
2008.11.18 조회수 21283