%EC%8B%A0%EA%B2%BD%EC%83%9D%EB%AC%BC%ED%95%99
-
 우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24876
우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24876 -
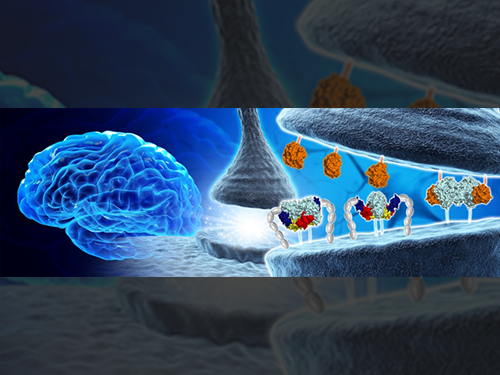 김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 22435
김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 22435 -
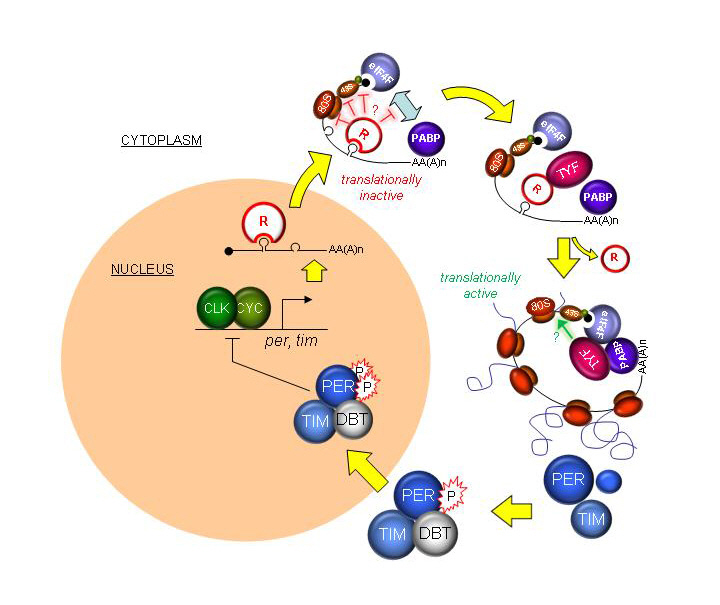 새로운 생체시계 유전자 기능 밝혀내다
- 최준호 교수팀 4년간의 결실, 네이처지 2월호 게재 -
교육과학기술부(장관 이주호)는 24시간을 주기로 반복적으로 일어나는 행동 유형의 하나인 일주기성 생체리듬을 조절하는 새로운 유전자(투엔티-포, Twenty-four)와 이 유전자의 기능 메커니즘이 국내 연구진에 의해 세계 최초로 밝혀졌다고 발표했다.
투엔티-포는 ‘21세기 프론티어 뇌기능활용 및 뇌질환치료기술개발사업’(사업단장 김경진)의 지원을 받은 KAIST 생명과학과 최준호(58)교수·이종빈(30)박사 팀이 미국 노스웨스턴대학교 신경생물학과 라비 알라다 교수·임정훈 박사 팀과의 국제 공동연구를 통해 발견한 것으로 세계 최고 권위의 과학학술지인 ‘네이처(Nature)" 2월호(2011년2월17일자)에 게재됐다.
동 논문의 공동 주저자인 이종빈, 임정훈 박사는 KAIST에서 수학한 국내박사 출신(지도교수 최준호)으로 현재 박사후 연구원으로 동 연구에 참여하고 있으며, 이번 성과는 국내에서 양성한 신진연구원이 주도했다는 점에서 큰 의의를 지닌다.
연구팀에 따르면 형질 전환 초파리를 대상으로 지난 4년간 행동 유형을 실험한 결과 뇌의 생체리듬을 주관하는 신경세포에서 기존에 알려지지 않은 새로운 유전자인 투엔티-포가 존재한다는 사실을 알아냈다.
기존의 생체리듬에 관여하는 유전자들이 DNA에서 mRNA(전령RNA)로 바뀌는 과정(전사단계 : Transcription)에서 작용하는 것과 달리 투엔티-포는 전사단계의 다음단계인 mRNA가 리보솜에서 단백질로 만들어지는 단계에서 작용한다. 특히 투엔티-포는 생체리듬을 조절하는 중요한 유전자인 피리어드(Period) 단백질*에 영향을 미치는 것으로 밝혀졌다.
* 피리어드(Period) 단백질 : 생체 시계 세포들은 외부 자극없이 스스로 돌아가는 분자적 시계 구조를 신경세포마다 가지고 있는데, 피리어드는 이러한 분자적 시계의 구성 유전자 중 하나임. 피리어드 단백질은 생체 시계의 중심 유전자인 클락(Clock)에 의한 전사 활성을 억제 시키는 역할을 함
이는 유전자의 기능을 밝히는 실험을 통해 이 유전자가 만드는 단백질이 신경세포에서 어떻게 기능을 하는지 과학적으로 증명한 것이다. 이번 발견은 기존의 생체리듬에 관여하는 각종 유전자의 작용 메커니즘과 전혀 다른 것으로 생체리듬의 연구 분야에서는 획기적인 일로 평가받고 있다.
이 연구 결과는 앞으로 인간을 포함한 고등생물체의 수면장애·시차적응·식사활동·생리현상 등 일주기성 생체리듬의 문제를 해소하는 방안을 찾는데 중요한 열쇠가 될 것으로 전망된다.
최준호 교수는 “생체리듬의 조절이 유전자의 번역단계에서도 이루어지고 있음을 밝혀 생체시계의 새로운 작용 메커니즘을 찾아냈다는 점에서 연구 결과의 의미가 크다”고 말했다.
연구팀이 새 유전자의 이름을 투엔티-포(Twenty-four)라고 붙인 것은 일주기성(24시간)에 부합하고 유전자 기호 번호(CG4857)를 합한 숫자가 24라는 점에 착안한 것이다.
2011.02.16 조회수 23592
새로운 생체시계 유전자 기능 밝혀내다
- 최준호 교수팀 4년간의 결실, 네이처지 2월호 게재 -
교육과학기술부(장관 이주호)는 24시간을 주기로 반복적으로 일어나는 행동 유형의 하나인 일주기성 생체리듬을 조절하는 새로운 유전자(투엔티-포, Twenty-four)와 이 유전자의 기능 메커니즘이 국내 연구진에 의해 세계 최초로 밝혀졌다고 발표했다.
투엔티-포는 ‘21세기 프론티어 뇌기능활용 및 뇌질환치료기술개발사업’(사업단장 김경진)의 지원을 받은 KAIST 생명과학과 최준호(58)교수·이종빈(30)박사 팀이 미국 노스웨스턴대학교 신경생물학과 라비 알라다 교수·임정훈 박사 팀과의 국제 공동연구를 통해 발견한 것으로 세계 최고 권위의 과학학술지인 ‘네이처(Nature)" 2월호(2011년2월17일자)에 게재됐다.
동 논문의 공동 주저자인 이종빈, 임정훈 박사는 KAIST에서 수학한 국내박사 출신(지도교수 최준호)으로 현재 박사후 연구원으로 동 연구에 참여하고 있으며, 이번 성과는 국내에서 양성한 신진연구원이 주도했다는 점에서 큰 의의를 지닌다.
연구팀에 따르면 형질 전환 초파리를 대상으로 지난 4년간 행동 유형을 실험한 결과 뇌의 생체리듬을 주관하는 신경세포에서 기존에 알려지지 않은 새로운 유전자인 투엔티-포가 존재한다는 사실을 알아냈다.
기존의 생체리듬에 관여하는 유전자들이 DNA에서 mRNA(전령RNA)로 바뀌는 과정(전사단계 : Transcription)에서 작용하는 것과 달리 투엔티-포는 전사단계의 다음단계인 mRNA가 리보솜에서 단백질로 만들어지는 단계에서 작용한다. 특히 투엔티-포는 생체리듬을 조절하는 중요한 유전자인 피리어드(Period) 단백질*에 영향을 미치는 것으로 밝혀졌다.
* 피리어드(Period) 단백질 : 생체 시계 세포들은 외부 자극없이 스스로 돌아가는 분자적 시계 구조를 신경세포마다 가지고 있는데, 피리어드는 이러한 분자적 시계의 구성 유전자 중 하나임. 피리어드 단백질은 생체 시계의 중심 유전자인 클락(Clock)에 의한 전사 활성을 억제 시키는 역할을 함
이는 유전자의 기능을 밝히는 실험을 통해 이 유전자가 만드는 단백질이 신경세포에서 어떻게 기능을 하는지 과학적으로 증명한 것이다. 이번 발견은 기존의 생체리듬에 관여하는 각종 유전자의 작용 메커니즘과 전혀 다른 것으로 생체리듬의 연구 분야에서는 획기적인 일로 평가받고 있다.
이 연구 결과는 앞으로 인간을 포함한 고등생물체의 수면장애·시차적응·식사활동·생리현상 등 일주기성 생체리듬의 문제를 해소하는 방안을 찾는데 중요한 열쇠가 될 것으로 전망된다.
최준호 교수는 “생체리듬의 조절이 유전자의 번역단계에서도 이루어지고 있음을 밝혀 생체시계의 새로운 작용 메커니즘을 찾아냈다는 점에서 연구 결과의 의미가 크다”고 말했다.
연구팀이 새 유전자의 이름을 투엔티-포(Twenty-four)라고 붙인 것은 일주기성(24시간)에 부합하고 유전자 기호 번호(CG4857)를 합한 숫자가 24라는 점에 착안한 것이다.
2011.02.16 조회수 23592