%EC%A1%B0%EB%A6%BD%EC%B2%B4
-
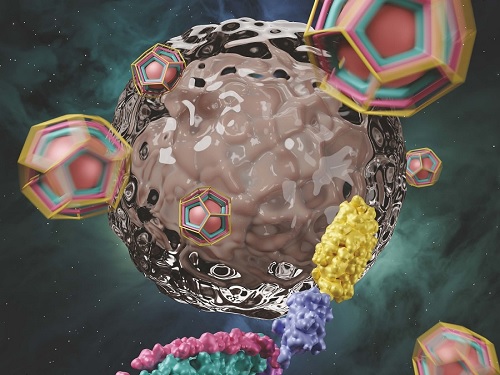 KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 7913
KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 7913 -
 새 인공 형광 단백질 나노 조립체 개발
정 용 원 교수
우리 대학 화학과 정용원 교수 연구팀이 새로운 모양과 다양한 크기의 인공적 형광 단백질 나노 조립체를 개발했다.
이 단백질 나노 조립체 연구로 단백질 기반 신약 및 백신 개발 등 새로운 나노구조체 분야에 활발한 적용이 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 14일자 온라인 판에 게재됐다.
우리 몸의 필수 구성요소인 단백질은 나노미터 크기의 특성과 더불어 무한한 기능과 구조를 갖고 있다는 점에서 새로운 물질 및 구조체 개발에 매우 적합한 것으로 알려져 있다.
특히 단백질 다수가 조립된 다중 조립체는 새로운 성질과 모양, 크기를 가지며 생체친화적인 나노 구조체이기 때문에 많은 관심을 받고 있다. 단백질 다중 조립체는 다수의 단백질이 동시에 작용하기 때문에 결합력을 극대화 해 신약, 백신 기능 향상 연구에 중요한 방법론을 제시할 것으로 기대되기 때문이다.
이 조립체의 상업적, 연구적 이용을 위해선 조립된 단백질의 수가 정확히 조절되고, 다양한 크기의 조립체를 제작할 수 있어야 한다. 하지만 현재의 기술로는 조립체의 크기에 따라 정밀히 분리하는 것이 쉽지 않다.
연구팀은 문제 해결을 위해 인공적 형광 단백질 조립체를 세포 내 합성을 통해 다양한 크기로 제작했다. 또한 조립체 표면 개량을 통해 거대 생체분자의 안정성을 향상시켰고, 다양한 크기의 조립체를 분리할 수 있는 방법을 최초로 개발했다.
이 방법을 이용해 다각형 및 선형 배열을 갖는 형광 단백질 조립체 또한 제작해 관찰했다. 이 과정에서 나노크기 공간에서의 결합 단백질의 개수를 증가시켰고, 기존 단일 단백질보다 비약적으로 향상된 결합력을 확인했다.
정 교수는 “이번 단백질 조립체 제작 기술은 다양한 모양과 크기, 기능성을 갖는 새 조립체 제작의 기반이 될 것이다”며 “비약적으로 향상된 기능을 가진 단백질 신약, 백신, 혹은 결합 리셉터 연구에 핵심적 역할을 할 것”이라 말했다.
정용원 교수 지도 아래 김영은 박사과정 학생이 1저자로 참여한 이번 연구는 우리 대학 김호민 교수 연구팀이 참여했으며, 한국연구재단이 추진하는 글로벌프론티어사업(바이오나노 헬스가드 연구단) 및 기초연구실지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 형광단백질 조립체 모식도 및 전자현미경 사진
2015.05.26 조회수 16227
새 인공 형광 단백질 나노 조립체 개발
정 용 원 교수
우리 대학 화학과 정용원 교수 연구팀이 새로운 모양과 다양한 크기의 인공적 형광 단백질 나노 조립체를 개발했다.
이 단백질 나노 조립체 연구로 단백질 기반 신약 및 백신 개발 등 새로운 나노구조체 분야에 활발한 적용이 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 14일자 온라인 판에 게재됐다.
우리 몸의 필수 구성요소인 단백질은 나노미터 크기의 특성과 더불어 무한한 기능과 구조를 갖고 있다는 점에서 새로운 물질 및 구조체 개발에 매우 적합한 것으로 알려져 있다.
특히 단백질 다수가 조립된 다중 조립체는 새로운 성질과 모양, 크기를 가지며 생체친화적인 나노 구조체이기 때문에 많은 관심을 받고 있다. 단백질 다중 조립체는 다수의 단백질이 동시에 작용하기 때문에 결합력을 극대화 해 신약, 백신 기능 향상 연구에 중요한 방법론을 제시할 것으로 기대되기 때문이다.
이 조립체의 상업적, 연구적 이용을 위해선 조립된 단백질의 수가 정확히 조절되고, 다양한 크기의 조립체를 제작할 수 있어야 한다. 하지만 현재의 기술로는 조립체의 크기에 따라 정밀히 분리하는 것이 쉽지 않다.
연구팀은 문제 해결을 위해 인공적 형광 단백질 조립체를 세포 내 합성을 통해 다양한 크기로 제작했다. 또한 조립체 표면 개량을 통해 거대 생체분자의 안정성을 향상시켰고, 다양한 크기의 조립체를 분리할 수 있는 방법을 최초로 개발했다.
이 방법을 이용해 다각형 및 선형 배열을 갖는 형광 단백질 조립체 또한 제작해 관찰했다. 이 과정에서 나노크기 공간에서의 결합 단백질의 개수를 증가시켰고, 기존 단일 단백질보다 비약적으로 향상된 결합력을 확인했다.
정 교수는 “이번 단백질 조립체 제작 기술은 다양한 모양과 크기, 기능성을 갖는 새 조립체 제작의 기반이 될 것이다”며 “비약적으로 향상된 기능을 가진 단백질 신약, 백신, 혹은 결합 리셉터 연구에 핵심적 역할을 할 것”이라 말했다.
정용원 교수 지도 아래 김영은 박사과정 학생이 1저자로 참여한 이번 연구는 우리 대학 김호민 교수 연구팀이 참여했으며, 한국연구재단이 추진하는 글로벌프론티어사업(바이오나노 헬스가드 연구단) 및 기초연구실지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 형광단백질 조립체 모식도 및 전자현미경 사진
2015.05.26 조회수 16227