-
 부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
2025.07.08
조회수 535
-
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01
조회수 850
-
 교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
2025.04.21
조회수 3981
-
 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08
조회수 3197
-
 손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31
조회수 10362
-
 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10
조회수 4081
-
 뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
2025.01.14
조회수 5190
-
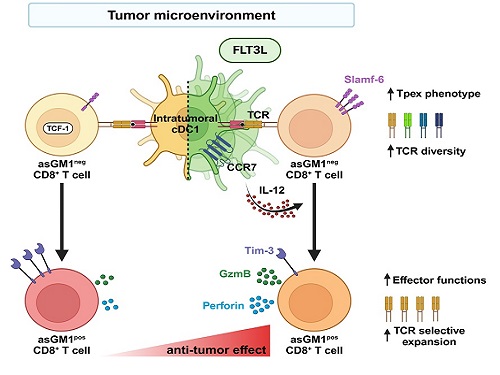 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07
조회수 3899
-
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18
조회수 4735
-
 인간 장 줄기세포 대량 배양, 재생 치료 길 열렸다
우리 연구진이 세계 최초로 화학적으로 규명되고 동물 성분이 완전히 배제된 완전 무이종 (xenogeneic-free) 환경에서 인간 장 줄기세포를 대량 배양하여 줄기세포 치료제로의 임상 적용 가능성을 입증하는데 성공했다. 이번 성과로 향후 환자 맞춤형 줄기세포를 활용한 첨단 재생 치료에 적용 이 가능할 것으로 기대된다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(기관장 김장성) 국가아젠다연구부 손미영 박사 연구팀과 공동 연구를 통해, 무이종(xenogeneic-free) 인간 장 줄기세포 재생 치료 플랫폼을 개발했다고 12일 밝혔다.
연구팀은 기존에 사용되던 쥐 섬유아세포, 매트리젤 코팅 없이, 기상 증착된 유기 고분자를 활용한 혁신적인 배양 및 재생 치료 플랫폼을 개발했다.
고분자 스크리닝을 통해 장 줄기세포를 동물 유래 물질 없이 배양하기에 최적인 ‘XF-DISC’ 표면을 발굴했으며, 개발된 XF-DISC는 장 줄기세포의 장기배양, 대량 배양, 동결 보관 시스템에 성공적으로 적용 가능함을 입증했다.
이 플랫폼에서 배양된 장 줄기세포는 분화 모델로 확장 가능할 뿐만 아니라, 생체 내 이식 (in vivo) 실험에 적용되어 장 상피 손상 및 염증성 모델의 쥐 대장에 성공적으로 이식되었다.
이식 이후, 인간 장 줄기세포는 쥐의 대장 조직과 효과적으로 융합되었고, 손상 부위를 재생하고 염증 반응을 완화하는데 탁월한 성능을 보였다.
특히, 사람의 세포가 동물 모델에 이종이식(xenogaft) 된 후에도 기능을 유지하고 조직 재생 효과를 발휘한 것은, 이 플랫폼이 줄기세포 치료제로서의 실질적인 임상 적용 가능성을 입증한 중요한 사례로 평가받고 있다.
이번 연구는 재생 의학 분야에서 인간 만능줄기세포(hPSC)로부터 유도된 장 줄기세포의 신뢰성 있는 대량 배양과 임상 적용 가능성을 한 단계 높일 것으로 기대된다.
향후 연구는 이 플랫폼의 상용화 가능성과 대규모 생산성을 평가하고, 환자 유래 줄기세포에 대한 적용성을 검토할 계획이다. 또한, 환자 유래 장 줄기세포가 무이종 환경에서 성공적으로 배양될 경우, 실제 환자를 대상으로 한 임상 효과를 검증하는 후속 연구가 진행될 예정이다.
임성갑 교수는 “이번 연구성과는 기존 줄기세포 배양 방식을 넘어, 동물 유래 성분을 완전히 배제한 혁신적인 무이종 배양 플랫폼을 개발한 중요한 전환점이다. 특히, 인간 장 줄기세포의 대량 배양, 장기배양 및 이식 가능성을 세계 최초로 입증함으로써 줄기세포 치료제의 신뢰성과 생산성을 획기적으로 향상시켰다. 이는 재생 의학 분야에서 중요한 진전을 의미하며, 향후 연구는 이 플랫폼의 상용화 가능성과 환자 맞춤형 임상 성능을 평가하는 데 집중될 것이다.”라고 말했다.
이번 연구 결과는 우리 대학 박성현 박사과정생, 한국생명공학연구원 권오만 박사, 이하나 박사가 제1 저자로 참여했으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’지에 12월 2일 자 온라인에 게재됐다.
(논문명: Xenogeneic-free culture of human intestinal stem cells on functional polymer-coated substrates for scalable, clinical-grade stem cell therapy)
한편 과학산업통상자원부, 한국연구재단, 한국과학기술정보통신부, 한국보건복지부, 한국생명공학연구원의 지원을 받아 수행됐다.
인간 장 줄기세포 대량 배양, 재생 치료 길 열렸다
우리 연구진이 세계 최초로 화학적으로 규명되고 동물 성분이 완전히 배제된 완전 무이종 (xenogeneic-free) 환경에서 인간 장 줄기세포를 대량 배양하여 줄기세포 치료제로의 임상 적용 가능성을 입증하는데 성공했다. 이번 성과로 향후 환자 맞춤형 줄기세포를 활용한 첨단 재생 치료에 적용 이 가능할 것으로 기대된다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(기관장 김장성) 국가아젠다연구부 손미영 박사 연구팀과 공동 연구를 통해, 무이종(xenogeneic-free) 인간 장 줄기세포 재생 치료 플랫폼을 개발했다고 12일 밝혔다.
연구팀은 기존에 사용되던 쥐 섬유아세포, 매트리젤 코팅 없이, 기상 증착된 유기 고분자를 활용한 혁신적인 배양 및 재생 치료 플랫폼을 개발했다.
고분자 스크리닝을 통해 장 줄기세포를 동물 유래 물질 없이 배양하기에 최적인 ‘XF-DISC’ 표면을 발굴했으며, 개발된 XF-DISC는 장 줄기세포의 장기배양, 대량 배양, 동결 보관 시스템에 성공적으로 적용 가능함을 입증했다.
이 플랫폼에서 배양된 장 줄기세포는 분화 모델로 확장 가능할 뿐만 아니라, 생체 내 이식 (in vivo) 실험에 적용되어 장 상피 손상 및 염증성 모델의 쥐 대장에 성공적으로 이식되었다.
이식 이후, 인간 장 줄기세포는 쥐의 대장 조직과 효과적으로 융합되었고, 손상 부위를 재생하고 염증 반응을 완화하는데 탁월한 성능을 보였다.
특히, 사람의 세포가 동물 모델에 이종이식(xenogaft) 된 후에도 기능을 유지하고 조직 재생 효과를 발휘한 것은, 이 플랫폼이 줄기세포 치료제로서의 실질적인 임상 적용 가능성을 입증한 중요한 사례로 평가받고 있다.
이번 연구는 재생 의학 분야에서 인간 만능줄기세포(hPSC)로부터 유도된 장 줄기세포의 신뢰성 있는 대량 배양과 임상 적용 가능성을 한 단계 높일 것으로 기대된다.
향후 연구는 이 플랫폼의 상용화 가능성과 대규모 생산성을 평가하고, 환자 유래 줄기세포에 대한 적용성을 검토할 계획이다. 또한, 환자 유래 장 줄기세포가 무이종 환경에서 성공적으로 배양될 경우, 실제 환자를 대상으로 한 임상 효과를 검증하는 후속 연구가 진행될 예정이다.
임성갑 교수는 “이번 연구성과는 기존 줄기세포 배양 방식을 넘어, 동물 유래 성분을 완전히 배제한 혁신적인 무이종 배양 플랫폼을 개발한 중요한 전환점이다. 특히, 인간 장 줄기세포의 대량 배양, 장기배양 및 이식 가능성을 세계 최초로 입증함으로써 줄기세포 치료제의 신뢰성과 생산성을 획기적으로 향상시켰다. 이는 재생 의학 분야에서 중요한 진전을 의미하며, 향후 연구는 이 플랫폼의 상용화 가능성과 환자 맞춤형 임상 성능을 평가하는 데 집중될 것이다.”라고 말했다.
이번 연구 결과는 우리 대학 박성현 박사과정생, 한국생명공학연구원 권오만 박사, 이하나 박사가 제1 저자로 참여했으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’지에 12월 2일 자 온라인에 게재됐다.
(논문명: Xenogeneic-free culture of human intestinal stem cells on functional polymer-coated substrates for scalable, clinical-grade stem cell therapy)
한편 과학산업통상자원부, 한국연구재단, 한국과학기술정보통신부, 한국보건복지부, 한국생명공학연구원의 지원을 받아 수행됐다.
2024.12.15
조회수 5707
-
 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11
조회수 5231
-
 기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.10.10
조회수 5878
 부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
2025.07.08 조회수 535
부작용·내성 극복한 신개념 칸디다증 치료제 개발
칸디다증은 곰팡이균(진균)의 일종인 칸디다(Candida)가 혈액을 통해 전신으로 퍼지며 장기 손상과 패혈증을 유발할 수 있는 치명적인 감염 질환이다. 최근 면역 저하 치료, 장기 이식, 의료기기 사용 등이 증가함에 따라 칸디다증 발병이 급증하고 있다. 한국 연구진이 기존 항진균제와 달리, 칸디다균에만 선택적으로 작용해 높은 치료 효능과 낮은 부작용을 동시에 갖춘 차세대 치료제를 개발하는데 성공했다.
우리 대학 생명과학과 정현정 교수 연구팀이 서울아산병원 정용필 교수팀과의 협력을 통해, 칸디다 세포벽의 두 핵심 효소를 동시에 저해하는 유전자 기반 나노치료제(FTNx)를 개발했다고 8일 밝혔다.
현재 사용 중인 칸디다의 항진균제들은 표적 선택성이 낮아 인체 세포에도 영향을 미칠 수 있으며, 이에 내성을 가지는 새로운 균의 출현으로 인해 치료 효과가 점차 떨어지고 있다. 특히 면역력이 저하된 환자들에게는 감염의 진행이 빠르고 예후도 좋지 않아, 기존 치료제의 한계를 극복할 수 있는 새로운 치료법의 개발이 시급한 상황이다.
이에 연구팀이 개발한 치료제는 전신 투여가 가능하며, 유전자 억제 기술과 나노소재 기술을 융합함으로써 기존 화합물 기반의 약물들이 가지는 구조적 한계를 효과적으로 극복하고, 칸디다균에만 선택적으로 치료하는데 성공했다.
연구팀은 칸디다라는 곰팡이균의 세포벽을 만드는 데 중요한 두 가지 효소 — β‑1,3‑글루칸 합성효소(FKS1)와 키틴 합성효소(CHS3)를 동시에 표적하는 짧은 DNA 조각(antisense oligonucleotide, ASO)을 탑재한 금 나노입자 기반의 복합체를 제작했다.
여기에 칸디다 세포벽의 특정 당지질 구조(당과 지방이 결합된 구조)와 결합하는 표면 코팅 기술을 적용하여 표적유도장치를 장착함으로써, 인체 세포에는 아예 전달되지 않고 칸디다에만 선택적으로 작용하는 정밀 타겟팅 효과를 구현하는 데 성공했다.
이 복합체는 칸디다 세포 내로 진입한 후, FKS1 및 CHS3의 유전자가 만들어내는 mRNA를 잘라버려서 번역을 억제해 세포벽 성분인 β‑1,3‑글루칸과 키틴의 합성을 동시에 차단한다. 이로 인해 칸디다 세포벽은 구조적 안정성을 유지하지 못하고 붕괴되며, 세균의 생존과 증식이 억제된다.
실제로 쥐에서 전신 칸디다증 모델 실험을 통해 치료 효과를 검증한 결과, 치료군에서 칸디다의 장기 내 균 수 감소, 면역 반응 정상화, 그리고 생존율의 유의미한 증가가 관찰됐다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 치료제가 인체 독성과 약제내성 확산 문제를 극복하는 방법을 제시하며, 유전자 치료의 전신 감염 적용 가능성을 보여주는 중요한 전환점”이라며, “향후 임상 적용을 위한 투여 방식 최적화 및 독성 검증 연구를 지속적으로 진행할 계획”이라고 밝혔다.
해당 연구는 생명과학과 정주연 학생 및 서울아산병원 홍윤경 박사가 제1 저자로 참여했으며, 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 7월 1일 자로 게재됐다.
※ 논문명 : Effective treatment of systemic candidiasis by synergistic targeting of cell wall synthesis
※ DOI : 10.1038/s41467-025-60684-7
이번 연구는 보건복지부 및 한국연구재단의 지원을 받아 수행됐다.
2025.07.08 조회수 535 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 850
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 850 교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
2025.04.21 조회수 3981
교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
2025.04.21 조회수 3981 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 3197
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 3197 손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 10362
손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 10362 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 4081
선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 4081 뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
2025.01.14 조회수 5190
뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
2025.01.14 조회수 5190 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3899
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3899 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4735
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4735 인간 장 줄기세포 대량 배양, 재생 치료 길 열렸다
우리 연구진이 세계 최초로 화학적으로 규명되고 동물 성분이 완전히 배제된 완전 무이종 (xenogeneic-free) 환경에서 인간 장 줄기세포를 대량 배양하여 줄기세포 치료제로의 임상 적용 가능성을 입증하는데 성공했다. 이번 성과로 향후 환자 맞춤형 줄기세포를 활용한 첨단 재생 치료에 적용 이 가능할 것으로 기대된다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(기관장 김장성) 국가아젠다연구부 손미영 박사 연구팀과 공동 연구를 통해, 무이종(xenogeneic-free) 인간 장 줄기세포 재생 치료 플랫폼을 개발했다고 12일 밝혔다.
연구팀은 기존에 사용되던 쥐 섬유아세포, 매트리젤 코팅 없이, 기상 증착된 유기 고분자를 활용한 혁신적인 배양 및 재생 치료 플랫폼을 개발했다.
고분자 스크리닝을 통해 장 줄기세포를 동물 유래 물질 없이 배양하기에 최적인 ‘XF-DISC’ 표면을 발굴했으며, 개발된 XF-DISC는 장 줄기세포의 장기배양, 대량 배양, 동결 보관 시스템에 성공적으로 적용 가능함을 입증했다.
이 플랫폼에서 배양된 장 줄기세포는 분화 모델로 확장 가능할 뿐만 아니라, 생체 내 이식 (in vivo) 실험에 적용되어 장 상피 손상 및 염증성 모델의 쥐 대장에 성공적으로 이식되었다.
이식 이후, 인간 장 줄기세포는 쥐의 대장 조직과 효과적으로 융합되었고, 손상 부위를 재생하고 염증 반응을 완화하는데 탁월한 성능을 보였다.
특히, 사람의 세포가 동물 모델에 이종이식(xenogaft) 된 후에도 기능을 유지하고 조직 재생 효과를 발휘한 것은, 이 플랫폼이 줄기세포 치료제로서의 실질적인 임상 적용 가능성을 입증한 중요한 사례로 평가받고 있다.
이번 연구는 재생 의학 분야에서 인간 만능줄기세포(hPSC)로부터 유도된 장 줄기세포의 신뢰성 있는 대량 배양과 임상 적용 가능성을 한 단계 높일 것으로 기대된다.
향후 연구는 이 플랫폼의 상용화 가능성과 대규모 생산성을 평가하고, 환자 유래 줄기세포에 대한 적용성을 검토할 계획이다. 또한, 환자 유래 장 줄기세포가 무이종 환경에서 성공적으로 배양될 경우, 실제 환자를 대상으로 한 임상 효과를 검증하는 후속 연구가 진행될 예정이다.
임성갑 교수는 “이번 연구성과는 기존 줄기세포 배양 방식을 넘어, 동물 유래 성분을 완전히 배제한 혁신적인 무이종 배양 플랫폼을 개발한 중요한 전환점이다. 특히, 인간 장 줄기세포의 대량 배양, 장기배양 및 이식 가능성을 세계 최초로 입증함으로써 줄기세포 치료제의 신뢰성과 생산성을 획기적으로 향상시켰다. 이는 재생 의학 분야에서 중요한 진전을 의미하며, 향후 연구는 이 플랫폼의 상용화 가능성과 환자 맞춤형 임상 성능을 평가하는 데 집중될 것이다.”라고 말했다.
이번 연구 결과는 우리 대학 박성현 박사과정생, 한국생명공학연구원 권오만 박사, 이하나 박사가 제1 저자로 참여했으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’지에 12월 2일 자 온라인에 게재됐다.
(논문명: Xenogeneic-free culture of human intestinal stem cells on functional polymer-coated substrates for scalable, clinical-grade stem cell therapy)
한편 과학산업통상자원부, 한국연구재단, 한국과학기술정보통신부, 한국보건복지부, 한국생명공학연구원의 지원을 받아 수행됐다.
2024.12.15 조회수 5707
인간 장 줄기세포 대량 배양, 재생 치료 길 열렸다
우리 연구진이 세계 최초로 화학적으로 규명되고 동물 성분이 완전히 배제된 완전 무이종 (xenogeneic-free) 환경에서 인간 장 줄기세포를 대량 배양하여 줄기세포 치료제로의 임상 적용 가능성을 입증하는데 성공했다. 이번 성과로 향후 환자 맞춤형 줄기세포를 활용한 첨단 재생 치료에 적용 이 가능할 것으로 기대된다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(기관장 김장성) 국가아젠다연구부 손미영 박사 연구팀과 공동 연구를 통해, 무이종(xenogeneic-free) 인간 장 줄기세포 재생 치료 플랫폼을 개발했다고 12일 밝혔다.
연구팀은 기존에 사용되던 쥐 섬유아세포, 매트리젤 코팅 없이, 기상 증착된 유기 고분자를 활용한 혁신적인 배양 및 재생 치료 플랫폼을 개발했다.
고분자 스크리닝을 통해 장 줄기세포를 동물 유래 물질 없이 배양하기에 최적인 ‘XF-DISC’ 표면을 발굴했으며, 개발된 XF-DISC는 장 줄기세포의 장기배양, 대량 배양, 동결 보관 시스템에 성공적으로 적용 가능함을 입증했다.
이 플랫폼에서 배양된 장 줄기세포는 분화 모델로 확장 가능할 뿐만 아니라, 생체 내 이식 (in vivo) 실험에 적용되어 장 상피 손상 및 염증성 모델의 쥐 대장에 성공적으로 이식되었다.
이식 이후, 인간 장 줄기세포는 쥐의 대장 조직과 효과적으로 융합되었고, 손상 부위를 재생하고 염증 반응을 완화하는데 탁월한 성능을 보였다.
특히, 사람의 세포가 동물 모델에 이종이식(xenogaft) 된 후에도 기능을 유지하고 조직 재생 효과를 발휘한 것은, 이 플랫폼이 줄기세포 치료제로서의 실질적인 임상 적용 가능성을 입증한 중요한 사례로 평가받고 있다.
이번 연구는 재생 의학 분야에서 인간 만능줄기세포(hPSC)로부터 유도된 장 줄기세포의 신뢰성 있는 대량 배양과 임상 적용 가능성을 한 단계 높일 것으로 기대된다.
향후 연구는 이 플랫폼의 상용화 가능성과 대규모 생산성을 평가하고, 환자 유래 줄기세포에 대한 적용성을 검토할 계획이다. 또한, 환자 유래 장 줄기세포가 무이종 환경에서 성공적으로 배양될 경우, 실제 환자를 대상으로 한 임상 효과를 검증하는 후속 연구가 진행될 예정이다.
임성갑 교수는 “이번 연구성과는 기존 줄기세포 배양 방식을 넘어, 동물 유래 성분을 완전히 배제한 혁신적인 무이종 배양 플랫폼을 개발한 중요한 전환점이다. 특히, 인간 장 줄기세포의 대량 배양, 장기배양 및 이식 가능성을 세계 최초로 입증함으로써 줄기세포 치료제의 신뢰성과 생산성을 획기적으로 향상시켰다. 이는 재생 의학 분야에서 중요한 진전을 의미하며, 향후 연구는 이 플랫폼의 상용화 가능성과 환자 맞춤형 임상 성능을 평가하는 데 집중될 것이다.”라고 말했다.
이번 연구 결과는 우리 대학 박성현 박사과정생, 한국생명공학연구원 권오만 박사, 이하나 박사가 제1 저자로 참여했으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’지에 12월 2일 자 온라인에 게재됐다.
(논문명: Xenogeneic-free culture of human intestinal stem cells on functional polymer-coated substrates for scalable, clinical-grade stem cell therapy)
한편 과학산업통상자원부, 한국연구재단, 한국과학기술정보통신부, 한국보건복지부, 한국생명공학연구원의 지원을 받아 수행됐다.
2024.12.15 조회수 5707 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 5231
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 5231 기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.10.10 조회수 5878
기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.10.10 조회수 5878