-
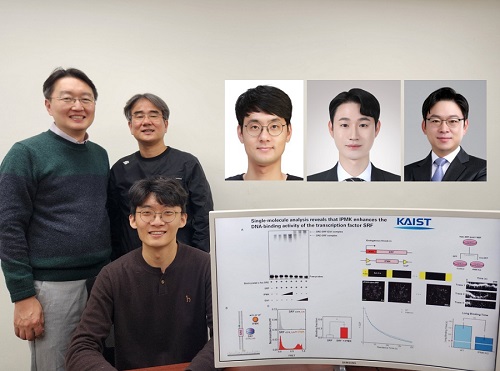 암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22
조회수 5188
-
 전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11
조회수 10860
-
 유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14
조회수 13837
-
 RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15
조회수 14516
-
 세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28
조회수 53167
-
 박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
2016.05.03
조회수 12236
-
 핵산중합효소의 비정상적인 활성 유도 규명
- 금속이온의 고감도 검출 및 새로운 유전자 분석기술로 적용 가능- 화학분야 세계적 학술지 ‘앙게반테 케미誌’12월호 표지논문 선정
우리학교 생명화학공학과 박현규 교수가 핵산중합효소의 비정상적인 활성을 금속이온을 통해 조절하고 이를 이용해 바이오 컴퓨터를 포함하는 미래 바이오 전자 분야의 핵심기술인 로직 게이트를 구현하는 기술을 개발했다고 23일 밝혔다.
DNA를 새롭게 생성해 증폭시키는 효소인 핵산중합효소는 증폭 대상인 목적 DNA와 프라이머(primer)의 염기쌍이 서로 상보적인 짝(A와 T, C와 G)을 이룰 경우에만 가능하다고 알려져 왔었다.
박 교수는 이러한 기존의 개념을 뛰어넘어 특정 금속이 있을 경우에는 상보적인 염기쌍이 아닌 T-T 및 C-C 염기쌍으로부터도 핵산중합효소의 활성을 유도해 핵산을 증폭할 수 있다는 사실을 규명해냈다.
이는 수은 및 은 이온과의 결합을 통해 안정화 된 비 상보적인 T-T와 C-C 염기쌍을 상보적인 염기쌍으로 인식하는 핵산중합효소의 착각 현상에 기인한 것으로, 박 교수는 이를 ‘중합효소 활성 착오(Illusionary polymerase activity)’로 묘사했다.
연구팀은 이 현상을 기반으로 바이오 컴퓨터 등 초고성능 메모리를 가능하게 하는 미래 바이오전자 구현을 위한 핵심기술인 로직게이트를 구현했다.
박현규 교수는 “이번 연구는 기존에 연구되어온 금속 이온과 핵산의 상호작용연구에서 한 걸음 더 나아가 이를 효소활성 유도와 연관시킨 최초의 시도로써, 금속이온의 초고감도 검출 및 새로운 단일염기다형성(single nucleotide polymorphism) 유전자 분석 기술로 적용될 수 있다”고 말했다.
특히, “기존 핵산 기반 기술들과 비교해 비용이 저렴하고 간단한 시스템 디자인을 통해 정확한 로직 게이트 구현이 가능함으로써 분자 수준의 전자소자 연구에 큰 진보를 가져왔다”고 덧붙였다.
한편, 이번 연구는 한국연구재단(이사장 박찬모)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적인 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 12월호(12월 10일자) 표지논문으로 선정됐다.
핵산중합효소의 비정상적인 활성 유도 규명
- 금속이온의 고감도 검출 및 새로운 유전자 분석기술로 적용 가능- 화학분야 세계적 학술지 ‘앙게반테 케미誌’12월호 표지논문 선정
우리학교 생명화학공학과 박현규 교수가 핵산중합효소의 비정상적인 활성을 금속이온을 통해 조절하고 이를 이용해 바이오 컴퓨터를 포함하는 미래 바이오 전자 분야의 핵심기술인 로직 게이트를 구현하는 기술을 개발했다고 23일 밝혔다.
DNA를 새롭게 생성해 증폭시키는 효소인 핵산중합효소는 증폭 대상인 목적 DNA와 프라이머(primer)의 염기쌍이 서로 상보적인 짝(A와 T, C와 G)을 이룰 경우에만 가능하다고 알려져 왔었다.
박 교수는 이러한 기존의 개념을 뛰어넘어 특정 금속이 있을 경우에는 상보적인 염기쌍이 아닌 T-T 및 C-C 염기쌍으로부터도 핵산중합효소의 활성을 유도해 핵산을 증폭할 수 있다는 사실을 규명해냈다.
이는 수은 및 은 이온과의 결합을 통해 안정화 된 비 상보적인 T-T와 C-C 염기쌍을 상보적인 염기쌍으로 인식하는 핵산중합효소의 착각 현상에 기인한 것으로, 박 교수는 이를 ‘중합효소 활성 착오(Illusionary polymerase activity)’로 묘사했다.
연구팀은 이 현상을 기반으로 바이오 컴퓨터 등 초고성능 메모리를 가능하게 하는 미래 바이오전자 구현을 위한 핵심기술인 로직게이트를 구현했다.
박현규 교수는 “이번 연구는 기존에 연구되어온 금속 이온과 핵산의 상호작용연구에서 한 걸음 더 나아가 이를 효소활성 유도와 연관시킨 최초의 시도로써, 금속이온의 초고감도 검출 및 새로운 단일염기다형성(single nucleotide polymorphism) 유전자 분석 기술로 적용될 수 있다”고 말했다.
특히, “기존 핵산 기반 기술들과 비교해 비용이 저렴하고 간단한 시스템 디자인을 통해 정확한 로직 게이트 구현이 가능함으로써 분자 수준의 전자소자 연구에 큰 진보를 가져왔다”고 덧붙였다.
한편, 이번 연구는 한국연구재단(이사장 박찬모)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적인 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 12월호(12월 10일자) 표지논문으로 선정됐다.
2010.12.23
조회수 17289
 암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22 조회수 5188
암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22 조회수 5188 전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11 조회수 10860
전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11 조회수 10860 유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 13837
유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 13837 RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15 조회수 14516
RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15 조회수 14516 세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28 조회수 53167
세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28 조회수 53167 박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
2016.05.03 조회수 12236
박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
2016.05.03 조회수 12236 핵산중합효소의 비정상적인 활성 유도 규명
- 금속이온의 고감도 검출 및 새로운 유전자 분석기술로 적용 가능- 화학분야 세계적 학술지 ‘앙게반테 케미誌’12월호 표지논문 선정
우리학교 생명화학공학과 박현규 교수가 핵산중합효소의 비정상적인 활성을 금속이온을 통해 조절하고 이를 이용해 바이오 컴퓨터를 포함하는 미래 바이오 전자 분야의 핵심기술인 로직 게이트를 구현하는 기술을 개발했다고 23일 밝혔다.
DNA를 새롭게 생성해 증폭시키는 효소인 핵산중합효소는 증폭 대상인 목적 DNA와 프라이머(primer)의 염기쌍이 서로 상보적인 짝(A와 T, C와 G)을 이룰 경우에만 가능하다고 알려져 왔었다.
박 교수는 이러한 기존의 개념을 뛰어넘어 특정 금속이 있을 경우에는 상보적인 염기쌍이 아닌 T-T 및 C-C 염기쌍으로부터도 핵산중합효소의 활성을 유도해 핵산을 증폭할 수 있다는 사실을 규명해냈다.
이는 수은 및 은 이온과의 결합을 통해 안정화 된 비 상보적인 T-T와 C-C 염기쌍을 상보적인 염기쌍으로 인식하는 핵산중합효소의 착각 현상에 기인한 것으로, 박 교수는 이를 ‘중합효소 활성 착오(Illusionary polymerase activity)’로 묘사했다.
연구팀은 이 현상을 기반으로 바이오 컴퓨터 등 초고성능 메모리를 가능하게 하는 미래 바이오전자 구현을 위한 핵심기술인 로직게이트를 구현했다.
박현규 교수는 “이번 연구는 기존에 연구되어온 금속 이온과 핵산의 상호작용연구에서 한 걸음 더 나아가 이를 효소활성 유도와 연관시킨 최초의 시도로써, 금속이온의 초고감도 검출 및 새로운 단일염기다형성(single nucleotide polymorphism) 유전자 분석 기술로 적용될 수 있다”고 말했다.
특히, “기존 핵산 기반 기술들과 비교해 비용이 저렴하고 간단한 시스템 디자인을 통해 정확한 로직 게이트 구현이 가능함으로써 분자 수준의 전자소자 연구에 큰 진보를 가져왔다”고 덧붙였다.
한편, 이번 연구는 한국연구재단(이사장 박찬모)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적인 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 12월호(12월 10일자) 표지논문으로 선정됐다.
2010.12.23 조회수 17289
핵산중합효소의 비정상적인 활성 유도 규명
- 금속이온의 고감도 검출 및 새로운 유전자 분석기술로 적용 가능- 화학분야 세계적 학술지 ‘앙게반테 케미誌’12월호 표지논문 선정
우리학교 생명화학공학과 박현규 교수가 핵산중합효소의 비정상적인 활성을 금속이온을 통해 조절하고 이를 이용해 바이오 컴퓨터를 포함하는 미래 바이오 전자 분야의 핵심기술인 로직 게이트를 구현하는 기술을 개발했다고 23일 밝혔다.
DNA를 새롭게 생성해 증폭시키는 효소인 핵산중합효소는 증폭 대상인 목적 DNA와 프라이머(primer)의 염기쌍이 서로 상보적인 짝(A와 T, C와 G)을 이룰 경우에만 가능하다고 알려져 왔었다.
박 교수는 이러한 기존의 개념을 뛰어넘어 특정 금속이 있을 경우에는 상보적인 염기쌍이 아닌 T-T 및 C-C 염기쌍으로부터도 핵산중합효소의 활성을 유도해 핵산을 증폭할 수 있다는 사실을 규명해냈다.
이는 수은 및 은 이온과의 결합을 통해 안정화 된 비 상보적인 T-T와 C-C 염기쌍을 상보적인 염기쌍으로 인식하는 핵산중합효소의 착각 현상에 기인한 것으로, 박 교수는 이를 ‘중합효소 활성 착오(Illusionary polymerase activity)’로 묘사했다.
연구팀은 이 현상을 기반으로 바이오 컴퓨터 등 초고성능 메모리를 가능하게 하는 미래 바이오전자 구현을 위한 핵심기술인 로직게이트를 구현했다.
박현규 교수는 “이번 연구는 기존에 연구되어온 금속 이온과 핵산의 상호작용연구에서 한 걸음 더 나아가 이를 효소활성 유도와 연관시킨 최초의 시도로써, 금속이온의 초고감도 검출 및 새로운 단일염기다형성(single nucleotide polymorphism) 유전자 분석 기술로 적용될 수 있다”고 말했다.
특히, “기존 핵산 기반 기술들과 비교해 비용이 저렴하고 간단한 시스템 디자인을 통해 정확한 로직 게이트 구현이 가능함으로써 분자 수준의 전자소자 연구에 큰 진보를 가져왔다”고 덧붙였다.
한편, 이번 연구는 한국연구재단(이사장 박찬모)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적인 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 12월호(12월 10일자) 표지논문으로 선정됐다.
2010.12.23 조회수 17289