-
 기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09
조회수 6522
-
 알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.08
조회수 6765
-
 10배 이상 생체신호 정밀 측정 ‘SUPPORT’ 개발
최근 유전공학 기술의 발전으로 형광현미경을 활용해 살아있는 생체조직 내 신호를 형광신호로 변환하여 연속적으로 촬영하고 측정하는 기술들이 개발되어 활용되고 있다. 그러나, 생체조직에서 방출되는 형광신호가 미약하기 때문에 빠르게 변화하는 신경세포의 전기신호 등의 신호를 측정할 경우, 매우 낮은 신호대잡음비를 가지게 되어 정밀한 측정이 어려워지게 된다.
우리 대학 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 10배 이상 정밀하게 생체 형광 신호 측정을 가능하게 하는 인공지능(AI) 영상 분석 기술을 개발했다고 20일 밝혔다.
윤 교수 연구팀은 별도의 학습 데이터 없이, 낮은 신호대잡음비를 가지는 형광현미경 영상으로부터 데이터의 통계적 분포를 스스로 학습해 영상의 신호대잡음비를 10배 이상 높여 생체신호를 정밀 측정할 수 있는 기술을 개발했다. 이를 활용하면 각종 생체 신호의 측정 정밀도가 크게 향상될 수 있어 생명과학 연구 전반과 뇌 질환 치료제 개발에 폭넓게 활용될 수 있을 것으로 기대된다.
윤 교수는 “이 기술이 다양한 뇌과학, 생명과학 연구에 도움이 되길 바라는 마음을 담아 ‘서포트(SUPPORT, Statistically Unbiased Prediction utilizing sPatiOtempoRal information in imaging daTa)라는 이름을 붙였다”며, “다양한 형광 이미징 장비를 활용하는 연구자들이 별도의 학습 데이터 없이도 쉽게 활용가능한 기술로, 새로운 생명현상 규명에 폭넓게 활용될 수 있을 것”이라고 말했다.
공동 제1 저자인 엄민호 연구원은 "서포트(SUPPORT) 기술을 통해 관측이 어려웠던 생체 신호의 빠른 변화를 정밀하게 측정하는 것에 성공하였고, 특히 밀리초 단위로 변하는 신경세포의 활동전위를 광학적으로 정밀하게 측정할 수 있어 뇌과학 연구에 매우 유용할 것이다”라고 하였으며, 공동 제1 저자인 한승재 연구원은 “서포트 기술은 형광현미경 영상 내 생체 신호의 정밀 측정을 위해 개발됐지만, 일반적인 타임랩스 영상의 품질을 높이기 위해서도 폭넓게 활용가능하다”라고 말했다.
이 기술은 전기및전자공학부 윤영규 교수팀의 주도하에 신소재공학과 장재범 교수, 의과학대학원 김필한 교수, 충남대학교, 서울대학교, 하버드대학(Harvard University), 보스턴대학(Boston University), 앨런 연구소(Allen Institute), 웨스트레이크대학(Westlake University) 연구진들과 다국적, 다학제간 협력을 통해서 개발됐다.
이번 연구는 한국연구재단의 지원을 받아 수행됐으며 국제 학술지 `네이처 메소드(Nature Methods)'에 9월 19일 자로 온라인 게재되었으며 10월호 표지 논문으로 선정됐다. (논문명 : Statistically unbiased prediction enables accurate denoising of voltage imaging data)
10배 이상 생체신호 정밀 측정 ‘SUPPORT’ 개발
최근 유전공학 기술의 발전으로 형광현미경을 활용해 살아있는 생체조직 내 신호를 형광신호로 변환하여 연속적으로 촬영하고 측정하는 기술들이 개발되어 활용되고 있다. 그러나, 생체조직에서 방출되는 형광신호가 미약하기 때문에 빠르게 변화하는 신경세포의 전기신호 등의 신호를 측정할 경우, 매우 낮은 신호대잡음비를 가지게 되어 정밀한 측정이 어려워지게 된다.
우리 대학 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 10배 이상 정밀하게 생체 형광 신호 측정을 가능하게 하는 인공지능(AI) 영상 분석 기술을 개발했다고 20일 밝혔다.
윤 교수 연구팀은 별도의 학습 데이터 없이, 낮은 신호대잡음비를 가지는 형광현미경 영상으로부터 데이터의 통계적 분포를 스스로 학습해 영상의 신호대잡음비를 10배 이상 높여 생체신호를 정밀 측정할 수 있는 기술을 개발했다. 이를 활용하면 각종 생체 신호의 측정 정밀도가 크게 향상될 수 있어 생명과학 연구 전반과 뇌 질환 치료제 개발에 폭넓게 활용될 수 있을 것으로 기대된다.
윤 교수는 “이 기술이 다양한 뇌과학, 생명과학 연구에 도움이 되길 바라는 마음을 담아 ‘서포트(SUPPORT, Statistically Unbiased Prediction utilizing sPatiOtempoRal information in imaging daTa)라는 이름을 붙였다”며, “다양한 형광 이미징 장비를 활용하는 연구자들이 별도의 학습 데이터 없이도 쉽게 활용가능한 기술로, 새로운 생명현상 규명에 폭넓게 활용될 수 있을 것”이라고 말했다.
공동 제1 저자인 엄민호 연구원은 "서포트(SUPPORT) 기술을 통해 관측이 어려웠던 생체 신호의 빠른 변화를 정밀하게 측정하는 것에 성공하였고, 특히 밀리초 단위로 변하는 신경세포의 활동전위를 광학적으로 정밀하게 측정할 수 있어 뇌과학 연구에 매우 유용할 것이다”라고 하였으며, 공동 제1 저자인 한승재 연구원은 “서포트 기술은 형광현미경 영상 내 생체 신호의 정밀 측정을 위해 개발됐지만, 일반적인 타임랩스 영상의 품질을 높이기 위해서도 폭넓게 활용가능하다”라고 말했다.
이 기술은 전기및전자공학부 윤영규 교수팀의 주도하에 신소재공학과 장재범 교수, 의과학대학원 김필한 교수, 충남대학교, 서울대학교, 하버드대학(Harvard University), 보스턴대학(Boston University), 앨런 연구소(Allen Institute), 웨스트레이크대학(Westlake University) 연구진들과 다국적, 다학제간 협력을 통해서 개발됐다.
이번 연구는 한국연구재단의 지원을 받아 수행됐으며 국제 학술지 `네이처 메소드(Nature Methods)'에 9월 19일 자로 온라인 게재되었으며 10월호 표지 논문으로 선정됐다. (논문명 : Statistically unbiased prediction enables accurate denoising of voltage imaging data)
2023.09.20
조회수 6330
-
 새로운 인공지능 형광 현미경 적용, 뇌 신경세포 등 3차원 고화질 영상기술 개발
우리 대학 김재철 AI 대학원 예종철 교수 연구팀이 서울대학교 장성호 교수팀, 포스텍 김기현 교수팀과 공동연구를 통해 형광 현미경의 오랜 문제인 이방성(Anisotropy)을 해결해, 3차원 영상 화질을 획기적으로 끌어올리는 인공지능 기술을 개발했다고 29일 밝혔다.
이방성 문제란 형광 현미경으로 3차원 영상을 획득하는 데 있어 빛의 성질로 인해 영상 공간 방향 간에 적게는 2~3배, 많게는 10배까지도 화질 차이가 발생하는 문제를 뜻한다. 예를 들면 3차원 영상을 보는 각도마다 화질의 차이가 발생하는 것이다.
연구팀은 수학적 기법인 최적 수송이론 기반을 둔 새로운 인공지능 시스템을 개발해 공초점 현미경과 광 시트 현미경에 적용했다. 기존 인공지능 기법들과는 다르게, 인공지능 학습 데이터가 따로 필요하지 않고, 하나의 3차원 영상만으로도 인공지능 학습에 적용할 수 있다는 점에서 획기적이라 볼 수 있으며, 생물학 연구자들에게 생물 표본의 3차원 고화질 영상 획득에 큰 도움을 줄 것으로 기대된다.
예종철 교수는 "3차원 영상 획득에 있어 극복하기 어려웠던 현미경의 물리적 한계를 인공지능 기술을 통해 뛰어넘었다는 점에서 의미가 있고, 비지도 학습 기반으로 훈련이 진행되기 때문에, 다양한 많은 종류의 3차원 영상 촬영 기법에도 확장 적용 가능하며, 또한 인공지능 연구의 새로운 응용을 개척했다는 데 의미가 있다ˮ 고 말했다.
김재철 AI 대학원의 예종철 교수가 주도하고, 박형준 연구원이 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션스(Nature Communications)' 6월 8일 字 온라인판에 게재됐다.
*논문명 : Deep learning enables reference-free isotropic super-resolution for volumetric fluorescence microscopy
논문 링크: https://www.nature.com/articles/s41467-022-30949-6
새로운 인공지능 형광 현미경 적용, 뇌 신경세포 등 3차원 고화질 영상기술 개발
우리 대학 김재철 AI 대학원 예종철 교수 연구팀이 서울대학교 장성호 교수팀, 포스텍 김기현 교수팀과 공동연구를 통해 형광 현미경의 오랜 문제인 이방성(Anisotropy)을 해결해, 3차원 영상 화질을 획기적으로 끌어올리는 인공지능 기술을 개발했다고 29일 밝혔다.
이방성 문제란 형광 현미경으로 3차원 영상을 획득하는 데 있어 빛의 성질로 인해 영상 공간 방향 간에 적게는 2~3배, 많게는 10배까지도 화질 차이가 발생하는 문제를 뜻한다. 예를 들면 3차원 영상을 보는 각도마다 화질의 차이가 발생하는 것이다.
연구팀은 수학적 기법인 최적 수송이론 기반을 둔 새로운 인공지능 시스템을 개발해 공초점 현미경과 광 시트 현미경에 적용했다. 기존 인공지능 기법들과는 다르게, 인공지능 학습 데이터가 따로 필요하지 않고, 하나의 3차원 영상만으로도 인공지능 학습에 적용할 수 있다는 점에서 획기적이라 볼 수 있으며, 생물학 연구자들에게 생물 표본의 3차원 고화질 영상 획득에 큰 도움을 줄 것으로 기대된다.
예종철 교수는 "3차원 영상 획득에 있어 극복하기 어려웠던 현미경의 물리적 한계를 인공지능 기술을 통해 뛰어넘었다는 점에서 의미가 있고, 비지도 학습 기반으로 훈련이 진행되기 때문에, 다양한 많은 종류의 3차원 영상 촬영 기법에도 확장 적용 가능하며, 또한 인공지능 연구의 새로운 응용을 개척했다는 데 의미가 있다ˮ 고 말했다.
김재철 AI 대학원의 예종철 교수가 주도하고, 박형준 연구원이 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션스(Nature Communications)' 6월 8일 字 온라인판에 게재됐다.
*논문명 : Deep learning enables reference-free isotropic super-resolution for volumetric fluorescence microscopy
논문 링크: https://www.nature.com/articles/s41467-022-30949-6
2022.06.29
조회수 11936
-
 형광 염색 없이 분자 정보를 보는 AI 현미경 개발
우리 대학 물리학과 박용근 석좌교수 연구팀이 형광 염색 없이 세포의 분자 정보를 볼 수 있는 인공지능 현미경 기술을 개발했다고 20일 밝혔다.
광학 현미경은 수백 년 전부터 현재에 이르기까지 생물학 및 의학에서 가장 중요하게 쓰이는 기술 중 하나로, 이미지 형성 원리에 따라 여러 형태로 발전해왔다. 최근 수십 년간 분자생물학이 눈부시게 발전하면서 세포 내의 특정 구조를 형광(fluorescence) 으로 표지하는 것이 가능해졌고, 이처럼 높은 생화학적 특이성(biochemical specificity) 덕분에 형광 현미경은 현재 가장 폭넓게 쓰이는 광학 현미경 기술이 됐다.
그러나 형광 현미경은 형광 표지 자체가 세포를 변형하는 것이기 때문에 세포에 부담을 주게 되고, 밝기와 세포독성, 안정성 문제 때문에 초고속 또는 장기간 측정이 힘들며, 제한된 색깔로 인해 다양한 구조를 동시에 보는 것이 어려운 근본적인 한계가 있다.
이와는 대조적으로, 각 물질과 빛의 상호작용을 결정하는 근본적인 특성인 굴절률(refractive index)을 이용해 아무런 염색을 하지 않아도 되는 현미경 기술 또한 꾸준히 발전해왔다. 굴절률로부터 파생되는 빛의 흡수, 위상차 등을 이용한 전통적인 현미경은 물론, 최근에는 굴절률 자체를 3차원 상에서 정량적으로 측정하는 다양한 홀로그래픽 현미경(holographic microscopy) 기술이 박용근 교수 연구팀에서 개발돼 상용화된 바 있다. 이러한 비표지(label-free) 현미경 기술은 형광 현미경과 비교해 여러 가지 장점을 갖고 있지만, 굴절률과 세포 내 구조들의 관계가 명확하지 않아 분자 특이성이 떨어진다는 단점이 있었다.
박용근 교수 연구팀에서는 2012년 초부터 조영주 졸업생(제1 저자, 물리학과·수리과학과 학사 11학번·KAIST 총장 장학생, 現 스탠퍼드대학교 응용물리학과 박사과정) 주도로 홀로그래픽 현미경 분야에 인공지능을 도입해 특이성 문제를 해결하려는 일련의 연구가 시작됐다.
우선 형태적으로는 비슷하나 생화학적인 구성에 차이가 있는 시료(여러 종의 박테리아, 다양한 분류의 백혈구 등)의 굴절률 영상은 사람 눈에는 비슷하게 보이는데, 흥미롭게도 인공지능은 이를 높은 정확도로 분류할 수 있음을 보였다(2013-2014년 KAIST 학부연구프로그램(URP) 이후, 2015년 Optics Express, 2017년 Science Advances, 2020년 ACS Nano 등 게재). 이러한 결과는 매우 다양한 생체 시료에서 일관되게 관찰됐고, 따라서 연구팀은 생화학적 특이성이 높은 정보가 굴절률의 공간 분포에 숨겨져 있다는 가설을 세웠다.
세포생물학 분야 최고 권위지인 `네이처 셀 바이올로지(Nature Cell Biology, IF 28.82)'에 12월 7일 발표된 이번 연구(논문명: Label-free multiplexed microtomography of endogenous subcellular dynamics using generalizable deep learning)에서, 연구팀은 홀로그래픽 현미경 영상으로부터 형광 현미경 영상을 직접 예측할 수 있음을 보임으로써 이 가설을 증명했다. 인공지능이 찾아낸 굴절률 공간 분포와 세포 내 주요 구조 간의 정량적인 관계를 이용해 굴절률의 공간 분포 해독이 가능해졌고, 놀랍게도 이러한 관계는 세포 종류와 관계없이 보존돼 있음을 확인했다.
이 과정에서 만들어진 `인공지능 현미경'은 홀로그래픽 현미경과 형광 현미경의 장점만을 갖는다. 즉, 형광 표지 없이 형광 현미경의 특이적인 영상을 얻을 수 있다. 따라서 자연 상태 그대로의 세포에서 동시에 수많은 종류의 구조를 3차원으로 볼 수 있으며, 밀리초(ms) 수준의 초고속 측정과 수십 일 수준의 장기간 측정이 가능해졌다. 더욱이 기존 데이터에 포함되지 않은 새로운 종류의 세포에도 즉시 적용이 가능하기에, 다양한 생물학 및 의학 연구에 응용이 가능할 것으로 기대된다.
이번 연구는 조영주 박사과정과 박용근 교수가 지난 10여 년간 발전시켜온 광학 및 인공지능 기술력 이외에도, 다학제적 접근과 KAIST 기술을 바탕으로 한 창업 덕분에 가능했다. 생명과학과 허원도 교수(공동 교신저자)와 박외선 박사(공동 제1 저자)가 오랜 기간 발전시켜온 분자생물학 및 형광 현미경 기술 덕분에 인공지능 학습에 필요한 데이터를 얻을 수 있었으며, 조영주 박사과정이 허원도 교수 연구팀에서 2015년 1년간 연구했던 경험 덕분에 구체적인 아이디어가 나오게 됐다.
또한 박용근 교수 연구팀 홀로그래픽 현미경 기술로 창업한 ㈜토모큐브를 통해 현미경 및 데이터 형식이 규격화돼 대규모 인공지능 학습이 용이했고, 이를 바탕으로 ㈜토모큐브 조형주 연구원(공동 제1 저자) 및 민현석 연구원(공동 교신저자) 등 인공지능 전문 인력이 합류하면서 최신 인공지능 기법들의 빠른 도입이 가능했다.
한편 이번 연구는 한국연구재단의 창의연구사업, 과학기술정보통신부의 정보통신방송 기술개발사업 (홀로그램핵심기술), 일자리진흥원의 연구장비개발 및 고도화지원사업, 한국보건산업진흥원의 보건의료기술 연구개발사업의 지원을 받아 수행됐다.
형광 염색 없이 분자 정보를 보는 AI 현미경 개발
우리 대학 물리학과 박용근 석좌교수 연구팀이 형광 염색 없이 세포의 분자 정보를 볼 수 있는 인공지능 현미경 기술을 개발했다고 20일 밝혔다.
광학 현미경은 수백 년 전부터 현재에 이르기까지 생물학 및 의학에서 가장 중요하게 쓰이는 기술 중 하나로, 이미지 형성 원리에 따라 여러 형태로 발전해왔다. 최근 수십 년간 분자생물학이 눈부시게 발전하면서 세포 내의 특정 구조를 형광(fluorescence) 으로 표지하는 것이 가능해졌고, 이처럼 높은 생화학적 특이성(biochemical specificity) 덕분에 형광 현미경은 현재 가장 폭넓게 쓰이는 광학 현미경 기술이 됐다.
그러나 형광 현미경은 형광 표지 자체가 세포를 변형하는 것이기 때문에 세포에 부담을 주게 되고, 밝기와 세포독성, 안정성 문제 때문에 초고속 또는 장기간 측정이 힘들며, 제한된 색깔로 인해 다양한 구조를 동시에 보는 것이 어려운 근본적인 한계가 있다.
이와는 대조적으로, 각 물질과 빛의 상호작용을 결정하는 근본적인 특성인 굴절률(refractive index)을 이용해 아무런 염색을 하지 않아도 되는 현미경 기술 또한 꾸준히 발전해왔다. 굴절률로부터 파생되는 빛의 흡수, 위상차 등을 이용한 전통적인 현미경은 물론, 최근에는 굴절률 자체를 3차원 상에서 정량적으로 측정하는 다양한 홀로그래픽 현미경(holographic microscopy) 기술이 박용근 교수 연구팀에서 개발돼 상용화된 바 있다. 이러한 비표지(label-free) 현미경 기술은 형광 현미경과 비교해 여러 가지 장점을 갖고 있지만, 굴절률과 세포 내 구조들의 관계가 명확하지 않아 분자 특이성이 떨어진다는 단점이 있었다.
박용근 교수 연구팀에서는 2012년 초부터 조영주 졸업생(제1 저자, 물리학과·수리과학과 학사 11학번·KAIST 총장 장학생, 現 스탠퍼드대학교 응용물리학과 박사과정) 주도로 홀로그래픽 현미경 분야에 인공지능을 도입해 특이성 문제를 해결하려는 일련의 연구가 시작됐다.
우선 형태적으로는 비슷하나 생화학적인 구성에 차이가 있는 시료(여러 종의 박테리아, 다양한 분류의 백혈구 등)의 굴절률 영상은 사람 눈에는 비슷하게 보이는데, 흥미롭게도 인공지능은 이를 높은 정확도로 분류할 수 있음을 보였다(2013-2014년 KAIST 학부연구프로그램(URP) 이후, 2015년 Optics Express, 2017년 Science Advances, 2020년 ACS Nano 등 게재). 이러한 결과는 매우 다양한 생체 시료에서 일관되게 관찰됐고, 따라서 연구팀은 생화학적 특이성이 높은 정보가 굴절률의 공간 분포에 숨겨져 있다는 가설을 세웠다.
세포생물학 분야 최고 권위지인 `네이처 셀 바이올로지(Nature Cell Biology, IF 28.82)'에 12월 7일 발표된 이번 연구(논문명: Label-free multiplexed microtomography of endogenous subcellular dynamics using generalizable deep learning)에서, 연구팀은 홀로그래픽 현미경 영상으로부터 형광 현미경 영상을 직접 예측할 수 있음을 보임으로써 이 가설을 증명했다. 인공지능이 찾아낸 굴절률 공간 분포와 세포 내 주요 구조 간의 정량적인 관계를 이용해 굴절률의 공간 분포 해독이 가능해졌고, 놀랍게도 이러한 관계는 세포 종류와 관계없이 보존돼 있음을 확인했다.
이 과정에서 만들어진 `인공지능 현미경'은 홀로그래픽 현미경과 형광 현미경의 장점만을 갖는다. 즉, 형광 표지 없이 형광 현미경의 특이적인 영상을 얻을 수 있다. 따라서 자연 상태 그대로의 세포에서 동시에 수많은 종류의 구조를 3차원으로 볼 수 있으며, 밀리초(ms) 수준의 초고속 측정과 수십 일 수준의 장기간 측정이 가능해졌다. 더욱이 기존 데이터에 포함되지 않은 새로운 종류의 세포에도 즉시 적용이 가능하기에, 다양한 생물학 및 의학 연구에 응용이 가능할 것으로 기대된다.
이번 연구는 조영주 박사과정과 박용근 교수가 지난 10여 년간 발전시켜온 광학 및 인공지능 기술력 이외에도, 다학제적 접근과 KAIST 기술을 바탕으로 한 창업 덕분에 가능했다. 생명과학과 허원도 교수(공동 교신저자)와 박외선 박사(공동 제1 저자)가 오랜 기간 발전시켜온 분자생물학 및 형광 현미경 기술 덕분에 인공지능 학습에 필요한 데이터를 얻을 수 있었으며, 조영주 박사과정이 허원도 교수 연구팀에서 2015년 1년간 연구했던 경험 덕분에 구체적인 아이디어가 나오게 됐다.
또한 박용근 교수 연구팀 홀로그래픽 현미경 기술로 창업한 ㈜토모큐브를 통해 현미경 및 데이터 형식이 규격화돼 대규모 인공지능 학습이 용이했고, 이를 바탕으로 ㈜토모큐브 조형주 연구원(공동 제1 저자) 및 민현석 연구원(공동 교신저자) 등 인공지능 전문 인력이 합류하면서 최신 인공지능 기법들의 빠른 도입이 가능했다.
한편 이번 연구는 한국연구재단의 창의연구사업, 과학기술정보통신부의 정보통신방송 기술개발사업 (홀로그램핵심기술), 일자리진흥원의 연구장비개발 및 고도화지원사업, 한국보건산업진흥원의 보건의료기술 연구개발사업의 지원을 받아 수행됐다.
2021.12.20
조회수 11537
-
 암 진단에 필요한 새로운 형광 증폭 기술 개발
우리 대학 신소재공학과 장재범 교수 연구팀이 암 진단에 필요한 새로운 형광 신호 증폭 기술을 개발했다고 17일 밝혔다. 연구 결과는 국제 학술지인 영국왕립화학회(Royal Society of Chemistry)의 `나노스케일(Nanoscale)'誌 11월 13일 字에 게재됐다. (논문명: FRACTAL: Signal amplification of immunofluorescence via cyclic staining of target molecules)
※ 저자 정보: 조예린(신소재공학과 학사과정 학생, 제1 저자), 서준영(신소재공학과 박사과정 학생, 제2 저자), 장재범 교수(교신저자) 등 총 8명
최근 3D 전체 조직 영상화(이미징)를 가능하게 하는 생체조직 *팽창 기술(ExM) 및 투명화 기술(CLARITY, 3DISCO, CUBIC)은 복잡한 세포 간 상호작용 및 역할을 밝혀내는 핵심적인 역할을 하고 있다. 하지만 큰 부피 내부의 세포 변화를 관찰하기 위해서는 약한 형광 신호를 증폭해 높은 이미지 처리량을 갖는 기술이 필요하다.
※ 팽창 현미경 (Expansion Microscopy): 조직을 팽창시켜 일반 현미경으로 초고해상도를 얻을 수 있는 기술
※ 조직 투명화 기술 (Tissue Clearing System): 빛의 산란을 최소화하고 투과도를 극대화하여 3D 전체 조직을 이미징하는 기술
지금까지 신호 증폭 기술은 다양한 화학 반응으로 개발돼왔는데, 이들 중 많은 기술은 단일 화학 반응을 이용하기 때문에 다중 표지 신호 증폭 영상화를 위해서는 단일 신호 증폭과 비활성화 과정을 채널별로 반복해야 하는 단점이 있고, 유전자(DNA) 기반의 신호 증폭 기법은 서로 다른 항체에 대한 유전 물질 분자 결합의 최적화 과정이 필요하므로 일반적인 생물 실험실에서 사용이 어렵다.
장재범 교수 연구팀은 이러한 문제점 개선을 위해 현재 상용화돼 있는 형광 분자가 표지된 항체를 사용해, 추가적인 최적화 과정이 필요 없는 신호 증폭 기술에 주목했다.
결과적으로 연구팀은 `프랙탈(FRACTAL, Fluorescence signal amplification via repetitive labeling of target molecules)'이라는 새로운 신호 증폭 기술을 개발했다. 프랙탈 기술은 항체 기반의 염색 방법으로, 신호 증폭 과정이 매우 간단하다는 특징이 있다. 이 기술은 신호 증폭을 위해 특수한 화학 물질을 필요로 하지 않으며, 형광 분자가 표지된 2차 항체의 반복적인 염색을 통해 형광 신호를 증폭시킨다.
이 기술은 한 종류의 1차 항체, 두 종류의 2차 항체, 총 세 종류의 항체를 이용하는 아주 간단한 기술이다. 신호 증폭 과정은 표적 단백질에 대한 1차 항체 및 첫 번째 2차 항체 염색으로 시작되며, 그다음으로 첫 번째 2차 항체에 결합하는 두 번째 2차 항체의 염색이 이뤄진다. 두 번째 2차 항체의 숙주(host)와 1차 항체의 숙주(host)는 같으며, 그다음 염색은 다시 두 번째 2차 항체에 결합하는 첫 번째 2차 항체의 염색으로 이어진다.
예를 들어 토끼의 1차 항체를 사용하고 당나귀의 항-토끼 2차 항체를 첫 번째 2차 항체로 사용했다면 토끼의 항-당나귀 2차 항체를 두 번째 2차 항체로 사용하게 된다. 그러면 두 번째 2차 항체에는 첫 번째 2차 항체가 결합하게 되고 그 반대의 경우로도 결합해 염색을 이어나가게 된다.
이 과정의 반복을 통해 연구팀은 기존 형광 신호를 9배 이상 증폭시켰으며, 이는 같은 밝기를 얻는 데 필요한 영상화 시간을 9배 이상 줄일 수 있다는 결과를 얻었다. 연구팀은 초고해상도 현미경(STORM) 분석을 통해 염색 횟수에 따라 항체가 균일한 결합 층을 형성하며 형광 신호를 증폭시키는 현상을 확인했다.
연구팀은 이 기술을 서로 다른 종으로부터 유래된 직교적인(orthogonal) 항체 쌍에 적용해, 동시 다중 표지 신호 증폭 영상화를 구현했으며, 팽창 현미경에도 적용해 팽창 후에도 높은 형광의 강도를 갖는 형광 신호 증폭 기술을 구현했다.
이 기술은 간단한 항체-항원 반응에 기반해 형광 신호를 증폭시키는 기술로, 영상을 통한 생체조직의 분석 및 치료기술 개발, 다지표 검사, 의료 및 신약 개발 분야에 이바지할 것으로 연구진은 기대하고 있다.
제1 저자인 조예린 학생은 "높은 이미지 처리량을 가진 이 기술은 디지털 병리 분야의 발전에 중추적인 영향을 미칠 것ˮ이며, "생체 내 다중지표에 대한 정보를 정밀하게 제공해 현대 의약 분야의 의약품 분석 및 치료 시스템에 직접적으로 응용될 수 있다ˮ라고 말했다.
장재범 교수도“이 기술은 환자 생체 검사 조직 내부에서 매우 중요하지만 낮은 수준으로 발현되는 바이오마커들을 정확하게 이미징 할 수 있게 해주기 때문에, 암 진단 및 면역 항암제 반응률 예측 등에 큰 도움이 될 것으로 기대된다.”라고 강조했다
한편 이번 연구는 과학기술정보통신부가 지원하는 뇌과학원천기술개발 과제와 KAIST 학부연구생프로그램(URP)의 지원을 받아 수행됐다.
암 진단에 필요한 새로운 형광 증폭 기술 개발
우리 대학 신소재공학과 장재범 교수 연구팀이 암 진단에 필요한 새로운 형광 신호 증폭 기술을 개발했다고 17일 밝혔다. 연구 결과는 국제 학술지인 영국왕립화학회(Royal Society of Chemistry)의 `나노스케일(Nanoscale)'誌 11월 13일 字에 게재됐다. (논문명: FRACTAL: Signal amplification of immunofluorescence via cyclic staining of target molecules)
※ 저자 정보: 조예린(신소재공학과 학사과정 학생, 제1 저자), 서준영(신소재공학과 박사과정 학생, 제2 저자), 장재범 교수(교신저자) 등 총 8명
최근 3D 전체 조직 영상화(이미징)를 가능하게 하는 생체조직 *팽창 기술(ExM) 및 투명화 기술(CLARITY, 3DISCO, CUBIC)은 복잡한 세포 간 상호작용 및 역할을 밝혀내는 핵심적인 역할을 하고 있다. 하지만 큰 부피 내부의 세포 변화를 관찰하기 위해서는 약한 형광 신호를 증폭해 높은 이미지 처리량을 갖는 기술이 필요하다.
※ 팽창 현미경 (Expansion Microscopy): 조직을 팽창시켜 일반 현미경으로 초고해상도를 얻을 수 있는 기술
※ 조직 투명화 기술 (Tissue Clearing System): 빛의 산란을 최소화하고 투과도를 극대화하여 3D 전체 조직을 이미징하는 기술
지금까지 신호 증폭 기술은 다양한 화학 반응으로 개발돼왔는데, 이들 중 많은 기술은 단일 화학 반응을 이용하기 때문에 다중 표지 신호 증폭 영상화를 위해서는 단일 신호 증폭과 비활성화 과정을 채널별로 반복해야 하는 단점이 있고, 유전자(DNA) 기반의 신호 증폭 기법은 서로 다른 항체에 대한 유전 물질 분자 결합의 최적화 과정이 필요하므로 일반적인 생물 실험실에서 사용이 어렵다.
장재범 교수 연구팀은 이러한 문제점 개선을 위해 현재 상용화돼 있는 형광 분자가 표지된 항체를 사용해, 추가적인 최적화 과정이 필요 없는 신호 증폭 기술에 주목했다.
결과적으로 연구팀은 `프랙탈(FRACTAL, Fluorescence signal amplification via repetitive labeling of target molecules)'이라는 새로운 신호 증폭 기술을 개발했다. 프랙탈 기술은 항체 기반의 염색 방법으로, 신호 증폭 과정이 매우 간단하다는 특징이 있다. 이 기술은 신호 증폭을 위해 특수한 화학 물질을 필요로 하지 않으며, 형광 분자가 표지된 2차 항체의 반복적인 염색을 통해 형광 신호를 증폭시킨다.
이 기술은 한 종류의 1차 항체, 두 종류의 2차 항체, 총 세 종류의 항체를 이용하는 아주 간단한 기술이다. 신호 증폭 과정은 표적 단백질에 대한 1차 항체 및 첫 번째 2차 항체 염색으로 시작되며, 그다음으로 첫 번째 2차 항체에 결합하는 두 번째 2차 항체의 염색이 이뤄진다. 두 번째 2차 항체의 숙주(host)와 1차 항체의 숙주(host)는 같으며, 그다음 염색은 다시 두 번째 2차 항체에 결합하는 첫 번째 2차 항체의 염색으로 이어진다.
예를 들어 토끼의 1차 항체를 사용하고 당나귀의 항-토끼 2차 항체를 첫 번째 2차 항체로 사용했다면 토끼의 항-당나귀 2차 항체를 두 번째 2차 항체로 사용하게 된다. 그러면 두 번째 2차 항체에는 첫 번째 2차 항체가 결합하게 되고 그 반대의 경우로도 결합해 염색을 이어나가게 된다.
이 과정의 반복을 통해 연구팀은 기존 형광 신호를 9배 이상 증폭시켰으며, 이는 같은 밝기를 얻는 데 필요한 영상화 시간을 9배 이상 줄일 수 있다는 결과를 얻었다. 연구팀은 초고해상도 현미경(STORM) 분석을 통해 염색 횟수에 따라 항체가 균일한 결합 층을 형성하며 형광 신호를 증폭시키는 현상을 확인했다.
연구팀은 이 기술을 서로 다른 종으로부터 유래된 직교적인(orthogonal) 항체 쌍에 적용해, 동시 다중 표지 신호 증폭 영상화를 구현했으며, 팽창 현미경에도 적용해 팽창 후에도 높은 형광의 강도를 갖는 형광 신호 증폭 기술을 구현했다.
이 기술은 간단한 항체-항원 반응에 기반해 형광 신호를 증폭시키는 기술로, 영상을 통한 생체조직의 분석 및 치료기술 개발, 다지표 검사, 의료 및 신약 개발 분야에 이바지할 것으로 연구진은 기대하고 있다.
제1 저자인 조예린 학생은 "높은 이미지 처리량을 가진 이 기술은 디지털 병리 분야의 발전에 중추적인 영향을 미칠 것ˮ이며, "생체 내 다중지표에 대한 정보를 정밀하게 제공해 현대 의약 분야의 의약품 분석 및 치료 시스템에 직접적으로 응용될 수 있다ˮ라고 말했다.
장재범 교수도“이 기술은 환자 생체 검사 조직 내부에서 매우 중요하지만 낮은 수준으로 발현되는 바이오마커들을 정확하게 이미징 할 수 있게 해주기 때문에, 암 진단 및 면역 항암제 반응률 예측 등에 큰 도움이 될 것으로 기대된다.”라고 강조했다
한편 이번 연구는 과학기술정보통신부가 지원하는 뇌과학원천기술개발 과제와 KAIST 학부연구생프로그램(URP)의 지원을 받아 수행됐다.
2020.12.18
조회수 53472
-
 허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
2019.10.15
조회수 17589
-
 허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21
조회수 11191
-
 김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17
조회수 23464
-
 박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22
조회수 21735
-
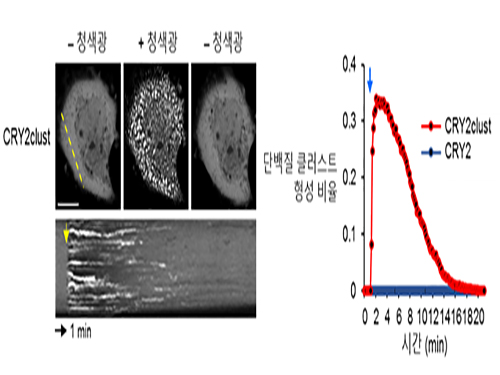 허원도 교수, 빛으로 단백질군집형성 속도 10배 높이는 새 광유전학 기술 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀이 청색광 수용 단백질인 크립토크롬2(Cryptochrome2)를 변형한 크립토크롬2 클러스트(CRY2clust)를 개발했다.
이를 통해 기존에 비해 약 10배 더 빠른 반응속도로 단백질 군집을 형성하는 데 성공했다.
이번 연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 23일자에 게재됐다.
세포막 단백질이나 신호전달 단백질, 효소 등 많은 단백질은 자신들끼리 서로 군집을 이룰 때 제 기능이 활성화된다. 그 동안 화학물질을 이용해 단백질 군집 형성을 유도하려는 노력이 이뤄져왔으나 부작용과 시간적 제약 등 한계가 있었다.
광유전학 분야 연구자들은 화학물질을 사용하지 않는 대신 빛을 이용해 단백질 군집을 형성하고자 식물의 청색광 수용 단백질인 크립토크롬2를 활용했다.
허원도 교수 연구팀은 크립토크롬2의 일부 구조를 변형해 기존 크립토크롬2를 활용한 광유전학 기술보다 단백질 군집을 더 빠르게 만들 수 있는 방법을 찾았다.
크립토크롬2의 단백질 사슬 C말단(C-terminal)에 9개의 아미노산 잔기로 구성된 매우 짧은 펩티드(Peptide)를 부착하자 일반 크립토크롬2보다 빛에 10배 이상 더 빠르게 반응한다는 사실을 관찰한 것이다.
연구진은 이 기술을 CRY2clust라 이름 붙였다.
연구팀은 과거 자체 개발한 광유전학 기술에 CRY2clust를 접목해 CRY2을 이용한 기존 시스템과의 단백질 활성 효율의 차이를 확인했다. CRY2clust를 사용하면 빛으로 세포막의 칼슘이온채널을 훨씬 빠르게 끄고 켜거나(광유도 칼슘이온채널 활성 시스템 ; OptoSTIM1) 신경세포의 분화를 더욱 효율적으로 조절(광유도 신경성장인자 수용체 활성 시스템 ; OptoTrkB)할 수 있었다.
연구진은 더 나아가 실험실에서 단백질 군집 형성에 주로 활용하는 여러 형광단백질(Fluorescent protein)과 크립토크롬2를 짝지어 결합해봄으로써 빛을 이용해 단백질 군집을 더 효율적으로 만들 수 있는 조합의 조건을 찾았다.
형광단백질이 하나보다는 여러 개가 결합한 형태일수록 빛을 비추었을 때 광유도 클러스트를 더욱 높은 비율로 형성했다. 또한 형광단백질을 크립토크롬2의 단백질 사슬 말단 중 N말단이 아닌 C말단에 붙이는 경우 광유도 클러스트 형성 효율이 더 높은 것으로 확인됐다. 단백질 군집이 잘 형성되는 조건을 찾았다는 점에서 연구자의 실험 선택의 폭을 넓혀준 데 의의가 있다.
허원도 교수 연구팀은 CRY2clust를 개발해 빛을 이용한 단백질의 활성을 훨씬 효율적으로 유도하는데 성공했다.
허원도 교수는 “이번 연구에서 개발한 CRY2clust는 향후 광유전학 분야의 실험에 유용한 도구가 될 것이다”며“다양한 형광단백질-CRY2 조합을 통해 찾은 단백질 군집 형성 성공 요인은 광유전학 시스템 개발에 길잡이 역할을 할 것이다”고 말했다.
□ 그림 설명
그림1. 기존 크립토크롬2 대비 CRY2clust의 단백질 군집 형성 속도
그림2. CRY2clust 시스템을 적용한 광유도 단백질 기능 조절
그림3. 형광단백질을 이용한 다양한 단백질 군집 형성
허원도 교수, 빛으로 단백질군집형성 속도 10배 높이는 새 광유전학 기술 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀이 청색광 수용 단백질인 크립토크롬2(Cryptochrome2)를 변형한 크립토크롬2 클러스트(CRY2clust)를 개발했다.
이를 통해 기존에 비해 약 10배 더 빠른 반응속도로 단백질 군집을 형성하는 데 성공했다.
이번 연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 23일자에 게재됐다.
세포막 단백질이나 신호전달 단백질, 효소 등 많은 단백질은 자신들끼리 서로 군집을 이룰 때 제 기능이 활성화된다. 그 동안 화학물질을 이용해 단백질 군집 형성을 유도하려는 노력이 이뤄져왔으나 부작용과 시간적 제약 등 한계가 있었다.
광유전학 분야 연구자들은 화학물질을 사용하지 않는 대신 빛을 이용해 단백질 군집을 형성하고자 식물의 청색광 수용 단백질인 크립토크롬2를 활용했다.
허원도 교수 연구팀은 크립토크롬2의 일부 구조를 변형해 기존 크립토크롬2를 활용한 광유전학 기술보다 단백질 군집을 더 빠르게 만들 수 있는 방법을 찾았다.
크립토크롬2의 단백질 사슬 C말단(C-terminal)에 9개의 아미노산 잔기로 구성된 매우 짧은 펩티드(Peptide)를 부착하자 일반 크립토크롬2보다 빛에 10배 이상 더 빠르게 반응한다는 사실을 관찰한 것이다.
연구진은 이 기술을 CRY2clust라 이름 붙였다.
연구팀은 과거 자체 개발한 광유전학 기술에 CRY2clust를 접목해 CRY2을 이용한 기존 시스템과의 단백질 활성 효율의 차이를 확인했다. CRY2clust를 사용하면 빛으로 세포막의 칼슘이온채널을 훨씬 빠르게 끄고 켜거나(광유도 칼슘이온채널 활성 시스템 ; OptoSTIM1) 신경세포의 분화를 더욱 효율적으로 조절(광유도 신경성장인자 수용체 활성 시스템 ; OptoTrkB)할 수 있었다.
연구진은 더 나아가 실험실에서 단백질 군집 형성에 주로 활용하는 여러 형광단백질(Fluorescent protein)과 크립토크롬2를 짝지어 결합해봄으로써 빛을 이용해 단백질 군집을 더 효율적으로 만들 수 있는 조합의 조건을 찾았다.
형광단백질이 하나보다는 여러 개가 결합한 형태일수록 빛을 비추었을 때 광유도 클러스트를 더욱 높은 비율로 형성했다. 또한 형광단백질을 크립토크롬2의 단백질 사슬 말단 중 N말단이 아닌 C말단에 붙이는 경우 광유도 클러스트 형성 효율이 더 높은 것으로 확인됐다. 단백질 군집이 잘 형성되는 조건을 찾았다는 점에서 연구자의 실험 선택의 폭을 넓혀준 데 의의가 있다.
허원도 교수 연구팀은 CRY2clust를 개발해 빛을 이용한 단백질의 활성을 훨씬 효율적으로 유도하는데 성공했다.
허원도 교수는 “이번 연구에서 개발한 CRY2clust는 향후 광유전학 분야의 실험에 유용한 도구가 될 것이다”며“다양한 형광단백질-CRY2 조합을 통해 찾은 단백질 군집 형성 성공 요인은 광유전학 시스템 개발에 길잡이 역할을 할 것이다”고 말했다.
□ 그림 설명
그림1. 기존 크립토크롬2 대비 CRY2clust의 단백질 군집 형성 속도
그림2. CRY2clust 시스템을 적용한 광유도 단백질 기능 조절
그림3. 형광단백질을 이용한 다양한 단백질 군집 형성
2017.06.26
조회수 16582
-
 김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27
조회수 21914
 기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6522
기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6522 알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.08 조회수 6765
알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.08 조회수 6765 10배 이상 생체신호 정밀 측정 ‘SUPPORT’ 개발
최근 유전공학 기술의 발전으로 형광현미경을 활용해 살아있는 생체조직 내 신호를 형광신호로 변환하여 연속적으로 촬영하고 측정하는 기술들이 개발되어 활용되고 있다. 그러나, 생체조직에서 방출되는 형광신호가 미약하기 때문에 빠르게 변화하는 신경세포의 전기신호 등의 신호를 측정할 경우, 매우 낮은 신호대잡음비를 가지게 되어 정밀한 측정이 어려워지게 된다.
우리 대학 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 10배 이상 정밀하게 생체 형광 신호 측정을 가능하게 하는 인공지능(AI) 영상 분석 기술을 개발했다고 20일 밝혔다.
윤 교수 연구팀은 별도의 학습 데이터 없이, 낮은 신호대잡음비를 가지는 형광현미경 영상으로부터 데이터의 통계적 분포를 스스로 학습해 영상의 신호대잡음비를 10배 이상 높여 생체신호를 정밀 측정할 수 있는 기술을 개발했다. 이를 활용하면 각종 생체 신호의 측정 정밀도가 크게 향상될 수 있어 생명과학 연구 전반과 뇌 질환 치료제 개발에 폭넓게 활용될 수 있을 것으로 기대된다.
윤 교수는 “이 기술이 다양한 뇌과학, 생명과학 연구에 도움이 되길 바라는 마음을 담아 ‘서포트(SUPPORT, Statistically Unbiased Prediction utilizing sPatiOtempoRal information in imaging daTa)라는 이름을 붙였다”며, “다양한 형광 이미징 장비를 활용하는 연구자들이 별도의 학습 데이터 없이도 쉽게 활용가능한 기술로, 새로운 생명현상 규명에 폭넓게 활용될 수 있을 것”이라고 말했다.
공동 제1 저자인 엄민호 연구원은 "서포트(SUPPORT) 기술을 통해 관측이 어려웠던 생체 신호의 빠른 변화를 정밀하게 측정하는 것에 성공하였고, 특히 밀리초 단위로 변하는 신경세포의 활동전위를 광학적으로 정밀하게 측정할 수 있어 뇌과학 연구에 매우 유용할 것이다”라고 하였으며, 공동 제1 저자인 한승재 연구원은 “서포트 기술은 형광현미경 영상 내 생체 신호의 정밀 측정을 위해 개발됐지만, 일반적인 타임랩스 영상의 품질을 높이기 위해서도 폭넓게 활용가능하다”라고 말했다.
이 기술은 전기및전자공학부 윤영규 교수팀의 주도하에 신소재공학과 장재범 교수, 의과학대학원 김필한 교수, 충남대학교, 서울대학교, 하버드대학(Harvard University), 보스턴대학(Boston University), 앨런 연구소(Allen Institute), 웨스트레이크대학(Westlake University) 연구진들과 다국적, 다학제간 협력을 통해서 개발됐다.
이번 연구는 한국연구재단의 지원을 받아 수행됐으며 국제 학술지 `네이처 메소드(Nature Methods)'에 9월 19일 자로 온라인 게재되었으며 10월호 표지 논문으로 선정됐다. (논문명 : Statistically unbiased prediction enables accurate denoising of voltage imaging data)
2023.09.20 조회수 6330
10배 이상 생체신호 정밀 측정 ‘SUPPORT’ 개발
최근 유전공학 기술의 발전으로 형광현미경을 활용해 살아있는 생체조직 내 신호를 형광신호로 변환하여 연속적으로 촬영하고 측정하는 기술들이 개발되어 활용되고 있다. 그러나, 생체조직에서 방출되는 형광신호가 미약하기 때문에 빠르게 변화하는 신경세포의 전기신호 등의 신호를 측정할 경우, 매우 낮은 신호대잡음비를 가지게 되어 정밀한 측정이 어려워지게 된다.
우리 대학 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 10배 이상 정밀하게 생체 형광 신호 측정을 가능하게 하는 인공지능(AI) 영상 분석 기술을 개발했다고 20일 밝혔다.
윤 교수 연구팀은 별도의 학습 데이터 없이, 낮은 신호대잡음비를 가지는 형광현미경 영상으로부터 데이터의 통계적 분포를 스스로 학습해 영상의 신호대잡음비를 10배 이상 높여 생체신호를 정밀 측정할 수 있는 기술을 개발했다. 이를 활용하면 각종 생체 신호의 측정 정밀도가 크게 향상될 수 있어 생명과학 연구 전반과 뇌 질환 치료제 개발에 폭넓게 활용될 수 있을 것으로 기대된다.
윤 교수는 “이 기술이 다양한 뇌과학, 생명과학 연구에 도움이 되길 바라는 마음을 담아 ‘서포트(SUPPORT, Statistically Unbiased Prediction utilizing sPatiOtempoRal information in imaging daTa)라는 이름을 붙였다”며, “다양한 형광 이미징 장비를 활용하는 연구자들이 별도의 학습 데이터 없이도 쉽게 활용가능한 기술로, 새로운 생명현상 규명에 폭넓게 활용될 수 있을 것”이라고 말했다.
공동 제1 저자인 엄민호 연구원은 "서포트(SUPPORT) 기술을 통해 관측이 어려웠던 생체 신호의 빠른 변화를 정밀하게 측정하는 것에 성공하였고, 특히 밀리초 단위로 변하는 신경세포의 활동전위를 광학적으로 정밀하게 측정할 수 있어 뇌과학 연구에 매우 유용할 것이다”라고 하였으며, 공동 제1 저자인 한승재 연구원은 “서포트 기술은 형광현미경 영상 내 생체 신호의 정밀 측정을 위해 개발됐지만, 일반적인 타임랩스 영상의 품질을 높이기 위해서도 폭넓게 활용가능하다”라고 말했다.
이 기술은 전기및전자공학부 윤영규 교수팀의 주도하에 신소재공학과 장재범 교수, 의과학대학원 김필한 교수, 충남대학교, 서울대학교, 하버드대학(Harvard University), 보스턴대학(Boston University), 앨런 연구소(Allen Institute), 웨스트레이크대학(Westlake University) 연구진들과 다국적, 다학제간 협력을 통해서 개발됐다.
이번 연구는 한국연구재단의 지원을 받아 수행됐으며 국제 학술지 `네이처 메소드(Nature Methods)'에 9월 19일 자로 온라인 게재되었으며 10월호 표지 논문으로 선정됐다. (논문명 : Statistically unbiased prediction enables accurate denoising of voltage imaging data)
2023.09.20 조회수 6330 새로운 인공지능 형광 현미경 적용, 뇌 신경세포 등 3차원 고화질 영상기술 개발
우리 대학 김재철 AI 대학원 예종철 교수 연구팀이 서울대학교 장성호 교수팀, 포스텍 김기현 교수팀과 공동연구를 통해 형광 현미경의 오랜 문제인 이방성(Anisotropy)을 해결해, 3차원 영상 화질을 획기적으로 끌어올리는 인공지능 기술을 개발했다고 29일 밝혔다.
이방성 문제란 형광 현미경으로 3차원 영상을 획득하는 데 있어 빛의 성질로 인해 영상 공간 방향 간에 적게는 2~3배, 많게는 10배까지도 화질 차이가 발생하는 문제를 뜻한다. 예를 들면 3차원 영상을 보는 각도마다 화질의 차이가 발생하는 것이다.
연구팀은 수학적 기법인 최적 수송이론 기반을 둔 새로운 인공지능 시스템을 개발해 공초점 현미경과 광 시트 현미경에 적용했다. 기존 인공지능 기법들과는 다르게, 인공지능 학습 데이터가 따로 필요하지 않고, 하나의 3차원 영상만으로도 인공지능 학습에 적용할 수 있다는 점에서 획기적이라 볼 수 있으며, 생물학 연구자들에게 생물 표본의 3차원 고화질 영상 획득에 큰 도움을 줄 것으로 기대된다.
예종철 교수는 "3차원 영상 획득에 있어 극복하기 어려웠던 현미경의 물리적 한계를 인공지능 기술을 통해 뛰어넘었다는 점에서 의미가 있고, 비지도 학습 기반으로 훈련이 진행되기 때문에, 다양한 많은 종류의 3차원 영상 촬영 기법에도 확장 적용 가능하며, 또한 인공지능 연구의 새로운 응용을 개척했다는 데 의미가 있다ˮ 고 말했다.
김재철 AI 대학원의 예종철 교수가 주도하고, 박형준 연구원이 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션스(Nature Communications)' 6월 8일 字 온라인판에 게재됐다.
*논문명 : Deep learning enables reference-free isotropic super-resolution for volumetric fluorescence microscopy
논문 링크: https://www.nature.com/articles/s41467-022-30949-6
2022.06.29 조회수 11936
새로운 인공지능 형광 현미경 적용, 뇌 신경세포 등 3차원 고화질 영상기술 개발
우리 대학 김재철 AI 대학원 예종철 교수 연구팀이 서울대학교 장성호 교수팀, 포스텍 김기현 교수팀과 공동연구를 통해 형광 현미경의 오랜 문제인 이방성(Anisotropy)을 해결해, 3차원 영상 화질을 획기적으로 끌어올리는 인공지능 기술을 개발했다고 29일 밝혔다.
이방성 문제란 형광 현미경으로 3차원 영상을 획득하는 데 있어 빛의 성질로 인해 영상 공간 방향 간에 적게는 2~3배, 많게는 10배까지도 화질 차이가 발생하는 문제를 뜻한다. 예를 들면 3차원 영상을 보는 각도마다 화질의 차이가 발생하는 것이다.
연구팀은 수학적 기법인 최적 수송이론 기반을 둔 새로운 인공지능 시스템을 개발해 공초점 현미경과 광 시트 현미경에 적용했다. 기존 인공지능 기법들과는 다르게, 인공지능 학습 데이터가 따로 필요하지 않고, 하나의 3차원 영상만으로도 인공지능 학습에 적용할 수 있다는 점에서 획기적이라 볼 수 있으며, 생물학 연구자들에게 생물 표본의 3차원 고화질 영상 획득에 큰 도움을 줄 것으로 기대된다.
예종철 교수는 "3차원 영상 획득에 있어 극복하기 어려웠던 현미경의 물리적 한계를 인공지능 기술을 통해 뛰어넘었다는 점에서 의미가 있고, 비지도 학습 기반으로 훈련이 진행되기 때문에, 다양한 많은 종류의 3차원 영상 촬영 기법에도 확장 적용 가능하며, 또한 인공지능 연구의 새로운 응용을 개척했다는 데 의미가 있다ˮ 고 말했다.
김재철 AI 대학원의 예종철 교수가 주도하고, 박형준 연구원이 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션스(Nature Communications)' 6월 8일 字 온라인판에 게재됐다.
*논문명 : Deep learning enables reference-free isotropic super-resolution for volumetric fluorescence microscopy
논문 링크: https://www.nature.com/articles/s41467-022-30949-6
2022.06.29 조회수 11936 형광 염색 없이 분자 정보를 보는 AI 현미경 개발
우리 대학 물리학과 박용근 석좌교수 연구팀이 형광 염색 없이 세포의 분자 정보를 볼 수 있는 인공지능 현미경 기술을 개발했다고 20일 밝혔다.
광학 현미경은 수백 년 전부터 현재에 이르기까지 생물학 및 의학에서 가장 중요하게 쓰이는 기술 중 하나로, 이미지 형성 원리에 따라 여러 형태로 발전해왔다. 최근 수십 년간 분자생물학이 눈부시게 발전하면서 세포 내의 특정 구조를 형광(fluorescence) 으로 표지하는 것이 가능해졌고, 이처럼 높은 생화학적 특이성(biochemical specificity) 덕분에 형광 현미경은 현재 가장 폭넓게 쓰이는 광학 현미경 기술이 됐다.
그러나 형광 현미경은 형광 표지 자체가 세포를 변형하는 것이기 때문에 세포에 부담을 주게 되고, 밝기와 세포독성, 안정성 문제 때문에 초고속 또는 장기간 측정이 힘들며, 제한된 색깔로 인해 다양한 구조를 동시에 보는 것이 어려운 근본적인 한계가 있다.
이와는 대조적으로, 각 물질과 빛의 상호작용을 결정하는 근본적인 특성인 굴절률(refractive index)을 이용해 아무런 염색을 하지 않아도 되는 현미경 기술 또한 꾸준히 발전해왔다. 굴절률로부터 파생되는 빛의 흡수, 위상차 등을 이용한 전통적인 현미경은 물론, 최근에는 굴절률 자체를 3차원 상에서 정량적으로 측정하는 다양한 홀로그래픽 현미경(holographic microscopy) 기술이 박용근 교수 연구팀에서 개발돼 상용화된 바 있다. 이러한 비표지(label-free) 현미경 기술은 형광 현미경과 비교해 여러 가지 장점을 갖고 있지만, 굴절률과 세포 내 구조들의 관계가 명확하지 않아 분자 특이성이 떨어진다는 단점이 있었다.
박용근 교수 연구팀에서는 2012년 초부터 조영주 졸업생(제1 저자, 물리학과·수리과학과 학사 11학번·KAIST 총장 장학생, 現 스탠퍼드대학교 응용물리학과 박사과정) 주도로 홀로그래픽 현미경 분야에 인공지능을 도입해 특이성 문제를 해결하려는 일련의 연구가 시작됐다.
우선 형태적으로는 비슷하나 생화학적인 구성에 차이가 있는 시료(여러 종의 박테리아, 다양한 분류의 백혈구 등)의 굴절률 영상은 사람 눈에는 비슷하게 보이는데, 흥미롭게도 인공지능은 이를 높은 정확도로 분류할 수 있음을 보였다(2013-2014년 KAIST 학부연구프로그램(URP) 이후, 2015년 Optics Express, 2017년 Science Advances, 2020년 ACS Nano 등 게재). 이러한 결과는 매우 다양한 생체 시료에서 일관되게 관찰됐고, 따라서 연구팀은 생화학적 특이성이 높은 정보가 굴절률의 공간 분포에 숨겨져 있다는 가설을 세웠다.
세포생물학 분야 최고 권위지인 `네이처 셀 바이올로지(Nature Cell Biology, IF 28.82)'에 12월 7일 발표된 이번 연구(논문명: Label-free multiplexed microtomography of endogenous subcellular dynamics using generalizable deep learning)에서, 연구팀은 홀로그래픽 현미경 영상으로부터 형광 현미경 영상을 직접 예측할 수 있음을 보임으로써 이 가설을 증명했다. 인공지능이 찾아낸 굴절률 공간 분포와 세포 내 주요 구조 간의 정량적인 관계를 이용해 굴절률의 공간 분포 해독이 가능해졌고, 놀랍게도 이러한 관계는 세포 종류와 관계없이 보존돼 있음을 확인했다.
이 과정에서 만들어진 `인공지능 현미경'은 홀로그래픽 현미경과 형광 현미경의 장점만을 갖는다. 즉, 형광 표지 없이 형광 현미경의 특이적인 영상을 얻을 수 있다. 따라서 자연 상태 그대로의 세포에서 동시에 수많은 종류의 구조를 3차원으로 볼 수 있으며, 밀리초(ms) 수준의 초고속 측정과 수십 일 수준의 장기간 측정이 가능해졌다. 더욱이 기존 데이터에 포함되지 않은 새로운 종류의 세포에도 즉시 적용이 가능하기에, 다양한 생물학 및 의학 연구에 응용이 가능할 것으로 기대된다.
이번 연구는 조영주 박사과정과 박용근 교수가 지난 10여 년간 발전시켜온 광학 및 인공지능 기술력 이외에도, 다학제적 접근과 KAIST 기술을 바탕으로 한 창업 덕분에 가능했다. 생명과학과 허원도 교수(공동 교신저자)와 박외선 박사(공동 제1 저자)가 오랜 기간 발전시켜온 분자생물학 및 형광 현미경 기술 덕분에 인공지능 학습에 필요한 데이터를 얻을 수 있었으며, 조영주 박사과정이 허원도 교수 연구팀에서 2015년 1년간 연구했던 경험 덕분에 구체적인 아이디어가 나오게 됐다.
또한 박용근 교수 연구팀 홀로그래픽 현미경 기술로 창업한 ㈜토모큐브를 통해 현미경 및 데이터 형식이 규격화돼 대규모 인공지능 학습이 용이했고, 이를 바탕으로 ㈜토모큐브 조형주 연구원(공동 제1 저자) 및 민현석 연구원(공동 교신저자) 등 인공지능 전문 인력이 합류하면서 최신 인공지능 기법들의 빠른 도입이 가능했다.
한편 이번 연구는 한국연구재단의 창의연구사업, 과학기술정보통신부의 정보통신방송 기술개발사업 (홀로그램핵심기술), 일자리진흥원의 연구장비개발 및 고도화지원사업, 한국보건산업진흥원의 보건의료기술 연구개발사업의 지원을 받아 수행됐다.
2021.12.20 조회수 11537
형광 염색 없이 분자 정보를 보는 AI 현미경 개발
우리 대학 물리학과 박용근 석좌교수 연구팀이 형광 염색 없이 세포의 분자 정보를 볼 수 있는 인공지능 현미경 기술을 개발했다고 20일 밝혔다.
광학 현미경은 수백 년 전부터 현재에 이르기까지 생물학 및 의학에서 가장 중요하게 쓰이는 기술 중 하나로, 이미지 형성 원리에 따라 여러 형태로 발전해왔다. 최근 수십 년간 분자생물학이 눈부시게 발전하면서 세포 내의 특정 구조를 형광(fluorescence) 으로 표지하는 것이 가능해졌고, 이처럼 높은 생화학적 특이성(biochemical specificity) 덕분에 형광 현미경은 현재 가장 폭넓게 쓰이는 광학 현미경 기술이 됐다.
그러나 형광 현미경은 형광 표지 자체가 세포를 변형하는 것이기 때문에 세포에 부담을 주게 되고, 밝기와 세포독성, 안정성 문제 때문에 초고속 또는 장기간 측정이 힘들며, 제한된 색깔로 인해 다양한 구조를 동시에 보는 것이 어려운 근본적인 한계가 있다.
이와는 대조적으로, 각 물질과 빛의 상호작용을 결정하는 근본적인 특성인 굴절률(refractive index)을 이용해 아무런 염색을 하지 않아도 되는 현미경 기술 또한 꾸준히 발전해왔다. 굴절률로부터 파생되는 빛의 흡수, 위상차 등을 이용한 전통적인 현미경은 물론, 최근에는 굴절률 자체를 3차원 상에서 정량적으로 측정하는 다양한 홀로그래픽 현미경(holographic microscopy) 기술이 박용근 교수 연구팀에서 개발돼 상용화된 바 있다. 이러한 비표지(label-free) 현미경 기술은 형광 현미경과 비교해 여러 가지 장점을 갖고 있지만, 굴절률과 세포 내 구조들의 관계가 명확하지 않아 분자 특이성이 떨어진다는 단점이 있었다.
박용근 교수 연구팀에서는 2012년 초부터 조영주 졸업생(제1 저자, 물리학과·수리과학과 학사 11학번·KAIST 총장 장학생, 現 스탠퍼드대학교 응용물리학과 박사과정) 주도로 홀로그래픽 현미경 분야에 인공지능을 도입해 특이성 문제를 해결하려는 일련의 연구가 시작됐다.
우선 형태적으로는 비슷하나 생화학적인 구성에 차이가 있는 시료(여러 종의 박테리아, 다양한 분류의 백혈구 등)의 굴절률 영상은 사람 눈에는 비슷하게 보이는데, 흥미롭게도 인공지능은 이를 높은 정확도로 분류할 수 있음을 보였다(2013-2014년 KAIST 학부연구프로그램(URP) 이후, 2015년 Optics Express, 2017년 Science Advances, 2020년 ACS Nano 등 게재). 이러한 결과는 매우 다양한 생체 시료에서 일관되게 관찰됐고, 따라서 연구팀은 생화학적 특이성이 높은 정보가 굴절률의 공간 분포에 숨겨져 있다는 가설을 세웠다.
세포생물학 분야 최고 권위지인 `네이처 셀 바이올로지(Nature Cell Biology, IF 28.82)'에 12월 7일 발표된 이번 연구(논문명: Label-free multiplexed microtomography of endogenous subcellular dynamics using generalizable deep learning)에서, 연구팀은 홀로그래픽 현미경 영상으로부터 형광 현미경 영상을 직접 예측할 수 있음을 보임으로써 이 가설을 증명했다. 인공지능이 찾아낸 굴절률 공간 분포와 세포 내 주요 구조 간의 정량적인 관계를 이용해 굴절률의 공간 분포 해독이 가능해졌고, 놀랍게도 이러한 관계는 세포 종류와 관계없이 보존돼 있음을 확인했다.
이 과정에서 만들어진 `인공지능 현미경'은 홀로그래픽 현미경과 형광 현미경의 장점만을 갖는다. 즉, 형광 표지 없이 형광 현미경의 특이적인 영상을 얻을 수 있다. 따라서 자연 상태 그대로의 세포에서 동시에 수많은 종류의 구조를 3차원으로 볼 수 있으며, 밀리초(ms) 수준의 초고속 측정과 수십 일 수준의 장기간 측정이 가능해졌다. 더욱이 기존 데이터에 포함되지 않은 새로운 종류의 세포에도 즉시 적용이 가능하기에, 다양한 생물학 및 의학 연구에 응용이 가능할 것으로 기대된다.
이번 연구는 조영주 박사과정과 박용근 교수가 지난 10여 년간 발전시켜온 광학 및 인공지능 기술력 이외에도, 다학제적 접근과 KAIST 기술을 바탕으로 한 창업 덕분에 가능했다. 생명과학과 허원도 교수(공동 교신저자)와 박외선 박사(공동 제1 저자)가 오랜 기간 발전시켜온 분자생물학 및 형광 현미경 기술 덕분에 인공지능 학습에 필요한 데이터를 얻을 수 있었으며, 조영주 박사과정이 허원도 교수 연구팀에서 2015년 1년간 연구했던 경험 덕분에 구체적인 아이디어가 나오게 됐다.
또한 박용근 교수 연구팀 홀로그래픽 현미경 기술로 창업한 ㈜토모큐브를 통해 현미경 및 데이터 형식이 규격화돼 대규모 인공지능 학습이 용이했고, 이를 바탕으로 ㈜토모큐브 조형주 연구원(공동 제1 저자) 및 민현석 연구원(공동 교신저자) 등 인공지능 전문 인력이 합류하면서 최신 인공지능 기법들의 빠른 도입이 가능했다.
한편 이번 연구는 한국연구재단의 창의연구사업, 과학기술정보통신부의 정보통신방송 기술개발사업 (홀로그램핵심기술), 일자리진흥원의 연구장비개발 및 고도화지원사업, 한국보건산업진흥원의 보건의료기술 연구개발사업의 지원을 받아 수행됐다.
2021.12.20 조회수 11537 암 진단에 필요한 새로운 형광 증폭 기술 개발
우리 대학 신소재공학과 장재범 교수 연구팀이 암 진단에 필요한 새로운 형광 신호 증폭 기술을 개발했다고 17일 밝혔다. 연구 결과는 국제 학술지인 영국왕립화학회(Royal Society of Chemistry)의 `나노스케일(Nanoscale)'誌 11월 13일 字에 게재됐다. (논문명: FRACTAL: Signal amplification of immunofluorescence via cyclic staining of target molecules)
※ 저자 정보: 조예린(신소재공학과 학사과정 학생, 제1 저자), 서준영(신소재공학과 박사과정 학생, 제2 저자), 장재범 교수(교신저자) 등 총 8명
최근 3D 전체 조직 영상화(이미징)를 가능하게 하는 생체조직 *팽창 기술(ExM) 및 투명화 기술(CLARITY, 3DISCO, CUBIC)은 복잡한 세포 간 상호작용 및 역할을 밝혀내는 핵심적인 역할을 하고 있다. 하지만 큰 부피 내부의 세포 변화를 관찰하기 위해서는 약한 형광 신호를 증폭해 높은 이미지 처리량을 갖는 기술이 필요하다.
※ 팽창 현미경 (Expansion Microscopy): 조직을 팽창시켜 일반 현미경으로 초고해상도를 얻을 수 있는 기술
※ 조직 투명화 기술 (Tissue Clearing System): 빛의 산란을 최소화하고 투과도를 극대화하여 3D 전체 조직을 이미징하는 기술
지금까지 신호 증폭 기술은 다양한 화학 반응으로 개발돼왔는데, 이들 중 많은 기술은 단일 화학 반응을 이용하기 때문에 다중 표지 신호 증폭 영상화를 위해서는 단일 신호 증폭과 비활성화 과정을 채널별로 반복해야 하는 단점이 있고, 유전자(DNA) 기반의 신호 증폭 기법은 서로 다른 항체에 대한 유전 물질 분자 결합의 최적화 과정이 필요하므로 일반적인 생물 실험실에서 사용이 어렵다.
장재범 교수 연구팀은 이러한 문제점 개선을 위해 현재 상용화돼 있는 형광 분자가 표지된 항체를 사용해, 추가적인 최적화 과정이 필요 없는 신호 증폭 기술에 주목했다.
결과적으로 연구팀은 `프랙탈(FRACTAL, Fluorescence signal amplification via repetitive labeling of target molecules)'이라는 새로운 신호 증폭 기술을 개발했다. 프랙탈 기술은 항체 기반의 염색 방법으로, 신호 증폭 과정이 매우 간단하다는 특징이 있다. 이 기술은 신호 증폭을 위해 특수한 화학 물질을 필요로 하지 않으며, 형광 분자가 표지된 2차 항체의 반복적인 염색을 통해 형광 신호를 증폭시킨다.
이 기술은 한 종류의 1차 항체, 두 종류의 2차 항체, 총 세 종류의 항체를 이용하는 아주 간단한 기술이다. 신호 증폭 과정은 표적 단백질에 대한 1차 항체 및 첫 번째 2차 항체 염색으로 시작되며, 그다음으로 첫 번째 2차 항체에 결합하는 두 번째 2차 항체의 염색이 이뤄진다. 두 번째 2차 항체의 숙주(host)와 1차 항체의 숙주(host)는 같으며, 그다음 염색은 다시 두 번째 2차 항체에 결합하는 첫 번째 2차 항체의 염색으로 이어진다.
예를 들어 토끼의 1차 항체를 사용하고 당나귀의 항-토끼 2차 항체를 첫 번째 2차 항체로 사용했다면 토끼의 항-당나귀 2차 항체를 두 번째 2차 항체로 사용하게 된다. 그러면 두 번째 2차 항체에는 첫 번째 2차 항체가 결합하게 되고 그 반대의 경우로도 결합해 염색을 이어나가게 된다.
이 과정의 반복을 통해 연구팀은 기존 형광 신호를 9배 이상 증폭시켰으며, 이는 같은 밝기를 얻는 데 필요한 영상화 시간을 9배 이상 줄일 수 있다는 결과를 얻었다. 연구팀은 초고해상도 현미경(STORM) 분석을 통해 염색 횟수에 따라 항체가 균일한 결합 층을 형성하며 형광 신호를 증폭시키는 현상을 확인했다.
연구팀은 이 기술을 서로 다른 종으로부터 유래된 직교적인(orthogonal) 항체 쌍에 적용해, 동시 다중 표지 신호 증폭 영상화를 구현했으며, 팽창 현미경에도 적용해 팽창 후에도 높은 형광의 강도를 갖는 형광 신호 증폭 기술을 구현했다.
이 기술은 간단한 항체-항원 반응에 기반해 형광 신호를 증폭시키는 기술로, 영상을 통한 생체조직의 분석 및 치료기술 개발, 다지표 검사, 의료 및 신약 개발 분야에 이바지할 것으로 연구진은 기대하고 있다.
제1 저자인 조예린 학생은 "높은 이미지 처리량을 가진 이 기술은 디지털 병리 분야의 발전에 중추적인 영향을 미칠 것ˮ이며, "생체 내 다중지표에 대한 정보를 정밀하게 제공해 현대 의약 분야의 의약품 분석 및 치료 시스템에 직접적으로 응용될 수 있다ˮ라고 말했다.
장재범 교수도“이 기술은 환자 생체 검사 조직 내부에서 매우 중요하지만 낮은 수준으로 발현되는 바이오마커들을 정확하게 이미징 할 수 있게 해주기 때문에, 암 진단 및 면역 항암제 반응률 예측 등에 큰 도움이 될 것으로 기대된다.”라고 강조했다
한편 이번 연구는 과학기술정보통신부가 지원하는 뇌과학원천기술개발 과제와 KAIST 학부연구생프로그램(URP)의 지원을 받아 수행됐다.
2020.12.18 조회수 53472
암 진단에 필요한 새로운 형광 증폭 기술 개발
우리 대학 신소재공학과 장재범 교수 연구팀이 암 진단에 필요한 새로운 형광 신호 증폭 기술을 개발했다고 17일 밝혔다. 연구 결과는 국제 학술지인 영국왕립화학회(Royal Society of Chemistry)의 `나노스케일(Nanoscale)'誌 11월 13일 字에 게재됐다. (논문명: FRACTAL: Signal amplification of immunofluorescence via cyclic staining of target molecules)
※ 저자 정보: 조예린(신소재공학과 학사과정 학생, 제1 저자), 서준영(신소재공학과 박사과정 학생, 제2 저자), 장재범 교수(교신저자) 등 총 8명
최근 3D 전체 조직 영상화(이미징)를 가능하게 하는 생체조직 *팽창 기술(ExM) 및 투명화 기술(CLARITY, 3DISCO, CUBIC)은 복잡한 세포 간 상호작용 및 역할을 밝혀내는 핵심적인 역할을 하고 있다. 하지만 큰 부피 내부의 세포 변화를 관찰하기 위해서는 약한 형광 신호를 증폭해 높은 이미지 처리량을 갖는 기술이 필요하다.
※ 팽창 현미경 (Expansion Microscopy): 조직을 팽창시켜 일반 현미경으로 초고해상도를 얻을 수 있는 기술
※ 조직 투명화 기술 (Tissue Clearing System): 빛의 산란을 최소화하고 투과도를 극대화하여 3D 전체 조직을 이미징하는 기술
지금까지 신호 증폭 기술은 다양한 화학 반응으로 개발돼왔는데, 이들 중 많은 기술은 단일 화학 반응을 이용하기 때문에 다중 표지 신호 증폭 영상화를 위해서는 단일 신호 증폭과 비활성화 과정을 채널별로 반복해야 하는 단점이 있고, 유전자(DNA) 기반의 신호 증폭 기법은 서로 다른 항체에 대한 유전 물질 분자 결합의 최적화 과정이 필요하므로 일반적인 생물 실험실에서 사용이 어렵다.
장재범 교수 연구팀은 이러한 문제점 개선을 위해 현재 상용화돼 있는 형광 분자가 표지된 항체를 사용해, 추가적인 최적화 과정이 필요 없는 신호 증폭 기술에 주목했다.
결과적으로 연구팀은 `프랙탈(FRACTAL, Fluorescence signal amplification via repetitive labeling of target molecules)'이라는 새로운 신호 증폭 기술을 개발했다. 프랙탈 기술은 항체 기반의 염색 방법으로, 신호 증폭 과정이 매우 간단하다는 특징이 있다. 이 기술은 신호 증폭을 위해 특수한 화학 물질을 필요로 하지 않으며, 형광 분자가 표지된 2차 항체의 반복적인 염색을 통해 형광 신호를 증폭시킨다.
이 기술은 한 종류의 1차 항체, 두 종류의 2차 항체, 총 세 종류의 항체를 이용하는 아주 간단한 기술이다. 신호 증폭 과정은 표적 단백질에 대한 1차 항체 및 첫 번째 2차 항체 염색으로 시작되며, 그다음으로 첫 번째 2차 항체에 결합하는 두 번째 2차 항체의 염색이 이뤄진다. 두 번째 2차 항체의 숙주(host)와 1차 항체의 숙주(host)는 같으며, 그다음 염색은 다시 두 번째 2차 항체에 결합하는 첫 번째 2차 항체의 염색으로 이어진다.
예를 들어 토끼의 1차 항체를 사용하고 당나귀의 항-토끼 2차 항체를 첫 번째 2차 항체로 사용했다면 토끼의 항-당나귀 2차 항체를 두 번째 2차 항체로 사용하게 된다. 그러면 두 번째 2차 항체에는 첫 번째 2차 항체가 결합하게 되고 그 반대의 경우로도 결합해 염색을 이어나가게 된다.
이 과정의 반복을 통해 연구팀은 기존 형광 신호를 9배 이상 증폭시켰으며, 이는 같은 밝기를 얻는 데 필요한 영상화 시간을 9배 이상 줄일 수 있다는 결과를 얻었다. 연구팀은 초고해상도 현미경(STORM) 분석을 통해 염색 횟수에 따라 항체가 균일한 결합 층을 형성하며 형광 신호를 증폭시키는 현상을 확인했다.
연구팀은 이 기술을 서로 다른 종으로부터 유래된 직교적인(orthogonal) 항체 쌍에 적용해, 동시 다중 표지 신호 증폭 영상화를 구현했으며, 팽창 현미경에도 적용해 팽창 후에도 높은 형광의 강도를 갖는 형광 신호 증폭 기술을 구현했다.
이 기술은 간단한 항체-항원 반응에 기반해 형광 신호를 증폭시키는 기술로, 영상을 통한 생체조직의 분석 및 치료기술 개발, 다지표 검사, 의료 및 신약 개발 분야에 이바지할 것으로 연구진은 기대하고 있다.
제1 저자인 조예린 학생은 "높은 이미지 처리량을 가진 이 기술은 디지털 병리 분야의 발전에 중추적인 영향을 미칠 것ˮ이며, "생체 내 다중지표에 대한 정보를 정밀하게 제공해 현대 의약 분야의 의약품 분석 및 치료 시스템에 직접적으로 응용될 수 있다ˮ라고 말했다.
장재범 교수도“이 기술은 환자 생체 검사 조직 내부에서 매우 중요하지만 낮은 수준으로 발현되는 바이오마커들을 정확하게 이미징 할 수 있게 해주기 때문에, 암 진단 및 면역 항암제 반응률 예측 등에 큰 도움이 될 것으로 기대된다.”라고 강조했다
한편 이번 연구는 과학기술정보통신부가 지원하는 뇌과학원천기술개발 과제와 KAIST 학부연구생프로그램(URP)의 지원을 받아 수행됐다.
2020.12.18 조회수 53472 허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
2019.10.15 조회수 17589
허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
2019.10.15 조회수 17589 허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21 조회수 11191
허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21 조회수 11191 김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 23464
김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 23464 박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21735
박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21735 허원도 교수, 빛으로 단백질군집형성 속도 10배 높이는 새 광유전학 기술 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀이 청색광 수용 단백질인 크립토크롬2(Cryptochrome2)를 변형한 크립토크롬2 클러스트(CRY2clust)를 개발했다.
이를 통해 기존에 비해 약 10배 더 빠른 반응속도로 단백질 군집을 형성하는 데 성공했다.
이번 연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 23일자에 게재됐다.
세포막 단백질이나 신호전달 단백질, 효소 등 많은 단백질은 자신들끼리 서로 군집을 이룰 때 제 기능이 활성화된다. 그 동안 화학물질을 이용해 단백질 군집 형성을 유도하려는 노력이 이뤄져왔으나 부작용과 시간적 제약 등 한계가 있었다.
광유전학 분야 연구자들은 화학물질을 사용하지 않는 대신 빛을 이용해 단백질 군집을 형성하고자 식물의 청색광 수용 단백질인 크립토크롬2를 활용했다.
허원도 교수 연구팀은 크립토크롬2의 일부 구조를 변형해 기존 크립토크롬2를 활용한 광유전학 기술보다 단백질 군집을 더 빠르게 만들 수 있는 방법을 찾았다.
크립토크롬2의 단백질 사슬 C말단(C-terminal)에 9개의 아미노산 잔기로 구성된 매우 짧은 펩티드(Peptide)를 부착하자 일반 크립토크롬2보다 빛에 10배 이상 더 빠르게 반응한다는 사실을 관찰한 것이다.
연구진은 이 기술을 CRY2clust라 이름 붙였다.
연구팀은 과거 자체 개발한 광유전학 기술에 CRY2clust를 접목해 CRY2을 이용한 기존 시스템과의 단백질 활성 효율의 차이를 확인했다. CRY2clust를 사용하면 빛으로 세포막의 칼슘이온채널을 훨씬 빠르게 끄고 켜거나(광유도 칼슘이온채널 활성 시스템 ; OptoSTIM1) 신경세포의 분화를 더욱 효율적으로 조절(광유도 신경성장인자 수용체 활성 시스템 ; OptoTrkB)할 수 있었다.
연구진은 더 나아가 실험실에서 단백질 군집 형성에 주로 활용하는 여러 형광단백질(Fluorescent protein)과 크립토크롬2를 짝지어 결합해봄으로써 빛을 이용해 단백질 군집을 더 효율적으로 만들 수 있는 조합의 조건을 찾았다.
형광단백질이 하나보다는 여러 개가 결합한 형태일수록 빛을 비추었을 때 광유도 클러스트를 더욱 높은 비율로 형성했다. 또한 형광단백질을 크립토크롬2의 단백질 사슬 말단 중 N말단이 아닌 C말단에 붙이는 경우 광유도 클러스트 형성 효율이 더 높은 것으로 확인됐다. 단백질 군집이 잘 형성되는 조건을 찾았다는 점에서 연구자의 실험 선택의 폭을 넓혀준 데 의의가 있다.
허원도 교수 연구팀은 CRY2clust를 개발해 빛을 이용한 단백질의 활성을 훨씬 효율적으로 유도하는데 성공했다.
허원도 교수는 “이번 연구에서 개발한 CRY2clust는 향후 광유전학 분야의 실험에 유용한 도구가 될 것이다”며“다양한 형광단백질-CRY2 조합을 통해 찾은 단백질 군집 형성 성공 요인은 광유전학 시스템 개발에 길잡이 역할을 할 것이다”고 말했다.
□ 그림 설명
그림1. 기존 크립토크롬2 대비 CRY2clust의 단백질 군집 형성 속도
그림2. CRY2clust 시스템을 적용한 광유도 단백질 기능 조절
그림3. 형광단백질을 이용한 다양한 단백질 군집 형성
2017.06.26 조회수 16582
허원도 교수, 빛으로 단백질군집형성 속도 10배 높이는 새 광유전학 기술 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀이 청색광 수용 단백질인 크립토크롬2(Cryptochrome2)를 변형한 크립토크롬2 클러스트(CRY2clust)를 개발했다.
이를 통해 기존에 비해 약 10배 더 빠른 반응속도로 단백질 군집을 형성하는 데 성공했다.
이번 연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 23일자에 게재됐다.
세포막 단백질이나 신호전달 단백질, 효소 등 많은 단백질은 자신들끼리 서로 군집을 이룰 때 제 기능이 활성화된다. 그 동안 화학물질을 이용해 단백질 군집 형성을 유도하려는 노력이 이뤄져왔으나 부작용과 시간적 제약 등 한계가 있었다.
광유전학 분야 연구자들은 화학물질을 사용하지 않는 대신 빛을 이용해 단백질 군집을 형성하고자 식물의 청색광 수용 단백질인 크립토크롬2를 활용했다.
허원도 교수 연구팀은 크립토크롬2의 일부 구조를 변형해 기존 크립토크롬2를 활용한 광유전학 기술보다 단백질 군집을 더 빠르게 만들 수 있는 방법을 찾았다.
크립토크롬2의 단백질 사슬 C말단(C-terminal)에 9개의 아미노산 잔기로 구성된 매우 짧은 펩티드(Peptide)를 부착하자 일반 크립토크롬2보다 빛에 10배 이상 더 빠르게 반응한다는 사실을 관찰한 것이다.
연구진은 이 기술을 CRY2clust라 이름 붙였다.
연구팀은 과거 자체 개발한 광유전학 기술에 CRY2clust를 접목해 CRY2을 이용한 기존 시스템과의 단백질 활성 효율의 차이를 확인했다. CRY2clust를 사용하면 빛으로 세포막의 칼슘이온채널을 훨씬 빠르게 끄고 켜거나(광유도 칼슘이온채널 활성 시스템 ; OptoSTIM1) 신경세포의 분화를 더욱 효율적으로 조절(광유도 신경성장인자 수용체 활성 시스템 ; OptoTrkB)할 수 있었다.
연구진은 더 나아가 실험실에서 단백질 군집 형성에 주로 활용하는 여러 형광단백질(Fluorescent protein)과 크립토크롬2를 짝지어 결합해봄으로써 빛을 이용해 단백질 군집을 더 효율적으로 만들 수 있는 조합의 조건을 찾았다.
형광단백질이 하나보다는 여러 개가 결합한 형태일수록 빛을 비추었을 때 광유도 클러스트를 더욱 높은 비율로 형성했다. 또한 형광단백질을 크립토크롬2의 단백질 사슬 말단 중 N말단이 아닌 C말단에 붙이는 경우 광유도 클러스트 형성 효율이 더 높은 것으로 확인됐다. 단백질 군집이 잘 형성되는 조건을 찾았다는 점에서 연구자의 실험 선택의 폭을 넓혀준 데 의의가 있다.
허원도 교수 연구팀은 CRY2clust를 개발해 빛을 이용한 단백질의 활성을 훨씬 효율적으로 유도하는데 성공했다.
허원도 교수는 “이번 연구에서 개발한 CRY2clust는 향후 광유전학 분야의 실험에 유용한 도구가 될 것이다”며“다양한 형광단백질-CRY2 조합을 통해 찾은 단백질 군집 형성 성공 요인은 광유전학 시스템 개발에 길잡이 역할을 할 것이다”고 말했다.
□ 그림 설명
그림1. 기존 크립토크롬2 대비 CRY2clust의 단백질 군집 형성 속도
그림2. CRY2clust 시스템을 적용한 광유도 단백질 기능 조절
그림3. 형광단백질을 이용한 다양한 단백질 군집 형성
2017.06.26 조회수 16582 김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21914
김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21914