-
 소금, 자가조립 나노캡슐 소재로 쓰이다
우리 대학 기계공학과 김형수 교수와 박광석 박사과정이 소금의 결정화 프로세스를 표면장력 효과로 제어해 나노 및 마이크로 캡슐을 제작하는 원천 기술을 개발했다고 5일 밝혔다. 이를 `결정 모세관 오리가미 기술(Crystal Capillary Origami Technology)'이라고 칭한다.
최근 나노물질 자가 조립기술은 기능성 고분자, 바이오 재료 분야 및 반도체 나노 구조체 제조 등에 활용되는 등 바이오기술(BT) 및 정보통신기술(IT) 분야와 서로 기술적으로 융합 발전되고 있어, 미래 산업에 미칠 경제적 효과가 막대할 것으로 예상되어 그 관심도가 높아지고 있다.
일반적인 자가 조립기술은 미리 정해진 기본 유닛을 이용하는 상향식 (bottom-up approach) 기술 방법이다. 보통 폴리머나 콜로이드 등을 이용해 최종 형태를 구성하게 되고, 이 기술은 분자 수준부터 마이크로미터 수준까지 폭넓은 길이 차원에 적용할 수 있다.
자가 조립기술을 이용하면 나노캡슐을 제작할 수 있는데 공정 특성상 캡슐화를 위해서 경화 과정이 필수적이라 제작공정이 간단하지 않다.
김형수 교수는 “지구상에 존재하는 수많은 미네랄이 있을 텐데 이번 연구에서 사용한 특정 소금들과 같이 기본 결정 구조가 얇고 잘 휘는 성질의 결정을 발견해서 활용할 수 있으면 이멀젼(유화액)이나 액적(물방울) 내부에 원하는 물질을 자발적이고 효과적으로 가둘 수 있다ˮ라고 설명했다.
기계공학과 박광석 박사과정이 제1 저자로 참여한 해당 연구 결과는 국제적 권위 학술단체 영국왕립화학회(Royal Society of Chemistry)의 저명학술지 나노스케일(Nanoscale) 誌에 9월 10일 字 게재됐고, 연구의 우수성을 인정받아 표지논문(Inside Front Cover)으로 게재됐다.
한편 이번 연구는 한국연구재단의 지원을 받아 핵융합기초연구사업(NRF-2021R1A2C2007835)과 삼성전자 산학협력 과제 (IO201216-08212-01)의 지원을 부분적으로 받아 수행됐다.
(논문명: Crystal capillary origami capsule with self-assembled nanostructures)
소금, 자가조립 나노캡슐 소재로 쓰이다
우리 대학 기계공학과 김형수 교수와 박광석 박사과정이 소금의 결정화 프로세스를 표면장력 효과로 제어해 나노 및 마이크로 캡슐을 제작하는 원천 기술을 개발했다고 5일 밝혔다. 이를 `결정 모세관 오리가미 기술(Crystal Capillary Origami Technology)'이라고 칭한다.
최근 나노물질 자가 조립기술은 기능성 고분자, 바이오 재료 분야 및 반도체 나노 구조체 제조 등에 활용되는 등 바이오기술(BT) 및 정보통신기술(IT) 분야와 서로 기술적으로 융합 발전되고 있어, 미래 산업에 미칠 경제적 효과가 막대할 것으로 예상되어 그 관심도가 높아지고 있다.
일반적인 자가 조립기술은 미리 정해진 기본 유닛을 이용하는 상향식 (bottom-up approach) 기술 방법이다. 보통 폴리머나 콜로이드 등을 이용해 최종 형태를 구성하게 되고, 이 기술은 분자 수준부터 마이크로미터 수준까지 폭넓은 길이 차원에 적용할 수 있다.
자가 조립기술을 이용하면 나노캡슐을 제작할 수 있는데 공정 특성상 캡슐화를 위해서 경화 과정이 필수적이라 제작공정이 간단하지 않다.
김형수 교수는 “지구상에 존재하는 수많은 미네랄이 있을 텐데 이번 연구에서 사용한 특정 소금들과 같이 기본 결정 구조가 얇고 잘 휘는 성질의 결정을 발견해서 활용할 수 있으면 이멀젼(유화액)이나 액적(물방울) 내부에 원하는 물질을 자발적이고 효과적으로 가둘 수 있다ˮ라고 설명했다.
기계공학과 박광석 박사과정이 제1 저자로 참여한 해당 연구 결과는 국제적 권위 학술단체 영국왕립화학회(Royal Society of Chemistry)의 저명학술지 나노스케일(Nanoscale) 誌에 9월 10일 字 게재됐고, 연구의 우수성을 인정받아 표지논문(Inside Front Cover)으로 게재됐다.
한편 이번 연구는 한국연구재단의 지원을 받아 핵융합기초연구사업(NRF-2021R1A2C2007835)과 삼성전자 산학협력 과제 (IO201216-08212-01)의 지원을 부분적으로 받아 수행됐다.
(논문명: Crystal capillary origami capsule with self-assembled nanostructures)
2021.10.05
조회수 10843
-
 숨 쉬는 헤어셀 구조의 피부부착형 맥파 센서 개발
우리 대학 바이오및뇌공학과 조영호 교수 연구팀이 피부에서 발생하는 땀을 실시간으로 투과시키며 피부와의 접촉면적을 획기적으로 개선한 다공성 헤어셀 구조의 맥파※ 센서를 개발했다고 17일 밝혔다.
※ 맥파: 심장이 박동할 때 발생하는 파동을 말한다.
헤어셀 구조란 피부의 섬모와 같이 다공성 표면 위에 여러 개의 섬모가 형성돼있는 구조를 말한다.
새로 개발된 다공성 헤어셀 구조의 맥파 센서 기술은 맥파 외 피부 온도, 피부 전도도 등 타 생체신호 센서들의 결합을 통해, 인간의 정신건강 상태를 상시 장기적으로 판별하는 연구에 적용하고 있다.
바이오및뇌공학과 석민호 박사과정의 주도로 개발한 이번 연구는 국제 학술지 `나노스케일 어드벤시스(Nanoscale Advances)' 7월 27일 字 온라인판에 게재됐다. 논문명: A Porous PDMS Pulsewave Sensor with Haircell Structures for Water Vapor Transmission Rate and Signal-to-Noise Ratio Enhancement)
기존 폴리머 기반 맥파 센서는 땀 투과도가 피부의 하루 평균 땀 발생량 (432g/m2) 보다 낮아 장기간 부착 시 접촉성 피부염, 가려움 등의 피부 문제를 일으키는 단점이 있으며, 피부에 안정적으로 접촉할 수 있는 면적이 낮아 맥파 신호의 정확도가 떨어지는 문제를 지닌다.
조영호 교수 연구팀은 문제 해결을 위해, 폴리디메틸실록산(PDMS) 고분자 내에 구연산을 결정화 후 에탄올로 녹여 작고 균일한 공극을 형성함으로써 맥파 센서의 땀 투과도를 높였으며, 이러한 다공성 고분자 표면에 헤어셀 구조를 형성해 피부와의 접촉면적을 획기적으로 넓혀 맥파 센서의 측정 정확도를 개선한 다공성 헤어셀 구조의 맥파 센서를 제작했다.
이번 다공성 헤어셀 구조의 맥파 센서의 땀 투과도는 하루 486g/m2을 보여 피부의 하루 평균 땀 발생량보다 많고, 기존 기술 대비 72% 증가함을 보였다. 또한 피부에 장기간 부착 시에도 피부 트러블이 발생하지 않음을 7일간의 연속 부착 실험을 통해 입증했다. 측정 정확도(≈신호대잡음비※)는 22.89를 보여, 기존 기술 대비 측정 정확도를 약 9배 높였다.
※ 신호대잡음비: 잡음의 크기 대비 맥파 신호의 크기 정도를 말한다.
조영호 교수는 "이번 연구를 통해 피부 트러블 없이 인간의 건강 상태를 상시 모니터링할 수 있는 웨어러블 센서를 개발했고 인공피부로서의 상시 사용성 역시 확립했다ˮ고 말했다.
한편, 이번 연구는 알키미스트 프로젝트 사업의 지원을 통해 수행됐다.
숨 쉬는 헤어셀 구조의 피부부착형 맥파 센서 개발
우리 대학 바이오및뇌공학과 조영호 교수 연구팀이 피부에서 발생하는 땀을 실시간으로 투과시키며 피부와의 접촉면적을 획기적으로 개선한 다공성 헤어셀 구조의 맥파※ 센서를 개발했다고 17일 밝혔다.
※ 맥파: 심장이 박동할 때 발생하는 파동을 말한다.
헤어셀 구조란 피부의 섬모와 같이 다공성 표면 위에 여러 개의 섬모가 형성돼있는 구조를 말한다.
새로 개발된 다공성 헤어셀 구조의 맥파 센서 기술은 맥파 외 피부 온도, 피부 전도도 등 타 생체신호 센서들의 결합을 통해, 인간의 정신건강 상태를 상시 장기적으로 판별하는 연구에 적용하고 있다.
바이오및뇌공학과 석민호 박사과정의 주도로 개발한 이번 연구는 국제 학술지 `나노스케일 어드벤시스(Nanoscale Advances)' 7월 27일 字 온라인판에 게재됐다. 논문명: A Porous PDMS Pulsewave Sensor with Haircell Structures for Water Vapor Transmission Rate and Signal-to-Noise Ratio Enhancement)
기존 폴리머 기반 맥파 센서는 땀 투과도가 피부의 하루 평균 땀 발생량 (432g/m2) 보다 낮아 장기간 부착 시 접촉성 피부염, 가려움 등의 피부 문제를 일으키는 단점이 있으며, 피부에 안정적으로 접촉할 수 있는 면적이 낮아 맥파 신호의 정확도가 떨어지는 문제를 지닌다.
조영호 교수 연구팀은 문제 해결을 위해, 폴리디메틸실록산(PDMS) 고분자 내에 구연산을 결정화 후 에탄올로 녹여 작고 균일한 공극을 형성함으로써 맥파 센서의 땀 투과도를 높였으며, 이러한 다공성 고분자 표면에 헤어셀 구조를 형성해 피부와의 접촉면적을 획기적으로 넓혀 맥파 센서의 측정 정확도를 개선한 다공성 헤어셀 구조의 맥파 센서를 제작했다.
이번 다공성 헤어셀 구조의 맥파 센서의 땀 투과도는 하루 486g/m2을 보여 피부의 하루 평균 땀 발생량보다 많고, 기존 기술 대비 72% 증가함을 보였다. 또한 피부에 장기간 부착 시에도 피부 트러블이 발생하지 않음을 7일간의 연속 부착 실험을 통해 입증했다. 측정 정확도(≈신호대잡음비※)는 22.89를 보여, 기존 기술 대비 측정 정확도를 약 9배 높였다.
※ 신호대잡음비: 잡음의 크기 대비 맥파 신호의 크기 정도를 말한다.
조영호 교수는 "이번 연구를 통해 피부 트러블 없이 인간의 건강 상태를 상시 모니터링할 수 있는 웨어러블 센서를 개발했고 인공피부로서의 상시 사용성 역시 확립했다ˮ고 말했다.
한편, 이번 연구는 알키미스트 프로젝트 사업의 지원을 통해 수행됐다.
2021.08.18
조회수 9722
-
 RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15
조회수 14200
-
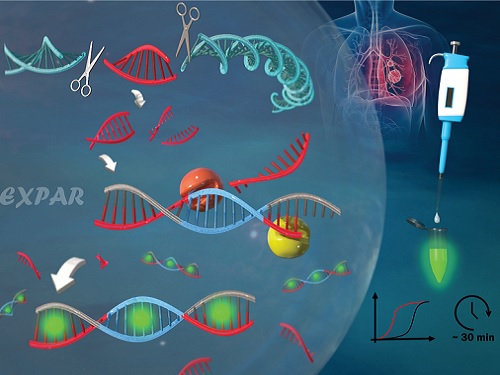 유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11
조회수 33494
-
 박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22
조회수 21133
 소금, 자가조립 나노캡슐 소재로 쓰이다
우리 대학 기계공학과 김형수 교수와 박광석 박사과정이 소금의 결정화 프로세스를 표면장력 효과로 제어해 나노 및 마이크로 캡슐을 제작하는 원천 기술을 개발했다고 5일 밝혔다. 이를 `결정 모세관 오리가미 기술(Crystal Capillary Origami Technology)'이라고 칭한다.
최근 나노물질 자가 조립기술은 기능성 고분자, 바이오 재료 분야 및 반도체 나노 구조체 제조 등에 활용되는 등 바이오기술(BT) 및 정보통신기술(IT) 분야와 서로 기술적으로 융합 발전되고 있어, 미래 산업에 미칠 경제적 효과가 막대할 것으로 예상되어 그 관심도가 높아지고 있다.
일반적인 자가 조립기술은 미리 정해진 기본 유닛을 이용하는 상향식 (bottom-up approach) 기술 방법이다. 보통 폴리머나 콜로이드 등을 이용해 최종 형태를 구성하게 되고, 이 기술은 분자 수준부터 마이크로미터 수준까지 폭넓은 길이 차원에 적용할 수 있다.
자가 조립기술을 이용하면 나노캡슐을 제작할 수 있는데 공정 특성상 캡슐화를 위해서 경화 과정이 필수적이라 제작공정이 간단하지 않다.
김형수 교수는 “지구상에 존재하는 수많은 미네랄이 있을 텐데 이번 연구에서 사용한 특정 소금들과 같이 기본 결정 구조가 얇고 잘 휘는 성질의 결정을 발견해서 활용할 수 있으면 이멀젼(유화액)이나 액적(물방울) 내부에 원하는 물질을 자발적이고 효과적으로 가둘 수 있다ˮ라고 설명했다.
기계공학과 박광석 박사과정이 제1 저자로 참여한 해당 연구 결과는 국제적 권위 학술단체 영국왕립화학회(Royal Society of Chemistry)의 저명학술지 나노스케일(Nanoscale) 誌에 9월 10일 字 게재됐고, 연구의 우수성을 인정받아 표지논문(Inside Front Cover)으로 게재됐다.
한편 이번 연구는 한국연구재단의 지원을 받아 핵융합기초연구사업(NRF-2021R1A2C2007835)과 삼성전자 산학협력 과제 (IO201216-08212-01)의 지원을 부분적으로 받아 수행됐다.
(논문명: Crystal capillary origami capsule with self-assembled nanostructures)
2021.10.05 조회수 10843
소금, 자가조립 나노캡슐 소재로 쓰이다
우리 대학 기계공학과 김형수 교수와 박광석 박사과정이 소금의 결정화 프로세스를 표면장력 효과로 제어해 나노 및 마이크로 캡슐을 제작하는 원천 기술을 개발했다고 5일 밝혔다. 이를 `결정 모세관 오리가미 기술(Crystal Capillary Origami Technology)'이라고 칭한다.
최근 나노물질 자가 조립기술은 기능성 고분자, 바이오 재료 분야 및 반도체 나노 구조체 제조 등에 활용되는 등 바이오기술(BT) 및 정보통신기술(IT) 분야와 서로 기술적으로 융합 발전되고 있어, 미래 산업에 미칠 경제적 효과가 막대할 것으로 예상되어 그 관심도가 높아지고 있다.
일반적인 자가 조립기술은 미리 정해진 기본 유닛을 이용하는 상향식 (bottom-up approach) 기술 방법이다. 보통 폴리머나 콜로이드 등을 이용해 최종 형태를 구성하게 되고, 이 기술은 분자 수준부터 마이크로미터 수준까지 폭넓은 길이 차원에 적용할 수 있다.
자가 조립기술을 이용하면 나노캡슐을 제작할 수 있는데 공정 특성상 캡슐화를 위해서 경화 과정이 필수적이라 제작공정이 간단하지 않다.
김형수 교수는 “지구상에 존재하는 수많은 미네랄이 있을 텐데 이번 연구에서 사용한 특정 소금들과 같이 기본 결정 구조가 얇고 잘 휘는 성질의 결정을 발견해서 활용할 수 있으면 이멀젼(유화액)이나 액적(물방울) 내부에 원하는 물질을 자발적이고 효과적으로 가둘 수 있다ˮ라고 설명했다.
기계공학과 박광석 박사과정이 제1 저자로 참여한 해당 연구 결과는 국제적 권위 학술단체 영국왕립화학회(Royal Society of Chemistry)의 저명학술지 나노스케일(Nanoscale) 誌에 9월 10일 字 게재됐고, 연구의 우수성을 인정받아 표지논문(Inside Front Cover)으로 게재됐다.
한편 이번 연구는 한국연구재단의 지원을 받아 핵융합기초연구사업(NRF-2021R1A2C2007835)과 삼성전자 산학협력 과제 (IO201216-08212-01)의 지원을 부분적으로 받아 수행됐다.
(논문명: Crystal capillary origami capsule with self-assembled nanostructures)
2021.10.05 조회수 10843 숨 쉬는 헤어셀 구조의 피부부착형 맥파 센서 개발
우리 대학 바이오및뇌공학과 조영호 교수 연구팀이 피부에서 발생하는 땀을 실시간으로 투과시키며 피부와의 접촉면적을 획기적으로 개선한 다공성 헤어셀 구조의 맥파※ 센서를 개발했다고 17일 밝혔다.
※ 맥파: 심장이 박동할 때 발생하는 파동을 말한다.
헤어셀 구조란 피부의 섬모와 같이 다공성 표면 위에 여러 개의 섬모가 형성돼있는 구조를 말한다.
새로 개발된 다공성 헤어셀 구조의 맥파 센서 기술은 맥파 외 피부 온도, 피부 전도도 등 타 생체신호 센서들의 결합을 통해, 인간의 정신건강 상태를 상시 장기적으로 판별하는 연구에 적용하고 있다.
바이오및뇌공학과 석민호 박사과정의 주도로 개발한 이번 연구는 국제 학술지 `나노스케일 어드벤시스(Nanoscale Advances)' 7월 27일 字 온라인판에 게재됐다. 논문명: A Porous PDMS Pulsewave Sensor with Haircell Structures for Water Vapor Transmission Rate and Signal-to-Noise Ratio Enhancement)
기존 폴리머 기반 맥파 센서는 땀 투과도가 피부의 하루 평균 땀 발생량 (432g/m2) 보다 낮아 장기간 부착 시 접촉성 피부염, 가려움 등의 피부 문제를 일으키는 단점이 있으며, 피부에 안정적으로 접촉할 수 있는 면적이 낮아 맥파 신호의 정확도가 떨어지는 문제를 지닌다.
조영호 교수 연구팀은 문제 해결을 위해, 폴리디메틸실록산(PDMS) 고분자 내에 구연산을 결정화 후 에탄올로 녹여 작고 균일한 공극을 형성함으로써 맥파 센서의 땀 투과도를 높였으며, 이러한 다공성 고분자 표면에 헤어셀 구조를 형성해 피부와의 접촉면적을 획기적으로 넓혀 맥파 센서의 측정 정확도를 개선한 다공성 헤어셀 구조의 맥파 센서를 제작했다.
이번 다공성 헤어셀 구조의 맥파 센서의 땀 투과도는 하루 486g/m2을 보여 피부의 하루 평균 땀 발생량보다 많고, 기존 기술 대비 72% 증가함을 보였다. 또한 피부에 장기간 부착 시에도 피부 트러블이 발생하지 않음을 7일간의 연속 부착 실험을 통해 입증했다. 측정 정확도(≈신호대잡음비※)는 22.89를 보여, 기존 기술 대비 측정 정확도를 약 9배 높였다.
※ 신호대잡음비: 잡음의 크기 대비 맥파 신호의 크기 정도를 말한다.
조영호 교수는 "이번 연구를 통해 피부 트러블 없이 인간의 건강 상태를 상시 모니터링할 수 있는 웨어러블 센서를 개발했고 인공피부로서의 상시 사용성 역시 확립했다ˮ고 말했다.
한편, 이번 연구는 알키미스트 프로젝트 사업의 지원을 통해 수행됐다.
2021.08.18 조회수 9722
숨 쉬는 헤어셀 구조의 피부부착형 맥파 센서 개발
우리 대학 바이오및뇌공학과 조영호 교수 연구팀이 피부에서 발생하는 땀을 실시간으로 투과시키며 피부와의 접촉면적을 획기적으로 개선한 다공성 헤어셀 구조의 맥파※ 센서를 개발했다고 17일 밝혔다.
※ 맥파: 심장이 박동할 때 발생하는 파동을 말한다.
헤어셀 구조란 피부의 섬모와 같이 다공성 표면 위에 여러 개의 섬모가 형성돼있는 구조를 말한다.
새로 개발된 다공성 헤어셀 구조의 맥파 센서 기술은 맥파 외 피부 온도, 피부 전도도 등 타 생체신호 센서들의 결합을 통해, 인간의 정신건강 상태를 상시 장기적으로 판별하는 연구에 적용하고 있다.
바이오및뇌공학과 석민호 박사과정의 주도로 개발한 이번 연구는 국제 학술지 `나노스케일 어드벤시스(Nanoscale Advances)' 7월 27일 字 온라인판에 게재됐다. 논문명: A Porous PDMS Pulsewave Sensor with Haircell Structures for Water Vapor Transmission Rate and Signal-to-Noise Ratio Enhancement)
기존 폴리머 기반 맥파 센서는 땀 투과도가 피부의 하루 평균 땀 발생량 (432g/m2) 보다 낮아 장기간 부착 시 접촉성 피부염, 가려움 등의 피부 문제를 일으키는 단점이 있으며, 피부에 안정적으로 접촉할 수 있는 면적이 낮아 맥파 신호의 정확도가 떨어지는 문제를 지닌다.
조영호 교수 연구팀은 문제 해결을 위해, 폴리디메틸실록산(PDMS) 고분자 내에 구연산을 결정화 후 에탄올로 녹여 작고 균일한 공극을 형성함으로써 맥파 센서의 땀 투과도를 높였으며, 이러한 다공성 고분자 표면에 헤어셀 구조를 형성해 피부와의 접촉면적을 획기적으로 넓혀 맥파 센서의 측정 정확도를 개선한 다공성 헤어셀 구조의 맥파 센서를 제작했다.
이번 다공성 헤어셀 구조의 맥파 센서의 땀 투과도는 하루 486g/m2을 보여 피부의 하루 평균 땀 발생량보다 많고, 기존 기술 대비 72% 증가함을 보였다. 또한 피부에 장기간 부착 시에도 피부 트러블이 발생하지 않음을 7일간의 연속 부착 실험을 통해 입증했다. 측정 정확도(≈신호대잡음비※)는 22.89를 보여, 기존 기술 대비 측정 정확도를 약 9배 높였다.
※ 신호대잡음비: 잡음의 크기 대비 맥파 신호의 크기 정도를 말한다.
조영호 교수는 "이번 연구를 통해 피부 트러블 없이 인간의 건강 상태를 상시 모니터링할 수 있는 웨어러블 센서를 개발했고 인공피부로서의 상시 사용성 역시 확립했다ˮ고 말했다.
한편, 이번 연구는 알키미스트 프로젝트 사업의 지원을 통해 수행됐다.
2021.08.18 조회수 9722 RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15 조회수 14200
RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15 조회수 14200 유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 33494
유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 33494 박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21133
박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21133