-
 뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
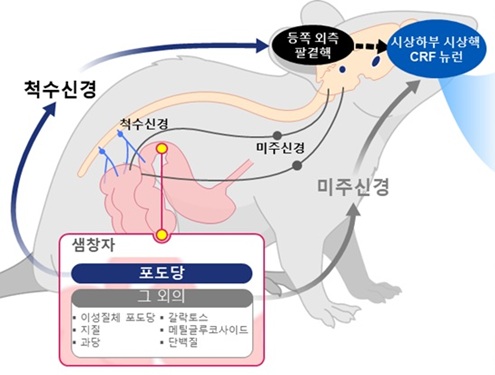
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
2025.07.09
조회수 245
-
 동물의 과식을 억제하는 원리 규명
장면 하나, 영국의 전설적인 코미디 그룹인 몬티 파이선(Monthy Phython) 의 '삶의 의미(The meaning of life) (1983)'라는 영화에서는 영화사에 손꼽히는 충격적 장면이 등장한다. 배가 잔뜩 불러 레스토랑에 들어온 크레오소트 씨는 웨이터가 권하는 음식을 끊임없이 먹다가 결국 배가 터져버린다. 이로 인해 배 속에 있던 음식물이 레스토랑 전체로 흩뿌려지는 장면은 관객들에게 하여금 매우 불쾌한 감정을 느끼게 한다.
장면 둘, 오스트레일리아 빅토리아주 멜버른 대학교에서 모기를 연구하는 페란 로즈 박사가 공개한 영상이 화제가 되고 있다. 이 영상에서는 인간의 피를 탐욕스럽게 빨다가 결국 배가 터져버리는 모기의 충격적인 모습을 보여주고 있다. 본격적으로 시작되는 초여름 더위와 함께 찾아온 모기들 때문에 밤잠을 설친 사람이라면 약간의 통쾌함을 느낄 수도 있는 장면일 수도 있겠다.
앞서 제시한 두 가지의 충격적이고 약간은 괴기스러운 장면들은 실제 자연 상태에서는 발생하지 않는다는 공통점을 가지고 있다. 실제 자연 상태의 (인간을 포함한) 동물들에서는 특정 수준 이상으로 음식을 섭취하면 섭식 행동을 억제하는 신경전달체계가 작동해 과식으로 인한 내장 파열은 발생하지 않는다.
인간은 자연적인 상황에서 내장기관이 손상될 정도로 음식을 과도하게 먹지 않으며, 모기의 경우 과도한 섭식 행동을 억제하는 복부 신경중추가 물리적으로 파손됐기 때문에 배가 터지도록 피를 빨았던 것이다. 이렇듯 동물들은 과도한 섭식 행동을 억제하는 다양하고 체계적인 시스템을 가지고 있다. 이러한 과식 억제 신호에 대한 구체적 이해는 인간의 식이장애 및 비만 발생 과정을 이해하는 데 필수적이지만, 이에 관한 연구는 아직 충분히 이루어지지 않은 상태다. 이런 가운데 최근 국내외 연구진의 과식 방지를 위한 새로운 억제 신경망에 대한 연구결과가 밝혀져 화제가 되고 있다.
우리 대학 생명과학과 서성배 교수 연구팀이 뉴욕대학교 (NYU) 오양균 박사 연구팀과 공동연구를 통해 충분한 음식을 섭취한 초파리에서 특이적으로 발견되는 두 개의 독립적인 과식 억제 시스템을 최초로 발견했다고 15일 밝혔다. 뉴욕대학교 (NYU) 오양균 박사가 제1 저자로, KAIST 생명과학과 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제 신경과학 전문 최고 권위 학술지 `뉴런 (Neuron)'의 5월 19일 字 온라인판에 게재됐다. (논문명: Periphery signals generated by Piezo-mediated stomach stretch and Neuromedin-mediated glucose load regulate the Drosophila brain nutrient sensor)
동물의 뇌 속에는 미각 신경이 생기기 이전부터 있어온 영양분 감지 신경세포들이 존재한다. 서성배 교수가 뉴욕대(NYU) 재직 당시 박사후 연구원 모니카 더스(Monica Dus) 박사와 함께 발표한 2015년 논문에서 초파리가 영양분을 필요로 하는 상황에서 다우레틱 호르몬(Diuretic Hormone 44, DH44) 펩타이드를 특이적으로 분비하는 신경세포(DH44+ 신경세포)가 체내 당분의 농도를 감지함으로써 영양가 있는 음식을 선택하도록 행동 변화를 일으키는 현상을 발견했다. 이전까지 포유동물의 뇌 속에서 영양분을 감지해 자신의 활성을 조절하는 신경세포들은 보고된 적이 있으나, 이들 영양분 감지 신경세포의 생물학적 기능은 위 연구를 통해서 최초로 보고됐다.
DH44 신경세포의 생물학적 기능에 대한 발표를 한 연구팀은 후속 연구를 통해 초파리 체내에 영양분이 많은 상황에서는 DH44 신경세포를 특이적으로 억제하는 상위 조절 신호를 발견했으며 오양균 박사를 중심으로 이들 억제 신호에 관한 본격적인 연구가 시작됐다.
먼저 연구팀은 DH44 신경세포의 생물학적 기능이 단지 초파리의 음식 선택 행동을 조절하는 데 그치지 않고 영양분이 필요한 상황에서 적극적으로 영양적 가치가 있는 탄수화물류에 대한 섭식 행동을 증가시킴을 자동화된 초파리 섭식 행동 측정 장치를 이용해 증명했다. 즉 DH44 신경세포의 활성화는 초파리가 식사량을 증가시키며, 배가 부른 상태에서 특이적으로 활성화되는 억제 신호를 통해 DH44 활성화에 의한 과잉 섭식 행동이 방지되는 것이다.
이어서 연구팀은 DH44 신경세포에 대한 억제 신호가 초파리 뇌 밖의 주변 장기들로부터 전해져 오는 것을 실험으로 확인했다. 연구팀은 구체적으로 어떠한 말단 장기에서 DH44 억제 신호를 보내는지 확인하기 위해 초파리의 뇌와 연결된 다양한 말단 장기들을 하나씩 제거해 나가는 방식으로 억제 신호의 유래를 추적했으며, 그 결과 초파리의 위에 해당하는 내장 부위와(Crop), 척수에 해당하는 복부 신경중추(ventral nerve cord, VNC) 에서 DH44 억제 신호가 발생함을 확인했다.
계속해서 연구팀은 DH44 신경세포가 초파리의 위에 해당하는 내장기관에 신경 가지를 뻗어서 음식물 섭취에 의한 해당 기관의 물리적 팽창 신호를 `피에조(Piezo)' 채널을 통해 인지할 수 있음을 확인했다. 피에조 채널은 특정 세포나 조직에 가해지는 물리적 팽창을 감지할 수 있는 센서로 포유동물의 호흡, 혈압 조절 등에 중요한 역할을 하고 있으며 초파리에게서는 소화기관의 물리적 팽창 감지를 통한 식욕 억제를 유발한다. 이번 연구에서는 피에조 채널이 음식물 섭취에 의한 초파리 위의 물리적 팽창을 감지한 후 DH44 신경세포의 기능을 특이적으로 억제해 추가적인 탄수화물 섭취 행위를 방지함으로써 과도한 물리적 팽창으로부터 내장기관을 보호하는 기능을 가짐을 밝혔다.
또한, 초파리의 척수에 해당하는 복부 신경중추에 있는 `후긴(Hugin)' 신경세포는 채 내에 순환되고 있는 영양분의 농도가 높을 때 이를 감지해 후긴 수용체를 발현하고 있는 DH44 세포들의 신경 활성을 억제한다. 이러한 작용을 통해 이미 체내 에너지가 높은 상태일 때 소화기관에 부담을 줄 수 있는 추가적 섭식 행동을 효과적으로 차단할 수 있음을 실험적으로 확인했다.
위 실험들을 통해 연구팀은 초파리 내장기관에 가해지는 물리적 압력을 인지해 활성화되는 피에조 채널과 체내에 순환되는 영양분이 많을 때 활성화되는 후긴 신경세포들이 각기 다른 물리적, 화학적 신호를 인지해 서로 독립적이면서도 상호보완적으로 DH44 세포 활성화를 통해 야기될 수 있는 과식을 억제함을 확인했다.
서성배 교수는 "이번 연구 결과는 동물의 뇌 속에 존재하는 영양분 감지 신경세포의 섭식 유도기능이 상위 신호전달 체계에 의해서 특이적으로 억제될 수 있음을 보여주는 첫 번째 사례ˮ라며 "과식에 대한 억제는 독립적으로 인지되는 물리, 화학적 척도를 다각적으로 종합해 체계적으로 이뤄져야 할 만큼 동물 생존에 매우 중요함을 다시 한번 보여주는 결과이며 인간의 식이장애 및 비만 예방에 도움이 되기 위한 밑거름이 될 연구 결과ˮ라고 말했다.
즉, 처음에 제시한 두 가지 끔찍한 장면들은 동물에 존재하는 유기적인 과식 억제 시스템으로 인해 자연 상태에서는 일어날 가능성이 희박함을 이번 연구 결과를 통해 다시금 확인할 수 있다.
동물의 과식을 억제하는 원리 규명
장면 하나, 영국의 전설적인 코미디 그룹인 몬티 파이선(Monthy Phython) 의 '삶의 의미(The meaning of life) (1983)'라는 영화에서는 영화사에 손꼽히는 충격적 장면이 등장한다. 배가 잔뜩 불러 레스토랑에 들어온 크레오소트 씨는 웨이터가 권하는 음식을 끊임없이 먹다가 결국 배가 터져버린다. 이로 인해 배 속에 있던 음식물이 레스토랑 전체로 흩뿌려지는 장면은 관객들에게 하여금 매우 불쾌한 감정을 느끼게 한다.
장면 둘, 오스트레일리아 빅토리아주 멜버른 대학교에서 모기를 연구하는 페란 로즈 박사가 공개한 영상이 화제가 되고 있다. 이 영상에서는 인간의 피를 탐욕스럽게 빨다가 결국 배가 터져버리는 모기의 충격적인 모습을 보여주고 있다. 본격적으로 시작되는 초여름 더위와 함께 찾아온 모기들 때문에 밤잠을 설친 사람이라면 약간의 통쾌함을 느낄 수도 있는 장면일 수도 있겠다.
앞서 제시한 두 가지의 충격적이고 약간은 괴기스러운 장면들은 실제 자연 상태에서는 발생하지 않는다는 공통점을 가지고 있다. 실제 자연 상태의 (인간을 포함한) 동물들에서는 특정 수준 이상으로 음식을 섭취하면 섭식 행동을 억제하는 신경전달체계가 작동해 과식으로 인한 내장 파열은 발생하지 않는다.
인간은 자연적인 상황에서 내장기관이 손상될 정도로 음식을 과도하게 먹지 않으며, 모기의 경우 과도한 섭식 행동을 억제하는 복부 신경중추가 물리적으로 파손됐기 때문에 배가 터지도록 피를 빨았던 것이다. 이렇듯 동물들은 과도한 섭식 행동을 억제하는 다양하고 체계적인 시스템을 가지고 있다. 이러한 과식 억제 신호에 대한 구체적 이해는 인간의 식이장애 및 비만 발생 과정을 이해하는 데 필수적이지만, 이에 관한 연구는 아직 충분히 이루어지지 않은 상태다. 이런 가운데 최근 국내외 연구진의 과식 방지를 위한 새로운 억제 신경망에 대한 연구결과가 밝혀져 화제가 되고 있다.
우리 대학 생명과학과 서성배 교수 연구팀이 뉴욕대학교 (NYU) 오양균 박사 연구팀과 공동연구를 통해 충분한 음식을 섭취한 초파리에서 특이적으로 발견되는 두 개의 독립적인 과식 억제 시스템을 최초로 발견했다고 15일 밝혔다. 뉴욕대학교 (NYU) 오양균 박사가 제1 저자로, KAIST 생명과학과 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제 신경과학 전문 최고 권위 학술지 `뉴런 (Neuron)'의 5월 19일 字 온라인판에 게재됐다. (논문명: Periphery signals generated by Piezo-mediated stomach stretch and Neuromedin-mediated glucose load regulate the Drosophila brain nutrient sensor)
동물의 뇌 속에는 미각 신경이 생기기 이전부터 있어온 영양분 감지 신경세포들이 존재한다. 서성배 교수가 뉴욕대(NYU) 재직 당시 박사후 연구원 모니카 더스(Monica Dus) 박사와 함께 발표한 2015년 논문에서 초파리가 영양분을 필요로 하는 상황에서 다우레틱 호르몬(Diuretic Hormone 44, DH44) 펩타이드를 특이적으로 분비하는 신경세포(DH44+ 신경세포)가 체내 당분의 농도를 감지함으로써 영양가 있는 음식을 선택하도록 행동 변화를 일으키는 현상을 발견했다. 이전까지 포유동물의 뇌 속에서 영양분을 감지해 자신의 활성을 조절하는 신경세포들은 보고된 적이 있으나, 이들 영양분 감지 신경세포의 생물학적 기능은 위 연구를 통해서 최초로 보고됐다.
DH44 신경세포의 생물학적 기능에 대한 발표를 한 연구팀은 후속 연구를 통해 초파리 체내에 영양분이 많은 상황에서는 DH44 신경세포를 특이적으로 억제하는 상위 조절 신호를 발견했으며 오양균 박사를 중심으로 이들 억제 신호에 관한 본격적인 연구가 시작됐다.
먼저 연구팀은 DH44 신경세포의 생물학적 기능이 단지 초파리의 음식 선택 행동을 조절하는 데 그치지 않고 영양분이 필요한 상황에서 적극적으로 영양적 가치가 있는 탄수화물류에 대한 섭식 행동을 증가시킴을 자동화된 초파리 섭식 행동 측정 장치를 이용해 증명했다. 즉 DH44 신경세포의 활성화는 초파리가 식사량을 증가시키며, 배가 부른 상태에서 특이적으로 활성화되는 억제 신호를 통해 DH44 활성화에 의한 과잉 섭식 행동이 방지되는 것이다.
이어서 연구팀은 DH44 신경세포에 대한 억제 신호가 초파리 뇌 밖의 주변 장기들로부터 전해져 오는 것을 실험으로 확인했다. 연구팀은 구체적으로 어떠한 말단 장기에서 DH44 억제 신호를 보내는지 확인하기 위해 초파리의 뇌와 연결된 다양한 말단 장기들을 하나씩 제거해 나가는 방식으로 억제 신호의 유래를 추적했으며, 그 결과 초파리의 위에 해당하는 내장 부위와(Crop), 척수에 해당하는 복부 신경중추(ventral nerve cord, VNC) 에서 DH44 억제 신호가 발생함을 확인했다.
계속해서 연구팀은 DH44 신경세포가 초파리의 위에 해당하는 내장기관에 신경 가지를 뻗어서 음식물 섭취에 의한 해당 기관의 물리적 팽창 신호를 `피에조(Piezo)' 채널을 통해 인지할 수 있음을 확인했다. 피에조 채널은 특정 세포나 조직에 가해지는 물리적 팽창을 감지할 수 있는 센서로 포유동물의 호흡, 혈압 조절 등에 중요한 역할을 하고 있으며 초파리에게서는 소화기관의 물리적 팽창 감지를 통한 식욕 억제를 유발한다. 이번 연구에서는 피에조 채널이 음식물 섭취에 의한 초파리 위의 물리적 팽창을 감지한 후 DH44 신경세포의 기능을 특이적으로 억제해 추가적인 탄수화물 섭취 행위를 방지함으로써 과도한 물리적 팽창으로부터 내장기관을 보호하는 기능을 가짐을 밝혔다.
또한, 초파리의 척수에 해당하는 복부 신경중추에 있는 `후긴(Hugin)' 신경세포는 채 내에 순환되고 있는 영양분의 농도가 높을 때 이를 감지해 후긴 수용체를 발현하고 있는 DH44 세포들의 신경 활성을 억제한다. 이러한 작용을 통해 이미 체내 에너지가 높은 상태일 때 소화기관에 부담을 줄 수 있는 추가적 섭식 행동을 효과적으로 차단할 수 있음을 실험적으로 확인했다.
위 실험들을 통해 연구팀은 초파리 내장기관에 가해지는 물리적 압력을 인지해 활성화되는 피에조 채널과 체내에 순환되는 영양분이 많을 때 활성화되는 후긴 신경세포들이 각기 다른 물리적, 화학적 신호를 인지해 서로 독립적이면서도 상호보완적으로 DH44 세포 활성화를 통해 야기될 수 있는 과식을 억제함을 확인했다.
서성배 교수는 "이번 연구 결과는 동물의 뇌 속에 존재하는 영양분 감지 신경세포의 섭식 유도기능이 상위 신호전달 체계에 의해서 특이적으로 억제될 수 있음을 보여주는 첫 번째 사례ˮ라며 "과식에 대한 억제는 독립적으로 인지되는 물리, 화학적 척도를 다각적으로 종합해 체계적으로 이뤄져야 할 만큼 동물 생존에 매우 중요함을 다시 한번 보여주는 결과이며 인간의 식이장애 및 비만 예방에 도움이 되기 위한 밑거름이 될 연구 결과ˮ라고 말했다.
즉, 처음에 제시한 두 가지 끔찍한 장면들은 동물에 존재하는 유기적인 과식 억제 시스템으로 인해 자연 상태에서는 일어날 가능성이 희박함을 이번 연구 결과를 통해 다시금 확인할 수 있다.
2021.06.15
조회수 51844
-
 김대수 교수, 파킨슨병 신경회로 원리 규명
김 대 수 교수 〉
우리 대학 생명과학과 김대수 교수 연구팀이 기저핵 신호물질이 타겟신경을 억제하는 것이 아니라 흥분시킴으로써 파킨슨병의 운동 이상을 유발한다는 사실을 규명했다.
현재 학계는 드롱(Delong) 박사 연구팀이 1980년대에 제시했던 운동신호 억제이론을 파킨슨병 치료연구에 활용하고 있다. 이 이론은 파킨슨병 환자의 뇌에서 분비되는 기저핵 억제성 신호물질이 뇌의 운동신경을 억제함으로써 운동기능을 방해한다고 설명한다. 그러나 이 학설은 파킨슨 환자의 복잡한 증상을 설명하는 데에 한계가 있었다.
연구팀은 기존 학설의 핵심 내용을 뒤흔들었다. 연구팀은 광유전학 기법으로 생쥐 뇌의 기저핵 신경을 빛으로 자극해서 파킨슨병 환자와 유사한 증상을 유발했다. 기저핵의 억제성 신호를 받은 시상핵 신경들이 일시적으로 억제신호에 순응하여 억제되는 듯 했으나 이후 반발성 흥분을 보이는 것을 확인했다.
연구팀은 또한 반발성 흥분을 억제했을 때 다양한 파킨슨 증상을 보이던 파킨슨병 생쥐가 완전히 회복되는 것을 확인했다. 기저핵의 작용에 의해 시상핵 신경이 억제되는 것이 아닌 흥분함으로써 운동질환을 유도한 것이다. 반발성 흥분을 약물이나 빛으로 억제함으로써 파킨슨병 증상을 제거할 수 있는 가능성이 열렸다.
김대수 교수는 “이번 연구를 통해 반발성 흥분을 조절함으로써 파킨슨병 증상을 억제할 수 있는 기작이 규명됐다”며 “향후 도파민 세포가 이미 사라져 회복이 어려운 파킨슨병 환자를 치료할 수 있는 차세대 치료법이 가능할 것”이라고 연구의 의의를 설명했다. 이 연구는 과학기술정보통신부․한국연구재단 기초연구사업(개인연구) 지원으로 수행됐으며, 신경과학 분야 국제학술지인 뉴런(Neuron) 8월 30자 논문으로 게재됐다.
□ 그림 설명
그림1. 기저핵 억제성 입력이 파킨슨 증상을 나타내는 모식도
그림2. 광유전학적 기법으로 파킨슨 증상회복 성공
김대수 교수, 파킨슨병 신경회로 원리 규명
김 대 수 교수 〉
우리 대학 생명과학과 김대수 교수 연구팀이 기저핵 신호물질이 타겟신경을 억제하는 것이 아니라 흥분시킴으로써 파킨슨병의 운동 이상을 유발한다는 사실을 규명했다.
현재 학계는 드롱(Delong) 박사 연구팀이 1980년대에 제시했던 운동신호 억제이론을 파킨슨병 치료연구에 활용하고 있다. 이 이론은 파킨슨병 환자의 뇌에서 분비되는 기저핵 억제성 신호물질이 뇌의 운동신경을 억제함으로써 운동기능을 방해한다고 설명한다. 그러나 이 학설은 파킨슨 환자의 복잡한 증상을 설명하는 데에 한계가 있었다.
연구팀은 기존 학설의 핵심 내용을 뒤흔들었다. 연구팀은 광유전학 기법으로 생쥐 뇌의 기저핵 신경을 빛으로 자극해서 파킨슨병 환자와 유사한 증상을 유발했다. 기저핵의 억제성 신호를 받은 시상핵 신경들이 일시적으로 억제신호에 순응하여 억제되는 듯 했으나 이후 반발성 흥분을 보이는 것을 확인했다.
연구팀은 또한 반발성 흥분을 억제했을 때 다양한 파킨슨 증상을 보이던 파킨슨병 생쥐가 완전히 회복되는 것을 확인했다. 기저핵의 작용에 의해 시상핵 신경이 억제되는 것이 아닌 흥분함으로써 운동질환을 유도한 것이다. 반발성 흥분을 약물이나 빛으로 억제함으로써 파킨슨병 증상을 제거할 수 있는 가능성이 열렸다.
김대수 교수는 “이번 연구를 통해 반발성 흥분을 조절함으로써 파킨슨병 증상을 억제할 수 있는 기작이 규명됐다”며 “향후 도파민 세포가 이미 사라져 회복이 어려운 파킨슨병 환자를 치료할 수 있는 차세대 치료법이 가능할 것”이라고 연구의 의의를 설명했다. 이 연구는 과학기술정보통신부․한국연구재단 기초연구사업(개인연구) 지원으로 수행됐으며, 신경과학 분야 국제학술지인 뉴런(Neuron) 8월 30자 논문으로 게재됐다.
□ 그림 설명
그림1. 기저핵 억제성 입력이 파킨슨 증상을 나타내는 모식도
그림2. 광유전학적 기법으로 파킨슨 증상회복 성공
2017.09.26
조회수 15597
-
 김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11
조회수 22339
 뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
2025.07.09 조회수 245
뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다.
생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도당에 특이적으로 반응하는 장-뇌 회로와 이에 반응하는 특정 뇌세포의 존재는 규명되지 않았다.
연구팀은 이번 연구를 통해 뇌의 기능에 필수적인 포도당을 감지하고 필요한 영양소에 대한 섭취 행동을 조절하는 ‘장-뇌 회로’를 밝혀내는 데 성공했다.
또한, 이 회로는 뇌의 ‘스트레스 반응 세포(CRF 뉴런*)’가 배고픔이나 외부 자극뿐만 아니라, 소장에 직접 유입된 특정 열량 영양소에 대해서도 초 단위로 반응하며, 특히 ‘포도당(D-glucose)’에 선택적으로 반응한다는 점을 처음으로 입증했다.
*CRF 뉴런: 우리 몸이 심리적·물리적 스트레스에 대응하는 핵심 생리 시스템은 시상하부-뇌하수체-부신 축(Hypothalamus-Pituitary-Adrenal Axis, HPA axis)이다. 이 축의 중심에는 시상하부에서 CRF(부신피질호르몬 방출인자)를 분비하는 뉴런이 있으며, 이들은 다양한 스트레스 자극에 반응해 코르티솔 분비를 유도하고, 생리 및 대사 균형을 유지하는 신경 내분비 조절의 중추로 알려져 있다.
연구팀은 실시간 뇌 속을 정밀하게 추적할 수 있는 광유전학 기반 신경 활성 조절 및 회로 추적 기법을 활용해서, 포도당(D-글루코스, L-글루코스,) 아미노산, 지방 등 다양한 영양소의 쥐의 소장 내 직접 주입하고 관찰했다.
그 결과, 뇌 시상하부의 ‘시상하부 시상핵(PVN)* 부위’에 있는 CRF 뉴런 중 D-글루코스(glucose) 포도당에만 선택적으로 반응하며, 다른 당류나 단백질·지방류에는 반응하지 않거나 반대 방향의 반응을 보이는 것을 확인했다. 이는 뇌가 장내 영양소가 유입 시 반응에 대해 단일 뇌세포 수준에서 어떤 방향성을 유도한다는 것을 처음 확인한 것을 의미한다.
* 시상하부 시상핵(paraventricular nucleus, PVN): 뇌의 시상하부(hypothalamus) 안에 있는 매우 중요한 신경핵(뉴런 무리)으로, 신체 항상성(몸의 균형 유지)을 조절하는 핵심 구조
또한, 연구팀은 소장의 포도당 감지 신호가 ‘척수신경’을 거쳐 뇌의 특정 부위(등쪽 외측 팔곁핵,parabrachial nucleus, PBNdl)을 통해 PVN의 CRF 뉴런으로 전달되는 특징적인 회로를 밝혀냈다. 반면, 아미노산이나 지방 등 기타 영양소는 미주신경(vagus nerve)이란 다른 통로로 뇌에 전달된다는 사실도 확인했다.
광유전학적 억제 실험에서도, 공복 상태의 생쥐에서 CRF 뉴런을 억제하면 동물은 더 이상 포도당을 선호하지 않게 됐으며, 이 회로가 영양소 선택에 있어 포도당 특이적 선호를 유도하는 데 필수적임이 드러났다.
이 연구는 서 교수가 뉴욕대(NYU) 재직 시절 초파리를 모델로, 장내 포도당(글루코스) 및 당을 선택적으로 감지하는 ‘DH44 뉴런’을 발견했던 점을 착안해, 포유류에서도 시상하부 뉴런이 포도당 특이적 반응에 있어 기능적 유사성을 보일 것이라는 가설에서 시작되었다.
이 가설을 입증하기 위해 서 교수 연구팀 김진은 박사(KAIST 박사 졸, 現 캘리포니아공과대학교 연수연구원)가 학위과정 중 생쥐 실험을 통해 배고픈 쥐는 장에 주입된 다양한 영양소 중 열량을 지닌 포도당을 선호하며, CRF 뉴런이 빠르고 특이적인 반응을 보인다는 사실을 확인했다.
또한, 같은 팀 정원교 연구원(KAIST 학사 졸, 現 캘리포니아공과대학교 박사과정)과 함께 실험과 모델링을 통해 CRF 뉴런의 중요성을 규명했고, 김신혜 박사는 협업을 통해 장-뇌 회로 중 특정 척추 신경세포가 장의 정보를 뇌로 전달 한다는 놀라운 발견을 입증했다.
김진은 박사와 김신혜 박사는 “이 연구는 ‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해내는가?’라는 단순하지만, 본질적인 질문에서 시작됐고, 이번 연구에서 장-뇌 연결 회로의 핵심 축인 척수신경의 역할을 규명하고 장내 특정 영양소를 감지한 후 이를 뇌에 전달하는 척수 기반 신경 회로가 우리 몸의 에너지 대사 조절과 항상성 유지에 핵심적일 것이라는 것을 밝혀냈다”고 말했다.
서성배 교수는 “이번 연구는 포도당에 특화된 장-뇌 신호 경로를 규명함으로써, 비만·당뇨병 등 대사 질환의 새로운 치료 표적을 제시할 수 있다”며 “향후 아미노산, 지방 등 다른 필수 영양소를 감지하는 유사 회로의 존재와 그 상호작용 메커니즘을 밝히는 연구로 확장될 예정”이라고 밝혔다.
우리 대학 김진은 박사, 김신혜 박사, 정원교 학생이 공동 제1 저자로 참여한 이번 연구의 결과는 국제 학술지 ‘뉴런(Neuron)’에 2025년 6월 20일 온라인 게재됐다.
※논문명: Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis
※DOI: https://doi.org/10.1016/j.neuron.2025.05.024
이번 연구는 삼성미래기술육성사업, 한국연구재단 리더과제, 포스코 청암재단 사이언스 펠로십, 아산재단 의생명과학 장학사업, 기초과학연구원, KAIST KAIX 사업의 지원을 통해 수행됐다.
2025.07.09 조회수 245 동물의 과식을 억제하는 원리 규명
장면 하나, 영국의 전설적인 코미디 그룹인 몬티 파이선(Monthy Phython) 의 '삶의 의미(The meaning of life) (1983)'라는 영화에서는 영화사에 손꼽히는 충격적 장면이 등장한다. 배가 잔뜩 불러 레스토랑에 들어온 크레오소트 씨는 웨이터가 권하는 음식을 끊임없이 먹다가 결국 배가 터져버린다. 이로 인해 배 속에 있던 음식물이 레스토랑 전체로 흩뿌려지는 장면은 관객들에게 하여금 매우 불쾌한 감정을 느끼게 한다.
장면 둘, 오스트레일리아 빅토리아주 멜버른 대학교에서 모기를 연구하는 페란 로즈 박사가 공개한 영상이 화제가 되고 있다. 이 영상에서는 인간의 피를 탐욕스럽게 빨다가 결국 배가 터져버리는 모기의 충격적인 모습을 보여주고 있다. 본격적으로 시작되는 초여름 더위와 함께 찾아온 모기들 때문에 밤잠을 설친 사람이라면 약간의 통쾌함을 느낄 수도 있는 장면일 수도 있겠다.
앞서 제시한 두 가지의 충격적이고 약간은 괴기스러운 장면들은 실제 자연 상태에서는 발생하지 않는다는 공통점을 가지고 있다. 실제 자연 상태의 (인간을 포함한) 동물들에서는 특정 수준 이상으로 음식을 섭취하면 섭식 행동을 억제하는 신경전달체계가 작동해 과식으로 인한 내장 파열은 발생하지 않는다.
인간은 자연적인 상황에서 내장기관이 손상될 정도로 음식을 과도하게 먹지 않으며, 모기의 경우 과도한 섭식 행동을 억제하는 복부 신경중추가 물리적으로 파손됐기 때문에 배가 터지도록 피를 빨았던 것이다. 이렇듯 동물들은 과도한 섭식 행동을 억제하는 다양하고 체계적인 시스템을 가지고 있다. 이러한 과식 억제 신호에 대한 구체적 이해는 인간의 식이장애 및 비만 발생 과정을 이해하는 데 필수적이지만, 이에 관한 연구는 아직 충분히 이루어지지 않은 상태다. 이런 가운데 최근 국내외 연구진의 과식 방지를 위한 새로운 억제 신경망에 대한 연구결과가 밝혀져 화제가 되고 있다.
우리 대학 생명과학과 서성배 교수 연구팀이 뉴욕대학교 (NYU) 오양균 박사 연구팀과 공동연구를 통해 충분한 음식을 섭취한 초파리에서 특이적으로 발견되는 두 개의 독립적인 과식 억제 시스템을 최초로 발견했다고 15일 밝혔다. 뉴욕대학교 (NYU) 오양균 박사가 제1 저자로, KAIST 생명과학과 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제 신경과학 전문 최고 권위 학술지 `뉴런 (Neuron)'의 5월 19일 字 온라인판에 게재됐다. (논문명: Periphery signals generated by Piezo-mediated stomach stretch and Neuromedin-mediated glucose load regulate the Drosophila brain nutrient sensor)
동물의 뇌 속에는 미각 신경이 생기기 이전부터 있어온 영양분 감지 신경세포들이 존재한다. 서성배 교수가 뉴욕대(NYU) 재직 당시 박사후 연구원 모니카 더스(Monica Dus) 박사와 함께 발표한 2015년 논문에서 초파리가 영양분을 필요로 하는 상황에서 다우레틱 호르몬(Diuretic Hormone 44, DH44) 펩타이드를 특이적으로 분비하는 신경세포(DH44+ 신경세포)가 체내 당분의 농도를 감지함으로써 영양가 있는 음식을 선택하도록 행동 변화를 일으키는 현상을 발견했다. 이전까지 포유동물의 뇌 속에서 영양분을 감지해 자신의 활성을 조절하는 신경세포들은 보고된 적이 있으나, 이들 영양분 감지 신경세포의 생물학적 기능은 위 연구를 통해서 최초로 보고됐다.
DH44 신경세포의 생물학적 기능에 대한 발표를 한 연구팀은 후속 연구를 통해 초파리 체내에 영양분이 많은 상황에서는 DH44 신경세포를 특이적으로 억제하는 상위 조절 신호를 발견했으며 오양균 박사를 중심으로 이들 억제 신호에 관한 본격적인 연구가 시작됐다.
먼저 연구팀은 DH44 신경세포의 생물학적 기능이 단지 초파리의 음식 선택 행동을 조절하는 데 그치지 않고 영양분이 필요한 상황에서 적극적으로 영양적 가치가 있는 탄수화물류에 대한 섭식 행동을 증가시킴을 자동화된 초파리 섭식 행동 측정 장치를 이용해 증명했다. 즉 DH44 신경세포의 활성화는 초파리가 식사량을 증가시키며, 배가 부른 상태에서 특이적으로 활성화되는 억제 신호를 통해 DH44 활성화에 의한 과잉 섭식 행동이 방지되는 것이다.
이어서 연구팀은 DH44 신경세포에 대한 억제 신호가 초파리 뇌 밖의 주변 장기들로부터 전해져 오는 것을 실험으로 확인했다. 연구팀은 구체적으로 어떠한 말단 장기에서 DH44 억제 신호를 보내는지 확인하기 위해 초파리의 뇌와 연결된 다양한 말단 장기들을 하나씩 제거해 나가는 방식으로 억제 신호의 유래를 추적했으며, 그 결과 초파리의 위에 해당하는 내장 부위와(Crop), 척수에 해당하는 복부 신경중추(ventral nerve cord, VNC) 에서 DH44 억제 신호가 발생함을 확인했다.
계속해서 연구팀은 DH44 신경세포가 초파리의 위에 해당하는 내장기관에 신경 가지를 뻗어서 음식물 섭취에 의한 해당 기관의 물리적 팽창 신호를 `피에조(Piezo)' 채널을 통해 인지할 수 있음을 확인했다. 피에조 채널은 특정 세포나 조직에 가해지는 물리적 팽창을 감지할 수 있는 센서로 포유동물의 호흡, 혈압 조절 등에 중요한 역할을 하고 있으며 초파리에게서는 소화기관의 물리적 팽창 감지를 통한 식욕 억제를 유발한다. 이번 연구에서는 피에조 채널이 음식물 섭취에 의한 초파리 위의 물리적 팽창을 감지한 후 DH44 신경세포의 기능을 특이적으로 억제해 추가적인 탄수화물 섭취 행위를 방지함으로써 과도한 물리적 팽창으로부터 내장기관을 보호하는 기능을 가짐을 밝혔다.
또한, 초파리의 척수에 해당하는 복부 신경중추에 있는 `후긴(Hugin)' 신경세포는 채 내에 순환되고 있는 영양분의 농도가 높을 때 이를 감지해 후긴 수용체를 발현하고 있는 DH44 세포들의 신경 활성을 억제한다. 이러한 작용을 통해 이미 체내 에너지가 높은 상태일 때 소화기관에 부담을 줄 수 있는 추가적 섭식 행동을 효과적으로 차단할 수 있음을 실험적으로 확인했다.
위 실험들을 통해 연구팀은 초파리 내장기관에 가해지는 물리적 압력을 인지해 활성화되는 피에조 채널과 체내에 순환되는 영양분이 많을 때 활성화되는 후긴 신경세포들이 각기 다른 물리적, 화학적 신호를 인지해 서로 독립적이면서도 상호보완적으로 DH44 세포 활성화를 통해 야기될 수 있는 과식을 억제함을 확인했다.
서성배 교수는 "이번 연구 결과는 동물의 뇌 속에 존재하는 영양분 감지 신경세포의 섭식 유도기능이 상위 신호전달 체계에 의해서 특이적으로 억제될 수 있음을 보여주는 첫 번째 사례ˮ라며 "과식에 대한 억제는 독립적으로 인지되는 물리, 화학적 척도를 다각적으로 종합해 체계적으로 이뤄져야 할 만큼 동물 생존에 매우 중요함을 다시 한번 보여주는 결과이며 인간의 식이장애 및 비만 예방에 도움이 되기 위한 밑거름이 될 연구 결과ˮ라고 말했다.
즉, 처음에 제시한 두 가지 끔찍한 장면들은 동물에 존재하는 유기적인 과식 억제 시스템으로 인해 자연 상태에서는 일어날 가능성이 희박함을 이번 연구 결과를 통해 다시금 확인할 수 있다.
2021.06.15 조회수 51844
동물의 과식을 억제하는 원리 규명
장면 하나, 영국의 전설적인 코미디 그룹인 몬티 파이선(Monthy Phython) 의 '삶의 의미(The meaning of life) (1983)'라는 영화에서는 영화사에 손꼽히는 충격적 장면이 등장한다. 배가 잔뜩 불러 레스토랑에 들어온 크레오소트 씨는 웨이터가 권하는 음식을 끊임없이 먹다가 결국 배가 터져버린다. 이로 인해 배 속에 있던 음식물이 레스토랑 전체로 흩뿌려지는 장면은 관객들에게 하여금 매우 불쾌한 감정을 느끼게 한다.
장면 둘, 오스트레일리아 빅토리아주 멜버른 대학교에서 모기를 연구하는 페란 로즈 박사가 공개한 영상이 화제가 되고 있다. 이 영상에서는 인간의 피를 탐욕스럽게 빨다가 결국 배가 터져버리는 모기의 충격적인 모습을 보여주고 있다. 본격적으로 시작되는 초여름 더위와 함께 찾아온 모기들 때문에 밤잠을 설친 사람이라면 약간의 통쾌함을 느낄 수도 있는 장면일 수도 있겠다.
앞서 제시한 두 가지의 충격적이고 약간은 괴기스러운 장면들은 실제 자연 상태에서는 발생하지 않는다는 공통점을 가지고 있다. 실제 자연 상태의 (인간을 포함한) 동물들에서는 특정 수준 이상으로 음식을 섭취하면 섭식 행동을 억제하는 신경전달체계가 작동해 과식으로 인한 내장 파열은 발생하지 않는다.
인간은 자연적인 상황에서 내장기관이 손상될 정도로 음식을 과도하게 먹지 않으며, 모기의 경우 과도한 섭식 행동을 억제하는 복부 신경중추가 물리적으로 파손됐기 때문에 배가 터지도록 피를 빨았던 것이다. 이렇듯 동물들은 과도한 섭식 행동을 억제하는 다양하고 체계적인 시스템을 가지고 있다. 이러한 과식 억제 신호에 대한 구체적 이해는 인간의 식이장애 및 비만 발생 과정을 이해하는 데 필수적이지만, 이에 관한 연구는 아직 충분히 이루어지지 않은 상태다. 이런 가운데 최근 국내외 연구진의 과식 방지를 위한 새로운 억제 신경망에 대한 연구결과가 밝혀져 화제가 되고 있다.
우리 대학 생명과학과 서성배 교수 연구팀이 뉴욕대학교 (NYU) 오양균 박사 연구팀과 공동연구를 통해 충분한 음식을 섭취한 초파리에서 특이적으로 발견되는 두 개의 독립적인 과식 억제 시스템을 최초로 발견했다고 15일 밝혔다. 뉴욕대학교 (NYU) 오양균 박사가 제1 저자로, KAIST 생명과학과 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제 신경과학 전문 최고 권위 학술지 `뉴런 (Neuron)'의 5월 19일 字 온라인판에 게재됐다. (논문명: Periphery signals generated by Piezo-mediated stomach stretch and Neuromedin-mediated glucose load regulate the Drosophila brain nutrient sensor)
동물의 뇌 속에는 미각 신경이 생기기 이전부터 있어온 영양분 감지 신경세포들이 존재한다. 서성배 교수가 뉴욕대(NYU) 재직 당시 박사후 연구원 모니카 더스(Monica Dus) 박사와 함께 발표한 2015년 논문에서 초파리가 영양분을 필요로 하는 상황에서 다우레틱 호르몬(Diuretic Hormone 44, DH44) 펩타이드를 특이적으로 분비하는 신경세포(DH44+ 신경세포)가 체내 당분의 농도를 감지함으로써 영양가 있는 음식을 선택하도록 행동 변화를 일으키는 현상을 발견했다. 이전까지 포유동물의 뇌 속에서 영양분을 감지해 자신의 활성을 조절하는 신경세포들은 보고된 적이 있으나, 이들 영양분 감지 신경세포의 생물학적 기능은 위 연구를 통해서 최초로 보고됐다.
DH44 신경세포의 생물학적 기능에 대한 발표를 한 연구팀은 후속 연구를 통해 초파리 체내에 영양분이 많은 상황에서는 DH44 신경세포를 특이적으로 억제하는 상위 조절 신호를 발견했으며 오양균 박사를 중심으로 이들 억제 신호에 관한 본격적인 연구가 시작됐다.
먼저 연구팀은 DH44 신경세포의 생물학적 기능이 단지 초파리의 음식 선택 행동을 조절하는 데 그치지 않고 영양분이 필요한 상황에서 적극적으로 영양적 가치가 있는 탄수화물류에 대한 섭식 행동을 증가시킴을 자동화된 초파리 섭식 행동 측정 장치를 이용해 증명했다. 즉 DH44 신경세포의 활성화는 초파리가 식사량을 증가시키며, 배가 부른 상태에서 특이적으로 활성화되는 억제 신호를 통해 DH44 활성화에 의한 과잉 섭식 행동이 방지되는 것이다.
이어서 연구팀은 DH44 신경세포에 대한 억제 신호가 초파리 뇌 밖의 주변 장기들로부터 전해져 오는 것을 실험으로 확인했다. 연구팀은 구체적으로 어떠한 말단 장기에서 DH44 억제 신호를 보내는지 확인하기 위해 초파리의 뇌와 연결된 다양한 말단 장기들을 하나씩 제거해 나가는 방식으로 억제 신호의 유래를 추적했으며, 그 결과 초파리의 위에 해당하는 내장 부위와(Crop), 척수에 해당하는 복부 신경중추(ventral nerve cord, VNC) 에서 DH44 억제 신호가 발생함을 확인했다.
계속해서 연구팀은 DH44 신경세포가 초파리의 위에 해당하는 내장기관에 신경 가지를 뻗어서 음식물 섭취에 의한 해당 기관의 물리적 팽창 신호를 `피에조(Piezo)' 채널을 통해 인지할 수 있음을 확인했다. 피에조 채널은 특정 세포나 조직에 가해지는 물리적 팽창을 감지할 수 있는 센서로 포유동물의 호흡, 혈압 조절 등에 중요한 역할을 하고 있으며 초파리에게서는 소화기관의 물리적 팽창 감지를 통한 식욕 억제를 유발한다. 이번 연구에서는 피에조 채널이 음식물 섭취에 의한 초파리 위의 물리적 팽창을 감지한 후 DH44 신경세포의 기능을 특이적으로 억제해 추가적인 탄수화물 섭취 행위를 방지함으로써 과도한 물리적 팽창으로부터 내장기관을 보호하는 기능을 가짐을 밝혔다.
또한, 초파리의 척수에 해당하는 복부 신경중추에 있는 `후긴(Hugin)' 신경세포는 채 내에 순환되고 있는 영양분의 농도가 높을 때 이를 감지해 후긴 수용체를 발현하고 있는 DH44 세포들의 신경 활성을 억제한다. 이러한 작용을 통해 이미 체내 에너지가 높은 상태일 때 소화기관에 부담을 줄 수 있는 추가적 섭식 행동을 효과적으로 차단할 수 있음을 실험적으로 확인했다.
위 실험들을 통해 연구팀은 초파리 내장기관에 가해지는 물리적 압력을 인지해 활성화되는 피에조 채널과 체내에 순환되는 영양분이 많을 때 활성화되는 후긴 신경세포들이 각기 다른 물리적, 화학적 신호를 인지해 서로 독립적이면서도 상호보완적으로 DH44 세포 활성화를 통해 야기될 수 있는 과식을 억제함을 확인했다.
서성배 교수는 "이번 연구 결과는 동물의 뇌 속에 존재하는 영양분 감지 신경세포의 섭식 유도기능이 상위 신호전달 체계에 의해서 특이적으로 억제될 수 있음을 보여주는 첫 번째 사례ˮ라며 "과식에 대한 억제는 독립적으로 인지되는 물리, 화학적 척도를 다각적으로 종합해 체계적으로 이뤄져야 할 만큼 동물 생존에 매우 중요함을 다시 한번 보여주는 결과이며 인간의 식이장애 및 비만 예방에 도움이 되기 위한 밑거름이 될 연구 결과ˮ라고 말했다.
즉, 처음에 제시한 두 가지 끔찍한 장면들은 동물에 존재하는 유기적인 과식 억제 시스템으로 인해 자연 상태에서는 일어날 가능성이 희박함을 이번 연구 결과를 통해 다시금 확인할 수 있다.
2021.06.15 조회수 51844 김대수 교수, 파킨슨병 신경회로 원리 규명
김 대 수 교수 〉
우리 대학 생명과학과 김대수 교수 연구팀이 기저핵 신호물질이 타겟신경을 억제하는 것이 아니라 흥분시킴으로써 파킨슨병의 운동 이상을 유발한다는 사실을 규명했다.
현재 학계는 드롱(Delong) 박사 연구팀이 1980년대에 제시했던 운동신호 억제이론을 파킨슨병 치료연구에 활용하고 있다. 이 이론은 파킨슨병 환자의 뇌에서 분비되는 기저핵 억제성 신호물질이 뇌의 운동신경을 억제함으로써 운동기능을 방해한다고 설명한다. 그러나 이 학설은 파킨슨 환자의 복잡한 증상을 설명하는 데에 한계가 있었다.
연구팀은 기존 학설의 핵심 내용을 뒤흔들었다. 연구팀은 광유전학 기법으로 생쥐 뇌의 기저핵 신경을 빛으로 자극해서 파킨슨병 환자와 유사한 증상을 유발했다. 기저핵의 억제성 신호를 받은 시상핵 신경들이 일시적으로 억제신호에 순응하여 억제되는 듯 했으나 이후 반발성 흥분을 보이는 것을 확인했다.
연구팀은 또한 반발성 흥분을 억제했을 때 다양한 파킨슨 증상을 보이던 파킨슨병 생쥐가 완전히 회복되는 것을 확인했다. 기저핵의 작용에 의해 시상핵 신경이 억제되는 것이 아닌 흥분함으로써 운동질환을 유도한 것이다. 반발성 흥분을 약물이나 빛으로 억제함으로써 파킨슨병 증상을 제거할 수 있는 가능성이 열렸다.
김대수 교수는 “이번 연구를 통해 반발성 흥분을 조절함으로써 파킨슨병 증상을 억제할 수 있는 기작이 규명됐다”며 “향후 도파민 세포가 이미 사라져 회복이 어려운 파킨슨병 환자를 치료할 수 있는 차세대 치료법이 가능할 것”이라고 연구의 의의를 설명했다. 이 연구는 과학기술정보통신부․한국연구재단 기초연구사업(개인연구) 지원으로 수행됐으며, 신경과학 분야 국제학술지인 뉴런(Neuron) 8월 30자 논문으로 게재됐다.
□ 그림 설명
그림1. 기저핵 억제성 입력이 파킨슨 증상을 나타내는 모식도
그림2. 광유전학적 기법으로 파킨슨 증상회복 성공
2017.09.26 조회수 15597
김대수 교수, 파킨슨병 신경회로 원리 규명
김 대 수 교수 〉
우리 대학 생명과학과 김대수 교수 연구팀이 기저핵 신호물질이 타겟신경을 억제하는 것이 아니라 흥분시킴으로써 파킨슨병의 운동 이상을 유발한다는 사실을 규명했다.
현재 학계는 드롱(Delong) 박사 연구팀이 1980년대에 제시했던 운동신호 억제이론을 파킨슨병 치료연구에 활용하고 있다. 이 이론은 파킨슨병 환자의 뇌에서 분비되는 기저핵 억제성 신호물질이 뇌의 운동신경을 억제함으로써 운동기능을 방해한다고 설명한다. 그러나 이 학설은 파킨슨 환자의 복잡한 증상을 설명하는 데에 한계가 있었다.
연구팀은 기존 학설의 핵심 내용을 뒤흔들었다. 연구팀은 광유전학 기법으로 생쥐 뇌의 기저핵 신경을 빛으로 자극해서 파킨슨병 환자와 유사한 증상을 유발했다. 기저핵의 억제성 신호를 받은 시상핵 신경들이 일시적으로 억제신호에 순응하여 억제되는 듯 했으나 이후 반발성 흥분을 보이는 것을 확인했다.
연구팀은 또한 반발성 흥분을 억제했을 때 다양한 파킨슨 증상을 보이던 파킨슨병 생쥐가 완전히 회복되는 것을 확인했다. 기저핵의 작용에 의해 시상핵 신경이 억제되는 것이 아닌 흥분함으로써 운동질환을 유도한 것이다. 반발성 흥분을 약물이나 빛으로 억제함으로써 파킨슨병 증상을 제거할 수 있는 가능성이 열렸다.
김대수 교수는 “이번 연구를 통해 반발성 흥분을 조절함으로써 파킨슨병 증상을 억제할 수 있는 기작이 규명됐다”며 “향후 도파민 세포가 이미 사라져 회복이 어려운 파킨슨병 환자를 치료할 수 있는 차세대 치료법이 가능할 것”이라고 연구의 의의를 설명했다. 이 연구는 과학기술정보통신부․한국연구재단 기초연구사업(개인연구) 지원으로 수행됐으며, 신경과학 분야 국제학술지인 뉴런(Neuron) 8월 30자 논문으로 게재됐다.
□ 그림 설명
그림1. 기저핵 억제성 입력이 파킨슨 증상을 나타내는 모식도
그림2. 광유전학적 기법으로 파킨슨 증상회복 성공
2017.09.26 조회수 15597 김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 22339
김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 22339