-
 김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
2016.11.10
조회수 49747
-
 수학 통해 생체시계 유지 원리 60여년 만에 밝혀
김 재 경 교수
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 온도 변화에도 생체시계의 속도를 유지하는 원리를 발견했다.
이번 연구는 저명 학술지 셀(Cell) 자매지 몰라큘러 셀(Molecular Cell) 10월 1일자에 게재됐다.
우리 뇌에 위치한 생체시계는 밤 9시 경이 되면 멜라토닌 분비가 시작되게 하고 아침 7시 경에 멈추게 한다. 그로 인해 우리는 매일 일정한 시간에 잠을 자고 기상할 수 있다.
생체시계는 온도가 변화해도 빨라지거나 느려지지 않고 일정한 속도가 유지된다. 따라서 우리의 체온이 변화해도 규칙적인 삶을 살 수 있고, 이는 환경에 따라 체온이 변하는 변온 동물에게도 적용된다.
이러한 생체시계의 성질은 1954년에 발견됐지만 그 원리는 밝혀지지 않아 지난 60여 년간 생체시계 분야의 가장 큰 미스테리로 남아 있었다.
김 교수는 수학 모델링을 통해 이 원리를 밝혀냈고 모델링 결과는 듀크-싱가폴 국립 의과대학 데이빗 벌쉽(David Virshup) 교수 연구팀의 실험을 통해 검증돼 60년의 난제가 풀렸다.
생체시계에는 Period2라는 핵심 단백질이 존재한다. 이 단백질은 12시간 동안 증가하고 나머지 12시간 동안 분해되는 리듬을 평생 반복한다.
김 교수는 이 Period2 분해가 두 가지 방법으로 발생하는 것을 밝혔다. 하나는 매우 빠른 속도로 분해가 일어나는 것이고 나머지 하나는 매우 느린 속도로 분해가 이뤄지는 것이다. 그리고 두 가지 방법의 비율을 조절하는 것이 Period2에 존재하는 인산화 스위치(Phosphoryltion switch)이다.
인산화 스위치의 역할은 온도가 올라갔을 때 느리게 분해되는 Period2의 양을 늘림으로써 전체적인 분해 속도가 천천히 이뤄지게 만든다. 반대로 온도가 내려갔을 때는 빠르게 분해되는 비율을 늘려 생체시계의 속도를 조절하는 것이다.
결국 생체시계 속도 유지의 핵심은 인산화 스위치이고, 다른 생화학 반응이 빨라져도 생체시계의 속도 유지를 가능하게 만드는 요소인 것이다.
이번 연구에서 밝혀진 인산화 스위치는 생체시계의 속도를 조절할 수 있는 핵심 요소가 될 전망이다. 이 인산화 스위치를 조절할 수 있는 약을 개발한다면 잦은 해외 출장으로 인한 시차, 주야 교대 근무 등에 의한 생체 시계 고장 예방 등에 기여할 수 있을 것으로 기대된다.
김 교수는 “이번 성과를 통해 우리나라에선 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”며 “수학이 생물학의 난제들을 해결하는데 기여할 수 있음을 알리고 싶다”고 말했다.
이번 연구는 듀크-국립 싱가폴 의과 대학 데이빗 벌쉽 (David Virshup) 교수 연구팀, 미국 미시간 대학 (University of Michigan, Ann Arbor) 데니 폴저 (Daniel Forger) 교수와의 공동연구로 진행됐다.
□ 그림 설명
그림 1 . 이번 연구에서 밝혀진 인산화 스위치와 그 과정에서 사용된 수학 방정식의 일부
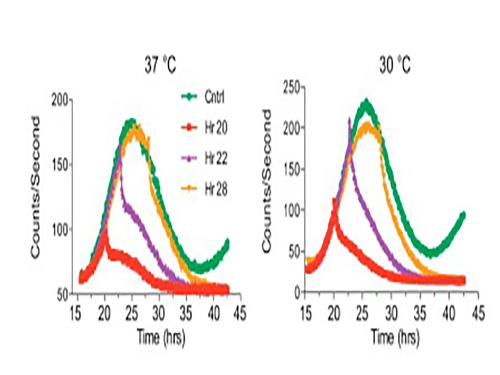
그림 2. Period2 단백질이 인산화 스위치에 의해 낮은 온도(30도) 에서 분해되는 속도가 더 빨라진다는 것을 보여주는 실험
수학 통해 생체시계 유지 원리 60여년 만에 밝혀
김 재 경 교수
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 온도 변화에도 생체시계의 속도를 유지하는 원리를 발견했다.
이번 연구는 저명 학술지 셀(Cell) 자매지 몰라큘러 셀(Molecular Cell) 10월 1일자에 게재됐다.
우리 뇌에 위치한 생체시계는 밤 9시 경이 되면 멜라토닌 분비가 시작되게 하고 아침 7시 경에 멈추게 한다. 그로 인해 우리는 매일 일정한 시간에 잠을 자고 기상할 수 있다.
생체시계는 온도가 변화해도 빨라지거나 느려지지 않고 일정한 속도가 유지된다. 따라서 우리의 체온이 변화해도 규칙적인 삶을 살 수 있고, 이는 환경에 따라 체온이 변하는 변온 동물에게도 적용된다.
이러한 생체시계의 성질은 1954년에 발견됐지만 그 원리는 밝혀지지 않아 지난 60여 년간 생체시계 분야의 가장 큰 미스테리로 남아 있었다.
김 교수는 수학 모델링을 통해 이 원리를 밝혀냈고 모델링 결과는 듀크-싱가폴 국립 의과대학 데이빗 벌쉽(David Virshup) 교수 연구팀의 실험을 통해 검증돼 60년의 난제가 풀렸다.
생체시계에는 Period2라는 핵심 단백질이 존재한다. 이 단백질은 12시간 동안 증가하고 나머지 12시간 동안 분해되는 리듬을 평생 반복한다.
김 교수는 이 Period2 분해가 두 가지 방법으로 발생하는 것을 밝혔다. 하나는 매우 빠른 속도로 분해가 일어나는 것이고 나머지 하나는 매우 느린 속도로 분해가 이뤄지는 것이다. 그리고 두 가지 방법의 비율을 조절하는 것이 Period2에 존재하는 인산화 스위치(Phosphoryltion switch)이다.
인산화 스위치의 역할은 온도가 올라갔을 때 느리게 분해되는 Period2의 양을 늘림으로써 전체적인 분해 속도가 천천히 이뤄지게 만든다. 반대로 온도가 내려갔을 때는 빠르게 분해되는 비율을 늘려 생체시계의 속도를 조절하는 것이다.
결국 생체시계 속도 유지의 핵심은 인산화 스위치이고, 다른 생화학 반응이 빨라져도 생체시계의 속도 유지를 가능하게 만드는 요소인 것이다.
이번 연구에서 밝혀진 인산화 스위치는 생체시계의 속도를 조절할 수 있는 핵심 요소가 될 전망이다. 이 인산화 스위치를 조절할 수 있는 약을 개발한다면 잦은 해외 출장으로 인한 시차, 주야 교대 근무 등에 의한 생체 시계 고장 예방 등에 기여할 수 있을 것으로 기대된다.
김 교수는 “이번 성과를 통해 우리나라에선 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”며 “수학이 생물학의 난제들을 해결하는데 기여할 수 있음을 알리고 싶다”고 말했다.
이번 연구는 듀크-국립 싱가폴 의과 대학 데이빗 벌쉽 (David Virshup) 교수 연구팀, 미국 미시간 대학 (University of Michigan, Ann Arbor) 데니 폴저 (Daniel Forger) 교수와의 공동연구로 진행됐다.
□ 그림 설명
그림 1 . 이번 연구에서 밝혀진 인산화 스위치와 그 과정에서 사용된 수학 방정식의 일부
그림 2. Period2 단백질이 인산화 스위치에 의해 낮은 온도(30도) 에서 분해되는 속도가 더 빨라진다는 것을 보여주는 실험
2015.10.05
조회수 18595
 김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
2016.11.10 조회수 49747
김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
2016.11.10 조회수 49747 수학 통해 생체시계 유지 원리 60여년 만에 밝혀
김 재 경 교수
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 온도 변화에도 생체시계의 속도를 유지하는 원리를 발견했다.
이번 연구는 저명 학술지 셀(Cell) 자매지 몰라큘러 셀(Molecular Cell) 10월 1일자에 게재됐다.
우리 뇌에 위치한 생체시계는 밤 9시 경이 되면 멜라토닌 분비가 시작되게 하고 아침 7시 경에 멈추게 한다. 그로 인해 우리는 매일 일정한 시간에 잠을 자고 기상할 수 있다.
생체시계는 온도가 변화해도 빨라지거나 느려지지 않고 일정한 속도가 유지된다. 따라서 우리의 체온이 변화해도 규칙적인 삶을 살 수 있고, 이는 환경에 따라 체온이 변하는 변온 동물에게도 적용된다.
이러한 생체시계의 성질은 1954년에 발견됐지만 그 원리는 밝혀지지 않아 지난 60여 년간 생체시계 분야의 가장 큰 미스테리로 남아 있었다.
김 교수는 수학 모델링을 통해 이 원리를 밝혀냈고 모델링 결과는 듀크-싱가폴 국립 의과대학 데이빗 벌쉽(David Virshup) 교수 연구팀의 실험을 통해 검증돼 60년의 난제가 풀렸다.
생체시계에는 Period2라는 핵심 단백질이 존재한다. 이 단백질은 12시간 동안 증가하고 나머지 12시간 동안 분해되는 리듬을 평생 반복한다.
김 교수는 이 Period2 분해가 두 가지 방법으로 발생하는 것을 밝혔다. 하나는 매우 빠른 속도로 분해가 일어나는 것이고 나머지 하나는 매우 느린 속도로 분해가 이뤄지는 것이다. 그리고 두 가지 방법의 비율을 조절하는 것이 Period2에 존재하는 인산화 스위치(Phosphoryltion switch)이다.
인산화 스위치의 역할은 온도가 올라갔을 때 느리게 분해되는 Period2의 양을 늘림으로써 전체적인 분해 속도가 천천히 이뤄지게 만든다. 반대로 온도가 내려갔을 때는 빠르게 분해되는 비율을 늘려 생체시계의 속도를 조절하는 것이다.
결국 생체시계 속도 유지의 핵심은 인산화 스위치이고, 다른 생화학 반응이 빨라져도 생체시계의 속도 유지를 가능하게 만드는 요소인 것이다.
이번 연구에서 밝혀진 인산화 스위치는 생체시계의 속도를 조절할 수 있는 핵심 요소가 될 전망이다. 이 인산화 스위치를 조절할 수 있는 약을 개발한다면 잦은 해외 출장으로 인한 시차, 주야 교대 근무 등에 의한 생체 시계 고장 예방 등에 기여할 수 있을 것으로 기대된다.
김 교수는 “이번 성과를 통해 우리나라에선 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”며 “수학이 생물학의 난제들을 해결하는데 기여할 수 있음을 알리고 싶다”고 말했다.
이번 연구는 듀크-국립 싱가폴 의과 대학 데이빗 벌쉽 (David Virshup) 교수 연구팀, 미국 미시간 대학 (University of Michigan, Ann Arbor) 데니 폴저 (Daniel Forger) 교수와의 공동연구로 진행됐다.
□ 그림 설명
그림 1 . 이번 연구에서 밝혀진 인산화 스위치와 그 과정에서 사용된 수학 방정식의 일부
그림 2. Period2 단백질이 인산화 스위치에 의해 낮은 온도(30도) 에서 분해되는 속도가 더 빨라진다는 것을 보여주는 실험
2015.10.05 조회수 18595
수학 통해 생체시계 유지 원리 60여년 만에 밝혀
김 재 경 교수
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 온도 변화에도 생체시계의 속도를 유지하는 원리를 발견했다.
이번 연구는 저명 학술지 셀(Cell) 자매지 몰라큘러 셀(Molecular Cell) 10월 1일자에 게재됐다.
우리 뇌에 위치한 생체시계는 밤 9시 경이 되면 멜라토닌 분비가 시작되게 하고 아침 7시 경에 멈추게 한다. 그로 인해 우리는 매일 일정한 시간에 잠을 자고 기상할 수 있다.
생체시계는 온도가 변화해도 빨라지거나 느려지지 않고 일정한 속도가 유지된다. 따라서 우리의 체온이 변화해도 규칙적인 삶을 살 수 있고, 이는 환경에 따라 체온이 변하는 변온 동물에게도 적용된다.
이러한 생체시계의 성질은 1954년에 발견됐지만 그 원리는 밝혀지지 않아 지난 60여 년간 생체시계 분야의 가장 큰 미스테리로 남아 있었다.
김 교수는 수학 모델링을 통해 이 원리를 밝혀냈고 모델링 결과는 듀크-싱가폴 국립 의과대학 데이빗 벌쉽(David Virshup) 교수 연구팀의 실험을 통해 검증돼 60년의 난제가 풀렸다.
생체시계에는 Period2라는 핵심 단백질이 존재한다. 이 단백질은 12시간 동안 증가하고 나머지 12시간 동안 분해되는 리듬을 평생 반복한다.
김 교수는 이 Period2 분해가 두 가지 방법으로 발생하는 것을 밝혔다. 하나는 매우 빠른 속도로 분해가 일어나는 것이고 나머지 하나는 매우 느린 속도로 분해가 이뤄지는 것이다. 그리고 두 가지 방법의 비율을 조절하는 것이 Period2에 존재하는 인산화 스위치(Phosphoryltion switch)이다.
인산화 스위치의 역할은 온도가 올라갔을 때 느리게 분해되는 Period2의 양을 늘림으로써 전체적인 분해 속도가 천천히 이뤄지게 만든다. 반대로 온도가 내려갔을 때는 빠르게 분해되는 비율을 늘려 생체시계의 속도를 조절하는 것이다.
결국 생체시계 속도 유지의 핵심은 인산화 스위치이고, 다른 생화학 반응이 빨라져도 생체시계의 속도 유지를 가능하게 만드는 요소인 것이다.
이번 연구에서 밝혀진 인산화 스위치는 생체시계의 속도를 조절할 수 있는 핵심 요소가 될 전망이다. 이 인산화 스위치를 조절할 수 있는 약을 개발한다면 잦은 해외 출장으로 인한 시차, 주야 교대 근무 등에 의한 생체 시계 고장 예방 등에 기여할 수 있을 것으로 기대된다.
김 교수는 “이번 성과를 통해 우리나라에선 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”며 “수학이 생물학의 난제들을 해결하는데 기여할 수 있음을 알리고 싶다”고 말했다.
이번 연구는 듀크-국립 싱가폴 의과 대학 데이빗 벌쉽 (David Virshup) 교수 연구팀, 미국 미시간 대학 (University of Michigan, Ann Arbor) 데니 폴저 (Daniel Forger) 교수와의 공동연구로 진행됐다.
□ 그림 설명
그림 1 . 이번 연구에서 밝혀진 인산화 스위치와 그 과정에서 사용된 수학 방정식의 일부
그림 2. Period2 단백질이 인산화 스위치에 의해 낮은 온도(30도) 에서 분해되는 속도가 더 빨라진다는 것을 보여주는 실험
2015.10.05 조회수 18595