%EB%B0%95%ED%98%84%EA%B7%9C
-
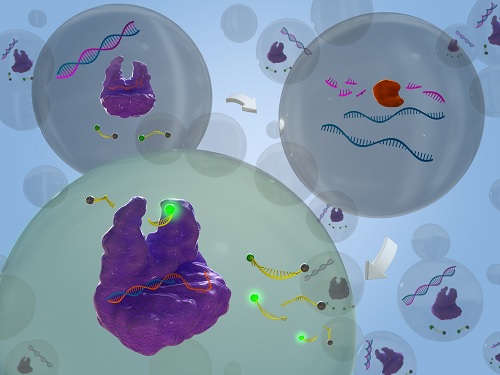 유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 13545
유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 13545 -
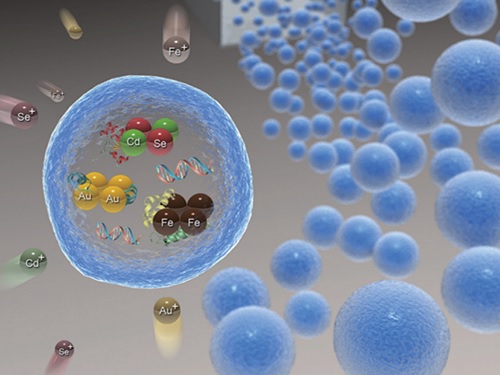 위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 17060
위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 17060 -
 RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15 조회수 14333
RNA 바이러스 초고감도 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 핵산의 절단 및 중합 연쇄반응 시스템을 활용해 RNA 바이러스의 표적 RNA를 초고감도로 검출하는 새로운 등온 핵산 증폭(NESBA, Nicking and Extension chain reaction System-Based Amplification) 기술을 개발했다고 15일 밝혔다.
생명화학공학과 주용 박사과정, 김효용 박사가 공동 제1 저자로 참여한 이번 연구는 영국 왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 24호 표지(Front cover) 논문으로 지난달 16일 선정됐다. (논문명: Ultrasensitive version of nucleic acid sequence-based amplification (NASBA) utilizing nicking and extension chain reaction system)
현재 전 세계적으로 팬데믹 (Pandemic)을 일으키고 있는 코로나19 바이러스와 같은 RNA 바이러스를 검출하기 위한 표준 진단 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 이러한 표준 분자진단 방법은 면역진단 방법과 비교해 진단의 정확도는 매우 우수하지만 정교한 온도 조절 장치가 필요하고 진단에 드는 시간이 길어 장비의 소형화에 제약이 있으며 전문 진단 설비가 갖추어진 대형 병원 또는 전문 임상검사실에서만 제한적으로 사용된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해 핵산의 절단 및 중합 연쇄반응 시스템에 의해 구동되는 초고감도의 신개념 등온 핵산 증폭 기술을 개발했으며, 이를 통해 별도의 온도 변환 과정 없이 동일 온도에서 표적 바이러스의 RNA를 초고감도로(검출 한계: 1 아토 몰 (aM)) 매우 신속하게(20분 이내) 검출하는 데 성공했다.
연구팀은 기존 나스바(NASBA, Nucleic Acid Sequence-Based Amplification) 등온 증폭 기술에 절단효소 인식 염기서열이 수식된 프라이머를 도입함으로써, 절단효소 및 DNA 중합효소 활성을 기반으로 T7 프로모터를 포함하는 이중가닥 DNA를 지수함수적으로 증폭할 수 있었고, 최종적으로 표적 RNA를 기존의 NASBA 기술에 비해 100배 이상 향상된 민감도로 검출할 수 있었다.
연구팀은 이 기술을 통해서, 호흡기 세포 융합 바이러스(RSV)의 유전 RNA(genomic RNA)를 별도의 전처리 없이 매우 신속하고 고감도로 검출함으로써, 기술의 실용성을 증명함과 동시에 현장 검사(POCT) 기술로서의 높은 활용 가능성을 입증했다.
박현규 교수는 "이번 신개념 등온 핵산 증폭 기술은 현재 대유행하고 있는 코로나19 바이러스와 같은 RNA 바이러스들을 신속하게 조기 진단 할 수 있는 분자진단 시스템에 활용될 가능성이 매우 큰 기술ˮ이라고 이번 연구의 의의를 설명했으며, 현재 코로나19의 임상 샘플 테스트에서도 매우 좋은 결과를 얻었다고 언급했다.
한편 이번 연구는 한국연구재단의 글로벌 프런티어사업과 경남제약(주)의 연구비 지원으로 수행됐다.
2021.07.15 조회수 14333 -
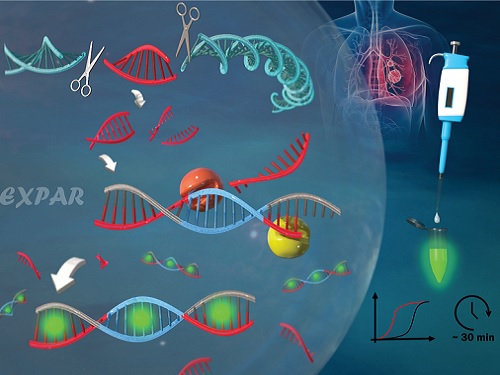 유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 33608
유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 33608 -
 박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21389
박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21389 -
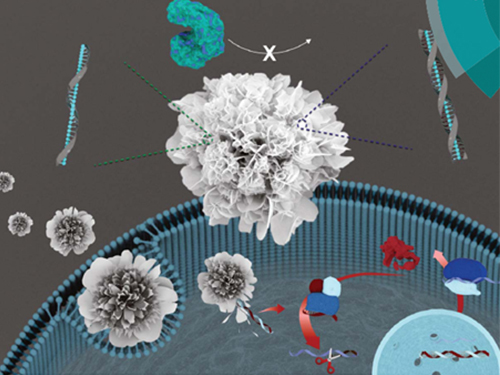 박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14 조회수 22487
박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14 조회수 22487 -
 박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
2016.05.03 조회수 12055
박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
2016.05.03 조회수 12055 -
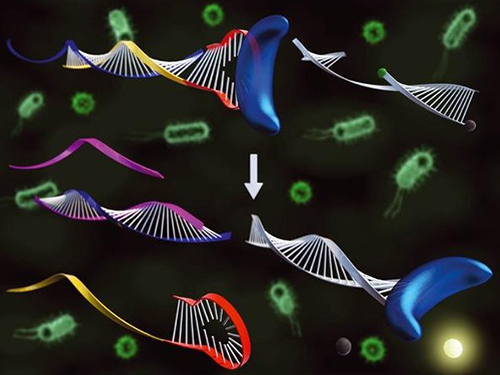 표적 DNA 저렴하게 분석 가능한 유전자 진단 기술 개발
박 현 규 교수
우리 대학 생명화학공학과 박현규 교수 연구팀이 특정 단백질이나 효소를 인식하는 물질인 압타머(Aptamer : 표적 물질과 결합할 수 있는 특성을 가진 DNA)를 이용해 다양한 표적 DNA를 분석할 수 있는 기술을 개발했다.
이 기술을 통해 메르스와 같은 신종 바이러스 병원균 감염 여부 등 다양한 유전자를 기존에 비해 저렴한 가격으로 진단할 수 있을 것으로 기대된다.
이번 연구결과는 영국왕립화학회가 발행하는 케미컬 커뮤니케이션즈(Chemical communications) 6월호 후면 표지논문으로 선정됐다.
기존의 분자 비콘(Molecular beacon) 프로브 기반 유전자 분석은 분석 대상인 표적 DNA가 변경되면 이에 대응하는 새로운 분자 비콘 프로브가 필요했다. 따라서 다양한 표적 DNA를 분석하는데 많은 비용이 필요하다는 한계가 있었다.
문제 해결을 위해 연구팀은 DNA 중합효소와 결합해 활성을 저해시키는 압타머를 고안했다. 그리고 이를 역으로 이용해 표적 DNA가 존재하는 경우에만 압타머가 DNA 중합효소와 결합하지 않고 활성을 유지할 수 있게 조절하는 기술을 최초로 개발했다.
이 기술 개발로 조절된 DNA 중합효소의 활성이 핵산 신장 및 절단 반응을 일으키고 그 결과로 형광 프로브(TaqMan probe)의 형광신호 측정이 가능해졌다. 따라서 동일한 형광 프로브를 이용해 다양한 표적 DNA를 민감하게 검출할 수 있는 새로운 유전자 진단 기술 개발이 가능해졌다.
이 기술은 표적 DNA의 종류에 따라 새로운 프로브를 사용해야 했던 기존 기술과 달리 동일한 형광 프로브를 이용하기 때문에 다양한 표적핵산을 값싸고 손쉽게 검출할 수 있다. 기술을 응용하면 과거에 비해 여러 가지 다른 병원균의 감염 여부를 저렴하고 수월하게 파악할 수 있다.
박 교수는 “메르스처럼 새로운 병원체에 대한 진단 키트를 용이하게 제작할 수 있어 여러 병원균에 대해 신속히 대응할 수 있다”며 “향후 유전자 진단 분야에서 새 원천기술로 널리 활용될 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 추진하는 글로벌프론티어사업(바이오나노헬스가드연구단)의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 표적핵산에 의한 DNA 중합효소 활성 변화를 이용해 표적 핵산을 검출한 모식도
2015.07.27 조회수 12559
표적 DNA 저렴하게 분석 가능한 유전자 진단 기술 개발
박 현 규 교수
우리 대학 생명화학공학과 박현규 교수 연구팀이 특정 단백질이나 효소를 인식하는 물질인 압타머(Aptamer : 표적 물질과 결합할 수 있는 특성을 가진 DNA)를 이용해 다양한 표적 DNA를 분석할 수 있는 기술을 개발했다.
이 기술을 통해 메르스와 같은 신종 바이러스 병원균 감염 여부 등 다양한 유전자를 기존에 비해 저렴한 가격으로 진단할 수 있을 것으로 기대된다.
이번 연구결과는 영국왕립화학회가 발행하는 케미컬 커뮤니케이션즈(Chemical communications) 6월호 후면 표지논문으로 선정됐다.
기존의 분자 비콘(Molecular beacon) 프로브 기반 유전자 분석은 분석 대상인 표적 DNA가 변경되면 이에 대응하는 새로운 분자 비콘 프로브가 필요했다. 따라서 다양한 표적 DNA를 분석하는데 많은 비용이 필요하다는 한계가 있었다.
문제 해결을 위해 연구팀은 DNA 중합효소와 결합해 활성을 저해시키는 압타머를 고안했다. 그리고 이를 역으로 이용해 표적 DNA가 존재하는 경우에만 압타머가 DNA 중합효소와 결합하지 않고 활성을 유지할 수 있게 조절하는 기술을 최초로 개발했다.
이 기술 개발로 조절된 DNA 중합효소의 활성이 핵산 신장 및 절단 반응을 일으키고 그 결과로 형광 프로브(TaqMan probe)의 형광신호 측정이 가능해졌다. 따라서 동일한 형광 프로브를 이용해 다양한 표적 DNA를 민감하게 검출할 수 있는 새로운 유전자 진단 기술 개발이 가능해졌다.
이 기술은 표적 DNA의 종류에 따라 새로운 프로브를 사용해야 했던 기존 기술과 달리 동일한 형광 프로브를 이용하기 때문에 다양한 표적핵산을 값싸고 손쉽게 검출할 수 있다. 기술을 응용하면 과거에 비해 여러 가지 다른 병원균의 감염 여부를 저렴하고 수월하게 파악할 수 있다.
박 교수는 “메르스처럼 새로운 병원체에 대한 진단 키트를 용이하게 제작할 수 있어 여러 병원균에 대해 신속히 대응할 수 있다”며 “향후 유전자 진단 분야에서 새 원천기술로 널리 활용될 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 추진하는 글로벌프론티어사업(바이오나노헬스가드연구단)의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 표적핵산에 의한 DNA 중합효소 활성 변화를 이용해 표적 핵산을 검출한 모식도
2015.07.27 조회수 12559 -
 DNA 기반 반도체 핵심 원천기술 개발
박현규 교수
- 분자 비콘을 이용해 모든(8가지) 논리게이트 구현하는 데 성공 -- 스몰(Small)誌 7월호 표지논문으로 실려 -
초소형 미래 바이오전자기기를 구현하기 위한 핵심기술 개발됐다.
우리 학교 생명화학공학과 박현규 교수 연구팀이 DNA를 이용해 모든 논리게이트를 구현하는 데 성공, 나노분야의 세계적 학술지 ‘스몰(Small)’ 7월호(23일자) 표지논문으로 실렸다.
현재 최첨단 기술로도 10nm(나노미터) 이하의 실리콘 기반 반도체 제작은 불가능한 것으로 알려져 있지만, DNA는 굵기가 2nm 정도로 가늘기 때문에 보다 저렴하면서도 획기적인 집적도를 가진 반도체를 만들 수 있을 것으로 기대된다.
2나노급 반도체가 개발되면 우표 크기의 메모리 반도체에 고화질 영화 10000편을 저장하는 등 현재 상용화중인 20나노급 반도체보다 약 100배의 용량을 담을 수 있게 된다.
DNA는 네 종류의 염기인 아데닌(adenine, A), 시토신(cytosine, C), 구아닌(guanin, G), 티민(thymine, T)이 연속적으로 연결돼 있는데 A는 T와, G는 C와 각각 특이적으로 결합하는 특성을 갖고 있다.
특정 DNA는 특이적으로 결합하는 염기서열을 지닌 또 다른 DNA와 결합해 이중나선 구조를 형성하는 데, 연구팀은 이러한 DNA의 특이적 결합 특성과 구조 변화에 따른 형광신호 특성이 있는 고리모양의 분자 비콘을 이용했다.
연구팀은 생체 DNA물질을 디지털 회로에서 사용되는 논리게이트와 같은 역할을 담당하도록 입력신호로 사용해 고리모양의 DNA가 열리거나 닫히도록 했다.
고리모양 DNA가 열린 형태에서는 형광신호가 증가하고 닫힌 상태에서는 형광 신호가 감소하며 이로 인해 발생하는 형광신호의 변화를 출력신호로 사용했다.
연구팀은 제한적인 시스템만을 구현하는 기존의 논리게이트의 문제점을 극복, 8가지 모든 논리게이트(AND, OR, XOR, INHIBIT, NAND, NOR, XNOR, IMPlCATION)를 구현하는 데 성공해 반도체 기술로써의 적용 가능성을 높였다.
이와 함께, 각각의 논리게이트의 연결을 통한 다중 논리게이트(Multilevel circuits)와 논리게이트의 재생성을 보여주는 데도 성공했다.
박현규 교수는 “하나의 분자 비콘을 모든 게이트 구성을 위한 보편적인 요소로 사용해 저렴하면서도 초고집적 바이오 전자기기의 가능성을 높였다”며 “앞으로 분자 수준의 전자 소자 연구에 큰 변화가 있을 것으로 예상된다”고 말했다.
이번 연구를 주도한 박기수 박사과정 학생(제1저자)은 “DNA는 10개의 염기서열 길이가 3.4nm이고 굵기가 2nm밖에 되지 않는 매우 작은 물질이기 때문에 이를 이용해 전자 소자를 구현하면 획기적인 집적도 향상을 이룰 수 있다”며 “간단한 시스템 디자인을 통해 정확한 논리게이트를 구현해 내 DNA 반도체를 탑재한 바이오컴퓨터가 곧 현실로 다가올 것”이라고 말했다.XOR 게이트 : 입력 DNA A(input A)와 입력 DNA B(input B) 둘 중 하나만 있을 때는 고리모양 DNA가 열려서 형광 신호가 나오고(출력신호 1), DNA A와 B가 모두 없을 경우와 모두 있는 경우에는 고리모양 DNA가 고리모양을 유지하여 형광을 발생하지 않게 함으로써 XOR 논리게이트를 정확하게 구현했다.
2012.09.18 조회수 16821
DNA 기반 반도체 핵심 원천기술 개발
박현규 교수
- 분자 비콘을 이용해 모든(8가지) 논리게이트 구현하는 데 성공 -- 스몰(Small)誌 7월호 표지논문으로 실려 -
초소형 미래 바이오전자기기를 구현하기 위한 핵심기술 개발됐다.
우리 학교 생명화학공학과 박현규 교수 연구팀이 DNA를 이용해 모든 논리게이트를 구현하는 데 성공, 나노분야의 세계적 학술지 ‘스몰(Small)’ 7월호(23일자) 표지논문으로 실렸다.
현재 최첨단 기술로도 10nm(나노미터) 이하의 실리콘 기반 반도체 제작은 불가능한 것으로 알려져 있지만, DNA는 굵기가 2nm 정도로 가늘기 때문에 보다 저렴하면서도 획기적인 집적도를 가진 반도체를 만들 수 있을 것으로 기대된다.
2나노급 반도체가 개발되면 우표 크기의 메모리 반도체에 고화질 영화 10000편을 저장하는 등 현재 상용화중인 20나노급 반도체보다 약 100배의 용량을 담을 수 있게 된다.
DNA는 네 종류의 염기인 아데닌(adenine, A), 시토신(cytosine, C), 구아닌(guanin, G), 티민(thymine, T)이 연속적으로 연결돼 있는데 A는 T와, G는 C와 각각 특이적으로 결합하는 특성을 갖고 있다.
특정 DNA는 특이적으로 결합하는 염기서열을 지닌 또 다른 DNA와 결합해 이중나선 구조를 형성하는 데, 연구팀은 이러한 DNA의 특이적 결합 특성과 구조 변화에 따른 형광신호 특성이 있는 고리모양의 분자 비콘을 이용했다.
연구팀은 생체 DNA물질을 디지털 회로에서 사용되는 논리게이트와 같은 역할을 담당하도록 입력신호로 사용해 고리모양의 DNA가 열리거나 닫히도록 했다.
고리모양 DNA가 열린 형태에서는 형광신호가 증가하고 닫힌 상태에서는 형광 신호가 감소하며 이로 인해 발생하는 형광신호의 변화를 출력신호로 사용했다.
연구팀은 제한적인 시스템만을 구현하는 기존의 논리게이트의 문제점을 극복, 8가지 모든 논리게이트(AND, OR, XOR, INHIBIT, NAND, NOR, XNOR, IMPlCATION)를 구현하는 데 성공해 반도체 기술로써의 적용 가능성을 높였다.
이와 함께, 각각의 논리게이트의 연결을 통한 다중 논리게이트(Multilevel circuits)와 논리게이트의 재생성을 보여주는 데도 성공했다.
박현규 교수는 “하나의 분자 비콘을 모든 게이트 구성을 위한 보편적인 요소로 사용해 저렴하면서도 초고집적 바이오 전자기기의 가능성을 높였다”며 “앞으로 분자 수준의 전자 소자 연구에 큰 변화가 있을 것으로 예상된다”고 말했다.
이번 연구를 주도한 박기수 박사과정 학생(제1저자)은 “DNA는 10개의 염기서열 길이가 3.4nm이고 굵기가 2nm밖에 되지 않는 매우 작은 물질이기 때문에 이를 이용해 전자 소자를 구현하면 획기적인 집적도 향상을 이룰 수 있다”며 “간단한 시스템 디자인을 통해 정확한 논리게이트를 구현해 내 DNA 반도체를 탑재한 바이오컴퓨터가 곧 현실로 다가올 것”이라고 말했다.XOR 게이트 : 입력 DNA A(input A)와 입력 DNA B(input B) 둘 중 하나만 있을 때는 고리모양 DNA가 열려서 형광 신호가 나오고(출력신호 1), DNA A와 B가 모두 없을 경우와 모두 있는 경우에는 고리모양 DNA가 고리모양을 유지하여 형광을 발생하지 않게 함으로써 XOR 논리게이트를 정확하게 구현했다.
2012.09.18 조회수 16821 -
 스마트폰 질병진단 원천기술 개발
- 신개념의 생체분자 검출기술로 휴대용 체외진단 분야에 획기적 원천기술- 화학분야 세계적 학술지 ‘앙게반테 케미’ 1월호(16일자) 표지논문 선정
스마트폰으로도 질병을 진단하는 원천기술이 국내 연구진에 의해 개발됐다.
우리 학교 생명화학공학과 박현규 교수 연구팀이 스마트폰을 비롯한 휴대용 개인기기에 널리 이용되고 있는 정전기방식의 터치스크린을 이용해 생체분자를 검출하는 원천기술을 세계 최초로 개발하는 데 성공했다.
앞으로 병원에 가지 않고도 스마트폰을 가지고 간단한 질병을 진단하는 시대가 열릴 것으로 기대된다.
최근 스마트폰과 같은 휴대용 전자기기에 적용되는 정전기방식의 터치스크린은 일반적으로 손가락의 접촉을 통해 발생하는 터치스크린 표면의 정전용량 변화를 감지해 작업을 수행하도록 설계돼 있다.
연구팀은 DNA가 자체의 정전용량을 가지고 있으며, 농도에 따라 정전용량이 변화한다는 사실에 착안해 정전기방식의 터치스크린을 생체분자 검출에 활용할 수 있을 것이라고 예상했다.
이를 규명하기 위해 연구팀은 대표적인 생체분자인 DNA를 터치스크린 위에 가하고 정전용량 변화량을 감지했다. 실험결과 터치스크린을 이용해 DNA의 유무와 농도를 정확하게 검출할 수 있었다.이 결과에 따라 DNA뿐만 아니라 세포, 단백질, 핵산, 등 대부분의 생체분자가 정전용량을 갖고 있기 때문에 다양한 생체물질의 검출에도 활용될 수 있다는 가능성을 제시했다는 게 이 기술의 큰 특징이다.
박현규 교수는 “모바일 기기 등에 입력장치로만 이용해 왔던 터치스크린으로 생체 분자 등의 분석에 이용할 수 있음을 세계 최초로 입증한 결과”라며 “이 원천기술을 이용해 앞으로 터치스크린 기반의 스마트폰 또는 태블릿 PC 등을 이용해 개인이 질병을 진단하는 시대가 올 것”이라고 말했다.
이와 함께 논문의 제1저자인 원병연 연구조교수는 “현재는 생체분자의 유무 또는 농도만 측정 가능한 단계이며, 앞으로 특정 생체분자를 선택적으로 검출할 수 있는 기술을 개발해 가까운 시일 내에 상용화에 주력할 것”이라고 덧붙였다.
한편, 이번 연구는 지식경제부가 시행하는 ‘산업원천기술개발사업’으로 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적 학술지 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 1월호(16일자) 표지논문으로 선정됐다.
그림1. 터치스크린을 이용한 생체 분자 검출 시스템 모식도 (앙게반테 케미 논문 표지). 휴대용 모바일 기기의 입력장치인 터치스크린 위에서 세포, 단백실, 핵산, 소분자 등의 생체 분자를 검출할 수 있다.
그림2. 정전용량 터치스크린 방식의 한가지인 surface capacitive touchscreen을 이용한 시스템 모식도. 여러 지점을 동시에 접촉했을 때 접촉점의 시료 농도에 따라 터치 신호의 위치가 변하는 원리를 이용한 방법. 동시에 두 개의 미지 시료의 농도를 측정할 수 있다.
그림3. 정전용량 터치스크린 방식의 한가지인 projected capacitive touchscreen을 이용한 시스템 모식도. 현재 스마트폰 등에 쓰이는 터치스크린 방식으로서, 터치스크린 표면 내부에 여러 라인의 전극이 패턴되어 있어, 각 전극의 정전용량 변화를 각각 측정함으로써 여러 접촉 시료의 농도를 동시에 검출할 수 있다.
2012.01.16 조회수 21385
스마트폰 질병진단 원천기술 개발
- 신개념의 생체분자 검출기술로 휴대용 체외진단 분야에 획기적 원천기술- 화학분야 세계적 학술지 ‘앙게반테 케미’ 1월호(16일자) 표지논문 선정
스마트폰으로도 질병을 진단하는 원천기술이 국내 연구진에 의해 개발됐다.
우리 학교 생명화학공학과 박현규 교수 연구팀이 스마트폰을 비롯한 휴대용 개인기기에 널리 이용되고 있는 정전기방식의 터치스크린을 이용해 생체분자를 검출하는 원천기술을 세계 최초로 개발하는 데 성공했다.
앞으로 병원에 가지 않고도 스마트폰을 가지고 간단한 질병을 진단하는 시대가 열릴 것으로 기대된다.
최근 스마트폰과 같은 휴대용 전자기기에 적용되는 정전기방식의 터치스크린은 일반적으로 손가락의 접촉을 통해 발생하는 터치스크린 표면의 정전용량 변화를 감지해 작업을 수행하도록 설계돼 있다.
연구팀은 DNA가 자체의 정전용량을 가지고 있으며, 농도에 따라 정전용량이 변화한다는 사실에 착안해 정전기방식의 터치스크린을 생체분자 검출에 활용할 수 있을 것이라고 예상했다.
이를 규명하기 위해 연구팀은 대표적인 생체분자인 DNA를 터치스크린 위에 가하고 정전용량 변화량을 감지했다. 실험결과 터치스크린을 이용해 DNA의 유무와 농도를 정확하게 검출할 수 있었다.이 결과에 따라 DNA뿐만 아니라 세포, 단백질, 핵산, 등 대부분의 생체분자가 정전용량을 갖고 있기 때문에 다양한 생체물질의 검출에도 활용될 수 있다는 가능성을 제시했다는 게 이 기술의 큰 특징이다.
박현규 교수는 “모바일 기기 등에 입력장치로만 이용해 왔던 터치스크린으로 생체 분자 등의 분석에 이용할 수 있음을 세계 최초로 입증한 결과”라며 “이 원천기술을 이용해 앞으로 터치스크린 기반의 스마트폰 또는 태블릿 PC 등을 이용해 개인이 질병을 진단하는 시대가 올 것”이라고 말했다.
이와 함께 논문의 제1저자인 원병연 연구조교수는 “현재는 생체분자의 유무 또는 농도만 측정 가능한 단계이며, 앞으로 특정 생체분자를 선택적으로 검출할 수 있는 기술을 개발해 가까운 시일 내에 상용화에 주력할 것”이라고 덧붙였다.
한편, 이번 연구는 지식경제부가 시행하는 ‘산업원천기술개발사업’으로 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적 학술지 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 1월호(16일자) 표지논문으로 선정됐다.
그림1. 터치스크린을 이용한 생체 분자 검출 시스템 모식도 (앙게반테 케미 논문 표지). 휴대용 모바일 기기의 입력장치인 터치스크린 위에서 세포, 단백실, 핵산, 소분자 등의 생체 분자를 검출할 수 있다.
그림2. 정전용량 터치스크린 방식의 한가지인 surface capacitive touchscreen을 이용한 시스템 모식도. 여러 지점을 동시에 접촉했을 때 접촉점의 시료 농도에 따라 터치 신호의 위치가 변하는 원리를 이용한 방법. 동시에 두 개의 미지 시료의 농도를 측정할 수 있다.
그림3. 정전용량 터치스크린 방식의 한가지인 projected capacitive touchscreen을 이용한 시스템 모식도. 현재 스마트폰 등에 쓰이는 터치스크린 방식으로서, 터치스크린 표면 내부에 여러 라인의 전극이 패턴되어 있어, 각 전극의 정전용량 변화를 각각 측정함으로써 여러 접촉 시료의 농도를 동시에 검출할 수 있다.
2012.01.16 조회수 21385 -
 신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
2011.06.29 조회수 18089
신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
2011.06.29 조회수 18089 -
 신개념 심혈관질환 진단시스템 개발
- 심혈관질환 진단을 위한 호모시스테인 분석법 개발 연구에 큰 진보- 분석화학분야 세계적 학술지‘어널리티컬 케미스트리誌’4월호 표지논문 선정
신속하고 간편한 신개념 심혈관질환 진단시스템이 국내연구진에의해 개발됐다.
우리학교 생명화학공학과 박현규 교수는 대장균을 이용해 심혈관질환을 유발하는 혈액 속 호모시스테인(Homocysteine)의 농도를 분석하는 기술을 개발했다.
연구팀은 유전자 재조합을 통해 서로 다른 두 개의 생물발광 대장균 영양요구주를 만들어 호모시스테인에 대한 두 균주의 성장차이를 생물발광 신호로 분석했다.
이 기술은 많은 수의 혈액 샘플을 대량으로 동시에 분석할 수 있어 매우 경제적이기 때문에 최근 급성장하는 호모시스테인 정량검사 분야의 상업화에 커다란 진보를 일궈낸 것으로 평가받고 있다.
기존의 효소반응 또는 고성능 액체크로마토그래피(High Performance Liquid Chromatography)를 이용하는 방법은 비교적 긴 시간이 소요되며 가격이 비싼 단점이 있었다.
연구팀은 이를 극복해 아무런 추가 조작 없이 유전자 재조합 대장균을 배양하고 이에 따라 자동적으로 생성되는 발광신호를 측정함으로써 호모시스테인을 매우 신속하고 간편하게 측정할 수 있었다.
박현규 교수는 “이 기술은 심혈관질환을 유발하는 호모시스테인을 유전자 재조합 대장균을 이용해 정확하게 분석하는 신개념 분석법으로 학계에서 최초로 발표된 신기술이다”라고 말했다.
이번 연구는 그 중요성을 인정받아 분석화학 분야의 세계적인 학술지인 ‘어낼리티컬 케미스트리(Analytical Chemistry)’ 4월호(4월 15일자) 표지논문으로 선정됐다.
한편, 생명화학공학과 박현규 교수와 우민아 박사과정 학생이 주도한 이번 연구는 한국연구재단(이사장 오세정)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐다.
2011.04.27 조회수 19291
신개념 심혈관질환 진단시스템 개발
- 심혈관질환 진단을 위한 호모시스테인 분석법 개발 연구에 큰 진보- 분석화학분야 세계적 학술지‘어널리티컬 케미스트리誌’4월호 표지논문 선정
신속하고 간편한 신개념 심혈관질환 진단시스템이 국내연구진에의해 개발됐다.
우리학교 생명화학공학과 박현규 교수는 대장균을 이용해 심혈관질환을 유발하는 혈액 속 호모시스테인(Homocysteine)의 농도를 분석하는 기술을 개발했다.
연구팀은 유전자 재조합을 통해 서로 다른 두 개의 생물발광 대장균 영양요구주를 만들어 호모시스테인에 대한 두 균주의 성장차이를 생물발광 신호로 분석했다.
이 기술은 많은 수의 혈액 샘플을 대량으로 동시에 분석할 수 있어 매우 경제적이기 때문에 최근 급성장하는 호모시스테인 정량검사 분야의 상업화에 커다란 진보를 일궈낸 것으로 평가받고 있다.
기존의 효소반응 또는 고성능 액체크로마토그래피(High Performance Liquid Chromatography)를 이용하는 방법은 비교적 긴 시간이 소요되며 가격이 비싼 단점이 있었다.
연구팀은 이를 극복해 아무런 추가 조작 없이 유전자 재조합 대장균을 배양하고 이에 따라 자동적으로 생성되는 발광신호를 측정함으로써 호모시스테인을 매우 신속하고 간편하게 측정할 수 있었다.
박현규 교수는 “이 기술은 심혈관질환을 유발하는 호모시스테인을 유전자 재조합 대장균을 이용해 정확하게 분석하는 신개념 분석법으로 학계에서 최초로 발표된 신기술이다”라고 말했다.
이번 연구는 그 중요성을 인정받아 분석화학 분야의 세계적인 학술지인 ‘어낼리티컬 케미스트리(Analytical Chemistry)’ 4월호(4월 15일자) 표지논문으로 선정됐다.
한편, 생명화학공학과 박현규 교수와 우민아 박사과정 학생이 주도한 이번 연구는 한국연구재단(이사장 오세정)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐다.
2011.04.27 조회수 19291