%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B3%BC
-
 소금 결핍 시 장에서 섭취 욕구 조절하다
나트륨은 생물이 살아가는 데 필요한 중요한 미량영양소 중 하나로, 수분 균형과 혈압을 조절하며 근육 수축 및 신경세포의 작용전위 생성에 필수적이다. 한국 연구진은 소금 섭취 욕구가 짠맛에만 의존하는 것이 아니라, 체내 나트륨 수준에 따라 결정된다는 새로운 시각을 제시했고 미각 감지 기작과는 다르게 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견했다.
우리 대학 생명과학과 서성배 교수 연구팀이 나트륨이라는 미량영양소에 대한 우리 몸의 새로운 감지 기작과 그 욕구를 조절하는 새로운 메커니즘을 발견했다고 2일 밝혔다.
연구팀은 소금에 대한 미각 감지 기작을 넘어 장내 신경세포가 나트륨에 직접적으로 반응하고 이 반응이 동물의 소금에 대한 섭취 욕구를 조절하는 새로운 감지 기작으로 작용한다는 연구 결과를 밝혔다.
해당 연구에서는 초파리를 이용해 나트륨 결핍 상태에 따른 소금에 대한 선호도가 증가함을 확인했다. 더욱 흥미로운 점은 나트륨에 대한 선호도가 소금에 대한 미각 센서가 작동하지 못하는 ‘Ir76b’ 돌연변이 파리에서도 나트륨 결핍 상태에서 소금을 더 선호한다는 것이다. 이에 연구진은 스크리닝을 통해 나트륨을 직접 인지하는 초파리의 장내 신경세포를 발견했으며, 이 신경세포가 나트륨 결핍에 따라 나트륨에 대한 반응 정도를 다르게 해 초파리의 소금 섭취 욕구를 조절하는 역할을 한다는 것을 규명했다.
연구팀은 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견하며 소금에 대한 섭취 욕구는 모든 생물에 존재하는 것이기에 해당 연구는 곤충뿐 아니라 포유동물과 같은 척추동물에서도 유사한 메커니즘이 존재할 수 있다는 가능성도 제시했다.
나아가 소금에 대한 섭취 욕구를 조절함으로써 이를 통해 소금 과다 섭취로 생기는 고혈압 등의 여러 질병에서 새로운 생리학적 측면에서의 접근 방식을 할 수 있을 것이라 여겨진다.
연구를 주도한 서성배 교수는 “이번 연구는 소금의 짠맛과는 독립적으로 장 신경세포를 통해 선호도가 결정된다는 것을 발견하였고, 나트륨 섭취의 생리적 조절에 대한 새로운 메커니즘을 제공하였다 소금에 대한 섭취욕은 모든 진화 생물에서 보이는 공통적인 특징으로 해당 연구를 통해서 소금에 대한 섭취 욕구를 조절하여 고혈압을 포함한 여러 질병에 생리학적으로 접근할 수 있는 가능성을 보여준 것이라 기대한다.”고 말했다.
생명과학과 김병수 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이쳐 메타볼리즘(Nature Metabolism)’ 4월 3일 자로 온라인판에 게재됐다. (논문명 : Postprandial sodium sensing by enteric neurons in Drosophila).
한편 이번 연구는 한국연구재단, 리더과제 (전 창의과제), 생명과학 프로젝트 지원을 받아 수행됐다.
2024.05.02 조회수 3877
소금 결핍 시 장에서 섭취 욕구 조절하다
나트륨은 생물이 살아가는 데 필요한 중요한 미량영양소 중 하나로, 수분 균형과 혈압을 조절하며 근육 수축 및 신경세포의 작용전위 생성에 필수적이다. 한국 연구진은 소금 섭취 욕구가 짠맛에만 의존하는 것이 아니라, 체내 나트륨 수준에 따라 결정된다는 새로운 시각을 제시했고 미각 감지 기작과는 다르게 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견했다.
우리 대학 생명과학과 서성배 교수 연구팀이 나트륨이라는 미량영양소에 대한 우리 몸의 새로운 감지 기작과 그 욕구를 조절하는 새로운 메커니즘을 발견했다고 2일 밝혔다.
연구팀은 소금에 대한 미각 감지 기작을 넘어 장내 신경세포가 나트륨에 직접적으로 반응하고 이 반응이 동물의 소금에 대한 섭취 욕구를 조절하는 새로운 감지 기작으로 작용한다는 연구 결과를 밝혔다.
해당 연구에서는 초파리를 이용해 나트륨 결핍 상태에 따른 소금에 대한 선호도가 증가함을 확인했다. 더욱 흥미로운 점은 나트륨에 대한 선호도가 소금에 대한 미각 센서가 작동하지 못하는 ‘Ir76b’ 돌연변이 파리에서도 나트륨 결핍 상태에서 소금을 더 선호한다는 것이다. 이에 연구진은 스크리닝을 통해 나트륨을 직접 인지하는 초파리의 장내 신경세포를 발견했으며, 이 신경세포가 나트륨 결핍에 따라 나트륨에 대한 반응 정도를 다르게 해 초파리의 소금 섭취 욕구를 조절하는 역할을 한다는 것을 규명했다.
연구팀은 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견하며 소금에 대한 섭취 욕구는 모든 생물에 존재하는 것이기에 해당 연구는 곤충뿐 아니라 포유동물과 같은 척추동물에서도 유사한 메커니즘이 존재할 수 있다는 가능성도 제시했다.
나아가 소금에 대한 섭취 욕구를 조절함으로써 이를 통해 소금 과다 섭취로 생기는 고혈압 등의 여러 질병에서 새로운 생리학적 측면에서의 접근 방식을 할 수 있을 것이라 여겨진다.
연구를 주도한 서성배 교수는 “이번 연구는 소금의 짠맛과는 독립적으로 장 신경세포를 통해 선호도가 결정된다는 것을 발견하였고, 나트륨 섭취의 생리적 조절에 대한 새로운 메커니즘을 제공하였다 소금에 대한 섭취욕은 모든 진화 생물에서 보이는 공통적인 특징으로 해당 연구를 통해서 소금에 대한 섭취 욕구를 조절하여 고혈압을 포함한 여러 질병에 생리학적으로 접근할 수 있는 가능성을 보여준 것이라 기대한다.”고 말했다.
생명과학과 김병수 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이쳐 메타볼리즘(Nature Metabolism)’ 4월 3일 자로 온라인판에 게재됐다. (논문명 : Postprandial sodium sensing by enteric neurons in Drosophila).
한편 이번 연구는 한국연구재단, 리더과제 (전 창의과제), 생명과학 프로젝트 지원을 받아 수행됐다.
2024.05.02 조회수 3877 -
 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 7244
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 7244 -
 비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 5164
비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 5164 -
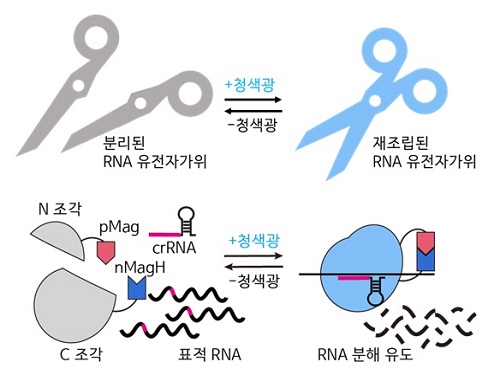 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 7158
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 7158 -
 기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 4856
기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 4856 -
 알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.08 조회수 5026
알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.08 조회수 5026 -
 DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.04 조회수 4611
DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.04 조회수 4611 -
 이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
2023.11.07 조회수 4395
이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
2023.11.07 조회수 4395 -
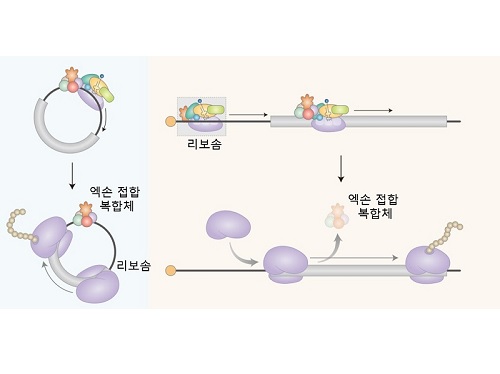 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 5509
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 5509 -
 비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 5665
비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 5665 -
 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 8289
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 8289 -
 탄수화물 나노입자로 염증성 장 질환 치료하다
위장관에 발병하는 만성적인 염증성 장 질환은 아직 뚜렷한 원인이 밝혀지지 않아 비스테로이드성 항염증제들과 주사용 항체 치료제들을 이용한 치료법이 일반적이지만 면역약화 등의 부작용들로 인해 치료에 어려움이 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 장 내 당질층을 모사한 탄수화물 나노입자에 생체 내에서 항산화 및 항염증 작용을 하는 빌리루빈을 결합해 ‘항염증 탄수화물 나노입자(Anti-inflammatory Glycocalyx-mimicking nanoparticles)‘ 수십 종을 합성하고 이를 염증성 장 질환 치료에 적용함으로써 탁월한 효능을 보이는 의약을 개발했다고 2일 밝혔다.
세포막은 다양한 형태의 당 사슬 집합체인 당질층(glycocalyx)으로 둘러싸여 있다. 염증성 장 질환이 있는 사람의 장 조직에서는 정상인들과 다른 당질층이 형성되어 있다. 이러한 당질층은 우리 몸이나 음식에 많이 존재하는 탄수화물을 이루는 구성 성분인 여러 가지 당들에 대해 선택적인 결합력을 보인다. 이에 착안해 연구팀은 자연에 존재하는 탄수화물을 구성하는 대표적인 다섯 가지의 당들을 조합해 수 십가지의 인공 탄수화물(glycopolymers) 후보군들을 합성하여 염증성 장 질환 조직에 형성된 당질층에 잘 결합하는 인공 탄수화물 후보군을 선별하고자 하였다. 합성된 수 십가지의 인공 탄수화물에 우리 몸속에서 항산화 및 항염증 작용을 하는 빌리루빈 생리활성 물질을 결합하여 최종적으로 당질층을 표적할 수 있는 ‘항염증 탄수화물 나노입자(anti-inflammatory glyconanoparticles)’후보군들을 구축하였다.
연구팀은 구축된 항염증 탄수화물 나노입자 후보군들을 염증성 장 질환 생쥐모델에서 직접 경구투여를 통해 치료효능이 가장 우수한 탄수화물 나노입자를 선별할 수 있었다. 선별된 항염증 탄수화물 나노입자가 어떻게 치료효능 및 작용기전을 나타냈는지도 조사하였고 치료 효능이 기존에 사용하던 저분자 합성의약보다 더 우수한 효능을 가질 수 있음을 확인했다.
우리 대학 생명과학과 유도현 박사 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 정상급 학술지인 `앙게반테 케미(Angewandte Chemie International Edition, ISSN: 1433-7851 print, 1521-3773 online, Impact Factor: 16.823)' 6월 13일 字 온라인판에 게재됐다.
(https://doi.org/10.1002/anie.202304815 논문명: Anti-inflammatory Glycocalyx-Mimicking Nanoparticles for Colitis Treatment: Construction and In Vivo Evaluation).
전상용 교수는 “본 연구를 통해 당질층 표적형 항염증 탄수화물 나노입자 플랫폼 기술은 염증성 장 질환 외에도 다양한 염증 질환들의 치료에 적용될 수 있을 것으로 기대한다” 라고 말했다.
이 논문은 해당 학술지에서 선정한 특별 언론홍보 대상으로 선정돼 해외 과학 전문 보도 매체인 ‘ScienceDaily’ 와 ‘ChemistryViews’ 등에도 소개된 바 있다.(ScienceDaily: https://www.sciencedaily.com, ChemistryViews: https://www.chemistryviews.org)
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2023.08.02 조회수 5883
탄수화물 나노입자로 염증성 장 질환 치료하다
위장관에 발병하는 만성적인 염증성 장 질환은 아직 뚜렷한 원인이 밝혀지지 않아 비스테로이드성 항염증제들과 주사용 항체 치료제들을 이용한 치료법이 일반적이지만 면역약화 등의 부작용들로 인해 치료에 어려움이 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 장 내 당질층을 모사한 탄수화물 나노입자에 생체 내에서 항산화 및 항염증 작용을 하는 빌리루빈을 결합해 ‘항염증 탄수화물 나노입자(Anti-inflammatory Glycocalyx-mimicking nanoparticles)‘ 수십 종을 합성하고 이를 염증성 장 질환 치료에 적용함으로써 탁월한 효능을 보이는 의약을 개발했다고 2일 밝혔다.
세포막은 다양한 형태의 당 사슬 집합체인 당질층(glycocalyx)으로 둘러싸여 있다. 염증성 장 질환이 있는 사람의 장 조직에서는 정상인들과 다른 당질층이 형성되어 있다. 이러한 당질층은 우리 몸이나 음식에 많이 존재하는 탄수화물을 이루는 구성 성분인 여러 가지 당들에 대해 선택적인 결합력을 보인다. 이에 착안해 연구팀은 자연에 존재하는 탄수화물을 구성하는 대표적인 다섯 가지의 당들을 조합해 수 십가지의 인공 탄수화물(glycopolymers) 후보군들을 합성하여 염증성 장 질환 조직에 형성된 당질층에 잘 결합하는 인공 탄수화물 후보군을 선별하고자 하였다. 합성된 수 십가지의 인공 탄수화물에 우리 몸속에서 항산화 및 항염증 작용을 하는 빌리루빈 생리활성 물질을 결합하여 최종적으로 당질층을 표적할 수 있는 ‘항염증 탄수화물 나노입자(anti-inflammatory glyconanoparticles)’후보군들을 구축하였다.
연구팀은 구축된 항염증 탄수화물 나노입자 후보군들을 염증성 장 질환 생쥐모델에서 직접 경구투여를 통해 치료효능이 가장 우수한 탄수화물 나노입자를 선별할 수 있었다. 선별된 항염증 탄수화물 나노입자가 어떻게 치료효능 및 작용기전을 나타냈는지도 조사하였고 치료 효능이 기존에 사용하던 저분자 합성의약보다 더 우수한 효능을 가질 수 있음을 확인했다.
우리 대학 생명과학과 유도현 박사 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 정상급 학술지인 `앙게반테 케미(Angewandte Chemie International Edition, ISSN: 1433-7851 print, 1521-3773 online, Impact Factor: 16.823)' 6월 13일 字 온라인판에 게재됐다.
(https://doi.org/10.1002/anie.202304815 논문명: Anti-inflammatory Glycocalyx-Mimicking Nanoparticles for Colitis Treatment: Construction and In Vivo Evaluation).
전상용 교수는 “본 연구를 통해 당질층 표적형 항염증 탄수화물 나노입자 플랫폼 기술은 염증성 장 질환 외에도 다양한 염증 질환들의 치료에 적용될 수 있을 것으로 기대한다” 라고 말했다.
이 논문은 해당 학술지에서 선정한 특별 언론홍보 대상으로 선정돼 해외 과학 전문 보도 매체인 ‘ScienceDaily’ 와 ‘ChemistryViews’ 등에도 소개된 바 있다.(ScienceDaily: https://www.sciencedaily.com, ChemistryViews: https://www.chemistryviews.org)
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2023.08.02 조회수 5883