%EB%8B%A8%EB%B0%B1%EC%A7%88
-
 알츠하이머병 유발하는 독성 단백질 발굴
알츠하이머병은 가장 대표적인 신경퇴행성 질환으로, 기억력 감퇴와 인지능력 저하를 유발한다. 알츠하이머병의 발병 인구가 급속히 증가하고 있으나, 현재까지 발병 원인이 명확히 밝혀진 바 없고, 이에 따라 효과적인 치료제 개발 또한 굉장히 더디게 진행되고 있다.
우리 대학 화학과 임미희 교수(금속신경단백질연구단 단장) 연구팀이 한국기초과학지원연구원 바이오융합연구부 이영호 박사 연구팀, 우리 대학 화학과 백무현 교수 연구팀, 의과학대학원 한진주 교수 연구팀과의 공동연구와 한국생명공학연구원 희귀난치질환연구센터 이다용 박사 연구팀과 공동연구를 통해 알츠하이머병 유발인자의 독성을 촉진하는 세포 내 단백질을 발굴함으로써, 알츠하이머병과 관련된 새로운 병리적 네트워크를 제시했다고 20일 밝혔다.
알츠하이머병 환자들의 뇌에서 대표적으로 나타나는 병리적 현상은 노인성 반점 축적이다. 노인성 반점의 주된 구성분은 아밀로이드-베타 펩타이드로인 응집체로 세포 내 물질들과 결합해 세포 손상을 유발한다. 따라서, 이들 응집체와 세포 사멸 간의 상관관계가 활발히 연구되고 있다. 그러나, 아밀로이드-베타와 세포 사멸 유발 인자들 간의 직접적인 상호작용에 관해서는 아직 많은 부분이 밝혀진 바 없다.
최근 미국 FDA에서 승인한 알츠하이머병 신약은 노인성 반점을 나타내는 아밀로이드-베타 펩타이드의 응집체의 세포 손상을 주요 타깃으로 하여 개발됐다. 하지만, 제한된 사용 여부(특히, 부작용)로 그 신약 개발의 방향 전환 및 개선이 필요함을 연구자들은 절실히 느끼고 있다.
임미희 교수 연구팀은 알츠하이머병에서 과발현되며 원인 미상의 신경세포 사멸을 유발하는 ‘아밀로이드 전구체 C 말단 절단체’ 단백질이 아밀로이드-베타 및 금속-아밀로이드-베타 복합체와 결합해 응집을 촉진하고 독성 촉진제 역할을 함을 세계 최초로 증명하는 연구 내용을 발표했다.
이번 연구 결과는 아밀로이드 전구체 C 말단 절단체 자체 또는 아밀로이드-베타과 결합한 복합체가 새로운 알츠하이머병의 새로운 바이오마커로 작용할 수 있고, 또한 그들이 새로운 신약개발 타깃이 될 수 있음을 제시하고 있다.
임미희 교수 연구팀의 남은주 박사(KAIST 화학과 박사 졸업, 現 브리검 여성 병원 및 하버드 의과대학 연구원)가 제1 저자로 참여한 이번 연구는 세포 내 단백질 미세주입 기술을 통해 세포 안에서 아밀로이드 전구체 C 말단 절단체가 아밀로이드-베타 응집 촉진에 미치는 역할을 연구팀은 확인했다. 더 나아가, 뉴런 세포 및 설치류의 뇌에서 아밀로이드-베타와 관련된 세포 사멸, 뉴런 손상, 염증반응이 아밀로이드 전구체 C 말단 절단체에 의해 더욱 증가하는 현상을 최초로 확인해 세계적으로 주목받고 있다.
임미희 교수는 “이번 연구 결과는 알츠하이머병에서 기존에 알려지지 않은 생체 내 아밀로이드-베타 응집 및 독성 촉진제 발굴에 큰 의의가 있다”고 말하며, “이 연구 성과는 새로운 바이오마커 및 치료타깃을 제안하고 있다”고 밝혔다.
이번 연구는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science, Impact factor: 15.1)'에 11월 10일 자 게재됐다. (논문명: APP-C31: An Intracellular Promoter of Both Metal-Free and Metal-Bound Amyloid-β40 Aggregation and Toxicity in Alzheimer’s Disease) Adv. Sci. 2023, 2307182 (https://doi.org/10.1002/advs.202307182)
이번 연구는 한국연구재단 기초연구사업(특히, 리더연구), KBSI, 국가과학기술연구회(NST), IBS 및 KAIST의 지원을 받아 진행됐다.
2023.11.20 조회수 7801
알츠하이머병 유발하는 독성 단백질 발굴
알츠하이머병은 가장 대표적인 신경퇴행성 질환으로, 기억력 감퇴와 인지능력 저하를 유발한다. 알츠하이머병의 발병 인구가 급속히 증가하고 있으나, 현재까지 발병 원인이 명확히 밝혀진 바 없고, 이에 따라 효과적인 치료제 개발 또한 굉장히 더디게 진행되고 있다.
우리 대학 화학과 임미희 교수(금속신경단백질연구단 단장) 연구팀이 한국기초과학지원연구원 바이오융합연구부 이영호 박사 연구팀, 우리 대학 화학과 백무현 교수 연구팀, 의과학대학원 한진주 교수 연구팀과의 공동연구와 한국생명공학연구원 희귀난치질환연구센터 이다용 박사 연구팀과 공동연구를 통해 알츠하이머병 유발인자의 독성을 촉진하는 세포 내 단백질을 발굴함으로써, 알츠하이머병과 관련된 새로운 병리적 네트워크를 제시했다고 20일 밝혔다.
알츠하이머병 환자들의 뇌에서 대표적으로 나타나는 병리적 현상은 노인성 반점 축적이다. 노인성 반점의 주된 구성분은 아밀로이드-베타 펩타이드로인 응집체로 세포 내 물질들과 결합해 세포 손상을 유발한다. 따라서, 이들 응집체와 세포 사멸 간의 상관관계가 활발히 연구되고 있다. 그러나, 아밀로이드-베타와 세포 사멸 유발 인자들 간의 직접적인 상호작용에 관해서는 아직 많은 부분이 밝혀진 바 없다.
최근 미국 FDA에서 승인한 알츠하이머병 신약은 노인성 반점을 나타내는 아밀로이드-베타 펩타이드의 응집체의 세포 손상을 주요 타깃으로 하여 개발됐다. 하지만, 제한된 사용 여부(특히, 부작용)로 그 신약 개발의 방향 전환 및 개선이 필요함을 연구자들은 절실히 느끼고 있다.
임미희 교수 연구팀은 알츠하이머병에서 과발현되며 원인 미상의 신경세포 사멸을 유발하는 ‘아밀로이드 전구체 C 말단 절단체’ 단백질이 아밀로이드-베타 및 금속-아밀로이드-베타 복합체와 결합해 응집을 촉진하고 독성 촉진제 역할을 함을 세계 최초로 증명하는 연구 내용을 발표했다.
이번 연구 결과는 아밀로이드 전구체 C 말단 절단체 자체 또는 아밀로이드-베타과 결합한 복합체가 새로운 알츠하이머병의 새로운 바이오마커로 작용할 수 있고, 또한 그들이 새로운 신약개발 타깃이 될 수 있음을 제시하고 있다.
임미희 교수 연구팀의 남은주 박사(KAIST 화학과 박사 졸업, 現 브리검 여성 병원 및 하버드 의과대학 연구원)가 제1 저자로 참여한 이번 연구는 세포 내 단백질 미세주입 기술을 통해 세포 안에서 아밀로이드 전구체 C 말단 절단체가 아밀로이드-베타 응집 촉진에 미치는 역할을 연구팀은 확인했다. 더 나아가, 뉴런 세포 및 설치류의 뇌에서 아밀로이드-베타와 관련된 세포 사멸, 뉴런 손상, 염증반응이 아밀로이드 전구체 C 말단 절단체에 의해 더욱 증가하는 현상을 최초로 확인해 세계적으로 주목받고 있다.
임미희 교수는 “이번 연구 결과는 알츠하이머병에서 기존에 알려지지 않은 생체 내 아밀로이드-베타 응집 및 독성 촉진제 발굴에 큰 의의가 있다”고 말하며, “이 연구 성과는 새로운 바이오마커 및 치료타깃을 제안하고 있다”고 밝혔다.
이번 연구는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science, Impact factor: 15.1)'에 11월 10일 자 게재됐다. (논문명: APP-C31: An Intracellular Promoter of Both Metal-Free and Metal-Bound Amyloid-β40 Aggregation and Toxicity in Alzheimer’s Disease) Adv. Sci. 2023, 2307182 (https://doi.org/10.1002/advs.202307182)
이번 연구는 한국연구재단 기초연구사업(특히, 리더연구), KBSI, 국가과학기술연구회(NST), IBS 및 KAIST의 지원을 받아 진행됐다.
2023.11.20 조회수 7801 -
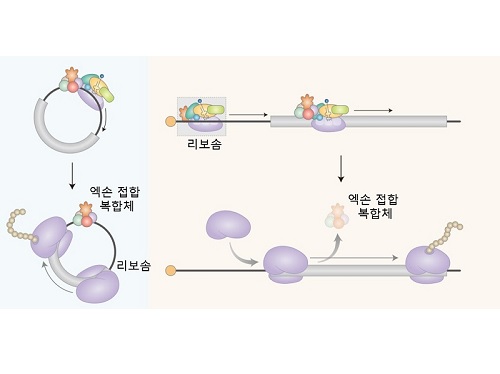 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 7603
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 7603 -
 비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 7896
비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 7896 -
 천식 등 만성질환 염증 조절 실마리 풀어
우리 몸에 침입한 병원균이나 암세포를 치료할 수 있는 면역세포인 T세포 중 CD4+ T세포는 적응면역계의 지휘관과 같은 역할을 하며, 이러한 CD4+ T세포의 활성 정도에 따라서 천식과 같은 만성질환의 진행 양상과 예후가 달라지게 된다. T세포의 활성화 증폭을 위해서는 마치 과녁 모양처럼 면역학적 시냅스 형성이 필요하다는 보고들이 있으나 어떠한 메커니즘으로 면역학적 시냅스가 형성이 되는지는 잘 알려져 있지 않았다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 면역학적 시냅스 형성에 섬모 형성 단백질(IFT20)과 엔도솜 형성 단백질(TSG101)의 결합이 중요한 역할을 한다고 26일 밝혔다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사), 강인 박사과정, 생명과학과 김유민 박사과정 등이 주도한 이번 연구에서 연구팀은 단일세포 전사체 분석법을 활용해 활성화된 CD4+ T세포에서 섬모 형성 단백질(IFT20)의 발현이 증가해 있음을 확인했다.
연구팀은 T세포에 국한되어 섬모 형성 단백질(IFT20)이 결핍된 마우스를 제작해 해당 마우스가 정상 마우스보다 천식 증상의 특징이 감소함을 확인했고, 이는 정상 CD4+ T세포와 비교했을 때 섬모 형성 단백질(IFT20) 결핍 CD4+ T세포가 면역학적 시냅스 형성을 감소시켜 T세포 증식, 해당작용 및 세포호흡이 감소하기 때문임을 확인했다.
또한, 연구팀은 섬모 형성 단백질(IFT20)에 결합하는 단백질을 찾기 위해 효모단백질잡종법과 면역침강법을 이용함으로써 섬모 형성 단백질(IFT20)이 엔도솜 형성단백질(TSG101)과 서로 결합한다는 것을 세계 최초로 규명했다.
이를 입증하기 위해 연구팀은 T세포에 국한되어 엔도솜 형성단백질(TSG101)이 결핍된 마우스를 제작해 엔도솜 형성단백질(TSG101)이 결핍된 CD4+ T세포가 정상 CD4+ T세포에 비해 면역학적 시냅스 형성이 감소함을 확인했다. 결과적으로 기존에 알려지지 않았던 면역학적 시냅스 형성에 기여하는 섬모형성 단백질(IFT20)과 엔도솜 형성단백질(TSG101)의 역할을 밝힘으로써 T세포 활성화를 조절할 수 있는 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 정지웅 박사는 "그동안 잘 알려지지 않은 면역학적 시냅스 형성을 조절하는 단백질을 확인하는 중요한 연구”라고 설명했다. 이흥규 교수는 “면역학적 시냅스 형성의 변화를 통해 천식의 염증 정도가 변화할 수 있음을 확인했고, 향후 면역학적 시냅스를 조절함으로써 천식을 비롯한 다양한 면역 질환 등에서 질환의 염증을 조절하는 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사)가 제1 저자로 참여한 이번 연구는 면역학 분야 국제 학술지 `세포 및 분자 면역학(Cellular & Molecular Immunology, JCR IF = 22.10)'에 4월 7일 字 온라인판에 게재됐다. (논문명: Regulation of c-SMAC formation and AKT-mTOR signaling by the TSG101-IFT20 axis in CD4+ T cells)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업 및 글로벌박사양성사업의 지원을 받아 수행됐다.
2023.04.26 조회수 8080
천식 등 만성질환 염증 조절 실마리 풀어
우리 몸에 침입한 병원균이나 암세포를 치료할 수 있는 면역세포인 T세포 중 CD4+ T세포는 적응면역계의 지휘관과 같은 역할을 하며, 이러한 CD4+ T세포의 활성 정도에 따라서 천식과 같은 만성질환의 진행 양상과 예후가 달라지게 된다. T세포의 활성화 증폭을 위해서는 마치 과녁 모양처럼 면역학적 시냅스 형성이 필요하다는 보고들이 있으나 어떠한 메커니즘으로 면역학적 시냅스가 형성이 되는지는 잘 알려져 있지 않았다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 면역학적 시냅스 형성에 섬모 형성 단백질(IFT20)과 엔도솜 형성 단백질(TSG101)의 결합이 중요한 역할을 한다고 26일 밝혔다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사), 강인 박사과정, 생명과학과 김유민 박사과정 등이 주도한 이번 연구에서 연구팀은 단일세포 전사체 분석법을 활용해 활성화된 CD4+ T세포에서 섬모 형성 단백질(IFT20)의 발현이 증가해 있음을 확인했다.
연구팀은 T세포에 국한되어 섬모 형성 단백질(IFT20)이 결핍된 마우스를 제작해 해당 마우스가 정상 마우스보다 천식 증상의 특징이 감소함을 확인했고, 이는 정상 CD4+ T세포와 비교했을 때 섬모 형성 단백질(IFT20) 결핍 CD4+ T세포가 면역학적 시냅스 형성을 감소시켜 T세포 증식, 해당작용 및 세포호흡이 감소하기 때문임을 확인했다.
또한, 연구팀은 섬모 형성 단백질(IFT20)에 결합하는 단백질을 찾기 위해 효모단백질잡종법과 면역침강법을 이용함으로써 섬모 형성 단백질(IFT20)이 엔도솜 형성단백질(TSG101)과 서로 결합한다는 것을 세계 최초로 규명했다.
이를 입증하기 위해 연구팀은 T세포에 국한되어 엔도솜 형성단백질(TSG101)이 결핍된 마우스를 제작해 엔도솜 형성단백질(TSG101)이 결핍된 CD4+ T세포가 정상 CD4+ T세포에 비해 면역학적 시냅스 형성이 감소함을 확인했다. 결과적으로 기존에 알려지지 않았던 면역학적 시냅스 형성에 기여하는 섬모형성 단백질(IFT20)과 엔도솜 형성단백질(TSG101)의 역할을 밝힘으로써 T세포 활성화를 조절할 수 있는 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 정지웅 박사는 "그동안 잘 알려지지 않은 면역학적 시냅스 형성을 조절하는 단백질을 확인하는 중요한 연구”라고 설명했다. 이흥규 교수는 “면역학적 시냅스 형성의 변화를 통해 천식의 염증 정도가 변화할 수 있음을 확인했고, 향후 면역학적 시냅스를 조절함으로써 천식을 비롯한 다양한 면역 질환 등에서 질환의 염증을 조절하는 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사)가 제1 저자로 참여한 이번 연구는 면역학 분야 국제 학술지 `세포 및 분자 면역학(Cellular & Molecular Immunology, JCR IF = 22.10)'에 4월 7일 字 온라인판에 게재됐다. (논문명: Regulation of c-SMAC formation and AKT-mTOR signaling by the TSG101-IFT20 axis in CD4+ T cells)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업 및 글로벌박사양성사업의 지원을 받아 수행됐다.
2023.04.26 조회수 8080 -
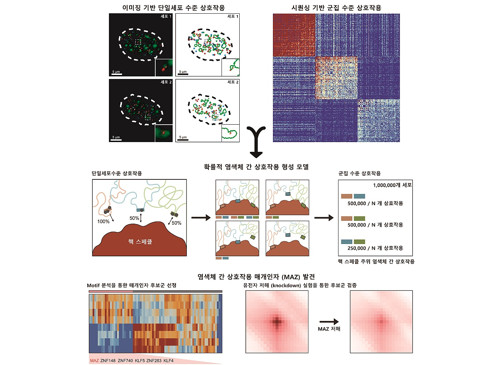 암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 8160
암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 8160 -
 KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 7915
KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 7915 -
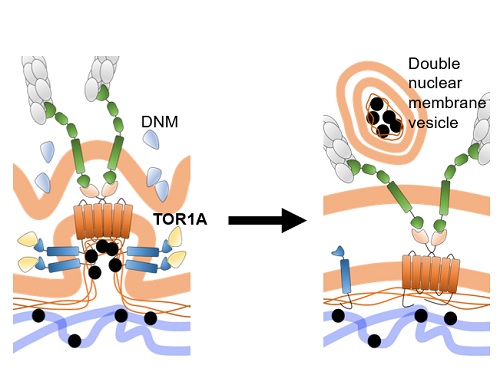 새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 10143
새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 10143 -
 획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
2023.02.01 조회수 9476
획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
2023.02.01 조회수 9476 -
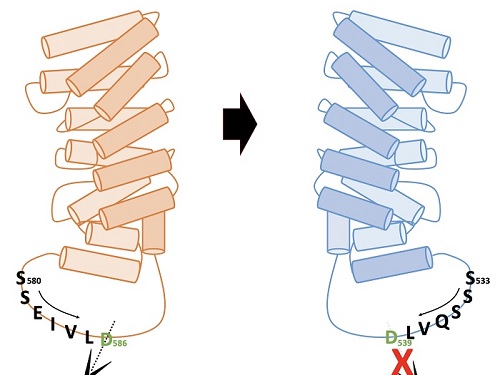 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 9179
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 9179 -
 심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
2022.08.22 조회수 10665
심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
2022.08.22 조회수 10665 -
 항체를 활용한 신개념 생체 형틀법 최초 개발
우리 대학 신소재공학과 장재범 교수 연구팀이 다세포 생물이 갖는 특정 단백질 구조체를 활용할 수 있는 새로운 개념의 생체 형틀법을 최초로 개발했다고 10일 밝혔다. 긴 시간 동안 특정 기능에 최적화된 생명체가 갖는 복잡하고 정교한 구조체를 형틀로 삼아 이를 모방한 무기물 구조체를 만드는 방법을 생체 형틀법 이라고 한다. 이는 에너지, 광학, 마이크로로봇 분야 등에 응용돼왔다.
장 교수 연구팀은 항원-항체 반응에 착안해 특정 단백질을 항체로 표적화한 뒤, 항체에 붙어 있는 1.4 나노미터(nm) 크기의 금 입자에서 다양한 금속 입자들을 성장시킴으로써 특정 단백질 구조체를 모방한 금속 구조체를 합성하는 데 성공했다. 개발된 생체 형틀법은 일반적인 항원-항체 반응과 금속 입자 성장법을 기반으로 하기 때문에 다양한 생명체에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
신소재공학과 송창우, 송대현 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 머티리얼즈(Advanced Materials)'에 7월 7일 字 온라인 출판됐다. (논문명 : Multiscale Functional Metal Architectures by Antibody-Guided Metallization of Specific Protein Assemblies in Ex Vivo Multicellular Organisms).
생명체가 갖는 특정 기능에 최적화된 다양한 구조체들은 복잡하고 계층적 구조를 기반으로 하여 인공적인 합성 방법을 통해 재현하기 어렵다. 따라서 이러한 생체 구조체를 형틀로 해 동일한 모양의 무기물 구조체를 합성하는 생체 형틀법이 개발돼왔으며, 합성된 생체 재료들은 촉매, 에너지 저장 및 생산, 센서 등 다양하게 활용돼왔다.
하지만 개발된 생체 형틀법 중 특정 단백질 구조체를 형틀로 사용한 경우는 적으며, 있다 하더라도 바이러스나 효모와 같은 단세포 생물의 특정 단백질 구조체를 형틀로 활용한 연구들 뿐이었다.
생명체의 특정 단백질 구조체를 활용하는 생체 형틀법은 원하는 생체 구조체만을 활용 가능하며 합성하고자 하는 생체 재료의 목적에 맞는 단백질을 선택해 사용할 수 있다는 장점이 있다.
연구팀은 기존의 생체 형틀법 한계를 해결을 위해 특정 단백질을 이미징할 때 활용하는 항원-항체 반응을 생체 형틀법에 적용했다.
연구팀이 사용한 항체는 1.4 나노미터(nm) 크기의 금 입자가 달려있고 이는 금속 입자 성장을 위한 종자(seed) 역할을 하게 되어 특정 단백질을 표적화한 항체로부터 다양한 금속 입자를 성장시킬 수 있다.
연구팀은 인간 세포 내부의 미세소관, 미토콘드리아, 핵, 세포막, 세포질에 존재하는 특정 단백질에서만 금 입자를 성장시키는 데 성공했으며, 세포 수준뿐만 아니라 조직 수준인 쥐의 뇌, 신장, 심장에서도 개발한 방법을 적용할 수 있다는 것을 보였다.
나아가 연구팀은 금 입자뿐만 아니라 은, 금-백금, 금-팔라듐 입자를 세포 내부 미세소관 구조체를 따라 합성함으로써 합성된 세포를 액상 반응의 촉매로 활용 가능하다는 것을 증명했다. 또한, 세포 표면에 철 입자를 성장시킨 후 자석으로 조절할 수 있음을 보여 향후 이러한 금속 입자가 성장된 세포들을 조절하거나 군집 행동을 구현하는 것이 가능함을 보였다.
연구팀이 개발한 신개념 생체 형틀법은 다세포 생물뿐만 아니라 항체 염색이 가능한 식물, 균류, 바이러스 등의 생명체에도 활용 가능해 다양한 생체 구조체를 모방한 생체 재료 합성에 이용될 것으로 기대된다.
제1 저자인 송창우 박사과정은 "이번 연구는 기존의 생체 형틀법으로 구현할 수 없었던 다세포 생물의 특정 구조체를 모방한 금속 구조체를 합성한 최초의 사례이며, 이를 통해 생체 형틀법을 활용할 수 있는 생체 구조체의 범위를 넓혔다ˮ 라며 "합성된 생체 재료는 이번 연구에서 보여준 촉매뿐만 아니라 전기화학 및 바이오센서에도 활용 가능할 것으로 예상된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 과학난제도전 융합연구개발사업, 우수신진연구사업, 뇌과학원천기술개발사업 등의 지원을 받아 수행됐다.
2022.08.10 조회수 10752
항체를 활용한 신개념 생체 형틀법 최초 개발
우리 대학 신소재공학과 장재범 교수 연구팀이 다세포 생물이 갖는 특정 단백질 구조체를 활용할 수 있는 새로운 개념의 생체 형틀법을 최초로 개발했다고 10일 밝혔다. 긴 시간 동안 특정 기능에 최적화된 생명체가 갖는 복잡하고 정교한 구조체를 형틀로 삼아 이를 모방한 무기물 구조체를 만드는 방법을 생체 형틀법 이라고 한다. 이는 에너지, 광학, 마이크로로봇 분야 등에 응용돼왔다.
장 교수 연구팀은 항원-항체 반응에 착안해 특정 단백질을 항체로 표적화한 뒤, 항체에 붙어 있는 1.4 나노미터(nm) 크기의 금 입자에서 다양한 금속 입자들을 성장시킴으로써 특정 단백질 구조체를 모방한 금속 구조체를 합성하는 데 성공했다. 개발된 생체 형틀법은 일반적인 항원-항체 반응과 금속 입자 성장법을 기반으로 하기 때문에 다양한 생명체에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
신소재공학과 송창우, 송대현 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 머티리얼즈(Advanced Materials)'에 7월 7일 字 온라인 출판됐다. (논문명 : Multiscale Functional Metal Architectures by Antibody-Guided Metallization of Specific Protein Assemblies in Ex Vivo Multicellular Organisms).
생명체가 갖는 특정 기능에 최적화된 다양한 구조체들은 복잡하고 계층적 구조를 기반으로 하여 인공적인 합성 방법을 통해 재현하기 어렵다. 따라서 이러한 생체 구조체를 형틀로 해 동일한 모양의 무기물 구조체를 합성하는 생체 형틀법이 개발돼왔으며, 합성된 생체 재료들은 촉매, 에너지 저장 및 생산, 센서 등 다양하게 활용돼왔다.
하지만 개발된 생체 형틀법 중 특정 단백질 구조체를 형틀로 사용한 경우는 적으며, 있다 하더라도 바이러스나 효모와 같은 단세포 생물의 특정 단백질 구조체를 형틀로 활용한 연구들 뿐이었다.
생명체의 특정 단백질 구조체를 활용하는 생체 형틀법은 원하는 생체 구조체만을 활용 가능하며 합성하고자 하는 생체 재료의 목적에 맞는 단백질을 선택해 사용할 수 있다는 장점이 있다.
연구팀은 기존의 생체 형틀법 한계를 해결을 위해 특정 단백질을 이미징할 때 활용하는 항원-항체 반응을 생체 형틀법에 적용했다.
연구팀이 사용한 항체는 1.4 나노미터(nm) 크기의 금 입자가 달려있고 이는 금속 입자 성장을 위한 종자(seed) 역할을 하게 되어 특정 단백질을 표적화한 항체로부터 다양한 금속 입자를 성장시킬 수 있다.
연구팀은 인간 세포 내부의 미세소관, 미토콘드리아, 핵, 세포막, 세포질에 존재하는 특정 단백질에서만 금 입자를 성장시키는 데 성공했으며, 세포 수준뿐만 아니라 조직 수준인 쥐의 뇌, 신장, 심장에서도 개발한 방법을 적용할 수 있다는 것을 보였다.
나아가 연구팀은 금 입자뿐만 아니라 은, 금-백금, 금-팔라듐 입자를 세포 내부 미세소관 구조체를 따라 합성함으로써 합성된 세포를 액상 반응의 촉매로 활용 가능하다는 것을 증명했다. 또한, 세포 표면에 철 입자를 성장시킨 후 자석으로 조절할 수 있음을 보여 향후 이러한 금속 입자가 성장된 세포들을 조절하거나 군집 행동을 구현하는 것이 가능함을 보였다.
연구팀이 개발한 신개념 생체 형틀법은 다세포 생물뿐만 아니라 항체 염색이 가능한 식물, 균류, 바이러스 등의 생명체에도 활용 가능해 다양한 생체 구조체를 모방한 생체 재료 합성에 이용될 것으로 기대된다.
제1 저자인 송창우 박사과정은 "이번 연구는 기존의 생체 형틀법으로 구현할 수 없었던 다세포 생물의 특정 구조체를 모방한 금속 구조체를 합성한 최초의 사례이며, 이를 통해 생체 형틀법을 활용할 수 있는 생체 구조체의 범위를 넓혔다ˮ 라며 "합성된 생체 재료는 이번 연구에서 보여준 촉매뿐만 아니라 전기화학 및 바이오센서에도 활용 가능할 것으로 예상된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 과학난제도전 융합연구개발사업, 우수신진연구사업, 뇌과학원천기술개발사업 등의 지원을 받아 수행됐다.
2022.08.10 조회수 10752 -
 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 13239
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 13239