-
 세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28
조회수 53166
-
 조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09
조회수 20858
-
 정인경 교수, 인체 조직의 3차원 게놈지도 해독
〈 정인경 교수, 이정운 박사과정 〉
우리 대학 생명과학과 정인경 교수와 美 루드윅 암 연구소(Ludwig Institute of Cancer Research) 빙 렌 (Bing Ren) 교수 공동 연구팀이 인체 조직의 3차원 게놈 지도를 해독하는 데 성공했다.
연구팀은 인체의 27개 부위 조직의 3차원 게놈 지도를 분석해 치매, 심혈관계 질환 등을 포함한 2만 7천여 개 이상의 복합 질환 관련 유전 변이 기능을 예측했다.
정인경 교수, 빙 렌 교수가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 제네틱스(Nature Genetics) 9월 10일 자 온라인판에 게재됐다. (논문명 : A compendium of promoter-centered long-range chromatin interactions in the human genome)
현재까지 수많은 연구를 통해 알츠하이머병, 파킨슨병, 자가면역질환 등 다양한 복합 질환의 원인을 규명하려는 시도가 이뤄지면서 실제 다수의 질환과 관련한 중요 유전변이가 발견됐다.
하지만 이들 대부분의 유전변이는 DNA가 단백질을 생성하지 않는 비전사 지역에 존재하기 때문에 1차원적 DNA 서열 분석에 기반한 유전체 연구로는 모든 기능을 규명하는 데 한계가 있다.
이에 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비전사 지역에 존재하는 유전변이도 3차원 게놈 구조에 의해 형성되는 염색질 고리 구조(chromatin loop)를 통해 멀리 떨어진 유전자를 조절할 수 있다는 모델을 제시했다.
그러나 이러한 3차원 게놈 구조 연구는 몇 가지 세포주를 대상으로만 국한돼 있고, 질환과 직접 연관이 있는 각 인체 조직을 표적으로 한 게놈 3차 구조는 규명되지 않았다.
연구팀은 인체 내의 27개 조직을 대상으로 이들 게놈의 3차원 구조를 규명하기 위해 전사촉진 부위만 선택적으로 분석하는 ‘표적 염색질 3차 구조 포착법(promoter-capture Hi-C)’이라 불리는 신규 실험 기법을 활용해 고해상도의 3차원 게놈 참조 지도를 작성했다.
그 결과 인간 게놈에 존재하는 약 90만 개의 게놈 3차원 염색질 고리 구조를 발굴하고, 이들 중 상당수가 각 인체 조직 특이적으로 존재한다는 사실도 규명했다.
연구팀은 3차원 게놈 구조를 기반으로 지금까지 기능이 명확하게 정의되지 않은 2만 7천여 개 이상의 질환 연관 유전 변이의 표적 유전자를 정의해 이들 변이의 기능을 예측했다. 나아가 각 질환의 표적 유전자 유사도에 기반해 질환과 질환 사이의 신규 관계를 규명했고, 이를 바탕으로 여러 질환에 공통으로 관여하는 신규 분자 기전을 제시했다.
정 교수는 “복합 질환 기전 규명을 위해 비전사 게놈의 중요성을 강조하고 존재하는 다수의 중요 유전변이를 3차원 게놈 구조 해독을 통해 규명 가능함을 보였다”라며 “이번 결과는 퇴행성 뇌 질환을 포함 다양한 복합 질환의 신규 기전 규명 및 표적 발굴에 활용될 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업, 보건복지부 질환극복기술개발사업, 서경배 과학재단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 3차원 게놈 구조 모식도 (modified from Stefano et al., 2016)
정인경 교수, 인체 조직의 3차원 게놈지도 해독
〈 정인경 교수, 이정운 박사과정 〉
우리 대학 생명과학과 정인경 교수와 美 루드윅 암 연구소(Ludwig Institute of Cancer Research) 빙 렌 (Bing Ren) 교수 공동 연구팀이 인체 조직의 3차원 게놈 지도를 해독하는 데 성공했다.
연구팀은 인체의 27개 부위 조직의 3차원 게놈 지도를 분석해 치매, 심혈관계 질환 등을 포함한 2만 7천여 개 이상의 복합 질환 관련 유전 변이 기능을 예측했다.
정인경 교수, 빙 렌 교수가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 제네틱스(Nature Genetics) 9월 10일 자 온라인판에 게재됐다. (논문명 : A compendium of promoter-centered long-range chromatin interactions in the human genome)
현재까지 수많은 연구를 통해 알츠하이머병, 파킨슨병, 자가면역질환 등 다양한 복합 질환의 원인을 규명하려는 시도가 이뤄지면서 실제 다수의 질환과 관련한 중요 유전변이가 발견됐다.
하지만 이들 대부분의 유전변이는 DNA가 단백질을 생성하지 않는 비전사 지역에 존재하기 때문에 1차원적 DNA 서열 분석에 기반한 유전체 연구로는 모든 기능을 규명하는 데 한계가 있다.
이에 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비전사 지역에 존재하는 유전변이도 3차원 게놈 구조에 의해 형성되는 염색질 고리 구조(chromatin loop)를 통해 멀리 떨어진 유전자를 조절할 수 있다는 모델을 제시했다.
그러나 이러한 3차원 게놈 구조 연구는 몇 가지 세포주를 대상으로만 국한돼 있고, 질환과 직접 연관이 있는 각 인체 조직을 표적으로 한 게놈 3차 구조는 규명되지 않았다.
연구팀은 인체 내의 27개 조직을 대상으로 이들 게놈의 3차원 구조를 규명하기 위해 전사촉진 부위만 선택적으로 분석하는 ‘표적 염색질 3차 구조 포착법(promoter-capture Hi-C)’이라 불리는 신규 실험 기법을 활용해 고해상도의 3차원 게놈 참조 지도를 작성했다.
그 결과 인간 게놈에 존재하는 약 90만 개의 게놈 3차원 염색질 고리 구조를 발굴하고, 이들 중 상당수가 각 인체 조직 특이적으로 존재한다는 사실도 규명했다.
연구팀은 3차원 게놈 구조를 기반으로 지금까지 기능이 명확하게 정의되지 않은 2만 7천여 개 이상의 질환 연관 유전 변이의 표적 유전자를 정의해 이들 변이의 기능을 예측했다. 나아가 각 질환의 표적 유전자 유사도에 기반해 질환과 질환 사이의 신규 관계를 규명했고, 이를 바탕으로 여러 질환에 공통으로 관여하는 신규 분자 기전을 제시했다.
정 교수는 “복합 질환 기전 규명을 위해 비전사 게놈의 중요성을 강조하고 존재하는 다수의 중요 유전변이를 3차원 게놈 구조 해독을 통해 규명 가능함을 보였다”라며 “이번 결과는 퇴행성 뇌 질환을 포함 다양한 복합 질환의 신규 기전 규명 및 표적 발굴에 활용될 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업, 보건복지부 질환극복기술개발사업, 서경배 과학재단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 3차원 게놈 구조 모식도 (modified from Stefano et al., 2016)
2019.09.24
조회수 12678
-
 심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13
조회수 16931
-
 박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17
조회수 19701
-
 주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
2019.06.03
조회수 25696
-
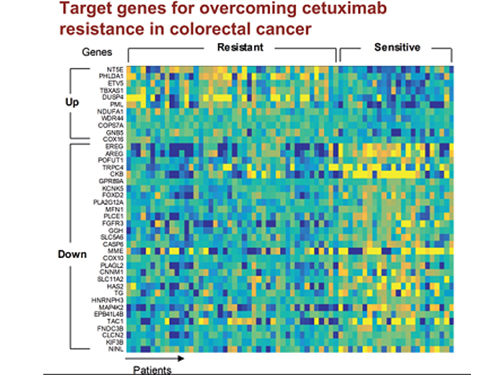 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07
조회수 25032
-
 고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18
조회수 13846
-
 이정호 교수, 박상민 연구원, 후천적 뇌 돌연변이로 인한 뇌발달 장애 원인 규명
〈 박 상 민 연구원 〉
우리 대학 의과학대학원 이정호 교수 연구팀이 후천적인 뇌 돌연변이로 인한 뇌전증(간질) 및 자폐증 환자에게 나타나는 신경 세포 이동 장애 증상이 발생하는 원리를 규명했다.
연구팀의 이번 연구 결과는 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 치료에 기여할 수 있을 것으로 기대된다.
박상민 석박사통합과정이 1저자로 참여한 이번 연구 결과는 신경생물학 분야 국제 학술지 ‘뉴런(Neuron)’ 6월 21자에 게재됐다. (논문명: ‘Brain somatic mutations in MTOR disrupt neuronal ciliogenesis, leading to focal cortical lamination’)
이정호 교수 연구팀은 후천적인 뇌 돌연변이가 뇌전증과 자폐증을 유발할 수 있고, 이 돌연변이로 인해 신경 세포 이동 장애 증상이 발생한다는 사실을 이전 연구에서 증명한 바 있다.
그러나 이 신경 세포의 이동 장애가 발생하는 근본적인 원리에 대해서는 완벽하게 밝혀내지 못했다.
연구팀은 난치성 뇌전증 및 자폐증과 밀접하게 연관된 대뇌 피질 발달장애 환자의 뇌 조직에서 엠토르(mTOR) 유전자의 후천적인 뇌 돌연변이가 발생함을 확인했다. 이를 반영한 동물 및 세포 모델을 이용해 대뇌 피질 발달 이상의 원리를 연구했다.
그 결과 엠토르(mTOR) 돌연변이를 가진 신경 세포에서 세포 소기관인 일차 섬모의 생성 기능이 망가져 있음을 확인했고 이것이 환자에게서 발견되는 신경 세포 이동 장애의 원리임을 밝혔다.
엠토르(mTOR) 유전자가 OFD1이라는 단백질을 적절하게 제거하는 역할을 수행해야 하지만 엠토르(mTOR)에 돌연변이가 발생함으로써 OFD1 단백질이 과하게 축적됐고 그것이 신경 세포 이동의 장애 현상으로 이어진 것이다.
연구팀은 돌연변이를 가진 신경 세포에서 과하게 축적돼 일차 섬모 생성을 방해하는 역할인 OFD1 단백질의 발현을 억제시킴으로써 일차 섬모의 생성을 회복시켰다. 이를 통해 신경 세포의 이동을 정상 수준으로 되돌렸다.
1저자인 박상민 석박사통합과정은 “후천적 뇌 돌연 변이로 인한 뇌 발달 장애 환자에서 관찰되는 대표적 증상인 신경 세포 이동 결함이 그동안 주목받지 않았던 일차 섬모라는 세포소기관의 생성으로 설명할 수 있다는 점을 발견했다”고 말했다.
연구팀은 이번 연구 결과를 바탕으로 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 새로운 치료제 개발을 위한 후속 연구를 진행 중이다.
이번 연구는 서경배 과학재단, 보건복지부 세계선도 의생명과학자 육성 사업, 질병중심 중개 중점 연구 사업을 통해 수행됐다.
□ 그림 설명
그림1. 후천적 뇌 돌연 변이의 대뇌 피질 발달 장애 환자의 뇌 조직, 동물 모델에서 망가진 일차섬모 생성
그림2. 일차섬모 생성을 회복시킨 대뇌 피질 발달 장애 모델에서 신경 세포의 이동이 정상 수준으로 돌아옴
이정호 교수, 박상민 연구원, 후천적 뇌 돌연변이로 인한 뇌발달 장애 원인 규명
〈 박 상 민 연구원 〉
우리 대학 의과학대학원 이정호 교수 연구팀이 후천적인 뇌 돌연변이로 인한 뇌전증(간질) 및 자폐증 환자에게 나타나는 신경 세포 이동 장애 증상이 발생하는 원리를 규명했다.
연구팀의 이번 연구 결과는 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 치료에 기여할 수 있을 것으로 기대된다.
박상민 석박사통합과정이 1저자로 참여한 이번 연구 결과는 신경생물학 분야 국제 학술지 ‘뉴런(Neuron)’ 6월 21자에 게재됐다. (논문명: ‘Brain somatic mutations in MTOR disrupt neuronal ciliogenesis, leading to focal cortical lamination’)
이정호 교수 연구팀은 후천적인 뇌 돌연변이가 뇌전증과 자폐증을 유발할 수 있고, 이 돌연변이로 인해 신경 세포 이동 장애 증상이 발생한다는 사실을 이전 연구에서 증명한 바 있다.
그러나 이 신경 세포의 이동 장애가 발생하는 근본적인 원리에 대해서는 완벽하게 밝혀내지 못했다.
연구팀은 난치성 뇌전증 및 자폐증과 밀접하게 연관된 대뇌 피질 발달장애 환자의 뇌 조직에서 엠토르(mTOR) 유전자의 후천적인 뇌 돌연변이가 발생함을 확인했다. 이를 반영한 동물 및 세포 모델을 이용해 대뇌 피질 발달 이상의 원리를 연구했다.
그 결과 엠토르(mTOR) 돌연변이를 가진 신경 세포에서 세포 소기관인 일차 섬모의 생성 기능이 망가져 있음을 확인했고 이것이 환자에게서 발견되는 신경 세포 이동 장애의 원리임을 밝혔다.
엠토르(mTOR) 유전자가 OFD1이라는 단백질을 적절하게 제거하는 역할을 수행해야 하지만 엠토르(mTOR)에 돌연변이가 발생함으로써 OFD1 단백질이 과하게 축적됐고 그것이 신경 세포 이동의 장애 현상으로 이어진 것이다.
연구팀은 돌연변이를 가진 신경 세포에서 과하게 축적돼 일차 섬모 생성을 방해하는 역할인 OFD1 단백질의 발현을 억제시킴으로써 일차 섬모의 생성을 회복시켰다. 이를 통해 신경 세포의 이동을 정상 수준으로 되돌렸다.
1저자인 박상민 석박사통합과정은 “후천적 뇌 돌연 변이로 인한 뇌 발달 장애 환자에서 관찰되는 대표적 증상인 신경 세포 이동 결함이 그동안 주목받지 않았던 일차 섬모라는 세포소기관의 생성으로 설명할 수 있다는 점을 발견했다”고 말했다.
연구팀은 이번 연구 결과를 바탕으로 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 새로운 치료제 개발을 위한 후속 연구를 진행 중이다.
이번 연구는 서경배 과학재단, 보건복지부 세계선도 의생명과학자 육성 사업, 질병중심 중개 중점 연구 사업을 통해 수행됐다.
□ 그림 설명
그림1. 후천적 뇌 돌연 변이의 대뇌 피질 발달 장애 환자의 뇌 조직, 동물 모델에서 망가진 일차섬모 생성
그림2. 일차섬모 생성을 회복시킨 대뇌 피질 발달 장애 모델에서 신경 세포의 이동이 정상 수준으로 돌아옴
2018.06.25
조회수 12414
-
 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07
조회수 25179
-
 조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07
조회수 25626
-
 대장조직의 숨겨진 암발생 억제 메커니즘 규명
KAIST 연구진이 대장조직에 숨겨진 암발생 억제 메커니즘을 규명해냈다. 대장조직에 내재된 방어 메커니즘이 밝혀짐에 따라 대장암 발병에 대한 이해를 돕는 계기가 될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 송제훈 박사과정 연구원(제1저자)이 참여하였으며, 영국 암연구소 오웬 삼손 박사와 데이비드 휴웰, 레이첼 리지웨이, 아일랜드 연구소 보리스 콜로덴코, 월터 콜치 박사가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었고 연구결과는 셀(Cell) 자매지 셀 리포트(Cell Reports)지 온라인판 3월 28일자에 게재되었다.
* 논문명 : The APC network regulates the removal of mutated cells from colonic crypts
생명체는 손상된 조직을 스스로 복구할 수 있지만 복구를 위한 세포분열 과정에서 암을 일으킬 수 있는 유전자 변이가 생길 수 있다. 이는 빠른 세포분열 속도와 소화과정에서의 독성물질 때문에 유전자 변이 확률이 높은 대장의 장샘*에서 특히 문제가 된다.
* 장샘(crypt) : 대장 표면을 형성하는 약 2000여개의 세포로 구성된 동굴모양의 상피 연구팀은 유전자 변이로 발암 가능성이 높아진 세포를 대장의 장샘에서 빨리 내보내는 방식으로 대장조직이 빠르고 빈번한 조직재생과정에서 암 발생을 억제한다는 것을 알아냈다. 변이된 세포의 장샘 체류시간을 줄여 비정상적 세포분열을 억제하는 방어 메커니즘이 대장에 내재되어 있다는 것이다.
수학모델을 만들고 이에 대한 방대한 컴퓨터 시뮬레이션 분석을 수행한 결과 유전자 변이에 의해 윈트신호전달*이 강화된 변이세포는 정상세포에 비해 접착력이 높아지면서 장샘의 위쪽으로 더욱 빠르게 이동, 장샘을 벗어나 장내로 배출되기 쉬운 것으로 나타났다.
* 윈트 신호전달(Wnt Signaling) : 세포의 증식과 분화에 관여하는 신호전달 경로로 배아발달이나 성체조직의 항상성 관리에 특히 중요하다. 세포 외부에서 윈트 신호가 들어오면 베타 카테닌을 분해시켜 농도를 낮게 유지해 주는 분해복합체가 억제되면서 세포증식을 돕는 표적 유전자들이 발현되어 세포증식이 일어나게 된다.
유전자 변이로 윈트 신호전달회로의 핵심인자인 베타 카테닌이 분해되지 못하면 축적된 베타 카테닌이 세포증식을 활성화시키는 한편세포 접착력을 높이게 되는데, 장샘 조직의 특수한 환경과 비슷한 접착력을 가진 세포들이 모이려는 성질로 인해 결국 변이된 세포를 배출시켜 조직의 항상성을 유지한다는 것이다.
실제 생쥐모델에서도 비정상적인 장샘 조직의 경우 증식이 활발한 세포가 오히려 느리게 이동하는 것으로 나타나 이같은 시뮬레이션 결과를 확인할 수 있었다.
조 교수는 “본 연구는 컴퓨터 시뮬레이션으로 다세포 생명체가 비정상적 세포 변이에도 불구하고 조직의 항상성을 유지하도록 정교하게 설계되어 있음을 규명한 것으로 IT와 BT의 융합연구인 시스템생물학 연구를 통해 복잡한 생명현상의 숨겨진 원리를 파악할 수 있음을 보인 것” 이라고 밝혔다.
이 연구를 통해 대장의 장샘조직이 조직 내 암의 진화를 애초에 억제할 수 있는 메커니즘을 내재하고 있다는 놀라운 사실을 밝힘으로써 대장암 발생에 대한 이해를 한 단계 높이게 되었다. 또한 이번 연구결과는 대장암을 치료하기 위한 신약개발의 개발 방향에 대한 새로운 통찰을 제시하였다
주요그림 1 설명.
연구개요 모식도: 세포의 자가복구는 다세포생명체가 손상된 조직을 재생하기 위한 필수적인 과정이지만동시에 암을 일으킬 수 있는 체세포 변이의 위험성을 수반한다. 그렇다면 어떻게 이런 딜레마가 생체조직 내에서 해결될 수 있는 것인가?
이 문제는 재생속도가 빠르고 다양한 변이인자에 노출이 많은 대장조직에서 특히 중요하다. 연구팀은 대장 장샘의 세포증식과 이동에 관한 수학모델의 대규모 컴퓨터시뮬레이션과 생물학 시험을 결합한 시스템생물학(Systems Biology) 연구를 통해 그 분자적 메커니즘을 최초로 규명하였다. 장샘 조직 상단으로 이동하는 단일세포의 동역학 특성을 분석함으로써 암의 발생을 방지하는 장샘의 숨겨진 메커니즘을 밝힌 것이다. 그림은 실험용 생쥐에서 추출한 대장조직의 현미경 사진 위에 규명한 메커니즘을 그림으로 도식화 한 것이다.
주요그림 2 설명. 컴퓨터시뮬레이션 결과와 동물모델 실험을 통한 검증: (A) 야생형 장샘(첫째 행) 및 에이피시 유전자 변이된 장샘(둘째 행), 베타카테닌 유전자 변이된 장샘(셋째 행)에서, 이질적 세포군집에 의한 세포 재배치의 효과를 조사하는 컴퓨터 시뮬레이션이 수행되었다. 여기서 이질성은 균등하게 취해진 100개의 표본세포(첫째와 둘째 열)에 대해서 가해진 랜덤 노이즈를 노이즈가 없는 기준 분자 프로파일(파랑 파선)에 추가함으로써 모사된다. 표본세포들의 초기위치들은 세포 재배치에 의해서 최종위치로 변경된다. 이러한 세포재배치가 가져오는 윈트신호전달 및 세포접착의 분포(셋째와 네째 열)가 변화되는 양상이 조사되었다. 빨강 점 및 초록 점들은 기준 분자 프로파일에 대한 양과 음의 편차를 각각 가리키고, 빨강 및 초록 화살표들은 빨강과 초록 점들의 이동 방향을 각각 가리킨다. (B,C) 동형 에이피시 유전자 변이와 동형 및 이형 베타카테닌 변이들을 가지도록 유전자 조작된 생체모델(실험용 마우스)을 사용하였다(B,C). APCfl/fl(동형) 및 β-cateninexon3/+(이형), β-cateninexon3/exon3(동형) 유전자변이 실험용 마우스 (B, 첫째 행)의 대장 조직에 대해서, BrDU주입 후 2시간 이후에 BrDU 양성으로 마크된 세포들은 장샘의 증식영역(주로 아랫부분)에 한정된다. BrDU 주입 후 48시간 이후 장샘의 BrDU양성 세포들은 장샘의 윗쪽 방향으로 이동하였음을 가리킨다(B, 둘째 열). 에이피시 유전자 변이의 경우에는 동형 변이를 가진 생체모델이 사용되었다 (C, 둘째 열). 베타카테닌 변이의 경우에는 이형 변이(C, 셋째 열) 및 동형 변이(C, 넷째 열)를 가진 생체모델이 사용되었다. 본 연구팀은 BrDU 주입 후 2시간 및 48시간 후 BrDU가 마크된 세포들을 관측하였다. BrDU가 주입 후 2시간 이전에 DNA내에 포함되어지기 때문에 2시간에서의 BrDU마크는 증식영역의 위치를 가리킨다. BrDU 주입 후 48시간에서 장샘 내 세포의 이동과 증식이 관찰되었다. 본 연구팀은 증식성 세포들의 위치와 개수를 정량화하였고(C, 좌측) BrDU 표식 된 세포군집의 이동을 측정하기 위하여 누적빈도를 계산하였다(C, 우측). (C)의 화살표는 BrDU 표식된 세포군집의 이동거리를 가리킨다. 표본 마우스마다 50개의 ½장샘이 기록되었는데, 여기서 유전자 형마다 적어도 3개의 다른 실험용 마우스가 사용되었다.
대장조직의 숨겨진 암발생 억제 메커니즘 규명
KAIST 연구진이 대장조직에 숨겨진 암발생 억제 메커니즘을 규명해냈다. 대장조직에 내재된 방어 메커니즘이 밝혀짐에 따라 대장암 발병에 대한 이해를 돕는 계기가 될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 송제훈 박사과정 연구원(제1저자)이 참여하였으며, 영국 암연구소 오웬 삼손 박사와 데이비드 휴웰, 레이첼 리지웨이, 아일랜드 연구소 보리스 콜로덴코, 월터 콜치 박사가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었고 연구결과는 셀(Cell) 자매지 셀 리포트(Cell Reports)지 온라인판 3월 28일자에 게재되었다.
* 논문명 : The APC network regulates the removal of mutated cells from colonic crypts
생명체는 손상된 조직을 스스로 복구할 수 있지만 복구를 위한 세포분열 과정에서 암을 일으킬 수 있는 유전자 변이가 생길 수 있다. 이는 빠른 세포분열 속도와 소화과정에서의 독성물질 때문에 유전자 변이 확률이 높은 대장의 장샘*에서 특히 문제가 된다.
* 장샘(crypt) : 대장 표면을 형성하는 약 2000여개의 세포로 구성된 동굴모양의 상피 연구팀은 유전자 변이로 발암 가능성이 높아진 세포를 대장의 장샘에서 빨리 내보내는 방식으로 대장조직이 빠르고 빈번한 조직재생과정에서 암 발생을 억제한다는 것을 알아냈다. 변이된 세포의 장샘 체류시간을 줄여 비정상적 세포분열을 억제하는 방어 메커니즘이 대장에 내재되어 있다는 것이다.
수학모델을 만들고 이에 대한 방대한 컴퓨터 시뮬레이션 분석을 수행한 결과 유전자 변이에 의해 윈트신호전달*이 강화된 변이세포는 정상세포에 비해 접착력이 높아지면서 장샘의 위쪽으로 더욱 빠르게 이동, 장샘을 벗어나 장내로 배출되기 쉬운 것으로 나타났다.
* 윈트 신호전달(Wnt Signaling) : 세포의 증식과 분화에 관여하는 신호전달 경로로 배아발달이나 성체조직의 항상성 관리에 특히 중요하다. 세포 외부에서 윈트 신호가 들어오면 베타 카테닌을 분해시켜 농도를 낮게 유지해 주는 분해복합체가 억제되면서 세포증식을 돕는 표적 유전자들이 발현되어 세포증식이 일어나게 된다.
유전자 변이로 윈트 신호전달회로의 핵심인자인 베타 카테닌이 분해되지 못하면 축적된 베타 카테닌이 세포증식을 활성화시키는 한편세포 접착력을 높이게 되는데, 장샘 조직의 특수한 환경과 비슷한 접착력을 가진 세포들이 모이려는 성질로 인해 결국 변이된 세포를 배출시켜 조직의 항상성을 유지한다는 것이다.
실제 생쥐모델에서도 비정상적인 장샘 조직의 경우 증식이 활발한 세포가 오히려 느리게 이동하는 것으로 나타나 이같은 시뮬레이션 결과를 확인할 수 있었다.
조 교수는 “본 연구는 컴퓨터 시뮬레이션으로 다세포 생명체가 비정상적 세포 변이에도 불구하고 조직의 항상성을 유지하도록 정교하게 설계되어 있음을 규명한 것으로 IT와 BT의 융합연구인 시스템생물학 연구를 통해 복잡한 생명현상의 숨겨진 원리를 파악할 수 있음을 보인 것” 이라고 밝혔다.
이 연구를 통해 대장의 장샘조직이 조직 내 암의 진화를 애초에 억제할 수 있는 메커니즘을 내재하고 있다는 놀라운 사실을 밝힘으로써 대장암 발생에 대한 이해를 한 단계 높이게 되었다. 또한 이번 연구결과는 대장암을 치료하기 위한 신약개발의 개발 방향에 대한 새로운 통찰을 제시하였다
주요그림 1 설명.
연구개요 모식도: 세포의 자가복구는 다세포생명체가 손상된 조직을 재생하기 위한 필수적인 과정이지만동시에 암을 일으킬 수 있는 체세포 변이의 위험성을 수반한다. 그렇다면 어떻게 이런 딜레마가 생체조직 내에서 해결될 수 있는 것인가?
이 문제는 재생속도가 빠르고 다양한 변이인자에 노출이 많은 대장조직에서 특히 중요하다. 연구팀은 대장 장샘의 세포증식과 이동에 관한 수학모델의 대규모 컴퓨터시뮬레이션과 생물학 시험을 결합한 시스템생물학(Systems Biology) 연구를 통해 그 분자적 메커니즘을 최초로 규명하였다. 장샘 조직 상단으로 이동하는 단일세포의 동역학 특성을 분석함으로써 암의 발생을 방지하는 장샘의 숨겨진 메커니즘을 밝힌 것이다. 그림은 실험용 생쥐에서 추출한 대장조직의 현미경 사진 위에 규명한 메커니즘을 그림으로 도식화 한 것이다.
주요그림 2 설명. 컴퓨터시뮬레이션 결과와 동물모델 실험을 통한 검증: (A) 야생형 장샘(첫째 행) 및 에이피시 유전자 변이된 장샘(둘째 행), 베타카테닌 유전자 변이된 장샘(셋째 행)에서, 이질적 세포군집에 의한 세포 재배치의 효과를 조사하는 컴퓨터 시뮬레이션이 수행되었다. 여기서 이질성은 균등하게 취해진 100개의 표본세포(첫째와 둘째 열)에 대해서 가해진 랜덤 노이즈를 노이즈가 없는 기준 분자 프로파일(파랑 파선)에 추가함으로써 모사된다. 표본세포들의 초기위치들은 세포 재배치에 의해서 최종위치로 변경된다. 이러한 세포재배치가 가져오는 윈트신호전달 및 세포접착의 분포(셋째와 네째 열)가 변화되는 양상이 조사되었다. 빨강 점 및 초록 점들은 기준 분자 프로파일에 대한 양과 음의 편차를 각각 가리키고, 빨강 및 초록 화살표들은 빨강과 초록 점들의 이동 방향을 각각 가리킨다. (B,C) 동형 에이피시 유전자 변이와 동형 및 이형 베타카테닌 변이들을 가지도록 유전자 조작된 생체모델(실험용 마우스)을 사용하였다(B,C). APCfl/fl(동형) 및 β-cateninexon3/+(이형), β-cateninexon3/exon3(동형) 유전자변이 실험용 마우스 (B, 첫째 행)의 대장 조직에 대해서, BrDU주입 후 2시간 이후에 BrDU 양성으로 마크된 세포들은 장샘의 증식영역(주로 아랫부분)에 한정된다. BrDU 주입 후 48시간 이후 장샘의 BrDU양성 세포들은 장샘의 윗쪽 방향으로 이동하였음을 가리킨다(B, 둘째 열). 에이피시 유전자 변이의 경우에는 동형 변이를 가진 생체모델이 사용되었다 (C, 둘째 열). 베타카테닌 변이의 경우에는 이형 변이(C, 셋째 열) 및 동형 변이(C, 넷째 열)를 가진 생체모델이 사용되었다. 본 연구팀은 BrDU 주입 후 2시간 및 48시간 후 BrDU가 마크된 세포들을 관측하였다. BrDU가 주입 후 2시간 이전에 DNA내에 포함되어지기 때문에 2시간에서의 BrDU마크는 증식영역의 위치를 가리킨다. BrDU 주입 후 48시간에서 장샘 내 세포의 이동과 증식이 관찰되었다. 본 연구팀은 증식성 세포들의 위치와 개수를 정량화하였고(C, 좌측) BrDU 표식 된 세포군집의 이동을 측정하기 위하여 누적빈도를 계산하였다(C, 우측). (C)의 화살표는 BrDU 표식된 세포군집의 이동거리를 가리킨다. 표본 마우스마다 50개의 ½장샘이 기록되었는데, 여기서 유전자 형마다 적어도 3개의 다른 실험용 마우스가 사용되었다.
2014.04.02
조회수 22248
 세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28 조회수 53166
세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28 조회수 53166 조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 20858
조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 20858 정인경 교수, 인체 조직의 3차원 게놈지도 해독
〈 정인경 교수, 이정운 박사과정 〉
우리 대학 생명과학과 정인경 교수와 美 루드윅 암 연구소(Ludwig Institute of Cancer Research) 빙 렌 (Bing Ren) 교수 공동 연구팀이 인체 조직의 3차원 게놈 지도를 해독하는 데 성공했다.
연구팀은 인체의 27개 부위 조직의 3차원 게놈 지도를 분석해 치매, 심혈관계 질환 등을 포함한 2만 7천여 개 이상의 복합 질환 관련 유전 변이 기능을 예측했다.
정인경 교수, 빙 렌 교수가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 제네틱스(Nature Genetics) 9월 10일 자 온라인판에 게재됐다. (논문명 : A compendium of promoter-centered long-range chromatin interactions in the human genome)
현재까지 수많은 연구를 통해 알츠하이머병, 파킨슨병, 자가면역질환 등 다양한 복합 질환의 원인을 규명하려는 시도가 이뤄지면서 실제 다수의 질환과 관련한 중요 유전변이가 발견됐다.
하지만 이들 대부분의 유전변이는 DNA가 단백질을 생성하지 않는 비전사 지역에 존재하기 때문에 1차원적 DNA 서열 분석에 기반한 유전체 연구로는 모든 기능을 규명하는 데 한계가 있다.
이에 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비전사 지역에 존재하는 유전변이도 3차원 게놈 구조에 의해 형성되는 염색질 고리 구조(chromatin loop)를 통해 멀리 떨어진 유전자를 조절할 수 있다는 모델을 제시했다.
그러나 이러한 3차원 게놈 구조 연구는 몇 가지 세포주를 대상으로만 국한돼 있고, 질환과 직접 연관이 있는 각 인체 조직을 표적으로 한 게놈 3차 구조는 규명되지 않았다.
연구팀은 인체 내의 27개 조직을 대상으로 이들 게놈의 3차원 구조를 규명하기 위해 전사촉진 부위만 선택적으로 분석하는 ‘표적 염색질 3차 구조 포착법(promoter-capture Hi-C)’이라 불리는 신규 실험 기법을 활용해 고해상도의 3차원 게놈 참조 지도를 작성했다.
그 결과 인간 게놈에 존재하는 약 90만 개의 게놈 3차원 염색질 고리 구조를 발굴하고, 이들 중 상당수가 각 인체 조직 특이적으로 존재한다는 사실도 규명했다.
연구팀은 3차원 게놈 구조를 기반으로 지금까지 기능이 명확하게 정의되지 않은 2만 7천여 개 이상의 질환 연관 유전 변이의 표적 유전자를 정의해 이들 변이의 기능을 예측했다. 나아가 각 질환의 표적 유전자 유사도에 기반해 질환과 질환 사이의 신규 관계를 규명했고, 이를 바탕으로 여러 질환에 공통으로 관여하는 신규 분자 기전을 제시했다.
정 교수는 “복합 질환 기전 규명을 위해 비전사 게놈의 중요성을 강조하고 존재하는 다수의 중요 유전변이를 3차원 게놈 구조 해독을 통해 규명 가능함을 보였다”라며 “이번 결과는 퇴행성 뇌 질환을 포함 다양한 복합 질환의 신규 기전 규명 및 표적 발굴에 활용될 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업, 보건복지부 질환극복기술개발사업, 서경배 과학재단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 3차원 게놈 구조 모식도 (modified from Stefano et al., 2016)
2019.09.24 조회수 12678
정인경 교수, 인체 조직의 3차원 게놈지도 해독
〈 정인경 교수, 이정운 박사과정 〉
우리 대학 생명과학과 정인경 교수와 美 루드윅 암 연구소(Ludwig Institute of Cancer Research) 빙 렌 (Bing Ren) 교수 공동 연구팀이 인체 조직의 3차원 게놈 지도를 해독하는 데 성공했다.
연구팀은 인체의 27개 부위 조직의 3차원 게놈 지도를 분석해 치매, 심혈관계 질환 등을 포함한 2만 7천여 개 이상의 복합 질환 관련 유전 변이 기능을 예측했다.
정인경 교수, 빙 렌 교수가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 제네틱스(Nature Genetics) 9월 10일 자 온라인판에 게재됐다. (논문명 : A compendium of promoter-centered long-range chromatin interactions in the human genome)
현재까지 수많은 연구를 통해 알츠하이머병, 파킨슨병, 자가면역질환 등 다양한 복합 질환의 원인을 규명하려는 시도가 이뤄지면서 실제 다수의 질환과 관련한 중요 유전변이가 발견됐다.
하지만 이들 대부분의 유전변이는 DNA가 단백질을 생성하지 않는 비전사 지역에 존재하기 때문에 1차원적 DNA 서열 분석에 기반한 유전체 연구로는 모든 기능을 규명하는 데 한계가 있다.
이에 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비전사 지역에 존재하는 유전변이도 3차원 게놈 구조에 의해 형성되는 염색질 고리 구조(chromatin loop)를 통해 멀리 떨어진 유전자를 조절할 수 있다는 모델을 제시했다.
그러나 이러한 3차원 게놈 구조 연구는 몇 가지 세포주를 대상으로만 국한돼 있고, 질환과 직접 연관이 있는 각 인체 조직을 표적으로 한 게놈 3차 구조는 규명되지 않았다.
연구팀은 인체 내의 27개 조직을 대상으로 이들 게놈의 3차원 구조를 규명하기 위해 전사촉진 부위만 선택적으로 분석하는 ‘표적 염색질 3차 구조 포착법(promoter-capture Hi-C)’이라 불리는 신규 실험 기법을 활용해 고해상도의 3차원 게놈 참조 지도를 작성했다.
그 결과 인간 게놈에 존재하는 약 90만 개의 게놈 3차원 염색질 고리 구조를 발굴하고, 이들 중 상당수가 각 인체 조직 특이적으로 존재한다는 사실도 규명했다.
연구팀은 3차원 게놈 구조를 기반으로 지금까지 기능이 명확하게 정의되지 않은 2만 7천여 개 이상의 질환 연관 유전 변이의 표적 유전자를 정의해 이들 변이의 기능을 예측했다. 나아가 각 질환의 표적 유전자 유사도에 기반해 질환과 질환 사이의 신규 관계를 규명했고, 이를 바탕으로 여러 질환에 공통으로 관여하는 신규 분자 기전을 제시했다.
정 교수는 “복합 질환 기전 규명을 위해 비전사 게놈의 중요성을 강조하고 존재하는 다수의 중요 유전변이를 3차원 게놈 구조 해독을 통해 규명 가능함을 보였다”라며 “이번 결과는 퇴행성 뇌 질환을 포함 다양한 복합 질환의 신규 기전 규명 및 표적 발굴에 활용될 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업, 보건복지부 질환극복기술개발사업, 서경배 과학재단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 3차원 게놈 구조 모식도 (modified from Stefano et al., 2016)
2019.09.24 조회수 12678 심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13 조회수 16931
심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13 조회수 16931 박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17 조회수 19701
박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17 조회수 19701 주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
2019.06.03 조회수 25696
주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
2019.06.03 조회수 25696 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 25032
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 25032 고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18 조회수 13846
고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18 조회수 13846 이정호 교수, 박상민 연구원, 후천적 뇌 돌연변이로 인한 뇌발달 장애 원인 규명
〈 박 상 민 연구원 〉
우리 대학 의과학대학원 이정호 교수 연구팀이 후천적인 뇌 돌연변이로 인한 뇌전증(간질) 및 자폐증 환자에게 나타나는 신경 세포 이동 장애 증상이 발생하는 원리를 규명했다.
연구팀의 이번 연구 결과는 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 치료에 기여할 수 있을 것으로 기대된다.
박상민 석박사통합과정이 1저자로 참여한 이번 연구 결과는 신경생물학 분야 국제 학술지 ‘뉴런(Neuron)’ 6월 21자에 게재됐다. (논문명: ‘Brain somatic mutations in MTOR disrupt neuronal ciliogenesis, leading to focal cortical lamination’)
이정호 교수 연구팀은 후천적인 뇌 돌연변이가 뇌전증과 자폐증을 유발할 수 있고, 이 돌연변이로 인해 신경 세포 이동 장애 증상이 발생한다는 사실을 이전 연구에서 증명한 바 있다.
그러나 이 신경 세포의 이동 장애가 발생하는 근본적인 원리에 대해서는 완벽하게 밝혀내지 못했다.
연구팀은 난치성 뇌전증 및 자폐증과 밀접하게 연관된 대뇌 피질 발달장애 환자의 뇌 조직에서 엠토르(mTOR) 유전자의 후천적인 뇌 돌연변이가 발생함을 확인했다. 이를 반영한 동물 및 세포 모델을 이용해 대뇌 피질 발달 이상의 원리를 연구했다.
그 결과 엠토르(mTOR) 돌연변이를 가진 신경 세포에서 세포 소기관인 일차 섬모의 생성 기능이 망가져 있음을 확인했고 이것이 환자에게서 발견되는 신경 세포 이동 장애의 원리임을 밝혔다.
엠토르(mTOR) 유전자가 OFD1이라는 단백질을 적절하게 제거하는 역할을 수행해야 하지만 엠토르(mTOR)에 돌연변이가 발생함으로써 OFD1 단백질이 과하게 축적됐고 그것이 신경 세포 이동의 장애 현상으로 이어진 것이다.
연구팀은 돌연변이를 가진 신경 세포에서 과하게 축적돼 일차 섬모 생성을 방해하는 역할인 OFD1 단백질의 발현을 억제시킴으로써 일차 섬모의 생성을 회복시켰다. 이를 통해 신경 세포의 이동을 정상 수준으로 되돌렸다.
1저자인 박상민 석박사통합과정은 “후천적 뇌 돌연 변이로 인한 뇌 발달 장애 환자에서 관찰되는 대표적 증상인 신경 세포 이동 결함이 그동안 주목받지 않았던 일차 섬모라는 세포소기관의 생성으로 설명할 수 있다는 점을 발견했다”고 말했다.
연구팀은 이번 연구 결과를 바탕으로 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 새로운 치료제 개발을 위한 후속 연구를 진행 중이다.
이번 연구는 서경배 과학재단, 보건복지부 세계선도 의생명과학자 육성 사업, 질병중심 중개 중점 연구 사업을 통해 수행됐다.
□ 그림 설명
그림1. 후천적 뇌 돌연 변이의 대뇌 피질 발달 장애 환자의 뇌 조직, 동물 모델에서 망가진 일차섬모 생성
그림2. 일차섬모 생성을 회복시킨 대뇌 피질 발달 장애 모델에서 신경 세포의 이동이 정상 수준으로 돌아옴
2018.06.25 조회수 12414
이정호 교수, 박상민 연구원, 후천적 뇌 돌연변이로 인한 뇌발달 장애 원인 규명
〈 박 상 민 연구원 〉
우리 대학 의과학대학원 이정호 교수 연구팀이 후천적인 뇌 돌연변이로 인한 뇌전증(간질) 및 자폐증 환자에게 나타나는 신경 세포 이동 장애 증상이 발생하는 원리를 규명했다.
연구팀의 이번 연구 결과는 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 치료에 기여할 수 있을 것으로 기대된다.
박상민 석박사통합과정이 1저자로 참여한 이번 연구 결과는 신경생물학 분야 국제 학술지 ‘뉴런(Neuron)’ 6월 21자에 게재됐다. (논문명: ‘Brain somatic mutations in MTOR disrupt neuronal ciliogenesis, leading to focal cortical lamination’)
이정호 교수 연구팀은 후천적인 뇌 돌연변이가 뇌전증과 자폐증을 유발할 수 있고, 이 돌연변이로 인해 신경 세포 이동 장애 증상이 발생한다는 사실을 이전 연구에서 증명한 바 있다.
그러나 이 신경 세포의 이동 장애가 발생하는 근본적인 원리에 대해서는 완벽하게 밝혀내지 못했다.
연구팀은 난치성 뇌전증 및 자폐증과 밀접하게 연관된 대뇌 피질 발달장애 환자의 뇌 조직에서 엠토르(mTOR) 유전자의 후천적인 뇌 돌연변이가 발생함을 확인했다. 이를 반영한 동물 및 세포 모델을 이용해 대뇌 피질 발달 이상의 원리를 연구했다.
그 결과 엠토르(mTOR) 돌연변이를 가진 신경 세포에서 세포 소기관인 일차 섬모의 생성 기능이 망가져 있음을 확인했고 이것이 환자에게서 발견되는 신경 세포 이동 장애의 원리임을 밝혔다.
엠토르(mTOR) 유전자가 OFD1이라는 단백질을 적절하게 제거하는 역할을 수행해야 하지만 엠토르(mTOR)에 돌연변이가 발생함으로써 OFD1 단백질이 과하게 축적됐고 그것이 신경 세포 이동의 장애 현상으로 이어진 것이다.
연구팀은 돌연변이를 가진 신경 세포에서 과하게 축적돼 일차 섬모 생성을 방해하는 역할인 OFD1 단백질의 발현을 억제시킴으로써 일차 섬모의 생성을 회복시켰다. 이를 통해 신경 세포의 이동을 정상 수준으로 되돌렸다.
1저자인 박상민 석박사통합과정은 “후천적 뇌 돌연 변이로 인한 뇌 발달 장애 환자에서 관찰되는 대표적 증상인 신경 세포 이동 결함이 그동안 주목받지 않았던 일차 섬모라는 세포소기관의 생성으로 설명할 수 있다는 점을 발견했다”고 말했다.
연구팀은 이번 연구 결과를 바탕으로 후천적 뇌 돌연변이로 인한 뇌 발달 장애 환자의 새로운 치료제 개발을 위한 후속 연구를 진행 중이다.
이번 연구는 서경배 과학재단, 보건복지부 세계선도 의생명과학자 육성 사업, 질병중심 중개 중점 연구 사업을 통해 수행됐다.
□ 그림 설명
그림1. 후천적 뇌 돌연 변이의 대뇌 피질 발달 장애 환자의 뇌 조직, 동물 모델에서 망가진 일차섬모 생성
그림2. 일차섬모 생성을 회복시킨 대뇌 피질 발달 장애 모델에서 신경 세포의 이동이 정상 수준으로 돌아옴
2018.06.25 조회수 12414 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 25179
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 25179 조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 25626
조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 25626 대장조직의 숨겨진 암발생 억제 메커니즘 규명
KAIST 연구진이 대장조직에 숨겨진 암발생 억제 메커니즘을 규명해냈다. 대장조직에 내재된 방어 메커니즘이 밝혀짐에 따라 대장암 발병에 대한 이해를 돕는 계기가 될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 송제훈 박사과정 연구원(제1저자)이 참여하였으며, 영국 암연구소 오웬 삼손 박사와 데이비드 휴웰, 레이첼 리지웨이, 아일랜드 연구소 보리스 콜로덴코, 월터 콜치 박사가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었고 연구결과는 셀(Cell) 자매지 셀 리포트(Cell Reports)지 온라인판 3월 28일자에 게재되었다.
* 논문명 : The APC network regulates the removal of mutated cells from colonic crypts
생명체는 손상된 조직을 스스로 복구할 수 있지만 복구를 위한 세포분열 과정에서 암을 일으킬 수 있는 유전자 변이가 생길 수 있다. 이는 빠른 세포분열 속도와 소화과정에서의 독성물질 때문에 유전자 변이 확률이 높은 대장의 장샘*에서 특히 문제가 된다.
* 장샘(crypt) : 대장 표면을 형성하는 약 2000여개의 세포로 구성된 동굴모양의 상피 연구팀은 유전자 변이로 발암 가능성이 높아진 세포를 대장의 장샘에서 빨리 내보내는 방식으로 대장조직이 빠르고 빈번한 조직재생과정에서 암 발생을 억제한다는 것을 알아냈다. 변이된 세포의 장샘 체류시간을 줄여 비정상적 세포분열을 억제하는 방어 메커니즘이 대장에 내재되어 있다는 것이다.
수학모델을 만들고 이에 대한 방대한 컴퓨터 시뮬레이션 분석을 수행한 결과 유전자 변이에 의해 윈트신호전달*이 강화된 변이세포는 정상세포에 비해 접착력이 높아지면서 장샘의 위쪽으로 더욱 빠르게 이동, 장샘을 벗어나 장내로 배출되기 쉬운 것으로 나타났다.
* 윈트 신호전달(Wnt Signaling) : 세포의 증식과 분화에 관여하는 신호전달 경로로 배아발달이나 성체조직의 항상성 관리에 특히 중요하다. 세포 외부에서 윈트 신호가 들어오면 베타 카테닌을 분해시켜 농도를 낮게 유지해 주는 분해복합체가 억제되면서 세포증식을 돕는 표적 유전자들이 발현되어 세포증식이 일어나게 된다.
유전자 변이로 윈트 신호전달회로의 핵심인자인 베타 카테닌이 분해되지 못하면 축적된 베타 카테닌이 세포증식을 활성화시키는 한편세포 접착력을 높이게 되는데, 장샘 조직의 특수한 환경과 비슷한 접착력을 가진 세포들이 모이려는 성질로 인해 결국 변이된 세포를 배출시켜 조직의 항상성을 유지한다는 것이다.
실제 생쥐모델에서도 비정상적인 장샘 조직의 경우 증식이 활발한 세포가 오히려 느리게 이동하는 것으로 나타나 이같은 시뮬레이션 결과를 확인할 수 있었다.
조 교수는 “본 연구는 컴퓨터 시뮬레이션으로 다세포 생명체가 비정상적 세포 변이에도 불구하고 조직의 항상성을 유지하도록 정교하게 설계되어 있음을 규명한 것으로 IT와 BT의 융합연구인 시스템생물학 연구를 통해 복잡한 생명현상의 숨겨진 원리를 파악할 수 있음을 보인 것” 이라고 밝혔다.
이 연구를 통해 대장의 장샘조직이 조직 내 암의 진화를 애초에 억제할 수 있는 메커니즘을 내재하고 있다는 놀라운 사실을 밝힘으로써 대장암 발생에 대한 이해를 한 단계 높이게 되었다. 또한 이번 연구결과는 대장암을 치료하기 위한 신약개발의 개발 방향에 대한 새로운 통찰을 제시하였다
주요그림 1 설명.
연구개요 모식도: 세포의 자가복구는 다세포생명체가 손상된 조직을 재생하기 위한 필수적인 과정이지만동시에 암을 일으킬 수 있는 체세포 변이의 위험성을 수반한다. 그렇다면 어떻게 이런 딜레마가 생체조직 내에서 해결될 수 있는 것인가?
이 문제는 재생속도가 빠르고 다양한 변이인자에 노출이 많은 대장조직에서 특히 중요하다. 연구팀은 대장 장샘의 세포증식과 이동에 관한 수학모델의 대규모 컴퓨터시뮬레이션과 생물학 시험을 결합한 시스템생물학(Systems Biology) 연구를 통해 그 분자적 메커니즘을 최초로 규명하였다. 장샘 조직 상단으로 이동하는 단일세포의 동역학 특성을 분석함으로써 암의 발생을 방지하는 장샘의 숨겨진 메커니즘을 밝힌 것이다. 그림은 실험용 생쥐에서 추출한 대장조직의 현미경 사진 위에 규명한 메커니즘을 그림으로 도식화 한 것이다.
주요그림 2 설명. 컴퓨터시뮬레이션 결과와 동물모델 실험을 통한 검증: (A) 야생형 장샘(첫째 행) 및 에이피시 유전자 변이된 장샘(둘째 행), 베타카테닌 유전자 변이된 장샘(셋째 행)에서, 이질적 세포군집에 의한 세포 재배치의 효과를 조사하는 컴퓨터 시뮬레이션이 수행되었다. 여기서 이질성은 균등하게 취해진 100개의 표본세포(첫째와 둘째 열)에 대해서 가해진 랜덤 노이즈를 노이즈가 없는 기준 분자 프로파일(파랑 파선)에 추가함으로써 모사된다. 표본세포들의 초기위치들은 세포 재배치에 의해서 최종위치로 변경된다. 이러한 세포재배치가 가져오는 윈트신호전달 및 세포접착의 분포(셋째와 네째 열)가 변화되는 양상이 조사되었다. 빨강 점 및 초록 점들은 기준 분자 프로파일에 대한 양과 음의 편차를 각각 가리키고, 빨강 및 초록 화살표들은 빨강과 초록 점들의 이동 방향을 각각 가리킨다. (B,C) 동형 에이피시 유전자 변이와 동형 및 이형 베타카테닌 변이들을 가지도록 유전자 조작된 생체모델(실험용 마우스)을 사용하였다(B,C). APCfl/fl(동형) 및 β-cateninexon3/+(이형), β-cateninexon3/exon3(동형) 유전자변이 실험용 마우스 (B, 첫째 행)의 대장 조직에 대해서, BrDU주입 후 2시간 이후에 BrDU 양성으로 마크된 세포들은 장샘의 증식영역(주로 아랫부분)에 한정된다. BrDU 주입 후 48시간 이후 장샘의 BrDU양성 세포들은 장샘의 윗쪽 방향으로 이동하였음을 가리킨다(B, 둘째 열). 에이피시 유전자 변이의 경우에는 동형 변이를 가진 생체모델이 사용되었다 (C, 둘째 열). 베타카테닌 변이의 경우에는 이형 변이(C, 셋째 열) 및 동형 변이(C, 넷째 열)를 가진 생체모델이 사용되었다. 본 연구팀은 BrDU 주입 후 2시간 및 48시간 후 BrDU가 마크된 세포들을 관측하였다. BrDU가 주입 후 2시간 이전에 DNA내에 포함되어지기 때문에 2시간에서의 BrDU마크는 증식영역의 위치를 가리킨다. BrDU 주입 후 48시간에서 장샘 내 세포의 이동과 증식이 관찰되었다. 본 연구팀은 증식성 세포들의 위치와 개수를 정량화하였고(C, 좌측) BrDU 표식 된 세포군집의 이동을 측정하기 위하여 누적빈도를 계산하였다(C, 우측). (C)의 화살표는 BrDU 표식된 세포군집의 이동거리를 가리킨다. 표본 마우스마다 50개의 ½장샘이 기록되었는데, 여기서 유전자 형마다 적어도 3개의 다른 실험용 마우스가 사용되었다.
2014.04.02 조회수 22248
대장조직의 숨겨진 암발생 억제 메커니즘 규명
KAIST 연구진이 대장조직에 숨겨진 암발생 억제 메커니즘을 규명해냈다. 대장조직에 내재된 방어 메커니즘이 밝혀짐에 따라 대장암 발병에 대한 이해를 돕는 계기가 될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 송제훈 박사과정 연구원(제1저자)이 참여하였으며, 영국 암연구소 오웬 삼손 박사와 데이비드 휴웰, 레이첼 리지웨이, 아일랜드 연구소 보리스 콜로덴코, 월터 콜치 박사가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었고 연구결과는 셀(Cell) 자매지 셀 리포트(Cell Reports)지 온라인판 3월 28일자에 게재되었다.
* 논문명 : The APC network regulates the removal of mutated cells from colonic crypts
생명체는 손상된 조직을 스스로 복구할 수 있지만 복구를 위한 세포분열 과정에서 암을 일으킬 수 있는 유전자 변이가 생길 수 있다. 이는 빠른 세포분열 속도와 소화과정에서의 독성물질 때문에 유전자 변이 확률이 높은 대장의 장샘*에서 특히 문제가 된다.
* 장샘(crypt) : 대장 표면을 형성하는 약 2000여개의 세포로 구성된 동굴모양의 상피 연구팀은 유전자 변이로 발암 가능성이 높아진 세포를 대장의 장샘에서 빨리 내보내는 방식으로 대장조직이 빠르고 빈번한 조직재생과정에서 암 발생을 억제한다는 것을 알아냈다. 변이된 세포의 장샘 체류시간을 줄여 비정상적 세포분열을 억제하는 방어 메커니즘이 대장에 내재되어 있다는 것이다.
수학모델을 만들고 이에 대한 방대한 컴퓨터 시뮬레이션 분석을 수행한 결과 유전자 변이에 의해 윈트신호전달*이 강화된 변이세포는 정상세포에 비해 접착력이 높아지면서 장샘의 위쪽으로 더욱 빠르게 이동, 장샘을 벗어나 장내로 배출되기 쉬운 것으로 나타났다.
* 윈트 신호전달(Wnt Signaling) : 세포의 증식과 분화에 관여하는 신호전달 경로로 배아발달이나 성체조직의 항상성 관리에 특히 중요하다. 세포 외부에서 윈트 신호가 들어오면 베타 카테닌을 분해시켜 농도를 낮게 유지해 주는 분해복합체가 억제되면서 세포증식을 돕는 표적 유전자들이 발현되어 세포증식이 일어나게 된다.
유전자 변이로 윈트 신호전달회로의 핵심인자인 베타 카테닌이 분해되지 못하면 축적된 베타 카테닌이 세포증식을 활성화시키는 한편세포 접착력을 높이게 되는데, 장샘 조직의 특수한 환경과 비슷한 접착력을 가진 세포들이 모이려는 성질로 인해 결국 변이된 세포를 배출시켜 조직의 항상성을 유지한다는 것이다.
실제 생쥐모델에서도 비정상적인 장샘 조직의 경우 증식이 활발한 세포가 오히려 느리게 이동하는 것으로 나타나 이같은 시뮬레이션 결과를 확인할 수 있었다.
조 교수는 “본 연구는 컴퓨터 시뮬레이션으로 다세포 생명체가 비정상적 세포 변이에도 불구하고 조직의 항상성을 유지하도록 정교하게 설계되어 있음을 규명한 것으로 IT와 BT의 융합연구인 시스템생물학 연구를 통해 복잡한 생명현상의 숨겨진 원리를 파악할 수 있음을 보인 것” 이라고 밝혔다.
이 연구를 통해 대장의 장샘조직이 조직 내 암의 진화를 애초에 억제할 수 있는 메커니즘을 내재하고 있다는 놀라운 사실을 밝힘으로써 대장암 발생에 대한 이해를 한 단계 높이게 되었다. 또한 이번 연구결과는 대장암을 치료하기 위한 신약개발의 개발 방향에 대한 새로운 통찰을 제시하였다
주요그림 1 설명.
연구개요 모식도: 세포의 자가복구는 다세포생명체가 손상된 조직을 재생하기 위한 필수적인 과정이지만동시에 암을 일으킬 수 있는 체세포 변이의 위험성을 수반한다. 그렇다면 어떻게 이런 딜레마가 생체조직 내에서 해결될 수 있는 것인가?
이 문제는 재생속도가 빠르고 다양한 변이인자에 노출이 많은 대장조직에서 특히 중요하다. 연구팀은 대장 장샘의 세포증식과 이동에 관한 수학모델의 대규모 컴퓨터시뮬레이션과 생물학 시험을 결합한 시스템생물학(Systems Biology) 연구를 통해 그 분자적 메커니즘을 최초로 규명하였다. 장샘 조직 상단으로 이동하는 단일세포의 동역학 특성을 분석함으로써 암의 발생을 방지하는 장샘의 숨겨진 메커니즘을 밝힌 것이다. 그림은 실험용 생쥐에서 추출한 대장조직의 현미경 사진 위에 규명한 메커니즘을 그림으로 도식화 한 것이다.
주요그림 2 설명. 컴퓨터시뮬레이션 결과와 동물모델 실험을 통한 검증: (A) 야생형 장샘(첫째 행) 및 에이피시 유전자 변이된 장샘(둘째 행), 베타카테닌 유전자 변이된 장샘(셋째 행)에서, 이질적 세포군집에 의한 세포 재배치의 효과를 조사하는 컴퓨터 시뮬레이션이 수행되었다. 여기서 이질성은 균등하게 취해진 100개의 표본세포(첫째와 둘째 열)에 대해서 가해진 랜덤 노이즈를 노이즈가 없는 기준 분자 프로파일(파랑 파선)에 추가함으로써 모사된다. 표본세포들의 초기위치들은 세포 재배치에 의해서 최종위치로 변경된다. 이러한 세포재배치가 가져오는 윈트신호전달 및 세포접착의 분포(셋째와 네째 열)가 변화되는 양상이 조사되었다. 빨강 점 및 초록 점들은 기준 분자 프로파일에 대한 양과 음의 편차를 각각 가리키고, 빨강 및 초록 화살표들은 빨강과 초록 점들의 이동 방향을 각각 가리킨다. (B,C) 동형 에이피시 유전자 변이와 동형 및 이형 베타카테닌 변이들을 가지도록 유전자 조작된 생체모델(실험용 마우스)을 사용하였다(B,C). APCfl/fl(동형) 및 β-cateninexon3/+(이형), β-cateninexon3/exon3(동형) 유전자변이 실험용 마우스 (B, 첫째 행)의 대장 조직에 대해서, BrDU주입 후 2시간 이후에 BrDU 양성으로 마크된 세포들은 장샘의 증식영역(주로 아랫부분)에 한정된다. BrDU 주입 후 48시간 이후 장샘의 BrDU양성 세포들은 장샘의 윗쪽 방향으로 이동하였음을 가리킨다(B, 둘째 열). 에이피시 유전자 변이의 경우에는 동형 변이를 가진 생체모델이 사용되었다 (C, 둘째 열). 베타카테닌 변이의 경우에는 이형 변이(C, 셋째 열) 및 동형 변이(C, 넷째 열)를 가진 생체모델이 사용되었다. 본 연구팀은 BrDU 주입 후 2시간 및 48시간 후 BrDU가 마크된 세포들을 관측하였다. BrDU가 주입 후 2시간 이전에 DNA내에 포함되어지기 때문에 2시간에서의 BrDU마크는 증식영역의 위치를 가리킨다. BrDU 주입 후 48시간에서 장샘 내 세포의 이동과 증식이 관찰되었다. 본 연구팀은 증식성 세포들의 위치와 개수를 정량화하였고(C, 좌측) BrDU 표식 된 세포군집의 이동을 측정하기 위하여 누적빈도를 계산하였다(C, 우측). (C)의 화살표는 BrDU 표식된 세포군집의 이동거리를 가리킨다. 표본 마우스마다 50개의 ½장샘이 기록되었는데, 여기서 유전자 형마다 적어도 3개의 다른 실험용 마우스가 사용되었다.
2014.04.02 조회수 22248