-
 사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23
조회수 6701
-
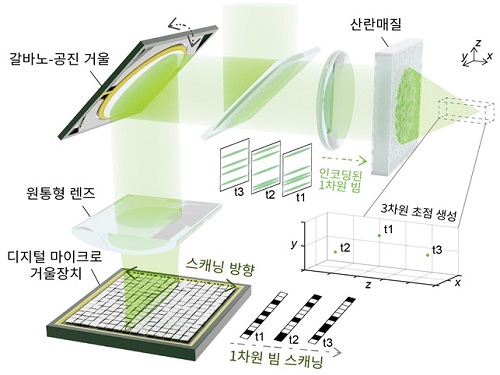 세계 최고 속도 입체적 조명 기술 개발
디스플레이(조명) 기술에서는 고속화가 아주 중요한 성능 중 하나로 꼽힌다. 최근 주요 스마트폰 제조사들은 화면 전환 속도가 기존의 초당 60회보다 크게 향상된 초당 120회의 고속 디스플레이를 선보였다. 이런 고속 디스플레이를 탑재한 모델의 이용자들 사이에 ‘한번 경험하면 예전으로 돌아갈 수 없다’는 말이 회자될 정도로, 고속화는 상업적인 가치도 크다고 볼 수 있다.
우리 대학 바이오및뇌공학과 장무석 교수 연구팀이 북해도대학 전자과학연구소의 시부카와 아츠시 부교수, 미카미 히데하루 교수, 오카야마대학 의·치·약과학과의 스도 유키 교수 연구팀과 공동연구를 통해 세계 최고속의 3차원 광 패턴 조명 기술*을 개발하는 데 성공했다고 15일 밝혔다.
*광 패턴 조명 기술: 빛을 특정 패턴이나 형태로 조절하여 원하는 조명 효과를 얻는 기술
광 패턴 조명 기술은 우리에게 친숙한 디스플레이나 빔프로젝터에서 찾아볼 수 있다. 디스플레이나 빔 프로젝터 내부에는 원하는 이미지나 모양 등을 화소 단위로 만들어낼 수 있는 광 패턴 조명 장치인 공간 광 변조기*가 사용되고 있다. 이외에도 광 패턴 조명 기술은 최근 주목받는 가상 현실 기술 분야의 핵심 요소 기술인 3차원 디스플레이 기술에도 사용되며, 산업 분야에서는 금속 가공, 연구 분야에서는 뇌 심부 이미징을 위한 레이저 스캐닝 현미경 등에 사용되고 있다.
*공간 광 변조기: 빛을 화소 단위로 조작하여 원하는 이미지나 모양을 만들어내는 장치로, 빔 프로젝터나 3차원 디스플레이 기술 등에 사용되는 장치
하지만 공간 광 변조기는 조명 패턴의 전환을 고속으로 수행하는 데 큰 한계를 겪고 있었다. 현재 시판되는 공간 광 변조기는 액정형 디스플레이 장치나 디지털 미러 장치가 있지만, 통상적인 전환 속도는 50마이크로초에서 10밀리초 수준으로 제한되며, 원리적으로 이보다 더 빠르게 만드는 데에는 기술적 어려움이 있었다.
연구팀은 공간 자유도-시간 자유도 사이의 치환 개념을 개발하고, 이를 독자 개발한 초고속 1차원 광 변조기와 산란 매질*을 결합하여 구현하는 방식으로, 시판되는 공간 광 변조기보다 약 1,500배 빠른 30나노초의 전환 속도를 갖는 세계 최고 속도의 3차원의 조명(디스플레이) 기술을 개발했다.
*산란 매질: 안개나 물방울 맺힌 유리창처럼 빛을 무질서하게 굴절시키는 물질
연구팀은 빛의 전파를 교란하는 산란 매질의 특성을 역이용해 1차원의 광 패턴을 사용자가 원하는 3차원의 패턴으로 변환하기 위해 복잡 광 파면 조작 기술을 핵심 기술로 활용했다.
연구팀이 개발한 세계 최고 속도의 광 패턴 조명 기술은 특정 각도에서만 볼 수 있는 기존의 2차원 유사 홀로그램과 달리 실제로 3차원 공간상에 광 정보를 재구성해 입체 영상을 만드는 기술로 활용될 수 있다. 그뿐만 아니라 광유전학 기술에 기반한 뇌 신경 조절 기술과 같은 생체 조절 기술의 고속화·대규모화나 금속 3D 프린터 등의 광 가공 생산 효율 향상 등, 다양한 분야에서 응용될 전망이다.
*광유전학 기술: 빛을 이용해 살아있는 생물 조직의 세포를 제어하는 기술
해당 연구 결과는 바이오및뇌공학과 송국호 박사과정이 공저자, 장무석 교수가 교신저자로 참여했으며 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 2024년 4월 8일 온라인판에 게재되었다. (논문명 : Large-volume focus control at 10 MHz refresh rate via fast line-scanning amplitude-encoded scattering-assisted holography)
이번 연구는 과학기술정보통신부 한국연구재단이 주관하는 선도연구센터사업(컬러변조 초감각 인지기술 선도연구센터), 우수신진연구자 사업, 삼성미래기술육성사업, 국토교통부 국토교통과학기술진흥원이 주관하는 차세대 대인 보안검색 기술 개발 사업의 지원을 받아 수행됐다.
세계 최고 속도 입체적 조명 기술 개발
디스플레이(조명) 기술에서는 고속화가 아주 중요한 성능 중 하나로 꼽힌다. 최근 주요 스마트폰 제조사들은 화면 전환 속도가 기존의 초당 60회보다 크게 향상된 초당 120회의 고속 디스플레이를 선보였다. 이런 고속 디스플레이를 탑재한 모델의 이용자들 사이에 ‘한번 경험하면 예전으로 돌아갈 수 없다’는 말이 회자될 정도로, 고속화는 상업적인 가치도 크다고 볼 수 있다.
우리 대학 바이오및뇌공학과 장무석 교수 연구팀이 북해도대학 전자과학연구소의 시부카와 아츠시 부교수, 미카미 히데하루 교수, 오카야마대학 의·치·약과학과의 스도 유키 교수 연구팀과 공동연구를 통해 세계 최고속의 3차원 광 패턴 조명 기술*을 개발하는 데 성공했다고 15일 밝혔다.
*광 패턴 조명 기술: 빛을 특정 패턴이나 형태로 조절하여 원하는 조명 효과를 얻는 기술
광 패턴 조명 기술은 우리에게 친숙한 디스플레이나 빔프로젝터에서 찾아볼 수 있다. 디스플레이나 빔 프로젝터 내부에는 원하는 이미지나 모양 등을 화소 단위로 만들어낼 수 있는 광 패턴 조명 장치인 공간 광 변조기*가 사용되고 있다. 이외에도 광 패턴 조명 기술은 최근 주목받는 가상 현실 기술 분야의 핵심 요소 기술인 3차원 디스플레이 기술에도 사용되며, 산업 분야에서는 금속 가공, 연구 분야에서는 뇌 심부 이미징을 위한 레이저 스캐닝 현미경 등에 사용되고 있다.
*공간 광 변조기: 빛을 화소 단위로 조작하여 원하는 이미지나 모양을 만들어내는 장치로, 빔 프로젝터나 3차원 디스플레이 기술 등에 사용되는 장치
하지만 공간 광 변조기는 조명 패턴의 전환을 고속으로 수행하는 데 큰 한계를 겪고 있었다. 현재 시판되는 공간 광 변조기는 액정형 디스플레이 장치나 디지털 미러 장치가 있지만, 통상적인 전환 속도는 50마이크로초에서 10밀리초 수준으로 제한되며, 원리적으로 이보다 더 빠르게 만드는 데에는 기술적 어려움이 있었다.
연구팀은 공간 자유도-시간 자유도 사이의 치환 개념을 개발하고, 이를 독자 개발한 초고속 1차원 광 변조기와 산란 매질*을 결합하여 구현하는 방식으로, 시판되는 공간 광 변조기보다 약 1,500배 빠른 30나노초의 전환 속도를 갖는 세계 최고 속도의 3차원의 조명(디스플레이) 기술을 개발했다.
*산란 매질: 안개나 물방울 맺힌 유리창처럼 빛을 무질서하게 굴절시키는 물질
연구팀은 빛의 전파를 교란하는 산란 매질의 특성을 역이용해 1차원의 광 패턴을 사용자가 원하는 3차원의 패턴으로 변환하기 위해 복잡 광 파면 조작 기술을 핵심 기술로 활용했다.
연구팀이 개발한 세계 최고 속도의 광 패턴 조명 기술은 특정 각도에서만 볼 수 있는 기존의 2차원 유사 홀로그램과 달리 실제로 3차원 공간상에 광 정보를 재구성해 입체 영상을 만드는 기술로 활용될 수 있다. 그뿐만 아니라 광유전학 기술에 기반한 뇌 신경 조절 기술과 같은 생체 조절 기술의 고속화·대규모화나 금속 3D 프린터 등의 광 가공 생산 효율 향상 등, 다양한 분야에서 응용될 전망이다.
*광유전학 기술: 빛을 이용해 살아있는 생물 조직의 세포를 제어하는 기술
해당 연구 결과는 바이오및뇌공학과 송국호 박사과정이 공저자, 장무석 교수가 교신저자로 참여했으며 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 2024년 4월 8일 온라인판에 게재되었다. (논문명 : Large-volume focus control at 10 MHz refresh rate via fast line-scanning amplitude-encoded scattering-assisted holography)
이번 연구는 과학기술정보통신부 한국연구재단이 주관하는 선도연구센터사업(컬러변조 초감각 인지기술 선도연구센터), 우수신진연구자 사업, 삼성미래기술육성사업, 국토교통부 국토교통과학기술진흥원이 주관하는 차세대 대인 보안검색 기술 개발 사업의 지원을 받아 수행됐다.
2024.04.15
조회수 8160
-
 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08
조회수 9950
-
 화학물질 없이 식각하는 반도체 기술 최초 개발
차세대 반도체 메모리의 소재로 주목을 받고 있는 강유전체는 차세대 메모리 소자 혹은 작은 물리적 변화를 감지하는 센서로 활용되는 등 그 중요성이 커지고 있다. 이에 반도체의 핵심 소자가 되는 강유전체를 화학물질없이 식각할 수 있는 연구를 성공해 화제다.
우리 대학 신소재공학과 홍승범 교수가 제네바 대학교와 국제공동연구를 통해 강유전체 표면의 비대칭 마멸* 현상을 세계 최초로 관찰 및 규명했고, 이를 활용해 혁신적인 나노 패터닝 기술**을 개발했다고 26일 밝혔다.
*마멸: 물체 표면의 재료가 점진적으로 손실 또는 제거되는 현상
**나노 패터닝 기술: 나노스케일로 소재의 표면에 정밀한 패턴을 생성하여 다양한 첨단 기술 분야에서 제품 성능을 향상시키는데 사용되는 기술
연구팀은 강유전체 소재의 표면 특성에 관한 연구에 집중했다. 이들은 원자간력 현미경(Atomic Force Microscopy)을 활용해 다양한 강유전체의 트라이볼로지(Tribology, 마찰 및 마모) 현상을 관찰했고, 강유전체의 전기적인 분극* 방향에 따라 마찰되거나 마모되는 특성이 다르다는 것을 세계 최초로 발견했다. (그림 1) 아울러, 이러한 분극 방향에 따라 달라지는 트라이볼로지의 원인으로 변전 효과(Flexoelectric effect)*에 주목했다.
*전기적 분극(electric dipole): 자석의 북극과 남극처럼 전기적으로 양극과 음극이 있는 것을 의미함
*변전 효과: 물질이 휘어졌을 때 분극이 발생하는 현상이지만, 거시 규모에서 물질을 구부렸을 때 유도되는 분극의 크기가 매우 작아 그동안 큰 주목을 받지 못했다. 그러나 2010년대 들어서 물질이 나노스케일로 미세화될 경우, 매우 큰 변전 효과가 발생할 수 있다는 연구 결과가 나오면서 많은 연구자의 주목을 받기 시작했다.
연구진은 강유전체의 트라이볼로지 특성이 나노 단위에서 강한 응력이 가해질 때 발생하는 변전 효과로 인해 강유전체 내부의 분극 방향에 따른 상호작용으로 트라이볼로지 특성이 바뀌게 된다는 것을 발견했다. 또한 이러한 새로운 강유전체 트라이볼로지 현상을 소재의 나노 패터닝에 응용했다.
이러한 패터닝 방식은 기존의 반도체 패터닝 방식과는 다르게 화학 물질 및 고비용의 리소그래피 장비가 필요하지 않고, 기존 공정 대비 매우 빠르게 나노 구조를 제작할 수 있는 장점이 있다.
이번 연구의 제1 저자인 신소재공학과 졸업생 조성우 박사는 “이번 연구는 세계 최초로 강유전체 비대칭 트라이볼로지를 관찰하고 규명한 데 의의가 있고, 이러한 분극에 민감한 트라이볼로지 비대칭성이 다양한 화학적 구성 및 결정 구조를 가진 강유전체에서 널리 적용될 수 있어 많은 후속 연구를 기대할 수 있다”고 밝혔다.
공동교신저자로 본 연구를 공동 지도한 제네바 대학교 파루치(Paruch) 교수는 “변전 효과를 통해 강유전체의 도메인이 분극 방향에 따라 서로 다른 표면 특성을 나타내는 것을 활용함으로써, 다양하고 유용한 기술들을 개발할 수 있을 것이다”며 이번 연구가 앞으로 뻗어나갈 분야에 대한 강한 자신감을 피력했다.
연구를 이끈 홍승범 교수는 “이번 연구에서 개발된 패터닝 기술은 기존 반도체 공정에서 쓰이는 패터닝 공정과 달리 화학 물질을 사용하지 않고, 매우 낮은 비용으로 대면적 나노 구조를 만들 수 있어 산업적으로 활용될 수 있는 잠재력을 가지고 있다”고 전망했다.
한편, 이번 연구는 한국연구재단(2020R1A2C2012078, NRF-2022K1A4A7A04095892, RS-2023-00247245), KAIST 글로벌특이점 사업의 지원 및 스위스, 스페인 연구진과의 국제공동연구를 통해 수행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 1월 9일 자 출판됐다. (논문 제목: Switchable tribology of ferroelectrics)
화학물질 없이 식각하는 반도체 기술 최초 개발
차세대 반도체 메모리의 소재로 주목을 받고 있는 강유전체는 차세대 메모리 소자 혹은 작은 물리적 변화를 감지하는 센서로 활용되는 등 그 중요성이 커지고 있다. 이에 반도체의 핵심 소자가 되는 강유전체를 화학물질없이 식각할 수 있는 연구를 성공해 화제다.
우리 대학 신소재공학과 홍승범 교수가 제네바 대학교와 국제공동연구를 통해 강유전체 표면의 비대칭 마멸* 현상을 세계 최초로 관찰 및 규명했고, 이를 활용해 혁신적인 나노 패터닝 기술**을 개발했다고 26일 밝혔다.
*마멸: 물체 표면의 재료가 점진적으로 손실 또는 제거되는 현상
**나노 패터닝 기술: 나노스케일로 소재의 표면에 정밀한 패턴을 생성하여 다양한 첨단 기술 분야에서 제품 성능을 향상시키는데 사용되는 기술
연구팀은 강유전체 소재의 표면 특성에 관한 연구에 집중했다. 이들은 원자간력 현미경(Atomic Force Microscopy)을 활용해 다양한 강유전체의 트라이볼로지(Tribology, 마찰 및 마모) 현상을 관찰했고, 강유전체의 전기적인 분극* 방향에 따라 마찰되거나 마모되는 특성이 다르다는 것을 세계 최초로 발견했다. (그림 1) 아울러, 이러한 분극 방향에 따라 달라지는 트라이볼로지의 원인으로 변전 효과(Flexoelectric effect)*에 주목했다.
*전기적 분극(electric dipole): 자석의 북극과 남극처럼 전기적으로 양극과 음극이 있는 것을 의미함
*변전 효과: 물질이 휘어졌을 때 분극이 발생하는 현상이지만, 거시 규모에서 물질을 구부렸을 때 유도되는 분극의 크기가 매우 작아 그동안 큰 주목을 받지 못했다. 그러나 2010년대 들어서 물질이 나노스케일로 미세화될 경우, 매우 큰 변전 효과가 발생할 수 있다는 연구 결과가 나오면서 많은 연구자의 주목을 받기 시작했다.
연구진은 강유전체의 트라이볼로지 특성이 나노 단위에서 강한 응력이 가해질 때 발생하는 변전 효과로 인해 강유전체 내부의 분극 방향에 따른 상호작용으로 트라이볼로지 특성이 바뀌게 된다는 것을 발견했다. 또한 이러한 새로운 강유전체 트라이볼로지 현상을 소재의 나노 패터닝에 응용했다.
이러한 패터닝 방식은 기존의 반도체 패터닝 방식과는 다르게 화학 물질 및 고비용의 리소그래피 장비가 필요하지 않고, 기존 공정 대비 매우 빠르게 나노 구조를 제작할 수 있는 장점이 있다.
이번 연구의 제1 저자인 신소재공학과 졸업생 조성우 박사는 “이번 연구는 세계 최초로 강유전체 비대칭 트라이볼로지를 관찰하고 규명한 데 의의가 있고, 이러한 분극에 민감한 트라이볼로지 비대칭성이 다양한 화학적 구성 및 결정 구조를 가진 강유전체에서 널리 적용될 수 있어 많은 후속 연구를 기대할 수 있다”고 밝혔다.
공동교신저자로 본 연구를 공동 지도한 제네바 대학교 파루치(Paruch) 교수는 “변전 효과를 통해 강유전체의 도메인이 분극 방향에 따라 서로 다른 표면 특성을 나타내는 것을 활용함으로써, 다양하고 유용한 기술들을 개발할 수 있을 것이다”며 이번 연구가 앞으로 뻗어나갈 분야에 대한 강한 자신감을 피력했다.
연구를 이끈 홍승범 교수는 “이번 연구에서 개발된 패터닝 기술은 기존 반도체 공정에서 쓰이는 패터닝 공정과 달리 화학 물질을 사용하지 않고, 매우 낮은 비용으로 대면적 나노 구조를 만들 수 있어 산업적으로 활용될 수 있는 잠재력을 가지고 있다”고 전망했다.
한편, 이번 연구는 한국연구재단(2020R1A2C2012078, NRF-2022K1A4A7A04095892, RS-2023-00247245), KAIST 글로벌특이점 사업의 지원 및 스위스, 스페인 연구진과의 국제공동연구를 통해 수행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 1월 9일 자 출판됐다. (논문 제목: Switchable tribology of ferroelectrics)
2024.03.26
조회수 9093
-
 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18
조회수 7521
-
 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15
조회수 7310
-
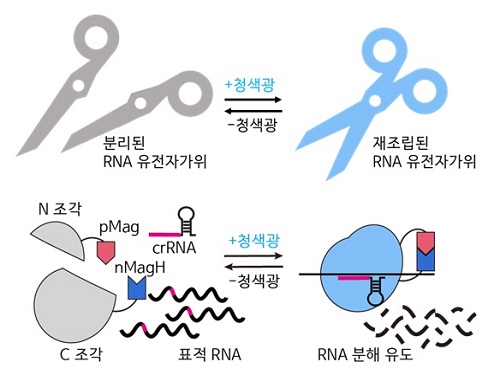 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07
조회수 10074
-
 숨겨진 효소 쏙쏙 찾아내는 인공지능 개발
대장균은 가장 많이 연구된 생명체 중 하나에 해당되지만 아직 대장균을 구성한 단백질 30%의 기능에 대해 명확하게 밝혀지지 않았다. 이에 대해 인공지능을 활용하여 아직 명확하게 밝혀진 바 없던 단백질에서 464종의 효소를 발견하였으며, 이 중 3종의 단백질의 예측된 기능을 시험관 내 효소 분석 방법을 통해 검증하는데 성공하였다.
우리 대학 생명화학공학과 이상엽 특훈교수와 캘리포니아대학교 샌디에이고(UCSD) 생명공학과 버나드 펄슨(Bernhard Palsson) 교수 공동연구팀이 단백질 서열을 활용, 해당 단백질의 효소 기능을 예측할 수 있는 인공지능, `딥 EC 트랜스포머(DeepECtransformer)'를 개발해 빠르고 정확하게 효소 기능을 파악할 수 있는 예측 시스템을 구축했다고 24일 밝혔다.
효소는 생물학적 반응을 촉매하는 단백질로서, 생명체 내 존재하는 다양한 화학 반응과 이에 따라 결정되는 생명체의 대사 특성을 파악하기 위해서는 각 효소의 기능을 이해하는 것이 필수적이다. EC 번호(효소 고유 번호, Enzyme Commission number)는 국제생화학 및 분자 생물학연맹 (International Union of Biochemistry and Molecular Biology, IUBMB)가 고안한 효소 기능 분류 체계로서, 다양한 유기체의 대사 특성을 이해하기 위해선 게놈 서열에서 존재하는 효소의 종류와 EC 번호를 빠르게 분석할 수 있는 기술 개발이 필요하다.
단백질의 기능 및 효소 기능 예측을 위해 인공지능을 활용하는 다양한 예측 시스템 또한 보고됐지만, 인공지능의 추론 과정을 직접 확인할 수 없는 블랙박스(black box)의 특징을 가졌거나, 효소 서열 내 아미노산 잔기(최소 단위) 수준으로 해석하지 못하는 문제가 있었다.
공동연구팀은 심층학습 기법과 단백질 상동성 분석 모듈을 활용해 주어진 단백질 서열의 효소 기능을 예측하는 인공지능 딥 EC 트랜스포머(DeepECtransformer)를 개발했다. 연구팀은 이번 연구에서 더 다양한 효소 기능을 정확하게 예측할 수 있도록 단백질 서열 전체 문맥에서 효소 기능에 중요한 정보를 추출하였고, 이를 통해 효소의 EC 번호를 정확하게 예측할 수 있었다. 개발된 인공지능은 총 5,360종류의 EC 번호를 예측할 수 있었다.
공동연구팀은 나아가 딥 EC 트랜스포머의 인공신경망 내 정보 흐름을 분석하여 인공지능이 추론 과정에서 효소 기능에 중요한 활성 부위나 보조 인자 결합 부위 정보를 활용하고 있음을 밝혀냈다. 이처럼 인공지능의 블랙박스를 해석함으로써 인공지능이 학습 과정에서 스스로 효소 기능에 중요한 특징을 파악하고 있음을 연구팀은 확인했다.
이번 논문의 제1 저자인 우리 대학 김기배 박사과정생은 “이번에 개발한 예측 시스템을 활용해 아직 밝혀진 적 없던 효소의 기능을 새롭게 예측하고 실험으로 검증할 수 있었다”고 말했다. 그는 또한 “딥 EC 트랜스포머를 활용해 생명체 내 밝혀지지 않았던 효소를 파악함으로써 유용 화합물을 생합성하기 위해 필요한 효소나 플라스틱을 생분해하기 위해 필요한 효소 등 다양한 대사 과정을 새롭게 밝혀낼 수 있을 것”이라고 덧붙였다.
또한 이상엽 특훈교수는 “효소 기능을 빠르고 정확하게 예측하는 딥 EC 트랜스포머는 기능 유전체학의 핵심 기술로서 시스템 수준에서 전체 효소들의 기능들을 분석할 수 있게 한다”며 “이를 활용해 모든 효소 정보를 포함한 대사 네트워크를 기반으로 친환경 미생물 공장 개발을 수행할 수 있을 것”이라고 밝혔다.
생명화학공학과 김기배 박사과정이 참여한 이번 논문은 국제 학술지 네이처(Nature) 誌가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 동료 심사를 거쳐 11월 14일 字 게재됐다.
※ 논문명 : 트랜스포머 레이어와 딥러닝을 사용하여 효소 인코딩 유전자의 기능적 주석 달기 (Functional annotation of enzyme-encoding genes using deep learning with transformer layers)
※ 저자 정보 : 김기배 (한국과학기술원, 제1 저자), 김지연 (한국과학기술원, 제2 저자), 이종언 (한국과학기술원, 제3 저자), Charles J. Norsigian (UCSD, 제4 저자), Bernhard O. Palsson (UCSD, 제5 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
숨겨진 효소 쏙쏙 찾아내는 인공지능 개발
대장균은 가장 많이 연구된 생명체 중 하나에 해당되지만 아직 대장균을 구성한 단백질 30%의 기능에 대해 명확하게 밝혀지지 않았다. 이에 대해 인공지능을 활용하여 아직 명확하게 밝혀진 바 없던 단백질에서 464종의 효소를 발견하였으며, 이 중 3종의 단백질의 예측된 기능을 시험관 내 효소 분석 방법을 통해 검증하는데 성공하였다.
우리 대학 생명화학공학과 이상엽 특훈교수와 캘리포니아대학교 샌디에이고(UCSD) 생명공학과 버나드 펄슨(Bernhard Palsson) 교수 공동연구팀이 단백질 서열을 활용, 해당 단백질의 효소 기능을 예측할 수 있는 인공지능, `딥 EC 트랜스포머(DeepECtransformer)'를 개발해 빠르고 정확하게 효소 기능을 파악할 수 있는 예측 시스템을 구축했다고 24일 밝혔다.
효소는 생물학적 반응을 촉매하는 단백질로서, 생명체 내 존재하는 다양한 화학 반응과 이에 따라 결정되는 생명체의 대사 특성을 파악하기 위해서는 각 효소의 기능을 이해하는 것이 필수적이다. EC 번호(효소 고유 번호, Enzyme Commission number)는 국제생화학 및 분자 생물학연맹 (International Union of Biochemistry and Molecular Biology, IUBMB)가 고안한 효소 기능 분류 체계로서, 다양한 유기체의 대사 특성을 이해하기 위해선 게놈 서열에서 존재하는 효소의 종류와 EC 번호를 빠르게 분석할 수 있는 기술 개발이 필요하다.
단백질의 기능 및 효소 기능 예측을 위해 인공지능을 활용하는 다양한 예측 시스템 또한 보고됐지만, 인공지능의 추론 과정을 직접 확인할 수 없는 블랙박스(black box)의 특징을 가졌거나, 효소 서열 내 아미노산 잔기(최소 단위) 수준으로 해석하지 못하는 문제가 있었다.
공동연구팀은 심층학습 기법과 단백질 상동성 분석 모듈을 활용해 주어진 단백질 서열의 효소 기능을 예측하는 인공지능 딥 EC 트랜스포머(DeepECtransformer)를 개발했다. 연구팀은 이번 연구에서 더 다양한 효소 기능을 정확하게 예측할 수 있도록 단백질 서열 전체 문맥에서 효소 기능에 중요한 정보를 추출하였고, 이를 통해 효소의 EC 번호를 정확하게 예측할 수 있었다. 개발된 인공지능은 총 5,360종류의 EC 번호를 예측할 수 있었다.
공동연구팀은 나아가 딥 EC 트랜스포머의 인공신경망 내 정보 흐름을 분석하여 인공지능이 추론 과정에서 효소 기능에 중요한 활성 부위나 보조 인자 결합 부위 정보를 활용하고 있음을 밝혀냈다. 이처럼 인공지능의 블랙박스를 해석함으로써 인공지능이 학습 과정에서 스스로 효소 기능에 중요한 특징을 파악하고 있음을 연구팀은 확인했다.
이번 논문의 제1 저자인 우리 대학 김기배 박사과정생은 “이번에 개발한 예측 시스템을 활용해 아직 밝혀진 적 없던 효소의 기능을 새롭게 예측하고 실험으로 검증할 수 있었다”고 말했다. 그는 또한 “딥 EC 트랜스포머를 활용해 생명체 내 밝혀지지 않았던 효소를 파악함으로써 유용 화합물을 생합성하기 위해 필요한 효소나 플라스틱을 생분해하기 위해 필요한 효소 등 다양한 대사 과정을 새롭게 밝혀낼 수 있을 것”이라고 덧붙였다.
또한 이상엽 특훈교수는 “효소 기능을 빠르고 정확하게 예측하는 딥 EC 트랜스포머는 기능 유전체학의 핵심 기술로서 시스템 수준에서 전체 효소들의 기능들을 분석할 수 있게 한다”며 “이를 활용해 모든 효소 정보를 포함한 대사 네트워크를 기반으로 친환경 미생물 공장 개발을 수행할 수 있을 것”이라고 밝혔다.
생명화학공학과 김기배 박사과정이 참여한 이번 논문은 국제 학술지 네이처(Nature) 誌가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 동료 심사를 거쳐 11월 14일 字 게재됐다.
※ 논문명 : 트랜스포머 레이어와 딥러닝을 사용하여 효소 인코딩 유전자의 기능적 주석 달기 (Functional annotation of enzyme-encoding genes using deep learning with transformer layers)
※ 저자 정보 : 김기배 (한국과학기술원, 제1 저자), 김지연 (한국과학기술원, 제2 저자), 이종언 (한국과학기술원, 제3 저자), Charles J. Norsigian (UCSD, 제4 저자), Bernhard O. Palsson (UCSD, 제5 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
2023.11.24
조회수 9254
-
 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03
조회수 10793
-
 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24
조회수 8843
-
 정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15
조회수 9430
-
 파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
2023.05.08
조회수 7395
 사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 6701
사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 6701 세계 최고 속도 입체적 조명 기술 개발
디스플레이(조명) 기술에서는 고속화가 아주 중요한 성능 중 하나로 꼽힌다. 최근 주요 스마트폰 제조사들은 화면 전환 속도가 기존의 초당 60회보다 크게 향상된 초당 120회의 고속 디스플레이를 선보였다. 이런 고속 디스플레이를 탑재한 모델의 이용자들 사이에 ‘한번 경험하면 예전으로 돌아갈 수 없다’는 말이 회자될 정도로, 고속화는 상업적인 가치도 크다고 볼 수 있다.
우리 대학 바이오및뇌공학과 장무석 교수 연구팀이 북해도대학 전자과학연구소의 시부카와 아츠시 부교수, 미카미 히데하루 교수, 오카야마대학 의·치·약과학과의 스도 유키 교수 연구팀과 공동연구를 통해 세계 최고속의 3차원 광 패턴 조명 기술*을 개발하는 데 성공했다고 15일 밝혔다.
*광 패턴 조명 기술: 빛을 특정 패턴이나 형태로 조절하여 원하는 조명 효과를 얻는 기술
광 패턴 조명 기술은 우리에게 친숙한 디스플레이나 빔프로젝터에서 찾아볼 수 있다. 디스플레이나 빔 프로젝터 내부에는 원하는 이미지나 모양 등을 화소 단위로 만들어낼 수 있는 광 패턴 조명 장치인 공간 광 변조기*가 사용되고 있다. 이외에도 광 패턴 조명 기술은 최근 주목받는 가상 현실 기술 분야의 핵심 요소 기술인 3차원 디스플레이 기술에도 사용되며, 산업 분야에서는 금속 가공, 연구 분야에서는 뇌 심부 이미징을 위한 레이저 스캐닝 현미경 등에 사용되고 있다.
*공간 광 변조기: 빛을 화소 단위로 조작하여 원하는 이미지나 모양을 만들어내는 장치로, 빔 프로젝터나 3차원 디스플레이 기술 등에 사용되는 장치
하지만 공간 광 변조기는 조명 패턴의 전환을 고속으로 수행하는 데 큰 한계를 겪고 있었다. 현재 시판되는 공간 광 변조기는 액정형 디스플레이 장치나 디지털 미러 장치가 있지만, 통상적인 전환 속도는 50마이크로초에서 10밀리초 수준으로 제한되며, 원리적으로 이보다 더 빠르게 만드는 데에는 기술적 어려움이 있었다.
연구팀은 공간 자유도-시간 자유도 사이의 치환 개념을 개발하고, 이를 독자 개발한 초고속 1차원 광 변조기와 산란 매질*을 결합하여 구현하는 방식으로, 시판되는 공간 광 변조기보다 약 1,500배 빠른 30나노초의 전환 속도를 갖는 세계 최고 속도의 3차원의 조명(디스플레이) 기술을 개발했다.
*산란 매질: 안개나 물방울 맺힌 유리창처럼 빛을 무질서하게 굴절시키는 물질
연구팀은 빛의 전파를 교란하는 산란 매질의 특성을 역이용해 1차원의 광 패턴을 사용자가 원하는 3차원의 패턴으로 변환하기 위해 복잡 광 파면 조작 기술을 핵심 기술로 활용했다.
연구팀이 개발한 세계 최고 속도의 광 패턴 조명 기술은 특정 각도에서만 볼 수 있는 기존의 2차원 유사 홀로그램과 달리 실제로 3차원 공간상에 광 정보를 재구성해 입체 영상을 만드는 기술로 활용될 수 있다. 그뿐만 아니라 광유전학 기술에 기반한 뇌 신경 조절 기술과 같은 생체 조절 기술의 고속화·대규모화나 금속 3D 프린터 등의 광 가공 생산 효율 향상 등, 다양한 분야에서 응용될 전망이다.
*광유전학 기술: 빛을 이용해 살아있는 생물 조직의 세포를 제어하는 기술
해당 연구 결과는 바이오및뇌공학과 송국호 박사과정이 공저자, 장무석 교수가 교신저자로 참여했으며 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 2024년 4월 8일 온라인판에 게재되었다. (논문명 : Large-volume focus control at 10 MHz refresh rate via fast line-scanning amplitude-encoded scattering-assisted holography)
이번 연구는 과학기술정보통신부 한국연구재단이 주관하는 선도연구센터사업(컬러변조 초감각 인지기술 선도연구센터), 우수신진연구자 사업, 삼성미래기술육성사업, 국토교통부 국토교통과학기술진흥원이 주관하는 차세대 대인 보안검색 기술 개발 사업의 지원을 받아 수행됐다.
2024.04.15 조회수 8160
세계 최고 속도 입체적 조명 기술 개발
디스플레이(조명) 기술에서는 고속화가 아주 중요한 성능 중 하나로 꼽힌다. 최근 주요 스마트폰 제조사들은 화면 전환 속도가 기존의 초당 60회보다 크게 향상된 초당 120회의 고속 디스플레이를 선보였다. 이런 고속 디스플레이를 탑재한 모델의 이용자들 사이에 ‘한번 경험하면 예전으로 돌아갈 수 없다’는 말이 회자될 정도로, 고속화는 상업적인 가치도 크다고 볼 수 있다.
우리 대학 바이오및뇌공학과 장무석 교수 연구팀이 북해도대학 전자과학연구소의 시부카와 아츠시 부교수, 미카미 히데하루 교수, 오카야마대학 의·치·약과학과의 스도 유키 교수 연구팀과 공동연구를 통해 세계 최고속의 3차원 광 패턴 조명 기술*을 개발하는 데 성공했다고 15일 밝혔다.
*광 패턴 조명 기술: 빛을 특정 패턴이나 형태로 조절하여 원하는 조명 효과를 얻는 기술
광 패턴 조명 기술은 우리에게 친숙한 디스플레이나 빔프로젝터에서 찾아볼 수 있다. 디스플레이나 빔 프로젝터 내부에는 원하는 이미지나 모양 등을 화소 단위로 만들어낼 수 있는 광 패턴 조명 장치인 공간 광 변조기*가 사용되고 있다. 이외에도 광 패턴 조명 기술은 최근 주목받는 가상 현실 기술 분야의 핵심 요소 기술인 3차원 디스플레이 기술에도 사용되며, 산업 분야에서는 금속 가공, 연구 분야에서는 뇌 심부 이미징을 위한 레이저 스캐닝 현미경 등에 사용되고 있다.
*공간 광 변조기: 빛을 화소 단위로 조작하여 원하는 이미지나 모양을 만들어내는 장치로, 빔 프로젝터나 3차원 디스플레이 기술 등에 사용되는 장치
하지만 공간 광 변조기는 조명 패턴의 전환을 고속으로 수행하는 데 큰 한계를 겪고 있었다. 현재 시판되는 공간 광 변조기는 액정형 디스플레이 장치나 디지털 미러 장치가 있지만, 통상적인 전환 속도는 50마이크로초에서 10밀리초 수준으로 제한되며, 원리적으로 이보다 더 빠르게 만드는 데에는 기술적 어려움이 있었다.
연구팀은 공간 자유도-시간 자유도 사이의 치환 개념을 개발하고, 이를 독자 개발한 초고속 1차원 광 변조기와 산란 매질*을 결합하여 구현하는 방식으로, 시판되는 공간 광 변조기보다 약 1,500배 빠른 30나노초의 전환 속도를 갖는 세계 최고 속도의 3차원의 조명(디스플레이) 기술을 개발했다.
*산란 매질: 안개나 물방울 맺힌 유리창처럼 빛을 무질서하게 굴절시키는 물질
연구팀은 빛의 전파를 교란하는 산란 매질의 특성을 역이용해 1차원의 광 패턴을 사용자가 원하는 3차원의 패턴으로 변환하기 위해 복잡 광 파면 조작 기술을 핵심 기술로 활용했다.
연구팀이 개발한 세계 최고 속도의 광 패턴 조명 기술은 특정 각도에서만 볼 수 있는 기존의 2차원 유사 홀로그램과 달리 실제로 3차원 공간상에 광 정보를 재구성해 입체 영상을 만드는 기술로 활용될 수 있다. 그뿐만 아니라 광유전학 기술에 기반한 뇌 신경 조절 기술과 같은 생체 조절 기술의 고속화·대규모화나 금속 3D 프린터 등의 광 가공 생산 효율 향상 등, 다양한 분야에서 응용될 전망이다.
*광유전학 기술: 빛을 이용해 살아있는 생물 조직의 세포를 제어하는 기술
해당 연구 결과는 바이오및뇌공학과 송국호 박사과정이 공저자, 장무석 교수가 교신저자로 참여했으며 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 2024년 4월 8일 온라인판에 게재되었다. (논문명 : Large-volume focus control at 10 MHz refresh rate via fast line-scanning amplitude-encoded scattering-assisted holography)
이번 연구는 과학기술정보통신부 한국연구재단이 주관하는 선도연구센터사업(컬러변조 초감각 인지기술 선도연구센터), 우수신진연구자 사업, 삼성미래기술육성사업, 국토교통부 국토교통과학기술진흥원이 주관하는 차세대 대인 보안검색 기술 개발 사업의 지원을 받아 수행됐다.
2024.04.15 조회수 8160 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9950
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9950 화학물질 없이 식각하는 반도체 기술 최초 개발
차세대 반도체 메모리의 소재로 주목을 받고 있는 강유전체는 차세대 메모리 소자 혹은 작은 물리적 변화를 감지하는 센서로 활용되는 등 그 중요성이 커지고 있다. 이에 반도체의 핵심 소자가 되는 강유전체를 화학물질없이 식각할 수 있는 연구를 성공해 화제다.
우리 대학 신소재공학과 홍승범 교수가 제네바 대학교와 국제공동연구를 통해 강유전체 표면의 비대칭 마멸* 현상을 세계 최초로 관찰 및 규명했고, 이를 활용해 혁신적인 나노 패터닝 기술**을 개발했다고 26일 밝혔다.
*마멸: 물체 표면의 재료가 점진적으로 손실 또는 제거되는 현상
**나노 패터닝 기술: 나노스케일로 소재의 표면에 정밀한 패턴을 생성하여 다양한 첨단 기술 분야에서 제품 성능을 향상시키는데 사용되는 기술
연구팀은 강유전체 소재의 표면 특성에 관한 연구에 집중했다. 이들은 원자간력 현미경(Atomic Force Microscopy)을 활용해 다양한 강유전체의 트라이볼로지(Tribology, 마찰 및 마모) 현상을 관찰했고, 강유전체의 전기적인 분극* 방향에 따라 마찰되거나 마모되는 특성이 다르다는 것을 세계 최초로 발견했다. (그림 1) 아울러, 이러한 분극 방향에 따라 달라지는 트라이볼로지의 원인으로 변전 효과(Flexoelectric effect)*에 주목했다.
*전기적 분극(electric dipole): 자석의 북극과 남극처럼 전기적으로 양극과 음극이 있는 것을 의미함
*변전 효과: 물질이 휘어졌을 때 분극이 발생하는 현상이지만, 거시 규모에서 물질을 구부렸을 때 유도되는 분극의 크기가 매우 작아 그동안 큰 주목을 받지 못했다. 그러나 2010년대 들어서 물질이 나노스케일로 미세화될 경우, 매우 큰 변전 효과가 발생할 수 있다는 연구 결과가 나오면서 많은 연구자의 주목을 받기 시작했다.
연구진은 강유전체의 트라이볼로지 특성이 나노 단위에서 강한 응력이 가해질 때 발생하는 변전 효과로 인해 강유전체 내부의 분극 방향에 따른 상호작용으로 트라이볼로지 특성이 바뀌게 된다는 것을 발견했다. 또한 이러한 새로운 강유전체 트라이볼로지 현상을 소재의 나노 패터닝에 응용했다.
이러한 패터닝 방식은 기존의 반도체 패터닝 방식과는 다르게 화학 물질 및 고비용의 리소그래피 장비가 필요하지 않고, 기존 공정 대비 매우 빠르게 나노 구조를 제작할 수 있는 장점이 있다.
이번 연구의 제1 저자인 신소재공학과 졸업생 조성우 박사는 “이번 연구는 세계 최초로 강유전체 비대칭 트라이볼로지를 관찰하고 규명한 데 의의가 있고, 이러한 분극에 민감한 트라이볼로지 비대칭성이 다양한 화학적 구성 및 결정 구조를 가진 강유전체에서 널리 적용될 수 있어 많은 후속 연구를 기대할 수 있다”고 밝혔다.
공동교신저자로 본 연구를 공동 지도한 제네바 대학교 파루치(Paruch) 교수는 “변전 효과를 통해 강유전체의 도메인이 분극 방향에 따라 서로 다른 표면 특성을 나타내는 것을 활용함으로써, 다양하고 유용한 기술들을 개발할 수 있을 것이다”며 이번 연구가 앞으로 뻗어나갈 분야에 대한 강한 자신감을 피력했다.
연구를 이끈 홍승범 교수는 “이번 연구에서 개발된 패터닝 기술은 기존 반도체 공정에서 쓰이는 패터닝 공정과 달리 화학 물질을 사용하지 않고, 매우 낮은 비용으로 대면적 나노 구조를 만들 수 있어 산업적으로 활용될 수 있는 잠재력을 가지고 있다”고 전망했다.
한편, 이번 연구는 한국연구재단(2020R1A2C2012078, NRF-2022K1A4A7A04095892, RS-2023-00247245), KAIST 글로벌특이점 사업의 지원 및 스위스, 스페인 연구진과의 국제공동연구를 통해 수행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 1월 9일 자 출판됐다. (논문 제목: Switchable tribology of ferroelectrics)
2024.03.26 조회수 9093
화학물질 없이 식각하는 반도체 기술 최초 개발
차세대 반도체 메모리의 소재로 주목을 받고 있는 강유전체는 차세대 메모리 소자 혹은 작은 물리적 변화를 감지하는 센서로 활용되는 등 그 중요성이 커지고 있다. 이에 반도체의 핵심 소자가 되는 강유전체를 화학물질없이 식각할 수 있는 연구를 성공해 화제다.
우리 대학 신소재공학과 홍승범 교수가 제네바 대학교와 국제공동연구를 통해 강유전체 표면의 비대칭 마멸* 현상을 세계 최초로 관찰 및 규명했고, 이를 활용해 혁신적인 나노 패터닝 기술**을 개발했다고 26일 밝혔다.
*마멸: 물체 표면의 재료가 점진적으로 손실 또는 제거되는 현상
**나노 패터닝 기술: 나노스케일로 소재의 표면에 정밀한 패턴을 생성하여 다양한 첨단 기술 분야에서 제품 성능을 향상시키는데 사용되는 기술
연구팀은 강유전체 소재의 표면 특성에 관한 연구에 집중했다. 이들은 원자간력 현미경(Atomic Force Microscopy)을 활용해 다양한 강유전체의 트라이볼로지(Tribology, 마찰 및 마모) 현상을 관찰했고, 강유전체의 전기적인 분극* 방향에 따라 마찰되거나 마모되는 특성이 다르다는 것을 세계 최초로 발견했다. (그림 1) 아울러, 이러한 분극 방향에 따라 달라지는 트라이볼로지의 원인으로 변전 효과(Flexoelectric effect)*에 주목했다.
*전기적 분극(electric dipole): 자석의 북극과 남극처럼 전기적으로 양극과 음극이 있는 것을 의미함
*변전 효과: 물질이 휘어졌을 때 분극이 발생하는 현상이지만, 거시 규모에서 물질을 구부렸을 때 유도되는 분극의 크기가 매우 작아 그동안 큰 주목을 받지 못했다. 그러나 2010년대 들어서 물질이 나노스케일로 미세화될 경우, 매우 큰 변전 효과가 발생할 수 있다는 연구 결과가 나오면서 많은 연구자의 주목을 받기 시작했다.
연구진은 강유전체의 트라이볼로지 특성이 나노 단위에서 강한 응력이 가해질 때 발생하는 변전 효과로 인해 강유전체 내부의 분극 방향에 따른 상호작용으로 트라이볼로지 특성이 바뀌게 된다는 것을 발견했다. 또한 이러한 새로운 강유전체 트라이볼로지 현상을 소재의 나노 패터닝에 응용했다.
이러한 패터닝 방식은 기존의 반도체 패터닝 방식과는 다르게 화학 물질 및 고비용의 리소그래피 장비가 필요하지 않고, 기존 공정 대비 매우 빠르게 나노 구조를 제작할 수 있는 장점이 있다.
이번 연구의 제1 저자인 신소재공학과 졸업생 조성우 박사는 “이번 연구는 세계 최초로 강유전체 비대칭 트라이볼로지를 관찰하고 규명한 데 의의가 있고, 이러한 분극에 민감한 트라이볼로지 비대칭성이 다양한 화학적 구성 및 결정 구조를 가진 강유전체에서 널리 적용될 수 있어 많은 후속 연구를 기대할 수 있다”고 밝혔다.
공동교신저자로 본 연구를 공동 지도한 제네바 대학교 파루치(Paruch) 교수는 “변전 효과를 통해 강유전체의 도메인이 분극 방향에 따라 서로 다른 표면 특성을 나타내는 것을 활용함으로써, 다양하고 유용한 기술들을 개발할 수 있을 것이다”며 이번 연구가 앞으로 뻗어나갈 분야에 대한 강한 자신감을 피력했다.
연구를 이끈 홍승범 교수는 “이번 연구에서 개발된 패터닝 기술은 기존 반도체 공정에서 쓰이는 패터닝 공정과 달리 화학 물질을 사용하지 않고, 매우 낮은 비용으로 대면적 나노 구조를 만들 수 있어 산업적으로 활용될 수 있는 잠재력을 가지고 있다”고 전망했다.
한편, 이번 연구는 한국연구재단(2020R1A2C2012078, NRF-2022K1A4A7A04095892, RS-2023-00247245), KAIST 글로벌특이점 사업의 지원 및 스위스, 스페인 연구진과의 국제공동연구를 통해 수행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 1월 9일 자 출판됐다. (논문 제목: Switchable tribology of ferroelectrics)
2024.03.26 조회수 9093 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7521
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7521 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7310
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7310 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 10074
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 10074 숨겨진 효소 쏙쏙 찾아내는 인공지능 개발
대장균은 가장 많이 연구된 생명체 중 하나에 해당되지만 아직 대장균을 구성한 단백질 30%의 기능에 대해 명확하게 밝혀지지 않았다. 이에 대해 인공지능을 활용하여 아직 명확하게 밝혀진 바 없던 단백질에서 464종의 효소를 발견하였으며, 이 중 3종의 단백질의 예측된 기능을 시험관 내 효소 분석 방법을 통해 검증하는데 성공하였다.
우리 대학 생명화학공학과 이상엽 특훈교수와 캘리포니아대학교 샌디에이고(UCSD) 생명공학과 버나드 펄슨(Bernhard Palsson) 교수 공동연구팀이 단백질 서열을 활용, 해당 단백질의 효소 기능을 예측할 수 있는 인공지능, `딥 EC 트랜스포머(DeepECtransformer)'를 개발해 빠르고 정확하게 효소 기능을 파악할 수 있는 예측 시스템을 구축했다고 24일 밝혔다.
효소는 생물학적 반응을 촉매하는 단백질로서, 생명체 내 존재하는 다양한 화학 반응과 이에 따라 결정되는 생명체의 대사 특성을 파악하기 위해서는 각 효소의 기능을 이해하는 것이 필수적이다. EC 번호(효소 고유 번호, Enzyme Commission number)는 국제생화학 및 분자 생물학연맹 (International Union of Biochemistry and Molecular Biology, IUBMB)가 고안한 효소 기능 분류 체계로서, 다양한 유기체의 대사 특성을 이해하기 위해선 게놈 서열에서 존재하는 효소의 종류와 EC 번호를 빠르게 분석할 수 있는 기술 개발이 필요하다.
단백질의 기능 및 효소 기능 예측을 위해 인공지능을 활용하는 다양한 예측 시스템 또한 보고됐지만, 인공지능의 추론 과정을 직접 확인할 수 없는 블랙박스(black box)의 특징을 가졌거나, 효소 서열 내 아미노산 잔기(최소 단위) 수준으로 해석하지 못하는 문제가 있었다.
공동연구팀은 심층학습 기법과 단백질 상동성 분석 모듈을 활용해 주어진 단백질 서열의 효소 기능을 예측하는 인공지능 딥 EC 트랜스포머(DeepECtransformer)를 개발했다. 연구팀은 이번 연구에서 더 다양한 효소 기능을 정확하게 예측할 수 있도록 단백질 서열 전체 문맥에서 효소 기능에 중요한 정보를 추출하였고, 이를 통해 효소의 EC 번호를 정확하게 예측할 수 있었다. 개발된 인공지능은 총 5,360종류의 EC 번호를 예측할 수 있었다.
공동연구팀은 나아가 딥 EC 트랜스포머의 인공신경망 내 정보 흐름을 분석하여 인공지능이 추론 과정에서 효소 기능에 중요한 활성 부위나 보조 인자 결합 부위 정보를 활용하고 있음을 밝혀냈다. 이처럼 인공지능의 블랙박스를 해석함으로써 인공지능이 학습 과정에서 스스로 효소 기능에 중요한 특징을 파악하고 있음을 연구팀은 확인했다.
이번 논문의 제1 저자인 우리 대학 김기배 박사과정생은 “이번에 개발한 예측 시스템을 활용해 아직 밝혀진 적 없던 효소의 기능을 새롭게 예측하고 실험으로 검증할 수 있었다”고 말했다. 그는 또한 “딥 EC 트랜스포머를 활용해 생명체 내 밝혀지지 않았던 효소를 파악함으로써 유용 화합물을 생합성하기 위해 필요한 효소나 플라스틱을 생분해하기 위해 필요한 효소 등 다양한 대사 과정을 새롭게 밝혀낼 수 있을 것”이라고 덧붙였다.
또한 이상엽 특훈교수는 “효소 기능을 빠르고 정확하게 예측하는 딥 EC 트랜스포머는 기능 유전체학의 핵심 기술로서 시스템 수준에서 전체 효소들의 기능들을 분석할 수 있게 한다”며 “이를 활용해 모든 효소 정보를 포함한 대사 네트워크를 기반으로 친환경 미생물 공장 개발을 수행할 수 있을 것”이라고 밝혔다.
생명화학공학과 김기배 박사과정이 참여한 이번 논문은 국제 학술지 네이처(Nature) 誌가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 동료 심사를 거쳐 11월 14일 字 게재됐다.
※ 논문명 : 트랜스포머 레이어와 딥러닝을 사용하여 효소 인코딩 유전자의 기능적 주석 달기 (Functional annotation of enzyme-encoding genes using deep learning with transformer layers)
※ 저자 정보 : 김기배 (한국과학기술원, 제1 저자), 김지연 (한국과학기술원, 제2 저자), 이종언 (한국과학기술원, 제3 저자), Charles J. Norsigian (UCSD, 제4 저자), Bernhard O. Palsson (UCSD, 제5 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
2023.11.24 조회수 9254
숨겨진 효소 쏙쏙 찾아내는 인공지능 개발
대장균은 가장 많이 연구된 생명체 중 하나에 해당되지만 아직 대장균을 구성한 단백질 30%의 기능에 대해 명확하게 밝혀지지 않았다. 이에 대해 인공지능을 활용하여 아직 명확하게 밝혀진 바 없던 단백질에서 464종의 효소를 발견하였으며, 이 중 3종의 단백질의 예측된 기능을 시험관 내 효소 분석 방법을 통해 검증하는데 성공하였다.
우리 대학 생명화학공학과 이상엽 특훈교수와 캘리포니아대학교 샌디에이고(UCSD) 생명공학과 버나드 펄슨(Bernhard Palsson) 교수 공동연구팀이 단백질 서열을 활용, 해당 단백질의 효소 기능을 예측할 수 있는 인공지능, `딥 EC 트랜스포머(DeepECtransformer)'를 개발해 빠르고 정확하게 효소 기능을 파악할 수 있는 예측 시스템을 구축했다고 24일 밝혔다.
효소는 생물학적 반응을 촉매하는 단백질로서, 생명체 내 존재하는 다양한 화학 반응과 이에 따라 결정되는 생명체의 대사 특성을 파악하기 위해서는 각 효소의 기능을 이해하는 것이 필수적이다. EC 번호(효소 고유 번호, Enzyme Commission number)는 국제생화학 및 분자 생물학연맹 (International Union of Biochemistry and Molecular Biology, IUBMB)가 고안한 효소 기능 분류 체계로서, 다양한 유기체의 대사 특성을 이해하기 위해선 게놈 서열에서 존재하는 효소의 종류와 EC 번호를 빠르게 분석할 수 있는 기술 개발이 필요하다.
단백질의 기능 및 효소 기능 예측을 위해 인공지능을 활용하는 다양한 예측 시스템 또한 보고됐지만, 인공지능의 추론 과정을 직접 확인할 수 없는 블랙박스(black box)의 특징을 가졌거나, 효소 서열 내 아미노산 잔기(최소 단위) 수준으로 해석하지 못하는 문제가 있었다.
공동연구팀은 심층학습 기법과 단백질 상동성 분석 모듈을 활용해 주어진 단백질 서열의 효소 기능을 예측하는 인공지능 딥 EC 트랜스포머(DeepECtransformer)를 개발했다. 연구팀은 이번 연구에서 더 다양한 효소 기능을 정확하게 예측할 수 있도록 단백질 서열 전체 문맥에서 효소 기능에 중요한 정보를 추출하였고, 이를 통해 효소의 EC 번호를 정확하게 예측할 수 있었다. 개발된 인공지능은 총 5,360종류의 EC 번호를 예측할 수 있었다.
공동연구팀은 나아가 딥 EC 트랜스포머의 인공신경망 내 정보 흐름을 분석하여 인공지능이 추론 과정에서 효소 기능에 중요한 활성 부위나 보조 인자 결합 부위 정보를 활용하고 있음을 밝혀냈다. 이처럼 인공지능의 블랙박스를 해석함으로써 인공지능이 학습 과정에서 스스로 효소 기능에 중요한 특징을 파악하고 있음을 연구팀은 확인했다.
이번 논문의 제1 저자인 우리 대학 김기배 박사과정생은 “이번에 개발한 예측 시스템을 활용해 아직 밝혀진 적 없던 효소의 기능을 새롭게 예측하고 실험으로 검증할 수 있었다”고 말했다. 그는 또한 “딥 EC 트랜스포머를 활용해 생명체 내 밝혀지지 않았던 효소를 파악함으로써 유용 화합물을 생합성하기 위해 필요한 효소나 플라스틱을 생분해하기 위해 필요한 효소 등 다양한 대사 과정을 새롭게 밝혀낼 수 있을 것”이라고 덧붙였다.
또한 이상엽 특훈교수는 “효소 기능을 빠르고 정확하게 예측하는 딥 EC 트랜스포머는 기능 유전체학의 핵심 기술로서 시스템 수준에서 전체 효소들의 기능들을 분석할 수 있게 한다”며 “이를 활용해 모든 효소 정보를 포함한 대사 네트워크를 기반으로 친환경 미생물 공장 개발을 수행할 수 있을 것”이라고 밝혔다.
생명화학공학과 김기배 박사과정이 참여한 이번 논문은 국제 학술지 네이처(Nature) 誌가 발행하는 `네이처 커뮤니케이션즈(Nature Communications)'에 동료 심사를 거쳐 11월 14일 字 게재됐다.
※ 논문명 : 트랜스포머 레이어와 딥러닝을 사용하여 효소 인코딩 유전자의 기능적 주석 달기 (Functional annotation of enzyme-encoding genes using deep learning with transformer layers)
※ 저자 정보 : 김기배 (한국과학기술원, 제1 저자), 김지연 (한국과학기술원, 제2 저자), 이종언 (한국과학기술원, 제3 저자), Charles J. Norsigian (UCSD, 제4 저자), Bernhard O. Palsson (UCSD, 제5 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
2023.11.24 조회수 9254 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 10793
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 10793 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 8843
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 8843 정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15 조회수 9430
정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15 조회수 9430 파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
2023.05.08 조회수 7395
파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
2023.05.08 조회수 7395