-
 이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
2019.07.03
조회수 25059
-
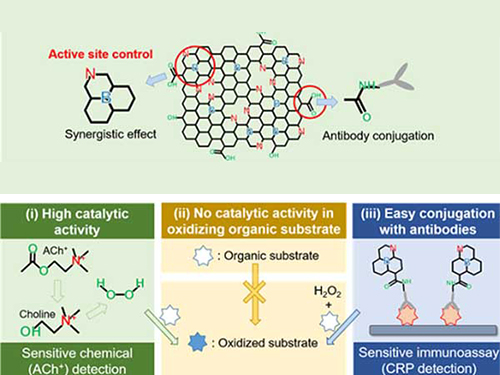 이진우 교수, 그래핀 기반의 자연 효소 모방물질 개발
〈 이진우 교수 〉
우리 대학 생명화학공학과 이진우 교수 연구팀이 그래핀을 기반으로 해 과산화효소의 선택성과 활성을 모방한 나노단위 크기의 무기 소재(나노자임, Nanozyme)를 합성하는 데 성공했다.
연구팀은 이 무기 소재를 이용하면 알츠하이머병 조기 진단과 관련된 신경전달물질인 아세틸콜린을 자연 효소를 이용했을 때보다 더 민감하게 검출할 수 있음을 확인했다.
가천대학교 바이오나노학과 김문일 교수, UNIST 에너지화학공학부 곽상규 교수팀과 공동으로 연구하고 김민수 박사가 1 저자로 참여한 이번 연구는 재료 분야 국제 학술지 ‘에이씨에스 나노(ACS Nano)’ 3월 25일자에 게재됐다. (논문명 : N and B Codoped Graphene: A Strong Candidate To Replace Natural Peroxidase in Sensitive and Selective Bioassays , 질소와 붕소가 동시에 도핑된 그래핀: 민감하고 선택성이 있는 바이오에세이에 사용되는 자연의 과산화효소를 대체할 수 있는 강력한 후보)
효소는 우리의 몸 속 다양한 화학 반응에 촉매로 참여하고 있다. 각각의 효소는 구조가 매우 복잡해 체내에서 특정 온도와 환경에서 원하는 특정 반응에만 촉매 역할을 할 수 있다.
특히 과산화효소는 과산화수소와 반응하면 푸른 색을 띠기 때문에 과산화수소를 시각적으로 검출할 수 있다. 이를 이용해 산화 과정에서 아세틸콜린을 포함한 과산화수소를 배출하는 다양한 물질을 시각적으로 검출할 수 있다는 장점이 있다.
대신 효소는 안정성, 생산성이 낮고 가격이 비싸다는 단점이 있다. 단백질로 이뤄진 효소와 달리 무기물질로 합성된 효소 모방 물질은 기존 효소의 단점을 해소할 수 있어 효소의 역할인 질병의 검출 및 진단 시스템에 활용할 수 있다. 따라서 효소의 활성을 정확히 모방하는 나노물질의 필요성이 커지고 있다.
그러나 효소를 모방하는 나노물질은 활성을 모방하는 것이 가능하지만 원하지 않은 다른 부가적인 반응을 일으킬 수 있다는 단점이 있어 효소를 대체하는 데 어려움이 있다. 특히 기존의 과산화효소 활성이 높은 물질은 과산화수소가 없는 상황에서도 색이 변하기 때문에 검출 물질이 없어도 발색이 되는 단점이 있다.
문제 해결을 위해 연구팀은 과산화효소 활성만을 선택적으로 모방하는 질소와 붕소가 동시에 도핑된 그래핀을 합성했다. 이 그래핀의 경우 과산화수소 활성은 폭발적으로 증가하지만 다른 효소 활성은 거의 증가하지 않아 과산화효소를 정확하게 모방할 수 있다.
연구팀은 실험적 내용을 계산화학을 통해 증명했으며 새롭게 개발한 물질을 이용해 중요 신경전달 물질인 아세틸콜린을 시각적으로 검출하는 데 성공했다.
아세틸콜린은 알츠하이머병의 조기 진단과 관련이 높아 연구팀의 효소모방 물질을 이용하면 향후 질병 진단 및 치료에 기여할 수 있을 것으로 예상된다.
이 교수는 “효소 모방 물질은 오래되지 않은 분야이지만 기존 효소를 대체할 수 있다는 잠재성 때문에 관심이 폭발적으로 커지고 있다”라며 “이번 연구를 통해 효소의 높은 활성 뿐 아니라 선택성까지 가질 수 있는 물질을 합성하고 알츠하이머의 진단 마커인 아세틸콜린을 효과적으로 시각적 검출할 수 있는 기술을 확보했다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업 중견연구자지원사업을 통해 수행됐다.
□ 그림 설명
그림1. 촉매의 과산화효소와 산화효소 활성을 시각적으로 확인할 수 있는 사진
그림2. 질소와 붕소가 동시에 도핑된 그래핀의 바이오 에세이 적용
이진우 교수, 그래핀 기반의 자연 효소 모방물질 개발
〈 이진우 교수 〉
우리 대학 생명화학공학과 이진우 교수 연구팀이 그래핀을 기반으로 해 과산화효소의 선택성과 활성을 모방한 나노단위 크기의 무기 소재(나노자임, Nanozyme)를 합성하는 데 성공했다.
연구팀은 이 무기 소재를 이용하면 알츠하이머병 조기 진단과 관련된 신경전달물질인 아세틸콜린을 자연 효소를 이용했을 때보다 더 민감하게 검출할 수 있음을 확인했다.
가천대학교 바이오나노학과 김문일 교수, UNIST 에너지화학공학부 곽상규 교수팀과 공동으로 연구하고 김민수 박사가 1 저자로 참여한 이번 연구는 재료 분야 국제 학술지 ‘에이씨에스 나노(ACS Nano)’ 3월 25일자에 게재됐다. (논문명 : N and B Codoped Graphene: A Strong Candidate To Replace Natural Peroxidase in Sensitive and Selective Bioassays , 질소와 붕소가 동시에 도핑된 그래핀: 민감하고 선택성이 있는 바이오에세이에 사용되는 자연의 과산화효소를 대체할 수 있는 강력한 후보)
효소는 우리의 몸 속 다양한 화학 반응에 촉매로 참여하고 있다. 각각의 효소는 구조가 매우 복잡해 체내에서 특정 온도와 환경에서 원하는 특정 반응에만 촉매 역할을 할 수 있다.
특히 과산화효소는 과산화수소와 반응하면 푸른 색을 띠기 때문에 과산화수소를 시각적으로 검출할 수 있다. 이를 이용해 산화 과정에서 아세틸콜린을 포함한 과산화수소를 배출하는 다양한 물질을 시각적으로 검출할 수 있다는 장점이 있다.
대신 효소는 안정성, 생산성이 낮고 가격이 비싸다는 단점이 있다. 단백질로 이뤄진 효소와 달리 무기물질로 합성된 효소 모방 물질은 기존 효소의 단점을 해소할 수 있어 효소의 역할인 질병의 검출 및 진단 시스템에 활용할 수 있다. 따라서 효소의 활성을 정확히 모방하는 나노물질의 필요성이 커지고 있다.
그러나 효소를 모방하는 나노물질은 활성을 모방하는 것이 가능하지만 원하지 않은 다른 부가적인 반응을 일으킬 수 있다는 단점이 있어 효소를 대체하는 데 어려움이 있다. 특히 기존의 과산화효소 활성이 높은 물질은 과산화수소가 없는 상황에서도 색이 변하기 때문에 검출 물질이 없어도 발색이 되는 단점이 있다.
문제 해결을 위해 연구팀은 과산화효소 활성만을 선택적으로 모방하는 질소와 붕소가 동시에 도핑된 그래핀을 합성했다. 이 그래핀의 경우 과산화수소 활성은 폭발적으로 증가하지만 다른 효소 활성은 거의 증가하지 않아 과산화효소를 정확하게 모방할 수 있다.
연구팀은 실험적 내용을 계산화학을 통해 증명했으며 새롭게 개발한 물질을 이용해 중요 신경전달 물질인 아세틸콜린을 시각적으로 검출하는 데 성공했다.
아세틸콜린은 알츠하이머병의 조기 진단과 관련이 높아 연구팀의 효소모방 물질을 이용하면 향후 질병 진단 및 치료에 기여할 수 있을 것으로 예상된다.
이 교수는 “효소 모방 물질은 오래되지 않은 분야이지만 기존 효소를 대체할 수 있다는 잠재성 때문에 관심이 폭발적으로 커지고 있다”라며 “이번 연구를 통해 효소의 높은 활성 뿐 아니라 선택성까지 가질 수 있는 물질을 합성하고 알츠하이머의 진단 마커인 아세틸콜린을 효과적으로 시각적 검출할 수 있는 기술을 확보했다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업 중견연구자지원사업을 통해 수행됐다.
□ 그림 설명
그림1. 촉매의 과산화효소와 산화효소 활성을 시각적으로 확인할 수 있는 사진
그림2. 질소와 붕소가 동시에 도핑된 그래핀의 바이오 에세이 적용
2019.04.23
조회수 20411
-
 허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21
조회수 11073
-
 박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22
조회수 21389
-
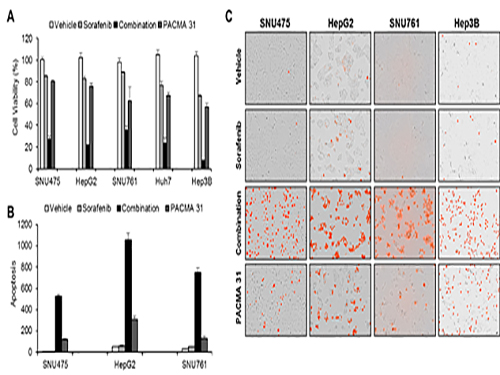 조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24
조회수 22360
-
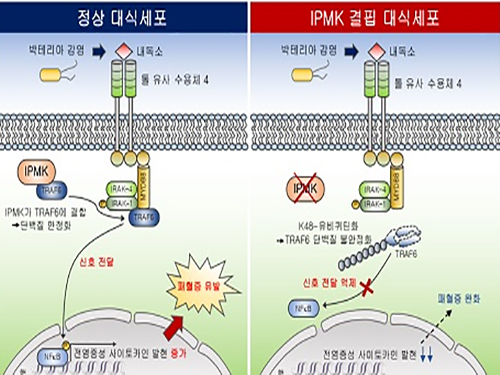 김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25
조회수 23690
-
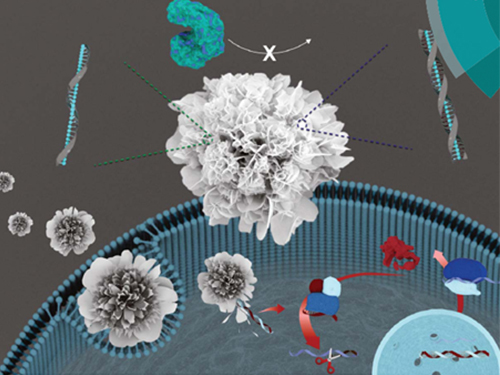 박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14
조회수 22487
-
 빛을 이용한 약물효소반응 촉진 플랫폼 개발
우리 대학 신소재공학과 박찬범 교수와 생명화학공학과 정기준 교수 연구팀은 빛으로 약물효소반응을 유도할 수 있는 새로운 반응 플랫폼을 개발했다.
연구결과는 지난 12일, 화학분야의 세계적 학술지인 ‘앙게반테 케미’에 후면 표지논문으로 게재됐다.
이 기술을 활용하면 저가의 염료로 고지혈증 등의 심혈관질환 치료제 및 오메프라졸과 같은 위궤양 치료제 등 고부가가치 의약품 생산이 가능할 것으로 보인다.
시토크롬 P450(cytochrome P450)은 생물체 안에서 약물 및 호르몬 등의 대사 과정에서 중요한 산화반응을 수행하는 효소이다. 사람에게 투여되는 약물의 75% 이상의 대사를 담당하고 있기 때문에 신약개발 과정에서 핵심적인 요소로 알려져 있다.
시토크롬 P450의 활성화를 위해선 환원효소로부터 전자를 받아야 하며 전달물질인 NADPH(생물 세포 내의 조효소)가 필요하다. 하지만 NADPH의 높은 가격 때문에 시토크롬 P450의 활용은 실험실 수준에 머무르고 있었으며, 산업적 활용에도 제 역할을 다하지 못했다.
연구팀은 NADPH 대신 빛에 반응하는 감광제인 에오신 Y를 활용해 대장균 기반의 ‘전세포 광-생촉매’ 방법을 개발했다. 저가의 에오신 Y를 빛에 노출시켜 시토크롬 P450의 효소반응을 촉진하여 고가의 대사물질을 생산한다는 원리다.
박 교수는 “이번 연구를 통해 산업적 활용에 제한이 컸던 시토크롬 P450 효소의 활용이 수월해졌다” 며 “우리의 기술은 시토크롬 P450 효소가 고부가가치 의약 물질을 생산하는데 큰 도움을 줄 것이다”라고 말했다.
박찬범, 정기준 교수(교신저자)의 지도아래 박종현 박사과정 학생, 이상하 박사가 주저자로 참여한 이번 연구는 한국연구재단이 추진하는 중견연구자사업과 글로벌프론티어사업, KAIST HRHRP (High Risk High Return Project)의 지원으로 수행됐다.
□ 그림설명
그림1. 빛으로부터 에오신 와이 (eosin Y, EY)를 통해 시토크롬 P450 효소로 전자를 전달하는 모식도
그림2. 연구결과를 설명하는 1월 12일자 ‘앙게반테 케미’ 후면 논문 표지
빛을 이용한 약물효소반응 촉진 플랫폼 개발
우리 대학 신소재공학과 박찬범 교수와 생명화학공학과 정기준 교수 연구팀은 빛으로 약물효소반응을 유도할 수 있는 새로운 반응 플랫폼을 개발했다.
연구결과는 지난 12일, 화학분야의 세계적 학술지인 ‘앙게반테 케미’에 후면 표지논문으로 게재됐다.
이 기술을 활용하면 저가의 염료로 고지혈증 등의 심혈관질환 치료제 및 오메프라졸과 같은 위궤양 치료제 등 고부가가치 의약품 생산이 가능할 것으로 보인다.
시토크롬 P450(cytochrome P450)은 생물체 안에서 약물 및 호르몬 등의 대사 과정에서 중요한 산화반응을 수행하는 효소이다. 사람에게 투여되는 약물의 75% 이상의 대사를 담당하고 있기 때문에 신약개발 과정에서 핵심적인 요소로 알려져 있다.
시토크롬 P450의 활성화를 위해선 환원효소로부터 전자를 받아야 하며 전달물질인 NADPH(생물 세포 내의 조효소)가 필요하다. 하지만 NADPH의 높은 가격 때문에 시토크롬 P450의 활용은 실험실 수준에 머무르고 있었으며, 산업적 활용에도 제 역할을 다하지 못했다.
연구팀은 NADPH 대신 빛에 반응하는 감광제인 에오신 Y를 활용해 대장균 기반의 ‘전세포 광-생촉매’ 방법을 개발했다. 저가의 에오신 Y를 빛에 노출시켜 시토크롬 P450의 효소반응을 촉진하여 고가의 대사물질을 생산한다는 원리다.
박 교수는 “이번 연구를 통해 산업적 활용에 제한이 컸던 시토크롬 P450 효소의 활용이 수월해졌다” 며 “우리의 기술은 시토크롬 P450 효소가 고부가가치 의약 물질을 생산하는데 큰 도움을 줄 것이다”라고 말했다.
박찬범, 정기준 교수(교신저자)의 지도아래 박종현 박사과정 학생, 이상하 박사가 주저자로 참여한 이번 연구는 한국연구재단이 추진하는 중견연구자사업과 글로벌프론티어사업, KAIST HRHRP (High Risk High Return Project)의 지원으로 수행됐다.
□ 그림설명
그림1. 빛으로부터 에오신 와이 (eosin Y, EY)를 통해 시토크롬 P450 효소로 전자를 전달하는 모식도
그림2. 연구결과를 설명하는 1월 12일자 ‘앙게반테 케미’ 후면 논문 표지
2015.01.21
조회수 19933
-
 단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
2014.04.25
조회수 20545
-
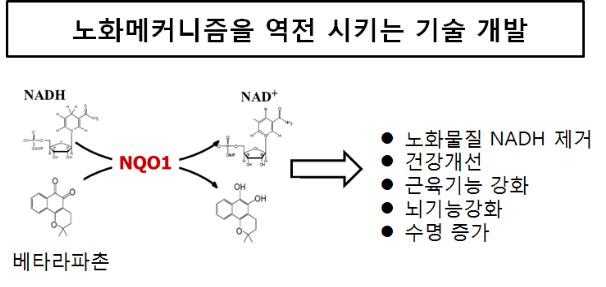 노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
2012.10.24
조회수 22498
-
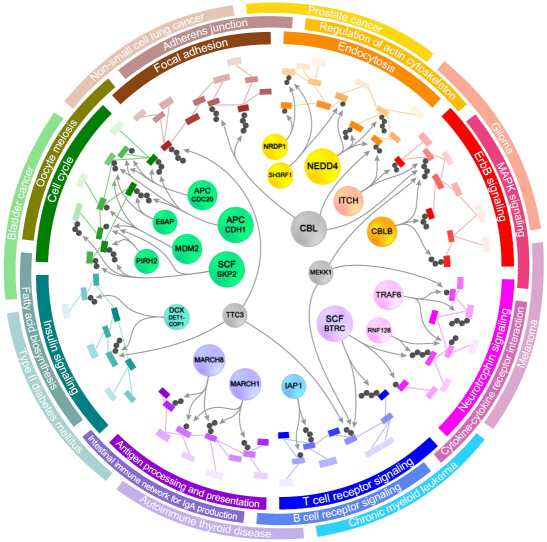 단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
2012.05.01
조회수 25505
-
 간단하고 저렴한 유전자 진단 기술 개발
- “유전자 진단의 시간과 비용을 획기적으로 절감할 수 있어”- 분석화학분야 세계적 학술지‘아날리스트’4월호 표지논문 선정
우리학교 박현규 생명화학공학과 교수가 전기화학적 활성을 가진 핵산 결합 분자인 메틸렌 블루(Methylene Blue)를 이용해 전기화학적 실시간 중합효소 연쇄 반응(Real-Time PCR) 기술을 개발했다.
현재 유전자 분석 분야에서 가장 널리 사용되고 있는 Real-Time PCR(Polymerase Chain Reaction) 방법은 형광 신호를 이용하기 때문에 고가의 장비와 시약이 사용되는 분석 기술이다.
이에 반해 전기화학적 방법은 사용이 간편하고 가격이 저렴하며, 무엇보다 분석 장치를 소형화 할 수 있는 이점이 있다.
박 교수 연구팀은 산화/환원을 통해 전기화학적인 신호를 발생하는 물질인 메틸렌 블루가 핵산과 결합하면 전기화학적 신호가 감소하는 현상에 착안, 이를 PCR에 적용해 핵산의 증폭 과정을 전기화학적 신호를 통해 실시간으로 검출할 수 있는 전기화학적 Real-Time PCR을 구현하는 데 성공했다.
또한, 이 신호 변화 현상이 메틸렌 블루의 확산 계수와 관련된 것임을 규명해 향후 다양한 방법으로 응용될 수 있는 신호 발생을 기반으로 한 기술도 확립했다.
연구팀은 이를 기반으로 전극이 인쇄된 작은 칩을 제작해 성병 유발 병원균인 클라미디아 트라코마티스(Chlamydia trachomatis)의 유전자를 대상으로 연구를 수행했다.
그 결과 기존 형광 기반의 Real-Time PCR과 거의 동일한 성능을 보였다. 따라서 다양한 질병 진단을 비롯해 다양한 유전자 연구 분야에 적용할 수 있음을 입증했다.
박현규 교수는 “Real-Time PCR 기술이 현재 유전자 진단 분야에서 가장 확실한 분석 방법임에도 불구하고 형광 기반의 분석 방법이다 보니 고가의 검출 장비 및 분석 시약을 필요로 한다”며 “이번 연구 결과로 유전자 진단에 소요되는 시간과 비용을 획기적으로 절감할 수 있다”라고 설명했다.
한편, 이번 연구는 한국연구재단(이사장 오세정)이 시행하는 ‘중견연구자 지원 사업(도약연구)’으로 수행됐으며, 연구의 중요성을 인정받아 분석화학 분야의 세계적인 학술지인 ‘아날리스트(The Analyst)’ 4월호(4월 21일자) 표지논문으로 선정됐다.(끝)
<그림설명>신호 분자 결합에 의한 전기화학적 Real-Time PCR 모식도 (아날리스트 표지)
<용어설명>○ Real-Time PCR (실시간 중합효소연쇄반응): 중합효소연쇄 반응을 통해 증폭되는 핵산을 실시간으로 모니터링을 하고 해석하는 기술
○ PCR: (Polymerase Chain Reaction, 중합효소 연쇄 반응): 현재 유전물질을 조작해 실험하는 거의 모든 과정에 사용되는 검사법으로, 검출을 원하는 특정 표적 유전물질을 증폭하는 방법이다. 1985년에 캐리 멀리스(Kary B. Mullis)에 의해 개발됐다.
○ Chlamydia Trachomatis: 클라미디아 트라코마티스(chlamydia trachomatis)라는 병원균에 의한 성병으로 성적 접촉으로 점염되어 비뇨생식계에 질병을 일으키는 감염증의 가장 흔한 원인균.
간단하고 저렴한 유전자 진단 기술 개발
- “유전자 진단의 시간과 비용을 획기적으로 절감할 수 있어”- 분석화학분야 세계적 학술지‘아날리스트’4월호 표지논문 선정
우리학교 박현규 생명화학공학과 교수가 전기화학적 활성을 가진 핵산 결합 분자인 메틸렌 블루(Methylene Blue)를 이용해 전기화학적 실시간 중합효소 연쇄 반응(Real-Time PCR) 기술을 개발했다.
현재 유전자 분석 분야에서 가장 널리 사용되고 있는 Real-Time PCR(Polymerase Chain Reaction) 방법은 형광 신호를 이용하기 때문에 고가의 장비와 시약이 사용되는 분석 기술이다.
이에 반해 전기화학적 방법은 사용이 간편하고 가격이 저렴하며, 무엇보다 분석 장치를 소형화 할 수 있는 이점이 있다.
박 교수 연구팀은 산화/환원을 통해 전기화학적인 신호를 발생하는 물질인 메틸렌 블루가 핵산과 결합하면 전기화학적 신호가 감소하는 현상에 착안, 이를 PCR에 적용해 핵산의 증폭 과정을 전기화학적 신호를 통해 실시간으로 검출할 수 있는 전기화학적 Real-Time PCR을 구현하는 데 성공했다.
또한, 이 신호 변화 현상이 메틸렌 블루의 확산 계수와 관련된 것임을 규명해 향후 다양한 방법으로 응용될 수 있는 신호 발생을 기반으로 한 기술도 확립했다.
연구팀은 이를 기반으로 전극이 인쇄된 작은 칩을 제작해 성병 유발 병원균인 클라미디아 트라코마티스(Chlamydia trachomatis)의 유전자를 대상으로 연구를 수행했다.
그 결과 기존 형광 기반의 Real-Time PCR과 거의 동일한 성능을 보였다. 따라서 다양한 질병 진단을 비롯해 다양한 유전자 연구 분야에 적용할 수 있음을 입증했다.
박현규 교수는 “Real-Time PCR 기술이 현재 유전자 진단 분야에서 가장 확실한 분석 방법임에도 불구하고 형광 기반의 분석 방법이다 보니 고가의 검출 장비 및 분석 시약을 필요로 한다”며 “이번 연구 결과로 유전자 진단에 소요되는 시간과 비용을 획기적으로 절감할 수 있다”라고 설명했다.
한편, 이번 연구는 한국연구재단(이사장 오세정)이 시행하는 ‘중견연구자 지원 사업(도약연구)’으로 수행됐으며, 연구의 중요성을 인정받아 분석화학 분야의 세계적인 학술지인 ‘아날리스트(The Analyst)’ 4월호(4월 21일자) 표지논문으로 선정됐다.(끝)
<그림설명>신호 분자 결합에 의한 전기화학적 Real-Time PCR 모식도 (아날리스트 표지)
<용어설명>○ Real-Time PCR (실시간 중합효소연쇄반응): 중합효소연쇄 반응을 통해 증폭되는 핵산을 실시간으로 모니터링을 하고 해석하는 기술
○ PCR: (Polymerase Chain Reaction, 중합효소 연쇄 반응): 현재 유전물질을 조작해 실험하는 거의 모든 과정에 사용되는 검사법으로, 검출을 원하는 특정 표적 유전물질을 증폭하는 방법이다. 1985년에 캐리 멀리스(Kary B. Mullis)에 의해 개발됐다.
○ Chlamydia Trachomatis: 클라미디아 트라코마티스(chlamydia trachomatis)라는 병원균에 의한 성병으로 성적 접촉으로 점염되어 비뇨생식계에 질병을 일으키는 감염증의 가장 흔한 원인균.
2011.04.21
조회수 20522
 이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
2019.07.03 조회수 25059
이상엽 특훈교수, 김현욱 교수, 인공지능 이용한 효소기능 예측 기술 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수의 초세대 협업연구실 공동연구팀이 딥러닝(deep learning) 기술을 이용해 효소의 기능을 신속하고 정확하게 예측할 수 있는 컴퓨터 방법론 DeepEC를 개발했다.
공동연구팀의 류재용 박사가 1 저자로 참여한 이번 연구결과는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 6월 20일 자 온라인판에 게재됐다. (논문명 : Deep learning enables high-quality and high-throughput prediction of enzyme commission numbers)
효소는 세포 내의 생화학반응들을 촉진하는 단백질 촉매로 이들의 기능을 정확히 이해하는 것은 세포의 대사(metabolism) 과정을 이해하는 데에 매우 중요하다.
특히 효소들은 다양한 질병 발생 원리 및 산업 생명공학과 밀접한 연관이 있어 방대한 게놈 정보에서 효소들의 기능을 빠르고 정확하게 예측하는 기술은 응용기술 측면에서도 중요하다.
효소의 기능을 표기하는 시스템 중 대표적인 것이 EC 번호(enzyme commission number)이다. EC 번호는 ‘EC 3.4.11.4’처럼 효소가 매개하는 생화학반응들의 종류에 따라 총 4개의 숫자로 구성돼 있다.
중요한 것은 특정 효소에 주어진 EC 번호를 통해서 해당 효소가 어떠한 종류의 생화학반응을 매개하는지 알 수 있다는 것이다. 따라서 게놈으로부터 얻을 수 있는 효소 단백질 서열의 EC 번호를 빠르고 정확하게 예측할 수 있는 기술은 효소 및 대사 관련 문제를 해결하는 데 중요한 역할을 한다.
작년까지 여러 해에 걸쳐 EC 번호를 예측해주는 컴퓨터 방법론들이 최소 10개 이상 개발됐다. 그러나 이들 모두 예측 속도, 예측 정확성 및 예측 가능 범위 측면에서 발전 필요성이 있었다. 특히 현대 생명과학 및 생명공학에서 이뤄지는 연구의 속도와 규모를 고려했을 때 이러한 방법론의 성능은 충분하지 않았다.
공동연구팀은 1,388,606개의 단백질 서열과 이들에게 신뢰성 있게 부여된 EC 번호를 담고 있는 바이오 빅데이터에 딥러닝 기술을 적용해 EC 번호를 빠르고 정확하게 예측할 수 있는 DeepEC를 개발했다.
DeepEC는 주어진 단백질 서열의 EC 번호를 예측하기 위해서 3개의 합성곱 신경망(Convolutional neural network)을 주요 예측기술로 사용하며, 합성곱 신경망으로 EC 번호를 예측하지 못했을 경우 서열정렬(sequence alignment)을 통해서 EC 번호를 예측한다.
연구팀은 더 나아가 단백질 서열의 도메인(domain)과 기질 결합 부위 잔기(binding site residue)에 변이를 인위적으로 주었을 때, DeepEC가 가장 민감하게 해당 변이의 영향을 감지하는 것을 확인했다.
김현욱 교수는 “DeepEC의 성능을 평가하기 위해서 이전에 발표된 5개의 대표적인 EC 번호 예측 방법론과 비교해보니 DeepEC가 가장 빠르고 정확하게 주어진 단백질의 EC 번호를 예측하는 것으로 나타났다”라며 “효소 기능 연구에 크게 이바지할 것으로 기대한다”라고 말했다.
이상엽 특훈교수는 “이번에 개발한 DeepEC를 통해서 지속해서 재생되는 게놈 및 메타 게놈에 존재하는 방대한 효소 단백질 서열의 기능을 보다 효율적이고 정확하게 알아내는 것이 가능해졌다”라고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 및 바이오·의료기술 개발 Korea Bio Grand Challenge 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 인공지능 기반의 DeepEC를 이용한 효소 기능 EC 번호 예측
2019.07.03 조회수 25059 이진우 교수, 그래핀 기반의 자연 효소 모방물질 개발
〈 이진우 교수 〉
우리 대학 생명화학공학과 이진우 교수 연구팀이 그래핀을 기반으로 해 과산화효소의 선택성과 활성을 모방한 나노단위 크기의 무기 소재(나노자임, Nanozyme)를 합성하는 데 성공했다.
연구팀은 이 무기 소재를 이용하면 알츠하이머병 조기 진단과 관련된 신경전달물질인 아세틸콜린을 자연 효소를 이용했을 때보다 더 민감하게 검출할 수 있음을 확인했다.
가천대학교 바이오나노학과 김문일 교수, UNIST 에너지화학공학부 곽상규 교수팀과 공동으로 연구하고 김민수 박사가 1 저자로 참여한 이번 연구는 재료 분야 국제 학술지 ‘에이씨에스 나노(ACS Nano)’ 3월 25일자에 게재됐다. (논문명 : N and B Codoped Graphene: A Strong Candidate To Replace Natural Peroxidase in Sensitive and Selective Bioassays , 질소와 붕소가 동시에 도핑된 그래핀: 민감하고 선택성이 있는 바이오에세이에 사용되는 자연의 과산화효소를 대체할 수 있는 강력한 후보)
효소는 우리의 몸 속 다양한 화학 반응에 촉매로 참여하고 있다. 각각의 효소는 구조가 매우 복잡해 체내에서 특정 온도와 환경에서 원하는 특정 반응에만 촉매 역할을 할 수 있다.
특히 과산화효소는 과산화수소와 반응하면 푸른 색을 띠기 때문에 과산화수소를 시각적으로 검출할 수 있다. 이를 이용해 산화 과정에서 아세틸콜린을 포함한 과산화수소를 배출하는 다양한 물질을 시각적으로 검출할 수 있다는 장점이 있다.
대신 효소는 안정성, 생산성이 낮고 가격이 비싸다는 단점이 있다. 단백질로 이뤄진 효소와 달리 무기물질로 합성된 효소 모방 물질은 기존 효소의 단점을 해소할 수 있어 효소의 역할인 질병의 검출 및 진단 시스템에 활용할 수 있다. 따라서 효소의 활성을 정확히 모방하는 나노물질의 필요성이 커지고 있다.
그러나 효소를 모방하는 나노물질은 활성을 모방하는 것이 가능하지만 원하지 않은 다른 부가적인 반응을 일으킬 수 있다는 단점이 있어 효소를 대체하는 데 어려움이 있다. 특히 기존의 과산화효소 활성이 높은 물질은 과산화수소가 없는 상황에서도 색이 변하기 때문에 검출 물질이 없어도 발색이 되는 단점이 있다.
문제 해결을 위해 연구팀은 과산화효소 활성만을 선택적으로 모방하는 질소와 붕소가 동시에 도핑된 그래핀을 합성했다. 이 그래핀의 경우 과산화수소 활성은 폭발적으로 증가하지만 다른 효소 활성은 거의 증가하지 않아 과산화효소를 정확하게 모방할 수 있다.
연구팀은 실험적 내용을 계산화학을 통해 증명했으며 새롭게 개발한 물질을 이용해 중요 신경전달 물질인 아세틸콜린을 시각적으로 검출하는 데 성공했다.
아세틸콜린은 알츠하이머병의 조기 진단과 관련이 높아 연구팀의 효소모방 물질을 이용하면 향후 질병 진단 및 치료에 기여할 수 있을 것으로 예상된다.
이 교수는 “효소 모방 물질은 오래되지 않은 분야이지만 기존 효소를 대체할 수 있다는 잠재성 때문에 관심이 폭발적으로 커지고 있다”라며 “이번 연구를 통해 효소의 높은 활성 뿐 아니라 선택성까지 가질 수 있는 물질을 합성하고 알츠하이머의 진단 마커인 아세틸콜린을 효과적으로 시각적 검출할 수 있는 기술을 확보했다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업 중견연구자지원사업을 통해 수행됐다.
□ 그림 설명
그림1. 촉매의 과산화효소와 산화효소 활성을 시각적으로 확인할 수 있는 사진
그림2. 질소와 붕소가 동시에 도핑된 그래핀의 바이오 에세이 적용
2019.04.23 조회수 20411
이진우 교수, 그래핀 기반의 자연 효소 모방물질 개발
〈 이진우 교수 〉
우리 대학 생명화학공학과 이진우 교수 연구팀이 그래핀을 기반으로 해 과산화효소의 선택성과 활성을 모방한 나노단위 크기의 무기 소재(나노자임, Nanozyme)를 합성하는 데 성공했다.
연구팀은 이 무기 소재를 이용하면 알츠하이머병 조기 진단과 관련된 신경전달물질인 아세틸콜린을 자연 효소를 이용했을 때보다 더 민감하게 검출할 수 있음을 확인했다.
가천대학교 바이오나노학과 김문일 교수, UNIST 에너지화학공학부 곽상규 교수팀과 공동으로 연구하고 김민수 박사가 1 저자로 참여한 이번 연구는 재료 분야 국제 학술지 ‘에이씨에스 나노(ACS Nano)’ 3월 25일자에 게재됐다. (논문명 : N and B Codoped Graphene: A Strong Candidate To Replace Natural Peroxidase in Sensitive and Selective Bioassays , 질소와 붕소가 동시에 도핑된 그래핀: 민감하고 선택성이 있는 바이오에세이에 사용되는 자연의 과산화효소를 대체할 수 있는 강력한 후보)
효소는 우리의 몸 속 다양한 화학 반응에 촉매로 참여하고 있다. 각각의 효소는 구조가 매우 복잡해 체내에서 특정 온도와 환경에서 원하는 특정 반응에만 촉매 역할을 할 수 있다.
특히 과산화효소는 과산화수소와 반응하면 푸른 색을 띠기 때문에 과산화수소를 시각적으로 검출할 수 있다. 이를 이용해 산화 과정에서 아세틸콜린을 포함한 과산화수소를 배출하는 다양한 물질을 시각적으로 검출할 수 있다는 장점이 있다.
대신 효소는 안정성, 생산성이 낮고 가격이 비싸다는 단점이 있다. 단백질로 이뤄진 효소와 달리 무기물질로 합성된 효소 모방 물질은 기존 효소의 단점을 해소할 수 있어 효소의 역할인 질병의 검출 및 진단 시스템에 활용할 수 있다. 따라서 효소의 활성을 정확히 모방하는 나노물질의 필요성이 커지고 있다.
그러나 효소를 모방하는 나노물질은 활성을 모방하는 것이 가능하지만 원하지 않은 다른 부가적인 반응을 일으킬 수 있다는 단점이 있어 효소를 대체하는 데 어려움이 있다. 특히 기존의 과산화효소 활성이 높은 물질은 과산화수소가 없는 상황에서도 색이 변하기 때문에 검출 물질이 없어도 발색이 되는 단점이 있다.
문제 해결을 위해 연구팀은 과산화효소 활성만을 선택적으로 모방하는 질소와 붕소가 동시에 도핑된 그래핀을 합성했다. 이 그래핀의 경우 과산화수소 활성은 폭발적으로 증가하지만 다른 효소 활성은 거의 증가하지 않아 과산화효소를 정확하게 모방할 수 있다.
연구팀은 실험적 내용을 계산화학을 통해 증명했으며 새롭게 개발한 물질을 이용해 중요 신경전달 물질인 아세틸콜린을 시각적으로 검출하는 데 성공했다.
아세틸콜린은 알츠하이머병의 조기 진단과 관련이 높아 연구팀의 효소모방 물질을 이용하면 향후 질병 진단 및 치료에 기여할 수 있을 것으로 예상된다.
이 교수는 “효소 모방 물질은 오래되지 않은 분야이지만 기존 효소를 대체할 수 있다는 잠재성 때문에 관심이 폭발적으로 커지고 있다”라며 “이번 연구를 통해 효소의 높은 활성 뿐 아니라 선택성까지 가질 수 있는 물질을 합성하고 알츠하이머의 진단 마커인 아세틸콜린을 효과적으로 시각적 검출할 수 있는 기술을 확보했다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업 중견연구자지원사업을 통해 수행됐다.
□ 그림 설명
그림1. 촉매의 과산화효소와 산화효소 활성을 시각적으로 확인할 수 있는 사진
그림2. 질소와 붕소가 동시에 도핑된 그래핀의 바이오 에세이 적용
2019.04.23 조회수 20411 허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21 조회수 11073
허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21 조회수 11073 박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21389
박현규 교수, RNA 분해효소의 활성 검출기술 개발
〈 이 창 열 박사과정 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 새로운 RNA 분해효소(RNase H)의 활성을 검출하는 기술을 개발했다.
연구팀은 헤어핀 자기조립 반응이라는 고효율의 신호증폭 반응을 이용해 RNA 분해효소의 활성을 효과적으로 분석하는 기술을 개발했다.
RNA 분해효소가 HIV 바이러스 증식에 필수적으로 관여하는 물질임을 고려할 때 박 교수 연구팀의 연구가 향후 에이즈를 치료하는 데 기여할 수 있을 것으로 기대된다.
이창열, 장효원 박사과정이 공동 1저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 ‘나노스케일(Nanoscale)’ 2017년도 42호(11월 14일 발행) 표지논문으로 선정됐다.
현재 개발된 RNA 분해효소의 활성을 검출하는 기술들은 일반적으로 값비싼 형광체, 소광체가 필수적이고 그 도입 과정도 복잡하다는 한계가 있다. 또한 신호를 증폭시킬 수단이 없기 때문에 전반적으로 검출 성능이 매우 낮다.
연구팀은 기술의 한계를 극복하기 위해 헤어핀 자기조립 반응이라는 기술을 이용했다. 이 기술은 검출신호를 증폭시켜 RNA 분해효소 활성이 더 민감하게 검출될 수 있도록 도와준다.
그리고 연구팀은 이 헤어핀 자기조립 반응의 결과물이 형광신호의 발생에 적합한 지-쿼드러플렉스(G-quadruplex) 구조를 갖도록 반응시스템을 설계했다. 지-쿼드러플렉스 구조와 결합해 강한 형광을 내는 형광물질을 사용함으로써 기존의 RNA 분해효소 활성 검출 기술의 한계를 극복하는 고성능의 RNA 분해효소 활성 검출 기술을 개발했다.
또한 이 기술을 이용해 RNA 분해효소의 활성 저해제를 선별할 수 있었다.
연구팀의 연구 성과는 일반에 잘 알려진 에이즈를 치료하는 데 기여할 수 있을 것으로 예상된다. 에이즈는 HIV 바이러스가 발병하면 나타나는 전염병으로 HIV 바이러스는 역전사 반응의 특성을 갖는 일명 레트로 바이러스이다.
레트로 바이러스는 RNA가 DNA로 변하는 특성을 갖는다. 그리고 이 과정에서 RNA 분해효소가 개입해야만 이 특성을 유지할 수 있다. RNA 분해효소의 활성을 막을 수 있다면 HIV 바이러스의 발현을 막을 수 있는 것이다.
박 교수는 “이번 연구에서 개발된 기술은 RNA 분해효소의 활성 외에도 다양한 효소 활성 검출 기술 개발에 응용 가능하다”며 “이를 통해 효소 관련 질병 치료 연구에 다양하게 활용될 수 있을 것으로 기대한다”고 말했다.
이번 연구는 과학기술정보통신부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 나노스케일 42호 표지
2017.11.22 조회수 21389 조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 22360
조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 22360 김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25 조회수 23690
김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25 조회수 23690 박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14 조회수 22487
박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14 조회수 22487 빛을 이용한 약물효소반응 촉진 플랫폼 개발
우리 대학 신소재공학과 박찬범 교수와 생명화학공학과 정기준 교수 연구팀은 빛으로 약물효소반응을 유도할 수 있는 새로운 반응 플랫폼을 개발했다.
연구결과는 지난 12일, 화학분야의 세계적 학술지인 ‘앙게반테 케미’에 후면 표지논문으로 게재됐다.
이 기술을 활용하면 저가의 염료로 고지혈증 등의 심혈관질환 치료제 및 오메프라졸과 같은 위궤양 치료제 등 고부가가치 의약품 생산이 가능할 것으로 보인다.
시토크롬 P450(cytochrome P450)은 생물체 안에서 약물 및 호르몬 등의 대사 과정에서 중요한 산화반응을 수행하는 효소이다. 사람에게 투여되는 약물의 75% 이상의 대사를 담당하고 있기 때문에 신약개발 과정에서 핵심적인 요소로 알려져 있다.
시토크롬 P450의 활성화를 위해선 환원효소로부터 전자를 받아야 하며 전달물질인 NADPH(생물 세포 내의 조효소)가 필요하다. 하지만 NADPH의 높은 가격 때문에 시토크롬 P450의 활용은 실험실 수준에 머무르고 있었으며, 산업적 활용에도 제 역할을 다하지 못했다.
연구팀은 NADPH 대신 빛에 반응하는 감광제인 에오신 Y를 활용해 대장균 기반의 ‘전세포 광-생촉매’ 방법을 개발했다. 저가의 에오신 Y를 빛에 노출시켜 시토크롬 P450의 효소반응을 촉진하여 고가의 대사물질을 생산한다는 원리다.
박 교수는 “이번 연구를 통해 산업적 활용에 제한이 컸던 시토크롬 P450 효소의 활용이 수월해졌다” 며 “우리의 기술은 시토크롬 P450 효소가 고부가가치 의약 물질을 생산하는데 큰 도움을 줄 것이다”라고 말했다.
박찬범, 정기준 교수(교신저자)의 지도아래 박종현 박사과정 학생, 이상하 박사가 주저자로 참여한 이번 연구는 한국연구재단이 추진하는 중견연구자사업과 글로벌프론티어사업, KAIST HRHRP (High Risk High Return Project)의 지원으로 수행됐다.
□ 그림설명
그림1. 빛으로부터 에오신 와이 (eosin Y, EY)를 통해 시토크롬 P450 효소로 전자를 전달하는 모식도
그림2. 연구결과를 설명하는 1월 12일자 ‘앙게반테 케미’ 후면 논문 표지
2015.01.21 조회수 19933
빛을 이용한 약물효소반응 촉진 플랫폼 개발
우리 대학 신소재공학과 박찬범 교수와 생명화학공학과 정기준 교수 연구팀은 빛으로 약물효소반응을 유도할 수 있는 새로운 반응 플랫폼을 개발했다.
연구결과는 지난 12일, 화학분야의 세계적 학술지인 ‘앙게반테 케미’에 후면 표지논문으로 게재됐다.
이 기술을 활용하면 저가의 염료로 고지혈증 등의 심혈관질환 치료제 및 오메프라졸과 같은 위궤양 치료제 등 고부가가치 의약품 생산이 가능할 것으로 보인다.
시토크롬 P450(cytochrome P450)은 생물체 안에서 약물 및 호르몬 등의 대사 과정에서 중요한 산화반응을 수행하는 효소이다. 사람에게 투여되는 약물의 75% 이상의 대사를 담당하고 있기 때문에 신약개발 과정에서 핵심적인 요소로 알려져 있다.
시토크롬 P450의 활성화를 위해선 환원효소로부터 전자를 받아야 하며 전달물질인 NADPH(생물 세포 내의 조효소)가 필요하다. 하지만 NADPH의 높은 가격 때문에 시토크롬 P450의 활용은 실험실 수준에 머무르고 있었으며, 산업적 활용에도 제 역할을 다하지 못했다.
연구팀은 NADPH 대신 빛에 반응하는 감광제인 에오신 Y를 활용해 대장균 기반의 ‘전세포 광-생촉매’ 방법을 개발했다. 저가의 에오신 Y를 빛에 노출시켜 시토크롬 P450의 효소반응을 촉진하여 고가의 대사물질을 생산한다는 원리다.
박 교수는 “이번 연구를 통해 산업적 활용에 제한이 컸던 시토크롬 P450 효소의 활용이 수월해졌다” 며 “우리의 기술은 시토크롬 P450 효소가 고부가가치 의약 물질을 생산하는데 큰 도움을 줄 것이다”라고 말했다.
박찬범, 정기준 교수(교신저자)의 지도아래 박종현 박사과정 학생, 이상하 박사가 주저자로 참여한 이번 연구는 한국연구재단이 추진하는 중견연구자사업과 글로벌프론티어사업, KAIST HRHRP (High Risk High Return Project)의 지원으로 수행됐다.
□ 그림설명
그림1. 빛으로부터 에오신 와이 (eosin Y, EY)를 통해 시토크롬 P450 효소로 전자를 전달하는 모식도
그림2. 연구결과를 설명하는 1월 12일자 ‘앙게반테 케미’ 후면 논문 표지
2015.01.21 조회수 19933 단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
2014.04.25 조회수 20545
단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
2014.04.25 조회수 20545 노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
2012.10.24 조회수 22498
노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
2012.10.24 조회수 22498 단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
2012.05.01 조회수 25505
단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
2012.05.01 조회수 25505 간단하고 저렴한 유전자 진단 기술 개발
- “유전자 진단의 시간과 비용을 획기적으로 절감할 수 있어”- 분석화학분야 세계적 학술지‘아날리스트’4월호 표지논문 선정
우리학교 박현규 생명화학공학과 교수가 전기화학적 활성을 가진 핵산 결합 분자인 메틸렌 블루(Methylene Blue)를 이용해 전기화학적 실시간 중합효소 연쇄 반응(Real-Time PCR) 기술을 개발했다.
현재 유전자 분석 분야에서 가장 널리 사용되고 있는 Real-Time PCR(Polymerase Chain Reaction) 방법은 형광 신호를 이용하기 때문에 고가의 장비와 시약이 사용되는 분석 기술이다.
이에 반해 전기화학적 방법은 사용이 간편하고 가격이 저렴하며, 무엇보다 분석 장치를 소형화 할 수 있는 이점이 있다.
박 교수 연구팀은 산화/환원을 통해 전기화학적인 신호를 발생하는 물질인 메틸렌 블루가 핵산과 결합하면 전기화학적 신호가 감소하는 현상에 착안, 이를 PCR에 적용해 핵산의 증폭 과정을 전기화학적 신호를 통해 실시간으로 검출할 수 있는 전기화학적 Real-Time PCR을 구현하는 데 성공했다.
또한, 이 신호 변화 현상이 메틸렌 블루의 확산 계수와 관련된 것임을 규명해 향후 다양한 방법으로 응용될 수 있는 신호 발생을 기반으로 한 기술도 확립했다.
연구팀은 이를 기반으로 전극이 인쇄된 작은 칩을 제작해 성병 유발 병원균인 클라미디아 트라코마티스(Chlamydia trachomatis)의 유전자를 대상으로 연구를 수행했다.
그 결과 기존 형광 기반의 Real-Time PCR과 거의 동일한 성능을 보였다. 따라서 다양한 질병 진단을 비롯해 다양한 유전자 연구 분야에 적용할 수 있음을 입증했다.
박현규 교수는 “Real-Time PCR 기술이 현재 유전자 진단 분야에서 가장 확실한 분석 방법임에도 불구하고 형광 기반의 분석 방법이다 보니 고가의 검출 장비 및 분석 시약을 필요로 한다”며 “이번 연구 결과로 유전자 진단에 소요되는 시간과 비용을 획기적으로 절감할 수 있다”라고 설명했다.
한편, 이번 연구는 한국연구재단(이사장 오세정)이 시행하는 ‘중견연구자 지원 사업(도약연구)’으로 수행됐으며, 연구의 중요성을 인정받아 분석화학 분야의 세계적인 학술지인 ‘아날리스트(The Analyst)’ 4월호(4월 21일자) 표지논문으로 선정됐다.(끝)
<그림설명>신호 분자 결합에 의한 전기화학적 Real-Time PCR 모식도 (아날리스트 표지)
<용어설명>○ Real-Time PCR (실시간 중합효소연쇄반응): 중합효소연쇄 반응을 통해 증폭되는 핵산을 실시간으로 모니터링을 하고 해석하는 기술
○ PCR: (Polymerase Chain Reaction, 중합효소 연쇄 반응): 현재 유전물질을 조작해 실험하는 거의 모든 과정에 사용되는 검사법으로, 검출을 원하는 특정 표적 유전물질을 증폭하는 방법이다. 1985년에 캐리 멀리스(Kary B. Mullis)에 의해 개발됐다.
○ Chlamydia Trachomatis: 클라미디아 트라코마티스(chlamydia trachomatis)라는 병원균에 의한 성병으로 성적 접촉으로 점염되어 비뇨생식계에 질병을 일으키는 감염증의 가장 흔한 원인균.
2011.04.21 조회수 20522
간단하고 저렴한 유전자 진단 기술 개발
- “유전자 진단의 시간과 비용을 획기적으로 절감할 수 있어”- 분석화학분야 세계적 학술지‘아날리스트’4월호 표지논문 선정
우리학교 박현규 생명화학공학과 교수가 전기화학적 활성을 가진 핵산 결합 분자인 메틸렌 블루(Methylene Blue)를 이용해 전기화학적 실시간 중합효소 연쇄 반응(Real-Time PCR) 기술을 개발했다.
현재 유전자 분석 분야에서 가장 널리 사용되고 있는 Real-Time PCR(Polymerase Chain Reaction) 방법은 형광 신호를 이용하기 때문에 고가의 장비와 시약이 사용되는 분석 기술이다.
이에 반해 전기화학적 방법은 사용이 간편하고 가격이 저렴하며, 무엇보다 분석 장치를 소형화 할 수 있는 이점이 있다.
박 교수 연구팀은 산화/환원을 통해 전기화학적인 신호를 발생하는 물질인 메틸렌 블루가 핵산과 결합하면 전기화학적 신호가 감소하는 현상에 착안, 이를 PCR에 적용해 핵산의 증폭 과정을 전기화학적 신호를 통해 실시간으로 검출할 수 있는 전기화학적 Real-Time PCR을 구현하는 데 성공했다.
또한, 이 신호 변화 현상이 메틸렌 블루의 확산 계수와 관련된 것임을 규명해 향후 다양한 방법으로 응용될 수 있는 신호 발생을 기반으로 한 기술도 확립했다.
연구팀은 이를 기반으로 전극이 인쇄된 작은 칩을 제작해 성병 유발 병원균인 클라미디아 트라코마티스(Chlamydia trachomatis)의 유전자를 대상으로 연구를 수행했다.
그 결과 기존 형광 기반의 Real-Time PCR과 거의 동일한 성능을 보였다. 따라서 다양한 질병 진단을 비롯해 다양한 유전자 연구 분야에 적용할 수 있음을 입증했다.
박현규 교수는 “Real-Time PCR 기술이 현재 유전자 진단 분야에서 가장 확실한 분석 방법임에도 불구하고 형광 기반의 분석 방법이다 보니 고가의 검출 장비 및 분석 시약을 필요로 한다”며 “이번 연구 결과로 유전자 진단에 소요되는 시간과 비용을 획기적으로 절감할 수 있다”라고 설명했다.
한편, 이번 연구는 한국연구재단(이사장 오세정)이 시행하는 ‘중견연구자 지원 사업(도약연구)’으로 수행됐으며, 연구의 중요성을 인정받아 분석화학 분야의 세계적인 학술지인 ‘아날리스트(The Analyst)’ 4월호(4월 21일자) 표지논문으로 선정됐다.(끝)
<그림설명>신호 분자 결합에 의한 전기화학적 Real-Time PCR 모식도 (아날리스트 표지)
<용어설명>○ Real-Time PCR (실시간 중합효소연쇄반응): 중합효소연쇄 반응을 통해 증폭되는 핵산을 실시간으로 모니터링을 하고 해석하는 기술
○ PCR: (Polymerase Chain Reaction, 중합효소 연쇄 반응): 현재 유전물질을 조작해 실험하는 거의 모든 과정에 사용되는 검사법으로, 검출을 원하는 특정 표적 유전물질을 증폭하는 방법이다. 1985년에 캐리 멀리스(Kary B. Mullis)에 의해 개발됐다.
○ Chlamydia Trachomatis: 클라미디아 트라코마티스(chlamydia trachomatis)라는 병원균에 의한 성병으로 성적 접촉으로 점염되어 비뇨생식계에 질병을 일으키는 감염증의 가장 흔한 원인균.
2011.04.21 조회수 20522