-
 혹시 나도 수면 질환? AI로 간단히 검사해 보세요
각종 장비를 몸에 부착한 채 병원에서 하룻밤을 보내야 하는 번거로운 검사 없이 웹사이트를 통해 간단히 수면 질환 위험도를 파악할 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀이 삼성서울병원 주은연‧최수정 교수팀, 이화여대 서울병원 김지현 교수팀과 공동 연구를 통해 개발한 세 가지 수면 질환을 예측할 수 있는 알고리즘 ‘슬립스(SLEEPS‧SimpLe quEstionnairE Predicting Sleep disorders)’를 12일 공개했다.
‘잠이 보약’이라는 말처럼 수면은 정신적‧신체적 건강에 주요한 영향을 미친다. 성인의 60%가량이 수면 질환을 앓고 있지만, 관련하여 전문 의료진에게 문의한 비율은 6% 수준에 불과하다. 병원 방문을 꺼리는 원인 중 하나로는 수면 질환 진단을 받기 위해 시행하는 수면다원검사가 번거롭다는 이유가 있다.
공동연구진은 약 5,000명의 수면다원검사 결과를 기계 학습을 통해 학습시켜 수면 질환 위험도를 예측하는 알고리즘 ‘슬립스’를 개발했다. 슬립스에서 나이, 성별, 키, 체중, 최근 2주간의 수면 시 어려움, 수면 유지 어려움, 기상 시 어려움, 수면 패턴에 대한 만족도, 수면이 일상 기능에 미치는 영향 등 간단한 9개의 질문에 답하는 것만으로 만성불면증, 수면호흡장애, 수면호흡장애를 동반한 불면증의 위험도를 90%의 정확도로 예측할 수 있다. 가령, 슬립스 검사 결과 수면호흡장애 위험도가 50%라는 결과가 나왔다면, 실제 수면다원검사를 시행했을 때 수면호흡장애가 발견될 확률이 50%임을 의미한다.
제1 저자인 하석민 미국 MIT 박사과정생(前 IBS 의생명 수학 그룹 연구원)은 “미국 하버드대 연구팀도 AI 기반 수면 질환 검사 알고리즘을 개발한 바 있으나, 이 시스템은 목둘레, 혈압 등 쉽게 답하기 어려운 문항이 포함되어 있어 사용이 까다로웠다”며 “또한, 하버드대 연구팀의 시스템은 예측 정확도도 70% 정도에 그쳤다”고 말했다.
슬립스 사이트(www.sleep-math.com)를 통해 누구나 수면 질환 여부를 예측해볼 수 있다. 현재 본인의 상태를 기준으로 몸무게 변화나 나이가 듦에 따른 수면 질환 위험도 변화도 살펴볼 수 있다.
김재경 교수는 “이번 연구는 수학으로 우리가 직면한 건강 문제를 해결해보고자 하는 시도에서 시작됐고, 중요하지만 쉽게 간과할 수 있는 수면 질환에 기계 학습을 접목했다”며 “수면 질환 진단의 복잡한 과정을 줄인 만큼, 많은 사람이 슬립스를 통해 자신의 수면 건강을 알 수 있는 계기가 되길 바란다”고 말했다.
주은연 삼성서울병원 교수는 “슬립스는 간편한 수면 질환 자가 검진 시스템”이라며 “향후 건강검진 항목에 AI 기반 자가 검진 시스템을 포함한다면 잠재적인 수면 질환 환자들을 스크리닝하여 수면 질환으로 인해 발생하는 수많은 질병을 선제적으로 예방할 수 있을 것”이라고 말했다.
슬립스 개발 성과는 지난 9월 의료 건강 분야 국제학술지 ‘Journal of Medical Internet Research’에 실린 바 있다.
혹시 나도 수면 질환? AI로 간단히 검사해 보세요
각종 장비를 몸에 부착한 채 병원에서 하룻밤을 보내야 하는 번거로운 검사 없이 웹사이트를 통해 간단히 수면 질환 위험도를 파악할 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀이 삼성서울병원 주은연‧최수정 교수팀, 이화여대 서울병원 김지현 교수팀과 공동 연구를 통해 개발한 세 가지 수면 질환을 예측할 수 있는 알고리즘 ‘슬립스(SLEEPS‧SimpLe quEstionnairE Predicting Sleep disorders)’를 12일 공개했다.
‘잠이 보약’이라는 말처럼 수면은 정신적‧신체적 건강에 주요한 영향을 미친다. 성인의 60%가량이 수면 질환을 앓고 있지만, 관련하여 전문 의료진에게 문의한 비율은 6% 수준에 불과하다. 병원 방문을 꺼리는 원인 중 하나로는 수면 질환 진단을 받기 위해 시행하는 수면다원검사가 번거롭다는 이유가 있다.
공동연구진은 약 5,000명의 수면다원검사 결과를 기계 학습을 통해 학습시켜 수면 질환 위험도를 예측하는 알고리즘 ‘슬립스’를 개발했다. 슬립스에서 나이, 성별, 키, 체중, 최근 2주간의 수면 시 어려움, 수면 유지 어려움, 기상 시 어려움, 수면 패턴에 대한 만족도, 수면이 일상 기능에 미치는 영향 등 간단한 9개의 질문에 답하는 것만으로 만성불면증, 수면호흡장애, 수면호흡장애를 동반한 불면증의 위험도를 90%의 정확도로 예측할 수 있다. 가령, 슬립스 검사 결과 수면호흡장애 위험도가 50%라는 결과가 나왔다면, 실제 수면다원검사를 시행했을 때 수면호흡장애가 발견될 확률이 50%임을 의미한다.
제1 저자인 하석민 미국 MIT 박사과정생(前 IBS 의생명 수학 그룹 연구원)은 “미국 하버드대 연구팀도 AI 기반 수면 질환 검사 알고리즘을 개발한 바 있으나, 이 시스템은 목둘레, 혈압 등 쉽게 답하기 어려운 문항이 포함되어 있어 사용이 까다로웠다”며 “또한, 하버드대 연구팀의 시스템은 예측 정확도도 70% 정도에 그쳤다”고 말했다.
슬립스 사이트(www.sleep-math.com)를 통해 누구나 수면 질환 여부를 예측해볼 수 있다. 현재 본인의 상태를 기준으로 몸무게 변화나 나이가 듦에 따른 수면 질환 위험도 변화도 살펴볼 수 있다.
김재경 교수는 “이번 연구는 수학으로 우리가 직면한 건강 문제를 해결해보고자 하는 시도에서 시작됐고, 중요하지만 쉽게 간과할 수 있는 수면 질환에 기계 학습을 접목했다”며 “수면 질환 진단의 복잡한 과정을 줄인 만큼, 많은 사람이 슬립스를 통해 자신의 수면 건강을 알 수 있는 계기가 되길 바란다”고 말했다.
주은연 삼성서울병원 교수는 “슬립스는 간편한 수면 질환 자가 검진 시스템”이라며 “향후 건강검진 항목에 AI 기반 자가 검진 시스템을 포함한다면 잠재적인 수면 질환 환자들을 스크리닝하여 수면 질환으로 인해 발생하는 수많은 질병을 선제적으로 예방할 수 있을 것”이라고 말했다.
슬립스 개발 성과는 지난 9월 의료 건강 분야 국제학술지 ‘Journal of Medical Internet Research’에 실린 바 있다.
2023.12.14
조회수 11873
-
 K-약용식물에서 세 단계만에 분자연금술 뚝딱
K-약용식물 추출물에서 단 세 단계 만에 퇴행성 신경질환 등 난치성 신경질환 치료제로 개발가능한 물질인 ‘수프라니딘 B’를 합성하는 ‘분자 연금술’에 성공하여 화제다.
우리 대학 화학과 한순규 교수 연구팀이 국내 자생 ‘광대싸리’에 극미량 존재하는 고부가가치 천연물을 생체모방 전략을 통해 쉽게 얻을 수 있는 물질로부터 간단하게 합성하는 방법을 개발했다고 1일 밝혔다.
`세큐리네가 알칼로이드'는 국내 자생 약용식물인 ‘광대싸리’에서 발견되는 천연물 군으로, 항암 및 신경돌기 성장 촉진 등 다양한 약리 활성을 보여 수십 년간 합성화학계의 관심을 받아왔다.
이들 물질 군에는 기본 골격으로부터 산화되거나 사슬처럼 연결된 형태를 갖는 100여 종의 초복잡 천연물들이 존재하는데, 상대적으로 간단한 기본 골격체의 합성은 잘 정립되어 있었던 반면, 초복잡 화합물의 합성은 난제로 남아 있었다.
그 중 `수프라니딘(suffranidine) B'도 초복잡 세큐리네가 천연물 중의 하나로, 신경세포의 신경돌기 성장을 촉진해, 퇴행성 신경질환이나 신경 절단 등 현재는 난치성인 신경질환의 치료제로 기대되는 물질이다. 그러나 식물 1 킬로그램(kg)당 추출량이 0.4 밀리그램(mg)에 그칠 정도로 극히 적고 정제 또한 어려워 추가적인 연구에 제한점이 많았다.
한 교수 연구팀은 광대싸리에서 쉽게 대량으로 추출할 수 있는 기본골격을 갖는 세큐리네가 천연물인 알로세큐리닌(allosecurinine)과 시중에서 값싸게 구할 수 있는 누룩산(kojic acid) 유래 물질로부터 단 세 단계 만에 수프라니딘 B를 합성하는 방법을 개발했다.
이번 연구는 수프라니딘 B의 세계 최초 합성으로 쉽게 구할 수 있는 물질로부터 고부가가치 화합물을 간단하게 만들어 낸 일종의 `분자 연금술'이라 볼 수 있다. 수프라니딘 B와 같이 복잡한 천연물을 이렇게 짧은 과정으로 합성해 낸 사례는 몹시 드물다.
생체모방 합성(biomimetic synthesis)은 자연이 천연물을 합성하는 과정(생합성)을 모방해 복잡한 천연물을 합성하는 연구 방식이다. 합성 과정에서 생합성 경로에 존재할 것으로 여겨지는 중간체들의 화학적 반응성을 탐구할 수 있으므로, 해당 물질의 생합성 경로를 더욱 깊게 이해할 기회를 제공한다. 세큐리네가 알칼로이드는 1956년 최초로 발견되었으나 현재까지도 생합성 경로가 밝혀지지 않은 상태다.
한 교수는 "이번 연구로 수프라니딘 B를 간단하게 생산할 수 있게 되었을 뿐 아니라 초복잡 세큐리네가 천연물의 생합성에 대한 이해 또한 높일 수 있었다ˮ며 "고부가가치 국내 자생 약용식물을 합성화학적으로 또는 합성생물학적으로 생산할 수 있는 학문적 토대를 마련했다ˮ고 밝혔다.
KAIST 화학과 강규민 석박사통합과정 학생이 제1 저자로 참여한 이번 연구는 화학 분야 저명 국제 학술지인 `미국화학회지(Journal of the American Chemical Society)' 지난 11월 2일 자에 게재됐다. (논문명 : Synthesis of Suffranidine B)
한편 이번 연구는 KAIST의 도약연구(UP) 및 한국연구재단의 기초연구사업(중견연구)등의 지원을 통해 이뤄졌다.
K-약용식물에서 세 단계만에 분자연금술 뚝딱
K-약용식물 추출물에서 단 세 단계 만에 퇴행성 신경질환 등 난치성 신경질환 치료제로 개발가능한 물질인 ‘수프라니딘 B’를 합성하는 ‘분자 연금술’에 성공하여 화제다.
우리 대학 화학과 한순규 교수 연구팀이 국내 자생 ‘광대싸리’에 극미량 존재하는 고부가가치 천연물을 생체모방 전략을 통해 쉽게 얻을 수 있는 물질로부터 간단하게 합성하는 방법을 개발했다고 1일 밝혔다.
`세큐리네가 알칼로이드'는 국내 자생 약용식물인 ‘광대싸리’에서 발견되는 천연물 군으로, 항암 및 신경돌기 성장 촉진 등 다양한 약리 활성을 보여 수십 년간 합성화학계의 관심을 받아왔다.
이들 물질 군에는 기본 골격으로부터 산화되거나 사슬처럼 연결된 형태를 갖는 100여 종의 초복잡 천연물들이 존재하는데, 상대적으로 간단한 기본 골격체의 합성은 잘 정립되어 있었던 반면, 초복잡 화합물의 합성은 난제로 남아 있었다.
그 중 `수프라니딘(suffranidine) B'도 초복잡 세큐리네가 천연물 중의 하나로, 신경세포의 신경돌기 성장을 촉진해, 퇴행성 신경질환이나 신경 절단 등 현재는 난치성인 신경질환의 치료제로 기대되는 물질이다. 그러나 식물 1 킬로그램(kg)당 추출량이 0.4 밀리그램(mg)에 그칠 정도로 극히 적고 정제 또한 어려워 추가적인 연구에 제한점이 많았다.
한 교수 연구팀은 광대싸리에서 쉽게 대량으로 추출할 수 있는 기본골격을 갖는 세큐리네가 천연물인 알로세큐리닌(allosecurinine)과 시중에서 값싸게 구할 수 있는 누룩산(kojic acid) 유래 물질로부터 단 세 단계 만에 수프라니딘 B를 합성하는 방법을 개발했다.
이번 연구는 수프라니딘 B의 세계 최초 합성으로 쉽게 구할 수 있는 물질로부터 고부가가치 화합물을 간단하게 만들어 낸 일종의 `분자 연금술'이라 볼 수 있다. 수프라니딘 B와 같이 복잡한 천연물을 이렇게 짧은 과정으로 합성해 낸 사례는 몹시 드물다.
생체모방 합성(biomimetic synthesis)은 자연이 천연물을 합성하는 과정(생합성)을 모방해 복잡한 천연물을 합성하는 연구 방식이다. 합성 과정에서 생합성 경로에 존재할 것으로 여겨지는 중간체들의 화학적 반응성을 탐구할 수 있으므로, 해당 물질의 생합성 경로를 더욱 깊게 이해할 기회를 제공한다. 세큐리네가 알칼로이드는 1956년 최초로 발견되었으나 현재까지도 생합성 경로가 밝혀지지 않은 상태다.
한 교수는 "이번 연구로 수프라니딘 B를 간단하게 생산할 수 있게 되었을 뿐 아니라 초복잡 세큐리네가 천연물의 생합성에 대한 이해 또한 높일 수 있었다ˮ며 "고부가가치 국내 자생 약용식물을 합성화학적으로 또는 합성생물학적으로 생산할 수 있는 학문적 토대를 마련했다ˮ고 밝혔다.
KAIST 화학과 강규민 석박사통합과정 학생이 제1 저자로 참여한 이번 연구는 화학 분야 저명 국제 학술지인 `미국화학회지(Journal of the American Chemical Society)' 지난 11월 2일 자에 게재됐다. (논문명 : Synthesis of Suffranidine B)
한편 이번 연구는 KAIST의 도약연구(UP) 및 한국연구재단의 기초연구사업(중견연구)등의 지원을 통해 이뤄졌다.
2023.12.01
조회수 6571
-
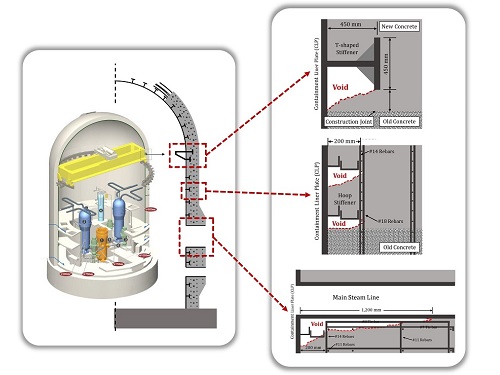 한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
2023.10.24
조회수 6571
-
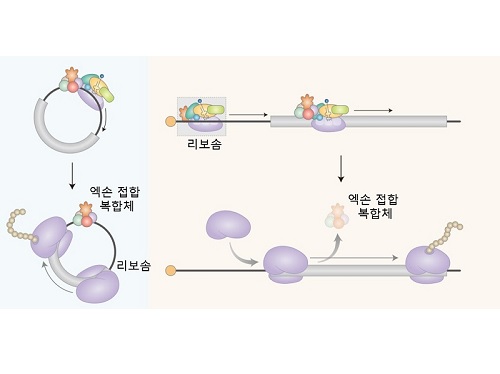 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24
조회수 6323
-
 산업 균주 제작 및 병원균 억제 범용기술 개발
박테리아는 우리 일상에서 김치, 된장, 술 등 식품에 활용되어 왔을 뿐만 아니라 최근에는 대사 공학을 통해 플라스틱, 영양제, 사료, 의약품 등을 생산하는 산업용 세포 공장으로 활약하고 있다. 하지만 유익한 박테리아 외에도 다양한 감염성 질병을 일으키는 폐렴균, 살모넬라균 등 병원균이 있어 대사공학적 기법을 통해 유해한 병원균은 병원성을 억제하거나 사멸을 유도하고, 유익한 산업용 박테리아는 고부가가치 물질을 고효율로 생산할 수 있도록 조작하는 것이 중요하다.
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다고 10일 밝혔다. 해당 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)'에 4월 24일 字 온라인 게재됐다.
※ 논문명 : Targeted and high-throughput gene knockdown in diverse bacteria using synthetic sRNAs
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 조재성(한국과학기술원, 현 MIT 박사후연구원, 공동 제1저자), 양동수(한국과학기술원, 현 고려대학교 조교수, 공동 제1저자), Cindy Prabowo (한국과학기술원, 공동저자), Mohammad Ghiffary (한국과학기술원, 공동저자), 한태희 (한국과학기술원, 공동저자), 최경록 (한국과학기술원, 공동저자), 문천우 (한국과학기술원, 공동저자), Hengrui Zhou (한국과학기술원, 공동저자), 류재용 (한국과학기술원, 현 덕성여자대학교 조교수, 공동저자), 김현욱 (한국과학기술원, 공동저자) - 총 11명
sRNA는 대장균에서 표적 유전자를 억제하기 위해 합성 조절하는 효과적인 도구이지만 그동안 대장균과 같은 그람 음성균 외에 산업적으로 유용한 고초균이나 코리네박테리움 같은 그람 양성균에서는 적용이 어려웠다.
이에 생명화학공학과 이상엽 특훈교수 연구팀은 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다. 연구팀은 우선 미생물 데이터베이스를 이용해 수천 종의 미생물 유래 sRNA 시스템을 검토했고, 그중 가장 높은 유전자 억제능을 보여준 `고초균(Bacillus subtilis)' 박테리아 유래 sRNA 시스템을 최종 선정했고 이를 ’광범위 미생물 적용 sRNA‘(Broad-Host-Range sRNA, 이하 BHR-sRNA)라고 명명했다.
sRNA와 유사한 시스템으로는 유전자 가위로 잘 알려진 크리스퍼(CRISPR)를 개량한 크리스퍼 간섭(CRISPR interference, CRISPRi) 시스템이 있다. 유전자 가위의 핵심인 Cas9 단백질에 돌연변이를 일으켜 DNA를 자르지 않으면서 유전자 전사 과정만을 억제해 유전자 발현을 억제하는 시스템인데, Cas9 단백질의 분자량이 매우 높아 몇몇 박테리아에서 성장을 저해하는 현상이 보고됐다. 하지만 이번 연구에서 개발한 BHR-sRNA 시스템은 박테리아의 성장에 전혀 영향을 끼치지 않으면서도 CRISPR 간섭과 유사한 유전자 억제능을 보였다.
BHR-sRNA 시스템의 범용성을 검증하기 위해 연구팀은 다양한 그람 음성균 및 그람 양성균 16종을 선정하여 테스트했고, 그중 15종의 박테리아에서 BHR-sRNA 시스템이 성공적으로 작동함을 증명했다. 또한, 10종의 박테리아에서 기존의 대장균 기반 sRNA 시스템보다 유전자 억제능이 뛰어남을 증명했다. 이와 같이 BHR-sRNA 시스템은 다양한 박테리아에서 효과적으로 유전자 발현을 억제할 수 있는 범용 도구임을 입증했다.
최근 점차 심각해져 가는 항생제 내성 병원균 문제를 해결하기 위해, 연구팀은 BHR-sRNA를 이용해 독성인자를 생산하는 유전자를 억제하고, 결과적으로 병원성을 억제하고자 했다. 특히 BHR-sRNA를 활용해 병원 발생 감염균인 표피포도상 구균(Staphylococcus epidermidis)에서 항생제 내성의 원인 중 하나인 바이오필름 형성을 73% 억제할 수 있었고, 폐렴균인 폐렴막대균(Klebsiella pneumoniae)에서 항생제 내성을 58% 약화하는 결과를 보였다. 연구팀은 또한, BHR-sRNA를 산업용 박테리아에 적용해 표적 물질을 고효율로 생산하고자 했다. 특히 폴리아마이드 고분자의 원재료인 발레로락탐(valerolactam), 포도향 첨가제인 메틸안트라닐산(methyl anthranilate), 그리고 청색 천연염료인 인디고이딘(indigoidine)을 최고 농도로 생산할 수 있었다.
이번 연구를 통해 개발한 BHR-sRNA를 활용해 다양한 산업공정으로의 응용이 기대되며, 항생제 내성 병원균 퇴치를 통한 연구에도 활용될 수 있으리라 기대된다. 교신저자인 이상엽 특훈교수는 “기존에는 각각의 박테리아마다 유전자 억제 도구를 새로 개발해야 했는데, 이번 연구를 통해 다양한 박테리아에서 범용으로 작동하는 도구를 개발했다”며 “앞으로 합성생물학과 대사공학, 그리고 병원균 대응연구 발전에 큰 도움이 될 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발 과제의 지원을 받아 수행됐다.
산업 균주 제작 및 병원균 억제 범용기술 개발
박테리아는 우리 일상에서 김치, 된장, 술 등 식품에 활용되어 왔을 뿐만 아니라 최근에는 대사 공학을 통해 플라스틱, 영양제, 사료, 의약품 등을 생산하는 산업용 세포 공장으로 활약하고 있다. 하지만 유익한 박테리아 외에도 다양한 감염성 질병을 일으키는 폐렴균, 살모넬라균 등 병원균이 있어 대사공학적 기법을 통해 유해한 병원균은 병원성을 억제하거나 사멸을 유도하고, 유익한 산업용 박테리아는 고부가가치 물질을 고효율로 생산할 수 있도록 조작하는 것이 중요하다.
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다고 10일 밝혔다. 해당 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)'에 4월 24일 字 온라인 게재됐다.
※ 논문명 : Targeted and high-throughput gene knockdown in diverse bacteria using synthetic sRNAs
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 조재성(한국과학기술원, 현 MIT 박사후연구원, 공동 제1저자), 양동수(한국과학기술원, 현 고려대학교 조교수, 공동 제1저자), Cindy Prabowo (한국과학기술원, 공동저자), Mohammad Ghiffary (한국과학기술원, 공동저자), 한태희 (한국과학기술원, 공동저자), 최경록 (한국과학기술원, 공동저자), 문천우 (한국과학기술원, 공동저자), Hengrui Zhou (한국과학기술원, 공동저자), 류재용 (한국과학기술원, 현 덕성여자대학교 조교수, 공동저자), 김현욱 (한국과학기술원, 공동저자) - 총 11명
sRNA는 대장균에서 표적 유전자를 억제하기 위해 합성 조절하는 효과적인 도구이지만 그동안 대장균과 같은 그람 음성균 외에 산업적으로 유용한 고초균이나 코리네박테리움 같은 그람 양성균에서는 적용이 어려웠다.
이에 생명화학공학과 이상엽 특훈교수 연구팀은 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다. 연구팀은 우선 미생물 데이터베이스를 이용해 수천 종의 미생물 유래 sRNA 시스템을 검토했고, 그중 가장 높은 유전자 억제능을 보여준 `고초균(Bacillus subtilis)' 박테리아 유래 sRNA 시스템을 최종 선정했고 이를 ’광범위 미생물 적용 sRNA‘(Broad-Host-Range sRNA, 이하 BHR-sRNA)라고 명명했다.
sRNA와 유사한 시스템으로는 유전자 가위로 잘 알려진 크리스퍼(CRISPR)를 개량한 크리스퍼 간섭(CRISPR interference, CRISPRi) 시스템이 있다. 유전자 가위의 핵심인 Cas9 단백질에 돌연변이를 일으켜 DNA를 자르지 않으면서 유전자 전사 과정만을 억제해 유전자 발현을 억제하는 시스템인데, Cas9 단백질의 분자량이 매우 높아 몇몇 박테리아에서 성장을 저해하는 현상이 보고됐다. 하지만 이번 연구에서 개발한 BHR-sRNA 시스템은 박테리아의 성장에 전혀 영향을 끼치지 않으면서도 CRISPR 간섭과 유사한 유전자 억제능을 보였다.
BHR-sRNA 시스템의 범용성을 검증하기 위해 연구팀은 다양한 그람 음성균 및 그람 양성균 16종을 선정하여 테스트했고, 그중 15종의 박테리아에서 BHR-sRNA 시스템이 성공적으로 작동함을 증명했다. 또한, 10종의 박테리아에서 기존의 대장균 기반 sRNA 시스템보다 유전자 억제능이 뛰어남을 증명했다. 이와 같이 BHR-sRNA 시스템은 다양한 박테리아에서 효과적으로 유전자 발현을 억제할 수 있는 범용 도구임을 입증했다.
최근 점차 심각해져 가는 항생제 내성 병원균 문제를 해결하기 위해, 연구팀은 BHR-sRNA를 이용해 독성인자를 생산하는 유전자를 억제하고, 결과적으로 병원성을 억제하고자 했다. 특히 BHR-sRNA를 활용해 병원 발생 감염균인 표피포도상 구균(Staphylococcus epidermidis)에서 항생제 내성의 원인 중 하나인 바이오필름 형성을 73% 억제할 수 있었고, 폐렴균인 폐렴막대균(Klebsiella pneumoniae)에서 항생제 내성을 58% 약화하는 결과를 보였다. 연구팀은 또한, BHR-sRNA를 산업용 박테리아에 적용해 표적 물질을 고효율로 생산하고자 했다. 특히 폴리아마이드 고분자의 원재료인 발레로락탐(valerolactam), 포도향 첨가제인 메틸안트라닐산(methyl anthranilate), 그리고 청색 천연염료인 인디고이딘(indigoidine)을 최고 농도로 생산할 수 있었다.
이번 연구를 통해 개발한 BHR-sRNA를 활용해 다양한 산업공정으로의 응용이 기대되며, 항생제 내성 병원균 퇴치를 통한 연구에도 활용될 수 있으리라 기대된다. 교신저자인 이상엽 특훈교수는 “기존에는 각각의 박테리아마다 유전자 억제 도구를 새로 개발해야 했는데, 이번 연구를 통해 다양한 박테리아에서 범용으로 작동하는 도구를 개발했다”며 “앞으로 합성생물학과 대사공학, 그리고 병원균 대응연구 발전에 큰 도움이 될 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발 과제의 지원을 받아 수행됐다.
2023.05.10
조회수 8222
-
 다결정 및 단결정 재료 극한 변형 메커니즘 규명
우리 대학 항공우주공학과 연구팀 (익스트림역학 및 멀티피직스 연구실; https://continuum.kaist.ac.kr)이 미국 로스앨러모스국립연구소, 오크리지국립연구소 및 위스콘신대학과의 공동연구를 통해 초고온 및 초고압용 체심입방 결정재료의 극한 변형 메커니즘을 실험 및 이론적으로 규명했다.
주기율표의 Group V 및 Group VI에 속한 체심입방 금속재료 (그림 1-a)는 높은 용융점, 우수한 기계 및 내화학적 성능 및 가공성으로 인해 항공우주, 원자력 및 초전도체 등 다양한 극한 환경에서 주로 사용돼왔으며 최근엔 의료기기용 재료로도 큰 주목을 받고 있다.
체심입방 금속재료의 극한 환경 하의 변형 및 흐름에 관한 예측은 원자미끄러짐 기반 비탄성 변형 메커니즘 특유의 물리 및 수학적 복잡성으로 인해, 대부분 경험적 방법론에 의존해왔다. 또한 기존에 제시된 대부분의 이론 모델들은 단결정 또는 다결정 상태의 극한 거동을 부분적으로만 예측할 수 있었지만, 본 연구에서는 체심입방 단결정 및 다결정 재료의 극한 거동을 다양한 온도 및 속도 조건에서 동시에 설명할 수 있는 연속체역학 기반 이론 모델을 제시하였다. 연구팀은 새롭게 제시된 이론 모델을 통해 대표적 체심입방금속재료인 단결정 및 다결정 탄탈럼의 극한의 기계적 변형, 전위 결함 및 미세 구조 발달을 정확하게 예측하고 (그림 1-b 및 1-c) 이를 로스앨러모스국립연구소가 보유한 Los Alamos Neutron Science Center (LANSCE)의 중성자 디프랙션 장비를 통해 실험적으로 검증했다 (그림 1-d). 또한 기존의 경험론적 이론 모델에서는 설명할 수 없었던 체심입방 단결정 구조체에서 주로 발견되는 원자 미끄러짐의 불안정성을 수리적으로 규명하였으며, 이는 향후 극한 환경용 재료 및 구조체 설계에 적극 활용될 수 있을 것으로 기대되고 있다.
본 연구 결과는 이론 및 실험에 관한 국제협력을 통해 얻어졌으며, 우리학교 항공우주공학과의 조한솔 교수 연구실과 위스콘신-매디슨 대학 기계공학과의 커트 브롱크홀스트(Curt Bronkhorst) 교수 연구실 및 오크리지국립연구소에서 이론 정립 및 단결정 및 다결정 거동 경계값 문제에 관한 수치 계산을 수행하고, 로스앨러모스 국립연구소에서 검증 실험을 수행했다.
우리 대학 항공우주공학과의 이승현 박사과정 학생이 제1 저자로 참여한 이번 연구는 고체 및 응용역학 분야 최상위 학술지인 인터내셔널 저널 오브 플라스티시티 (Int. Journal of Plasticity) 에 연속 출간됐다.
https://doi.org/10.1016/j.ijplas.2023.103529
https://doi.org/10.1016/j.ijplas.2020.102903
https://arxiv.org/abs/2303.06743
한편 본 연구에 참여한 박사과정 이승현 학생은 로스앨러모스국립연구소의 여름 프로그램에 지원 및 선정돼 이번 6월 로스앨러모스국립연구소의 이론부에 방문하여 후속 연구를 진행할 예정이다.
본 연구는 한국연구재단 신진과제 (2020R1C1C101324813), 기초연구실 (2021R1A4A103278312) 그리고 미국립과학재단 (CMMI 2118399)의 지원을 통해 수행됐다.
다결정 및 단결정 재료 극한 변형 메커니즘 규명
우리 대학 항공우주공학과 연구팀 (익스트림역학 및 멀티피직스 연구실; https://continuum.kaist.ac.kr)이 미국 로스앨러모스국립연구소, 오크리지국립연구소 및 위스콘신대학과의 공동연구를 통해 초고온 및 초고압용 체심입방 결정재료의 극한 변형 메커니즘을 실험 및 이론적으로 규명했다.
주기율표의 Group V 및 Group VI에 속한 체심입방 금속재료 (그림 1-a)는 높은 용융점, 우수한 기계 및 내화학적 성능 및 가공성으로 인해 항공우주, 원자력 및 초전도체 등 다양한 극한 환경에서 주로 사용돼왔으며 최근엔 의료기기용 재료로도 큰 주목을 받고 있다.
체심입방 금속재료의 극한 환경 하의 변형 및 흐름에 관한 예측은 원자미끄러짐 기반 비탄성 변형 메커니즘 특유의 물리 및 수학적 복잡성으로 인해, 대부분 경험적 방법론에 의존해왔다. 또한 기존에 제시된 대부분의 이론 모델들은 단결정 또는 다결정 상태의 극한 거동을 부분적으로만 예측할 수 있었지만, 본 연구에서는 체심입방 단결정 및 다결정 재료의 극한 거동을 다양한 온도 및 속도 조건에서 동시에 설명할 수 있는 연속체역학 기반 이론 모델을 제시하였다. 연구팀은 새롭게 제시된 이론 모델을 통해 대표적 체심입방금속재료인 단결정 및 다결정 탄탈럼의 극한의 기계적 변형, 전위 결함 및 미세 구조 발달을 정확하게 예측하고 (그림 1-b 및 1-c) 이를 로스앨러모스국립연구소가 보유한 Los Alamos Neutron Science Center (LANSCE)의 중성자 디프랙션 장비를 통해 실험적으로 검증했다 (그림 1-d). 또한 기존의 경험론적 이론 모델에서는 설명할 수 없었던 체심입방 단결정 구조체에서 주로 발견되는 원자 미끄러짐의 불안정성을 수리적으로 규명하였으며, 이는 향후 극한 환경용 재료 및 구조체 설계에 적극 활용될 수 있을 것으로 기대되고 있다.
본 연구 결과는 이론 및 실험에 관한 국제협력을 통해 얻어졌으며, 우리학교 항공우주공학과의 조한솔 교수 연구실과 위스콘신-매디슨 대학 기계공학과의 커트 브롱크홀스트(Curt Bronkhorst) 교수 연구실 및 오크리지국립연구소에서 이론 정립 및 단결정 및 다결정 거동 경계값 문제에 관한 수치 계산을 수행하고, 로스앨러모스 국립연구소에서 검증 실험을 수행했다.
우리 대학 항공우주공학과의 이승현 박사과정 학생이 제1 저자로 참여한 이번 연구는 고체 및 응용역학 분야 최상위 학술지인 인터내셔널 저널 오브 플라스티시티 (Int. Journal of Plasticity) 에 연속 출간됐다.
https://doi.org/10.1016/j.ijplas.2023.103529
https://doi.org/10.1016/j.ijplas.2020.102903
https://arxiv.org/abs/2303.06743
한편 본 연구에 참여한 박사과정 이승현 학생은 로스앨러모스국립연구소의 여름 프로그램에 지원 및 선정돼 이번 6월 로스앨러모스국립연구소의 이론부에 방문하여 후속 연구를 진행할 예정이다.
본 연구는 한국연구재단 신진과제 (2020R1C1C101324813), 기초연구실 (2021R1A4A103278312) 그리고 미국립과학재단 (CMMI 2118399)의 지원을 통해 수행됐다.
2023.05.02
조회수 6854
-
 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02
조회수 12441
-
 말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20
조회수 8012
-
 전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11
조회수 9176
-
 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27
조회수 7861
-
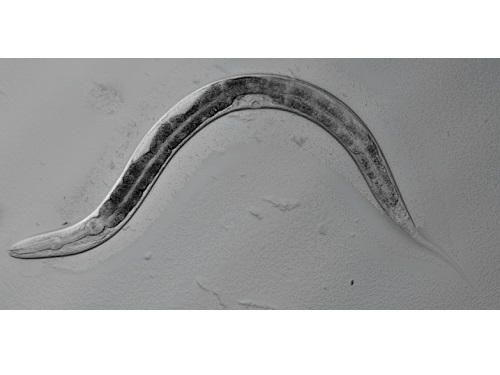 생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07
조회수 7337
-
 RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
2022.10.31
조회수 9345
 혹시 나도 수면 질환? AI로 간단히 검사해 보세요
각종 장비를 몸에 부착한 채 병원에서 하룻밤을 보내야 하는 번거로운 검사 없이 웹사이트를 통해 간단히 수면 질환 위험도를 파악할 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀이 삼성서울병원 주은연‧최수정 교수팀, 이화여대 서울병원 김지현 교수팀과 공동 연구를 통해 개발한 세 가지 수면 질환을 예측할 수 있는 알고리즘 ‘슬립스(SLEEPS‧SimpLe quEstionnairE Predicting Sleep disorders)’를 12일 공개했다.
‘잠이 보약’이라는 말처럼 수면은 정신적‧신체적 건강에 주요한 영향을 미친다. 성인의 60%가량이 수면 질환을 앓고 있지만, 관련하여 전문 의료진에게 문의한 비율은 6% 수준에 불과하다. 병원 방문을 꺼리는 원인 중 하나로는 수면 질환 진단을 받기 위해 시행하는 수면다원검사가 번거롭다는 이유가 있다.
공동연구진은 약 5,000명의 수면다원검사 결과를 기계 학습을 통해 학습시켜 수면 질환 위험도를 예측하는 알고리즘 ‘슬립스’를 개발했다. 슬립스에서 나이, 성별, 키, 체중, 최근 2주간의 수면 시 어려움, 수면 유지 어려움, 기상 시 어려움, 수면 패턴에 대한 만족도, 수면이 일상 기능에 미치는 영향 등 간단한 9개의 질문에 답하는 것만으로 만성불면증, 수면호흡장애, 수면호흡장애를 동반한 불면증의 위험도를 90%의 정확도로 예측할 수 있다. 가령, 슬립스 검사 결과 수면호흡장애 위험도가 50%라는 결과가 나왔다면, 실제 수면다원검사를 시행했을 때 수면호흡장애가 발견될 확률이 50%임을 의미한다.
제1 저자인 하석민 미국 MIT 박사과정생(前 IBS 의생명 수학 그룹 연구원)은 “미국 하버드대 연구팀도 AI 기반 수면 질환 검사 알고리즘을 개발한 바 있으나, 이 시스템은 목둘레, 혈압 등 쉽게 답하기 어려운 문항이 포함되어 있어 사용이 까다로웠다”며 “또한, 하버드대 연구팀의 시스템은 예측 정확도도 70% 정도에 그쳤다”고 말했다.
슬립스 사이트(www.sleep-math.com)를 통해 누구나 수면 질환 여부를 예측해볼 수 있다. 현재 본인의 상태를 기준으로 몸무게 변화나 나이가 듦에 따른 수면 질환 위험도 변화도 살펴볼 수 있다.
김재경 교수는 “이번 연구는 수학으로 우리가 직면한 건강 문제를 해결해보고자 하는 시도에서 시작됐고, 중요하지만 쉽게 간과할 수 있는 수면 질환에 기계 학습을 접목했다”며 “수면 질환 진단의 복잡한 과정을 줄인 만큼, 많은 사람이 슬립스를 통해 자신의 수면 건강을 알 수 있는 계기가 되길 바란다”고 말했다.
주은연 삼성서울병원 교수는 “슬립스는 간편한 수면 질환 자가 검진 시스템”이라며 “향후 건강검진 항목에 AI 기반 자가 검진 시스템을 포함한다면 잠재적인 수면 질환 환자들을 스크리닝하여 수면 질환으로 인해 발생하는 수많은 질병을 선제적으로 예방할 수 있을 것”이라고 말했다.
슬립스 개발 성과는 지난 9월 의료 건강 분야 국제학술지 ‘Journal of Medical Internet Research’에 실린 바 있다.
2023.12.14 조회수 11873
혹시 나도 수면 질환? AI로 간단히 검사해 보세요
각종 장비를 몸에 부착한 채 병원에서 하룻밤을 보내야 하는 번거로운 검사 없이 웹사이트를 통해 간단히 수면 질환 위험도를 파악할 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀이 삼성서울병원 주은연‧최수정 교수팀, 이화여대 서울병원 김지현 교수팀과 공동 연구를 통해 개발한 세 가지 수면 질환을 예측할 수 있는 알고리즘 ‘슬립스(SLEEPS‧SimpLe quEstionnairE Predicting Sleep disorders)’를 12일 공개했다.
‘잠이 보약’이라는 말처럼 수면은 정신적‧신체적 건강에 주요한 영향을 미친다. 성인의 60%가량이 수면 질환을 앓고 있지만, 관련하여 전문 의료진에게 문의한 비율은 6% 수준에 불과하다. 병원 방문을 꺼리는 원인 중 하나로는 수면 질환 진단을 받기 위해 시행하는 수면다원검사가 번거롭다는 이유가 있다.
공동연구진은 약 5,000명의 수면다원검사 결과를 기계 학습을 통해 학습시켜 수면 질환 위험도를 예측하는 알고리즘 ‘슬립스’를 개발했다. 슬립스에서 나이, 성별, 키, 체중, 최근 2주간의 수면 시 어려움, 수면 유지 어려움, 기상 시 어려움, 수면 패턴에 대한 만족도, 수면이 일상 기능에 미치는 영향 등 간단한 9개의 질문에 답하는 것만으로 만성불면증, 수면호흡장애, 수면호흡장애를 동반한 불면증의 위험도를 90%의 정확도로 예측할 수 있다. 가령, 슬립스 검사 결과 수면호흡장애 위험도가 50%라는 결과가 나왔다면, 실제 수면다원검사를 시행했을 때 수면호흡장애가 발견될 확률이 50%임을 의미한다.
제1 저자인 하석민 미국 MIT 박사과정생(前 IBS 의생명 수학 그룹 연구원)은 “미국 하버드대 연구팀도 AI 기반 수면 질환 검사 알고리즘을 개발한 바 있으나, 이 시스템은 목둘레, 혈압 등 쉽게 답하기 어려운 문항이 포함되어 있어 사용이 까다로웠다”며 “또한, 하버드대 연구팀의 시스템은 예측 정확도도 70% 정도에 그쳤다”고 말했다.
슬립스 사이트(www.sleep-math.com)를 통해 누구나 수면 질환 여부를 예측해볼 수 있다. 현재 본인의 상태를 기준으로 몸무게 변화나 나이가 듦에 따른 수면 질환 위험도 변화도 살펴볼 수 있다.
김재경 교수는 “이번 연구는 수학으로 우리가 직면한 건강 문제를 해결해보고자 하는 시도에서 시작됐고, 중요하지만 쉽게 간과할 수 있는 수면 질환에 기계 학습을 접목했다”며 “수면 질환 진단의 복잡한 과정을 줄인 만큼, 많은 사람이 슬립스를 통해 자신의 수면 건강을 알 수 있는 계기가 되길 바란다”고 말했다.
주은연 삼성서울병원 교수는 “슬립스는 간편한 수면 질환 자가 검진 시스템”이라며 “향후 건강검진 항목에 AI 기반 자가 검진 시스템을 포함한다면 잠재적인 수면 질환 환자들을 스크리닝하여 수면 질환으로 인해 발생하는 수많은 질병을 선제적으로 예방할 수 있을 것”이라고 말했다.
슬립스 개발 성과는 지난 9월 의료 건강 분야 국제학술지 ‘Journal of Medical Internet Research’에 실린 바 있다.
2023.12.14 조회수 11873 K-약용식물에서 세 단계만에 분자연금술 뚝딱
K-약용식물 추출물에서 단 세 단계 만에 퇴행성 신경질환 등 난치성 신경질환 치료제로 개발가능한 물질인 ‘수프라니딘 B’를 합성하는 ‘분자 연금술’에 성공하여 화제다.
우리 대학 화학과 한순규 교수 연구팀이 국내 자생 ‘광대싸리’에 극미량 존재하는 고부가가치 천연물을 생체모방 전략을 통해 쉽게 얻을 수 있는 물질로부터 간단하게 합성하는 방법을 개발했다고 1일 밝혔다.
`세큐리네가 알칼로이드'는 국내 자생 약용식물인 ‘광대싸리’에서 발견되는 천연물 군으로, 항암 및 신경돌기 성장 촉진 등 다양한 약리 활성을 보여 수십 년간 합성화학계의 관심을 받아왔다.
이들 물질 군에는 기본 골격으로부터 산화되거나 사슬처럼 연결된 형태를 갖는 100여 종의 초복잡 천연물들이 존재하는데, 상대적으로 간단한 기본 골격체의 합성은 잘 정립되어 있었던 반면, 초복잡 화합물의 합성은 난제로 남아 있었다.
그 중 `수프라니딘(suffranidine) B'도 초복잡 세큐리네가 천연물 중의 하나로, 신경세포의 신경돌기 성장을 촉진해, 퇴행성 신경질환이나 신경 절단 등 현재는 난치성인 신경질환의 치료제로 기대되는 물질이다. 그러나 식물 1 킬로그램(kg)당 추출량이 0.4 밀리그램(mg)에 그칠 정도로 극히 적고 정제 또한 어려워 추가적인 연구에 제한점이 많았다.
한 교수 연구팀은 광대싸리에서 쉽게 대량으로 추출할 수 있는 기본골격을 갖는 세큐리네가 천연물인 알로세큐리닌(allosecurinine)과 시중에서 값싸게 구할 수 있는 누룩산(kojic acid) 유래 물질로부터 단 세 단계 만에 수프라니딘 B를 합성하는 방법을 개발했다.
이번 연구는 수프라니딘 B의 세계 최초 합성으로 쉽게 구할 수 있는 물질로부터 고부가가치 화합물을 간단하게 만들어 낸 일종의 `분자 연금술'이라 볼 수 있다. 수프라니딘 B와 같이 복잡한 천연물을 이렇게 짧은 과정으로 합성해 낸 사례는 몹시 드물다.
생체모방 합성(biomimetic synthesis)은 자연이 천연물을 합성하는 과정(생합성)을 모방해 복잡한 천연물을 합성하는 연구 방식이다. 합성 과정에서 생합성 경로에 존재할 것으로 여겨지는 중간체들의 화학적 반응성을 탐구할 수 있으므로, 해당 물질의 생합성 경로를 더욱 깊게 이해할 기회를 제공한다. 세큐리네가 알칼로이드는 1956년 최초로 발견되었으나 현재까지도 생합성 경로가 밝혀지지 않은 상태다.
한 교수는 "이번 연구로 수프라니딘 B를 간단하게 생산할 수 있게 되었을 뿐 아니라 초복잡 세큐리네가 천연물의 생합성에 대한 이해 또한 높일 수 있었다ˮ며 "고부가가치 국내 자생 약용식물을 합성화학적으로 또는 합성생물학적으로 생산할 수 있는 학문적 토대를 마련했다ˮ고 밝혔다.
KAIST 화학과 강규민 석박사통합과정 학생이 제1 저자로 참여한 이번 연구는 화학 분야 저명 국제 학술지인 `미국화학회지(Journal of the American Chemical Society)' 지난 11월 2일 자에 게재됐다. (논문명 : Synthesis of Suffranidine B)
한편 이번 연구는 KAIST의 도약연구(UP) 및 한국연구재단의 기초연구사업(중견연구)등의 지원을 통해 이뤄졌다.
2023.12.01 조회수 6571
K-약용식물에서 세 단계만에 분자연금술 뚝딱
K-약용식물 추출물에서 단 세 단계 만에 퇴행성 신경질환 등 난치성 신경질환 치료제로 개발가능한 물질인 ‘수프라니딘 B’를 합성하는 ‘분자 연금술’에 성공하여 화제다.
우리 대학 화학과 한순규 교수 연구팀이 국내 자생 ‘광대싸리’에 극미량 존재하는 고부가가치 천연물을 생체모방 전략을 통해 쉽게 얻을 수 있는 물질로부터 간단하게 합성하는 방법을 개발했다고 1일 밝혔다.
`세큐리네가 알칼로이드'는 국내 자생 약용식물인 ‘광대싸리’에서 발견되는 천연물 군으로, 항암 및 신경돌기 성장 촉진 등 다양한 약리 활성을 보여 수십 년간 합성화학계의 관심을 받아왔다.
이들 물질 군에는 기본 골격으로부터 산화되거나 사슬처럼 연결된 형태를 갖는 100여 종의 초복잡 천연물들이 존재하는데, 상대적으로 간단한 기본 골격체의 합성은 잘 정립되어 있었던 반면, 초복잡 화합물의 합성은 난제로 남아 있었다.
그 중 `수프라니딘(suffranidine) B'도 초복잡 세큐리네가 천연물 중의 하나로, 신경세포의 신경돌기 성장을 촉진해, 퇴행성 신경질환이나 신경 절단 등 현재는 난치성인 신경질환의 치료제로 기대되는 물질이다. 그러나 식물 1 킬로그램(kg)당 추출량이 0.4 밀리그램(mg)에 그칠 정도로 극히 적고 정제 또한 어려워 추가적인 연구에 제한점이 많았다.
한 교수 연구팀은 광대싸리에서 쉽게 대량으로 추출할 수 있는 기본골격을 갖는 세큐리네가 천연물인 알로세큐리닌(allosecurinine)과 시중에서 값싸게 구할 수 있는 누룩산(kojic acid) 유래 물질로부터 단 세 단계 만에 수프라니딘 B를 합성하는 방법을 개발했다.
이번 연구는 수프라니딘 B의 세계 최초 합성으로 쉽게 구할 수 있는 물질로부터 고부가가치 화합물을 간단하게 만들어 낸 일종의 `분자 연금술'이라 볼 수 있다. 수프라니딘 B와 같이 복잡한 천연물을 이렇게 짧은 과정으로 합성해 낸 사례는 몹시 드물다.
생체모방 합성(biomimetic synthesis)은 자연이 천연물을 합성하는 과정(생합성)을 모방해 복잡한 천연물을 합성하는 연구 방식이다. 합성 과정에서 생합성 경로에 존재할 것으로 여겨지는 중간체들의 화학적 반응성을 탐구할 수 있으므로, 해당 물질의 생합성 경로를 더욱 깊게 이해할 기회를 제공한다. 세큐리네가 알칼로이드는 1956년 최초로 발견되었으나 현재까지도 생합성 경로가 밝혀지지 않은 상태다.
한 교수는 "이번 연구로 수프라니딘 B를 간단하게 생산할 수 있게 되었을 뿐 아니라 초복잡 세큐리네가 천연물의 생합성에 대한 이해 또한 높일 수 있었다ˮ며 "고부가가치 국내 자생 약용식물을 합성화학적으로 또는 합성생물학적으로 생산할 수 있는 학문적 토대를 마련했다ˮ고 밝혔다.
KAIST 화학과 강규민 석박사통합과정 학생이 제1 저자로 참여한 이번 연구는 화학 분야 저명 국제 학술지인 `미국화학회지(Journal of the American Chemical Society)' 지난 11월 2일 자에 게재됐다. (논문명 : Synthesis of Suffranidine B)
한편 이번 연구는 KAIST의 도약연구(UP) 및 한국연구재단의 기초연구사업(중견연구)등의 지원을 통해 이뤄졌다.
2023.12.01 조회수 6571 한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
2023.10.24 조회수 6571
한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
2023.10.24 조회수 6571 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 6323
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 6323 산업 균주 제작 및 병원균 억제 범용기술 개발
박테리아는 우리 일상에서 김치, 된장, 술 등 식품에 활용되어 왔을 뿐만 아니라 최근에는 대사 공학을 통해 플라스틱, 영양제, 사료, 의약품 등을 생산하는 산업용 세포 공장으로 활약하고 있다. 하지만 유익한 박테리아 외에도 다양한 감염성 질병을 일으키는 폐렴균, 살모넬라균 등 병원균이 있어 대사공학적 기법을 통해 유해한 병원균은 병원성을 억제하거나 사멸을 유도하고, 유익한 산업용 박테리아는 고부가가치 물질을 고효율로 생산할 수 있도록 조작하는 것이 중요하다.
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다고 10일 밝혔다. 해당 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)'에 4월 24일 字 온라인 게재됐다.
※ 논문명 : Targeted and high-throughput gene knockdown in diverse bacteria using synthetic sRNAs
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 조재성(한국과학기술원, 현 MIT 박사후연구원, 공동 제1저자), 양동수(한국과학기술원, 현 고려대학교 조교수, 공동 제1저자), Cindy Prabowo (한국과학기술원, 공동저자), Mohammad Ghiffary (한국과학기술원, 공동저자), 한태희 (한국과학기술원, 공동저자), 최경록 (한국과학기술원, 공동저자), 문천우 (한국과학기술원, 공동저자), Hengrui Zhou (한국과학기술원, 공동저자), 류재용 (한국과학기술원, 현 덕성여자대학교 조교수, 공동저자), 김현욱 (한국과학기술원, 공동저자) - 총 11명
sRNA는 대장균에서 표적 유전자를 억제하기 위해 합성 조절하는 효과적인 도구이지만 그동안 대장균과 같은 그람 음성균 외에 산업적으로 유용한 고초균이나 코리네박테리움 같은 그람 양성균에서는 적용이 어려웠다.
이에 생명화학공학과 이상엽 특훈교수 연구팀은 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다. 연구팀은 우선 미생물 데이터베이스를 이용해 수천 종의 미생물 유래 sRNA 시스템을 검토했고, 그중 가장 높은 유전자 억제능을 보여준 `고초균(Bacillus subtilis)' 박테리아 유래 sRNA 시스템을 최종 선정했고 이를 ’광범위 미생물 적용 sRNA‘(Broad-Host-Range sRNA, 이하 BHR-sRNA)라고 명명했다.
sRNA와 유사한 시스템으로는 유전자 가위로 잘 알려진 크리스퍼(CRISPR)를 개량한 크리스퍼 간섭(CRISPR interference, CRISPRi) 시스템이 있다. 유전자 가위의 핵심인 Cas9 단백질에 돌연변이를 일으켜 DNA를 자르지 않으면서 유전자 전사 과정만을 억제해 유전자 발현을 억제하는 시스템인데, Cas9 단백질의 분자량이 매우 높아 몇몇 박테리아에서 성장을 저해하는 현상이 보고됐다. 하지만 이번 연구에서 개발한 BHR-sRNA 시스템은 박테리아의 성장에 전혀 영향을 끼치지 않으면서도 CRISPR 간섭과 유사한 유전자 억제능을 보였다.
BHR-sRNA 시스템의 범용성을 검증하기 위해 연구팀은 다양한 그람 음성균 및 그람 양성균 16종을 선정하여 테스트했고, 그중 15종의 박테리아에서 BHR-sRNA 시스템이 성공적으로 작동함을 증명했다. 또한, 10종의 박테리아에서 기존의 대장균 기반 sRNA 시스템보다 유전자 억제능이 뛰어남을 증명했다. 이와 같이 BHR-sRNA 시스템은 다양한 박테리아에서 효과적으로 유전자 발현을 억제할 수 있는 범용 도구임을 입증했다.
최근 점차 심각해져 가는 항생제 내성 병원균 문제를 해결하기 위해, 연구팀은 BHR-sRNA를 이용해 독성인자를 생산하는 유전자를 억제하고, 결과적으로 병원성을 억제하고자 했다. 특히 BHR-sRNA를 활용해 병원 발생 감염균인 표피포도상 구균(Staphylococcus epidermidis)에서 항생제 내성의 원인 중 하나인 바이오필름 형성을 73% 억제할 수 있었고, 폐렴균인 폐렴막대균(Klebsiella pneumoniae)에서 항생제 내성을 58% 약화하는 결과를 보였다. 연구팀은 또한, BHR-sRNA를 산업용 박테리아에 적용해 표적 물질을 고효율로 생산하고자 했다. 특히 폴리아마이드 고분자의 원재료인 발레로락탐(valerolactam), 포도향 첨가제인 메틸안트라닐산(methyl anthranilate), 그리고 청색 천연염료인 인디고이딘(indigoidine)을 최고 농도로 생산할 수 있었다.
이번 연구를 통해 개발한 BHR-sRNA를 활용해 다양한 산업공정으로의 응용이 기대되며, 항생제 내성 병원균 퇴치를 통한 연구에도 활용될 수 있으리라 기대된다. 교신저자인 이상엽 특훈교수는 “기존에는 각각의 박테리아마다 유전자 억제 도구를 새로 개발해야 했는데, 이번 연구를 통해 다양한 박테리아에서 범용으로 작동하는 도구를 개발했다”며 “앞으로 합성생물학과 대사공학, 그리고 병원균 대응연구 발전에 큰 도움이 될 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발 과제의 지원을 받아 수행됐다.
2023.05.10 조회수 8222
산업 균주 제작 및 병원균 억제 범용기술 개발
박테리아는 우리 일상에서 김치, 된장, 술 등 식품에 활용되어 왔을 뿐만 아니라 최근에는 대사 공학을 통해 플라스틱, 영양제, 사료, 의약품 등을 생산하는 산업용 세포 공장으로 활약하고 있다. 하지만 유익한 박테리아 외에도 다양한 감염성 질병을 일으키는 폐렴균, 살모넬라균 등 병원균이 있어 대사공학적 기법을 통해 유해한 병원균은 병원성을 억제하거나 사멸을 유도하고, 유익한 산업용 박테리아는 고부가가치 물질을 고효율로 생산할 수 있도록 조작하는 것이 중요하다.
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다고 10일 밝혔다. 해당 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)'에 4월 24일 字 온라인 게재됐다.
※ 논문명 : Targeted and high-throughput gene knockdown in diverse bacteria using synthetic sRNAs
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 조재성(한국과학기술원, 현 MIT 박사후연구원, 공동 제1저자), 양동수(한국과학기술원, 현 고려대학교 조교수, 공동 제1저자), Cindy Prabowo (한국과학기술원, 공동저자), Mohammad Ghiffary (한국과학기술원, 공동저자), 한태희 (한국과학기술원, 공동저자), 최경록 (한국과학기술원, 공동저자), 문천우 (한국과학기술원, 공동저자), Hengrui Zhou (한국과학기술원, 공동저자), 류재용 (한국과학기술원, 현 덕성여자대학교 조교수, 공동저자), 김현욱 (한국과학기술원, 공동저자) - 총 11명
sRNA는 대장균에서 표적 유전자를 억제하기 위해 합성 조절하는 효과적인 도구이지만 그동안 대장균과 같은 그람 음성균 외에 산업적으로 유용한 고초균이나 코리네박테리움 같은 그람 양성균에서는 적용이 어려웠다.
이에 생명화학공학과 이상엽 특훈교수 연구팀은 그람 음성균과 양성균 모두를 포함한 다양한 박테리아에서 표적 유전자를 효과적으로 억제할 수 있는 신규 sRNA 도구를 개발했다. 연구팀은 우선 미생물 데이터베이스를 이용해 수천 종의 미생물 유래 sRNA 시스템을 검토했고, 그중 가장 높은 유전자 억제능을 보여준 `고초균(Bacillus subtilis)' 박테리아 유래 sRNA 시스템을 최종 선정했고 이를 ’광범위 미생물 적용 sRNA‘(Broad-Host-Range sRNA, 이하 BHR-sRNA)라고 명명했다.
sRNA와 유사한 시스템으로는 유전자 가위로 잘 알려진 크리스퍼(CRISPR)를 개량한 크리스퍼 간섭(CRISPR interference, CRISPRi) 시스템이 있다. 유전자 가위의 핵심인 Cas9 단백질에 돌연변이를 일으켜 DNA를 자르지 않으면서 유전자 전사 과정만을 억제해 유전자 발현을 억제하는 시스템인데, Cas9 단백질의 분자량이 매우 높아 몇몇 박테리아에서 성장을 저해하는 현상이 보고됐다. 하지만 이번 연구에서 개발한 BHR-sRNA 시스템은 박테리아의 성장에 전혀 영향을 끼치지 않으면서도 CRISPR 간섭과 유사한 유전자 억제능을 보였다.
BHR-sRNA 시스템의 범용성을 검증하기 위해 연구팀은 다양한 그람 음성균 및 그람 양성균 16종을 선정하여 테스트했고, 그중 15종의 박테리아에서 BHR-sRNA 시스템이 성공적으로 작동함을 증명했다. 또한, 10종의 박테리아에서 기존의 대장균 기반 sRNA 시스템보다 유전자 억제능이 뛰어남을 증명했다. 이와 같이 BHR-sRNA 시스템은 다양한 박테리아에서 효과적으로 유전자 발현을 억제할 수 있는 범용 도구임을 입증했다.
최근 점차 심각해져 가는 항생제 내성 병원균 문제를 해결하기 위해, 연구팀은 BHR-sRNA를 이용해 독성인자를 생산하는 유전자를 억제하고, 결과적으로 병원성을 억제하고자 했다. 특히 BHR-sRNA를 활용해 병원 발생 감염균인 표피포도상 구균(Staphylococcus epidermidis)에서 항생제 내성의 원인 중 하나인 바이오필름 형성을 73% 억제할 수 있었고, 폐렴균인 폐렴막대균(Klebsiella pneumoniae)에서 항생제 내성을 58% 약화하는 결과를 보였다. 연구팀은 또한, BHR-sRNA를 산업용 박테리아에 적용해 표적 물질을 고효율로 생산하고자 했다. 특히 폴리아마이드 고분자의 원재료인 발레로락탐(valerolactam), 포도향 첨가제인 메틸안트라닐산(methyl anthranilate), 그리고 청색 천연염료인 인디고이딘(indigoidine)을 최고 농도로 생산할 수 있었다.
이번 연구를 통해 개발한 BHR-sRNA를 활용해 다양한 산업공정으로의 응용이 기대되며, 항생제 내성 병원균 퇴치를 통한 연구에도 활용될 수 있으리라 기대된다. 교신저자인 이상엽 특훈교수는 “기존에는 각각의 박테리아마다 유전자 억제 도구를 새로 개발해야 했는데, 이번 연구를 통해 다양한 박테리아에서 범용으로 작동하는 도구를 개발했다”며 “앞으로 합성생물학과 대사공학, 그리고 병원균 대응연구 발전에 큰 도움이 될 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발 과제의 지원을 받아 수행됐다.
2023.05.10 조회수 8222 다결정 및 단결정 재료 극한 변형 메커니즘 규명
우리 대학 항공우주공학과 연구팀 (익스트림역학 및 멀티피직스 연구실; https://continuum.kaist.ac.kr)이 미국 로스앨러모스국립연구소, 오크리지국립연구소 및 위스콘신대학과의 공동연구를 통해 초고온 및 초고압용 체심입방 결정재료의 극한 변형 메커니즘을 실험 및 이론적으로 규명했다.
주기율표의 Group V 및 Group VI에 속한 체심입방 금속재료 (그림 1-a)는 높은 용융점, 우수한 기계 및 내화학적 성능 및 가공성으로 인해 항공우주, 원자력 및 초전도체 등 다양한 극한 환경에서 주로 사용돼왔으며 최근엔 의료기기용 재료로도 큰 주목을 받고 있다.
체심입방 금속재료의 극한 환경 하의 변형 및 흐름에 관한 예측은 원자미끄러짐 기반 비탄성 변형 메커니즘 특유의 물리 및 수학적 복잡성으로 인해, 대부분 경험적 방법론에 의존해왔다. 또한 기존에 제시된 대부분의 이론 모델들은 단결정 또는 다결정 상태의 극한 거동을 부분적으로만 예측할 수 있었지만, 본 연구에서는 체심입방 단결정 및 다결정 재료의 극한 거동을 다양한 온도 및 속도 조건에서 동시에 설명할 수 있는 연속체역학 기반 이론 모델을 제시하였다. 연구팀은 새롭게 제시된 이론 모델을 통해 대표적 체심입방금속재료인 단결정 및 다결정 탄탈럼의 극한의 기계적 변형, 전위 결함 및 미세 구조 발달을 정확하게 예측하고 (그림 1-b 및 1-c) 이를 로스앨러모스국립연구소가 보유한 Los Alamos Neutron Science Center (LANSCE)의 중성자 디프랙션 장비를 통해 실험적으로 검증했다 (그림 1-d). 또한 기존의 경험론적 이론 모델에서는 설명할 수 없었던 체심입방 단결정 구조체에서 주로 발견되는 원자 미끄러짐의 불안정성을 수리적으로 규명하였으며, 이는 향후 극한 환경용 재료 및 구조체 설계에 적극 활용될 수 있을 것으로 기대되고 있다.
본 연구 결과는 이론 및 실험에 관한 국제협력을 통해 얻어졌으며, 우리학교 항공우주공학과의 조한솔 교수 연구실과 위스콘신-매디슨 대학 기계공학과의 커트 브롱크홀스트(Curt Bronkhorst) 교수 연구실 및 오크리지국립연구소에서 이론 정립 및 단결정 및 다결정 거동 경계값 문제에 관한 수치 계산을 수행하고, 로스앨러모스 국립연구소에서 검증 실험을 수행했다.
우리 대학 항공우주공학과의 이승현 박사과정 학생이 제1 저자로 참여한 이번 연구는 고체 및 응용역학 분야 최상위 학술지인 인터내셔널 저널 오브 플라스티시티 (Int. Journal of Plasticity) 에 연속 출간됐다.
https://doi.org/10.1016/j.ijplas.2023.103529
https://doi.org/10.1016/j.ijplas.2020.102903
https://arxiv.org/abs/2303.06743
한편 본 연구에 참여한 박사과정 이승현 학생은 로스앨러모스국립연구소의 여름 프로그램에 지원 및 선정돼 이번 6월 로스앨러모스국립연구소의 이론부에 방문하여 후속 연구를 진행할 예정이다.
본 연구는 한국연구재단 신진과제 (2020R1C1C101324813), 기초연구실 (2021R1A4A103278312) 그리고 미국립과학재단 (CMMI 2118399)의 지원을 통해 수행됐다.
2023.05.02 조회수 6854
다결정 및 단결정 재료 극한 변형 메커니즘 규명
우리 대학 항공우주공학과 연구팀 (익스트림역학 및 멀티피직스 연구실; https://continuum.kaist.ac.kr)이 미국 로스앨러모스국립연구소, 오크리지국립연구소 및 위스콘신대학과의 공동연구를 통해 초고온 및 초고압용 체심입방 결정재료의 극한 변형 메커니즘을 실험 및 이론적으로 규명했다.
주기율표의 Group V 및 Group VI에 속한 체심입방 금속재료 (그림 1-a)는 높은 용융점, 우수한 기계 및 내화학적 성능 및 가공성으로 인해 항공우주, 원자력 및 초전도체 등 다양한 극한 환경에서 주로 사용돼왔으며 최근엔 의료기기용 재료로도 큰 주목을 받고 있다.
체심입방 금속재료의 극한 환경 하의 변형 및 흐름에 관한 예측은 원자미끄러짐 기반 비탄성 변형 메커니즘 특유의 물리 및 수학적 복잡성으로 인해, 대부분 경험적 방법론에 의존해왔다. 또한 기존에 제시된 대부분의 이론 모델들은 단결정 또는 다결정 상태의 극한 거동을 부분적으로만 예측할 수 있었지만, 본 연구에서는 체심입방 단결정 및 다결정 재료의 극한 거동을 다양한 온도 및 속도 조건에서 동시에 설명할 수 있는 연속체역학 기반 이론 모델을 제시하였다. 연구팀은 새롭게 제시된 이론 모델을 통해 대표적 체심입방금속재료인 단결정 및 다결정 탄탈럼의 극한의 기계적 변형, 전위 결함 및 미세 구조 발달을 정확하게 예측하고 (그림 1-b 및 1-c) 이를 로스앨러모스국립연구소가 보유한 Los Alamos Neutron Science Center (LANSCE)의 중성자 디프랙션 장비를 통해 실험적으로 검증했다 (그림 1-d). 또한 기존의 경험론적 이론 모델에서는 설명할 수 없었던 체심입방 단결정 구조체에서 주로 발견되는 원자 미끄러짐의 불안정성을 수리적으로 규명하였으며, 이는 향후 극한 환경용 재료 및 구조체 설계에 적극 활용될 수 있을 것으로 기대되고 있다.
본 연구 결과는 이론 및 실험에 관한 국제협력을 통해 얻어졌으며, 우리학교 항공우주공학과의 조한솔 교수 연구실과 위스콘신-매디슨 대학 기계공학과의 커트 브롱크홀스트(Curt Bronkhorst) 교수 연구실 및 오크리지국립연구소에서 이론 정립 및 단결정 및 다결정 거동 경계값 문제에 관한 수치 계산을 수행하고, 로스앨러모스 국립연구소에서 검증 실험을 수행했다.
우리 대학 항공우주공학과의 이승현 박사과정 학생이 제1 저자로 참여한 이번 연구는 고체 및 응용역학 분야 최상위 학술지인 인터내셔널 저널 오브 플라스티시티 (Int. Journal of Plasticity) 에 연속 출간됐다.
https://doi.org/10.1016/j.ijplas.2023.103529
https://doi.org/10.1016/j.ijplas.2020.102903
https://arxiv.org/abs/2303.06743
한편 본 연구에 참여한 박사과정 이승현 학생은 로스앨러모스국립연구소의 여름 프로그램에 지원 및 선정돼 이번 6월 로스앨러모스국립연구소의 이론부에 방문하여 후속 연구를 진행할 예정이다.
본 연구는 한국연구재단 신진과제 (2020R1C1C101324813), 기초연구실 (2021R1A4A103278312) 그리고 미국립과학재단 (CMMI 2118399)의 지원을 통해 수행됐다.
2023.05.02 조회수 6854 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 12441
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 12441 말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 8012
말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 8012 전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11 조회수 9176
전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11 조회수 9176 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 7861
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 7861 생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 7337
생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 7337 RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
2022.10.31 조회수 9345
RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
2022.10.31 조회수 9345