%EC%8B%A0%EC%9D%98%EC%B2%A0
-
 A형 간염 환자의 간 손상 해결 단초 마련
우리 학교 의과학대학원 신의철 교수팀은 인체 면역계의 균형유지를 담당하는 조절 T 세포가 A형 간염 환자의 간 손상에 끼친 영향을 밝혔다.
연구결과는 세계적으로 저명한 소화기학 학술지인 ‘거트(Gut)’ 7월 9일자 온라인판에 게재됐다.
A형 간염은 A형 간염 바이러스에 의해 발생하는 급성 간염이다. 날씨가 더운 여름철에 발병률이 높고 바이러스가 입을 통해 소화기로 침입해 전파된다.
A형 간염은 환자의 발병초기와 회복기를 순차적으로 관찰할 수 있고 다양한 임상적 양상을 나타내 급성 바이러스 감염에 대한 인체의 면역반응을 연구하기에 적당한 질환이기 때문에 연구팀은 A형 간염을 선택했다.
인체 내에서 조절 T 세포는 다른 면역세포의 활성화를 억제함으로써 면역체계의 항상성을 유지하는데 중요한 역할을 한다. 만성 바이러스 감염의 경우 조절 T 세포는 바이러스에 대한 면역반응을 약화시켜 감염상태를 지속시키는데 기여한다고 알려져 있다. 그러나 급성 바이러스 감염에서는 조절 T 세포가 인체에서 어떠한 역할을 수행하는지 밝혀진 바가 없었다.
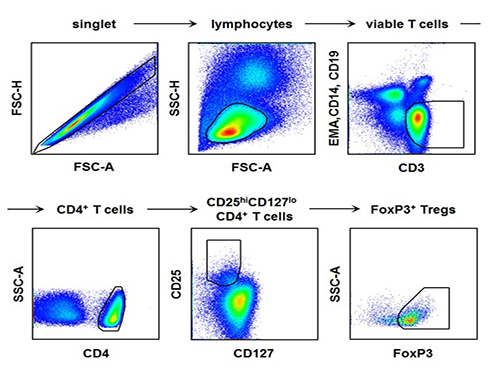
연구팀은 A형 간염 환자로부터 얻어진 혈액에서 조절 T 세포를 포함한 다양한 면역세포의 숫자와 특성을 파악하기 위해 형광 유세포 분석(fluorescence flow cytometry) 기법을 활용했다.
연구팀은 A형 간염 환자의 혈액에서 조절 T 세포의 현저한 감소와 함께 조절 T 세포의 면역 억제능이 감소되어 있음을 확인했다. 또 조절 T 세포의 감소가 더 현저하게 나타난 환자일수록 간 손상은 더욱 극심하게 발생함을 밝혔다.
연구팀은 세포사멸을 유도하는 세포표면 단백질인 ‘Fas’의 발현 증가에 의한 세포사멸 현상이 이러한 조절 T 세포의 수적, 기능적인 감소의 원인임을 실제 환자의 혈액을 분석해 입증했다.
신의철 교수는 이번 연구에 대해 “A형 간염 뿐만 아니라 급성 바이러스 감염증에서 임상 양상의 심화 기전을 제시한 첫 사례”라며 “향후 바이러스 자체에 대한 효과적인 치료가 없는 다양한 중증 급성 바이러스 감염질환에서 조절 T 세포의 세포사멸을 억제함으로써 조직 손상을 예방할 수 있을 것”이라고 의의를 밝혔다.
논문의 제1저자인 최윤석 박사는 의과대학을 졸업한 내과 의사로서 전문의 취득 후 KAIST 의과학대학원 박사과정에 진학했다. ‘인체 T 세포에 의한 면역반응의 조절에 대한 연구’를 수행하며 ‘의사-과학자’ 훈련을 5년간 받은 연구자로 ‘KAIST가 배출한 1세대 중개연구전문가’의 성공적 사례다.
KAIST에서의 연구 경험 및 심도 있는 교육을 바탕으로, 박사 학위 취득 후 충남대학교병원 혈액종양내과에서 진료교수로 재직하며 현재 신의철 교수와 함께 림프계 악성질환(악성림프종 및 다발성골수종)에서 종양특이 T 세포의 기능적 변화 및 그 임상적 의의에 대한 연구를 통해 난치성 질환에 대한 새로운 치료 타겟 발굴을 위한 연구를 진행 중이다.
□ 그림설명
혈액에서 형광 항체를 이용하여 조절 T 세포 및 다양한 면역세포를 형광염색하고 유세포 분석(flow cytometry)을 수행하여 그 숫자 및 특성을 분석한 데이터로서, 실제 A형 간염 환자의 혈액에서 이러한 분석을 수행하여 조절 T 세포의 감소를 규명하였음.
2014.07.31 조회수 19004
A형 간염 환자의 간 손상 해결 단초 마련
우리 학교 의과학대학원 신의철 교수팀은 인체 면역계의 균형유지를 담당하는 조절 T 세포가 A형 간염 환자의 간 손상에 끼친 영향을 밝혔다.
연구결과는 세계적으로 저명한 소화기학 학술지인 ‘거트(Gut)’ 7월 9일자 온라인판에 게재됐다.
A형 간염은 A형 간염 바이러스에 의해 발생하는 급성 간염이다. 날씨가 더운 여름철에 발병률이 높고 바이러스가 입을 통해 소화기로 침입해 전파된다.
A형 간염은 환자의 발병초기와 회복기를 순차적으로 관찰할 수 있고 다양한 임상적 양상을 나타내 급성 바이러스 감염에 대한 인체의 면역반응을 연구하기에 적당한 질환이기 때문에 연구팀은 A형 간염을 선택했다.
인체 내에서 조절 T 세포는 다른 면역세포의 활성화를 억제함으로써 면역체계의 항상성을 유지하는데 중요한 역할을 한다. 만성 바이러스 감염의 경우 조절 T 세포는 바이러스에 대한 면역반응을 약화시켜 감염상태를 지속시키는데 기여한다고 알려져 있다. 그러나 급성 바이러스 감염에서는 조절 T 세포가 인체에서 어떠한 역할을 수행하는지 밝혀진 바가 없었다.
연구팀은 A형 간염 환자로부터 얻어진 혈액에서 조절 T 세포를 포함한 다양한 면역세포의 숫자와 특성을 파악하기 위해 형광 유세포 분석(fluorescence flow cytometry) 기법을 활용했다.
연구팀은 A형 간염 환자의 혈액에서 조절 T 세포의 현저한 감소와 함께 조절 T 세포의 면역 억제능이 감소되어 있음을 확인했다. 또 조절 T 세포의 감소가 더 현저하게 나타난 환자일수록 간 손상은 더욱 극심하게 발생함을 밝혔다.
연구팀은 세포사멸을 유도하는 세포표면 단백질인 ‘Fas’의 발현 증가에 의한 세포사멸 현상이 이러한 조절 T 세포의 수적, 기능적인 감소의 원인임을 실제 환자의 혈액을 분석해 입증했다.
신의철 교수는 이번 연구에 대해 “A형 간염 뿐만 아니라 급성 바이러스 감염증에서 임상 양상의 심화 기전을 제시한 첫 사례”라며 “향후 바이러스 자체에 대한 효과적인 치료가 없는 다양한 중증 급성 바이러스 감염질환에서 조절 T 세포의 세포사멸을 억제함으로써 조직 손상을 예방할 수 있을 것”이라고 의의를 밝혔다.
논문의 제1저자인 최윤석 박사는 의과대학을 졸업한 내과 의사로서 전문의 취득 후 KAIST 의과학대학원 박사과정에 진학했다. ‘인체 T 세포에 의한 면역반응의 조절에 대한 연구’를 수행하며 ‘의사-과학자’ 훈련을 5년간 받은 연구자로 ‘KAIST가 배출한 1세대 중개연구전문가’의 성공적 사례다.
KAIST에서의 연구 경험 및 심도 있는 교육을 바탕으로, 박사 학위 취득 후 충남대학교병원 혈액종양내과에서 진료교수로 재직하며 현재 신의철 교수와 함께 림프계 악성질환(악성림프종 및 다발성골수종)에서 종양특이 T 세포의 기능적 변화 및 그 임상적 의의에 대한 연구를 통해 난치성 질환에 대한 새로운 치료 타겟 발굴을 위한 연구를 진행 중이다.
□ 그림설명
혈액에서 형광 항체를 이용하여 조절 T 세포 및 다양한 면역세포를 형광염색하고 유세포 분석(flow cytometry)을 수행하여 그 숫자 및 특성을 분석한 데이터로서, 실제 A형 간염 환자의 혈액에서 이러한 분석을 수행하여 조절 T 세포의 감소를 규명하였음.
2014.07.31 조회수 19004 -
 C형간염바이러스의 면역회피 기전 밝혀
C형간염은 우리나라 국민의 약 1~2%가 감염된 것으로 알려져 있다. C형간염바이러스에 감염되면 대부분 만성으로 진행되며 간경변증 및 간암이 발생해 사망에 이를 수도 있다.
A형이나 B형간염과는 달리 예방백신이 없어 감염원 노출을 피하는 것만이 최선의 예방법으로 알려진 가운데 우리학교 연구진이 백신 개발에 탄력을 받을 만한 연구 성과를 냈다.
우리학교 의과학대학원 신의철 교수팀은 C형간염바이러스가 체내에서 면역반응을 일으키지 않는 원인을 규명했다. 연구결과는 소화기병 분야 세계적 학술지 ‘위장병학(Gastroenterology)’ 5월호에 게재됐다.
우리 몸에서는 외부로부터 침입한 바이러스를 제거하기 위해 면역반응이 일어난다. 이 과정에서 바이러스에 감염된 세포의 제거에 필요한 T세포 반응을 적절하게 유도하는데 제1형 주조직복합체가 핵심적인 역할을 한다.
세포가 바이러스에 감염되면 인터페론이라는 물질에 의해 제1형 주조직복합체 발현이 증가되고 T세포는 증가된 제1형 주조직복합체를 인식해 바이러스에 감염된 세포를 찾아낼 수 있다.
그러나 그동안 C형간염바이러스의 경우 제1형 주조직복합체 발현에 어떤 영향을 미치는지 명확히 밝혀지지 않았다.
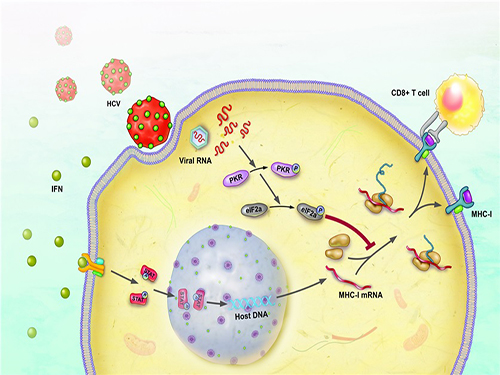
연구팀은 세포배양을 이용한 감염시스템을 통해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함을 밝혔다. 또 이에 대한 메커니즘을 분자 수준에서 규명, C형간염바이러스가 세포내의 PKR이라는 단백질을 활성화시켜 제1형 주조직복합체 단백질 발현을 억제하는 사실도 입증했다.
이와 함께 실제 C형간염바이러스 환자로부터 분리한 T세포 배양 기술을 이용해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함으로써 T세포 면역반응을 회피한다는 사실을 세계 최초로 규명했다.
이러한 연구를 통해 연구팀은 세포내 PKR 단백질을 조절하면 T세포 면역반응을 증강시킬 수 있다는 가설을 세우고 이를 실험을 통해 증명했다.
신의철 교수는 “C형간염바이러스를 치료하는 신약들은 많이 개발된 반면 백신은 아직 개발되지 않은 상태”라며 “C형간염바이러스의 면역회피 기전을 밝혀내 백신 개발에 탄력을 받을 것”이라고 이번 연구의 의의를 말했다.
그림1. 세포배양을 이용한 C형간염바이러스 감염 시스템을 유세포분석 기법으로 관찰, C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질 증가가 억제됨을 밝혔다.
그림2. C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질의 증가가 억제된다.
그림3. C형간염바이러스가 PKR-eIF2a 전달체계를 활성화시켜 제1형 주조직복합체 단백질 발현을 억제함으로써 바이러스에 대한 T세포의 활성이 약화된다.
2014.05.19 조회수 17682
C형간염바이러스의 면역회피 기전 밝혀
C형간염은 우리나라 국민의 약 1~2%가 감염된 것으로 알려져 있다. C형간염바이러스에 감염되면 대부분 만성으로 진행되며 간경변증 및 간암이 발생해 사망에 이를 수도 있다.
A형이나 B형간염과는 달리 예방백신이 없어 감염원 노출을 피하는 것만이 최선의 예방법으로 알려진 가운데 우리학교 연구진이 백신 개발에 탄력을 받을 만한 연구 성과를 냈다.
우리학교 의과학대학원 신의철 교수팀은 C형간염바이러스가 체내에서 면역반응을 일으키지 않는 원인을 규명했다. 연구결과는 소화기병 분야 세계적 학술지 ‘위장병학(Gastroenterology)’ 5월호에 게재됐다.
우리 몸에서는 외부로부터 침입한 바이러스를 제거하기 위해 면역반응이 일어난다. 이 과정에서 바이러스에 감염된 세포의 제거에 필요한 T세포 반응을 적절하게 유도하는데 제1형 주조직복합체가 핵심적인 역할을 한다.
세포가 바이러스에 감염되면 인터페론이라는 물질에 의해 제1형 주조직복합체 발현이 증가되고 T세포는 증가된 제1형 주조직복합체를 인식해 바이러스에 감염된 세포를 찾아낼 수 있다.
그러나 그동안 C형간염바이러스의 경우 제1형 주조직복합체 발현에 어떤 영향을 미치는지 명확히 밝혀지지 않았다.
연구팀은 세포배양을 이용한 감염시스템을 통해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함을 밝혔다. 또 이에 대한 메커니즘을 분자 수준에서 규명, C형간염바이러스가 세포내의 PKR이라는 단백질을 활성화시켜 제1형 주조직복합체 단백질 발현을 억제하는 사실도 입증했다.
이와 함께 실제 C형간염바이러스 환자로부터 분리한 T세포 배양 기술을 이용해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함으로써 T세포 면역반응을 회피한다는 사실을 세계 최초로 규명했다.
이러한 연구를 통해 연구팀은 세포내 PKR 단백질을 조절하면 T세포 면역반응을 증강시킬 수 있다는 가설을 세우고 이를 실험을 통해 증명했다.
신의철 교수는 “C형간염바이러스를 치료하는 신약들은 많이 개발된 반면 백신은 아직 개발되지 않은 상태”라며 “C형간염바이러스의 면역회피 기전을 밝혀내 백신 개발에 탄력을 받을 것”이라고 이번 연구의 의의를 말했다.
그림1. 세포배양을 이용한 C형간염바이러스 감염 시스템을 유세포분석 기법으로 관찰, C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질 증가가 억제됨을 밝혔다.
그림2. C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질의 증가가 억제된다.
그림3. C형간염바이러스가 PKR-eIF2a 전달체계를 활성화시켜 제1형 주조직복합체 단백질 발현을 억제함으로써 바이러스에 대한 T세포의 활성이 약화된다.
2014.05.19 조회수 17682 -
 C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
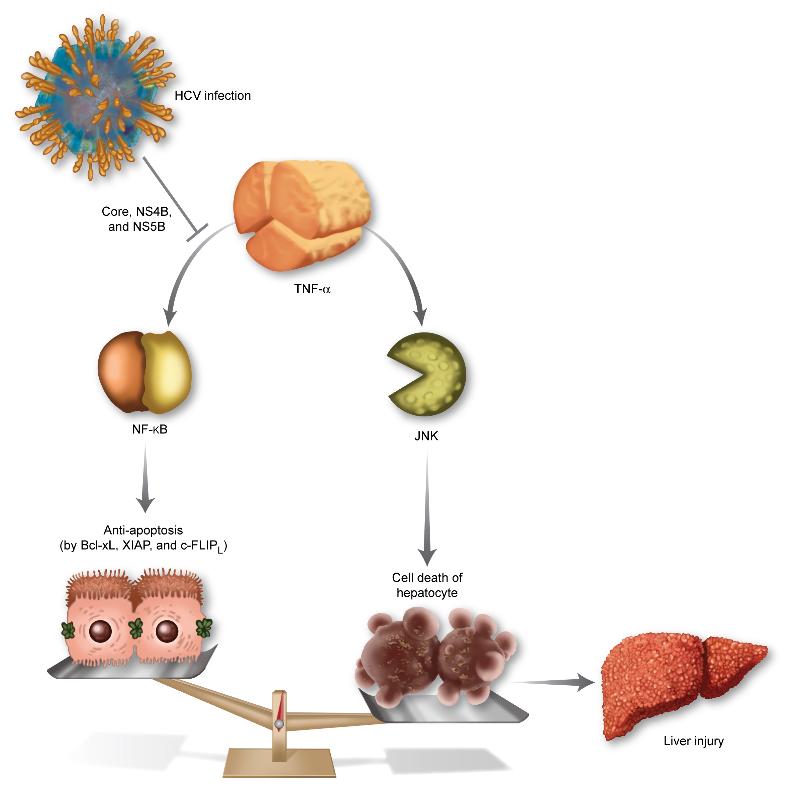
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
2012.09.04 조회수 18756
C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
2012.09.04 조회수 18756