%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B3%BC
-
 탄수화물 나노입자로 염증성 장 질환 치료하다
위장관에 발병하는 만성적인 염증성 장 질환은 아직 뚜렷한 원인이 밝혀지지 않아 비스테로이드성 항염증제들과 주사용 항체 치료제들을 이용한 치료법이 일반적이지만 면역약화 등의 부작용들로 인해 치료에 어려움이 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 장 내 당질층을 모사한 탄수화물 나노입자에 생체 내에서 항산화 및 항염증 작용을 하는 빌리루빈을 결합해 ‘항염증 탄수화물 나노입자(Anti-inflammatory Glycocalyx-mimicking nanoparticles)‘ 수십 종을 합성하고 이를 염증성 장 질환 치료에 적용함으로써 탁월한 효능을 보이는 의약을 개발했다고 2일 밝혔다.
세포막은 다양한 형태의 당 사슬 집합체인 당질층(glycocalyx)으로 둘러싸여 있다. 염증성 장 질환이 있는 사람의 장 조직에서는 정상인들과 다른 당질층이 형성되어 있다. 이러한 당질층은 우리 몸이나 음식에 많이 존재하는 탄수화물을 이루는 구성 성분인 여러 가지 당들에 대해 선택적인 결합력을 보인다. 이에 착안해 연구팀은 자연에 존재하는 탄수화물을 구성하는 대표적인 다섯 가지의 당들을 조합해 수 십가지의 인공 탄수화물(glycopolymers) 후보군들을 합성하여 염증성 장 질환 조직에 형성된 당질층에 잘 결합하는 인공 탄수화물 후보군을 선별하고자 하였다. 합성된 수 십가지의 인공 탄수화물에 우리 몸속에서 항산화 및 항염증 작용을 하는 빌리루빈 생리활성 물질을 결합하여 최종적으로 당질층을 표적할 수 있는 ‘항염증 탄수화물 나노입자(anti-inflammatory glyconanoparticles)’후보군들을 구축하였다.
연구팀은 구축된 항염증 탄수화물 나노입자 후보군들을 염증성 장 질환 생쥐모델에서 직접 경구투여를 통해 치료효능이 가장 우수한 탄수화물 나노입자를 선별할 수 있었다. 선별된 항염증 탄수화물 나노입자가 어떻게 치료효능 및 작용기전을 나타냈는지도 조사하였고 치료 효능이 기존에 사용하던 저분자 합성의약보다 더 우수한 효능을 가질 수 있음을 확인했다.
우리 대학 생명과학과 유도현 박사 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 정상급 학술지인 `앙게반테 케미(Angewandte Chemie International Edition, ISSN: 1433-7851 print, 1521-3773 online, Impact Factor: 16.823)' 6월 13일 字 온라인판에 게재됐다.
(https://doi.org/10.1002/anie.202304815 논문명: Anti-inflammatory Glycocalyx-Mimicking Nanoparticles for Colitis Treatment: Construction and In Vivo Evaluation).
전상용 교수는 “본 연구를 통해 당질층 표적형 항염증 탄수화물 나노입자 플랫폼 기술은 염증성 장 질환 외에도 다양한 염증 질환들의 치료에 적용될 수 있을 것으로 기대한다” 라고 말했다.
이 논문은 해당 학술지에서 선정한 특별 언론홍보 대상으로 선정돼 해외 과학 전문 보도 매체인 ‘ScienceDaily’ 와 ‘ChemistryViews’ 등에도 소개된 바 있다.(ScienceDaily: https://www.sciencedaily.com, ChemistryViews: https://www.chemistryviews.org)
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2023.08.02 조회수 6573
탄수화물 나노입자로 염증성 장 질환 치료하다
위장관에 발병하는 만성적인 염증성 장 질환은 아직 뚜렷한 원인이 밝혀지지 않아 비스테로이드성 항염증제들과 주사용 항체 치료제들을 이용한 치료법이 일반적이지만 면역약화 등의 부작용들로 인해 치료에 어려움이 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 장 내 당질층을 모사한 탄수화물 나노입자에 생체 내에서 항산화 및 항염증 작용을 하는 빌리루빈을 결합해 ‘항염증 탄수화물 나노입자(Anti-inflammatory Glycocalyx-mimicking nanoparticles)‘ 수십 종을 합성하고 이를 염증성 장 질환 치료에 적용함으로써 탁월한 효능을 보이는 의약을 개발했다고 2일 밝혔다.
세포막은 다양한 형태의 당 사슬 집합체인 당질층(glycocalyx)으로 둘러싸여 있다. 염증성 장 질환이 있는 사람의 장 조직에서는 정상인들과 다른 당질층이 형성되어 있다. 이러한 당질층은 우리 몸이나 음식에 많이 존재하는 탄수화물을 이루는 구성 성분인 여러 가지 당들에 대해 선택적인 결합력을 보인다. 이에 착안해 연구팀은 자연에 존재하는 탄수화물을 구성하는 대표적인 다섯 가지의 당들을 조합해 수 십가지의 인공 탄수화물(glycopolymers) 후보군들을 합성하여 염증성 장 질환 조직에 형성된 당질층에 잘 결합하는 인공 탄수화물 후보군을 선별하고자 하였다. 합성된 수 십가지의 인공 탄수화물에 우리 몸속에서 항산화 및 항염증 작용을 하는 빌리루빈 생리활성 물질을 결합하여 최종적으로 당질층을 표적할 수 있는 ‘항염증 탄수화물 나노입자(anti-inflammatory glyconanoparticles)’후보군들을 구축하였다.
연구팀은 구축된 항염증 탄수화물 나노입자 후보군들을 염증성 장 질환 생쥐모델에서 직접 경구투여를 통해 치료효능이 가장 우수한 탄수화물 나노입자를 선별할 수 있었다. 선별된 항염증 탄수화물 나노입자가 어떻게 치료효능 및 작용기전을 나타냈는지도 조사하였고 치료 효능이 기존에 사용하던 저분자 합성의약보다 더 우수한 효능을 가질 수 있음을 확인했다.
우리 대학 생명과학과 유도현 박사 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 정상급 학술지인 `앙게반테 케미(Angewandte Chemie International Edition, ISSN: 1433-7851 print, 1521-3773 online, Impact Factor: 16.823)' 6월 13일 字 온라인판에 게재됐다.
(https://doi.org/10.1002/anie.202304815 논문명: Anti-inflammatory Glycocalyx-Mimicking Nanoparticles for Colitis Treatment: Construction and In Vivo Evaluation).
전상용 교수는 “본 연구를 통해 당질층 표적형 항염증 탄수화물 나노입자 플랫폼 기술은 염증성 장 질환 외에도 다양한 염증 질환들의 치료에 적용될 수 있을 것으로 기대한다” 라고 말했다.
이 논문은 해당 학술지에서 선정한 특별 언론홍보 대상으로 선정돼 해외 과학 전문 보도 매체인 ‘ScienceDaily’ 와 ‘ChemistryViews’ 등에도 소개된 바 있다.(ScienceDaily: https://www.sciencedaily.com, ChemistryViews: https://www.chemistryviews.org)
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2023.08.02 조회수 6573 -
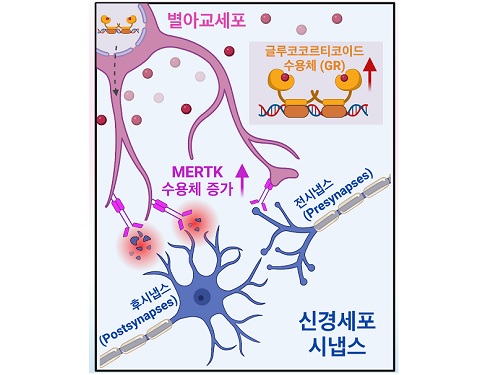 아동 학대로 인한 정신질환 발병 원인 최초 규명
아동기 시 부모에게서 떨어져서 방치되거나 학대를 받을 경우, 극심한 스트레스 현상이 일어난다. 이러한 스트레스 상황을 겪게 되면 성인으로 성장하는 과정 동안 뇌 신경 회로망 및 기능이 크게 변화되어 조현병 및 우울증과 같은 정신질환이 발생될 수 있다. 하지만 현재까지 아동기 스트레스에 따른 정신질환의 원인과 그 제어 방법에 대해서는 정확히 알려진 바가 없다.
우리 대학 생명과학과 정원석 교수 연구팀이 아동 학대 및 방임 등의 아동기 스트레스로 인해 발병되는 정신질환이 별아교세포의 과도한 시냅스 제거에서 기인함을 최초로 규명해 면역 관련 최고 국제 학술지인 ‘이뮤니티(Immunity)’에 발표했다고 1일 밝혔다.
정원석 교수 연구팀은 뇌에서 면역기능을 담당하는 별아교세포가 스트레스 호르몬에 반응하여 과도하게 흥분성 시냅스를 제거하는 현상이, 아동 학대 및 방임에 따른 정신질환 발병의 주요 원인임을 최초로 규명하였다. 과도한 스트레스가 다양한 정신질환의 원인으로 작용할 수 있음이 임상적으로 알려져 있었지만, 그 정확한 발병 기전은 알려지지 않았기 때문에 이번 연구는 스트레스로 인한 정신질환의 예방 및 치료에 크게 응용될 수 있을 것으로 기대된다.
연구팀은 미국식품의약국 (FDA)에서 승인된 임상 약물 스크리닝을 진행해 별아교세포의 외부 물질을 잡아 먹어 제거하는 역할(포식 작용)을 조절하는 새로운 기작을 발굴했다. 그 결과, 연구팀은 스트레스 호르몬이라 불리는 합성 글루코코르티코이드(synthetic glucocorticoid)가 별아교세포의 포식 작용을 비정상적으로 크게 높이는 것을 발견했다. 글루코코르티코이드는 당대사, 항염증 등 생명 유지에 필요한 역할을 하는 한편 스트레스와 같은 외부 자극에 의해 분비돼 신체가 대응할 수 있도록 한다. 하지만 만성 스트레스로 인해 글루코코르티코이드에 과도하게 장기간 노출되면 우울증, 인지장애, 불안 증세와 같은 다양한 정신질환이 발병할 수 있다.
연구팀은 아동기 스트레스로 인한 별아교세포의 기능 변화를 이해하고자 아동기 사회성 결핍(early social deprivation) 생쥐 모델을 활용했고, 그 결과 스트레스 호르몬이 별아교세포의 글루코코르티코이드 수용체 (glucocorticoid receptor; GR)와 결합해 별아교세포의 포식 작용에 중요한 역할을 하는 MERTK(Mer Tyrosine Kinase)라는 수용체의 발현을 크게 증가시킴을 알아냈다. 놀랍게도 별아교세포는 증가된 MERTK를 통해 다양한 대뇌 피질에 존재하는 특정 신경 세포의 흥분성 시냅스만을 선택적으로 잡아 먹어 감소시켰으며, 이로 인한 비정상적인 신경 회로망 형성으로 추후 성인기에 사회성 결핍과 우울증 같은 복합적인 행동 이상이 일어남을 발견했다.
뿐만 아니라 연구팀은 별아교세포와 함께 뇌 면역 기능에 중요한 역할을 담당하는 것으로 알려진 미세아교세포는 아동기 사회성 결핍 쥐 모델에서의 시냅스 제거에는 전혀 참여하고 있지 않음을 관찰했다. 이는 아동기 스트레스 상황에서 미세아교세포가 아닌 별아교세포가 특이적으로 스트레스 호르몬에 반응해 뇌의 환경을 조절하고 있음을 확인한 것이다.
연구팀은 이 같은 발견이 인간에게도 적용될 수 있는지를 알아보기 위해, 인간 만능 유도 줄기세포에서 유래한 뇌 오가노이드를 활용해 스트레스 호르몬에 대한 반응을 확인했다. 중요하게도 연구팀은 인간 뇌 오가노이드에서도 스트레스 호르몬에 의해 별아교세포의 글루코코르티코이드 수용체와 포식 수용체가 모두 활성화됨을 발견했으며, 또한 별아교세포가 흥분성 시냅스를 과도하게 제거함을 확인했다. 이로써 스트레스 반응에 대한 쥐와 인간의 시냅스 조절 메커니즘이 같음을 보임으로써, 연구팀은 이번 발견이 인간의 정신질환 치료에도 응용될 수 있음을 제시했다.
정원석 교수는 “지금까지 아동기 스트레스와 뇌 질환 발병의 메커니즘은 잘 밝혀져 있지 않았지만, 이번 연구를 통해 과도한 별아교세포의 포식 작용이 정신질환 발병에 있어 중요한 원인이 될 수 있음을 최초로 증명했다”고 언급하며 “추후 다양한 뇌 질환의 이해와 치료에 있어서 별아교세포의 면역기능 조절이 근본적인 타겟으로 응용될 수 있을 것”이라고 밝혔다.
우리 대학 생명과학과 변유경, 김규리 박사과정 학생과 김남식 박사후연구원이 공동 제1 저자로 참여한 이번 연구는 셀(Cell) 자매지이자 면역 관련 최고 국제 학술지인 `이뮤니티 (IMMUNITY)' 7월 31일 字 온라인 출판됐다. (논문명 : Stress induces behavioral abnormalities by increasing expression of phagocytic receptor MERTK in astrocytes to promote synapse phagocytosis).
한편 이번 연구는 연구재단 중견 연구, 뇌질환극복연구사업, 뇌기능 규명 조절 기술 개발사업의 지원을 받아 수행됐다.
2023.08.01 조회수 6714
아동 학대로 인한 정신질환 발병 원인 최초 규명
아동기 시 부모에게서 떨어져서 방치되거나 학대를 받을 경우, 극심한 스트레스 현상이 일어난다. 이러한 스트레스 상황을 겪게 되면 성인으로 성장하는 과정 동안 뇌 신경 회로망 및 기능이 크게 변화되어 조현병 및 우울증과 같은 정신질환이 발생될 수 있다. 하지만 현재까지 아동기 스트레스에 따른 정신질환의 원인과 그 제어 방법에 대해서는 정확히 알려진 바가 없다.
우리 대학 생명과학과 정원석 교수 연구팀이 아동 학대 및 방임 등의 아동기 스트레스로 인해 발병되는 정신질환이 별아교세포의 과도한 시냅스 제거에서 기인함을 최초로 규명해 면역 관련 최고 국제 학술지인 ‘이뮤니티(Immunity)’에 발표했다고 1일 밝혔다.
정원석 교수 연구팀은 뇌에서 면역기능을 담당하는 별아교세포가 스트레스 호르몬에 반응하여 과도하게 흥분성 시냅스를 제거하는 현상이, 아동 학대 및 방임에 따른 정신질환 발병의 주요 원인임을 최초로 규명하였다. 과도한 스트레스가 다양한 정신질환의 원인으로 작용할 수 있음이 임상적으로 알려져 있었지만, 그 정확한 발병 기전은 알려지지 않았기 때문에 이번 연구는 스트레스로 인한 정신질환의 예방 및 치료에 크게 응용될 수 있을 것으로 기대된다.
연구팀은 미국식품의약국 (FDA)에서 승인된 임상 약물 스크리닝을 진행해 별아교세포의 외부 물질을 잡아 먹어 제거하는 역할(포식 작용)을 조절하는 새로운 기작을 발굴했다. 그 결과, 연구팀은 스트레스 호르몬이라 불리는 합성 글루코코르티코이드(synthetic glucocorticoid)가 별아교세포의 포식 작용을 비정상적으로 크게 높이는 것을 발견했다. 글루코코르티코이드는 당대사, 항염증 등 생명 유지에 필요한 역할을 하는 한편 스트레스와 같은 외부 자극에 의해 분비돼 신체가 대응할 수 있도록 한다. 하지만 만성 스트레스로 인해 글루코코르티코이드에 과도하게 장기간 노출되면 우울증, 인지장애, 불안 증세와 같은 다양한 정신질환이 발병할 수 있다.
연구팀은 아동기 스트레스로 인한 별아교세포의 기능 변화를 이해하고자 아동기 사회성 결핍(early social deprivation) 생쥐 모델을 활용했고, 그 결과 스트레스 호르몬이 별아교세포의 글루코코르티코이드 수용체 (glucocorticoid receptor; GR)와 결합해 별아교세포의 포식 작용에 중요한 역할을 하는 MERTK(Mer Tyrosine Kinase)라는 수용체의 발현을 크게 증가시킴을 알아냈다. 놀랍게도 별아교세포는 증가된 MERTK를 통해 다양한 대뇌 피질에 존재하는 특정 신경 세포의 흥분성 시냅스만을 선택적으로 잡아 먹어 감소시켰으며, 이로 인한 비정상적인 신경 회로망 형성으로 추후 성인기에 사회성 결핍과 우울증 같은 복합적인 행동 이상이 일어남을 발견했다.
뿐만 아니라 연구팀은 별아교세포와 함께 뇌 면역 기능에 중요한 역할을 담당하는 것으로 알려진 미세아교세포는 아동기 사회성 결핍 쥐 모델에서의 시냅스 제거에는 전혀 참여하고 있지 않음을 관찰했다. 이는 아동기 스트레스 상황에서 미세아교세포가 아닌 별아교세포가 특이적으로 스트레스 호르몬에 반응해 뇌의 환경을 조절하고 있음을 확인한 것이다.
연구팀은 이 같은 발견이 인간에게도 적용될 수 있는지를 알아보기 위해, 인간 만능 유도 줄기세포에서 유래한 뇌 오가노이드를 활용해 스트레스 호르몬에 대한 반응을 확인했다. 중요하게도 연구팀은 인간 뇌 오가노이드에서도 스트레스 호르몬에 의해 별아교세포의 글루코코르티코이드 수용체와 포식 수용체가 모두 활성화됨을 발견했으며, 또한 별아교세포가 흥분성 시냅스를 과도하게 제거함을 확인했다. 이로써 스트레스 반응에 대한 쥐와 인간의 시냅스 조절 메커니즘이 같음을 보임으로써, 연구팀은 이번 발견이 인간의 정신질환 치료에도 응용될 수 있음을 제시했다.
정원석 교수는 “지금까지 아동기 스트레스와 뇌 질환 발병의 메커니즘은 잘 밝혀져 있지 않았지만, 이번 연구를 통해 과도한 별아교세포의 포식 작용이 정신질환 발병에 있어 중요한 원인이 될 수 있음을 최초로 증명했다”고 언급하며 “추후 다양한 뇌 질환의 이해와 치료에 있어서 별아교세포의 면역기능 조절이 근본적인 타겟으로 응용될 수 있을 것”이라고 밝혔다.
우리 대학 생명과학과 변유경, 김규리 박사과정 학생과 김남식 박사후연구원이 공동 제1 저자로 참여한 이번 연구는 셀(Cell) 자매지이자 면역 관련 최고 국제 학술지인 `이뮤니티 (IMMUNITY)' 7월 31일 字 온라인 출판됐다. (논문명 : Stress induces behavioral abnormalities by increasing expression of phagocytic receptor MERTK in astrocytes to promote synapse phagocytosis).
한편 이번 연구는 연구재단 중견 연구, 뇌질환극복연구사업, 뇌기능 규명 조절 기술 개발사업의 지원을 받아 수행됐다.
2023.08.01 조회수 6714 -
 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 7329
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 7329 -
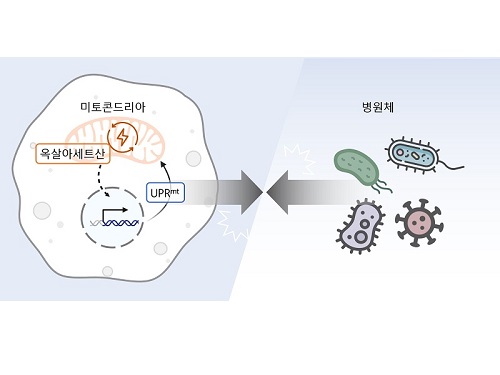 생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 7083
생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 7083 -
 나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 5802
나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 5802 -
 파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
2023.05.08 조회수 6274
파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
2023.05.08 조회수 6274 -
 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 12359
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 12359 -
 말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 7992
말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 7992 -
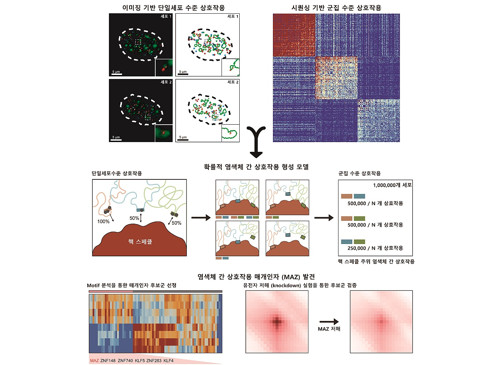 암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 6937
암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 6937 -
 KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 6870
KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 6870 -
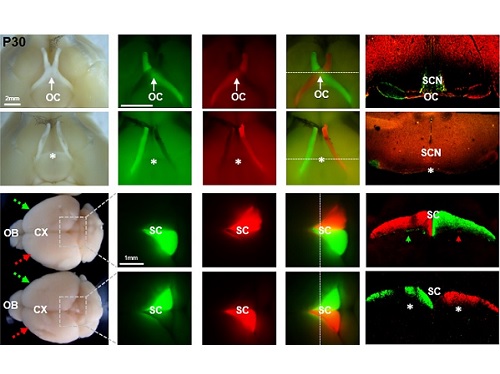 왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 8133
왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 8133 -
 새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
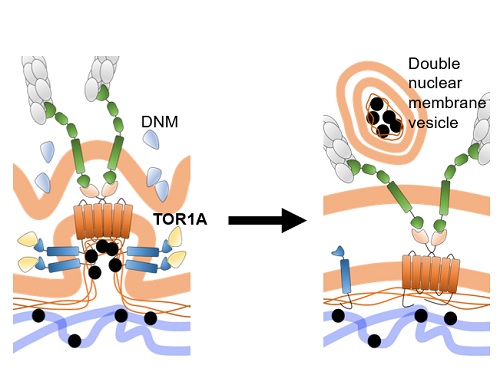
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 8599
새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 8599