%EB%8B%A8%EB%B0%B1%EC%A7%88
-
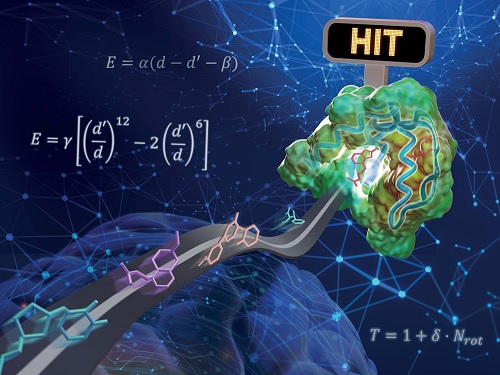 실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
2022.05.17 조회수 16204
실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
2022.05.17 조회수 16204 -
 수학과 실험을 결합하여 생체시계의 역설 규명
수학과 실험을 결합한 융합연구를 통해 생체시계가 안정적 리듬을 유지하면서도 환경변화에 쉽게 적응할 수 있는 원리가 밝혀졌다. 우리 대학 수리과학과 김재경 교수가 이끄는 기초과학연구원(IBS) 수리 및 계산과학 연구단 의생명 수학 그룹과 우리 대학 수리과학과 연구팀, 그리고 아주대 의과대학 뇌과학과 김은영 교수 연구팀은 공동연구를 통해 초파리 뇌의 생체시계 뉴런들의 생체시계 작동원리를 분석했다.
생체시계(Circadian clock)는 생명체가 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 예를 들어, 생체시계는 밤 9시경이 되면 뇌에서 멜라토닌 호르몬 분비를 유발해 일정 시간이 되면 수면을 취할 수 있도록 하는 등 우리 운동 능력이나 학습 능력에 이르는 거의 모든 생리 작용에 관여한다. 따라서, 평소에는 일정한 시간을 안정적으로 몸에 제시하면서, 동시에 계절 변화에 따른 낮밤의 길이 변화나 해외여행으로 인한 시차 등 환경변화가 생겼을 때는 새로운 환경에 유연하게 적응해서 변화한 시간을 몸에 제시해주어야 한다. 이러한 안정성과 유연성을 동시에 유지하는 생체시계의 역설적인 성질의 원리는 지금까지 알려져 있지 않았다.
초파리 생체시계 뉴런들의 경우, 마스터 뉴런(master neuron)이 외부로부터 들어오는 빛 정보를 취합하여 시간 정보를 슬레이브 뉴런(slave neuron)에 전달하면, 이에 맞춰 슬레이브 뉴런이 일주기 행동을 조절하는 계층구조를 형성하고 있다. 이러한 역할 차이에도 불구하고, 두 뉴런의 생체시계는 동일한 원리로 작동한다고 알려져 있었다. 2017년 노벨 생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
연구진은 초파리에서 CLK에 변이가 생겼을 때 마스터 뉴런과 슬레이브 뉴런에서 서로 다른 PER변화 양상이 나타나는 것에 착안하여 마스터 뉴런과 슬레이브 뉴런이 만들어내는 PER 단백질의 변화 양상을 1000여 개 수리 모델을 개발하여 분석한 결과, 마스터 뉴런의 PER이 슬레이브 뉴런의 PER에 비해 빠르게 합성되었다 분해되고 있음을 예측하였다. 이러한 마스터 뉴런의 독특한 성질 덕분에, 평소에 강한 PER 리듬을 생성해서 안정적인 시계 역할을 하다가 외부 환경에 변화가 일어났을 때 빠르게 적응할 수 있음 역시 가상 시뮬레이션을 통해 예측하였다. 이러한 마스터 뉴런에 관한 수리모델링 예측은 초파리 생체 실험을 통해서도 검증되었다.
김재경 교수는 “모든 세포의 생체시계는 당연히 비슷한 방식으로 작동될 것이란 오래된 믿음이 수학을 이용한 분석 덕분에 틀렸음을 알게 되었다”며 “수학과 실험을 융합한 방식으로 문제에 접근하였기 때문에 문제를 해결할 수 있었다”고 말했다. 또한, 김은영 교수는 “마스터 뉴런 생체시계의 독특한 성질 덕분에 생체시계가 안정성과 유연성이라는 역설적인 성질을 모두 가질 수 있었다”며 “모든 세포의 생체시계가 천편일률적으로 작동하는 대신 자신의 역할에 맞게 다른 작동 방식을 취한다는 점이 놀라웠다”고 말했다.
생체시계가 안정성과 유연성을 동시에 유지하지 못하면 다양한 환경에서 일정한 수면패턴을 유지할 수 없고, 일주기 리듬 수면장애가 발생한다. 이번 연구결과는 일주기 리듬 수면장애의 원인을 규명하고 치료법을 찾는 새로운 패러다임을 제시할 수 있을 것으로 예상된다.
정의민, 권미리, 조은주 박사가 공동 제 1저자로 참여한 이번 연구결과는 2월 15일 오후 5시(한국시간) 자연과학 분야의 저명 국제학술지인 미국국립과학원회보(Proceedings Of The National Academy Of Sciences, PNAS, IF 11.205)에 게재됐다.
* 논문명: Systematic modeling-driven experiments identify distinct molecular clockworks underlying hierarchically organized pacemaker neurons
2022.02.16 조회수 15780
수학과 실험을 결합하여 생체시계의 역설 규명
수학과 실험을 결합한 융합연구를 통해 생체시계가 안정적 리듬을 유지하면서도 환경변화에 쉽게 적응할 수 있는 원리가 밝혀졌다. 우리 대학 수리과학과 김재경 교수가 이끄는 기초과학연구원(IBS) 수리 및 계산과학 연구단 의생명 수학 그룹과 우리 대학 수리과학과 연구팀, 그리고 아주대 의과대학 뇌과학과 김은영 교수 연구팀은 공동연구를 통해 초파리 뇌의 생체시계 뉴런들의 생체시계 작동원리를 분석했다.
생체시계(Circadian clock)는 생명체가 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 예를 들어, 생체시계는 밤 9시경이 되면 뇌에서 멜라토닌 호르몬 분비를 유발해 일정 시간이 되면 수면을 취할 수 있도록 하는 등 우리 운동 능력이나 학습 능력에 이르는 거의 모든 생리 작용에 관여한다. 따라서, 평소에는 일정한 시간을 안정적으로 몸에 제시하면서, 동시에 계절 변화에 따른 낮밤의 길이 변화나 해외여행으로 인한 시차 등 환경변화가 생겼을 때는 새로운 환경에 유연하게 적응해서 변화한 시간을 몸에 제시해주어야 한다. 이러한 안정성과 유연성을 동시에 유지하는 생체시계의 역설적인 성질의 원리는 지금까지 알려져 있지 않았다.
초파리 생체시계 뉴런들의 경우, 마스터 뉴런(master neuron)이 외부로부터 들어오는 빛 정보를 취합하여 시간 정보를 슬레이브 뉴런(slave neuron)에 전달하면, 이에 맞춰 슬레이브 뉴런이 일주기 행동을 조절하는 계층구조를 형성하고 있다. 이러한 역할 차이에도 불구하고, 두 뉴런의 생체시계는 동일한 원리로 작동한다고 알려져 있었다. 2017년 노벨 생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
연구진은 초파리에서 CLK에 변이가 생겼을 때 마스터 뉴런과 슬레이브 뉴런에서 서로 다른 PER변화 양상이 나타나는 것에 착안하여 마스터 뉴런과 슬레이브 뉴런이 만들어내는 PER 단백질의 변화 양상을 1000여 개 수리 모델을 개발하여 분석한 결과, 마스터 뉴런의 PER이 슬레이브 뉴런의 PER에 비해 빠르게 합성되었다 분해되고 있음을 예측하였다. 이러한 마스터 뉴런의 독특한 성질 덕분에, 평소에 강한 PER 리듬을 생성해서 안정적인 시계 역할을 하다가 외부 환경에 변화가 일어났을 때 빠르게 적응할 수 있음 역시 가상 시뮬레이션을 통해 예측하였다. 이러한 마스터 뉴런에 관한 수리모델링 예측은 초파리 생체 실험을 통해서도 검증되었다.
김재경 교수는 “모든 세포의 생체시계는 당연히 비슷한 방식으로 작동될 것이란 오래된 믿음이 수학을 이용한 분석 덕분에 틀렸음을 알게 되었다”며 “수학과 실험을 융합한 방식으로 문제에 접근하였기 때문에 문제를 해결할 수 있었다”고 말했다. 또한, 김은영 교수는 “마스터 뉴런 생체시계의 독특한 성질 덕분에 생체시계가 안정성과 유연성이라는 역설적인 성질을 모두 가질 수 있었다”며 “모든 세포의 생체시계가 천편일률적으로 작동하는 대신 자신의 역할에 맞게 다른 작동 방식을 취한다는 점이 놀라웠다”고 말했다.
생체시계가 안정성과 유연성을 동시에 유지하지 못하면 다양한 환경에서 일정한 수면패턴을 유지할 수 없고, 일주기 리듬 수면장애가 발생한다. 이번 연구결과는 일주기 리듬 수면장애의 원인을 규명하고 치료법을 찾는 새로운 패러다임을 제시할 수 있을 것으로 예상된다.
정의민, 권미리, 조은주 박사가 공동 제 1저자로 참여한 이번 연구결과는 2월 15일 오후 5시(한국시간) 자연과학 분야의 저명 국제학술지인 미국국립과학원회보(Proceedings Of The National Academy Of Sciences, PNAS, IF 11.205)에 게재됐다.
* 논문명: Systematic modeling-driven experiments identify distinct molecular clockworks underlying hierarchically organized pacemaker neurons
2022.02.16 조회수 15780 -
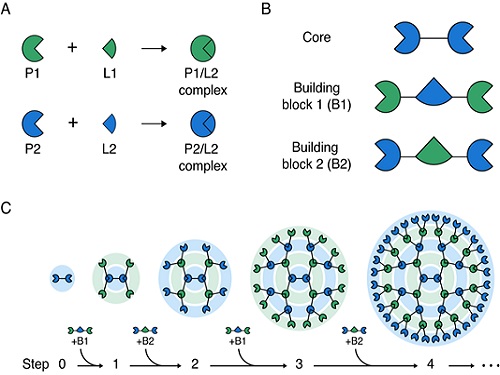 거대 단백질 구조체를 레고 블록 쌓듯 조립하는 기술 개발
우리 대학 생명과학과 김학성 교수와 배진호 박사팀이 거대 (초분자) 단백질을 레고 블록 쌓듯 조립할 수 있는 새로운 기술을 개발했다고 19일 밝혔다. 이 방법으로 단백질 구조체의 크기 및 작용기 수를 원하는 대로 조절할 수 있고 메가 달톤(dalton) 크기의 대칭형 거대 단백질 구조체를 조립할 수 있다. 거대 단백질 구조체는 효율적인 약물 전달, 다양한 백신 개발, 그리고 질병 진단에 활용될 것으로 기대된다.
이번 연구 성과는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science)' (IF: 16.806)에 2021년 11월 1일 字 온라인 발표됐다. (논문명: Dendrimer-like supramolecular assembly of proteins with a tunable size and valency through stepwise iterative growth)
자연계에는 매우 다양한 특성과 기능을 갖는 단백질이 존재하며 생명현상을 유지하는데 핵심 역할을 한다. 이러한 단백질 중에는 단량체가 큰 구조체 형태로 조립됐을 때만 정상적 기능을 수행하거나, 어떤 경우에는 조립된 경우가 단량체와 완전히 다른 특성을 나타내며, 심지어는 심각한 질병을 유발하는 경우도 많다.
예를 들어 바이러스의 껍질인 켑시드는 단백질 단량체가 조립(assembly)된 것이고, 치매는 아밀로이드 펩타이드나 타우(tau) 단백질이 파이브릴(fibril) 형태로 조립되면서 발생한다. 따라서, 거대(초분자) 단백질 구조체들의 조립 기작 이해는 단백질의 기능과 질병의 원인 규명 및 치료제 개발에 중요하다. 또한, 단백질 구조체는 뛰어난 생체 적합도 때문에 생명공학 및 의학 분야에서도 응용 가능성이 크다.
현재 많은 연구 그룹에서 자연계에 존재하는 단백질 구조체들의 조립 과정을 모방해 새로운 기능의 단백질 구조체 개발에 많은 연구를 진행하고 있다. 그러나 단백질의 구조적 다양성, 상이한 특성 및 큰 분자량 때문에 원하는 구조체를 자유자재로 조립하는 것은 아직도 어려운 과제로 남아 있다.
김학성 교수 연구팀은 두 종류의 빌딩(building) 블록 단백질을 코어(core) 단백질에 순차적으로 교대로 결합시킴으로써 간편하게 3차원 구조의 대칭형 거대 단백질 구조체를 조립하는 방법을 개발했다(그림 1). 즉, 서로 특이적으로 반응하는 두 쌍의 단백질과 리건드(P1/L1 과 P2/L2)를 이용해 코어(core) 단백질에 두 종류의 빌딩(building) 블록을 순차적, 반복적으로 결합함으로써 크기와 작용 기작 수를 조절하면서 메가 달톤 (Mega Dalton) 크기를 갖는 단백질 구조체를 쉽게 조립하였다.
개발된 구조체는 다양한 분야에 응용 가능하며 하나의 예로서, 이번 연구에서는 단백질 구조체에 박테리아 독소를 결합해 암세포 내로 고효율로 전달할 수 있었고, 결과적으로 암세포를 효과적으로 사멸했다(그림 2). 구조체 단백질의 특징인 다가 효과(avidity effect)로 인해 암 표적에 대한 결합력이 약 1,000배 이상 증가돼 암세포 사멸 효과가 획기적으로 증대됐고 이러한 특성은 백신 개발 및 질병 진단에도 응용될 수 있다.
제1 저자인 배진호 박사는 "이번 연구에서 개발된 거대(초분자) 단백질 구조체 조립 기술은 향후, 약물 전달, 백신 개발, 질병 진단 및 바이오센서 등을 포함한 광범위한 분야에서 새로운 플랫폼 기술로 활용될 수 있을 것ˮ이라고 말했다.
이번 연구는 한국 연구 재단의 중견 연구과제 (NRF-2021R1A2C201421811) 지원을 받아 수행됐다.
2021.11.19 조회수 10676
거대 단백질 구조체를 레고 블록 쌓듯 조립하는 기술 개발
우리 대학 생명과학과 김학성 교수와 배진호 박사팀이 거대 (초분자) 단백질을 레고 블록 쌓듯 조립할 수 있는 새로운 기술을 개발했다고 19일 밝혔다. 이 방법으로 단백질 구조체의 크기 및 작용기 수를 원하는 대로 조절할 수 있고 메가 달톤(dalton) 크기의 대칭형 거대 단백질 구조체를 조립할 수 있다. 거대 단백질 구조체는 효율적인 약물 전달, 다양한 백신 개발, 그리고 질병 진단에 활용될 것으로 기대된다.
이번 연구 성과는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science)' (IF: 16.806)에 2021년 11월 1일 字 온라인 발표됐다. (논문명: Dendrimer-like supramolecular assembly of proteins with a tunable size and valency through stepwise iterative growth)
자연계에는 매우 다양한 특성과 기능을 갖는 단백질이 존재하며 생명현상을 유지하는데 핵심 역할을 한다. 이러한 단백질 중에는 단량체가 큰 구조체 형태로 조립됐을 때만 정상적 기능을 수행하거나, 어떤 경우에는 조립된 경우가 단량체와 완전히 다른 특성을 나타내며, 심지어는 심각한 질병을 유발하는 경우도 많다.
예를 들어 바이러스의 껍질인 켑시드는 단백질 단량체가 조립(assembly)된 것이고, 치매는 아밀로이드 펩타이드나 타우(tau) 단백질이 파이브릴(fibril) 형태로 조립되면서 발생한다. 따라서, 거대(초분자) 단백질 구조체들의 조립 기작 이해는 단백질의 기능과 질병의 원인 규명 및 치료제 개발에 중요하다. 또한, 단백질 구조체는 뛰어난 생체 적합도 때문에 생명공학 및 의학 분야에서도 응용 가능성이 크다.
현재 많은 연구 그룹에서 자연계에 존재하는 단백질 구조체들의 조립 과정을 모방해 새로운 기능의 단백질 구조체 개발에 많은 연구를 진행하고 있다. 그러나 단백질의 구조적 다양성, 상이한 특성 및 큰 분자량 때문에 원하는 구조체를 자유자재로 조립하는 것은 아직도 어려운 과제로 남아 있다.
김학성 교수 연구팀은 두 종류의 빌딩(building) 블록 단백질을 코어(core) 단백질에 순차적으로 교대로 결합시킴으로써 간편하게 3차원 구조의 대칭형 거대 단백질 구조체를 조립하는 방법을 개발했다(그림 1). 즉, 서로 특이적으로 반응하는 두 쌍의 단백질과 리건드(P1/L1 과 P2/L2)를 이용해 코어(core) 단백질에 두 종류의 빌딩(building) 블록을 순차적, 반복적으로 결합함으로써 크기와 작용 기작 수를 조절하면서 메가 달톤 (Mega Dalton) 크기를 갖는 단백질 구조체를 쉽게 조립하였다.
개발된 구조체는 다양한 분야에 응용 가능하며 하나의 예로서, 이번 연구에서는 단백질 구조체에 박테리아 독소를 결합해 암세포 내로 고효율로 전달할 수 있었고, 결과적으로 암세포를 효과적으로 사멸했다(그림 2). 구조체 단백질의 특징인 다가 효과(avidity effect)로 인해 암 표적에 대한 결합력이 약 1,000배 이상 증가돼 암세포 사멸 효과가 획기적으로 증대됐고 이러한 특성은 백신 개발 및 질병 진단에도 응용될 수 있다.
제1 저자인 배진호 박사는 "이번 연구에서 개발된 거대(초분자) 단백질 구조체 조립 기술은 향후, 약물 전달, 백신 개발, 질병 진단 및 바이오센서 등을 포함한 광범위한 분야에서 새로운 플랫폼 기술로 활용될 수 있을 것ˮ이라고 말했다.
이번 연구는 한국 연구 재단의 중견 연구과제 (NRF-2021R1A2C201421811) 지원을 받아 수행됐다.
2021.11.19 조회수 10676 -
 생체 내 조직 특이적 분비 단백질 표지 기법 개발
우리 대학 의과학대학원 서재명 교수 연구팀이 서울대학교 화학부 이현우 교수, 서울대학교 생명과학부 김종서 교수 연구팀과 공동연구를 통해 생체 내 조직 특이적 분비 단백질 표지 기법을 개발했다고 13일 밝혔다.
공동연구팀은 근접 표지 효소를 활용해 생쥐의 혈장 내에서 특정 조직이 분비하는 단백질만을 분리할 수 있는 기법을 개발했다. 이러한 체내 표지 기법은 지금까지의 체외 세포주 실험의 한계를 뛰어넘어 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
의과학대학원 김광은 석박사통합과정, 서울대학교 화학부 박이삭 석박사통합과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션즈(Nature Communications)' 9월 1일 字 온라인판에 출판됐다. (논문명 : Dynamic tracking and identification of tissue-specific secretory proteins in the circulation of live mice).
분비 단백질은 세포 및 조직 간의 신호 전달을 매개해 생리학적 기능을 조절하는 주요한 인자이며 질병 치료제의 주요 표적으로도 활용되고 있어 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다.
현재까지 대부분의 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다.
이를 극복하기 위해서는 체내 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다.
공동연구팀은 문제 해결을 위해 근접 표지 효소를 활용해 소포체 내강을 통하는 분비 단백질을 바이오틴으로 표지했다. 표지된 단백질은 스트렙타비딘을 이용해 손쉽게 검출하거나 분리할 수 있었다.
이 효소를 생쥐의 간에 전달한 후 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있음을 확인했다.
나아가 공동연구팀은 이 기법을 질병 모델에서 검증하기 위해 인슐린 저항성 생쥐 모델에 적용했고, 그 결과 인슐린 저항성과 관련이 있는 것으로 보고된 단백질들을 성공적으로 검출할 수 있었다.
공동연구팀은 추후 이 기법을 체내의 다양한 조직에 적용하거나 질환 모델과 결합해 질병의 진행 과정과 관련된 단백질을 검출할 수 있을 것으로 예상했다.
공동 제1 저자인 김광은 석박사통합과정은 "체내에서 간이 분비하는 단백질들은 세포주의 결과와는 크게 달랐고, 이는 기존 세포주를 이용한 분비 단백질 연구의 한계와 그 한계를 극복할 수 있는 이번 기법의 차별성을 보여주는 결과다ˮ라며 "체내 생리학적 상태를 더 온전하게 반영할 수 있는 바이오마커 및 치료 표적 발굴에 활용될 수 있을 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단, KAIST 중점연구소(융합연구단), 기초과학연구원의 지원을 받아 수행됐다.
2021.09.13 조회수 13343
생체 내 조직 특이적 분비 단백질 표지 기법 개발
우리 대학 의과학대학원 서재명 교수 연구팀이 서울대학교 화학부 이현우 교수, 서울대학교 생명과학부 김종서 교수 연구팀과 공동연구를 통해 생체 내 조직 특이적 분비 단백질 표지 기법을 개발했다고 13일 밝혔다.
공동연구팀은 근접 표지 효소를 활용해 생쥐의 혈장 내에서 특정 조직이 분비하는 단백질만을 분리할 수 있는 기법을 개발했다. 이러한 체내 표지 기법은 지금까지의 체외 세포주 실험의 한계를 뛰어넘어 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
의과학대학원 김광은 석박사통합과정, 서울대학교 화학부 박이삭 석박사통합과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션즈(Nature Communications)' 9월 1일 字 온라인판에 출판됐다. (논문명 : Dynamic tracking and identification of tissue-specific secretory proteins in the circulation of live mice).
분비 단백질은 세포 및 조직 간의 신호 전달을 매개해 생리학적 기능을 조절하는 주요한 인자이며 질병 치료제의 주요 표적으로도 활용되고 있어 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다.
현재까지 대부분의 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다.
이를 극복하기 위해서는 체내 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다.
공동연구팀은 문제 해결을 위해 근접 표지 효소를 활용해 소포체 내강을 통하는 분비 단백질을 바이오틴으로 표지했다. 표지된 단백질은 스트렙타비딘을 이용해 손쉽게 검출하거나 분리할 수 있었다.
이 효소를 생쥐의 간에 전달한 후 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있음을 확인했다.
나아가 공동연구팀은 이 기법을 질병 모델에서 검증하기 위해 인슐린 저항성 생쥐 모델에 적용했고, 그 결과 인슐린 저항성과 관련이 있는 것으로 보고된 단백질들을 성공적으로 검출할 수 있었다.
공동연구팀은 추후 이 기법을 체내의 다양한 조직에 적용하거나 질환 모델과 결합해 질병의 진행 과정과 관련된 단백질을 검출할 수 있을 것으로 예상했다.
공동 제1 저자인 김광은 석박사통합과정은 "체내에서 간이 분비하는 단백질들은 세포주의 결과와는 크게 달랐고, 이는 기존 세포주를 이용한 분비 단백질 연구의 한계와 그 한계를 극복할 수 있는 이번 기법의 차별성을 보여주는 결과다ˮ라며 "체내 생리학적 상태를 더 온전하게 반영할 수 있는 바이오마커 및 치료 표적 발굴에 활용될 수 있을 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단, KAIST 중점연구소(융합연구단), 기초과학연구원의 지원을 받아 수행됐다.
2021.09.13 조회수 13343 -
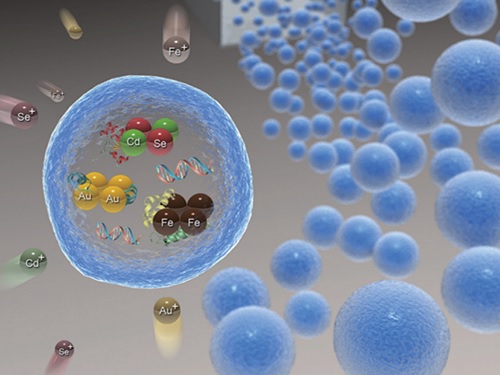 위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 17360
위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 17360 -
 자연에 없는 고감도 단백질 센서 제작 플랫폼 개발
우리 대학 생명과학과 오병하 교수가 미국 워싱턴주립대학 (University of Washington)과 국제 공동연구를 수행해 고감도의 단백질 센서 플랫폼을 개발했다고 5일 밝혔다.
단백질 센서들은 질병의 진단, 치료 경과의 추적, 병원 미생물의 감지 등에 널리 사용되고 있다. 상용되고 있는 단백질 센서들은 자연계에 존재하는 단백질이거나 이를 약간 변형한 형태이며 개발에는 많은 시간이 소요된다.
공동연구팀은 자연에 존재하는 단백질에 의존하지 않고 계산적 단백질 디자인 방법으로 인공적인 골격 단백질을 창출했으며 이를 두 부분으로 나누고 심해 새우가 만드는 발광 단백질과 재조합해 단백질을 감지하는 기능을 부여했다. 이렇게 만들어진 두 요소(two-component) 단백질 시스템은 그 자체로는 발광하지 않다가 감지하려는 표적 단백질이 존재하면 이와 결합하고 결과적으로 발광하도록 디자인돼있다.
그리고 그 발광 정도는 표적 단백질의 농도에 비례해 빛을 발생하기 때문에 발광의 세기를 측정함으로써 표적 단백질의 존재와 그 농도를 감지할 수 있다. 발생하는 빛은 시료의 전처리 없이도 감지할 수 있고, 발광 반응은 즉각적이며 1시간 안에 종료되기 때문에 기존 발색 반응의 측정보다 쉽다는 장점이 있다.
연구진이 창출한 단백질 시스템은 마치 레고 블록처럼 사용돼 여러 다양한 단백질 센서를 용이하게 제작하는데 쓸 수 있는 플랫폼을 제공한다. 실제로 발표된 논문에는 B형 간염 바이러스 단백질 센서, 코로나바이러스 단백질 센서 등 8개의 고감도 단백질 센서를 실제로 제작해 이 단백질 센서 플랫폼의 높은 응용성을 보여준다.
한편 이 단백질 센서의 작동 방식은 자연계에서는 그 예를 찾을 수 없어 자연의 모방을 넘어 자연에 존재하지 않는 단백질과 기능을 창출할 수 있다는 예를 보여준다.
이번 연구는 LG연암문화재단의 지원으로 오병하 교수가 미국 워싱턴 주립대학 데이비드 베이커(David Baker) 교수 실험실에 1년간 방문한 공동연구로 진행됐으며, 생명과학과 이한솔 박사와 강원대학교 홍효정 교수가 참여했다. 수행된 이번 연구 결과는 연구의 우수성을 인정받아 종합 과학 분야의 국제학술지 `네이처(Nature)'에 1월 27일 字 게재됐다. (논문명 : De novo design of modular and tunable protein biosensors)
2021.02.05 조회수 77409
자연에 없는 고감도 단백질 센서 제작 플랫폼 개발
우리 대학 생명과학과 오병하 교수가 미국 워싱턴주립대학 (University of Washington)과 국제 공동연구를 수행해 고감도의 단백질 센서 플랫폼을 개발했다고 5일 밝혔다.
단백질 센서들은 질병의 진단, 치료 경과의 추적, 병원 미생물의 감지 등에 널리 사용되고 있다. 상용되고 있는 단백질 센서들은 자연계에 존재하는 단백질이거나 이를 약간 변형한 형태이며 개발에는 많은 시간이 소요된다.
공동연구팀은 자연에 존재하는 단백질에 의존하지 않고 계산적 단백질 디자인 방법으로 인공적인 골격 단백질을 창출했으며 이를 두 부분으로 나누고 심해 새우가 만드는 발광 단백질과 재조합해 단백질을 감지하는 기능을 부여했다. 이렇게 만들어진 두 요소(two-component) 단백질 시스템은 그 자체로는 발광하지 않다가 감지하려는 표적 단백질이 존재하면 이와 결합하고 결과적으로 발광하도록 디자인돼있다.
그리고 그 발광 정도는 표적 단백질의 농도에 비례해 빛을 발생하기 때문에 발광의 세기를 측정함으로써 표적 단백질의 존재와 그 농도를 감지할 수 있다. 발생하는 빛은 시료의 전처리 없이도 감지할 수 있고, 발광 반응은 즉각적이며 1시간 안에 종료되기 때문에 기존 발색 반응의 측정보다 쉽다는 장점이 있다.
연구진이 창출한 단백질 시스템은 마치 레고 블록처럼 사용돼 여러 다양한 단백질 센서를 용이하게 제작하는데 쓸 수 있는 플랫폼을 제공한다. 실제로 발표된 논문에는 B형 간염 바이러스 단백질 센서, 코로나바이러스 단백질 센서 등 8개의 고감도 단백질 센서를 실제로 제작해 이 단백질 센서 플랫폼의 높은 응용성을 보여준다.
한편 이 단백질 센서의 작동 방식은 자연계에서는 그 예를 찾을 수 없어 자연의 모방을 넘어 자연에 존재하지 않는 단백질과 기능을 창출할 수 있다는 예를 보여준다.
이번 연구는 LG연암문화재단의 지원으로 오병하 교수가 미국 워싱턴 주립대학 데이비드 베이커(David Baker) 교수 실험실에 1년간 방문한 공동연구로 진행됐으며, 생명과학과 이한솔 박사와 강원대학교 홍효정 교수가 참여했다. 수행된 이번 연구 결과는 연구의 우수성을 인정받아 종합 과학 분야의 국제학술지 `네이처(Nature)'에 1월 27일 字 게재됐다. (논문명 : De novo design of modular and tunable protein biosensors)
2021.02.05 조회수 77409 -
 수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
2020.11.09 조회수 41038
수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
2020.11.09 조회수 41038 -
 단백질로 엮어낸 이중나선 개발
우리 대학 바이오및뇌공학과 최명철 교수 연구팀이 나노소재의 기초물질로 활용할 수 있는 단백질을 새롭게 발굴했다고 30일 밝혔다. 연구팀이 몸속에서 미세소관을 구성하는 `튜불린(Tubulin) 단백질'을 나노공학의 측면에서 재조명해 거둔 성과다.
바이오및뇌공학과 이준철 박사과정과 송채연 박사(現 아모레퍼시픽 R&D 센터)가 공동 제1 저자로 그리고 최명철 교수가 교신저자로 참여한 이번 연구결과는 국제학술지 `스몰(Small)'에 지난 9월 17일 字 표지논문(Back Cover)으로 게재됐다. (논문명: Tubulin Double Helix: Lateral and Longitudinal Curvature Changes of Tubulin Protofilament)
자연계와 산업계의 나노소재들은 놀라울 정도로 크고 복잡한 구조를 가진다. 이 구조들의 기본 형성원리는 작고 단순한 단위체들의 고유 형태가 전체구조를 결정한다는 원리다. 일반적으로 다양한 곡면 구조를 만들려면 서로 다른 모양을 가지는 최소 두 종류의 분자들을 이어 붙여야 한다. 예를 들어, 세포막의 경우 발아와 융합 과정에서 막의 곡률이 역동적으로 변하는데, 이는 형태가 다른 여러 종류의 인지질 분자들이 혼합돼 있어 가능한 특성이다.
최 교수 연구팀은 생명 현상의 중요한 역할을 담당하는 *미세소관의 특이한 성질에 주목했다. 바로 미세소관이 성장과 붕괴 과정에 필요한 다양한 곡면을 오직 한 종류의 단위체인 튜불린 단백질만으로 구현하기 때문이다.
☞ 미세소관 (Microtubule): 튜불린 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다. 물질 수송의 고속도로, 세포 분열 과정의 분자기계 역할을 수행한다.
연구팀은 튜불린이 수직한 두 방향으로 접히는 독특한 성질에 핵심이 있다고 판단, 튜불린의 형태 변형을 인공적으로 제어하겠다는 점에 아이디어를 얻은 후 곧장 연구를 시작했다. 튜불린 단백질의 접힘을 제어하는 분자스위치를 찾고자 한 것이다.
튜불린이 강한 음전하를 띤 단백질이라는 점을 감안해 양전하 중합체인 폴리라이신(poly-L-lysine)이 미세소관의 구조를 변형하는 과정을 관찰했다. 가속기 X선 산란장치를 이용해 옹스트롱(Å, 100억 분의 1미터)의 정확도로 측정하자 DNA 이중나선 구조의 결정적 증거가 된 로절린드 프랭클린의 *`포토 51'과 유사한 결과를 확인했다.
☞ 포토 51 (photo 51): 로절린드 프랭클린이 촬영한 DNA의 엑스선 회절 이미지로, 프랜시스 크릭과 제임스 왓슨이 DNA 이중나선 구조를 밝히는데 결정적인 증거가 되었다.
이 결과는 튜불린들이 꼭 두 줄씩 길게 늘어선 `튜불린 이중나선' 구조의 형성을 의미하는 것으로 연구팀은 튜불린을 두 방향으로 접을 수 있는 분자스위치를 찾아낸 것이다.
분자스위치의 크기와 개수를 조절함에 따라, 최 교수 연구팀은 단일 벽 나노튜브에서 이중벽 나노튜브로 변환하거나 이중나선의 간격을 자유자재로 조절이 가능한 성과를 거둘 수 있었다.
연구팀 관계자는 "우리 몸속 세포물질을 그대로 이용하되, 자연의 설계를 뛰어넘어 혁신적인 나노건축물을 구현해낸 것ˮ이라고 의미를 부여했다. 최 교수 연구팀의 이번 연구 결과는 튜불린 단백질을 나노소재의 기초물질로 활용하게 해줄 핵심 전략을 제시했다는 점에서 의미가 있다.
최명철 교수는 "이 논문을 계기로 튜불린을 나노소재로 활용하는 연구들이 본격적으로 시작될 것ˮ 이라면서 "새로운 바이오-나노기술의 특이점이 될 선도적 연구ˮ라고 이번 연구에 대한 의미를 부여했다.
최 교수는 이어 "나노미터 크기의 광학/전기/의료 소재를 개발하는 플랫폼으로는 물론 모터 단백질 키네신과 결합해 분자기계를 개발하는 등 활용 가능성이 무궁무진하다ˮ고 강조하면서 "향후 다양한 형태와 특성을 가진 나노소재를 만들어낼 `튜불린 나노공학'의 발전 기반 조성과 함께 이번 연구를 통해 발견한 분자스위치는 알츠하이머병 등 뇌질환의 새로운 치료 전략으로 활용될 것ˮ이라고 기대감을 내비쳤다.
앞서 연구팀은 이 분자스위치를 이용한 튜불린 나노소재의 의료적 가치를 입증한 바 있다. 튜불린 나노튜브를 항암 약물의 일종인 미세소관 표적 치료제의 만능 전달체로 활용할 수 있다는 결과를 지난 8월 20일 字 `어드밴스드 머티리얼스(Advanced Materials)'誌에 표지논문으로 발표했다.
미국 산타바바라 캘리포니아대와 공동으로 진행된 이번 연구는 한국연구재단 (중견연구, 방사선기술)과 한국원자력연구원·KAIST의 지원을 받았으며 포항 방사광 가속기의 소각 X선 산란 장치를 이용해 실험을 수행했다.
2020.10.30 조회수 29183
단백질로 엮어낸 이중나선 개발
우리 대학 바이오및뇌공학과 최명철 교수 연구팀이 나노소재의 기초물질로 활용할 수 있는 단백질을 새롭게 발굴했다고 30일 밝혔다. 연구팀이 몸속에서 미세소관을 구성하는 `튜불린(Tubulin) 단백질'을 나노공학의 측면에서 재조명해 거둔 성과다.
바이오및뇌공학과 이준철 박사과정과 송채연 박사(現 아모레퍼시픽 R&D 센터)가 공동 제1 저자로 그리고 최명철 교수가 교신저자로 참여한 이번 연구결과는 국제학술지 `스몰(Small)'에 지난 9월 17일 字 표지논문(Back Cover)으로 게재됐다. (논문명: Tubulin Double Helix: Lateral and Longitudinal Curvature Changes of Tubulin Protofilament)
자연계와 산업계의 나노소재들은 놀라울 정도로 크고 복잡한 구조를 가진다. 이 구조들의 기본 형성원리는 작고 단순한 단위체들의 고유 형태가 전체구조를 결정한다는 원리다. 일반적으로 다양한 곡면 구조를 만들려면 서로 다른 모양을 가지는 최소 두 종류의 분자들을 이어 붙여야 한다. 예를 들어, 세포막의 경우 발아와 융합 과정에서 막의 곡률이 역동적으로 변하는데, 이는 형태가 다른 여러 종류의 인지질 분자들이 혼합돼 있어 가능한 특성이다.
최 교수 연구팀은 생명 현상의 중요한 역할을 담당하는 *미세소관의 특이한 성질에 주목했다. 바로 미세소관이 성장과 붕괴 과정에 필요한 다양한 곡면을 오직 한 종류의 단위체인 튜불린 단백질만으로 구현하기 때문이다.
☞ 미세소관 (Microtubule): 튜불린 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다. 물질 수송의 고속도로, 세포 분열 과정의 분자기계 역할을 수행한다.
연구팀은 튜불린이 수직한 두 방향으로 접히는 독특한 성질에 핵심이 있다고 판단, 튜불린의 형태 변형을 인공적으로 제어하겠다는 점에 아이디어를 얻은 후 곧장 연구를 시작했다. 튜불린 단백질의 접힘을 제어하는 분자스위치를 찾고자 한 것이다.
튜불린이 강한 음전하를 띤 단백질이라는 점을 감안해 양전하 중합체인 폴리라이신(poly-L-lysine)이 미세소관의 구조를 변형하는 과정을 관찰했다. 가속기 X선 산란장치를 이용해 옹스트롱(Å, 100억 분의 1미터)의 정확도로 측정하자 DNA 이중나선 구조의 결정적 증거가 된 로절린드 프랭클린의 *`포토 51'과 유사한 결과를 확인했다.
☞ 포토 51 (photo 51): 로절린드 프랭클린이 촬영한 DNA의 엑스선 회절 이미지로, 프랜시스 크릭과 제임스 왓슨이 DNA 이중나선 구조를 밝히는데 결정적인 증거가 되었다.
이 결과는 튜불린들이 꼭 두 줄씩 길게 늘어선 `튜불린 이중나선' 구조의 형성을 의미하는 것으로 연구팀은 튜불린을 두 방향으로 접을 수 있는 분자스위치를 찾아낸 것이다.
분자스위치의 크기와 개수를 조절함에 따라, 최 교수 연구팀은 단일 벽 나노튜브에서 이중벽 나노튜브로 변환하거나 이중나선의 간격을 자유자재로 조절이 가능한 성과를 거둘 수 있었다.
연구팀 관계자는 "우리 몸속 세포물질을 그대로 이용하되, 자연의 설계를 뛰어넘어 혁신적인 나노건축물을 구현해낸 것ˮ이라고 의미를 부여했다. 최 교수 연구팀의 이번 연구 결과는 튜불린 단백질을 나노소재의 기초물질로 활용하게 해줄 핵심 전략을 제시했다는 점에서 의미가 있다.
최명철 교수는 "이 논문을 계기로 튜불린을 나노소재로 활용하는 연구들이 본격적으로 시작될 것ˮ 이라면서 "새로운 바이오-나노기술의 특이점이 될 선도적 연구ˮ라고 이번 연구에 대한 의미를 부여했다.
최 교수는 이어 "나노미터 크기의 광학/전기/의료 소재를 개발하는 플랫폼으로는 물론 모터 단백질 키네신과 결합해 분자기계를 개발하는 등 활용 가능성이 무궁무진하다ˮ고 강조하면서 "향후 다양한 형태와 특성을 가진 나노소재를 만들어낼 `튜불린 나노공학'의 발전 기반 조성과 함께 이번 연구를 통해 발견한 분자스위치는 알츠하이머병 등 뇌질환의 새로운 치료 전략으로 활용될 것ˮ이라고 기대감을 내비쳤다.
앞서 연구팀은 이 분자스위치를 이용한 튜불린 나노소재의 의료적 가치를 입증한 바 있다. 튜불린 나노튜브를 항암 약물의 일종인 미세소관 표적 치료제의 만능 전달체로 활용할 수 있다는 결과를 지난 8월 20일 字 `어드밴스드 머티리얼스(Advanced Materials)'誌에 표지논문으로 발표했다.
미국 산타바바라 캘리포니아대와 공동으로 진행된 이번 연구는 한국연구재단 (중견연구, 방사선기술)과 한국원자력연구원·KAIST의 지원을 받았으며 포항 방사광 가속기의 소각 X선 산란 장치를 이용해 실험을 수행했다.
2020.10.30 조회수 29183 -
 알츠하이머병을 유발하는 새로운 유전인자 발견
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 알츠하이머병을 유발하는 새로운 유전인자를 발견했다고 28일 밝혔다.
정 교수 연구팀은 환자의 뇌 영상·유전자와 함께 뇌척수액 데이터를 이용해 알츠하이머병의 새로운 유전인자를 발견했다. 연구팀은 새로 발견한 이 유전인자가 알츠하이머병의 원인 단백질로 알려진 아밀로이드 및 타우 단백질과는 별도로 환자의 인지 저하를 발생하는 사실과 함께 이 유전자가 항산화 효소 대사와 관련됐음을 입증했다. 이번 연구를 계기로 전 세계 약 1억5000만 명에 달하는 알츠하이머병 환자의 병태생리학적 규명은 물론 새로운 치료제 개발에 기여할 것으로 큰 기대를 모으고 있다.
우리 대학 의과학대학원김항래 박사가 제1 저자로 참여한 이번 연구 논문은 9월 16일 字 신경학 분야 저명 학술지인 '신경학(Neurology)'에 게재됐다. (논문명 : Genetic variants beyond amyloid and tau associated with cognitive decline: A cohort study)
알츠하이머병은 치매의 가장 흔한 원인인데 고령화에 따라 전 세계적으로 환자 수가 급속히 늘고 있다. 알츠하이머병을 유발하는 주요 원인 단백질로는 아밀로이드 및 타우 단백질이 알려져 있다. 따라서 이러한 주원인 단백질을 대상으로 하는 치료제가 많이 개발되는 추세다. 그러나 연이은 신약 개발의 실패로 인해 알츠하이머병에 대한 새로운 병태생리와 치료 대상에 관한 연구에 관심이 증가하고 있다.
정 교수 연구팀은 이번 연구를 위해 미국과 캐나다에 소재한 63개 지역 연구기관으로부터 얻은 정상인, 경도인지장애 관련 자료를 그리고 알츠하이머치매 환자로부터 얻은 뇌 영상·유전자·뇌척수액 데이터를 활용했다.(Alzheimer's Disease Neuroimaging Initiative, ADNI, http://adni.loni.usc.edu)
연구팀은 이와 함께 총 414명의 알츠하이머병 스펙트럼 환자(아밀로이드 단백질 양성 환자)를 대상으로 약 620만 개의 단일염기 다형성(Single Nucleotide Polymorphism, SNP)을 확인하는 과정에서 아밀로이드 및 타우 단백질과 별도로 환자의 인지기능에 영향을 주는 새로운 유전인자를 찾아냈다.
연구팀은 특히 독립된 데이터에서도 해당 유전자분석 결과의 재현에도 성공해 생물 정보학 분석을 통해서도 해당 유전인자가 항산화 효소 대사와 관련된 유전인자임을 입증했다. 연구팀은 실험을 통해 뇌 자기공명영상(Magnetic Resonance Imaging, MRI)으로 계산한 대뇌피질위축 데이터와 구조방정식 모델을 통해 해당 유전자가 뇌의 두정엽과 후두엽의 뇌 위축을 유발한다는 사실을 확인한 것이다. 이 패턴은 아밀로이드 및 타우 단백질에 의한 기존의 뇌 위축 패턴 현상과는 다른 것으로 나타났다.
제1 저자인 김항래 박사는 "이번 연구결과를 바탕으로 해당 유전인자가 있는 환자를 대상으로 항산화 치료의 효율성을 검증하는 추가 연구를 진행할 계획ˮ 이라고 밝혔다. 한편 이번 연구는 보건복지부 치매극복사업과 과학기술정보통신부 뇌과학원천기술사업의 지원을 받아 수행됐다.
2020.09.28 조회수 27239
알츠하이머병을 유발하는 새로운 유전인자 발견
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 알츠하이머병을 유발하는 새로운 유전인자를 발견했다고 28일 밝혔다.
정 교수 연구팀은 환자의 뇌 영상·유전자와 함께 뇌척수액 데이터를 이용해 알츠하이머병의 새로운 유전인자를 발견했다. 연구팀은 새로 발견한 이 유전인자가 알츠하이머병의 원인 단백질로 알려진 아밀로이드 및 타우 단백질과는 별도로 환자의 인지 저하를 발생하는 사실과 함께 이 유전자가 항산화 효소 대사와 관련됐음을 입증했다. 이번 연구를 계기로 전 세계 약 1억5000만 명에 달하는 알츠하이머병 환자의 병태생리학적 규명은 물론 새로운 치료제 개발에 기여할 것으로 큰 기대를 모으고 있다.
우리 대학 의과학대학원김항래 박사가 제1 저자로 참여한 이번 연구 논문은 9월 16일 字 신경학 분야 저명 학술지인 '신경학(Neurology)'에 게재됐다. (논문명 : Genetic variants beyond amyloid and tau associated with cognitive decline: A cohort study)
알츠하이머병은 치매의 가장 흔한 원인인데 고령화에 따라 전 세계적으로 환자 수가 급속히 늘고 있다. 알츠하이머병을 유발하는 주요 원인 단백질로는 아밀로이드 및 타우 단백질이 알려져 있다. 따라서 이러한 주원인 단백질을 대상으로 하는 치료제가 많이 개발되는 추세다. 그러나 연이은 신약 개발의 실패로 인해 알츠하이머병에 대한 새로운 병태생리와 치료 대상에 관한 연구에 관심이 증가하고 있다.
정 교수 연구팀은 이번 연구를 위해 미국과 캐나다에 소재한 63개 지역 연구기관으로부터 얻은 정상인, 경도인지장애 관련 자료를 그리고 알츠하이머치매 환자로부터 얻은 뇌 영상·유전자·뇌척수액 데이터를 활용했다.(Alzheimer's Disease Neuroimaging Initiative, ADNI, http://adni.loni.usc.edu)
연구팀은 이와 함께 총 414명의 알츠하이머병 스펙트럼 환자(아밀로이드 단백질 양성 환자)를 대상으로 약 620만 개의 단일염기 다형성(Single Nucleotide Polymorphism, SNP)을 확인하는 과정에서 아밀로이드 및 타우 단백질과 별도로 환자의 인지기능에 영향을 주는 새로운 유전인자를 찾아냈다.
연구팀은 특히 독립된 데이터에서도 해당 유전자분석 결과의 재현에도 성공해 생물 정보학 분석을 통해서도 해당 유전인자가 항산화 효소 대사와 관련된 유전인자임을 입증했다. 연구팀은 실험을 통해 뇌 자기공명영상(Magnetic Resonance Imaging, MRI)으로 계산한 대뇌피질위축 데이터와 구조방정식 모델을 통해 해당 유전자가 뇌의 두정엽과 후두엽의 뇌 위축을 유발한다는 사실을 확인한 것이다. 이 패턴은 아밀로이드 및 타우 단백질에 의한 기존의 뇌 위축 패턴 현상과는 다른 것으로 나타났다.
제1 저자인 김항래 박사는 "이번 연구결과를 바탕으로 해당 유전인자가 있는 환자를 대상으로 항산화 치료의 효율성을 검증하는 추가 연구를 진행할 계획ˮ 이라고 밝혔다. 한편 이번 연구는 보건복지부 치매극복사업과 과학기술정보통신부 뇌과학원천기술사업의 지원을 받아 수행됐다.
2020.09.28 조회수 27239 -
 1mm 크기 예쁜꼬마선충에서 노화 늦추는 단백질 찾았다
우리 대학 연구진이 '예쁜꼬마선충'(C. elegans)에서 수명 연장을 돕는 단백질을 찾아냈다.
우리 대학 생명과학과 이승재 교수와 포항공대 김경태 교수 연구팀이 예쁜꼬마선충에서 세포 내 에너지 조절 센서인 'AMPK'를 활성화해 노화를 지연시키는 단백질 'VRK-1'을 발견했다.
예쁜꼬마선충은 몸길이 1㎜ 정도의 선충류다. 배양이 쉽고 사람과 유전 정보 특성이 닮아 실험동물로 널리 활용된다.
한편 에너지 센서라 불리는 AMPK는 공복이나 운동 등으로 에너지 수준이 낮아질 때 활성화돼 세포가 항상성을 유지하도록 돕는다.
예쁜꼬마선충과 생쥐, 초파리 등에서 AMPK가 식이를 제한해 수명 연장을 돕는 역할을 한다는 연구는 그동안 활발히 진행되어 왔지만, AMPK를 자극하는 상위 조절 인자는 알려지지 않았다.
연구팀은 VRK1이 활성화될 때 2만여개의 예쁜꼬마선충 유전자가 단백질로 발현되는 패턴이 AMPK가 활성화될 때의 패턴과 비슷하다는 사실을 발견했다.
VRK1은 AMPK를 인산화시키고, 인산화된 AMPK는 미토콘드리아가 세포에 에너지를 공급하는 데 필수적인 과정인 '전자 전달계'의 기능을 억제함으로써 노화를 늦춘다는 것도 확인했다.
실제 VRK1의 자극에 반응하지 않는 AMPK 돌연변이 예쁜꼬마선충에서는 수명 연장 효과가 나타나지 않았다.
생명과학과 이승재 교수는 "이번 연구 결과는 AMPK 이상으로 인한 대사질환 치료와 항노화 약물 개발에 기여할 것"이라고 말했다.
한편, 이번 연구 결과는 국제 학술지 '사이언스 어드밴시스'(Science Advances) 7월 2일 자에 실렸다.
2020.07.16 조회수 30251
1mm 크기 예쁜꼬마선충에서 노화 늦추는 단백질 찾았다
우리 대학 연구진이 '예쁜꼬마선충'(C. elegans)에서 수명 연장을 돕는 단백질을 찾아냈다.
우리 대학 생명과학과 이승재 교수와 포항공대 김경태 교수 연구팀이 예쁜꼬마선충에서 세포 내 에너지 조절 센서인 'AMPK'를 활성화해 노화를 지연시키는 단백질 'VRK-1'을 발견했다.
예쁜꼬마선충은 몸길이 1㎜ 정도의 선충류다. 배양이 쉽고 사람과 유전 정보 특성이 닮아 실험동물로 널리 활용된다.
한편 에너지 센서라 불리는 AMPK는 공복이나 운동 등으로 에너지 수준이 낮아질 때 활성화돼 세포가 항상성을 유지하도록 돕는다.
예쁜꼬마선충과 생쥐, 초파리 등에서 AMPK가 식이를 제한해 수명 연장을 돕는 역할을 한다는 연구는 그동안 활발히 진행되어 왔지만, AMPK를 자극하는 상위 조절 인자는 알려지지 않았다.
연구팀은 VRK1이 활성화될 때 2만여개의 예쁜꼬마선충 유전자가 단백질로 발현되는 패턴이 AMPK가 활성화될 때의 패턴과 비슷하다는 사실을 발견했다.
VRK1은 AMPK를 인산화시키고, 인산화된 AMPK는 미토콘드리아가 세포에 에너지를 공급하는 데 필수적인 과정인 '전자 전달계'의 기능을 억제함으로써 노화를 늦춘다는 것도 확인했다.
실제 VRK1의 자극에 반응하지 않는 AMPK 돌연변이 예쁜꼬마선충에서는 수명 연장 효과가 나타나지 않았다.
생명과학과 이승재 교수는 "이번 연구 결과는 AMPK 이상으로 인한 대사질환 치료와 항노화 약물 개발에 기여할 것"이라고 말했다.
한편, 이번 연구 결과는 국제 학술지 '사이언스 어드밴시스'(Science Advances) 7월 2일 자에 실렸다.
2020.07.16 조회수 30251 -
 단백질 접힘 과정에서의 구조 변화 관측에 성공
우리 대학 화학과 이효철 교수(기초과학연구원 나노물질 및 화학반응 연구단 부연구단장 겸임) 연구팀이 풀려있는 단백질이 접히는 과정을 분자 수준에서 규명하는 데 성공, 단백질 구조기반의 신약 개발을 위한 토대를 마련했다. 획기적인 연구성과를 냈다고 평가받고 있는 이 교수 연구팀은 단백질 접힘 경로에서의 단백질 구조 변화를 실시간으로 관측하는 데 최초로 성공했다고 9일 밝혔다.
이 교수 연구팀에 따르면 풀린 단백질이 접히는 과정을 엑스선 펄스를 이용한 고속 연사 촬영기법을 통해 단백질의 구조 변화를 연속 스냅숏으로 추출했고 이를 통해 일련의 단백질 접힘 과정을 분자 수준에서 밝혀내는 쾌거를 달성했다.
KAIST 화학과 박사과정 졸업생 김태우 연구원이 제1 저자로, KAIST 화학과 이효철, 이영민 교수가 교신저자로 참여한 이번 연구결과는 국제 학술지 `미국 국립과학원회보(PNAS, Proceedings of the National Academy of Sciences of the United States of America)' 7월 1일 字에 게재됐다. (논문명 : Protein folding from heterogeneous unfolded state revealed by time-resolved X-ray solution scattering).
잘 접혀있는 단백질이 풀리는 과정은 비교적 쉽게 연구할 수 있어 많은 연구가 이뤄져 왔지만 풀려있는 단백질이 접히는 과정은 연구가 힘들었는데 이효철 교수팀의 이번 연구는 그 과정을 밝혀냈다는데 큰 의미가 있다. 단백질이 접히는 과정을 연구하기 힘든 이유는 풀려있는 단백질이 특정 구조를 가지지 않고 매우 다양한 구조를 갖기 때문이다. 하지만 이 교수 연구팀은 이번 연구에서 엑스선 산란 신호 분석법을 개발, 적용해서 이런 난제를 해결하는 데 성공했다.
단백질의 3차원 구조를 결정하는 고유의 접힘 과정은 가장 중요한 생체 반응이다. 때에 따라 발생하는 잘못 접히는 과정은 단백질의 정상적인 기능을 방해하며, 알츠하이머, 광우병, 파킨슨병 등이 바로 단백질 접힘이 올바르지 않아 발병되는 질병이다.
연구팀은 생체 내 전자전달에 관여하는 사이토크롬 단백질을 풀림 상태에서 접힘 상태로의 전이 과정을 발생시켜, 해당 접힘 과정을 시간 분해 엑스선 산란법을 이용해 연속적으로 움직이는 단백질의 구조 변화를 관측했다. 여기서 주목할만한 점은 이 교수 연구팀은 그간 단백질 접힘에 대한 이론적 모델로만 제시됐던 깔때기꼴 접힘 가설을 사이토크롬 단백질의 접힘 과정을 통해 실험적으로 입증했다는 사실이다.
이와 함께 이 교수팀은 단백질의 구조 변화뿐만 아니라 접히는 과정의 속도가 기존에 알려진 보통의 지수함수 형태가 아니라 늘어진 지수함수 형태임을 밝혀냈다. 이로써 풀린 단백질에서 접힌 상태로 가는 경로가 매우 다양하다는 것을 실험적으로 알아낸 것이다.
제1 저자인 김태우 연구원은 "단백질 접힘은 3차원 단백질 구조가 만들어지는 가장 중요한 생명현상인데, 접힘 과정에 대한 이해는 단백질 구조기반 신약 개발의 기초가 될 것ˮ이라고 기대했다. 공동 교신저자로 참여한 KAIST 화학과 이영민 교수도 "단백질 접힘 이론 모형에 대한 실험적 검증은 이론 생물리학 관점에서 더욱 정확한 계산 방법 개발에 중요한 자산이 될 것ˮ라고 강조했다.
한편 이번 연구는 기초과학연구원, 한국연구재단 등의 지원을 받아 수행됐다.
2020.07.09 조회수 27225
단백질 접힘 과정에서의 구조 변화 관측에 성공
우리 대학 화학과 이효철 교수(기초과학연구원 나노물질 및 화학반응 연구단 부연구단장 겸임) 연구팀이 풀려있는 단백질이 접히는 과정을 분자 수준에서 규명하는 데 성공, 단백질 구조기반의 신약 개발을 위한 토대를 마련했다. 획기적인 연구성과를 냈다고 평가받고 있는 이 교수 연구팀은 단백질 접힘 경로에서의 단백질 구조 변화를 실시간으로 관측하는 데 최초로 성공했다고 9일 밝혔다.
이 교수 연구팀에 따르면 풀린 단백질이 접히는 과정을 엑스선 펄스를 이용한 고속 연사 촬영기법을 통해 단백질의 구조 변화를 연속 스냅숏으로 추출했고 이를 통해 일련의 단백질 접힘 과정을 분자 수준에서 밝혀내는 쾌거를 달성했다.
KAIST 화학과 박사과정 졸업생 김태우 연구원이 제1 저자로, KAIST 화학과 이효철, 이영민 교수가 교신저자로 참여한 이번 연구결과는 국제 학술지 `미국 국립과학원회보(PNAS, Proceedings of the National Academy of Sciences of the United States of America)' 7월 1일 字에 게재됐다. (논문명 : Protein folding from heterogeneous unfolded state revealed by time-resolved X-ray solution scattering).
잘 접혀있는 단백질이 풀리는 과정은 비교적 쉽게 연구할 수 있어 많은 연구가 이뤄져 왔지만 풀려있는 단백질이 접히는 과정은 연구가 힘들었는데 이효철 교수팀의 이번 연구는 그 과정을 밝혀냈다는데 큰 의미가 있다. 단백질이 접히는 과정을 연구하기 힘든 이유는 풀려있는 단백질이 특정 구조를 가지지 않고 매우 다양한 구조를 갖기 때문이다. 하지만 이 교수 연구팀은 이번 연구에서 엑스선 산란 신호 분석법을 개발, 적용해서 이런 난제를 해결하는 데 성공했다.
단백질의 3차원 구조를 결정하는 고유의 접힘 과정은 가장 중요한 생체 반응이다. 때에 따라 발생하는 잘못 접히는 과정은 단백질의 정상적인 기능을 방해하며, 알츠하이머, 광우병, 파킨슨병 등이 바로 단백질 접힘이 올바르지 않아 발병되는 질병이다.
연구팀은 생체 내 전자전달에 관여하는 사이토크롬 단백질을 풀림 상태에서 접힘 상태로의 전이 과정을 발생시켜, 해당 접힘 과정을 시간 분해 엑스선 산란법을 이용해 연속적으로 움직이는 단백질의 구조 변화를 관측했다. 여기서 주목할만한 점은 이 교수 연구팀은 그간 단백질 접힘에 대한 이론적 모델로만 제시됐던 깔때기꼴 접힘 가설을 사이토크롬 단백질의 접힘 과정을 통해 실험적으로 입증했다는 사실이다.
이와 함께 이 교수팀은 단백질의 구조 변화뿐만 아니라 접히는 과정의 속도가 기존에 알려진 보통의 지수함수 형태가 아니라 늘어진 지수함수 형태임을 밝혀냈다. 이로써 풀린 단백질에서 접힌 상태로 가는 경로가 매우 다양하다는 것을 실험적으로 알아낸 것이다.
제1 저자인 김태우 연구원은 "단백질 접힘은 3차원 단백질 구조가 만들어지는 가장 중요한 생명현상인데, 접힘 과정에 대한 이해는 단백질 구조기반 신약 개발의 기초가 될 것ˮ이라고 기대했다. 공동 교신저자로 참여한 KAIST 화학과 이영민 교수도 "단백질 접힘 이론 모형에 대한 실험적 검증은 이론 생물리학 관점에서 더욱 정확한 계산 방법 개발에 중요한 자산이 될 것ˮ라고 강조했다.
한편 이번 연구는 기초과학연구원, 한국연구재단 등의 지원을 받아 수행됐다.
2020.07.09 조회수 27225 -
 빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
2020.02.21 조회수 21249
빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
2020.02.21 조회수 21249