-
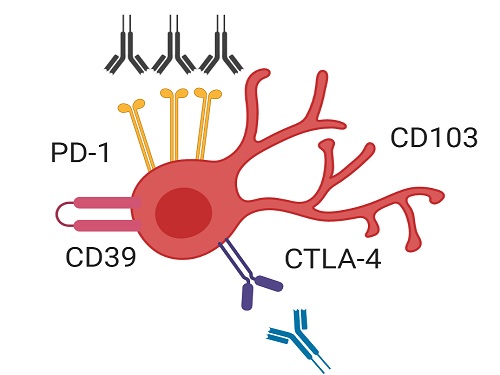 유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14
조회수 9700
-
 음파를 이용한 세포 자극 미세시스템 개발
우리 대학 연구진이 면역세포를 대상으로 기계적 자극을 가할 수 있는 고주파수 음파 기반의 미세유체 시스템 기술을 개발했다.
미국 스크립스 연구소의 아르뎀 파타푸리안 교수는 기계적 자극에 반응하는 세포 압력센서를 발견한 공로로 2021년도 노벨 생리의학상을 공동 수상했다. 또한 최근 다수의 연구를 통해 기계적 자극이 면역세포의 암세포 제거 기능에도 깊게 관여하는 기전이 보고되고 있다.
이에 기계적 자극을 인가할 수 있는 다양한 형태의 체외 동적 세포배양 시스템이 개발돼왔다. 그러나 펌프, 자력 교반기 등의 기존 시스템은 요구되는 시료 양이 비교적 크고, 부품과 세포 간의 접촉이 수반되어 잠재적 시료 오염과 세포 활성 저하의 문제점을 가진다.
문제 해결을 위해 기계공학과 전성윤 교수 연구팀(바이오미세유체 연구실)과 성형진 교수, 전남대학교 박진수 교수 연구팀은 필요한 시료 양이 수십 마이크로리터에 불과한 미세유체 칩에 기계적 자극을 비접촉식으로 만들어내고 그 크기를 정밀하게 제어할 수 있는 표면탄성파 인가 기술을 접목하였다. 해당 시스템의 빗살무늬전극에 고주파수 교류신호를 인가하여 표면탄성파를 형성하고, 표면탄성파는 기판을 따라 진행하여 미세유체 칩 내부의 유체에 흐름유동을 만들어낸다. 이 흐름유동은 유체 내부의 면역세포에 기계적 자극을 가함으로써 면역세포으로의 칼슘 이온 유입을 이끌어낸다.
연구팀은 “이번 연구는 고주파수 음파 기반의 비접촉식 기계적 자극 전달 시스템을 개발한 데 의의가 있으며, 음파를 접목한 미세유체 칩이 ‘차세대 동적 배양 시스템’으로써 적극적으로 활용될 가능성을 제시하였다”고 본 연구의 의의를 설명했다.
김승규 박사가 주저자로 참여한 이번 연구는 국제학술지 ‘Advanced Science' 16호의 앞면 내부 표지논문으로 게재되었다. (논문명: Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor)
이번 연구는 한국연구재단 중견연구자사업과 보건산업진흥원 글로벌바이오메디컬연수자사업 및 BK 21 Plus program의 지원을 받아 수행되었으며, 우리 대학 남현오 박사과정과 전남대학교 차범석 석사과정이 공동연구자로 참여했다.
#논문정보
Kim, S., Nam, H., Cha, B., Park, J., Sung, H. J., & Jeon, J. S. (2022). Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor. Advanced Science, 9(16), 2105809.
https://doi.org/10.1002/advs.202105809
음파를 이용한 세포 자극 미세시스템 개발
우리 대학 연구진이 면역세포를 대상으로 기계적 자극을 가할 수 있는 고주파수 음파 기반의 미세유체 시스템 기술을 개발했다.
미국 스크립스 연구소의 아르뎀 파타푸리안 교수는 기계적 자극에 반응하는 세포 압력센서를 발견한 공로로 2021년도 노벨 생리의학상을 공동 수상했다. 또한 최근 다수의 연구를 통해 기계적 자극이 면역세포의 암세포 제거 기능에도 깊게 관여하는 기전이 보고되고 있다.
이에 기계적 자극을 인가할 수 있는 다양한 형태의 체외 동적 세포배양 시스템이 개발돼왔다. 그러나 펌프, 자력 교반기 등의 기존 시스템은 요구되는 시료 양이 비교적 크고, 부품과 세포 간의 접촉이 수반되어 잠재적 시료 오염과 세포 활성 저하의 문제점을 가진다.
문제 해결을 위해 기계공학과 전성윤 교수 연구팀(바이오미세유체 연구실)과 성형진 교수, 전남대학교 박진수 교수 연구팀은 필요한 시료 양이 수십 마이크로리터에 불과한 미세유체 칩에 기계적 자극을 비접촉식으로 만들어내고 그 크기를 정밀하게 제어할 수 있는 표면탄성파 인가 기술을 접목하였다. 해당 시스템의 빗살무늬전극에 고주파수 교류신호를 인가하여 표면탄성파를 형성하고, 표면탄성파는 기판을 따라 진행하여 미세유체 칩 내부의 유체에 흐름유동을 만들어낸다. 이 흐름유동은 유체 내부의 면역세포에 기계적 자극을 가함으로써 면역세포으로의 칼슘 이온 유입을 이끌어낸다.
연구팀은 “이번 연구는 고주파수 음파 기반의 비접촉식 기계적 자극 전달 시스템을 개발한 데 의의가 있으며, 음파를 접목한 미세유체 칩이 ‘차세대 동적 배양 시스템’으로써 적극적으로 활용될 가능성을 제시하였다”고 본 연구의 의의를 설명했다.
김승규 박사가 주저자로 참여한 이번 연구는 국제학술지 ‘Advanced Science' 16호의 앞면 내부 표지논문으로 게재되었다. (논문명: Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor)
이번 연구는 한국연구재단 중견연구자사업과 보건산업진흥원 글로벌바이오메디컬연수자사업 및 BK 21 Plus program의 지원을 받아 수행되었으며, 우리 대학 남현오 박사과정과 전남대학교 차범석 석사과정이 공동연구자로 참여했다.
#논문정보
Kim, S., Nam, H., Cha, B., Park, J., Sung, H. J., & Jeon, J. S. (2022). Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor. Advanced Science, 9(16), 2105809.
https://doi.org/10.1002/advs.202105809
2022.06.22
조회수 7776
-
 기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08
조회수 10653
-
 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23
조회수 13064
-
 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24
조회수 12468
-
 면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
2021.10.21
조회수 13235
-
 방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
2021.09.01
조회수 11955
-
 코로나19 환자에서 나타나는 자연살해 세포 변화 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 충남대학교병원 감염내과 김연숙, 천신혜 교수팀과의 공동연구를 통해 코로나19 환자들에서 자연살해 세포의 항바이러스 기능이 약화돼 있고, 이러한 기능 변화는 경증 코로나19 환자에서는 일주일 내로 사라지지만 중증 환자에서는 오래 지속됨을 규명했다고 10일 밝혔다. 이로써, 항바이러스 선천면역 반응의 한 축을 담당하는 자연살해 세포의 기능 이상을 중증 코로나19 환자에서 처음으로 규명하게 됐다.
우리 몸은 바이러스에 감염되면 이에 대항하여 일차적으로 선천면역 반응이 나타나며, 항바이러스 선천면역 반응을 담당하는 주된 세포가 바로 자연살해 세포다. 이러한 자연살해 세포의 대부분을 차지하는 것이 바이러스에 감염된 세포를 직접 죽이는 세포독성 자연살해 세포인데, 코로나19 환자에서 이러한 세포독성 자연살해 세포의 수나 기능이 감소돼 있다는 보고는 있었지만, 자연살해 세포의 구체적인 변화나 기능감소 기전에 대해서는 규명된 바가 없었다.
이번 연구에서 KAIST-충남대병원 공동연구팀은 한국인 코로나19 환자들을 대상으로 진단 초기부터 회복 시까지 추적 연구를 수행해 코로나19 바이러스 감염증에서 질병의 진행 과정에 따라 자연살해 세포에 일어나는 변화를 최초로 규명했고, 중증 환자와 경증 환자에서 자연살해 세포의 특성 및 기능의 차이점에 대해 밝혔다. 특히 이번 연구에서는 최첨단 면역학 연구기법과 유전자 발현 분석을 동시에 활용해 코로나19 환자에서 자연살해 세포들에 나타나는 변화를 다각도에서 분석하고 규명했다.
공동연구팀은 정상인이나 독감 환자와는 달리 코로나19 환자에게서만 특징적으로 나타나는 비정형 자연살해 세포를 발견했고, 이러한 비정형 자연살해 세포가 일반적인 자연살해 세포보다 세포독성 기능이 감소해있음을 밝혔다.
연구팀은 이러한 비정형 자연살해 세포들이 질병의 중증도와 관계없이 코로나19 바이러스에 감염된 환자들에서 공통적으로 질병 초기에 빠르게 증가하며, 이로 인해 코로나19 환자의 선천면역 반응이 약화되어 있음을 밝혔다. 그리고 코로나19 환자들의 질병 진행 과정에서 자연살해 세포 특성을 추적 관찰한 결과, 중증 코로나19 환자에서 이러한 비정형 자연살해 세포들의 증가 상태가 더 장기간 지속되며 이는 선천면역 반응의 손상과 연관됨을 밝혔다.
이번 연구는 세계 처음으로 코로나19 환자에서 비정형 자연살해 세포의 증가를 발견해 코로나19 환자에서 나타나는 선천면역 반응 손상의 기전을 보고한 연구로 세계 면역학계의 주목을 받고 있다.
과학기술원 공동연구과제의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 `알레르기 및 임상면역학 저널(The Journal of Allergy and Clinical Immunolgy)'에 게재됐다. 특히 이번 논문은 저널 편집자로부터 주목을 받아야 할 주요 연구성과로 선정돼 하이라이트 논문으로 저널에 소개될 예정이다. (논문명: Abnormality in the NK cell population is prolonged in severe COVID-19 patients)
이번 연구의 제1 저자인 우리 대학 임가람 박사 연구원(現 연세의대 소화기내과 임상강사)은 "코로나19 바이러스 감염증에서 특징적으로 비정형 자연살해 세포들이 증가해 있음을 발견했다ˮ며 "다른 호흡기 바이러스 감염에서는 보이지 않는 이러한 자연살해 세포 변화는 코로나19 바이러스 감염증의 임상적 특징을 이해하고, 중증 환자에서 선제적인 치료를 조기에 시작하는 임상적 근거가 될 것이다ˮ고 설명했다.
충남대병원 김연숙 교수는 "이번 연구는 코로나19 환자의 질병 과정의 초기부터 회복기까지 자연살해 세포의 변화 및 특성을 세계에서 최초로 분석해 규명한 연구 결과로서 코로나19 환자에서 나타나는 선천면역 반응의 손상 기전을 최초로 밝혔다는 점에서 의미가 있는 연구ˮ라고 말했다.
코로나19 환자에서 나타나는 자연살해 세포 변화 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 충남대학교병원 감염내과 김연숙, 천신혜 교수팀과의 공동연구를 통해 코로나19 환자들에서 자연살해 세포의 항바이러스 기능이 약화돼 있고, 이러한 기능 변화는 경증 코로나19 환자에서는 일주일 내로 사라지지만 중증 환자에서는 오래 지속됨을 규명했다고 10일 밝혔다. 이로써, 항바이러스 선천면역 반응의 한 축을 담당하는 자연살해 세포의 기능 이상을 중증 코로나19 환자에서 처음으로 규명하게 됐다.
우리 몸은 바이러스에 감염되면 이에 대항하여 일차적으로 선천면역 반응이 나타나며, 항바이러스 선천면역 반응을 담당하는 주된 세포가 바로 자연살해 세포다. 이러한 자연살해 세포의 대부분을 차지하는 것이 바이러스에 감염된 세포를 직접 죽이는 세포독성 자연살해 세포인데, 코로나19 환자에서 이러한 세포독성 자연살해 세포의 수나 기능이 감소돼 있다는 보고는 있었지만, 자연살해 세포의 구체적인 변화나 기능감소 기전에 대해서는 규명된 바가 없었다.
이번 연구에서 KAIST-충남대병원 공동연구팀은 한국인 코로나19 환자들을 대상으로 진단 초기부터 회복 시까지 추적 연구를 수행해 코로나19 바이러스 감염증에서 질병의 진행 과정에 따라 자연살해 세포에 일어나는 변화를 최초로 규명했고, 중증 환자와 경증 환자에서 자연살해 세포의 특성 및 기능의 차이점에 대해 밝혔다. 특히 이번 연구에서는 최첨단 면역학 연구기법과 유전자 발현 분석을 동시에 활용해 코로나19 환자에서 자연살해 세포들에 나타나는 변화를 다각도에서 분석하고 규명했다.
공동연구팀은 정상인이나 독감 환자와는 달리 코로나19 환자에게서만 특징적으로 나타나는 비정형 자연살해 세포를 발견했고, 이러한 비정형 자연살해 세포가 일반적인 자연살해 세포보다 세포독성 기능이 감소해있음을 밝혔다.
연구팀은 이러한 비정형 자연살해 세포들이 질병의 중증도와 관계없이 코로나19 바이러스에 감염된 환자들에서 공통적으로 질병 초기에 빠르게 증가하며, 이로 인해 코로나19 환자의 선천면역 반응이 약화되어 있음을 밝혔다. 그리고 코로나19 환자들의 질병 진행 과정에서 자연살해 세포 특성을 추적 관찰한 결과, 중증 코로나19 환자에서 이러한 비정형 자연살해 세포들의 증가 상태가 더 장기간 지속되며 이는 선천면역 반응의 손상과 연관됨을 밝혔다.
이번 연구는 세계 처음으로 코로나19 환자에서 비정형 자연살해 세포의 증가를 발견해 코로나19 환자에서 나타나는 선천면역 반응 손상의 기전을 보고한 연구로 세계 면역학계의 주목을 받고 있다.
과학기술원 공동연구과제의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 `알레르기 및 임상면역학 저널(The Journal of Allergy and Clinical Immunolgy)'에 게재됐다. 특히 이번 논문은 저널 편집자로부터 주목을 받아야 할 주요 연구성과로 선정돼 하이라이트 논문으로 저널에 소개될 예정이다. (논문명: Abnormality in the NK cell population is prolonged in severe COVID-19 patients)
이번 연구의 제1 저자인 우리 대학 임가람 박사 연구원(現 연세의대 소화기내과 임상강사)은 "코로나19 바이러스 감염증에서 특징적으로 비정형 자연살해 세포들이 증가해 있음을 발견했다ˮ며 "다른 호흡기 바이러스 감염에서는 보이지 않는 이러한 자연살해 세포 변화는 코로나19 바이러스 감염증의 임상적 특징을 이해하고, 중증 환자에서 선제적인 치료를 조기에 시작하는 임상적 근거가 될 것이다ˮ고 설명했다.
충남대병원 김연숙 교수는 "이번 연구는 코로나19 환자의 질병 과정의 초기부터 회복기까지 자연살해 세포의 변화 및 특성을 세계에서 최초로 분석해 규명한 연구 결과로서 코로나19 환자에서 나타나는 선천면역 반응의 손상 기전을 최초로 밝혔다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.08.11
조회수 10943
-
 코로나19 폐 손상 유발 면역세포의 특성 및 역동적 변화 규명
우리 대학 의과학대학원 박수형 교수 연구팀이 충북대학교 의과대학 최영기 교수(현 한국바이러스기초연구소장), 지놈인사이트 이정석 박사팀과 공동연구를 통해 코로나19 바이러스 증식의 절정기, 그리고 회복기에 걸쳐 나타나는 면역반응의 양적·질적 변화를 규명해 폐 손상을 일으키는 특정 면역세포의 특성과 기원을 규명했다고 4일 밝혔다. 이는 코로나19 환자에서 과잉 면역반응에 의해 발생하는 폐 손상을 조절할 수 있는 타깃(대상)을 제시하는 연구 결과다.
코로나19에 감염되면 처음 바이러스가 유입되어 감염되는 폐 조직 내에서 즉각적인 면역세포의 활성화가 일어남이 알려져 있다. 이 면역세포의 대부분은 대식세포(macrophage)인데, 코로나19에 환자가 감염된 후 혈류를 통해 활성화된 단핵구가 폐 조직으로 들어오며 추가로 대식세포로 분화하며 바이러스에 감염된 폐 조직 세포들을 제거하여 초기 방어로 대응을 하게 된다.
코로나19 감염 후 일어나는 초기의 면역반응과 그 시간에 따른 변화를 폐에서 면역세포를 여러 차례 얻어 연구하는 것은 환자를 통해서는 불가능하다. 따라서 페럿(식육목 족제비과의 포유류)과 같은 호흡기감염 동물모델이 바이러스 감염 후 면역반응의 정확한 면모를 밝히는 데 중요한 역할을 한다. 충북대학교 최영기 교수 연구팀은 실험동물인 페렛이 SARS-CoV-2 바이러스에 감수성이 있다는 것을 세계 최초로 학계에 보고했다.
이번 연구에서 KAIST-충북대-지놈인사이트 공동연구팀은 코로나19 바이러스 감염 동물모델을 이용하여 감염이 진행되는 동안의 폐 내 면역세포의 변화를 첨단 연구기법인 단일세포 시퀀싱을 이용해 정밀하게 분석했고, 폐 면역세포의 대부분을 차지하는 대식세포를 10가지 아형으로 분류해 이중 어떤 대식 세포군이 폐 손상에 기여하는지를 분석했다.
연구팀은 코로나19 바이러스 감염 2일 후부터 혈류에서 활성화된 단핵구가 급격하게 폐 조직으로 침윤하며 대식세포로 분화하며 양적으로 증가함을 확인했다. 특히 이러한 혈류 기원 침윤 대식세포들은 염증성 대식세포의 성질을 강하게 나타내며, 바이러스 제거에 기여할 뿐만 아니라 조직손상을 일으키는 주범이 될 수 있음을 제시했다. 또한 이러한 대식세포 분화의 양상은 중증 코로나19 환자들의 폐 조직에서 관찰되는 변화와도 높은 유사도를 보임을 규명했다.
보건복지부와 KAIST의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 7월 28일 字에 게재됐다(논문명: Single-cell transcriptome of bronchoalveolar lavage fluid reveals sequential change of macrophages during SARS-CoV-2 infection in ferrets).
공동연구팀은 현재 면역억제제를 투약받은 코로나19 환자들의 면역반응 변화를 종적으로 추적하며, `싸이토카인 폭풍'과 같은 치명적인 중증 코로나19의 과잉면역반응의 적절한 제어와 약물의 면역학적 효과를 규명하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 지놈인사이트 이정석 박사와 우리 대학 고준영 박사과정은 "이번 연구 결과는 코로나19 환자의 폐가 경험하게 되는 선천 면역반응을 단일세포 전사체라는 오믹스 데이터를 이용해 다각적으로 분석해, 바이러스 감염 시에 발생하는 대식세포 면역반응의 이중성을 이해하는 중요한 자료ˮ고 설명했다.
충북대학교 최영기 교수는 “SARS-CoV-2 바이러스 감염 후 시간의 경과에 따른 바이러스의 증식성 변화 및 병리학적 분석을 수행한 이번 결과는 전반적인 바이러스 감염 및 회복에 관여하는 병인기전을 이해할 수 있는 중요한 연구자료“라고 말했다.
박수형 교수는 "코로나19가 감염된 직후 시간에 따른 변화를 감염 전과 비교하여 정밀하게 규명한 것이 이 연구의 가장 큰 수확이며, 감염 후 폐 손상이 특정 염증성 대식세포에 의한 것임을 규명하여 중증 코로나19 환자에서 사용되는 면역억제 치료 전략을 정교하게 만들 수 있는 근거를 마련했다ˮ라고 말했다.
코로나19 폐 손상 유발 면역세포의 특성 및 역동적 변화 규명
우리 대학 의과학대학원 박수형 교수 연구팀이 충북대학교 의과대학 최영기 교수(현 한국바이러스기초연구소장), 지놈인사이트 이정석 박사팀과 공동연구를 통해 코로나19 바이러스 증식의 절정기, 그리고 회복기에 걸쳐 나타나는 면역반응의 양적·질적 변화를 규명해 폐 손상을 일으키는 특정 면역세포의 특성과 기원을 규명했다고 4일 밝혔다. 이는 코로나19 환자에서 과잉 면역반응에 의해 발생하는 폐 손상을 조절할 수 있는 타깃(대상)을 제시하는 연구 결과다.
코로나19에 감염되면 처음 바이러스가 유입되어 감염되는 폐 조직 내에서 즉각적인 면역세포의 활성화가 일어남이 알려져 있다. 이 면역세포의 대부분은 대식세포(macrophage)인데, 코로나19에 환자가 감염된 후 혈류를 통해 활성화된 단핵구가 폐 조직으로 들어오며 추가로 대식세포로 분화하며 바이러스에 감염된 폐 조직 세포들을 제거하여 초기 방어로 대응을 하게 된다.
코로나19 감염 후 일어나는 초기의 면역반응과 그 시간에 따른 변화를 폐에서 면역세포를 여러 차례 얻어 연구하는 것은 환자를 통해서는 불가능하다. 따라서 페럿(식육목 족제비과의 포유류)과 같은 호흡기감염 동물모델이 바이러스 감염 후 면역반응의 정확한 면모를 밝히는 데 중요한 역할을 한다. 충북대학교 최영기 교수 연구팀은 실험동물인 페렛이 SARS-CoV-2 바이러스에 감수성이 있다는 것을 세계 최초로 학계에 보고했다.
이번 연구에서 KAIST-충북대-지놈인사이트 공동연구팀은 코로나19 바이러스 감염 동물모델을 이용하여 감염이 진행되는 동안의 폐 내 면역세포의 변화를 첨단 연구기법인 단일세포 시퀀싱을 이용해 정밀하게 분석했고, 폐 면역세포의 대부분을 차지하는 대식세포를 10가지 아형으로 분류해 이중 어떤 대식 세포군이 폐 손상에 기여하는지를 분석했다.
연구팀은 코로나19 바이러스 감염 2일 후부터 혈류에서 활성화된 단핵구가 급격하게 폐 조직으로 침윤하며 대식세포로 분화하며 양적으로 증가함을 확인했다. 특히 이러한 혈류 기원 침윤 대식세포들은 염증성 대식세포의 성질을 강하게 나타내며, 바이러스 제거에 기여할 뿐만 아니라 조직손상을 일으키는 주범이 될 수 있음을 제시했다. 또한 이러한 대식세포 분화의 양상은 중증 코로나19 환자들의 폐 조직에서 관찰되는 변화와도 높은 유사도를 보임을 규명했다.
보건복지부와 KAIST의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 7월 28일 字에 게재됐다(논문명: Single-cell transcriptome of bronchoalveolar lavage fluid reveals sequential change of macrophages during SARS-CoV-2 infection in ferrets).
공동연구팀은 현재 면역억제제를 투약받은 코로나19 환자들의 면역반응 변화를 종적으로 추적하며, `싸이토카인 폭풍'과 같은 치명적인 중증 코로나19의 과잉면역반응의 적절한 제어와 약물의 면역학적 효과를 규명하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 지놈인사이트 이정석 박사와 우리 대학 고준영 박사과정은 "이번 연구 결과는 코로나19 환자의 폐가 경험하게 되는 선천 면역반응을 단일세포 전사체라는 오믹스 데이터를 이용해 다각적으로 분석해, 바이러스 감염 시에 발생하는 대식세포 면역반응의 이중성을 이해하는 중요한 자료ˮ고 설명했다.
충북대학교 최영기 교수는 “SARS-CoV-2 바이러스 감염 후 시간의 경과에 따른 바이러스의 증식성 변화 및 병리학적 분석을 수행한 이번 결과는 전반적인 바이러스 감염 및 회복에 관여하는 병인기전을 이해할 수 있는 중요한 연구자료“라고 말했다.
박수형 교수는 "코로나19가 감염된 직후 시간에 따른 변화를 감염 전과 비교하여 정밀하게 규명한 것이 이 연구의 가장 큰 수확이며, 감염 후 폐 손상이 특정 염증성 대식세포에 의한 것임을 규명하여 중증 코로나19 환자에서 사용되는 면역억제 치료 전략을 정교하게 만들 수 있는 근거를 마련했다ˮ라고 말했다.
2021.08.05
조회수 14686
-
 코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07
조회수 14659
-
 암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27
조회수 32121
-
 의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
2021.02.16
조회수 80286
 유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14 조회수 9700
유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14 조회수 9700 음파를 이용한 세포 자극 미세시스템 개발
우리 대학 연구진이 면역세포를 대상으로 기계적 자극을 가할 수 있는 고주파수 음파 기반의 미세유체 시스템 기술을 개발했다.
미국 스크립스 연구소의 아르뎀 파타푸리안 교수는 기계적 자극에 반응하는 세포 압력센서를 발견한 공로로 2021년도 노벨 생리의학상을 공동 수상했다. 또한 최근 다수의 연구를 통해 기계적 자극이 면역세포의 암세포 제거 기능에도 깊게 관여하는 기전이 보고되고 있다.
이에 기계적 자극을 인가할 수 있는 다양한 형태의 체외 동적 세포배양 시스템이 개발돼왔다. 그러나 펌프, 자력 교반기 등의 기존 시스템은 요구되는 시료 양이 비교적 크고, 부품과 세포 간의 접촉이 수반되어 잠재적 시료 오염과 세포 활성 저하의 문제점을 가진다.
문제 해결을 위해 기계공학과 전성윤 교수 연구팀(바이오미세유체 연구실)과 성형진 교수, 전남대학교 박진수 교수 연구팀은 필요한 시료 양이 수십 마이크로리터에 불과한 미세유체 칩에 기계적 자극을 비접촉식으로 만들어내고 그 크기를 정밀하게 제어할 수 있는 표면탄성파 인가 기술을 접목하였다. 해당 시스템의 빗살무늬전극에 고주파수 교류신호를 인가하여 표면탄성파를 형성하고, 표면탄성파는 기판을 따라 진행하여 미세유체 칩 내부의 유체에 흐름유동을 만들어낸다. 이 흐름유동은 유체 내부의 면역세포에 기계적 자극을 가함으로써 면역세포으로의 칼슘 이온 유입을 이끌어낸다.
연구팀은 “이번 연구는 고주파수 음파 기반의 비접촉식 기계적 자극 전달 시스템을 개발한 데 의의가 있으며, 음파를 접목한 미세유체 칩이 ‘차세대 동적 배양 시스템’으로써 적극적으로 활용될 가능성을 제시하였다”고 본 연구의 의의를 설명했다.
김승규 박사가 주저자로 참여한 이번 연구는 국제학술지 ‘Advanced Science' 16호의 앞면 내부 표지논문으로 게재되었다. (논문명: Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor)
이번 연구는 한국연구재단 중견연구자사업과 보건산업진흥원 글로벌바이오메디컬연수자사업 및 BK 21 Plus program의 지원을 받아 수행되었으며, 우리 대학 남현오 박사과정과 전남대학교 차범석 석사과정이 공동연구자로 참여했다.
#논문정보
Kim, S., Nam, H., Cha, B., Park, J., Sung, H. J., & Jeon, J. S. (2022). Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor. Advanced Science, 9(16), 2105809.
https://doi.org/10.1002/advs.202105809
2022.06.22 조회수 7776
음파를 이용한 세포 자극 미세시스템 개발
우리 대학 연구진이 면역세포를 대상으로 기계적 자극을 가할 수 있는 고주파수 음파 기반의 미세유체 시스템 기술을 개발했다.
미국 스크립스 연구소의 아르뎀 파타푸리안 교수는 기계적 자극에 반응하는 세포 압력센서를 발견한 공로로 2021년도 노벨 생리의학상을 공동 수상했다. 또한 최근 다수의 연구를 통해 기계적 자극이 면역세포의 암세포 제거 기능에도 깊게 관여하는 기전이 보고되고 있다.
이에 기계적 자극을 인가할 수 있는 다양한 형태의 체외 동적 세포배양 시스템이 개발돼왔다. 그러나 펌프, 자력 교반기 등의 기존 시스템은 요구되는 시료 양이 비교적 크고, 부품과 세포 간의 접촉이 수반되어 잠재적 시료 오염과 세포 활성 저하의 문제점을 가진다.
문제 해결을 위해 기계공학과 전성윤 교수 연구팀(바이오미세유체 연구실)과 성형진 교수, 전남대학교 박진수 교수 연구팀은 필요한 시료 양이 수십 마이크로리터에 불과한 미세유체 칩에 기계적 자극을 비접촉식으로 만들어내고 그 크기를 정밀하게 제어할 수 있는 표면탄성파 인가 기술을 접목하였다. 해당 시스템의 빗살무늬전극에 고주파수 교류신호를 인가하여 표면탄성파를 형성하고, 표면탄성파는 기판을 따라 진행하여 미세유체 칩 내부의 유체에 흐름유동을 만들어낸다. 이 흐름유동은 유체 내부의 면역세포에 기계적 자극을 가함으로써 면역세포으로의 칼슘 이온 유입을 이끌어낸다.
연구팀은 “이번 연구는 고주파수 음파 기반의 비접촉식 기계적 자극 전달 시스템을 개발한 데 의의가 있으며, 음파를 접목한 미세유체 칩이 ‘차세대 동적 배양 시스템’으로써 적극적으로 활용될 가능성을 제시하였다”고 본 연구의 의의를 설명했다.
김승규 박사가 주저자로 참여한 이번 연구는 국제학술지 ‘Advanced Science' 16호의 앞면 내부 표지논문으로 게재되었다. (논문명: Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor)
이번 연구는 한국연구재단 중견연구자사업과 보건산업진흥원 글로벌바이오메디컬연수자사업 및 BK 21 Plus program의 지원을 받아 수행되었으며, 우리 대학 남현오 박사과정과 전남대학교 차범석 석사과정이 공동연구자로 참여했다.
#논문정보
Kim, S., Nam, H., Cha, B., Park, J., Sung, H. J., & Jeon, J. S. (2022). Acoustofluidic Stimulation of Functional Immune Cells in a Microreactor. Advanced Science, 9(16), 2105809.
https://doi.org/10.1002/advs.202105809
2022.06.22 조회수 7776 기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08 조회수 10653
기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08 조회수 10653 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 13064
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 13064 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12468
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12468 면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
2021.10.21 조회수 13235
면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
2021.10.21 조회수 13235 방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
2021.09.01 조회수 11955
방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
2021.09.01 조회수 11955 코로나19 환자에서 나타나는 자연살해 세포 변화 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 충남대학교병원 감염내과 김연숙, 천신혜 교수팀과의 공동연구를 통해 코로나19 환자들에서 자연살해 세포의 항바이러스 기능이 약화돼 있고, 이러한 기능 변화는 경증 코로나19 환자에서는 일주일 내로 사라지지만 중증 환자에서는 오래 지속됨을 규명했다고 10일 밝혔다. 이로써, 항바이러스 선천면역 반응의 한 축을 담당하는 자연살해 세포의 기능 이상을 중증 코로나19 환자에서 처음으로 규명하게 됐다.
우리 몸은 바이러스에 감염되면 이에 대항하여 일차적으로 선천면역 반응이 나타나며, 항바이러스 선천면역 반응을 담당하는 주된 세포가 바로 자연살해 세포다. 이러한 자연살해 세포의 대부분을 차지하는 것이 바이러스에 감염된 세포를 직접 죽이는 세포독성 자연살해 세포인데, 코로나19 환자에서 이러한 세포독성 자연살해 세포의 수나 기능이 감소돼 있다는 보고는 있었지만, 자연살해 세포의 구체적인 변화나 기능감소 기전에 대해서는 규명된 바가 없었다.
이번 연구에서 KAIST-충남대병원 공동연구팀은 한국인 코로나19 환자들을 대상으로 진단 초기부터 회복 시까지 추적 연구를 수행해 코로나19 바이러스 감염증에서 질병의 진행 과정에 따라 자연살해 세포에 일어나는 변화를 최초로 규명했고, 중증 환자와 경증 환자에서 자연살해 세포의 특성 및 기능의 차이점에 대해 밝혔다. 특히 이번 연구에서는 최첨단 면역학 연구기법과 유전자 발현 분석을 동시에 활용해 코로나19 환자에서 자연살해 세포들에 나타나는 변화를 다각도에서 분석하고 규명했다.
공동연구팀은 정상인이나 독감 환자와는 달리 코로나19 환자에게서만 특징적으로 나타나는 비정형 자연살해 세포를 발견했고, 이러한 비정형 자연살해 세포가 일반적인 자연살해 세포보다 세포독성 기능이 감소해있음을 밝혔다.
연구팀은 이러한 비정형 자연살해 세포들이 질병의 중증도와 관계없이 코로나19 바이러스에 감염된 환자들에서 공통적으로 질병 초기에 빠르게 증가하며, 이로 인해 코로나19 환자의 선천면역 반응이 약화되어 있음을 밝혔다. 그리고 코로나19 환자들의 질병 진행 과정에서 자연살해 세포 특성을 추적 관찰한 결과, 중증 코로나19 환자에서 이러한 비정형 자연살해 세포들의 증가 상태가 더 장기간 지속되며 이는 선천면역 반응의 손상과 연관됨을 밝혔다.
이번 연구는 세계 처음으로 코로나19 환자에서 비정형 자연살해 세포의 증가를 발견해 코로나19 환자에서 나타나는 선천면역 반응 손상의 기전을 보고한 연구로 세계 면역학계의 주목을 받고 있다.
과학기술원 공동연구과제의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 `알레르기 및 임상면역학 저널(The Journal of Allergy and Clinical Immunolgy)'에 게재됐다. 특히 이번 논문은 저널 편집자로부터 주목을 받아야 할 주요 연구성과로 선정돼 하이라이트 논문으로 저널에 소개될 예정이다. (논문명: Abnormality in the NK cell population is prolonged in severe COVID-19 patients)
이번 연구의 제1 저자인 우리 대학 임가람 박사 연구원(現 연세의대 소화기내과 임상강사)은 "코로나19 바이러스 감염증에서 특징적으로 비정형 자연살해 세포들이 증가해 있음을 발견했다ˮ며 "다른 호흡기 바이러스 감염에서는 보이지 않는 이러한 자연살해 세포 변화는 코로나19 바이러스 감염증의 임상적 특징을 이해하고, 중증 환자에서 선제적인 치료를 조기에 시작하는 임상적 근거가 될 것이다ˮ고 설명했다.
충남대병원 김연숙 교수는 "이번 연구는 코로나19 환자의 질병 과정의 초기부터 회복기까지 자연살해 세포의 변화 및 특성을 세계에서 최초로 분석해 규명한 연구 결과로서 코로나19 환자에서 나타나는 선천면역 반응의 손상 기전을 최초로 밝혔다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.08.11 조회수 10943
코로나19 환자에서 나타나는 자연살해 세포 변화 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 충남대학교병원 감염내과 김연숙, 천신혜 교수팀과의 공동연구를 통해 코로나19 환자들에서 자연살해 세포의 항바이러스 기능이 약화돼 있고, 이러한 기능 변화는 경증 코로나19 환자에서는 일주일 내로 사라지지만 중증 환자에서는 오래 지속됨을 규명했다고 10일 밝혔다. 이로써, 항바이러스 선천면역 반응의 한 축을 담당하는 자연살해 세포의 기능 이상을 중증 코로나19 환자에서 처음으로 규명하게 됐다.
우리 몸은 바이러스에 감염되면 이에 대항하여 일차적으로 선천면역 반응이 나타나며, 항바이러스 선천면역 반응을 담당하는 주된 세포가 바로 자연살해 세포다. 이러한 자연살해 세포의 대부분을 차지하는 것이 바이러스에 감염된 세포를 직접 죽이는 세포독성 자연살해 세포인데, 코로나19 환자에서 이러한 세포독성 자연살해 세포의 수나 기능이 감소돼 있다는 보고는 있었지만, 자연살해 세포의 구체적인 변화나 기능감소 기전에 대해서는 규명된 바가 없었다.
이번 연구에서 KAIST-충남대병원 공동연구팀은 한국인 코로나19 환자들을 대상으로 진단 초기부터 회복 시까지 추적 연구를 수행해 코로나19 바이러스 감염증에서 질병의 진행 과정에 따라 자연살해 세포에 일어나는 변화를 최초로 규명했고, 중증 환자와 경증 환자에서 자연살해 세포의 특성 및 기능의 차이점에 대해 밝혔다. 특히 이번 연구에서는 최첨단 면역학 연구기법과 유전자 발현 분석을 동시에 활용해 코로나19 환자에서 자연살해 세포들에 나타나는 변화를 다각도에서 분석하고 규명했다.
공동연구팀은 정상인이나 독감 환자와는 달리 코로나19 환자에게서만 특징적으로 나타나는 비정형 자연살해 세포를 발견했고, 이러한 비정형 자연살해 세포가 일반적인 자연살해 세포보다 세포독성 기능이 감소해있음을 밝혔다.
연구팀은 이러한 비정형 자연살해 세포들이 질병의 중증도와 관계없이 코로나19 바이러스에 감염된 환자들에서 공통적으로 질병 초기에 빠르게 증가하며, 이로 인해 코로나19 환자의 선천면역 반응이 약화되어 있음을 밝혔다. 그리고 코로나19 환자들의 질병 진행 과정에서 자연살해 세포 특성을 추적 관찰한 결과, 중증 코로나19 환자에서 이러한 비정형 자연살해 세포들의 증가 상태가 더 장기간 지속되며 이는 선천면역 반응의 손상과 연관됨을 밝혔다.
이번 연구는 세계 처음으로 코로나19 환자에서 비정형 자연살해 세포의 증가를 발견해 코로나19 환자에서 나타나는 선천면역 반응 손상의 기전을 보고한 연구로 세계 면역학계의 주목을 받고 있다.
과학기술원 공동연구과제의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 `알레르기 및 임상면역학 저널(The Journal of Allergy and Clinical Immunolgy)'에 게재됐다. 특히 이번 논문은 저널 편집자로부터 주목을 받아야 할 주요 연구성과로 선정돼 하이라이트 논문으로 저널에 소개될 예정이다. (논문명: Abnormality in the NK cell population is prolonged in severe COVID-19 patients)
이번 연구의 제1 저자인 우리 대학 임가람 박사 연구원(現 연세의대 소화기내과 임상강사)은 "코로나19 바이러스 감염증에서 특징적으로 비정형 자연살해 세포들이 증가해 있음을 발견했다ˮ며 "다른 호흡기 바이러스 감염에서는 보이지 않는 이러한 자연살해 세포 변화는 코로나19 바이러스 감염증의 임상적 특징을 이해하고, 중증 환자에서 선제적인 치료를 조기에 시작하는 임상적 근거가 될 것이다ˮ고 설명했다.
충남대병원 김연숙 교수는 "이번 연구는 코로나19 환자의 질병 과정의 초기부터 회복기까지 자연살해 세포의 변화 및 특성을 세계에서 최초로 분석해 규명한 연구 결과로서 코로나19 환자에서 나타나는 선천면역 반응의 손상 기전을 최초로 밝혔다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.08.11 조회수 10943 코로나19 폐 손상 유발 면역세포의 특성 및 역동적 변화 규명
우리 대학 의과학대학원 박수형 교수 연구팀이 충북대학교 의과대학 최영기 교수(현 한국바이러스기초연구소장), 지놈인사이트 이정석 박사팀과 공동연구를 통해 코로나19 바이러스 증식의 절정기, 그리고 회복기에 걸쳐 나타나는 면역반응의 양적·질적 변화를 규명해 폐 손상을 일으키는 특정 면역세포의 특성과 기원을 규명했다고 4일 밝혔다. 이는 코로나19 환자에서 과잉 면역반응에 의해 발생하는 폐 손상을 조절할 수 있는 타깃(대상)을 제시하는 연구 결과다.
코로나19에 감염되면 처음 바이러스가 유입되어 감염되는 폐 조직 내에서 즉각적인 면역세포의 활성화가 일어남이 알려져 있다. 이 면역세포의 대부분은 대식세포(macrophage)인데, 코로나19에 환자가 감염된 후 혈류를 통해 활성화된 단핵구가 폐 조직으로 들어오며 추가로 대식세포로 분화하며 바이러스에 감염된 폐 조직 세포들을 제거하여 초기 방어로 대응을 하게 된다.
코로나19 감염 후 일어나는 초기의 면역반응과 그 시간에 따른 변화를 폐에서 면역세포를 여러 차례 얻어 연구하는 것은 환자를 통해서는 불가능하다. 따라서 페럿(식육목 족제비과의 포유류)과 같은 호흡기감염 동물모델이 바이러스 감염 후 면역반응의 정확한 면모를 밝히는 데 중요한 역할을 한다. 충북대학교 최영기 교수 연구팀은 실험동물인 페렛이 SARS-CoV-2 바이러스에 감수성이 있다는 것을 세계 최초로 학계에 보고했다.
이번 연구에서 KAIST-충북대-지놈인사이트 공동연구팀은 코로나19 바이러스 감염 동물모델을 이용하여 감염이 진행되는 동안의 폐 내 면역세포의 변화를 첨단 연구기법인 단일세포 시퀀싱을 이용해 정밀하게 분석했고, 폐 면역세포의 대부분을 차지하는 대식세포를 10가지 아형으로 분류해 이중 어떤 대식 세포군이 폐 손상에 기여하는지를 분석했다.
연구팀은 코로나19 바이러스 감염 2일 후부터 혈류에서 활성화된 단핵구가 급격하게 폐 조직으로 침윤하며 대식세포로 분화하며 양적으로 증가함을 확인했다. 특히 이러한 혈류 기원 침윤 대식세포들은 염증성 대식세포의 성질을 강하게 나타내며, 바이러스 제거에 기여할 뿐만 아니라 조직손상을 일으키는 주범이 될 수 있음을 제시했다. 또한 이러한 대식세포 분화의 양상은 중증 코로나19 환자들의 폐 조직에서 관찰되는 변화와도 높은 유사도를 보임을 규명했다.
보건복지부와 KAIST의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 7월 28일 字에 게재됐다(논문명: Single-cell transcriptome of bronchoalveolar lavage fluid reveals sequential change of macrophages during SARS-CoV-2 infection in ferrets).
공동연구팀은 현재 면역억제제를 투약받은 코로나19 환자들의 면역반응 변화를 종적으로 추적하며, `싸이토카인 폭풍'과 같은 치명적인 중증 코로나19의 과잉면역반응의 적절한 제어와 약물의 면역학적 효과를 규명하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 지놈인사이트 이정석 박사와 우리 대학 고준영 박사과정은 "이번 연구 결과는 코로나19 환자의 폐가 경험하게 되는 선천 면역반응을 단일세포 전사체라는 오믹스 데이터를 이용해 다각적으로 분석해, 바이러스 감염 시에 발생하는 대식세포 면역반응의 이중성을 이해하는 중요한 자료ˮ고 설명했다.
충북대학교 최영기 교수는 “SARS-CoV-2 바이러스 감염 후 시간의 경과에 따른 바이러스의 증식성 변화 및 병리학적 분석을 수행한 이번 결과는 전반적인 바이러스 감염 및 회복에 관여하는 병인기전을 이해할 수 있는 중요한 연구자료“라고 말했다.
박수형 교수는 "코로나19가 감염된 직후 시간에 따른 변화를 감염 전과 비교하여 정밀하게 규명한 것이 이 연구의 가장 큰 수확이며, 감염 후 폐 손상이 특정 염증성 대식세포에 의한 것임을 규명하여 중증 코로나19 환자에서 사용되는 면역억제 치료 전략을 정교하게 만들 수 있는 근거를 마련했다ˮ라고 말했다.
2021.08.05 조회수 14686
코로나19 폐 손상 유발 면역세포의 특성 및 역동적 변화 규명
우리 대학 의과학대학원 박수형 교수 연구팀이 충북대학교 의과대학 최영기 교수(현 한국바이러스기초연구소장), 지놈인사이트 이정석 박사팀과 공동연구를 통해 코로나19 바이러스 증식의 절정기, 그리고 회복기에 걸쳐 나타나는 면역반응의 양적·질적 변화를 규명해 폐 손상을 일으키는 특정 면역세포의 특성과 기원을 규명했다고 4일 밝혔다. 이는 코로나19 환자에서 과잉 면역반응에 의해 발생하는 폐 손상을 조절할 수 있는 타깃(대상)을 제시하는 연구 결과다.
코로나19에 감염되면 처음 바이러스가 유입되어 감염되는 폐 조직 내에서 즉각적인 면역세포의 활성화가 일어남이 알려져 있다. 이 면역세포의 대부분은 대식세포(macrophage)인데, 코로나19에 환자가 감염된 후 혈류를 통해 활성화된 단핵구가 폐 조직으로 들어오며 추가로 대식세포로 분화하며 바이러스에 감염된 폐 조직 세포들을 제거하여 초기 방어로 대응을 하게 된다.
코로나19 감염 후 일어나는 초기의 면역반응과 그 시간에 따른 변화를 폐에서 면역세포를 여러 차례 얻어 연구하는 것은 환자를 통해서는 불가능하다. 따라서 페럿(식육목 족제비과의 포유류)과 같은 호흡기감염 동물모델이 바이러스 감염 후 면역반응의 정확한 면모를 밝히는 데 중요한 역할을 한다. 충북대학교 최영기 교수 연구팀은 실험동물인 페렛이 SARS-CoV-2 바이러스에 감수성이 있다는 것을 세계 최초로 학계에 보고했다.
이번 연구에서 KAIST-충북대-지놈인사이트 공동연구팀은 코로나19 바이러스 감염 동물모델을 이용하여 감염이 진행되는 동안의 폐 내 면역세포의 변화를 첨단 연구기법인 단일세포 시퀀싱을 이용해 정밀하게 분석했고, 폐 면역세포의 대부분을 차지하는 대식세포를 10가지 아형으로 분류해 이중 어떤 대식 세포군이 폐 손상에 기여하는지를 분석했다.
연구팀은 코로나19 바이러스 감염 2일 후부터 혈류에서 활성화된 단핵구가 급격하게 폐 조직으로 침윤하며 대식세포로 분화하며 양적으로 증가함을 확인했다. 특히 이러한 혈류 기원 침윤 대식세포들은 염증성 대식세포의 성질을 강하게 나타내며, 바이러스 제거에 기여할 뿐만 아니라 조직손상을 일으키는 주범이 될 수 있음을 제시했다. 또한 이러한 대식세포 분화의 양상은 중증 코로나19 환자들의 폐 조직에서 관찰되는 변화와도 높은 유사도를 보임을 규명했다.
보건복지부와 KAIST의 지원을 받아 수행한 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 7월 28일 字에 게재됐다(논문명: Single-cell transcriptome of bronchoalveolar lavage fluid reveals sequential change of macrophages during SARS-CoV-2 infection in ferrets).
공동연구팀은 현재 면역억제제를 투약받은 코로나19 환자들의 면역반응 변화를 종적으로 추적하며, `싸이토카인 폭풍'과 같은 치명적인 중증 코로나19의 과잉면역반응의 적절한 제어와 약물의 면역학적 효과를 규명하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 지놈인사이트 이정석 박사와 우리 대학 고준영 박사과정은 "이번 연구 결과는 코로나19 환자의 폐가 경험하게 되는 선천 면역반응을 단일세포 전사체라는 오믹스 데이터를 이용해 다각적으로 분석해, 바이러스 감염 시에 발생하는 대식세포 면역반응의 이중성을 이해하는 중요한 자료ˮ고 설명했다.
충북대학교 최영기 교수는 “SARS-CoV-2 바이러스 감염 후 시간의 경과에 따른 바이러스의 증식성 변화 및 병리학적 분석을 수행한 이번 결과는 전반적인 바이러스 감염 및 회복에 관여하는 병인기전을 이해할 수 있는 중요한 연구자료“라고 말했다.
박수형 교수는 "코로나19가 감염된 직후 시간에 따른 변화를 감염 전과 비교하여 정밀하게 규명한 것이 이 연구의 가장 큰 수확이며, 감염 후 폐 손상이 특정 염증성 대식세포에 의한 것임을 규명하여 중증 코로나19 환자에서 사용되는 면역억제 치료 전략을 정교하게 만들 수 있는 근거를 마련했다ˮ라고 말했다.
2021.08.05 조회수 14686 코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14659
코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14659 암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 32121
암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 32121 의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
2021.02.16 조회수 80286
의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
2021.02.16 조회수 80286