%EC%83%9D%EB%AC%BC%ED%95%99
-
 이상엽 특훈교수, 대장균 이용한 나노재료 생물학적 합성법 개발
〈 최 유 진 박사과정, 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 이용해 다양한 나노재료를 생물학적으로 합성할 수 있는 기술을 개발했다.
이번 연구를 통해 기존의 물리, 화학적 방법으로 합성되지 않는 새로운 나노재료도 생물학적으로 합성할 수 있는 가능성을 제시했다.
중앙대학교 박태정 교수 팀과 공동으로 진행하고 우리 대학 최유진 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘미국 국립과학원 회보(PNAS)’ 5월 22일자 온라인 판에 게재됐다.
기존의 생물학적 나노재료는 주로 고온, 고압의 조건에서 합성되고 유독한 유기용매와 값비싼 촉매를 사용하기 때문에 환경오염과 높은 에너지 소모의 문제가 있었다.
대안으로 친환경적이고 경제적인 미생물을 활용한 생물 공학적 나노재료 합성법에 대한 연구가 진행되고 있다. 그러나 현재까지 보고된 합성기술은 나노재료의 종류가 다양하지 않고 결정질과 비결정질 나노재료의 합성 원리가 규명되지 않아 다양한 결정질의 나노재료를 만드는 데 어려움이 있다.
이 교수 연구팀은 유전자 재조합 대장균을 이용해 주기율표 기반의 35개 원소로 이뤄진 60가지의 다양한 나노재료를 친환경적으로 생물학적 합성하는 기술을 개발했다.
다양한 금속 이온과 결합할 수 있는 단백질인 메탈로싸이오닌(metallothionein)과 펩타이드인 파이로킬레틴(phytochelatin)을 합성하는 파이오킬레틴 합성효소(phytochelatin synthase)를 대장균 내에서 동시에 발현해 다양한 나노재료를 합성하는 데 성공했다.
연구팀은 각 원소별 푸베 다이어그램(pourbaix diagram)을 분석해 생물학적 나노재료의 합성 과정에서 열역학적 안정성을 갖는 화학종의 상태를 파악했다. 이를 기반으로 생물학적으로 합성 가능한 물질을 예측 및 생산하는 데 성공했다.
또한 용액의 pH를 조절해 기존 생물학적 합성 조건에서 합성이 불가능하거나 비결정질 나노재료로 합성되는 물질을 합성이 가능하게 만들었다.
연구팀의 이번 연구는 화학적 방법으로 합성하기 어렵거나 아직 보고되지 않은 다양한 나노소재의 종류를 확장시켰다는 의의를 갖는다.
이상엽 특훈교수는 “기존의 물리, 화학적인 공정을 통한 나노재료 합성이 아닌 박테리아를 대사공학적으로 개량한 뒤 생물 공학적 배양을 통해 원하는 나노입자를 쉽고 효율적으로 합성 가능한 기술이다”고 말했다.
또한 “생물공학적 방법으로 합성된 60개의 나노재료들은 나노입자, 나노막대, 나노 판상형 등의 모양을 가지며 향후 에너지, 의료, 환경 분야 등 다양한 산업적 응용이 가능하다”고 말했다.
이번 연구는 과학기술정보통신부 기후변화대응사업의 ‘바이오리파이너리를 위한 시스템대사공학 연구과제’의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 재조합 대장균을 이용한 다양한 나노재료들의 생물학적 합성 기술의 전체 모식도 및 이미지
2018.05.23 조회수 17496
이상엽 특훈교수, 대장균 이용한 나노재료 생물학적 합성법 개발
〈 최 유 진 박사과정, 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 이용해 다양한 나노재료를 생물학적으로 합성할 수 있는 기술을 개발했다.
이번 연구를 통해 기존의 물리, 화학적 방법으로 합성되지 않는 새로운 나노재료도 생물학적으로 합성할 수 있는 가능성을 제시했다.
중앙대학교 박태정 교수 팀과 공동으로 진행하고 우리 대학 최유진 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘미국 국립과학원 회보(PNAS)’ 5월 22일자 온라인 판에 게재됐다.
기존의 생물학적 나노재료는 주로 고온, 고압의 조건에서 합성되고 유독한 유기용매와 값비싼 촉매를 사용하기 때문에 환경오염과 높은 에너지 소모의 문제가 있었다.
대안으로 친환경적이고 경제적인 미생물을 활용한 생물 공학적 나노재료 합성법에 대한 연구가 진행되고 있다. 그러나 현재까지 보고된 합성기술은 나노재료의 종류가 다양하지 않고 결정질과 비결정질 나노재료의 합성 원리가 규명되지 않아 다양한 결정질의 나노재료를 만드는 데 어려움이 있다.
이 교수 연구팀은 유전자 재조합 대장균을 이용해 주기율표 기반의 35개 원소로 이뤄진 60가지의 다양한 나노재료를 친환경적으로 생물학적 합성하는 기술을 개발했다.
다양한 금속 이온과 결합할 수 있는 단백질인 메탈로싸이오닌(metallothionein)과 펩타이드인 파이로킬레틴(phytochelatin)을 합성하는 파이오킬레틴 합성효소(phytochelatin synthase)를 대장균 내에서 동시에 발현해 다양한 나노재료를 합성하는 데 성공했다.
연구팀은 각 원소별 푸베 다이어그램(pourbaix diagram)을 분석해 생물학적 나노재료의 합성 과정에서 열역학적 안정성을 갖는 화학종의 상태를 파악했다. 이를 기반으로 생물학적으로 합성 가능한 물질을 예측 및 생산하는 데 성공했다.
또한 용액의 pH를 조절해 기존 생물학적 합성 조건에서 합성이 불가능하거나 비결정질 나노재료로 합성되는 물질을 합성이 가능하게 만들었다.
연구팀의 이번 연구는 화학적 방법으로 합성하기 어렵거나 아직 보고되지 않은 다양한 나노소재의 종류를 확장시켰다는 의의를 갖는다.
이상엽 특훈교수는 “기존의 물리, 화학적인 공정을 통한 나노재료 합성이 아닌 박테리아를 대사공학적으로 개량한 뒤 생물 공학적 배양을 통해 원하는 나노입자를 쉽고 효율적으로 합성 가능한 기술이다”고 말했다.
또한 “생물공학적 방법으로 합성된 60개의 나노재료들은 나노입자, 나노막대, 나노 판상형 등의 모양을 가지며 향후 에너지, 의료, 환경 분야 등 다양한 산업적 응용이 가능하다”고 말했다.
이번 연구는 과학기술정보통신부 기후변화대응사업의 ‘바이오리파이너리를 위한 시스템대사공학 연구과제’의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 재조합 대장균을 이용한 다양한 나노재료들의 생물학적 합성 기술의 전체 모식도 및 이미지
2018.05.23 조회수 17496 -
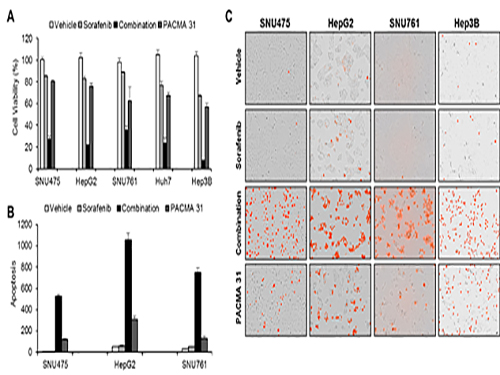 조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 21914
조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 21914 -
 김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 21545
김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 21545 -
 활성산소에 대한 세포반응 원리 규명 - 암과 노화 극복의 실마리 제공
우리 학교 연구진이 활성산소* 농도에 따라 세포의 운명이 어떻게 달라지는지 그 원리를 규명해냈다. 활성산소는 세포의 성장을 돕는 한편 세포손상을 일으켜 노화 등을 촉진하는 것으로 알려져 있었다. 이처럼 세포를 죽게도 하고 살리기도 하는 활성산소의 상반된 역할을 설명할 수 있는 실마리가 찾아진 것이다. * 활성산소(ROS) : 인체 대사활동에 의해 발생되는 산소 부산물로 세포의 성장과 분화를 돕고 염증을 억제하는 유익한 기능을 하는 한편 세포손상을 유발하여 암, 당뇨 등 여러 질병을 일으키고, 노화를 촉진시키는 것으로 알려져 있다.
우리 대학 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 이호성 박사과정 연구원(제1저자), 황채영 박사(공동 제1저자), 신성영 박사가 참여하였으며, 한국생명공학연구원 권기선 박사(교신저자)가 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약)과 바이오·의료기술개발사업의 지원으로 수행되었고 연구결과는 사이언스(Science) 자매지인 사이언스 시그널링(Science Signaling)지 6월 3일자에 게재되었다. * 논문명 : MLK3 is part of a feedback mechanism that regulates different cellular responses to reactive oxygen species
연구팀은 활성산소의 농도에 따라 세포의 증식 또는 세포의 사멸이라는 운명을 가르는 분자스위치가 MLK3* 중심의 피드백회로임을 알아냈다. * MLK3 : 루신-지퍼 구조의 인산화효소로 세포 사멸에 관여하는 단백질이다.
적절한 스트레스가 주어지는 환경에서는 세포가 분열하도록 신호를 보내는 반면 과도한 스트레스 상황에서는 오히려 세포분열을 멈추고 세포가 죽도록 유도하는 결정적 단백질회로가 밝혀짐에 따라 향후 활성산소와 관련된 인체질환 연구의 실마리가 될 것으로 기대된다.
연구팀은 활성산소 농도가 낮을 때는 세포증식에 관여하는 ERK* 단백질이 활성화되는 반면 활성산소 농도가 높아지면 세포사멸에 관여하는 JNK** 단백질이 활성화 되는 것을 알아냈다.
* ERK(Extracellular signal-regulated kinases) : 세포의 생존 및 증식에 관여하는 대표적인 신호전달 분자 ** JNK(c-Jun N-terminal kinases) : 세포의 스트레스 반응 및 사멸에 관여하는 대표적인 신호전달 분자
나아가 수학모델링과 컴퓨터시뮬레이션 분석, 그리고 분자세포생물학 실험을 융합한 시스템생물학 연구를 통해 MLK3 중심의 피드백회로가 활성산소에 대한 ERK와 JNK 경로 간의 신호흐름 균형을 조절하여 세포 반응을 결정하는 핵심적인 분자스위치임을 밝혀내었다.
조 교수는 “IT와 BT의 융합연구인 시스템생물학 연구를 통해 수수께끼로 남아있던 활성산소에 대한 상반된 세포반응의 원리를 규명한 것으로 향후 활성산소로 인한 노화나 암을 극복하기 위한 연구에 활용될 것으로 기대된다”고 밝혔다.
연구 개요도. (A, B) 낮은 농도의 활성산소에 대해서는 세포 증식에 관여하는 단백질인 ERK가 높은 활성도를 보이는 반면, 높은 농도의 활성산소에 대해서는 세포 사멸에 관여하는 단백질인 JNK가 높은 활성도를 보인다는 것을 실험을 통해 확인하였다. 이 실험 결과는 ERK와 JNK가 활성산소의 농도에 따른 상반된 세포 반응을 유발할 수 있음을 시사한다. (C) 대규모 컴퓨터 시뮬레이션 분석을 통해 MLK3을 매개하는 양성피드백 회로와 MKPs를 통한 ERK와 JNK 간 상호소통이 활성산소의 농도에 따른 ERK와 JNK의 상반된 활성화를 일으키는 핵심회로임을 밝혀내었다. (D) MLK3을 매개하는 양성피드백회로는 활성산소에 대한 ERK와 JNK 경로 간의 신호흐름 균형을 조절하여 세포 반응을 결정하는 분자스위치 역할을 한다.
2014.06.09 조회수 20450
활성산소에 대한 세포반응 원리 규명 - 암과 노화 극복의 실마리 제공
우리 학교 연구진이 활성산소* 농도에 따라 세포의 운명이 어떻게 달라지는지 그 원리를 규명해냈다. 활성산소는 세포의 성장을 돕는 한편 세포손상을 일으켜 노화 등을 촉진하는 것으로 알려져 있었다. 이처럼 세포를 죽게도 하고 살리기도 하는 활성산소의 상반된 역할을 설명할 수 있는 실마리가 찾아진 것이다. * 활성산소(ROS) : 인체 대사활동에 의해 발생되는 산소 부산물로 세포의 성장과 분화를 돕고 염증을 억제하는 유익한 기능을 하는 한편 세포손상을 유발하여 암, 당뇨 등 여러 질병을 일으키고, 노화를 촉진시키는 것으로 알려져 있다.
우리 대학 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 이호성 박사과정 연구원(제1저자), 황채영 박사(공동 제1저자), 신성영 박사가 참여하였으며, 한국생명공학연구원 권기선 박사(교신저자)가 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약)과 바이오·의료기술개발사업의 지원으로 수행되었고 연구결과는 사이언스(Science) 자매지인 사이언스 시그널링(Science Signaling)지 6월 3일자에 게재되었다. * 논문명 : MLK3 is part of a feedback mechanism that regulates different cellular responses to reactive oxygen species
연구팀은 활성산소의 농도에 따라 세포의 증식 또는 세포의 사멸이라는 운명을 가르는 분자스위치가 MLK3* 중심의 피드백회로임을 알아냈다. * MLK3 : 루신-지퍼 구조의 인산화효소로 세포 사멸에 관여하는 단백질이다.
적절한 스트레스가 주어지는 환경에서는 세포가 분열하도록 신호를 보내는 반면 과도한 스트레스 상황에서는 오히려 세포분열을 멈추고 세포가 죽도록 유도하는 결정적 단백질회로가 밝혀짐에 따라 향후 활성산소와 관련된 인체질환 연구의 실마리가 될 것으로 기대된다.
연구팀은 활성산소 농도가 낮을 때는 세포증식에 관여하는 ERK* 단백질이 활성화되는 반면 활성산소 농도가 높아지면 세포사멸에 관여하는 JNK** 단백질이 활성화 되는 것을 알아냈다.
* ERK(Extracellular signal-regulated kinases) : 세포의 생존 및 증식에 관여하는 대표적인 신호전달 분자 ** JNK(c-Jun N-terminal kinases) : 세포의 스트레스 반응 및 사멸에 관여하는 대표적인 신호전달 분자
나아가 수학모델링과 컴퓨터시뮬레이션 분석, 그리고 분자세포생물학 실험을 융합한 시스템생물학 연구를 통해 MLK3 중심의 피드백회로가 활성산소에 대한 ERK와 JNK 경로 간의 신호흐름 균형을 조절하여 세포 반응을 결정하는 핵심적인 분자스위치임을 밝혀내었다.
조 교수는 “IT와 BT의 융합연구인 시스템생물학 연구를 통해 수수께끼로 남아있던 활성산소에 대한 상반된 세포반응의 원리를 규명한 것으로 향후 활성산소로 인한 노화나 암을 극복하기 위한 연구에 활용될 것으로 기대된다”고 밝혔다.
연구 개요도. (A, B) 낮은 농도의 활성산소에 대해서는 세포 증식에 관여하는 단백질인 ERK가 높은 활성도를 보이는 반면, 높은 농도의 활성산소에 대해서는 세포 사멸에 관여하는 단백질인 JNK가 높은 활성도를 보인다는 것을 실험을 통해 확인하였다. 이 실험 결과는 ERK와 JNK가 활성산소의 농도에 따른 상반된 세포 반응을 유발할 수 있음을 시사한다. (C) 대규모 컴퓨터 시뮬레이션 분석을 통해 MLK3을 매개하는 양성피드백 회로와 MKPs를 통한 ERK와 JNK 간 상호소통이 활성산소의 농도에 따른 ERK와 JNK의 상반된 활성화를 일으키는 핵심회로임을 밝혀내었다. (D) MLK3을 매개하는 양성피드백회로는 활성산소에 대한 ERK와 JNK 경로 간의 신호흐름 균형을 조절하여 세포 반응을 결정하는 분자스위치 역할을 한다.
2014.06.09 조회수 20450 -
 손상된 DNA의 돌연변이 유발 메커니즘 규명
- DNA 손상을 용인하는 특수 복제효소 Rev1의 조절 메커니즘 밝혀 -- “암 치료 및 예방에 크게 기여할 것” -
우리 학교 화학과 최병석 교수는 생체정보를 저장하는 DNA가 손상돼 회복하고 복제하는 과정에서 돌연변이가 발생하는 메커니즘을 규명했다.
연구결과는 분자세포생물학분야 세계적 학술지 ‘분자세포생물학(Journal of Molecular Cell Biology)’ 6월호 표지논문으로 실렸다.
산업의 급격한 발전으로 현대인들의 유전자는 예전에 비해 훨씬 다양하게 위협받고 있다. 오존층의 파괴로 인해 자외선에 그대로 노출되는 것은 물론 담배연기를 비롯한 수많은 발암물질의 공격은 우리 몸속의 DNA를 손상시킨다.
하루에도 수 만 번 끊임없이 일어나는 DNA의 손상을 효과적으로 회복시켜주지 못하면 암 등 치명적인 질병이 발생한다.
손상된 DNA가 회복반응에 의해 복구되지 않은 상태에서 자기복제가 일어나면 정상적인 복제를 담당하는 폴리머라제는 손상부위에 도달하면 DNA 합성을 정지하게 되고 세포의 죽음을 초래 한다.
인체는 이 같은 비상사태를 맞이해 복제담당 폴리머라제를 잠깐 쉬게 하고 손상된 DNA 부위를 그냥 지나치는 능력이 있는 특수한 복구담당 폴리머라제들을 동원해 손상부위를 통과하고 DNA 합성을 다시 시작한다.
이때 DNA는 많은 오류가 발생돼 심각한 돌연변이를 유발시킨다. 즉, 열악한 상황에 놓인 세포가 복제를 진행하지 못해 죽음을 맞기 보다는 생존을 위해 매우 부정확한 DNA 복제일지라도 선수를 교체하면서까지 복제를 진행하게 된다.
지금까지 학계에서는 Rev1 단백질이 이러한 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능은 명확하게 밝혀내지 못했다.
연구팀은 핵자기공명 분광법(NMR)과 X-ray를 이용해 DNA 복제과정에서 중추적인 역할을 하는 단백질(Polκ과 Rev1, Rev1과 Rev3/Rev7) 각각의 복합구조를 밝혀냈다.
이를 통해 ▲DNA가 손상 시 돌연변이가 유발되는 메커니즘 ▲DNA 복제효소간의 상호작용 ▲손상부위를 통과한 합성된 DNA가 더 연장되는 메커니즘을 분자수준에서 규명했다.
암의 직접적인 발병 원인이 DNA의 손상인 만큼 이에 대한 메커니즘을 밝혀내고 응용하면 개인별로 암의 원인을 제거할 수 있어 부작용 없는 맞춤형 항암제를 개발할 수 있을 것으로 전망된다.
최병석 교수는 이번 연구에 대해 “판코니 빈혈 환자들에게 암이 많이 발생되는 문제를 조사해보니 DNA복제 시 회복 기능이 고장 나 있더라”며 “손상된 DNA의 회복과 복제 과정에 대한 메커니즘 규명을 통해 암을 예방하고 치료하는데 크게 기여할 것”이라고 말했다.
이번 연구는 KAIST 화학과 최병석 교수와 류디난 박사의 주도로 수행됐고, KAIST 화학과 이지오 교수, 고준상 박사, 임경은 박사과정, 기초과학지원연구원 류경석 박사와 황정미 박사가 참여했다.
그림1. Polκ/Rev1/Rev7/Rev3 단백질 복합체 구조
그림2. Rev1, Polκ와 Rev7와 Rev3를 상호형질 주입된 세포의 공초점 현미경 영상
그림3. 논문표지
2013.06.03 조회수 19883
손상된 DNA의 돌연변이 유발 메커니즘 규명
- DNA 손상을 용인하는 특수 복제효소 Rev1의 조절 메커니즘 밝혀 -- “암 치료 및 예방에 크게 기여할 것” -
우리 학교 화학과 최병석 교수는 생체정보를 저장하는 DNA가 손상돼 회복하고 복제하는 과정에서 돌연변이가 발생하는 메커니즘을 규명했다.
연구결과는 분자세포생물학분야 세계적 학술지 ‘분자세포생물학(Journal of Molecular Cell Biology)’ 6월호 표지논문으로 실렸다.
산업의 급격한 발전으로 현대인들의 유전자는 예전에 비해 훨씬 다양하게 위협받고 있다. 오존층의 파괴로 인해 자외선에 그대로 노출되는 것은 물론 담배연기를 비롯한 수많은 발암물질의 공격은 우리 몸속의 DNA를 손상시킨다.
하루에도 수 만 번 끊임없이 일어나는 DNA의 손상을 효과적으로 회복시켜주지 못하면 암 등 치명적인 질병이 발생한다.
손상된 DNA가 회복반응에 의해 복구되지 않은 상태에서 자기복제가 일어나면 정상적인 복제를 담당하는 폴리머라제는 손상부위에 도달하면 DNA 합성을 정지하게 되고 세포의 죽음을 초래 한다.
인체는 이 같은 비상사태를 맞이해 복제담당 폴리머라제를 잠깐 쉬게 하고 손상된 DNA 부위를 그냥 지나치는 능력이 있는 특수한 복구담당 폴리머라제들을 동원해 손상부위를 통과하고 DNA 합성을 다시 시작한다.
이때 DNA는 많은 오류가 발생돼 심각한 돌연변이를 유발시킨다. 즉, 열악한 상황에 놓인 세포가 복제를 진행하지 못해 죽음을 맞기 보다는 생존을 위해 매우 부정확한 DNA 복제일지라도 선수를 교체하면서까지 복제를 진행하게 된다.
지금까지 학계에서는 Rev1 단백질이 이러한 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능은 명확하게 밝혀내지 못했다.
연구팀은 핵자기공명 분광법(NMR)과 X-ray를 이용해 DNA 복제과정에서 중추적인 역할을 하는 단백질(Polκ과 Rev1, Rev1과 Rev3/Rev7) 각각의 복합구조를 밝혀냈다.
이를 통해 ▲DNA가 손상 시 돌연변이가 유발되는 메커니즘 ▲DNA 복제효소간의 상호작용 ▲손상부위를 통과한 합성된 DNA가 더 연장되는 메커니즘을 분자수준에서 규명했다.
암의 직접적인 발병 원인이 DNA의 손상인 만큼 이에 대한 메커니즘을 밝혀내고 응용하면 개인별로 암의 원인을 제거할 수 있어 부작용 없는 맞춤형 항암제를 개발할 수 있을 것으로 전망된다.
최병석 교수는 이번 연구에 대해 “판코니 빈혈 환자들에게 암이 많이 발생되는 문제를 조사해보니 DNA복제 시 회복 기능이 고장 나 있더라”며 “손상된 DNA의 회복과 복제 과정에 대한 메커니즘 규명을 통해 암을 예방하고 치료하는데 크게 기여할 것”이라고 말했다.
이번 연구는 KAIST 화학과 최병석 교수와 류디난 박사의 주도로 수행됐고, KAIST 화학과 이지오 교수, 고준상 박사, 임경은 박사과정, 기초과학지원연구원 류경석 박사와 황정미 박사가 참여했다.
그림1. Polκ/Rev1/Rev7/Rev3 단백질 복합체 구조
그림2. Rev1, Polκ와 Rev7와 Rev3를 상호형질 주입된 세포의 공초점 현미경 영상
그림3. 논문표지
2013.06.03 조회수 19883 -
 시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26219
시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26219 -
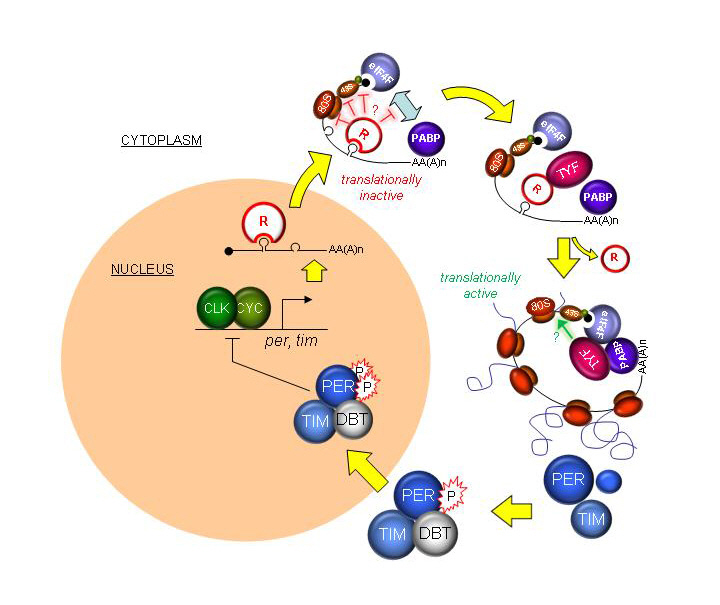 새로운 생체시계 유전자 기능 밝혀내다
- 최준호 교수팀 4년간의 결실, 네이처지 2월호 게재 -
교육과학기술부(장관 이주호)는 24시간을 주기로 반복적으로 일어나는 행동 유형의 하나인 일주기성 생체리듬을 조절하는 새로운 유전자(투엔티-포, Twenty-four)와 이 유전자의 기능 메커니즘이 국내 연구진에 의해 세계 최초로 밝혀졌다고 발표했다.
투엔티-포는 ‘21세기 프론티어 뇌기능활용 및 뇌질환치료기술개발사업’(사업단장 김경진)의 지원을 받은 KAIST 생명과학과 최준호(58)교수·이종빈(30)박사 팀이 미국 노스웨스턴대학교 신경생물학과 라비 알라다 교수·임정훈 박사 팀과의 국제 공동연구를 통해 발견한 것으로 세계 최고 권위의 과학학술지인 ‘네이처(Nature)" 2월호(2011년2월17일자)에 게재됐다.
동 논문의 공동 주저자인 이종빈, 임정훈 박사는 KAIST에서 수학한 국내박사 출신(지도교수 최준호)으로 현재 박사후 연구원으로 동 연구에 참여하고 있으며, 이번 성과는 국내에서 양성한 신진연구원이 주도했다는 점에서 큰 의의를 지닌다.
연구팀에 따르면 형질 전환 초파리를 대상으로 지난 4년간 행동 유형을 실험한 결과 뇌의 생체리듬을 주관하는 신경세포에서 기존에 알려지지 않은 새로운 유전자인 투엔티-포가 존재한다는 사실을 알아냈다.
기존의 생체리듬에 관여하는 유전자들이 DNA에서 mRNA(전령RNA)로 바뀌는 과정(전사단계 : Transcription)에서 작용하는 것과 달리 투엔티-포는 전사단계의 다음단계인 mRNA가 리보솜에서 단백질로 만들어지는 단계에서 작용한다. 특히 투엔티-포는 생체리듬을 조절하는 중요한 유전자인 피리어드(Period) 단백질*에 영향을 미치는 것으로 밝혀졌다.
* 피리어드(Period) 단백질 : 생체 시계 세포들은 외부 자극없이 스스로 돌아가는 분자적 시계 구조를 신경세포마다 가지고 있는데, 피리어드는 이러한 분자적 시계의 구성 유전자 중 하나임. 피리어드 단백질은 생체 시계의 중심 유전자인 클락(Clock)에 의한 전사 활성을 억제 시키는 역할을 함
이는 유전자의 기능을 밝히는 실험을 통해 이 유전자가 만드는 단백질이 신경세포에서 어떻게 기능을 하는지 과학적으로 증명한 것이다. 이번 발견은 기존의 생체리듬에 관여하는 각종 유전자의 작용 메커니즘과 전혀 다른 것으로 생체리듬의 연구 분야에서는 획기적인 일로 평가받고 있다.
이 연구 결과는 앞으로 인간을 포함한 고등생물체의 수면장애·시차적응·식사활동·생리현상 등 일주기성 생체리듬의 문제를 해소하는 방안을 찾는데 중요한 열쇠가 될 것으로 전망된다.
최준호 교수는 “생체리듬의 조절이 유전자의 번역단계에서도 이루어지고 있음을 밝혀 생체시계의 새로운 작용 메커니즘을 찾아냈다는 점에서 연구 결과의 의미가 크다”고 말했다.
연구팀이 새 유전자의 이름을 투엔티-포(Twenty-four)라고 붙인 것은 일주기성(24시간)에 부합하고 유전자 기호 번호(CG4857)를 합한 숫자가 24라는 점에 착안한 것이다.
2011.02.16 조회수 23046
새로운 생체시계 유전자 기능 밝혀내다
- 최준호 교수팀 4년간의 결실, 네이처지 2월호 게재 -
교육과학기술부(장관 이주호)는 24시간을 주기로 반복적으로 일어나는 행동 유형의 하나인 일주기성 생체리듬을 조절하는 새로운 유전자(투엔티-포, Twenty-four)와 이 유전자의 기능 메커니즘이 국내 연구진에 의해 세계 최초로 밝혀졌다고 발표했다.
투엔티-포는 ‘21세기 프론티어 뇌기능활용 및 뇌질환치료기술개발사업’(사업단장 김경진)의 지원을 받은 KAIST 생명과학과 최준호(58)교수·이종빈(30)박사 팀이 미국 노스웨스턴대학교 신경생물학과 라비 알라다 교수·임정훈 박사 팀과의 국제 공동연구를 통해 발견한 것으로 세계 최고 권위의 과학학술지인 ‘네이처(Nature)" 2월호(2011년2월17일자)에 게재됐다.
동 논문의 공동 주저자인 이종빈, 임정훈 박사는 KAIST에서 수학한 국내박사 출신(지도교수 최준호)으로 현재 박사후 연구원으로 동 연구에 참여하고 있으며, 이번 성과는 국내에서 양성한 신진연구원이 주도했다는 점에서 큰 의의를 지닌다.
연구팀에 따르면 형질 전환 초파리를 대상으로 지난 4년간 행동 유형을 실험한 결과 뇌의 생체리듬을 주관하는 신경세포에서 기존에 알려지지 않은 새로운 유전자인 투엔티-포가 존재한다는 사실을 알아냈다.
기존의 생체리듬에 관여하는 유전자들이 DNA에서 mRNA(전령RNA)로 바뀌는 과정(전사단계 : Transcription)에서 작용하는 것과 달리 투엔티-포는 전사단계의 다음단계인 mRNA가 리보솜에서 단백질로 만들어지는 단계에서 작용한다. 특히 투엔티-포는 생체리듬을 조절하는 중요한 유전자인 피리어드(Period) 단백질*에 영향을 미치는 것으로 밝혀졌다.
* 피리어드(Period) 단백질 : 생체 시계 세포들은 외부 자극없이 스스로 돌아가는 분자적 시계 구조를 신경세포마다 가지고 있는데, 피리어드는 이러한 분자적 시계의 구성 유전자 중 하나임. 피리어드 단백질은 생체 시계의 중심 유전자인 클락(Clock)에 의한 전사 활성을 억제 시키는 역할을 함
이는 유전자의 기능을 밝히는 실험을 통해 이 유전자가 만드는 단백질이 신경세포에서 어떻게 기능을 하는지 과학적으로 증명한 것이다. 이번 발견은 기존의 생체리듬에 관여하는 각종 유전자의 작용 메커니즘과 전혀 다른 것으로 생체리듬의 연구 분야에서는 획기적인 일로 평가받고 있다.
이 연구 결과는 앞으로 인간을 포함한 고등생물체의 수면장애·시차적응·식사활동·생리현상 등 일주기성 생체리듬의 문제를 해소하는 방안을 찾는데 중요한 열쇠가 될 것으로 전망된다.
최준호 교수는 “생체리듬의 조절이 유전자의 번역단계에서도 이루어지고 있음을 밝혀 생체시계의 새로운 작용 메커니즘을 찾아냈다는 점에서 연구 결과의 의미가 크다”고 말했다.
연구팀이 새 유전자의 이름을 투엔티-포(Twenty-four)라고 붙인 것은 일주기성(24시간)에 부합하고 유전자 기호 번호(CG4857)를 합한 숫자가 24라는 점에 착안한 것이다.
2011.02.16 조회수 23046 -
 가상세포 이용해 병원균 잡는 항생제 개발
교육과학기술부는 미래기반기술개발사업(시스템생물학 연구)으로 지원한 우리학교 이상엽 교수팀(전남대 이준행교수, 생명(연), 화학(연) 공동연구)이 항생제에 내성을 가진 병원균 퇴치를 위해 시스템생물학을 기반으로 한 신약발굴 방법론을 개발했다고 밝혔다.
이 교수팀은 병원균이 항생제의 오남용으로 인해 치유가 쉽지 않은 점을 감안하여 내성 병원균의 가상세포를 만들어서 이에 대한 특성을 분석하여 제어하는 방법으로 효과를 입증했다.
이번 연구의 대상은 오염된 어패류에 의해 감염되는 패혈증의 병원균인 비브리오 불니피쿠스(Vibrio vulnificus, 이하 비브리오균) 중 내성균 2개이며, 이에 대한 게놈정보와 생물정보를 토대로 가상세포를 구축하였다.
이러한 가상세포가 생존하기 위해 필요한 화학물질은 193개로 분석되었으며, 이중에서 결정적 역할을 수행하는 5개의 화학물질을 추출하였으며, 이에 관여하는 유전자를 제거함으로써 내성 비브리오균의 성장이 억제되는 효과를 증명하였다.
이 교수팀의 연구결과는 올해 1월 18일 세계적 권위의 네이처 자매지인 ‘분자시스템생물학 (Molecular Systems Biology)지’에 논문으로 게재되어 세계적으로도 연구의 우수성이 인정되었다.
이러한 시스템생물학 기법에 근거한 신약발굴 방법론은 다른 내성 병원균은 물론 다양한 인간 질병에도 적용할 수 있는 토대를 마련한 것으로 기대된다.
2011.01.19 조회수 16763
가상세포 이용해 병원균 잡는 항생제 개발
교육과학기술부는 미래기반기술개발사업(시스템생물학 연구)으로 지원한 우리학교 이상엽 교수팀(전남대 이준행교수, 생명(연), 화학(연) 공동연구)이 항생제에 내성을 가진 병원균 퇴치를 위해 시스템생물학을 기반으로 한 신약발굴 방법론을 개발했다고 밝혔다.
이 교수팀은 병원균이 항생제의 오남용으로 인해 치유가 쉽지 않은 점을 감안하여 내성 병원균의 가상세포를 만들어서 이에 대한 특성을 분석하여 제어하는 방법으로 효과를 입증했다.
이번 연구의 대상은 오염된 어패류에 의해 감염되는 패혈증의 병원균인 비브리오 불니피쿠스(Vibrio vulnificus, 이하 비브리오균) 중 내성균 2개이며, 이에 대한 게놈정보와 생물정보를 토대로 가상세포를 구축하였다.
이러한 가상세포가 생존하기 위해 필요한 화학물질은 193개로 분석되었으며, 이중에서 결정적 역할을 수행하는 5개의 화학물질을 추출하였으며, 이에 관여하는 유전자를 제거함으로써 내성 비브리오균의 성장이 억제되는 효과를 증명하였다.
이 교수팀의 연구결과는 올해 1월 18일 세계적 권위의 네이처 자매지인 ‘분자시스템생물학 (Molecular Systems Biology)지’에 논문으로 게재되어 세계적으로도 연구의 우수성이 인정되었다.
이러한 시스템생물학 기법에 근거한 신약발굴 방법론은 다른 내성 병원균은 물론 다양한 인간 질병에도 적용할 수 있는 토대를 마련한 것으로 기대된다.
2011.01.19 조회수 16763 -
 심장질환 원인신호전달메커니즘 규명
- 신약개발 및 심장질환 응용연구의 중요한 발판 마련
- IT와 BT를 융합한 시스템생물학 연구 통해 규명
우리학교 바이오및뇌공학과 조광현 교수팀과 생명과학과 허원도 교수팀이 시스템생물학 융합연구를 통해 심장질환 원인신호전달경로의 숨겨진 메커니즘을 규명했다.
심근비대증은 다양한 병인에 의해 심근세포가 비대해지는 병리학적 현상으로써 심부전증과 부정맥 등을 수반하는 주요 심장질환이다.
칼시뉴린-엔팻(calcineurin-NFAT) 신호전달경로는 이러한 심근비대증의 유발에 매우 중요한 역할을 하는 것으로 알려져 있다.
하지만 이 신호전달경로의 주요 조절단백질로 알려진 알캔(RCAN1)의 기능에 대해 많은 논쟁이 이어져 왔고 현재까지 그 구체적인 조절메커니즘이 밝혀지지 않았다.
조광현 교수 융합연구팀은 이러한 복잡한 현상에 대해 수학 모델링과 대규모 컴퓨터시뮬레이션, 그리고 단일세포 분자 이미징 기술을 동원한 시스템생물학 융합연구를 통해 어크(ERK)와 지에스케이(GSK3)로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 새롭게 규명했다.
특히 이 연구에서는 알캔이 세포내 농도가 낮을 때 칼시뉴린(calcineurin)의 기능을 저해하는 억제자로서 기능하지만, 그 농도가 증가하면 어크와 지에스케이에 의한 크로스토크를 통해 칼시뉴린 신호를 오히려 증가시키는 촉진자로서 기능 하도록 세포내 조절회로가 진화적으로 설계되어 있음을 최초로 밝혔다.
지금까지 많은 연구에서 알캔의 상반된 신호조절 역할이 보고되어 학계에서는 과연 무엇이 진실인가에 관한 논쟁이 이어졌다.
또한, 어떻게 동일한 분자가 그와 같이 서로 다른 기능을 보이는 것인지, 이를 유발하는 근본적인 메커니즘은 과연 무엇인지 등이 모두 수수께끼로 남아 있었다.
이번 연구를 통해 학계의 이러한 오랜 질문에 대한 해답이 제시됐으며, 알캔과 칼시뉴린-엔팻 신호전달경로의 근원적인 조절메커니즘이 시스템차원에서 최초로 규명됨으로써 앞으로 이를 표적으로 하는 신약개발 및 관련 심장질환 응용연구의 중요한 발판을 마련하게 되었다.
또한 기존의 실험적 접근만으로는 해결할 수 없는 복잡한 생명현상을 대상으로 IT와 BT의 융합연구인 생체시스템모델링 및 바이오시뮬레이션 연구를 통해 새로운 해결책을 찾을 수 있는 가능성을 제시하게 됐다.
이 연구는 교육과학기술부가 지원하는 한국연구재단의 기초연구실육성사업과 도약연구사업, 그리고 칼슘대사시스템생물학사업의 일환으로 수행됐으며, 연구 결과는 <저널오브셀사이언스(Journal of Cell Science)>의 표지논문으로 선정되어 2011년 1월 1일자(온라인판은 2010년 12월 13일자)에 게재된다.
2010.12.20 조회수 16857
심장질환 원인신호전달메커니즘 규명
- 신약개발 및 심장질환 응용연구의 중요한 발판 마련
- IT와 BT를 융합한 시스템생물학 연구 통해 규명
우리학교 바이오및뇌공학과 조광현 교수팀과 생명과학과 허원도 교수팀이 시스템생물학 융합연구를 통해 심장질환 원인신호전달경로의 숨겨진 메커니즘을 규명했다.
심근비대증은 다양한 병인에 의해 심근세포가 비대해지는 병리학적 현상으로써 심부전증과 부정맥 등을 수반하는 주요 심장질환이다.
칼시뉴린-엔팻(calcineurin-NFAT) 신호전달경로는 이러한 심근비대증의 유발에 매우 중요한 역할을 하는 것으로 알려져 있다.
하지만 이 신호전달경로의 주요 조절단백질로 알려진 알캔(RCAN1)의 기능에 대해 많은 논쟁이 이어져 왔고 현재까지 그 구체적인 조절메커니즘이 밝혀지지 않았다.
조광현 교수 융합연구팀은 이러한 복잡한 현상에 대해 수학 모델링과 대규모 컴퓨터시뮬레이션, 그리고 단일세포 분자 이미징 기술을 동원한 시스템생물학 융합연구를 통해 어크(ERK)와 지에스케이(GSK3)로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 새롭게 규명했다.
특히 이 연구에서는 알캔이 세포내 농도가 낮을 때 칼시뉴린(calcineurin)의 기능을 저해하는 억제자로서 기능하지만, 그 농도가 증가하면 어크와 지에스케이에 의한 크로스토크를 통해 칼시뉴린 신호를 오히려 증가시키는 촉진자로서 기능 하도록 세포내 조절회로가 진화적으로 설계되어 있음을 최초로 밝혔다.
지금까지 많은 연구에서 알캔의 상반된 신호조절 역할이 보고되어 학계에서는 과연 무엇이 진실인가에 관한 논쟁이 이어졌다.
또한, 어떻게 동일한 분자가 그와 같이 서로 다른 기능을 보이는 것인지, 이를 유발하는 근본적인 메커니즘은 과연 무엇인지 등이 모두 수수께끼로 남아 있었다.
이번 연구를 통해 학계의 이러한 오랜 질문에 대한 해답이 제시됐으며, 알캔과 칼시뉴린-엔팻 신호전달경로의 근원적인 조절메커니즘이 시스템차원에서 최초로 규명됨으로써 앞으로 이를 표적으로 하는 신약개발 및 관련 심장질환 응용연구의 중요한 발판을 마련하게 되었다.
또한 기존의 실험적 접근만으로는 해결할 수 없는 복잡한 생명현상을 대상으로 IT와 BT의 융합연구인 생체시스템모델링 및 바이오시뮬레이션 연구를 통해 새로운 해결책을 찾을 수 있는 가능성을 제시하게 됐다.
이 연구는 교육과학기술부가 지원하는 한국연구재단의 기초연구실육성사업과 도약연구사업, 그리고 칼슘대사시스템생물학사업의 일환으로 수행됐으며, 연구 결과는 <저널오브셀사이언스(Journal of Cell Science)>의 표지논문으로 선정되어 2011년 1월 1일자(온라인판은 2010년 12월 13일자)에 게재된다.
2010.12.20 조회수 16857 -
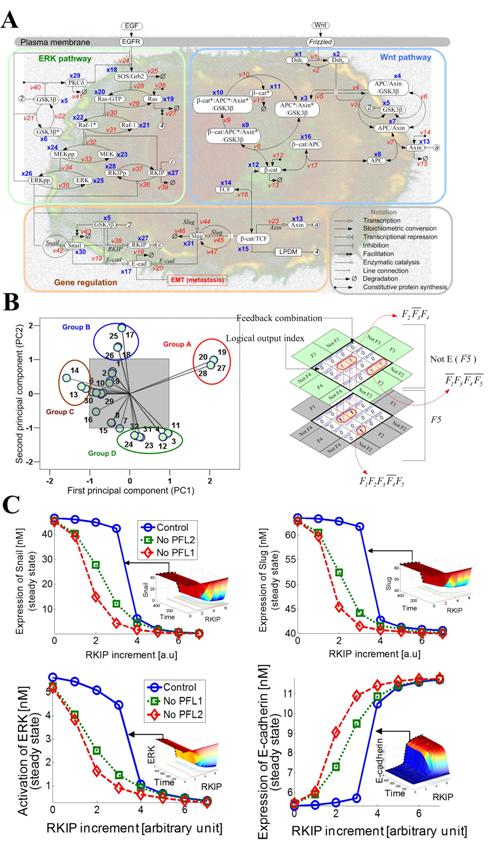 가상 암세포 실험을 통한 암 전이 핵심회로 규명
- 생체시스템 모델링 및 바이오시뮬레이션 연구의 새로운 가능성을 제시 -
우리학교는 바이오 및 뇌 공학과 조광현교수 연구팀이 IT와 BT의 융합연구인 시스템생물학 연구에 기반을 둔 ‘가상 암세포’ 실험을 통해 암 전이를 유발하는 핵심 분자회로를 규명했다고 14일 밝혔다.
이번 연구를 통해 알킵(RKIP)이 매개가 되는 암 전이 조절과정과 핵심회로가 규명됐다. 이로써 향후 이를 표적으로 하는 항암제 개발 등 IT를 이용한 생명과학 응용연구의 중요한 발판을 마련하게 됐다.
특히, 융합연구를 통해 생체시스템 모델링 및 바이오시뮬레이션 연구의 새로운 가능성을 제시하게 됐다.
상피세포가 중간엽세포로 변화하는 과정은 종양세포의 전이단계에서 일어나는 매우 중요한 과정이다. 이 과정의 주요 특징 가운데 하나는 세포 간 결합을 조절하는 단백질인 이카드헤린(E-cadherin)의 양이 급격히 줄어드는 것이다.
이카드헤린의 발현량은 어크(ERK)와 윈트(Wnt)가 포함된 다양한 신호전달경로에 의해 조절되는 것으로 알려져 있다. 하지만, 이들 신호전달경로는 다중결합 피드백회로에 의해 서로 복잡하게 얽혀 있어 실험적인 방법으로는 이들의 동역학 특성과 숨겨진 조절 메커니즘을 분석하는 것이 매우 어려운 것으로 여겨져 왔다.
조광현 교수 연구팀은 이에 대한 수학모형을 개발하고 대규모 컴퓨터시뮬레이션 분석을 통해 이들 결합 피드백회로의 복잡한 상호작용으로 인해 일어날 수 있는 다양한 생명현상을 규명했다.
또한, 어크에 의한 알킵(RKIP) 인산화와 스네일(Snail)에 의한 알킵 전사억제 과정으로 구성된 결합 양성피드백 회로가 임계점 이상의 자극세기에서만 이카드헤린이 급격하게 발현되도록 조절함으로써 외부 노이즈에 강건한 스위칭 동작을 유발한다는 것을 규명했다.
아울러 알킵이 스네일과 슬러그(Slug)의 발현을 억제함으로써 이카드헤린의 발현이 증가되고, 이 때문에 전이과정이 억제될 수 있음을 보였다.
지금까지 전이를 일으키는 종양세포에서 알킵의 발현이 현저하게 감소되었다는 많은 임상적 보고가 있었지만, 그 근본적인 메커니즘은 알려져 있지 않았다.
한편, 이번 연구는 교육과학기술부가 지원하는 한국연구재단의 도약연구사업과 기초연구실육성사업으로 수행됐으며, 연구결과는 순수 컴퓨터시뮬레이션 결과임에도 이례적으로 동물 또는 임상실험의 결과가 주로 게재되는 암 전문 학술지 ‘캔서 리서치(Cancer Research)’지 9월 1일자에 게재됐다.
<그림설명>암 전이과정을 조절하는 세포내 분자들 간의 다중결합 피드백 회로의 동역학 특성 및 조절메커니즘의 분석결과. 이 그림은 암 전이 조절회로에 대한 개념도와 시뮬레이션 분석에 사용된 방법 및 결과를 설명한 것이다.
A. 암 전이과정을 조절하는 세포내 주요 신호전달 네트워크의 예시.
B. 전자공학적 논리회로 분석기법을 이용해 암전이 조절회로를 정량적으로 모사하고 핵심 메커니즘을 분석하는 과정.C. 대규모 컴퓨터시뮬레이션 분석을 통해 알킵에 의해 매개되는 결합양성 피드백 회로가 노이즈가 주어지더라도 강건하게 이카드헤린의 스위칭 동작을 유발함을 보이는 예시.
<용어설명>
◯중간엽세포: 발생단계의 중배엽에서 기원된 결합조직세포로서 여러 다른 결합조직세포로 분화할 수 있는 능력이 있는 세포.
◯EMT: 상피세포가 중간엽세포로 변화하는 과정(Epithelial Mesenchymal Transition).
◯어크(ERK): 세포의 유사분열 신호를 전달하는 단백질의 한 종류.
◯윈트(Wnt): 세포의 유사분열 신호를 전달하는 단백질의 한 종류. 특히 배아의 발생단계에서 중요한 역할을 함.
◯이카드헤린(E-cadherin): 세포 접합에 중요한 역할을 하는 단백질의 한 종류.
◯알킵(RKIP): 유사분열 신호를 조절하는 단백질의 한 종류. 특히, 암의 전이과정에서 중요한 역할을 하는 것으로 알려져 있음.
◯스네일(Snail): 이카드헤린의 발현을 억제함으로써 암 전이 과정을 촉진시키는 역할을 하는 단백질.
◯분자회로: 세포내 유전자, 단백질 등의 분자간 상호작용을 나타낸 회로
◯상피세포: 동물의 몸 표면이나 내장기관의 내부 표면을 덮고 있는 세포
◯전이단계: 암이 다른 부위로 퍼지는 단계
◯다중결합 피드백회로: 피드백회로가 2개 이상 중첩된 구조
2010.09.14 조회수 21037
가상 암세포 실험을 통한 암 전이 핵심회로 규명
- 생체시스템 모델링 및 바이오시뮬레이션 연구의 새로운 가능성을 제시 -
우리학교는 바이오 및 뇌 공학과 조광현교수 연구팀이 IT와 BT의 융합연구인 시스템생물학 연구에 기반을 둔 ‘가상 암세포’ 실험을 통해 암 전이를 유발하는 핵심 분자회로를 규명했다고 14일 밝혔다.
이번 연구를 통해 알킵(RKIP)이 매개가 되는 암 전이 조절과정과 핵심회로가 규명됐다. 이로써 향후 이를 표적으로 하는 항암제 개발 등 IT를 이용한 생명과학 응용연구의 중요한 발판을 마련하게 됐다.
특히, 융합연구를 통해 생체시스템 모델링 및 바이오시뮬레이션 연구의 새로운 가능성을 제시하게 됐다.
상피세포가 중간엽세포로 변화하는 과정은 종양세포의 전이단계에서 일어나는 매우 중요한 과정이다. 이 과정의 주요 특징 가운데 하나는 세포 간 결합을 조절하는 단백질인 이카드헤린(E-cadherin)의 양이 급격히 줄어드는 것이다.
이카드헤린의 발현량은 어크(ERK)와 윈트(Wnt)가 포함된 다양한 신호전달경로에 의해 조절되는 것으로 알려져 있다. 하지만, 이들 신호전달경로는 다중결합 피드백회로에 의해 서로 복잡하게 얽혀 있어 실험적인 방법으로는 이들의 동역학 특성과 숨겨진 조절 메커니즘을 분석하는 것이 매우 어려운 것으로 여겨져 왔다.
조광현 교수 연구팀은 이에 대한 수학모형을 개발하고 대규모 컴퓨터시뮬레이션 분석을 통해 이들 결합 피드백회로의 복잡한 상호작용으로 인해 일어날 수 있는 다양한 생명현상을 규명했다.
또한, 어크에 의한 알킵(RKIP) 인산화와 스네일(Snail)에 의한 알킵 전사억제 과정으로 구성된 결합 양성피드백 회로가 임계점 이상의 자극세기에서만 이카드헤린이 급격하게 발현되도록 조절함으로써 외부 노이즈에 강건한 스위칭 동작을 유발한다는 것을 규명했다.
아울러 알킵이 스네일과 슬러그(Slug)의 발현을 억제함으로써 이카드헤린의 발현이 증가되고, 이 때문에 전이과정이 억제될 수 있음을 보였다.
지금까지 전이를 일으키는 종양세포에서 알킵의 발현이 현저하게 감소되었다는 많은 임상적 보고가 있었지만, 그 근본적인 메커니즘은 알려져 있지 않았다.
한편, 이번 연구는 교육과학기술부가 지원하는 한국연구재단의 도약연구사업과 기초연구실육성사업으로 수행됐으며, 연구결과는 순수 컴퓨터시뮬레이션 결과임에도 이례적으로 동물 또는 임상실험의 결과가 주로 게재되는 암 전문 학술지 ‘캔서 리서치(Cancer Research)’지 9월 1일자에 게재됐다.
<그림설명>암 전이과정을 조절하는 세포내 분자들 간의 다중결합 피드백 회로의 동역학 특성 및 조절메커니즘의 분석결과. 이 그림은 암 전이 조절회로에 대한 개념도와 시뮬레이션 분석에 사용된 방법 및 결과를 설명한 것이다.
A. 암 전이과정을 조절하는 세포내 주요 신호전달 네트워크의 예시.
B. 전자공학적 논리회로 분석기법을 이용해 암전이 조절회로를 정량적으로 모사하고 핵심 메커니즘을 분석하는 과정.C. 대규모 컴퓨터시뮬레이션 분석을 통해 알킵에 의해 매개되는 결합양성 피드백 회로가 노이즈가 주어지더라도 강건하게 이카드헤린의 스위칭 동작을 유발함을 보이는 예시.
<용어설명>
◯중간엽세포: 발생단계의 중배엽에서 기원된 결합조직세포로서 여러 다른 결합조직세포로 분화할 수 있는 능력이 있는 세포.
◯EMT: 상피세포가 중간엽세포로 변화하는 과정(Epithelial Mesenchymal Transition).
◯어크(ERK): 세포의 유사분열 신호를 전달하는 단백질의 한 종류.
◯윈트(Wnt): 세포의 유사분열 신호를 전달하는 단백질의 한 종류. 특히 배아의 발생단계에서 중요한 역할을 함.
◯이카드헤린(E-cadherin): 세포 접합에 중요한 역할을 하는 단백질의 한 종류.
◯알킵(RKIP): 유사분열 신호를 조절하는 단백질의 한 종류. 특히, 암의 전이과정에서 중요한 역할을 하는 것으로 알려져 있음.
◯스네일(Snail): 이카드헤린의 발현을 억제함으로써 암 전이 과정을 촉진시키는 역할을 하는 단백질.
◯분자회로: 세포내 유전자, 단백질 등의 분자간 상호작용을 나타낸 회로
◯상피세포: 동물의 몸 표면이나 내장기관의 내부 표면을 덮고 있는 세포
◯전이단계: 암이 다른 부위로 퍼지는 단계
◯다중결합 피드백회로: 피드백회로가 2개 이상 중첩된 구조
2010.09.14 조회수 21037 -
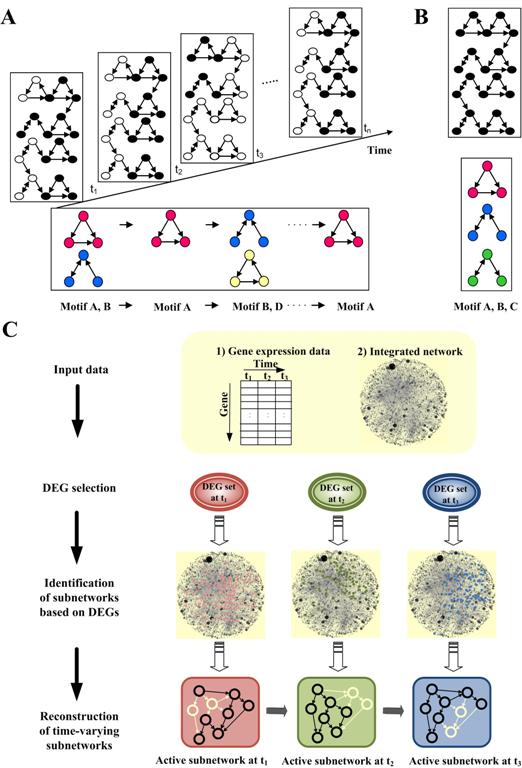 조광현교수 생체 분자네트워크의 다이나믹한 조절회로 규명
- 조광현 교수연구팀, IT와 BT를 융합한 시스템생물학 연구 통해- 초파리 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명
우리학교 바이오및뇌공학과 조광현 교수 연구팀은 IT와 BT를 융합한 시스템생물학 연구를 통해, 시간에 따라 변화하는 유전자 네트워크의 동역학 개념을 최초로 제시했다. 이 개념을 이용하면 초파리 발달과정 중 단계별로 중요한 조절작용을 하는 동적 네트워크 모티프를 찾아내어, 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명할 수 있다.
측정기술이 발달한 현대생명과학은 유전체나 단백질체 등 세포내 분자발현량의 집단 관측이 가능하다. 이러한 오믹스(Omics) 기술의 발전에 힘입어 생체 분자들 간 상호작용을 거대한 네트워크로 모사하고, 집합적 조절작용을 시스템 차원에서 분석 이해하고자 하는 시도가 이어지고 있다.
특히, 거대 생체 분자상호작용 네트워크를 이해하는 유용한 방법으로 네트워크를 구성하는 작은 모듈, 즉 네트워크 모티프를 찾아내고 그 역할을 분석하여 이들의 조합으로 이루어진 전체 네트워크의 거동을 추정하는 연구가 각광받고 있다. 그러나 지금까지 이런 조절 네트워크는 시간축 상에 고정된 정적 개념으로만 다루어져 왔다.
조교수 연구팀은 실제의 시간 흐름에 따라 다이나믹하게(동적으로) 변화하는 분자발현을 추적했다. 그리고 이 데이터로부터 거대 네트워크의 일부분만이 특정 시간대의 조절작용에 참여함을 밝히고 이 관점에서 동적 조절네트워크 모티프 개념을 도입해 4차원에서 생체분자 조절작용을 규명하는 새로운 시도를 했다.
이 개념을 이용해 초파리 발달과정에서 단계별 발달의 조절작용에 기여하는 동적 네트워크 모티프를 찾아내어 다이나믹하게 조절되는 발달과정의 메커니즘을 시스템관점에서 새롭게 규명한 것이다.
조교수는 “이번 연구에서 제안된 개념은 암과 같은 복잡한 인체질환의 발달과정을 분석하고 새로운 진단과 예측방법의 개발에 폭넓게 응용될 수 있을 것으로 보인다”고 말했다.
이 연구는 교육과학기술부가 지원하는 한국연구재단 연구사업의 일환으로 수행됐으며, 연구 결과는 국제저널 <바이오에세이(BioEssays)> 5월 18일자 온라인판 표지논문으로 소개됐다.
[그림설명]
발달유전학의 4차원 분해: 초파리 발달과정의 다이나믹 네트워크 모티프 원리 규명. 정적 조절네트워크 관점에서만 다뤄져 온 초파리 발달과정의 유전자 상호작용 네트워크에 시간축을 더해 4차원의 다이나믹한 관점으로 분석하는 새 개념의 연구가 조광현 교수 연구팀에 의해 제안되었다. 이 개념에 따르면 초파리 발달과정에서 단계별로 주요 역할을 하는 일련의 유전자집단을 새롭게 규명할 수 있다. 이 그림은 초파리 배아로부터 성체에 이르는 발달과정별로 주요 조절작용을 하는 네트워크 모티프의 개념을 설명한 것.
시간에 따라 변화하는 동적 조절네트워크의 개념도
A. 시간축으로 분해한 동적 조절네트워크 모티프
B. 시간축을 없애고 한 평면에 투영한 정적 조절네트워크 (섞여진 네트워크로부터 특정시간에 조절작용하는 요소를 식별하기 어려움).C. 마이크로어레이 실험을 통해 측정된 유전자 발현량으로부터 유전자 조절네트워크를 추론하고 시간대별로 작동하는 각각의 조절네트워크 모티프를 규명하는 과정의 모식도.
2010.06.07 조회수 19085
조광현교수 생체 분자네트워크의 다이나믹한 조절회로 규명
- 조광현 교수연구팀, IT와 BT를 융합한 시스템생물학 연구 통해- 초파리 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명
우리학교 바이오및뇌공학과 조광현 교수 연구팀은 IT와 BT를 융합한 시스템생물학 연구를 통해, 시간에 따라 변화하는 유전자 네트워크의 동역학 개념을 최초로 제시했다. 이 개념을 이용하면 초파리 발달과정 중 단계별로 중요한 조절작용을 하는 동적 네트워크 모티프를 찾아내어, 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명할 수 있다.
측정기술이 발달한 현대생명과학은 유전체나 단백질체 등 세포내 분자발현량의 집단 관측이 가능하다. 이러한 오믹스(Omics) 기술의 발전에 힘입어 생체 분자들 간 상호작용을 거대한 네트워크로 모사하고, 집합적 조절작용을 시스템 차원에서 분석 이해하고자 하는 시도가 이어지고 있다.
특히, 거대 생체 분자상호작용 네트워크를 이해하는 유용한 방법으로 네트워크를 구성하는 작은 모듈, 즉 네트워크 모티프를 찾아내고 그 역할을 분석하여 이들의 조합으로 이루어진 전체 네트워크의 거동을 추정하는 연구가 각광받고 있다. 그러나 지금까지 이런 조절 네트워크는 시간축 상에 고정된 정적 개념으로만 다루어져 왔다.
조교수 연구팀은 실제의 시간 흐름에 따라 다이나믹하게(동적으로) 변화하는 분자발현을 추적했다. 그리고 이 데이터로부터 거대 네트워크의 일부분만이 특정 시간대의 조절작용에 참여함을 밝히고 이 관점에서 동적 조절네트워크 모티프 개념을 도입해 4차원에서 생체분자 조절작용을 규명하는 새로운 시도를 했다.
이 개념을 이용해 초파리 발달과정에서 단계별 발달의 조절작용에 기여하는 동적 네트워크 모티프를 찾아내어 다이나믹하게 조절되는 발달과정의 메커니즘을 시스템관점에서 새롭게 규명한 것이다.
조교수는 “이번 연구에서 제안된 개념은 암과 같은 복잡한 인체질환의 발달과정을 분석하고 새로운 진단과 예측방법의 개발에 폭넓게 응용될 수 있을 것으로 보인다”고 말했다.
이 연구는 교육과학기술부가 지원하는 한국연구재단 연구사업의 일환으로 수행됐으며, 연구 결과는 국제저널 <바이오에세이(BioEssays)> 5월 18일자 온라인판 표지논문으로 소개됐다.
[그림설명]
발달유전학의 4차원 분해: 초파리 발달과정의 다이나믹 네트워크 모티프 원리 규명. 정적 조절네트워크 관점에서만 다뤄져 온 초파리 발달과정의 유전자 상호작용 네트워크에 시간축을 더해 4차원의 다이나믹한 관점으로 분석하는 새 개념의 연구가 조광현 교수 연구팀에 의해 제안되었다. 이 개념에 따르면 초파리 발달과정에서 단계별로 주요 역할을 하는 일련의 유전자집단을 새롭게 규명할 수 있다. 이 그림은 초파리 배아로부터 성체에 이르는 발달과정별로 주요 조절작용을 하는 네트워크 모티프의 개념을 설명한 것.
시간에 따라 변화하는 동적 조절네트워크의 개념도
A. 시간축으로 분해한 동적 조절네트워크 모티프
B. 시간축을 없애고 한 평면에 투영한 정적 조절네트워크 (섞여진 네트워크로부터 특정시간에 조절작용하는 요소를 식별하기 어려움).C. 마이크로어레이 실험을 통해 측정된 유전자 발현량으로부터 유전자 조절네트워크를 추론하고 시간대별로 작동하는 각각의 조절네트워크 모티프를 규명하는 과정의 모식도.
2010.06.07 조회수 19085 -
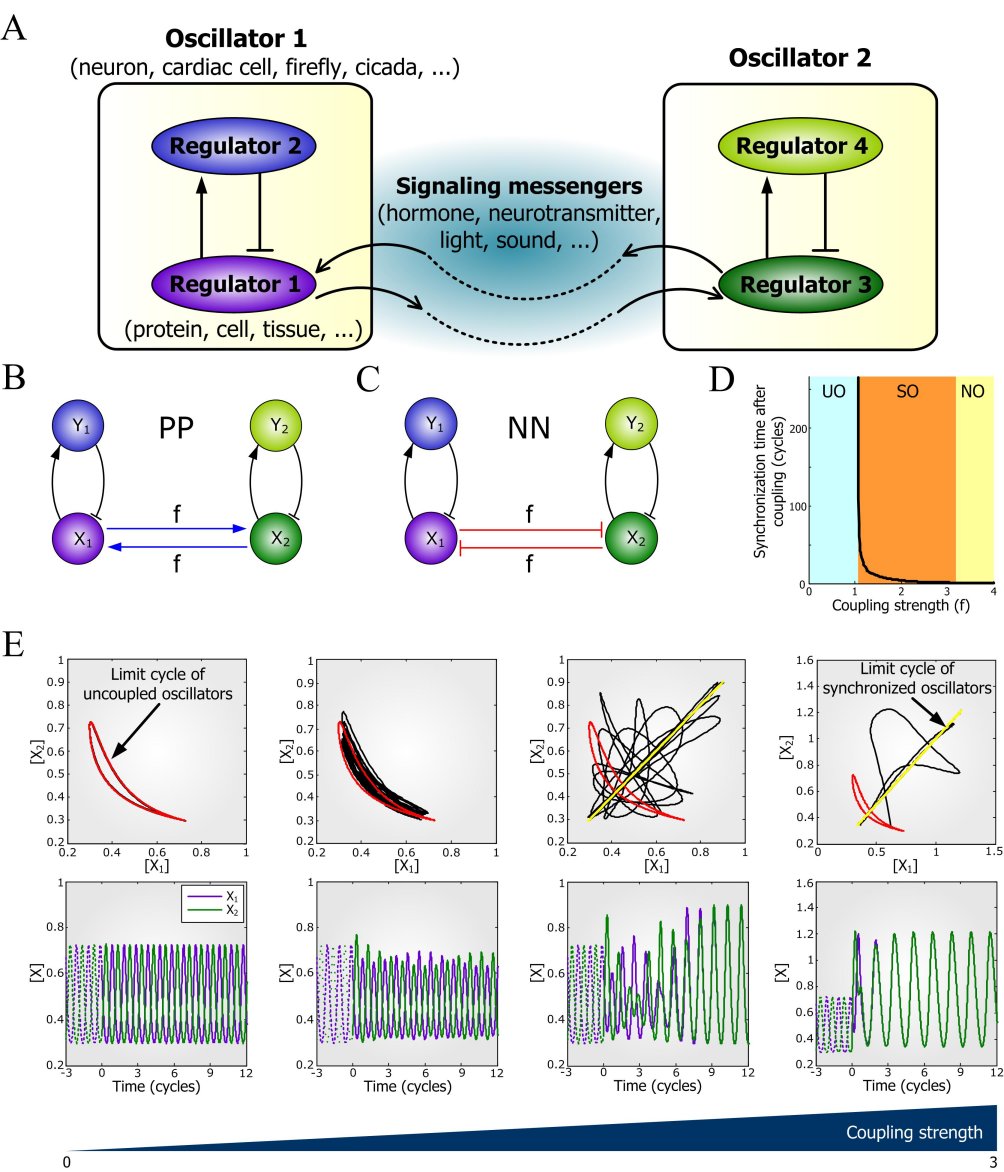 매미와 개구리는 지휘자없이 어떻게 합창할까
나무위의 매미와 논두렁의 개구리는 지휘자 없이 어떻게 합창할까? 이와 관련해서, KAIST 바이오 및 뇌공학과의 조광현 교수는 생명체의 동기화된 주기적 진동신호의 생성원리를 최근 규명했다. 나무에 붙어있는 많은 반딧불들의 동시다발적인 깜빡임, 매미들의 조율된 울음소리, 뇌신경세포들간의 전기신호, 세포내 분자들의 농도변화에 이르기까지 생명체는 다양한 형태의 주기적 진동신호 교환을 통해 정보를 전달하는데, 이들은 놀랍게도 정확히 동일한 위상(phase)으로 동기화되곤 한다. 이는 마치 오케스트라에서 지휘자 없이도 모든 연주가 일정한 박자에 맞춰 이루어지는 것과 같다.
어떻게 생명체의 여러 주기적 진동신호들이 그러한 동기화를 이루는가?
우리학교 바이오및뇌공학과 조광현(曺光鉉) 교수 연구팀이 대규모 가상세포(virtual cell)실험을 통해 생명체의 다양한 주기적 진동(oscillation)신호들이 동기화(synchronization)되는 보편적인 원리를 규명했다.
曺교수팀은 이번 연구를 통해 여러 독립적인 주기적 진동신호들은 양성피드백(positive feedback)을 통해 서로의 위상에 영향을 줘 하나의 동일한 위상으로 수렴되는 현상을 밝혀냈다.
특히 양성피드백은 이중활성(double activation) 또는 이중억제(double inhibition)의 구조로 구현된다. 이중활성피드백은 연결시간지연이 짧을 때, 이중억제피드백은 연결시간지연이 길 때 보다 안정적인 신호동기화를 가능하게 했다.
또한, 노이즈(noise) 교란이 있을 때 이중활성피드백은 진동신호의 주기보다 진폭을 안정적으로 유지하는 반면 이중억제피드백은 연결강도에 불규칙한 변화가 주어졌을 때 일정한 주기와 진폭을 유지시켜줬다. 현존하는 대부분의 현상들이 이러한 원칙을 따르고 있었다.
이번에 규명된 원리는 생체내 주기적 진동신호의 동기화가 교란될 때 발생하는 뇌질환 등 여러 질병의 원인을 새롭게 조명하는 계기를 마련할 것으로 기대된다.
이번 연구는 기존 생명과학의 난제에 대해 IT융합기술인 시스템생물학(Systems Biology) 연구를 통해 해답을 제시할 수 있음을 보여줬으며, 향후 생명과학 연구에 있어서 가상세포실험의 무한한 가능성을 제시했다.
曺교수는 “생명체는 복잡하게 얽혀있는 것으로 보이는 네트워크속에 이와 같이 정교한 진화적 설계원리를 간직하고 있었다”며 “이러한 규칙들은 임의로 수많은 디지털 진동자들을 만들어 인공진화를 통해 신호의 동기화 현상을 관측하였을 때에도 마찬가지로 성립된다는 흥미로운 사실을 확인했다”고 말했다.
이 연구는 교육과학기술부가 지원하는 한국연구재단 연구사업의 일환으로 수행되었으며, 연구결과는 세포생물학 분야 권위지인 세포과학저널(Journal of Cell Science) 2010년 1월 26일자 온라인판에 게재됐다.
세포생물학 실험결과만을 출판하는 이 저널에 순수 컴퓨터시뮬레이션만으로 수행된 가상세포실험 연구결과가 게재된 것은 매우 이례적인 일이다.
인터넷주소: http://jcs.biologists.org/cgi/content/abstract/jcs.060061v1
<용어설명>◯ 양성피드백(positive feedback): 서로 연결되어 있는 두 요소 사이에 어느 하나의 변화가 결과적으로 스스로를 동일한 방향으로 더욱 변화시키는 형태의 연결구조.
<사진설명>◯ 설명: A: 서로 상호작용하는 두 생체신호 진동자(oscillator)들의 예시. B: 이중활성 양성피드백으로 연결된 진동자들. C: 이중억제 양성피드백으로 연결된 진동자들. D: 연결강도에 따라 진동신호 동기화에 소요되는 시간. E: 연결강도 증가에 따라 점차 진동신호 동기화가 되어가는 모습의 예시 (좌측의 비동기화 진동신호들이 점차 우측의 동기화된 진동신호들로 변화되어 가는 과정을 나타냄).
2010.02.02 조회수 24445
매미와 개구리는 지휘자없이 어떻게 합창할까
나무위의 매미와 논두렁의 개구리는 지휘자 없이 어떻게 합창할까? 이와 관련해서, KAIST 바이오 및 뇌공학과의 조광현 교수는 생명체의 동기화된 주기적 진동신호의 생성원리를 최근 규명했다. 나무에 붙어있는 많은 반딧불들의 동시다발적인 깜빡임, 매미들의 조율된 울음소리, 뇌신경세포들간의 전기신호, 세포내 분자들의 농도변화에 이르기까지 생명체는 다양한 형태의 주기적 진동신호 교환을 통해 정보를 전달하는데, 이들은 놀랍게도 정확히 동일한 위상(phase)으로 동기화되곤 한다. 이는 마치 오케스트라에서 지휘자 없이도 모든 연주가 일정한 박자에 맞춰 이루어지는 것과 같다.
어떻게 생명체의 여러 주기적 진동신호들이 그러한 동기화를 이루는가?
우리학교 바이오및뇌공학과 조광현(曺光鉉) 교수 연구팀이 대규모 가상세포(virtual cell)실험을 통해 생명체의 다양한 주기적 진동(oscillation)신호들이 동기화(synchronization)되는 보편적인 원리를 규명했다.
曺교수팀은 이번 연구를 통해 여러 독립적인 주기적 진동신호들은 양성피드백(positive feedback)을 통해 서로의 위상에 영향을 줘 하나의 동일한 위상으로 수렴되는 현상을 밝혀냈다.
특히 양성피드백은 이중활성(double activation) 또는 이중억제(double inhibition)의 구조로 구현된다. 이중활성피드백은 연결시간지연이 짧을 때, 이중억제피드백은 연결시간지연이 길 때 보다 안정적인 신호동기화를 가능하게 했다.
또한, 노이즈(noise) 교란이 있을 때 이중활성피드백은 진동신호의 주기보다 진폭을 안정적으로 유지하는 반면 이중억제피드백은 연결강도에 불규칙한 변화가 주어졌을 때 일정한 주기와 진폭을 유지시켜줬다. 현존하는 대부분의 현상들이 이러한 원칙을 따르고 있었다.
이번에 규명된 원리는 생체내 주기적 진동신호의 동기화가 교란될 때 발생하는 뇌질환 등 여러 질병의 원인을 새롭게 조명하는 계기를 마련할 것으로 기대된다.
이번 연구는 기존 생명과학의 난제에 대해 IT융합기술인 시스템생물학(Systems Biology) 연구를 통해 해답을 제시할 수 있음을 보여줬으며, 향후 생명과학 연구에 있어서 가상세포실험의 무한한 가능성을 제시했다.
曺교수는 “생명체는 복잡하게 얽혀있는 것으로 보이는 네트워크속에 이와 같이 정교한 진화적 설계원리를 간직하고 있었다”며 “이러한 규칙들은 임의로 수많은 디지털 진동자들을 만들어 인공진화를 통해 신호의 동기화 현상을 관측하였을 때에도 마찬가지로 성립된다는 흥미로운 사실을 확인했다”고 말했다.
이 연구는 교육과학기술부가 지원하는 한국연구재단 연구사업의 일환으로 수행되었으며, 연구결과는 세포생물학 분야 권위지인 세포과학저널(Journal of Cell Science) 2010년 1월 26일자 온라인판에 게재됐다.
세포생물학 실험결과만을 출판하는 이 저널에 순수 컴퓨터시뮬레이션만으로 수행된 가상세포실험 연구결과가 게재된 것은 매우 이례적인 일이다.
인터넷주소: http://jcs.biologists.org/cgi/content/abstract/jcs.060061v1
<용어설명>◯ 양성피드백(positive feedback): 서로 연결되어 있는 두 요소 사이에 어느 하나의 변화가 결과적으로 스스로를 동일한 방향으로 더욱 변화시키는 형태의 연결구조.
<사진설명>◯ 설명: A: 서로 상호작용하는 두 생체신호 진동자(oscillator)들의 예시. B: 이중활성 양성피드백으로 연결된 진동자들. C: 이중억제 양성피드백으로 연결된 진동자들. D: 연결강도에 따라 진동신호 동기화에 소요되는 시간. E: 연결강도 증가에 따라 점차 진동신호 동기화가 되어가는 모습의 예시 (좌측의 비동기화 진동신호들이 점차 우측의 동기화된 진동신호들로 변화되어 가는 과정을 나타냄).
2010.02.02 조회수 24445