-
 다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
2020.06.01
조회수 16742
-
 해상도 높인 곤충 눈 구조 초박형 카메라 개발
바이오및뇌공학과 정기훈 교수 연구팀이 고해상도 이미징을 위한 곤충 눈 구조의 초박형 카메라를 개발했다. 이 카메라는 독특한 시각 구조를 가진 제노스 페키(Xenos peckii)라는 곤충의 눈을 모사해 개발돼, 상용 카메라보다 더 얇은 렌즈 두께와 넓은 광시야각을 갖는다. 이러한 특징을 이용해 모바일, 감시 및 정찰 장비, 의료영상 기기 등 다양한 소형 카메라가 필요한 분야에 적용 가능할 것으로 기대된다.
김기수 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용 (Light : Science & Applications)’ 2월 27일 자 온라인판에 게재됐다. (논문명: 고대비 고해상도 이미징을 위한 생체모사 초박형 카메라, Biologically Inspired Ultrathin Arrayed Camera for High Contrast and High Resolution Imaging)
최근 초소형 및 초박형 스마트 기기의 개발로 소형화된 이미징 시스템의 수요가 커지고 있다. 그러나 기존의 카메라는 물체의 상이 일그러지거나 흐려지는 현상인 수차를 줄이기 위해 다층 렌즈 구조를 활용하기 때문에 렌즈 두께를 감소하는 데 한계가 있다. 또한, 기존의 곤충 눈을 모사한 미세렌즈 배열(Microlens arrays)은 렌즈 사이의 광학 크로스토크(Optical crosstalk)로 인해 해상도가 저해되는 단점이 있다.
연구팀은 문제 해결을 위해 제노스 페키 곤충의 시각 구조를 모사한 렌즈를 제작했고 이를 이미지 센서와 결합해 초박형 카메라를 개발했다. 곤충의 눈은 렌즈와 렌즈 사이의 빛을 차단하는 색소 세포(pigment cells)가 존재해 각 렌즈에서 결상(어떤 물체에서 나온 광선 등이 반사 굴절한 다음 다시 모여 그 물체와 닮은꼴의 상을 만드는 현상)되는 영상들 간의 간섭을 막는다. 이러한 구조는 렌즈들 사이의 광학 크로스토크를 막아 고 대비 및 고해상도 영상을 획득하는 데 도움을 준다.
연구팀은 이러한 광 차단 구조를 포토리소그래피(Photolithography) 공정으로 매우 얇게 제작해 렌즈들 사이의 광학 크로스토크를 효율적으로 차단했다. 렌즈의 두께를 최소화하기 위해 렌즈의 방향을 이미지 센서 방향인 역방향으로 배치했으며, 이를 통해 최종 개발된 카메라 렌즈의 두께는 0.74mm로 이는 10원짜리 동전 절반 정도의 두께이다. 연구팀은 카메라의 원거리에 있는 물체를 모든 렌즈에서 같은 시야각을 통해 동일한 영상을 획득하고, 이 배열 영상들은 해상도를 하나의 이미지로 합성했다. 합성된 영상은 합성 전 단일 채널 영상보다 향상된 해상도를 가짐을 확인했다.
정기훈 교수는 “실질적으로 상용화 가능한 초박형 카메라를 제작하는 방법을 개발했다”라며 “이 카메라는 영상획득이 필요한 장치에 통합돼 장치 소형화에 크게 기여할 것으로 확신한다”라고 말했다.
해상도 높인 곤충 눈 구조 초박형 카메라 개발
바이오및뇌공학과 정기훈 교수 연구팀이 고해상도 이미징을 위한 곤충 눈 구조의 초박형 카메라를 개발했다. 이 카메라는 독특한 시각 구조를 가진 제노스 페키(Xenos peckii)라는 곤충의 눈을 모사해 개발돼, 상용 카메라보다 더 얇은 렌즈 두께와 넓은 광시야각을 갖는다. 이러한 특징을 이용해 모바일, 감시 및 정찰 장비, 의료영상 기기 등 다양한 소형 카메라가 필요한 분야에 적용 가능할 것으로 기대된다.
김기수 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용 (Light : Science & Applications)’ 2월 27일 자 온라인판에 게재됐다. (논문명: 고대비 고해상도 이미징을 위한 생체모사 초박형 카메라, Biologically Inspired Ultrathin Arrayed Camera for High Contrast and High Resolution Imaging)
최근 초소형 및 초박형 스마트 기기의 개발로 소형화된 이미징 시스템의 수요가 커지고 있다. 그러나 기존의 카메라는 물체의 상이 일그러지거나 흐려지는 현상인 수차를 줄이기 위해 다층 렌즈 구조를 활용하기 때문에 렌즈 두께를 감소하는 데 한계가 있다. 또한, 기존의 곤충 눈을 모사한 미세렌즈 배열(Microlens arrays)은 렌즈 사이의 광학 크로스토크(Optical crosstalk)로 인해 해상도가 저해되는 단점이 있다.
연구팀은 문제 해결을 위해 제노스 페키 곤충의 시각 구조를 모사한 렌즈를 제작했고 이를 이미지 센서와 결합해 초박형 카메라를 개발했다. 곤충의 눈은 렌즈와 렌즈 사이의 빛을 차단하는 색소 세포(pigment cells)가 존재해 각 렌즈에서 결상(어떤 물체에서 나온 광선 등이 반사 굴절한 다음 다시 모여 그 물체와 닮은꼴의 상을 만드는 현상)되는 영상들 간의 간섭을 막는다. 이러한 구조는 렌즈들 사이의 광학 크로스토크를 막아 고 대비 및 고해상도 영상을 획득하는 데 도움을 준다.
연구팀은 이러한 광 차단 구조를 포토리소그래피(Photolithography) 공정으로 매우 얇게 제작해 렌즈들 사이의 광학 크로스토크를 효율적으로 차단했다. 렌즈의 두께를 최소화하기 위해 렌즈의 방향을 이미지 센서 방향인 역방향으로 배치했으며, 이를 통해 최종 개발된 카메라 렌즈의 두께는 0.74mm로 이는 10원짜리 동전 절반 정도의 두께이다. 연구팀은 카메라의 원거리에 있는 물체를 모든 렌즈에서 같은 시야각을 통해 동일한 영상을 획득하고, 이 배열 영상들은 해상도를 하나의 이미지로 합성했다. 합성된 영상은 합성 전 단일 채널 영상보다 향상된 해상도를 가짐을 확인했다.
정기훈 교수는 “실질적으로 상용화 가능한 초박형 카메라를 제작하는 방법을 개발했다”라며 “이 카메라는 영상획득이 필요한 장치에 통합돼 장치 소형화에 크게 기여할 것으로 확신한다”라고 말했다.
2020.03.23
조회수 21121
-
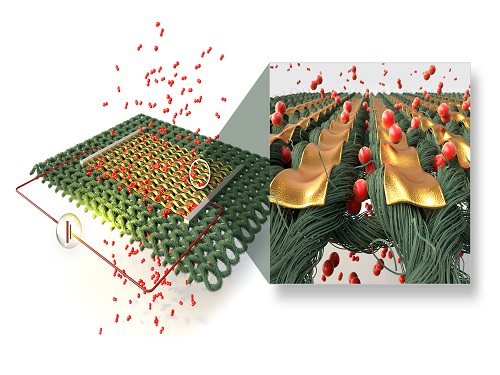 섬유 위에 기능성 나노구조체 구현
기계공학과 박인규 교수와 한국기계연구원 정준호 박사 공동 연구팀이 섬유 위에 다양한 기능성 나노 구조체를 구현하는 생체적합성 공정을 개발했다.
연구팀은 개발한 공정을 통해 다양한 재료의 나노 구조체를 섬유 위에 자유롭게 구현하는 데 성공했다. 섬유 위에 직접 나노 구조체를 전사할 수 있어 추가적인 기판이나 접착층 없이도 기능성 기기를 손쉽게 제작할 수 있다. 연구팀은 전기적·광학적 특성을 이용해 환경 및 신체 움직임 모니터링, 나노 구조색을 이용한 보안패턴, 광촉매를 이용한 자가 세정 기능 등을 섬유에 부여할 수 있으며, 스마트 섬유로 활용 가능할 것으로 전망했다.
고지우 박사과정이 1 저자로 참여한 이번 연구는 나노분야의 권위 있는 국제 학술지인 ‘에이씨에스 나노(ACS Nano, IF: 13.903)’2월 25일 자 14권 2호 논문에 게재됐다. (논문명: Nanotransfer Printing on Textile Substrate with Water-Soluble Polymer Nanotemplate, 수용성 폴리머 나노템플릿을 이용한 섬유에의 나노패턴전사)
최근 웨어러블 디바이스에 대한 관심이 커짐에 따라 섬유를 기판으로 하는 스마트 섬유 연구가 활발히 진행되고 있다. 섬유에 초미세 패턴을 구현하기 위해 다양한 방법이 시도되지만, 섬유의 거친 표면 특성으로 인해 기존의 공정은 기기 소형화 및 성능 향상에 필수적인 정교한 패턴을 구현할 수 없다는 한계가 있다. 이번 연구에서는 이를 해결하기 위해 물에 잘 젖는 섬유의 특성을 이용해 수용성 고분자이며 생체적합성이 우수한 히알루론산의 나노 패턴을 사용했다.
연구팀은 히알루론산 기판에 나노 패턴의 템플릿을 제작한 후 다양한 기능성 소재의 박막을 진공증착을 통해 형성했다. 그 후 섬유에 흡수된 물을 이용해 히알루론산 템플릿을 녹여냄으로써 최소 선폭 50 나노미터인 나노 구조체를 섬유 위에 전사했다. 이 방법을 통해 금, 은, 팔라듐, 알루미늄, 이산화규소와 같은 금속과 비금속 소재의 나노 패턴 형성이 모두 가능하며 동시에 다양한 나노 구조체의 조합을 자유롭게 섬유 위에 제작할 수 있다.
연구팀은 개발한 공정을 통해 팔라듐 나노 구조체를 전사해 수소 감지 센서를 제작했고, 나노 구조체가 없는 센서와 비교해 센서의 감도가 향상됐음을 확인했다. 또한, 나노 구조체가 갖는 광학적 특성인 국소 표면 플라즈몬 공명 현상으로 인한 나노 구조색을 이용해 같은 금속 및 구조이지만 두께 및 형상 파라미터에 따라 서로 다른 고유한 색을 나타냄으로써 보안패턴에 적용할 수 있음을 입증했다.
박인규 교수는 “스마트 섬유를 구현할 수 있는 간편하면서도 범용성 있는 나노 패터닝 공정을 개발했다. 다양한 섬유에 센서, 배터리, 보안패턴, 자가 세정 등의 첨단 기능을 쉽게 구현할 수 있는 데 큰 의의가 있다”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제 (올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 글로벌 프론티어 사업 (극한물성시스템 제조 플랫폼기술)의 지원을 통해 수행됐다.
섬유 위에 기능성 나노구조체 구현
기계공학과 박인규 교수와 한국기계연구원 정준호 박사 공동 연구팀이 섬유 위에 다양한 기능성 나노 구조체를 구현하는 생체적합성 공정을 개발했다.
연구팀은 개발한 공정을 통해 다양한 재료의 나노 구조체를 섬유 위에 자유롭게 구현하는 데 성공했다. 섬유 위에 직접 나노 구조체를 전사할 수 있어 추가적인 기판이나 접착층 없이도 기능성 기기를 손쉽게 제작할 수 있다. 연구팀은 전기적·광학적 특성을 이용해 환경 및 신체 움직임 모니터링, 나노 구조색을 이용한 보안패턴, 광촉매를 이용한 자가 세정 기능 등을 섬유에 부여할 수 있으며, 스마트 섬유로 활용 가능할 것으로 전망했다.
고지우 박사과정이 1 저자로 참여한 이번 연구는 나노분야의 권위 있는 국제 학술지인 ‘에이씨에스 나노(ACS Nano, IF: 13.903)’2월 25일 자 14권 2호 논문에 게재됐다. (논문명: Nanotransfer Printing on Textile Substrate with Water-Soluble Polymer Nanotemplate, 수용성 폴리머 나노템플릿을 이용한 섬유에의 나노패턴전사)
최근 웨어러블 디바이스에 대한 관심이 커짐에 따라 섬유를 기판으로 하는 스마트 섬유 연구가 활발히 진행되고 있다. 섬유에 초미세 패턴을 구현하기 위해 다양한 방법이 시도되지만, 섬유의 거친 표면 특성으로 인해 기존의 공정은 기기 소형화 및 성능 향상에 필수적인 정교한 패턴을 구현할 수 없다는 한계가 있다. 이번 연구에서는 이를 해결하기 위해 물에 잘 젖는 섬유의 특성을 이용해 수용성 고분자이며 생체적합성이 우수한 히알루론산의 나노 패턴을 사용했다.
연구팀은 히알루론산 기판에 나노 패턴의 템플릿을 제작한 후 다양한 기능성 소재의 박막을 진공증착을 통해 형성했다. 그 후 섬유에 흡수된 물을 이용해 히알루론산 템플릿을 녹여냄으로써 최소 선폭 50 나노미터인 나노 구조체를 섬유 위에 전사했다. 이 방법을 통해 금, 은, 팔라듐, 알루미늄, 이산화규소와 같은 금속과 비금속 소재의 나노 패턴 형성이 모두 가능하며 동시에 다양한 나노 구조체의 조합을 자유롭게 섬유 위에 제작할 수 있다.
연구팀은 개발한 공정을 통해 팔라듐 나노 구조체를 전사해 수소 감지 센서를 제작했고, 나노 구조체가 없는 센서와 비교해 센서의 감도가 향상됐음을 확인했다. 또한, 나노 구조체가 갖는 광학적 특성인 국소 표면 플라즈몬 공명 현상으로 인한 나노 구조색을 이용해 같은 금속 및 구조이지만 두께 및 형상 파라미터에 따라 서로 다른 고유한 색을 나타냄으로써 보안패턴에 적용할 수 있음을 입증했다.
박인규 교수는 “스마트 섬유를 구현할 수 있는 간편하면서도 범용성 있는 나노 패터닝 공정을 개발했다. 다양한 섬유에 센서, 배터리, 보안패턴, 자가 세정 등의 첨단 기능을 쉽게 구현할 수 있는 데 큰 의의가 있다”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제 (올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 글로벌 프론티어 사업 (극한물성시스템 제조 플랫폼기술)의 지원을 통해 수행됐다.
2020.03.18
조회수 20172
-
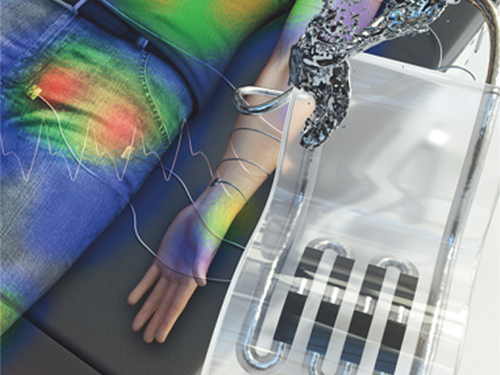 박인규 교수, 헬스 모니터링용 고감도 유연 압력센서 개발
우리 대학 기계공학과 박인규 교수 연구팀에서 생체 신호 및 신체 압력 모니터링에 활용이 가능한 액체 금속 기반 웨어러블 유연 압력 센서를 개발했다.
이 기술을 통해 맥박, 혈압 등 다양한 중요 생체 신호를 연속적으로 모니터링하고 욕창과 같은 압력으로 인해 비롯한 여러 질병을 예방할 수 있는 시스템으로 활용할 수 있을 것으로 기대된다.
김규영 박사과정이 1저자, 오용석 연구교수가 공동 교신저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스트 헬스케어 머터리얼스(Advanced Healthcare Materials)’11월 21일자 표지논문에 게재됐다. (논문명: Highly Sensitive and Wearable Liquid Metal‐Based Pressure Sensor for Health Monitoring Applications: Integration of a 3D‐Printed Microbump Array with the Microchannel)
최근 헬스케어에 대한 관심이 커짐에 따라 웨어러블 유연 센서 개발이 활발히 진행되고 있다. 기능성 소재를 기반으로 다양한 고감도의 유연 센서가 많이 개발되고 있지만, 기존 고체 소재 기반 센서는 웨어러블 디바이스로 활용되기에 신축성, 신호 반복성 및 안정성 측면에서 한계를 보인다.
이러한 점을 보완하기 위해 현재 액체 소재 기반 유연 센서가 다양하게 개발되고 있다. 액체 전극 중에서도 특히 갈린스탄(Galinstan)과 같은 액체 금속은 신축성에 제한이 없으며, 무독성, 높은 전기 전도도, 전기/기계적 안정성 등의 특징으로 신축성 소자 및 웨어러블 디바이스 요소로써 활용도가 매우 높다.
하지만 기존의 액체 금속 기반 유연 압력 센서는 안정적이지만 매우 감도가 낮아 맥박이나 신체 압력 모니터링과 같은 수 kPa 수준의 작은 범위의 압력 측정에 활용하기 어려웠다.
이번 연구에서는 다중물질 3D 프린팅 기술을 활용해 단단한 마이크로 범프 구조물을 액체 금속 채널에 배치하여 작은 압력에도 신호 변화가 크게 나타날 수 있는 구조를 개발했다. 이러한 구조를 통해 마이크로 범프가 없는 일반 액체 금속기반 압력 센서보다 6배 이상의 높은 감도를 얻고 고체 기반 유연 압력 센서 수준의 감도를 얻을 수 있었다.
또한, 개발된 유연 압력 센서는 1만 회 이상의 인장, 굽힘 등 다양한 물리 변형에도 안정적인 신호 회복을 보이고, 다양한 환경 요인(온도, 습도)에도 안정적인 감지 성능을 보여 웨어러블 디바이스로써 활용될 수 있는 큰 가능성을 보였다.
연구팀은 이러한 성능을 바탕으로 평상시와 운동 시의 맥박, 혈압을 측정하여 그 변화를 연속적으로 감지해 건강 상태를 모니터링할 수 있음을 확인했다.
센서가 부착된 양말과 무선 통신 시스템을 구축하여 누워있는 사람의 다양한 자세 변화 도중 나타나는 신체 압력 및 그 변화를 원격으로 모니터링할 수 있었다.
박인규 교수는 “개발한 고감도 및 고신뢰성 액체 금속기반 유연 압력 센서를 통해 다양한 생체 건강 정보를 연속적으로 수집할 수 있었다. 이를 이용하여 다양한 헬스 케어/헬스 모니터링 어플리케이션, 특히 욕창과 같이 압력으로 인해 나타나는 다양한 질병 관리 및 예방 분야에 활용될 수 있을 것으로 기대된다.”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제(올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 선도연구센터지원 사업 (초정밀 광 기계기술 연구센터)의 지원을 통해 수행됐다.
□ 그림 설명
그림1. Advanced Healthcare Materials 표지
그림2. 마이크로 범프가 집적된 액체 금속 기반 유연 압력 센서
그림3. 높은 감도와 안정적 성능의 유연 센서 및 신체 압력 측정 어플리케이션
박인규 교수, 헬스 모니터링용 고감도 유연 압력센서 개발
우리 대학 기계공학과 박인규 교수 연구팀에서 생체 신호 및 신체 압력 모니터링에 활용이 가능한 액체 금속 기반 웨어러블 유연 압력 센서를 개발했다.
이 기술을 통해 맥박, 혈압 등 다양한 중요 생체 신호를 연속적으로 모니터링하고 욕창과 같은 압력으로 인해 비롯한 여러 질병을 예방할 수 있는 시스템으로 활용할 수 있을 것으로 기대된다.
김규영 박사과정이 1저자, 오용석 연구교수가 공동 교신저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스트 헬스케어 머터리얼스(Advanced Healthcare Materials)’11월 21일자 표지논문에 게재됐다. (논문명: Highly Sensitive and Wearable Liquid Metal‐Based Pressure Sensor for Health Monitoring Applications: Integration of a 3D‐Printed Microbump Array with the Microchannel)
최근 헬스케어에 대한 관심이 커짐에 따라 웨어러블 유연 센서 개발이 활발히 진행되고 있다. 기능성 소재를 기반으로 다양한 고감도의 유연 센서가 많이 개발되고 있지만, 기존 고체 소재 기반 센서는 웨어러블 디바이스로 활용되기에 신축성, 신호 반복성 및 안정성 측면에서 한계를 보인다.
이러한 점을 보완하기 위해 현재 액체 소재 기반 유연 센서가 다양하게 개발되고 있다. 액체 전극 중에서도 특히 갈린스탄(Galinstan)과 같은 액체 금속은 신축성에 제한이 없으며, 무독성, 높은 전기 전도도, 전기/기계적 안정성 등의 특징으로 신축성 소자 및 웨어러블 디바이스 요소로써 활용도가 매우 높다.
하지만 기존의 액체 금속 기반 유연 압력 센서는 안정적이지만 매우 감도가 낮아 맥박이나 신체 압력 모니터링과 같은 수 kPa 수준의 작은 범위의 압력 측정에 활용하기 어려웠다.
이번 연구에서는 다중물질 3D 프린팅 기술을 활용해 단단한 마이크로 범프 구조물을 액체 금속 채널에 배치하여 작은 압력에도 신호 변화가 크게 나타날 수 있는 구조를 개발했다. 이러한 구조를 통해 마이크로 범프가 없는 일반 액체 금속기반 압력 센서보다 6배 이상의 높은 감도를 얻고 고체 기반 유연 압력 센서 수준의 감도를 얻을 수 있었다.
또한, 개발된 유연 압력 센서는 1만 회 이상의 인장, 굽힘 등 다양한 물리 변형에도 안정적인 신호 회복을 보이고, 다양한 환경 요인(온도, 습도)에도 안정적인 감지 성능을 보여 웨어러블 디바이스로써 활용될 수 있는 큰 가능성을 보였다.
연구팀은 이러한 성능을 바탕으로 평상시와 운동 시의 맥박, 혈압을 측정하여 그 변화를 연속적으로 감지해 건강 상태를 모니터링할 수 있음을 확인했다.
센서가 부착된 양말과 무선 통신 시스템을 구축하여 누워있는 사람의 다양한 자세 변화 도중 나타나는 신체 압력 및 그 변화를 원격으로 모니터링할 수 있었다.
박인규 교수는 “개발한 고감도 및 고신뢰성 액체 금속기반 유연 압력 센서를 통해 다양한 생체 건강 정보를 연속적으로 수집할 수 있었다. 이를 이용하여 다양한 헬스 케어/헬스 모니터링 어플리케이션, 특히 욕창과 같이 압력으로 인해 나타나는 다양한 질병 관리 및 예방 분야에 활용될 수 있을 것으로 기대된다.”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제(올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 선도연구센터지원 사업 (초정밀 광 기계기술 연구센터)의 지원을 통해 수행됐다.
□ 그림 설명
그림1. Advanced Healthcare Materials 표지
그림2. 마이크로 범프가 집적된 액체 금속 기반 유연 압력 센서
그림3. 높은 감도와 안정적 성능의 유연 센서 및 신체 압력 측정 어플리케이션
2019.12.11
조회수 17865
-
 정재웅 교수, 상황에 따라 딱딱해지고 유연해지는 전자기기 개발
〈 정재웅 교수, 변상혁 박사과정, 이주현 석사과정 〉
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 사용 목적과 신체 적용 여부에 따라 딱딱한 형태와 부드러운 형태를 하나의 전자기기에서 선택적으로 구현함으로써 기기의 모양과 유연성을 변화시킬 수 있는 기술을 개발했다.
연구팀이 개발한 기술은 딱딱한 형태의 전자기기와 유연 기기의 경계를 허물어 활용도, 사용 편의성, 휴대성, 생체적합성을 모두 극대화할 수 있어 소비 전자제품뿐 아니라 생체의학, 로봇 공학 등의 다양한 분야에 혁신적 변화를 일으킬 것으로 기대된다.
변상혁 연구원과 한국전자통신연구원의 심주용 박사가 1저자로 참여하고 이주현, 라자 콰지(Raza Qazi) 연구원 등이 참여한 이번 연구는 국제 학술지 ‘사이언스 어드밴시스(Science Advances)’ 11월 1일 자에 게재됐다. (논문명: Mechanically transformative electronics, sensors, and implantable devices).
일반적으로 전자기기는 사용 목적에 따라 특정 강성을 갖도록 설계된다. 스마트폰, 노트북은 딱딱한 형태로 손에 쥐거나 테이블 위에 놓고 사용하기 적합하고, 최근 활발히 개발되는 유연 신축성 전자기기는 착용성이 뛰어나 웨어러블 형태로 활용되고 있다.
하지만 딱딱한 형태의 전자기기는 신체에 착용 시 각종 불편함을 일으키고, 생체이식 시 조직 파괴나 염증 등을 유발할 수 있다. 반면 유연 신축성 전자기기는 외력을 견디지 못하고 쉽게 모양이 변하기 때문에 몸에서 탈착 시 일반적인 전자기기와 같이 편리하게 사용하기 어렵다는 단점을 가진다.
연구팀은 갈륨(Gallium)과 중합체(polymer)를 이용한 합성물질을 제작해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 구현했다. 이를 유연 신축성 전자회로와 결합해 강성률이 변화 가능한 새로운 형태의 전자기기를 구현했다.
갈륨은 이번 연구의 핵심 소재로, 금속임에도 불구하고 생체 온도(29.8℃)에서 녹는점을 가져 신체 탈부착 시 고체와 액체 간의 상태 변화가 가능하다. 이러한 점에 기반해 갈륨을 중합체에 내장해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 제작했다.
연구팀은 전자기기의 강성도를 변화시킬 수 있는 특징을 활용해 다양한 적용 분야에서 기존 전자기기가 갖는 한계점을 극복할 수 있음을 증명했다. 예를 들어, 이 기술을 휴대용 전자기기에 적용해 평상시에는 딱딱한 형태로 손에 쥔 상태나 책상 위에서 이용하고, 이동 시 몸에 부착해 부드러운 웨어러블 기기 형태로 만듦으로써 휴대성을 높일 수 있음을 보여줬다.
또한, 강성을 변환시킬 수 있는 압력 센서를 개발해 목적에 따라 민감도와 압력 감지의 범위를 조절하는 데 성공했다. 그뿐만 아니라, 뇌 조직에 이식 시 부드럽게 변화하는 뇌 탐침을 개발해 기존 딱딱한 탐침 대비 뇌 손상 및 염증 반응을 최소화할 수 있었다.
이렇게 변형 가능한 전자기기 기술은 웨어러블, 임플랜터블, 센싱기기 및 로봇 등에 적용돼 다양한 목적과 상황에 유동적으로 사용될 수 있는 다목적 전자기기 시스템 개발을 이끌 수 있을 것으로 기대된다.
정 교수는 “평상시 딱딱한 형태의 전자기기로 쓰이나 몸에 부착 시 혹은 내부 장기에 이식 시 우리 신체 조직처럼 부드럽고 신축성 있게 변환될 수 있는 기기 플랫폼 기술 개발을 통해, 일반적인 전자기기와 유연 기기가 갖는 단점은 없애면서 사용 목적에 따라 각각의 장점을 극대화할 수 있는 전자기기를 개발했다”라며 “이 기술을 이용하면 전자기기의 활용 폭을 크게 넓힐 수 있을 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업 및 기초연구실 지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 개발된 강성률 변화 가능한 전자기기의 개념도와 실제 구현사진
그림2. 딱딱한 모바일 기기와 부드러운 웨어러블 기기 간 변환이 가능한 전자기기 및 활용 예시
그림3. 압력 측정 민감도-동작 범위 튜닝이 가능한 압력 센서
그림4. 강성률 변화 가능 플랫폼을 활용한 뉴럴 프로브
그림5. 디바이스 개념을 보여주는 인포그래픽
정재웅 교수, 상황에 따라 딱딱해지고 유연해지는 전자기기 개발
〈 정재웅 교수, 변상혁 박사과정, 이주현 석사과정 〉
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 사용 목적과 신체 적용 여부에 따라 딱딱한 형태와 부드러운 형태를 하나의 전자기기에서 선택적으로 구현함으로써 기기의 모양과 유연성을 변화시킬 수 있는 기술을 개발했다.
연구팀이 개발한 기술은 딱딱한 형태의 전자기기와 유연 기기의 경계를 허물어 활용도, 사용 편의성, 휴대성, 생체적합성을 모두 극대화할 수 있어 소비 전자제품뿐 아니라 생체의학, 로봇 공학 등의 다양한 분야에 혁신적 변화를 일으킬 것으로 기대된다.
변상혁 연구원과 한국전자통신연구원의 심주용 박사가 1저자로 참여하고 이주현, 라자 콰지(Raza Qazi) 연구원 등이 참여한 이번 연구는 국제 학술지 ‘사이언스 어드밴시스(Science Advances)’ 11월 1일 자에 게재됐다. (논문명: Mechanically transformative electronics, sensors, and implantable devices).
일반적으로 전자기기는 사용 목적에 따라 특정 강성을 갖도록 설계된다. 스마트폰, 노트북은 딱딱한 형태로 손에 쥐거나 테이블 위에 놓고 사용하기 적합하고, 최근 활발히 개발되는 유연 신축성 전자기기는 착용성이 뛰어나 웨어러블 형태로 활용되고 있다.
하지만 딱딱한 형태의 전자기기는 신체에 착용 시 각종 불편함을 일으키고, 생체이식 시 조직 파괴나 염증 등을 유발할 수 있다. 반면 유연 신축성 전자기기는 외력을 견디지 못하고 쉽게 모양이 변하기 때문에 몸에서 탈착 시 일반적인 전자기기와 같이 편리하게 사용하기 어렵다는 단점을 가진다.
연구팀은 갈륨(Gallium)과 중합체(polymer)를 이용한 합성물질을 제작해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 구현했다. 이를 유연 신축성 전자회로와 결합해 강성률이 변화 가능한 새로운 형태의 전자기기를 구현했다.
갈륨은 이번 연구의 핵심 소재로, 금속임에도 불구하고 생체 온도(29.8℃)에서 녹는점을 가져 신체 탈부착 시 고체와 액체 간의 상태 변화가 가능하다. 이러한 점에 기반해 갈륨을 중합체에 내장해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 제작했다.
연구팀은 전자기기의 강성도를 변화시킬 수 있는 특징을 활용해 다양한 적용 분야에서 기존 전자기기가 갖는 한계점을 극복할 수 있음을 증명했다. 예를 들어, 이 기술을 휴대용 전자기기에 적용해 평상시에는 딱딱한 형태로 손에 쥔 상태나 책상 위에서 이용하고, 이동 시 몸에 부착해 부드러운 웨어러블 기기 형태로 만듦으로써 휴대성을 높일 수 있음을 보여줬다.
또한, 강성을 변환시킬 수 있는 압력 센서를 개발해 목적에 따라 민감도와 압력 감지의 범위를 조절하는 데 성공했다. 그뿐만 아니라, 뇌 조직에 이식 시 부드럽게 변화하는 뇌 탐침을 개발해 기존 딱딱한 탐침 대비 뇌 손상 및 염증 반응을 최소화할 수 있었다.
이렇게 변형 가능한 전자기기 기술은 웨어러블, 임플랜터블, 센싱기기 및 로봇 등에 적용돼 다양한 목적과 상황에 유동적으로 사용될 수 있는 다목적 전자기기 시스템 개발을 이끌 수 있을 것으로 기대된다.
정 교수는 “평상시 딱딱한 형태의 전자기기로 쓰이나 몸에 부착 시 혹은 내부 장기에 이식 시 우리 신체 조직처럼 부드럽고 신축성 있게 변환될 수 있는 기기 플랫폼 기술 개발을 통해, 일반적인 전자기기와 유연 기기가 갖는 단점은 없애면서 사용 목적에 따라 각각의 장점을 극대화할 수 있는 전자기기를 개발했다”라며 “이 기술을 이용하면 전자기기의 활용 폭을 크게 넓힐 수 있을 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업 및 기초연구실 지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 개발된 강성률 변화 가능한 전자기기의 개념도와 실제 구현사진
그림2. 딱딱한 모바일 기기와 부드러운 웨어러블 기기 간 변환이 가능한 전자기기 및 활용 예시
그림3. 압력 측정 민감도-동작 범위 튜닝이 가능한 압력 센서
그림4. 강성률 변화 가능 플랫폼을 활용한 뉴럴 프로브
그림5. 디바이스 개념을 보여주는 인포그래픽
2019.11.06
조회수 12059
-
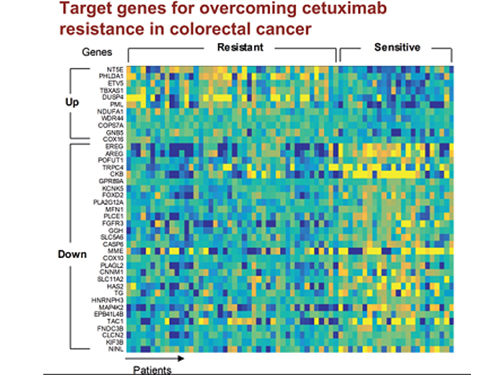 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07
조회수 24693
-
 김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01
조회수 23652
-
 석현정, 최경아 교수 청백색 조명이 아침잠 깨워주는 효과 입증
〈 왼쪽부터 정현정 교수, 석현정 교수, 김태수 박사과정, 최경아 연구교수 〉
출근과 등교. 이 두 단어는 대부분의 직장인과 학생에게 유쾌하지 않다. 회식, 인터넷 강의, 스마트폰, 육아 등으로 인해 부족해진 아침잠은 쉽사리 사라지지 않는다. 하지만 우리가 매일 접하는 빛을 통해 오전의 나른함을 깨우고 생체리듬을 유지할 수 있다는 연구 결과가 발표됐다.
우리 대학 산업디자인학과 석현정 교수, 최경아 연구교수가 높은 색의 온도를 갖는 청백색(blue-enriched white)의 푸른 빛이 아침잠을 깨우는 데 효과적임을 밝혀냈다.
이 연구는 인간 중심의 조명이 나아가야 할 방향을 제시한 것으로, 인공적인 조명 시스템을 변화하는 데 긍정적인 영향을 끼칠 것으로 기대된다.
특히 이번 연구는 산업디자인학과 소속 교수와 연구원이 교신저자 및 1 저자로 참여해 순수과학 분야 저널에 논문을 게재했다. 이는 세계적으로도 찾기 힘든 사례로 디자인학과 자연과학의 우수 융합 연구의 표본이 될 것으로 예상된다.
최경아 연구교수가 1 저자, 나노과학기술대학원 정현정 교수가 참여한 이번 연구는 국제 학술지 ‘사이언티픽 리포트(Scientific Reports)’ 1월 23일 자에 게재됐다. (논문명 : Awakening effects of blue-enriched morning light exposure on university students’ physiological and subjective responses)
2017년도 노벨 생리의학상은 태양의 주기에 따라 아침, 저녁으로 몸의 변화가 규칙적으로 일어나는 서카디안(circadian) 리듬, 즉 생체리듬을 조절하는 유전자를 규명한 미국의 과학자 제프리 홀 메인대(University Of Maine) 교수, 마이클 로스바시 브랜다이스대(Brandeis University) 교수, 마이클 영 록펠러대(Rockefeller University) 교수에게 돌아갔다.
이처럼 수면과 각성 등 인간의 생체리듬 관련 연구는 끊임없이 이뤄지고 있다. 빛이 생리적 작용에 관여한다는 사실은 2000년대 초반 인간의 망막에서 제3의 광수용세포가 발견된 이후 꾸준히 연구되고 있다.
제3의 광수용세포는 기존의 간상세포나 원추세포와는 달리 비 시각적인 것에 반응하고 뇌에 전달되는 경로도 다르다. 특히 이 세포는 빛의 파란색 영역에 가장 민감해 이를 통해 각성 등 여러 생리적 현상이 발생할 뿐 아니라 뇌파, 멜라토닌 분비, 심전도 등에도 영향을 미친다는 사실이 밝혀졌다.
그러나 관련 기존 연구는 푸른 빛의 강한 레이저를 직접 조사하는 한정적인 조건에서 실험이 이뤄지기 때문에 결과를 일상에 접목하기가 어려웠다. 또한 기존 연구 대부분은 푸른 빛을 저녁이나 늦은 오후에 접하면 멜라토닌 분비가 억제돼 숙면을 방해한다는 사실을 규명하는 데에만 주력했다.
연구팀은 푸른 빛이 저녁에는 숙면에 방해될 수 있지만, 때와 장소에 따라서는 이로운 빛으로 활용할 수 있음을 증명하기 위해 노력했다. 오전에 쬐는 청백색의 빛은 인체를 잠에서 깨워 생체리듬을 조절하는 데 긍정적인 영향을 미친다는 사실을 밝혀냈다.
연구팀은 우리 대학 학생 15명을 대상으로 실험을 진행했고 호르몬과 타액 변화 등의 생리적 지표와 설문조사를 통한 주관적 지표를 동시에 관찰했다. 이 결과 빛의 색 변화에 따라 감성 등을 나타낸 주관적 지표와 멜라토닌 분비에 변화가 일어남을 확인했다.
최경아 연구교수는 박사과정 시절 학습 환경의 조명이 학생들의 학습 활동에 미치는 영향을 밝힌 바 있다. (논문명: Dynamic lighting system for the learning environment: performance of elementary students). 이번 연구를 통해 조명의 빛깔이 사람에게 미치는 영향을 하루 주기와 접목해 더욱 심화된 결과를 얻은 것이다.
석현정 교수는 “처음에는 단순히 조명을 다양하게 바꿔가며 구성원들을 편하게 쉬게 해주려는 의도에서 시작해, 호텔이나 레스토랑, 모닥불 등의 조명에서는 편안해지고 흰색 조명에서는 긴장감이 발생하는 이유를 명쾌하게 밝히고자 했다”라며 “과학적 근거와 고도화를 통해 신뢰성이 있는 데이터를 수집했고 많은 사람이 혜택을 볼 수 있는 결과를 얻었다고 생각한다”라고 말했다.
최경아 연구교수는 “이와 같은 조명 시스템의 진화가 실내 건축물뿐 아니라 자동차 내부와 지하주차장 세탁기, 냉장고 등 각종 전자기기에도 적용될 수 있다”고 밝혔다. 또한 스마트 조명 시스템을 달력, 출장 앱과 연동한다면 자동 학습을 통해 인간의 생체리듬과 권장 수면시간 및 기상 시간에 맞춰 조명의 색과 세기를 조절할 수도 있을 것으로 전망했다.
석현정 교수는 “학문마다 중요시하는 관점이 달라 디자인학자로서 자연과학의 기준을 통과하기가 쉽지 않았다. 꼼꼼히 설계하고 유의미한 데이터를 축적하는 데 큰 노력을 기울여 좋은 결과가 나온 것 같다”라며 “인간 중심의 조명이 우리 일상생활에 성공적으로 적용될 기회는 무궁무진하다”라고 말했다.
최경아 연구교수는 “빛을 단순히 공간을 밝히는 용도를 넘어 사용자의 경험을 한층 더 풍요롭게 하는 중요한 도구로 인식하는 데서 시작된 연구이다”라며 “학문 간 경계를 허물고 우리 연구를 읽어주는 독자의 스펙트럼이 확대된다는 데 의의가 있다고 생각한다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 낮과 밤의 멜라토닌 분비량의 변화 그래프
석현정, 최경아 교수 청백색 조명이 아침잠 깨워주는 효과 입증
〈 왼쪽부터 정현정 교수, 석현정 교수, 김태수 박사과정, 최경아 연구교수 〉
출근과 등교. 이 두 단어는 대부분의 직장인과 학생에게 유쾌하지 않다. 회식, 인터넷 강의, 스마트폰, 육아 등으로 인해 부족해진 아침잠은 쉽사리 사라지지 않는다. 하지만 우리가 매일 접하는 빛을 통해 오전의 나른함을 깨우고 생체리듬을 유지할 수 있다는 연구 결과가 발표됐다.
우리 대학 산업디자인학과 석현정 교수, 최경아 연구교수가 높은 색의 온도를 갖는 청백색(blue-enriched white)의 푸른 빛이 아침잠을 깨우는 데 효과적임을 밝혀냈다.
이 연구는 인간 중심의 조명이 나아가야 할 방향을 제시한 것으로, 인공적인 조명 시스템을 변화하는 데 긍정적인 영향을 끼칠 것으로 기대된다.
특히 이번 연구는 산업디자인학과 소속 교수와 연구원이 교신저자 및 1 저자로 참여해 순수과학 분야 저널에 논문을 게재했다. 이는 세계적으로도 찾기 힘든 사례로 디자인학과 자연과학의 우수 융합 연구의 표본이 될 것으로 예상된다.
최경아 연구교수가 1 저자, 나노과학기술대학원 정현정 교수가 참여한 이번 연구는 국제 학술지 ‘사이언티픽 리포트(Scientific Reports)’ 1월 23일 자에 게재됐다. (논문명 : Awakening effects of blue-enriched morning light exposure on university students’ physiological and subjective responses)
2017년도 노벨 생리의학상은 태양의 주기에 따라 아침, 저녁으로 몸의 변화가 규칙적으로 일어나는 서카디안(circadian) 리듬, 즉 생체리듬을 조절하는 유전자를 규명한 미국의 과학자 제프리 홀 메인대(University Of Maine) 교수, 마이클 로스바시 브랜다이스대(Brandeis University) 교수, 마이클 영 록펠러대(Rockefeller University) 교수에게 돌아갔다.
이처럼 수면과 각성 등 인간의 생체리듬 관련 연구는 끊임없이 이뤄지고 있다. 빛이 생리적 작용에 관여한다는 사실은 2000년대 초반 인간의 망막에서 제3의 광수용세포가 발견된 이후 꾸준히 연구되고 있다.
제3의 광수용세포는 기존의 간상세포나 원추세포와는 달리 비 시각적인 것에 반응하고 뇌에 전달되는 경로도 다르다. 특히 이 세포는 빛의 파란색 영역에 가장 민감해 이를 통해 각성 등 여러 생리적 현상이 발생할 뿐 아니라 뇌파, 멜라토닌 분비, 심전도 등에도 영향을 미친다는 사실이 밝혀졌다.
그러나 관련 기존 연구는 푸른 빛의 강한 레이저를 직접 조사하는 한정적인 조건에서 실험이 이뤄지기 때문에 결과를 일상에 접목하기가 어려웠다. 또한 기존 연구 대부분은 푸른 빛을 저녁이나 늦은 오후에 접하면 멜라토닌 분비가 억제돼 숙면을 방해한다는 사실을 규명하는 데에만 주력했다.
연구팀은 푸른 빛이 저녁에는 숙면에 방해될 수 있지만, 때와 장소에 따라서는 이로운 빛으로 활용할 수 있음을 증명하기 위해 노력했다. 오전에 쬐는 청백색의 빛은 인체를 잠에서 깨워 생체리듬을 조절하는 데 긍정적인 영향을 미친다는 사실을 밝혀냈다.
연구팀은 우리 대학 학생 15명을 대상으로 실험을 진행했고 호르몬과 타액 변화 등의 생리적 지표와 설문조사를 통한 주관적 지표를 동시에 관찰했다. 이 결과 빛의 색 변화에 따라 감성 등을 나타낸 주관적 지표와 멜라토닌 분비에 변화가 일어남을 확인했다.
최경아 연구교수는 박사과정 시절 학습 환경의 조명이 학생들의 학습 활동에 미치는 영향을 밝힌 바 있다. (논문명: Dynamic lighting system for the learning environment: performance of elementary students). 이번 연구를 통해 조명의 빛깔이 사람에게 미치는 영향을 하루 주기와 접목해 더욱 심화된 결과를 얻은 것이다.
석현정 교수는 “처음에는 단순히 조명을 다양하게 바꿔가며 구성원들을 편하게 쉬게 해주려는 의도에서 시작해, 호텔이나 레스토랑, 모닥불 등의 조명에서는 편안해지고 흰색 조명에서는 긴장감이 발생하는 이유를 명쾌하게 밝히고자 했다”라며 “과학적 근거와 고도화를 통해 신뢰성이 있는 데이터를 수집했고 많은 사람이 혜택을 볼 수 있는 결과를 얻었다고 생각한다”라고 말했다.
최경아 연구교수는 “이와 같은 조명 시스템의 진화가 실내 건축물뿐 아니라 자동차 내부와 지하주차장 세탁기, 냉장고 등 각종 전자기기에도 적용될 수 있다”고 밝혔다. 또한 스마트 조명 시스템을 달력, 출장 앱과 연동한다면 자동 학습을 통해 인간의 생체리듬과 권장 수면시간 및 기상 시간에 맞춰 조명의 색과 세기를 조절할 수도 있을 것으로 전망했다.
석현정 교수는 “학문마다 중요시하는 관점이 달라 디자인학자로서 자연과학의 기준을 통과하기가 쉽지 않았다. 꼼꼼히 설계하고 유의미한 데이터를 축적하는 데 큰 노력을 기울여 좋은 결과가 나온 것 같다”라며 “인간 중심의 조명이 우리 일상생활에 성공적으로 적용될 기회는 무궁무진하다”라고 말했다.
최경아 연구교수는 “빛을 단순히 공간을 밝히는 용도를 넘어 사용자의 경험을 한층 더 풍요롭게 하는 중요한 도구로 인식하는 데서 시작된 연구이다”라며 “학문 간 경계를 허물고 우리 연구를 읽어주는 독자의 스펙트럼이 확대된다는 데 의의가 있다고 생각한다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 낮과 밤의 멜라토닌 분비량의 변화 그래프
2019.02.28
조회수 19965
-
 장석복 교수, 한 종류의 분자만 선택적으로 합성할 수 있는 새 촉매 개발
〈 박윤수 연구원, 장석복 교수 〉
자연계의 많은 분자들은 자신과 똑 닮은 ‘쌍둥이 분자’를 갖고 있다. 이들은 구성하는 원소의 종류와 개수가 같아도 서로 완전히 다른 성질을 나타낸다. 특히 쌍둥이 분자가 서로를 거울에 비친 모습과 같은 형상을 띈 경우를 ‘거울상 이성질체’라고 한다.
우리 대학 화학과 장석복 교수(IBS 분자활성 촉매반응 연구단장)와 IBS 박윤수 연구원은 두 개의 거울상 이성질체 중 한 종류의 분자만을 선택적으로 합성할 수 있는 새로운 촉매를 개발했다. 또 이 촉매를 이용해 자연에 풍부한 탄화수소화합물을 의약품의 필수재료인 카이랄 락탐으로 제조하는 데도 성공했다.
거울상 이성질체는 왼손과 오른손처럼 서로를 거울에 비춰보면 같은 모양이지만, 아무리 회전시켜도 겹칠 수 없는 이성질체를 말한다. 거울상 이성질성 또는 카이랄성(Chirality)이라고 불리는 이 특성은 의약품 개발에도 매우 중요하다. DNA, 단백질 등 생체물질 역시 카이랄성을 지녀 개발된 약물의 유형에 따라 각각 다른 생리활성을 나타내기 때문이다. 또 한 쪽 유형이 유용할지라도, 다른 유형의 이성질체는 독약이 될 수도 있다. 하지만 유용한 이성질체만을 선택적으로 합성하는 비대칭반응(asymmetric synthesis)은 아직까지 현대 화학의 난제로 꼽히고 있다.
연구진은 새로운 촉매 개발로 이 난제를 해결했다. 연구팀은 2018년 3월 국제학술지 ‘사이언스(Science)’에 자연계에 풍부한 탄화수소를 고부가가치의 감마-락탐 화합물로 전환시키는 이리듐 촉매 개발 성과를 발표한 바 있다. 하지만 당시 개발된 촉매 역시 두 가지 형태의 거울상 이성질체가 선택성 없이 모두 얻어진다는 단점이 있었다.
이번 연구에서 연구진은 수십여 개의 후보 촉매 중 카이랄 다이아민(Chiral Diamine) 골격을 포함한 이리듐 촉매가 99% 이상의 정확도로 거울상을 선택할 수 있음을 발견했다. 개발된 촉매는 필요에 따라 카이랄성 감마-락탐을 골라서 합성할 수 있다. 왼손잡이성 이리듐 촉매를 사용할 경우엔 왼손잡이성 감마-락탐이, 오른잡이성 이리듐 촉매를 사용하면 오른손잡이성 감마-락탐을 제조할 수 있다.
이후 연구진은 계산화학 시뮬레이션 연구를 통해 높은 선택성의 원인을 분석했다. 가령, 왼손잡이성 촉매를 사용한 경우에는 락탐의 합성과정에서 카이랄 다이아민 촉매와 탄화수소화합물 사이에는 일시적인 수소 결합이 발생하고, 이로 인해 왼손잡이성 락탐 형성이 촉진된다는 사실을 확인했다.
연구진은 개발한 촉매를 통해 다양한 구조를 갖는 카이랄 락탐 화합물을 합성하는 데도 성공했다. 이렇게 합성된 카이랄 락탐은 독특한 입체적 특성 때문에 생체 단백질과의 상호작용이 유용하다. 특히 우리 신체를 구성하는 아미노산 유도체나, 천연물도 모두 카이랄성 분자인 만큼, 신체 내 생리활성을 효과적으로 높인 약물 개발이 가능할 것으로 기대된다.
이번 연구를 이끈 장석복 단장은 “약효를 갖는 의약품의 핵심 단위만 선택적으로 제조할 수 있는 기술로 향후 유기합성 및 의약분야 연구로 이어져 부작용을 덜고 효과는 높인 신약개발까지 이어지리라 기대한다”며 “자연계에 풍부한 탄화수소화합물을 재료로 고부가가치 원료를 제조할 수 있다는 경제적 효과도 있다”고 말했다.
연구성과는 화학분야 권위지인 네이처 카탈리시스(Nature Catalysis) 2월 19일자(한국시간) 온라인 판에 실렸다.
□ 그림 설명
그림1. 비대칭반응을 통한 카이랄성 감마-락탐 합성
그림2. 연구 성과 개요
장석복 교수, 한 종류의 분자만 선택적으로 합성할 수 있는 새 촉매 개발
〈 박윤수 연구원, 장석복 교수 〉
자연계의 많은 분자들은 자신과 똑 닮은 ‘쌍둥이 분자’를 갖고 있다. 이들은 구성하는 원소의 종류와 개수가 같아도 서로 완전히 다른 성질을 나타낸다. 특히 쌍둥이 분자가 서로를 거울에 비친 모습과 같은 형상을 띈 경우를 ‘거울상 이성질체’라고 한다.
우리 대학 화학과 장석복 교수(IBS 분자활성 촉매반응 연구단장)와 IBS 박윤수 연구원은 두 개의 거울상 이성질체 중 한 종류의 분자만을 선택적으로 합성할 수 있는 새로운 촉매를 개발했다. 또 이 촉매를 이용해 자연에 풍부한 탄화수소화합물을 의약품의 필수재료인 카이랄 락탐으로 제조하는 데도 성공했다.
거울상 이성질체는 왼손과 오른손처럼 서로를 거울에 비춰보면 같은 모양이지만, 아무리 회전시켜도 겹칠 수 없는 이성질체를 말한다. 거울상 이성질성 또는 카이랄성(Chirality)이라고 불리는 이 특성은 의약품 개발에도 매우 중요하다. DNA, 단백질 등 생체물질 역시 카이랄성을 지녀 개발된 약물의 유형에 따라 각각 다른 생리활성을 나타내기 때문이다. 또 한 쪽 유형이 유용할지라도, 다른 유형의 이성질체는 독약이 될 수도 있다. 하지만 유용한 이성질체만을 선택적으로 합성하는 비대칭반응(asymmetric synthesis)은 아직까지 현대 화학의 난제로 꼽히고 있다.
연구진은 새로운 촉매 개발로 이 난제를 해결했다. 연구팀은 2018년 3월 국제학술지 ‘사이언스(Science)’에 자연계에 풍부한 탄화수소를 고부가가치의 감마-락탐 화합물로 전환시키는 이리듐 촉매 개발 성과를 발표한 바 있다. 하지만 당시 개발된 촉매 역시 두 가지 형태의 거울상 이성질체가 선택성 없이 모두 얻어진다는 단점이 있었다.
이번 연구에서 연구진은 수십여 개의 후보 촉매 중 카이랄 다이아민(Chiral Diamine) 골격을 포함한 이리듐 촉매가 99% 이상의 정확도로 거울상을 선택할 수 있음을 발견했다. 개발된 촉매는 필요에 따라 카이랄성 감마-락탐을 골라서 합성할 수 있다. 왼손잡이성 이리듐 촉매를 사용할 경우엔 왼손잡이성 감마-락탐이, 오른잡이성 이리듐 촉매를 사용하면 오른손잡이성 감마-락탐을 제조할 수 있다.
이후 연구진은 계산화학 시뮬레이션 연구를 통해 높은 선택성의 원인을 분석했다. 가령, 왼손잡이성 촉매를 사용한 경우에는 락탐의 합성과정에서 카이랄 다이아민 촉매와 탄화수소화합물 사이에는 일시적인 수소 결합이 발생하고, 이로 인해 왼손잡이성 락탐 형성이 촉진된다는 사실을 확인했다.
연구진은 개발한 촉매를 통해 다양한 구조를 갖는 카이랄 락탐 화합물을 합성하는 데도 성공했다. 이렇게 합성된 카이랄 락탐은 독특한 입체적 특성 때문에 생체 단백질과의 상호작용이 유용하다. 특히 우리 신체를 구성하는 아미노산 유도체나, 천연물도 모두 카이랄성 분자인 만큼, 신체 내 생리활성을 효과적으로 높인 약물 개발이 가능할 것으로 기대된다.
이번 연구를 이끈 장석복 단장은 “약효를 갖는 의약품의 핵심 단위만 선택적으로 제조할 수 있는 기술로 향후 유기합성 및 의약분야 연구로 이어져 부작용을 덜고 효과는 높인 신약개발까지 이어지리라 기대한다”며 “자연계에 풍부한 탄화수소화합물을 재료로 고부가가치 원료를 제조할 수 있다는 경제적 효과도 있다”고 말했다.
연구성과는 화학분야 권위지인 네이처 카탈리시스(Nature Catalysis) 2월 19일자(한국시간) 온라인 판에 실렸다.
□ 그림 설명
그림1. 비대칭반응을 통한 카이랄성 감마-락탐 합성
그림2. 연구 성과 개요
2019.02.19
조회수 15781
-
 유승협 교수, 초저전력 심박 및 산소포화도 센서 구현
〈 유승협 교수, 이현우 박사과정〉
우리 대학 전기및전자공학부 유승협 교수 연구팀이 유기발광다이오드(OLED)와 유기포토다이오드(OPD)를 이용해 초저전력 심박 및 산소포화도 센서 구현에 성공했다.
전기및전자공학부 유회준 교수 연구팀과의 협력을 통해 이뤄진 것으로 이 기술을 통해 심박 및 산소포화도 센서가 다양한 웨어러블 기기에 적용될 수 있는 계기가 될 것으로 기대된다.
이현우 박사과정이 1저자로 참여한 이번 연구는 ‘사이언스 어드밴스 (Science Advances)’11월 9일자 온라인 판에 게재됐다. (논문명 : Toward all-day wearable health monitoring: An ultralow-power, reflective organic pulse oximetry sensing patch)
심박 및 산소포화도 센서는 신체의 건강 상태를 나타내는 가장 중요한 생체 신호의 하나인 심장 박동과 혈액 내 산소와 결합한 헤모글로빈의 농도로서 신체 내 원활한 산소 공급 여부를 가늠할 수 있는 산소포화도를 측정하는 기기이다.
심박 및 산소포화도 센서에는 일반적으로 LED와 포토다이오드로 구성된 광학적 방법이 이용된다. 이 기술은 간단하고 소형화가 용이한 비 침습적 방법이면서 주요 생체신호의 모니터링이 가능하다는 이점이 있어 병원용 기기뿐 아니라 스마트 워치 등 웨어러블 기기에도 탑재되는 경우가 많다.
이러한 센서는 배터리 용량이 매우 제한적인 웨어러블 기기의 특성상 센서의 전력소모를 줄이는 것이 매우 중요하다.
그러나 현재 상용 심박 및 산소포화도 센서는 이산소자들의 배열로 구성돼 피부에서 산란으로 인해 전방위로 전달되는 빛을 효율적으로 감지하기 어렵다. 이러한 이유로 좀 더 강한 빛을 필요로 하기 때문에 장기간 실시간 모니터링에는 한계가 있다.
연구팀은 문제 해결을 위해 광원의 발광 파장에 따른 피부에서의 빛의 전달 형태를 실험과 피부 모델 시뮬레이션을 통해 검토했다. 유기소자의 경우 자유로운 패턴 구현이 용이한 점을 최대한 이용해 유기포토다이오드가 유기발광다이오드를 동심원 형태로 감싸 피부에서 전방위로 분포되는 빛을 효율적으로 감지하는 최적 구조를 갖는 유연 심박 및 산소포화도 센서를 구현했다.
이를 통해 평균소비전력 약 0.03밀리와트(mW)만으로도 심박 및 산소포화도를 측정할 수 있었다. 이는 LED와 PD가 일렬로 배치된 상용 센서가 갖는 통상 전력소모 양의 약 수십 분의 일에 해당하는 매우 작은 값으로 24시간 동작에도 1밀리와트시(mWh)가 채 되지 않는 양이다.
이 기술은 매우 낮은 전력 소모 외에도 유기소자가 갖는 유연 소자의 형태적 자유도도 그대로 갖는다. 따라서 스마트 워치부터 작게는 무선 이어폰, 스마트 반지, 인체 부착형 패치 등의 웨어러블 기기에서 배터리로 인한 제한을 최소화하면서 일상에 지장 없이 지속적인 생체 신호 모니터링을 가능하게 할 것으로 기대된다.
유승협 교수는 “생체 신호의 지속적인 모니터링은 건강의 이상 신호를 상시 검출 할 수 있게 할 뿐 아니라 향후 빅데이터 등과 연계하면 이들 생체신호의 특정 패턴과 질병 간의 상호 관계를 알아내는 등에도 활용될 수 있다.”고 말했다.
이번 연구는 과학기술정보통신부 한국연구재단-나노·소재원천기술개발사업 및 선도연구센터 사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 연구팀이 개발한 센서
유승협 교수, 초저전력 심박 및 산소포화도 센서 구현
〈 유승협 교수, 이현우 박사과정〉
우리 대학 전기및전자공학부 유승협 교수 연구팀이 유기발광다이오드(OLED)와 유기포토다이오드(OPD)를 이용해 초저전력 심박 및 산소포화도 센서 구현에 성공했다.
전기및전자공학부 유회준 교수 연구팀과의 협력을 통해 이뤄진 것으로 이 기술을 통해 심박 및 산소포화도 센서가 다양한 웨어러블 기기에 적용될 수 있는 계기가 될 것으로 기대된다.
이현우 박사과정이 1저자로 참여한 이번 연구는 ‘사이언스 어드밴스 (Science Advances)’11월 9일자 온라인 판에 게재됐다. (논문명 : Toward all-day wearable health monitoring: An ultralow-power, reflective organic pulse oximetry sensing patch)
심박 및 산소포화도 센서는 신체의 건강 상태를 나타내는 가장 중요한 생체 신호의 하나인 심장 박동과 혈액 내 산소와 결합한 헤모글로빈의 농도로서 신체 내 원활한 산소 공급 여부를 가늠할 수 있는 산소포화도를 측정하는 기기이다.
심박 및 산소포화도 센서에는 일반적으로 LED와 포토다이오드로 구성된 광학적 방법이 이용된다. 이 기술은 간단하고 소형화가 용이한 비 침습적 방법이면서 주요 생체신호의 모니터링이 가능하다는 이점이 있어 병원용 기기뿐 아니라 스마트 워치 등 웨어러블 기기에도 탑재되는 경우가 많다.
이러한 센서는 배터리 용량이 매우 제한적인 웨어러블 기기의 특성상 센서의 전력소모를 줄이는 것이 매우 중요하다.
그러나 현재 상용 심박 및 산소포화도 센서는 이산소자들의 배열로 구성돼 피부에서 산란으로 인해 전방위로 전달되는 빛을 효율적으로 감지하기 어렵다. 이러한 이유로 좀 더 강한 빛을 필요로 하기 때문에 장기간 실시간 모니터링에는 한계가 있다.
연구팀은 문제 해결을 위해 광원의 발광 파장에 따른 피부에서의 빛의 전달 형태를 실험과 피부 모델 시뮬레이션을 통해 검토했다. 유기소자의 경우 자유로운 패턴 구현이 용이한 점을 최대한 이용해 유기포토다이오드가 유기발광다이오드를 동심원 형태로 감싸 피부에서 전방위로 분포되는 빛을 효율적으로 감지하는 최적 구조를 갖는 유연 심박 및 산소포화도 센서를 구현했다.
이를 통해 평균소비전력 약 0.03밀리와트(mW)만으로도 심박 및 산소포화도를 측정할 수 있었다. 이는 LED와 PD가 일렬로 배치된 상용 센서가 갖는 통상 전력소모 양의 약 수십 분의 일에 해당하는 매우 작은 값으로 24시간 동작에도 1밀리와트시(mWh)가 채 되지 않는 양이다.
이 기술은 매우 낮은 전력 소모 외에도 유기소자가 갖는 유연 소자의 형태적 자유도도 그대로 갖는다. 따라서 스마트 워치부터 작게는 무선 이어폰, 스마트 반지, 인체 부착형 패치 등의 웨어러블 기기에서 배터리로 인한 제한을 최소화하면서 일상에 지장 없이 지속적인 생체 신호 모니터링을 가능하게 할 것으로 기대된다.
유승협 교수는 “생체 신호의 지속적인 모니터링은 건강의 이상 신호를 상시 검출 할 수 있게 할 뿐 아니라 향후 빅데이터 등과 연계하면 이들 생체신호의 특정 패턴과 질병 간의 상호 관계를 알아내는 등에도 활용될 수 있다.”고 말했다.
이번 연구는 과학기술정보통신부 한국연구재단-나노·소재원천기술개발사업 및 선도연구센터 사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 연구팀이 개발한 센서
2018.11.12
조회수 15619
-
 김신현 교수, 달걀 속 살충제 성분, 현장 즉시 검출 기술 개발
〈 김신현 교수, 김동재 박사과정 〉
우리 대학 생명화학공학과 김신현 교수 연구팀과 재료연구소(소장 이정환) 김동호 박사 공동 연구팀이 생체 시료에 들어있는 미량의 분자를 직접 검출할 수 있는 센서를 개발했다.
연구팀은 개발한 센서를 통해 다양한 종류의 살충제 성분을 검출하는데 성공했다. 특히 국내 및 유럽에서 문제가 됐던 달걀 속 살충제 성분인 피프로닐 술폰(Fipronil sulfone)을 시료 전처리 없이 검출할 수 있음을 증명했다.
연구팀의 센서는 전하를 띠는 하이드로젤 미세입자 내부에 금 나노입자 응집체를 캡슐화한 형태로 생체 시료 내에 존재하는 분자를 직접 분석해야 하는 광범위한 분야에 적용 가능할 것으로 기대된다.
김동재 박사과정이 1저자로 참여한 이번 연구는 나노분야의 국제 학술지 ‘스몰(Small)’ 10월 4일자 내부표지 논문으로 게재됐다.(논문명 : SERS-Active Charged Microgels for Size- and Charge-Selective Molecular Analysis of Complex Biological Samples, 생체 시료의 분자 크기 및 전하 선택적 분석을 위한 표면증강라만산란용 마이크로젤)
분자가 레이저에 노출되면 ‘분자 지문’이라고 불리는 고유의 라만(Raman) 신호를 보인다. 하지만 일반적으로 라만 신호의 세기는 매우 낮아 실질적인 분자 감지에 사용이 어렵다.
연구팀은 금속 나노구조의 표면에서 발생하는 표면 플라즈몬 공명 현상이 강한 세기의 기장을 형성하는 점을 이용해 라만신호를 현저히 증가시켰다. 이를 표면증강라만산란 현상이라고 한다.
이 표면증강라만산란 현상에 의해 금속 나노구조 표면에 존재하는 분자의 라만신호는 크게 증가시킬 수 있지만 이를 일반적인 생체 시료에 직접 적용하는 것은 어렵다. 생체 시료에 존재하는 다양한 크기의 단백질들이 금속 표면에 비가역적으로 흡착해 실제 분석이 필요한 분자의 접근을 막기 때문이다.
일반적으로 사용되는 생체 시료 분석법은 대형 장비를 이용한 시료 전처리 과정이 필수이다. 하지만 이로 인해 시료의 신속한 현장 분석이 어려워 시간과 비용을 증가시킨다.
연구팀은 시료의 정제 과정 없이 분자를 직접 검출하기 위해 하이드로젤에 주목했다. 하이드로젤은 친수성(親水性) 나노 그물 구조를 이루고 있어 단백질처럼 크기가 큰 분자는 배제하고 작은 크기의 분자만을 내부로 확산시킨다. 또한 하이드로젤이 전하를 띠는 경우 반대 전하를 띠고 있는 분자를 선택적으로 흡착시켜 농축할 수 있다.
연구팀은 이러한 원리를 센서 구현에 적용시키기 위해 미세유체기술을 이용했다. 이를 통해 금 나노입자 응집체를 형성하는 동시에 전하를 띠는 하이드로젤 미세입자 안에 캡슐화 하는데 성공했다.
하이드로젤 미세 입자는 생체 시료에 도입돼 단백질로부터 금 나노입자 응집체를 보호하고, 동시에 반대 전하를 띠는 표적 분자를 응집체 표면에 선택적으로 농축시킨다. 이를 통해 표적 분자의 라만 신호는 단백질의 방해 없이 증대되며 시료의 전처리 과정 없이 빠르고 정확한 분자 검출이 가능해진다.
김신현 교수는 “새롭게 개발한 라만 센서는 식품 내 살충제 성분 검출 뿐 아니라 혈액과 소변, 땀 등 인체 속 시료에 들어있는 약물, 마약 성분 등 다양한 바이오마커의 직접 검출에도 사용 가능하다”고 말했다.
재료연구소 김동호 박사는 “시료 전처리가 필요없기 때문에 현장에서 시료의 직접 분석이 가능해 시간과 비용의 혁신적 절감이 가능해질 것이다”고 말했다.
이번 연구결과는 재료연구소의 기관 주요사업과 한국연구재단의 중견연구자지원사업 및 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. small 저널 내부표지
그림2. 시료 전처리 없이 분자 선택적 라만 분석이 가능한 하이드로젤 기반 라만 센서의 원리
그림3. 분자 전하 선택적 농축 및 배제를 보여주는 현미경 사진
김신현 교수, 달걀 속 살충제 성분, 현장 즉시 검출 기술 개발
〈 김신현 교수, 김동재 박사과정 〉
우리 대학 생명화학공학과 김신현 교수 연구팀과 재료연구소(소장 이정환) 김동호 박사 공동 연구팀이 생체 시료에 들어있는 미량의 분자를 직접 검출할 수 있는 센서를 개발했다.
연구팀은 개발한 센서를 통해 다양한 종류의 살충제 성분을 검출하는데 성공했다. 특히 국내 및 유럽에서 문제가 됐던 달걀 속 살충제 성분인 피프로닐 술폰(Fipronil sulfone)을 시료 전처리 없이 검출할 수 있음을 증명했다.
연구팀의 센서는 전하를 띠는 하이드로젤 미세입자 내부에 금 나노입자 응집체를 캡슐화한 형태로 생체 시료 내에 존재하는 분자를 직접 분석해야 하는 광범위한 분야에 적용 가능할 것으로 기대된다.
김동재 박사과정이 1저자로 참여한 이번 연구는 나노분야의 국제 학술지 ‘스몰(Small)’ 10월 4일자 내부표지 논문으로 게재됐다.(논문명 : SERS-Active Charged Microgels for Size- and Charge-Selective Molecular Analysis of Complex Biological Samples, 생체 시료의 분자 크기 및 전하 선택적 분석을 위한 표면증강라만산란용 마이크로젤)
분자가 레이저에 노출되면 ‘분자 지문’이라고 불리는 고유의 라만(Raman) 신호를 보인다. 하지만 일반적으로 라만 신호의 세기는 매우 낮아 실질적인 분자 감지에 사용이 어렵다.
연구팀은 금속 나노구조의 표면에서 발생하는 표면 플라즈몬 공명 현상이 강한 세기의 기장을 형성하는 점을 이용해 라만신호를 현저히 증가시켰다. 이를 표면증강라만산란 현상이라고 한다.
이 표면증강라만산란 현상에 의해 금속 나노구조 표면에 존재하는 분자의 라만신호는 크게 증가시킬 수 있지만 이를 일반적인 생체 시료에 직접 적용하는 것은 어렵다. 생체 시료에 존재하는 다양한 크기의 단백질들이 금속 표면에 비가역적으로 흡착해 실제 분석이 필요한 분자의 접근을 막기 때문이다.
일반적으로 사용되는 생체 시료 분석법은 대형 장비를 이용한 시료 전처리 과정이 필수이다. 하지만 이로 인해 시료의 신속한 현장 분석이 어려워 시간과 비용을 증가시킨다.
연구팀은 시료의 정제 과정 없이 분자를 직접 검출하기 위해 하이드로젤에 주목했다. 하이드로젤은 친수성(親水性) 나노 그물 구조를 이루고 있어 단백질처럼 크기가 큰 분자는 배제하고 작은 크기의 분자만을 내부로 확산시킨다. 또한 하이드로젤이 전하를 띠는 경우 반대 전하를 띠고 있는 분자를 선택적으로 흡착시켜 농축할 수 있다.
연구팀은 이러한 원리를 센서 구현에 적용시키기 위해 미세유체기술을 이용했다. 이를 통해 금 나노입자 응집체를 형성하는 동시에 전하를 띠는 하이드로젤 미세입자 안에 캡슐화 하는데 성공했다.
하이드로젤 미세 입자는 생체 시료에 도입돼 단백질로부터 금 나노입자 응집체를 보호하고, 동시에 반대 전하를 띠는 표적 분자를 응집체 표면에 선택적으로 농축시킨다. 이를 통해 표적 분자의 라만 신호는 단백질의 방해 없이 증대되며 시료의 전처리 과정 없이 빠르고 정확한 분자 검출이 가능해진다.
김신현 교수는 “새롭게 개발한 라만 센서는 식품 내 살충제 성분 검출 뿐 아니라 혈액과 소변, 땀 등 인체 속 시료에 들어있는 약물, 마약 성분 등 다양한 바이오마커의 직접 검출에도 사용 가능하다”고 말했다.
재료연구소 김동호 박사는 “시료 전처리가 필요없기 때문에 현장에서 시료의 직접 분석이 가능해 시간과 비용의 혁신적 절감이 가능해질 것이다”고 말했다.
이번 연구결과는 재료연구소의 기관 주요사업과 한국연구재단의 중견연구자지원사업 및 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. small 저널 내부표지
그림2. 시료 전처리 없이 분자 선택적 라만 분석이 가능한 하이드로젤 기반 라만 센서의 원리
그림3. 분자 전하 선택적 농축 및 배제를 보여주는 현미경 사진
2018.10.18
조회수 15238
-
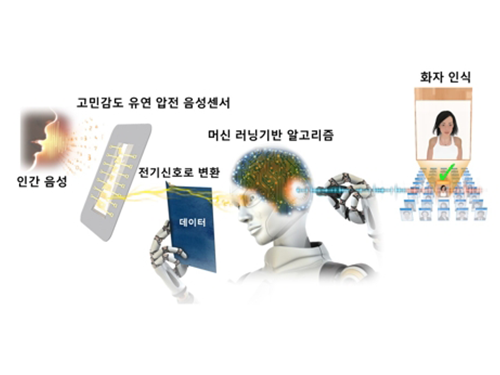 이건재 교수, 유창동 교수, 유연 압전 화자인식 음성센서 개발
〈 이 건 재 교수 〉
우리 대학 신소재공학과 이건재 교수와 전기및전자공학부 유창동 교수 공동 연구팀이 인공지능 기반의 화자(話者) 인식용 유연 압전 음성센서를 개발했다.
이번 연구를 통해 개인별 음성 서비스를 스마트 홈 가전이나 인공지능 비서, 생체 인증 분야 등 차세대 기술에 활용 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘나노 에너지(Nano Energy)’ 9월호에 ‘민감도’와 ‘화자인식’ 논문 두 편으로 동시 게재됐고 현재 관련 기술은 실용화 단계에 있다. (민감도 논문 : Basilar Membrane-Inspired Self-Powered Acoustic Sensor Enabled by Highly Sensitive Multi Tunable Frequency Band, 화자인식 논문 : Machine Learning-based Self-powered Acoustic Sensor for Speaker Recognition)
음성 센서는 인간과 기계 사이의 자유로운 소통을 가능하게 만드는 가장 직관적인 수단으로 4차 산업혁명의 핵심 기술로 주목받고 있다. 음성센서 시장은 2021년 대략 160억 달러 규모로 커질 것으로 예상된다.
그러나 현재 산업계에서는 음성 신호 수신 시 정전용량을 측정하는 콘덴서 형식을 사용하기 때문에 민감도가 낮고 인식 거리가 짧아 화자 인식률에 한계가 있다.
이번 연구에서 이 교수 연구팀은 인간의 달팽이관을 모사해 주파수에 따라 다른 영역이 진동하는 사다리꼴의 얇은 막을 제작했다. 음성신호에 따른 공진형 진동을 유연 압전 물질을 통해 감지하는 자가발전 고민감 음성 센서를 개발했다.
연구팀의 음성 센서는 기존 기술 대비 2배 이상 높은 민감도를 가져 미세한 음성 신호를 원거리에서도 감지할 수 있다. 또한 다채널로 신호를 받아들여 하나의 언어에 대해 복수 개의 데이터를 얻을 수 있다.
이 기술을 기반으로 누가 이야기하는지 찾아내는 화자인식 시스템에 적용해 97.5%의 화자인식 성공률을 무향실에서 달성했고 기존 기술 대비 오류를 75% 이상 줄였다.
화자인식 서비스는 음성 분야에 세상을 바꿀 next big thing으로 기대를 받고 있다. 기존 기술은 소프트웨어 업그레이드를 통한 접근으로 인식률에 한계가 있었지만 연구팀의 기술은 하드웨어 센서를 개발함으로써 능력을 크게 향상시켰다. 추후 첨단 소프트웨어를 접목한다면 다양한 환경에서도 화자 및 음성 인식률을 높일 수 있을 것으로 예상된다.
이건재 교수는 “이번에 개발한 머신 러닝 기반 고민감 유연 압전 음성센서는 화자를 정확하게 구별할 수 있기 때문에 개인별 음성 서비스를 스마트 가전이나 인공지능 비서에 접목할 수 있을 것이며 생체 인증 및 핀테크와 같은 보안 분야에서도 큰 역할을 할 수 있을 것이다”고 말했다.
이번 연구는 스마트 IT 융합시스템 연구단의 지원을 받아 수행됐다.
<관련 영상>
https://www.youtube.com/watch?v=QGEVJxCFVpc&feature=youtu.be
□ 그림 설명
그림1. 인간의 달팽이관을 모사한 유연 압전 음성 센서 구조
그림2. 인공지능을 통한 화자 인식 개략도
이건재 교수, 유창동 교수, 유연 압전 화자인식 음성센서 개발
〈 이 건 재 교수 〉
우리 대학 신소재공학과 이건재 교수와 전기및전자공학부 유창동 교수 공동 연구팀이 인공지능 기반의 화자(話者) 인식용 유연 압전 음성센서를 개발했다.
이번 연구를 통해 개인별 음성 서비스를 스마트 홈 가전이나 인공지능 비서, 생체 인증 분야 등 차세대 기술에 활용 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘나노 에너지(Nano Energy)’ 9월호에 ‘민감도’와 ‘화자인식’ 논문 두 편으로 동시 게재됐고 현재 관련 기술은 실용화 단계에 있다. (민감도 논문 : Basilar Membrane-Inspired Self-Powered Acoustic Sensor Enabled by Highly Sensitive Multi Tunable Frequency Band, 화자인식 논문 : Machine Learning-based Self-powered Acoustic Sensor for Speaker Recognition)
음성 센서는 인간과 기계 사이의 자유로운 소통을 가능하게 만드는 가장 직관적인 수단으로 4차 산업혁명의 핵심 기술로 주목받고 있다. 음성센서 시장은 2021년 대략 160억 달러 규모로 커질 것으로 예상된다.
그러나 현재 산업계에서는 음성 신호 수신 시 정전용량을 측정하는 콘덴서 형식을 사용하기 때문에 민감도가 낮고 인식 거리가 짧아 화자 인식률에 한계가 있다.
이번 연구에서 이 교수 연구팀은 인간의 달팽이관을 모사해 주파수에 따라 다른 영역이 진동하는 사다리꼴의 얇은 막을 제작했다. 음성신호에 따른 공진형 진동을 유연 압전 물질을 통해 감지하는 자가발전 고민감 음성 센서를 개발했다.
연구팀의 음성 센서는 기존 기술 대비 2배 이상 높은 민감도를 가져 미세한 음성 신호를 원거리에서도 감지할 수 있다. 또한 다채널로 신호를 받아들여 하나의 언어에 대해 복수 개의 데이터를 얻을 수 있다.
이 기술을 기반으로 누가 이야기하는지 찾아내는 화자인식 시스템에 적용해 97.5%의 화자인식 성공률을 무향실에서 달성했고 기존 기술 대비 오류를 75% 이상 줄였다.
화자인식 서비스는 음성 분야에 세상을 바꿀 next big thing으로 기대를 받고 있다. 기존 기술은 소프트웨어 업그레이드를 통한 접근으로 인식률에 한계가 있었지만 연구팀의 기술은 하드웨어 센서를 개발함으로써 능력을 크게 향상시켰다. 추후 첨단 소프트웨어를 접목한다면 다양한 환경에서도 화자 및 음성 인식률을 높일 수 있을 것으로 예상된다.
이건재 교수는 “이번에 개발한 머신 러닝 기반 고민감 유연 압전 음성센서는 화자를 정확하게 구별할 수 있기 때문에 개인별 음성 서비스를 스마트 가전이나 인공지능 비서에 접목할 수 있을 것이며 생체 인증 및 핀테크와 같은 보안 분야에서도 큰 역할을 할 수 있을 것이다”고 말했다.
이번 연구는 스마트 IT 융합시스템 연구단의 지원을 받아 수행됐다.
<관련 영상>
https://www.youtube.com/watch?v=QGEVJxCFVpc&feature=youtu.be
□ 그림 설명
그림1. 인간의 달팽이관을 모사한 유연 압전 음성 센서 구조
그림2. 인공지능을 통한 화자 인식 개략도
2018.10.04
조회수 14539
 다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
2020.06.01 조회수 16742
다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
2020.06.01 조회수 16742 해상도 높인 곤충 눈 구조 초박형 카메라 개발
바이오및뇌공학과 정기훈 교수 연구팀이 고해상도 이미징을 위한 곤충 눈 구조의 초박형 카메라를 개발했다. 이 카메라는 독특한 시각 구조를 가진 제노스 페키(Xenos peckii)라는 곤충의 눈을 모사해 개발돼, 상용 카메라보다 더 얇은 렌즈 두께와 넓은 광시야각을 갖는다. 이러한 특징을 이용해 모바일, 감시 및 정찰 장비, 의료영상 기기 등 다양한 소형 카메라가 필요한 분야에 적용 가능할 것으로 기대된다.
김기수 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용 (Light : Science & Applications)’ 2월 27일 자 온라인판에 게재됐다. (논문명: 고대비 고해상도 이미징을 위한 생체모사 초박형 카메라, Biologically Inspired Ultrathin Arrayed Camera for High Contrast and High Resolution Imaging)
최근 초소형 및 초박형 스마트 기기의 개발로 소형화된 이미징 시스템의 수요가 커지고 있다. 그러나 기존의 카메라는 물체의 상이 일그러지거나 흐려지는 현상인 수차를 줄이기 위해 다층 렌즈 구조를 활용하기 때문에 렌즈 두께를 감소하는 데 한계가 있다. 또한, 기존의 곤충 눈을 모사한 미세렌즈 배열(Microlens arrays)은 렌즈 사이의 광학 크로스토크(Optical crosstalk)로 인해 해상도가 저해되는 단점이 있다.
연구팀은 문제 해결을 위해 제노스 페키 곤충의 시각 구조를 모사한 렌즈를 제작했고 이를 이미지 센서와 결합해 초박형 카메라를 개발했다. 곤충의 눈은 렌즈와 렌즈 사이의 빛을 차단하는 색소 세포(pigment cells)가 존재해 각 렌즈에서 결상(어떤 물체에서 나온 광선 등이 반사 굴절한 다음 다시 모여 그 물체와 닮은꼴의 상을 만드는 현상)되는 영상들 간의 간섭을 막는다. 이러한 구조는 렌즈들 사이의 광학 크로스토크를 막아 고 대비 및 고해상도 영상을 획득하는 데 도움을 준다.
연구팀은 이러한 광 차단 구조를 포토리소그래피(Photolithography) 공정으로 매우 얇게 제작해 렌즈들 사이의 광학 크로스토크를 효율적으로 차단했다. 렌즈의 두께를 최소화하기 위해 렌즈의 방향을 이미지 센서 방향인 역방향으로 배치했으며, 이를 통해 최종 개발된 카메라 렌즈의 두께는 0.74mm로 이는 10원짜리 동전 절반 정도의 두께이다. 연구팀은 카메라의 원거리에 있는 물체를 모든 렌즈에서 같은 시야각을 통해 동일한 영상을 획득하고, 이 배열 영상들은 해상도를 하나의 이미지로 합성했다. 합성된 영상은 합성 전 단일 채널 영상보다 향상된 해상도를 가짐을 확인했다.
정기훈 교수는 “실질적으로 상용화 가능한 초박형 카메라를 제작하는 방법을 개발했다”라며 “이 카메라는 영상획득이 필요한 장치에 통합돼 장치 소형화에 크게 기여할 것으로 확신한다”라고 말했다.
2020.03.23 조회수 21121
해상도 높인 곤충 눈 구조 초박형 카메라 개발
바이오및뇌공학과 정기훈 교수 연구팀이 고해상도 이미징을 위한 곤충 눈 구조의 초박형 카메라를 개발했다. 이 카메라는 독특한 시각 구조를 가진 제노스 페키(Xenos peckii)라는 곤충의 눈을 모사해 개발돼, 상용 카메라보다 더 얇은 렌즈 두께와 넓은 광시야각을 갖는다. 이러한 특징을 이용해 모바일, 감시 및 정찰 장비, 의료영상 기기 등 다양한 소형 카메라가 필요한 분야에 적용 가능할 것으로 기대된다.
김기수 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용 (Light : Science & Applications)’ 2월 27일 자 온라인판에 게재됐다. (논문명: 고대비 고해상도 이미징을 위한 생체모사 초박형 카메라, Biologically Inspired Ultrathin Arrayed Camera for High Contrast and High Resolution Imaging)
최근 초소형 및 초박형 스마트 기기의 개발로 소형화된 이미징 시스템의 수요가 커지고 있다. 그러나 기존의 카메라는 물체의 상이 일그러지거나 흐려지는 현상인 수차를 줄이기 위해 다층 렌즈 구조를 활용하기 때문에 렌즈 두께를 감소하는 데 한계가 있다. 또한, 기존의 곤충 눈을 모사한 미세렌즈 배열(Microlens arrays)은 렌즈 사이의 광학 크로스토크(Optical crosstalk)로 인해 해상도가 저해되는 단점이 있다.
연구팀은 문제 해결을 위해 제노스 페키 곤충의 시각 구조를 모사한 렌즈를 제작했고 이를 이미지 센서와 결합해 초박형 카메라를 개발했다. 곤충의 눈은 렌즈와 렌즈 사이의 빛을 차단하는 색소 세포(pigment cells)가 존재해 각 렌즈에서 결상(어떤 물체에서 나온 광선 등이 반사 굴절한 다음 다시 모여 그 물체와 닮은꼴의 상을 만드는 현상)되는 영상들 간의 간섭을 막는다. 이러한 구조는 렌즈들 사이의 광학 크로스토크를 막아 고 대비 및 고해상도 영상을 획득하는 데 도움을 준다.
연구팀은 이러한 광 차단 구조를 포토리소그래피(Photolithography) 공정으로 매우 얇게 제작해 렌즈들 사이의 광학 크로스토크를 효율적으로 차단했다. 렌즈의 두께를 최소화하기 위해 렌즈의 방향을 이미지 센서 방향인 역방향으로 배치했으며, 이를 통해 최종 개발된 카메라 렌즈의 두께는 0.74mm로 이는 10원짜리 동전 절반 정도의 두께이다. 연구팀은 카메라의 원거리에 있는 물체를 모든 렌즈에서 같은 시야각을 통해 동일한 영상을 획득하고, 이 배열 영상들은 해상도를 하나의 이미지로 합성했다. 합성된 영상은 합성 전 단일 채널 영상보다 향상된 해상도를 가짐을 확인했다.
정기훈 교수는 “실질적으로 상용화 가능한 초박형 카메라를 제작하는 방법을 개발했다”라며 “이 카메라는 영상획득이 필요한 장치에 통합돼 장치 소형화에 크게 기여할 것으로 확신한다”라고 말했다.
2020.03.23 조회수 21121 섬유 위에 기능성 나노구조체 구현
기계공학과 박인규 교수와 한국기계연구원 정준호 박사 공동 연구팀이 섬유 위에 다양한 기능성 나노 구조체를 구현하는 생체적합성 공정을 개발했다.
연구팀은 개발한 공정을 통해 다양한 재료의 나노 구조체를 섬유 위에 자유롭게 구현하는 데 성공했다. 섬유 위에 직접 나노 구조체를 전사할 수 있어 추가적인 기판이나 접착층 없이도 기능성 기기를 손쉽게 제작할 수 있다. 연구팀은 전기적·광학적 특성을 이용해 환경 및 신체 움직임 모니터링, 나노 구조색을 이용한 보안패턴, 광촉매를 이용한 자가 세정 기능 등을 섬유에 부여할 수 있으며, 스마트 섬유로 활용 가능할 것으로 전망했다.
고지우 박사과정이 1 저자로 참여한 이번 연구는 나노분야의 권위 있는 국제 학술지인 ‘에이씨에스 나노(ACS Nano, IF: 13.903)’2월 25일 자 14권 2호 논문에 게재됐다. (논문명: Nanotransfer Printing on Textile Substrate with Water-Soluble Polymer Nanotemplate, 수용성 폴리머 나노템플릿을 이용한 섬유에의 나노패턴전사)
최근 웨어러블 디바이스에 대한 관심이 커짐에 따라 섬유를 기판으로 하는 스마트 섬유 연구가 활발히 진행되고 있다. 섬유에 초미세 패턴을 구현하기 위해 다양한 방법이 시도되지만, 섬유의 거친 표면 특성으로 인해 기존의 공정은 기기 소형화 및 성능 향상에 필수적인 정교한 패턴을 구현할 수 없다는 한계가 있다. 이번 연구에서는 이를 해결하기 위해 물에 잘 젖는 섬유의 특성을 이용해 수용성 고분자이며 생체적합성이 우수한 히알루론산의 나노 패턴을 사용했다.
연구팀은 히알루론산 기판에 나노 패턴의 템플릿을 제작한 후 다양한 기능성 소재의 박막을 진공증착을 통해 형성했다. 그 후 섬유에 흡수된 물을 이용해 히알루론산 템플릿을 녹여냄으로써 최소 선폭 50 나노미터인 나노 구조체를 섬유 위에 전사했다. 이 방법을 통해 금, 은, 팔라듐, 알루미늄, 이산화규소와 같은 금속과 비금속 소재의 나노 패턴 형성이 모두 가능하며 동시에 다양한 나노 구조체의 조합을 자유롭게 섬유 위에 제작할 수 있다.
연구팀은 개발한 공정을 통해 팔라듐 나노 구조체를 전사해 수소 감지 센서를 제작했고, 나노 구조체가 없는 센서와 비교해 센서의 감도가 향상됐음을 확인했다. 또한, 나노 구조체가 갖는 광학적 특성인 국소 표면 플라즈몬 공명 현상으로 인한 나노 구조색을 이용해 같은 금속 및 구조이지만 두께 및 형상 파라미터에 따라 서로 다른 고유한 색을 나타냄으로써 보안패턴에 적용할 수 있음을 입증했다.
박인규 교수는 “스마트 섬유를 구현할 수 있는 간편하면서도 범용성 있는 나노 패터닝 공정을 개발했다. 다양한 섬유에 센서, 배터리, 보안패턴, 자가 세정 등의 첨단 기능을 쉽게 구현할 수 있는 데 큰 의의가 있다”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제 (올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 글로벌 프론티어 사업 (극한물성시스템 제조 플랫폼기술)의 지원을 통해 수행됐다.
2020.03.18 조회수 20172
섬유 위에 기능성 나노구조체 구현
기계공학과 박인규 교수와 한국기계연구원 정준호 박사 공동 연구팀이 섬유 위에 다양한 기능성 나노 구조체를 구현하는 생체적합성 공정을 개발했다.
연구팀은 개발한 공정을 통해 다양한 재료의 나노 구조체를 섬유 위에 자유롭게 구현하는 데 성공했다. 섬유 위에 직접 나노 구조체를 전사할 수 있어 추가적인 기판이나 접착층 없이도 기능성 기기를 손쉽게 제작할 수 있다. 연구팀은 전기적·광학적 특성을 이용해 환경 및 신체 움직임 모니터링, 나노 구조색을 이용한 보안패턴, 광촉매를 이용한 자가 세정 기능 등을 섬유에 부여할 수 있으며, 스마트 섬유로 활용 가능할 것으로 전망했다.
고지우 박사과정이 1 저자로 참여한 이번 연구는 나노분야의 권위 있는 국제 학술지인 ‘에이씨에스 나노(ACS Nano, IF: 13.903)’2월 25일 자 14권 2호 논문에 게재됐다. (논문명: Nanotransfer Printing on Textile Substrate with Water-Soluble Polymer Nanotemplate, 수용성 폴리머 나노템플릿을 이용한 섬유에의 나노패턴전사)
최근 웨어러블 디바이스에 대한 관심이 커짐에 따라 섬유를 기판으로 하는 스마트 섬유 연구가 활발히 진행되고 있다. 섬유에 초미세 패턴을 구현하기 위해 다양한 방법이 시도되지만, 섬유의 거친 표면 특성으로 인해 기존의 공정은 기기 소형화 및 성능 향상에 필수적인 정교한 패턴을 구현할 수 없다는 한계가 있다. 이번 연구에서는 이를 해결하기 위해 물에 잘 젖는 섬유의 특성을 이용해 수용성 고분자이며 생체적합성이 우수한 히알루론산의 나노 패턴을 사용했다.
연구팀은 히알루론산 기판에 나노 패턴의 템플릿을 제작한 후 다양한 기능성 소재의 박막을 진공증착을 통해 형성했다. 그 후 섬유에 흡수된 물을 이용해 히알루론산 템플릿을 녹여냄으로써 최소 선폭 50 나노미터인 나노 구조체를 섬유 위에 전사했다. 이 방법을 통해 금, 은, 팔라듐, 알루미늄, 이산화규소와 같은 금속과 비금속 소재의 나노 패턴 형성이 모두 가능하며 동시에 다양한 나노 구조체의 조합을 자유롭게 섬유 위에 제작할 수 있다.
연구팀은 개발한 공정을 통해 팔라듐 나노 구조체를 전사해 수소 감지 센서를 제작했고, 나노 구조체가 없는 센서와 비교해 센서의 감도가 향상됐음을 확인했다. 또한, 나노 구조체가 갖는 광학적 특성인 국소 표면 플라즈몬 공명 현상으로 인한 나노 구조색을 이용해 같은 금속 및 구조이지만 두께 및 형상 파라미터에 따라 서로 다른 고유한 색을 나타냄으로써 보안패턴에 적용할 수 있음을 입증했다.
박인규 교수는 “스마트 섬유를 구현할 수 있는 간편하면서도 범용성 있는 나노 패터닝 공정을 개발했다. 다양한 섬유에 센서, 배터리, 보안패턴, 자가 세정 등의 첨단 기능을 쉽게 구현할 수 있는 데 큰 의의가 있다”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제 (올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 글로벌 프론티어 사업 (극한물성시스템 제조 플랫폼기술)의 지원을 통해 수행됐다.
2020.03.18 조회수 20172 박인규 교수, 헬스 모니터링용 고감도 유연 압력센서 개발
우리 대학 기계공학과 박인규 교수 연구팀에서 생체 신호 및 신체 압력 모니터링에 활용이 가능한 액체 금속 기반 웨어러블 유연 압력 센서를 개발했다.
이 기술을 통해 맥박, 혈압 등 다양한 중요 생체 신호를 연속적으로 모니터링하고 욕창과 같은 압력으로 인해 비롯한 여러 질병을 예방할 수 있는 시스템으로 활용할 수 있을 것으로 기대된다.
김규영 박사과정이 1저자, 오용석 연구교수가 공동 교신저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스트 헬스케어 머터리얼스(Advanced Healthcare Materials)’11월 21일자 표지논문에 게재됐다. (논문명: Highly Sensitive and Wearable Liquid Metal‐Based Pressure Sensor for Health Monitoring Applications: Integration of a 3D‐Printed Microbump Array with the Microchannel)
최근 헬스케어에 대한 관심이 커짐에 따라 웨어러블 유연 센서 개발이 활발히 진행되고 있다. 기능성 소재를 기반으로 다양한 고감도의 유연 센서가 많이 개발되고 있지만, 기존 고체 소재 기반 센서는 웨어러블 디바이스로 활용되기에 신축성, 신호 반복성 및 안정성 측면에서 한계를 보인다.
이러한 점을 보완하기 위해 현재 액체 소재 기반 유연 센서가 다양하게 개발되고 있다. 액체 전극 중에서도 특히 갈린스탄(Galinstan)과 같은 액체 금속은 신축성에 제한이 없으며, 무독성, 높은 전기 전도도, 전기/기계적 안정성 등의 특징으로 신축성 소자 및 웨어러블 디바이스 요소로써 활용도가 매우 높다.
하지만 기존의 액체 금속 기반 유연 압력 센서는 안정적이지만 매우 감도가 낮아 맥박이나 신체 압력 모니터링과 같은 수 kPa 수준의 작은 범위의 압력 측정에 활용하기 어려웠다.
이번 연구에서는 다중물질 3D 프린팅 기술을 활용해 단단한 마이크로 범프 구조물을 액체 금속 채널에 배치하여 작은 압력에도 신호 변화가 크게 나타날 수 있는 구조를 개발했다. 이러한 구조를 통해 마이크로 범프가 없는 일반 액체 금속기반 압력 센서보다 6배 이상의 높은 감도를 얻고 고체 기반 유연 압력 센서 수준의 감도를 얻을 수 있었다.
또한, 개발된 유연 압력 센서는 1만 회 이상의 인장, 굽힘 등 다양한 물리 변형에도 안정적인 신호 회복을 보이고, 다양한 환경 요인(온도, 습도)에도 안정적인 감지 성능을 보여 웨어러블 디바이스로써 활용될 수 있는 큰 가능성을 보였다.
연구팀은 이러한 성능을 바탕으로 평상시와 운동 시의 맥박, 혈압을 측정하여 그 변화를 연속적으로 감지해 건강 상태를 모니터링할 수 있음을 확인했다.
센서가 부착된 양말과 무선 통신 시스템을 구축하여 누워있는 사람의 다양한 자세 변화 도중 나타나는 신체 압력 및 그 변화를 원격으로 모니터링할 수 있었다.
박인규 교수는 “개발한 고감도 및 고신뢰성 액체 금속기반 유연 압력 센서를 통해 다양한 생체 건강 정보를 연속적으로 수집할 수 있었다. 이를 이용하여 다양한 헬스 케어/헬스 모니터링 어플리케이션, 특히 욕창과 같이 압력으로 인해 나타나는 다양한 질병 관리 및 예방 분야에 활용될 수 있을 것으로 기대된다.”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제(올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 선도연구센터지원 사업 (초정밀 광 기계기술 연구센터)의 지원을 통해 수행됐다.
□ 그림 설명
그림1. Advanced Healthcare Materials 표지
그림2. 마이크로 범프가 집적된 액체 금속 기반 유연 압력 센서
그림3. 높은 감도와 안정적 성능의 유연 센서 및 신체 압력 측정 어플리케이션
2019.12.11 조회수 17865
박인규 교수, 헬스 모니터링용 고감도 유연 압력센서 개발
우리 대학 기계공학과 박인규 교수 연구팀에서 생체 신호 및 신체 압력 모니터링에 활용이 가능한 액체 금속 기반 웨어러블 유연 압력 센서를 개발했다.
이 기술을 통해 맥박, 혈압 등 다양한 중요 생체 신호를 연속적으로 모니터링하고 욕창과 같은 압력으로 인해 비롯한 여러 질병을 예방할 수 있는 시스템으로 활용할 수 있을 것으로 기대된다.
김규영 박사과정이 1저자, 오용석 연구교수가 공동 교신저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스트 헬스케어 머터리얼스(Advanced Healthcare Materials)’11월 21일자 표지논문에 게재됐다. (논문명: Highly Sensitive and Wearable Liquid Metal‐Based Pressure Sensor for Health Monitoring Applications: Integration of a 3D‐Printed Microbump Array with the Microchannel)
최근 헬스케어에 대한 관심이 커짐에 따라 웨어러블 유연 센서 개발이 활발히 진행되고 있다. 기능성 소재를 기반으로 다양한 고감도의 유연 센서가 많이 개발되고 있지만, 기존 고체 소재 기반 센서는 웨어러블 디바이스로 활용되기에 신축성, 신호 반복성 및 안정성 측면에서 한계를 보인다.
이러한 점을 보완하기 위해 현재 액체 소재 기반 유연 센서가 다양하게 개발되고 있다. 액체 전극 중에서도 특히 갈린스탄(Galinstan)과 같은 액체 금속은 신축성에 제한이 없으며, 무독성, 높은 전기 전도도, 전기/기계적 안정성 등의 특징으로 신축성 소자 및 웨어러블 디바이스 요소로써 활용도가 매우 높다.
하지만 기존의 액체 금속 기반 유연 압력 센서는 안정적이지만 매우 감도가 낮아 맥박이나 신체 압력 모니터링과 같은 수 kPa 수준의 작은 범위의 압력 측정에 활용하기 어려웠다.
이번 연구에서는 다중물질 3D 프린팅 기술을 활용해 단단한 마이크로 범프 구조물을 액체 금속 채널에 배치하여 작은 압력에도 신호 변화가 크게 나타날 수 있는 구조를 개발했다. 이러한 구조를 통해 마이크로 범프가 없는 일반 액체 금속기반 압력 센서보다 6배 이상의 높은 감도를 얻고 고체 기반 유연 압력 센서 수준의 감도를 얻을 수 있었다.
또한, 개발된 유연 압력 센서는 1만 회 이상의 인장, 굽힘 등 다양한 물리 변형에도 안정적인 신호 회복을 보이고, 다양한 환경 요인(온도, 습도)에도 안정적인 감지 성능을 보여 웨어러블 디바이스로써 활용될 수 있는 큰 가능성을 보였다.
연구팀은 이러한 성능을 바탕으로 평상시와 운동 시의 맥박, 혈압을 측정하여 그 변화를 연속적으로 감지해 건강 상태를 모니터링할 수 있음을 확인했다.
센서가 부착된 양말과 무선 통신 시스템을 구축하여 누워있는 사람의 다양한 자세 변화 도중 나타나는 신체 압력 및 그 변화를 원격으로 모니터링할 수 있었다.
박인규 교수는 “개발한 고감도 및 고신뢰성 액체 금속기반 유연 압력 센서를 통해 다양한 생체 건강 정보를 연속적으로 수집할 수 있었다. 이를 이용하여 다양한 헬스 케어/헬스 모니터링 어플리케이션, 특히 욕창과 같이 압력으로 인해 나타나는 다양한 질병 관리 및 예방 분야에 활용될 수 있을 것으로 기대된다.”라고 말했다.
이번 연구는 한국연구재단의 중견 연구 과제(올인원 스마트 스킨을 위한 웨어러블 멀티센서 시스템 핵심기술 연구)와 선도연구센터지원 사업 (초정밀 광 기계기술 연구센터)의 지원을 통해 수행됐다.
□ 그림 설명
그림1. Advanced Healthcare Materials 표지
그림2. 마이크로 범프가 집적된 액체 금속 기반 유연 압력 센서
그림3. 높은 감도와 안정적 성능의 유연 센서 및 신체 압력 측정 어플리케이션
2019.12.11 조회수 17865 정재웅 교수, 상황에 따라 딱딱해지고 유연해지는 전자기기 개발
〈 정재웅 교수, 변상혁 박사과정, 이주현 석사과정 〉
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 사용 목적과 신체 적용 여부에 따라 딱딱한 형태와 부드러운 형태를 하나의 전자기기에서 선택적으로 구현함으로써 기기의 모양과 유연성을 변화시킬 수 있는 기술을 개발했다.
연구팀이 개발한 기술은 딱딱한 형태의 전자기기와 유연 기기의 경계를 허물어 활용도, 사용 편의성, 휴대성, 생체적합성을 모두 극대화할 수 있어 소비 전자제품뿐 아니라 생체의학, 로봇 공학 등의 다양한 분야에 혁신적 변화를 일으킬 것으로 기대된다.
변상혁 연구원과 한국전자통신연구원의 심주용 박사가 1저자로 참여하고 이주현, 라자 콰지(Raza Qazi) 연구원 등이 참여한 이번 연구는 국제 학술지 ‘사이언스 어드밴시스(Science Advances)’ 11월 1일 자에 게재됐다. (논문명: Mechanically transformative electronics, sensors, and implantable devices).
일반적으로 전자기기는 사용 목적에 따라 특정 강성을 갖도록 설계된다. 스마트폰, 노트북은 딱딱한 형태로 손에 쥐거나 테이블 위에 놓고 사용하기 적합하고, 최근 활발히 개발되는 유연 신축성 전자기기는 착용성이 뛰어나 웨어러블 형태로 활용되고 있다.
하지만 딱딱한 형태의 전자기기는 신체에 착용 시 각종 불편함을 일으키고, 생체이식 시 조직 파괴나 염증 등을 유발할 수 있다. 반면 유연 신축성 전자기기는 외력을 견디지 못하고 쉽게 모양이 변하기 때문에 몸에서 탈착 시 일반적인 전자기기와 같이 편리하게 사용하기 어렵다는 단점을 가진다.
연구팀은 갈륨(Gallium)과 중합체(polymer)를 이용한 합성물질을 제작해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 구현했다. 이를 유연 신축성 전자회로와 결합해 강성률이 변화 가능한 새로운 형태의 전자기기를 구현했다.
갈륨은 이번 연구의 핵심 소재로, 금속임에도 불구하고 생체 온도(29.8℃)에서 녹는점을 가져 신체 탈부착 시 고체와 액체 간의 상태 변화가 가능하다. 이러한 점에 기반해 갈륨을 중합체에 내장해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 제작했다.
연구팀은 전자기기의 강성도를 변화시킬 수 있는 특징을 활용해 다양한 적용 분야에서 기존 전자기기가 갖는 한계점을 극복할 수 있음을 증명했다. 예를 들어, 이 기술을 휴대용 전자기기에 적용해 평상시에는 딱딱한 형태로 손에 쥔 상태나 책상 위에서 이용하고, 이동 시 몸에 부착해 부드러운 웨어러블 기기 형태로 만듦으로써 휴대성을 높일 수 있음을 보여줬다.
또한, 강성을 변환시킬 수 있는 압력 센서를 개발해 목적에 따라 민감도와 압력 감지의 범위를 조절하는 데 성공했다. 그뿐만 아니라, 뇌 조직에 이식 시 부드럽게 변화하는 뇌 탐침을 개발해 기존 딱딱한 탐침 대비 뇌 손상 및 염증 반응을 최소화할 수 있었다.
이렇게 변형 가능한 전자기기 기술은 웨어러블, 임플랜터블, 센싱기기 및 로봇 등에 적용돼 다양한 목적과 상황에 유동적으로 사용될 수 있는 다목적 전자기기 시스템 개발을 이끌 수 있을 것으로 기대된다.
정 교수는 “평상시 딱딱한 형태의 전자기기로 쓰이나 몸에 부착 시 혹은 내부 장기에 이식 시 우리 신체 조직처럼 부드럽고 신축성 있게 변환될 수 있는 기기 플랫폼 기술 개발을 통해, 일반적인 전자기기와 유연 기기가 갖는 단점은 없애면서 사용 목적에 따라 각각의 장점을 극대화할 수 있는 전자기기를 개발했다”라며 “이 기술을 이용하면 전자기기의 활용 폭을 크게 넓힐 수 있을 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업 및 기초연구실 지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 개발된 강성률 변화 가능한 전자기기의 개념도와 실제 구현사진
그림2. 딱딱한 모바일 기기와 부드러운 웨어러블 기기 간 변환이 가능한 전자기기 및 활용 예시
그림3. 압력 측정 민감도-동작 범위 튜닝이 가능한 압력 센서
그림4. 강성률 변화 가능 플랫폼을 활용한 뉴럴 프로브
그림5. 디바이스 개념을 보여주는 인포그래픽
2019.11.06 조회수 12059
정재웅 교수, 상황에 따라 딱딱해지고 유연해지는 전자기기 개발
〈 정재웅 교수, 변상혁 박사과정, 이주현 석사과정 〉
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 사용 목적과 신체 적용 여부에 따라 딱딱한 형태와 부드러운 형태를 하나의 전자기기에서 선택적으로 구현함으로써 기기의 모양과 유연성을 변화시킬 수 있는 기술을 개발했다.
연구팀이 개발한 기술은 딱딱한 형태의 전자기기와 유연 기기의 경계를 허물어 활용도, 사용 편의성, 휴대성, 생체적합성을 모두 극대화할 수 있어 소비 전자제품뿐 아니라 생체의학, 로봇 공학 등의 다양한 분야에 혁신적 변화를 일으킬 것으로 기대된다.
변상혁 연구원과 한국전자통신연구원의 심주용 박사가 1저자로 참여하고 이주현, 라자 콰지(Raza Qazi) 연구원 등이 참여한 이번 연구는 국제 학술지 ‘사이언스 어드밴시스(Science Advances)’ 11월 1일 자에 게재됐다. (논문명: Mechanically transformative electronics, sensors, and implantable devices).
일반적으로 전자기기는 사용 목적에 따라 특정 강성을 갖도록 설계된다. 스마트폰, 노트북은 딱딱한 형태로 손에 쥐거나 테이블 위에 놓고 사용하기 적합하고, 최근 활발히 개발되는 유연 신축성 전자기기는 착용성이 뛰어나 웨어러블 형태로 활용되고 있다.
하지만 딱딱한 형태의 전자기기는 신체에 착용 시 각종 불편함을 일으키고, 생체이식 시 조직 파괴나 염증 등을 유발할 수 있다. 반면 유연 신축성 전자기기는 외력을 견디지 못하고 쉽게 모양이 변하기 때문에 몸에서 탈착 시 일반적인 전자기기와 같이 편리하게 사용하기 어렵다는 단점을 가진다.
연구팀은 갈륨(Gallium)과 중합체(polymer)를 이용한 합성물질을 제작해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 구현했다. 이를 유연 신축성 전자회로와 결합해 강성률이 변화 가능한 새로운 형태의 전자기기를 구현했다.
갈륨은 이번 연구의 핵심 소재로, 금속임에도 불구하고 생체 온도(29.8℃)에서 녹는점을 가져 신체 탈부착 시 고체와 액체 간의 상태 변화가 가능하다. 이러한 점에 기반해 갈륨을 중합체에 내장해 온도에 따라 강성률 변화가 가능한 전자 플랫폼을 제작했다.
연구팀은 전자기기의 강성도를 변화시킬 수 있는 특징을 활용해 다양한 적용 분야에서 기존 전자기기가 갖는 한계점을 극복할 수 있음을 증명했다. 예를 들어, 이 기술을 휴대용 전자기기에 적용해 평상시에는 딱딱한 형태로 손에 쥔 상태나 책상 위에서 이용하고, 이동 시 몸에 부착해 부드러운 웨어러블 기기 형태로 만듦으로써 휴대성을 높일 수 있음을 보여줬다.
또한, 강성을 변환시킬 수 있는 압력 센서를 개발해 목적에 따라 민감도와 압력 감지의 범위를 조절하는 데 성공했다. 그뿐만 아니라, 뇌 조직에 이식 시 부드럽게 변화하는 뇌 탐침을 개발해 기존 딱딱한 탐침 대비 뇌 손상 및 염증 반응을 최소화할 수 있었다.
이렇게 변형 가능한 전자기기 기술은 웨어러블, 임플랜터블, 센싱기기 및 로봇 등에 적용돼 다양한 목적과 상황에 유동적으로 사용될 수 있는 다목적 전자기기 시스템 개발을 이끌 수 있을 것으로 기대된다.
정 교수는 “평상시 딱딱한 형태의 전자기기로 쓰이나 몸에 부착 시 혹은 내부 장기에 이식 시 우리 신체 조직처럼 부드럽고 신축성 있게 변환될 수 있는 기기 플랫폼 기술 개발을 통해, 일반적인 전자기기와 유연 기기가 갖는 단점은 없애면서 사용 목적에 따라 각각의 장점을 극대화할 수 있는 전자기기를 개발했다”라며 “이 기술을 이용하면 전자기기의 활용 폭을 크게 넓힐 수 있을 것이다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업 및 기초연구실 지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 개발된 강성률 변화 가능한 전자기기의 개념도와 실제 구현사진
그림2. 딱딱한 모바일 기기와 부드러운 웨어러블 기기 간 변환이 가능한 전자기기 및 활용 예시
그림3. 압력 측정 민감도-동작 범위 튜닝이 가능한 압력 센서
그림4. 강성률 변화 가능 플랫폼을 활용한 뉴럴 프로브
그림5. 디바이스 개념을 보여주는 인포그래픽
2019.11.06 조회수 12059 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24693
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24693 김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01 조회수 23652
김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01 조회수 23652 석현정, 최경아 교수 청백색 조명이 아침잠 깨워주는 효과 입증
〈 왼쪽부터 정현정 교수, 석현정 교수, 김태수 박사과정, 최경아 연구교수 〉
출근과 등교. 이 두 단어는 대부분의 직장인과 학생에게 유쾌하지 않다. 회식, 인터넷 강의, 스마트폰, 육아 등으로 인해 부족해진 아침잠은 쉽사리 사라지지 않는다. 하지만 우리가 매일 접하는 빛을 통해 오전의 나른함을 깨우고 생체리듬을 유지할 수 있다는 연구 결과가 발표됐다.
우리 대학 산업디자인학과 석현정 교수, 최경아 연구교수가 높은 색의 온도를 갖는 청백색(blue-enriched white)의 푸른 빛이 아침잠을 깨우는 데 효과적임을 밝혀냈다.
이 연구는 인간 중심의 조명이 나아가야 할 방향을 제시한 것으로, 인공적인 조명 시스템을 변화하는 데 긍정적인 영향을 끼칠 것으로 기대된다.
특히 이번 연구는 산업디자인학과 소속 교수와 연구원이 교신저자 및 1 저자로 참여해 순수과학 분야 저널에 논문을 게재했다. 이는 세계적으로도 찾기 힘든 사례로 디자인학과 자연과학의 우수 융합 연구의 표본이 될 것으로 예상된다.
최경아 연구교수가 1 저자, 나노과학기술대학원 정현정 교수가 참여한 이번 연구는 국제 학술지 ‘사이언티픽 리포트(Scientific Reports)’ 1월 23일 자에 게재됐다. (논문명 : Awakening effects of blue-enriched morning light exposure on university students’ physiological and subjective responses)
2017년도 노벨 생리의학상은 태양의 주기에 따라 아침, 저녁으로 몸의 변화가 규칙적으로 일어나는 서카디안(circadian) 리듬, 즉 생체리듬을 조절하는 유전자를 규명한 미국의 과학자 제프리 홀 메인대(University Of Maine) 교수, 마이클 로스바시 브랜다이스대(Brandeis University) 교수, 마이클 영 록펠러대(Rockefeller University) 교수에게 돌아갔다.
이처럼 수면과 각성 등 인간의 생체리듬 관련 연구는 끊임없이 이뤄지고 있다. 빛이 생리적 작용에 관여한다는 사실은 2000년대 초반 인간의 망막에서 제3의 광수용세포가 발견된 이후 꾸준히 연구되고 있다.
제3의 광수용세포는 기존의 간상세포나 원추세포와는 달리 비 시각적인 것에 반응하고 뇌에 전달되는 경로도 다르다. 특히 이 세포는 빛의 파란색 영역에 가장 민감해 이를 통해 각성 등 여러 생리적 현상이 발생할 뿐 아니라 뇌파, 멜라토닌 분비, 심전도 등에도 영향을 미친다는 사실이 밝혀졌다.
그러나 관련 기존 연구는 푸른 빛의 강한 레이저를 직접 조사하는 한정적인 조건에서 실험이 이뤄지기 때문에 결과를 일상에 접목하기가 어려웠다. 또한 기존 연구 대부분은 푸른 빛을 저녁이나 늦은 오후에 접하면 멜라토닌 분비가 억제돼 숙면을 방해한다는 사실을 규명하는 데에만 주력했다.
연구팀은 푸른 빛이 저녁에는 숙면에 방해될 수 있지만, 때와 장소에 따라서는 이로운 빛으로 활용할 수 있음을 증명하기 위해 노력했다. 오전에 쬐는 청백색의 빛은 인체를 잠에서 깨워 생체리듬을 조절하는 데 긍정적인 영향을 미친다는 사실을 밝혀냈다.
연구팀은 우리 대학 학생 15명을 대상으로 실험을 진행했고 호르몬과 타액 변화 등의 생리적 지표와 설문조사를 통한 주관적 지표를 동시에 관찰했다. 이 결과 빛의 색 변화에 따라 감성 등을 나타낸 주관적 지표와 멜라토닌 분비에 변화가 일어남을 확인했다.
최경아 연구교수는 박사과정 시절 학습 환경의 조명이 학생들의 학습 활동에 미치는 영향을 밝힌 바 있다. (논문명: Dynamic lighting system for the learning environment: performance of elementary students). 이번 연구를 통해 조명의 빛깔이 사람에게 미치는 영향을 하루 주기와 접목해 더욱 심화된 결과를 얻은 것이다.
석현정 교수는 “처음에는 단순히 조명을 다양하게 바꿔가며 구성원들을 편하게 쉬게 해주려는 의도에서 시작해, 호텔이나 레스토랑, 모닥불 등의 조명에서는 편안해지고 흰색 조명에서는 긴장감이 발생하는 이유를 명쾌하게 밝히고자 했다”라며 “과학적 근거와 고도화를 통해 신뢰성이 있는 데이터를 수집했고 많은 사람이 혜택을 볼 수 있는 결과를 얻었다고 생각한다”라고 말했다.
최경아 연구교수는 “이와 같은 조명 시스템의 진화가 실내 건축물뿐 아니라 자동차 내부와 지하주차장 세탁기, 냉장고 등 각종 전자기기에도 적용될 수 있다”고 밝혔다. 또한 스마트 조명 시스템을 달력, 출장 앱과 연동한다면 자동 학습을 통해 인간의 생체리듬과 권장 수면시간 및 기상 시간에 맞춰 조명의 색과 세기를 조절할 수도 있을 것으로 전망했다.
석현정 교수는 “학문마다 중요시하는 관점이 달라 디자인학자로서 자연과학의 기준을 통과하기가 쉽지 않았다. 꼼꼼히 설계하고 유의미한 데이터를 축적하는 데 큰 노력을 기울여 좋은 결과가 나온 것 같다”라며 “인간 중심의 조명이 우리 일상생활에 성공적으로 적용될 기회는 무궁무진하다”라고 말했다.
최경아 연구교수는 “빛을 단순히 공간을 밝히는 용도를 넘어 사용자의 경험을 한층 더 풍요롭게 하는 중요한 도구로 인식하는 데서 시작된 연구이다”라며 “학문 간 경계를 허물고 우리 연구를 읽어주는 독자의 스펙트럼이 확대된다는 데 의의가 있다고 생각한다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 낮과 밤의 멜라토닌 분비량의 변화 그래프
2019.02.28 조회수 19965
석현정, 최경아 교수 청백색 조명이 아침잠 깨워주는 효과 입증
〈 왼쪽부터 정현정 교수, 석현정 교수, 김태수 박사과정, 최경아 연구교수 〉
출근과 등교. 이 두 단어는 대부분의 직장인과 학생에게 유쾌하지 않다. 회식, 인터넷 강의, 스마트폰, 육아 등으로 인해 부족해진 아침잠은 쉽사리 사라지지 않는다. 하지만 우리가 매일 접하는 빛을 통해 오전의 나른함을 깨우고 생체리듬을 유지할 수 있다는 연구 결과가 발표됐다.
우리 대학 산업디자인학과 석현정 교수, 최경아 연구교수가 높은 색의 온도를 갖는 청백색(blue-enriched white)의 푸른 빛이 아침잠을 깨우는 데 효과적임을 밝혀냈다.
이 연구는 인간 중심의 조명이 나아가야 할 방향을 제시한 것으로, 인공적인 조명 시스템을 변화하는 데 긍정적인 영향을 끼칠 것으로 기대된다.
특히 이번 연구는 산업디자인학과 소속 교수와 연구원이 교신저자 및 1 저자로 참여해 순수과학 분야 저널에 논문을 게재했다. 이는 세계적으로도 찾기 힘든 사례로 디자인학과 자연과학의 우수 융합 연구의 표본이 될 것으로 예상된다.
최경아 연구교수가 1 저자, 나노과학기술대학원 정현정 교수가 참여한 이번 연구는 국제 학술지 ‘사이언티픽 리포트(Scientific Reports)’ 1월 23일 자에 게재됐다. (논문명 : Awakening effects of blue-enriched morning light exposure on university students’ physiological and subjective responses)
2017년도 노벨 생리의학상은 태양의 주기에 따라 아침, 저녁으로 몸의 변화가 규칙적으로 일어나는 서카디안(circadian) 리듬, 즉 생체리듬을 조절하는 유전자를 규명한 미국의 과학자 제프리 홀 메인대(University Of Maine) 교수, 마이클 로스바시 브랜다이스대(Brandeis University) 교수, 마이클 영 록펠러대(Rockefeller University) 교수에게 돌아갔다.
이처럼 수면과 각성 등 인간의 생체리듬 관련 연구는 끊임없이 이뤄지고 있다. 빛이 생리적 작용에 관여한다는 사실은 2000년대 초반 인간의 망막에서 제3의 광수용세포가 발견된 이후 꾸준히 연구되고 있다.
제3의 광수용세포는 기존의 간상세포나 원추세포와는 달리 비 시각적인 것에 반응하고 뇌에 전달되는 경로도 다르다. 특히 이 세포는 빛의 파란색 영역에 가장 민감해 이를 통해 각성 등 여러 생리적 현상이 발생할 뿐 아니라 뇌파, 멜라토닌 분비, 심전도 등에도 영향을 미친다는 사실이 밝혀졌다.
그러나 관련 기존 연구는 푸른 빛의 강한 레이저를 직접 조사하는 한정적인 조건에서 실험이 이뤄지기 때문에 결과를 일상에 접목하기가 어려웠다. 또한 기존 연구 대부분은 푸른 빛을 저녁이나 늦은 오후에 접하면 멜라토닌 분비가 억제돼 숙면을 방해한다는 사실을 규명하는 데에만 주력했다.
연구팀은 푸른 빛이 저녁에는 숙면에 방해될 수 있지만, 때와 장소에 따라서는 이로운 빛으로 활용할 수 있음을 증명하기 위해 노력했다. 오전에 쬐는 청백색의 빛은 인체를 잠에서 깨워 생체리듬을 조절하는 데 긍정적인 영향을 미친다는 사실을 밝혀냈다.
연구팀은 우리 대학 학생 15명을 대상으로 실험을 진행했고 호르몬과 타액 변화 등의 생리적 지표와 설문조사를 통한 주관적 지표를 동시에 관찰했다. 이 결과 빛의 색 변화에 따라 감성 등을 나타낸 주관적 지표와 멜라토닌 분비에 변화가 일어남을 확인했다.
최경아 연구교수는 박사과정 시절 학습 환경의 조명이 학생들의 학습 활동에 미치는 영향을 밝힌 바 있다. (논문명: Dynamic lighting system for the learning environment: performance of elementary students). 이번 연구를 통해 조명의 빛깔이 사람에게 미치는 영향을 하루 주기와 접목해 더욱 심화된 결과를 얻은 것이다.
석현정 교수는 “처음에는 단순히 조명을 다양하게 바꿔가며 구성원들을 편하게 쉬게 해주려는 의도에서 시작해, 호텔이나 레스토랑, 모닥불 등의 조명에서는 편안해지고 흰색 조명에서는 긴장감이 발생하는 이유를 명쾌하게 밝히고자 했다”라며 “과학적 근거와 고도화를 통해 신뢰성이 있는 데이터를 수집했고 많은 사람이 혜택을 볼 수 있는 결과를 얻었다고 생각한다”라고 말했다.
최경아 연구교수는 “이와 같은 조명 시스템의 진화가 실내 건축물뿐 아니라 자동차 내부와 지하주차장 세탁기, 냉장고 등 각종 전자기기에도 적용될 수 있다”고 밝혔다. 또한 스마트 조명 시스템을 달력, 출장 앱과 연동한다면 자동 학습을 통해 인간의 생체리듬과 권장 수면시간 및 기상 시간에 맞춰 조명의 색과 세기를 조절할 수도 있을 것으로 전망했다.
석현정 교수는 “학문마다 중요시하는 관점이 달라 디자인학자로서 자연과학의 기준을 통과하기가 쉽지 않았다. 꼼꼼히 설계하고 유의미한 데이터를 축적하는 데 큰 노력을 기울여 좋은 결과가 나온 것 같다”라며 “인간 중심의 조명이 우리 일상생활에 성공적으로 적용될 기회는 무궁무진하다”라고 말했다.
최경아 연구교수는 “빛을 단순히 공간을 밝히는 용도를 넘어 사용자의 경험을 한층 더 풍요롭게 하는 중요한 도구로 인식하는 데서 시작된 연구이다”라며 “학문 간 경계를 허물고 우리 연구를 읽어주는 독자의 스펙트럼이 확대된다는 데 의의가 있다고 생각한다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 낮과 밤의 멜라토닌 분비량의 변화 그래프
2019.02.28 조회수 19965 장석복 교수, 한 종류의 분자만 선택적으로 합성할 수 있는 새 촉매 개발
〈 박윤수 연구원, 장석복 교수 〉
자연계의 많은 분자들은 자신과 똑 닮은 ‘쌍둥이 분자’를 갖고 있다. 이들은 구성하는 원소의 종류와 개수가 같아도 서로 완전히 다른 성질을 나타낸다. 특히 쌍둥이 분자가 서로를 거울에 비친 모습과 같은 형상을 띈 경우를 ‘거울상 이성질체’라고 한다.
우리 대학 화학과 장석복 교수(IBS 분자활성 촉매반응 연구단장)와 IBS 박윤수 연구원은 두 개의 거울상 이성질체 중 한 종류의 분자만을 선택적으로 합성할 수 있는 새로운 촉매를 개발했다. 또 이 촉매를 이용해 자연에 풍부한 탄화수소화합물을 의약품의 필수재료인 카이랄 락탐으로 제조하는 데도 성공했다.
거울상 이성질체는 왼손과 오른손처럼 서로를 거울에 비춰보면 같은 모양이지만, 아무리 회전시켜도 겹칠 수 없는 이성질체를 말한다. 거울상 이성질성 또는 카이랄성(Chirality)이라고 불리는 이 특성은 의약품 개발에도 매우 중요하다. DNA, 단백질 등 생체물질 역시 카이랄성을 지녀 개발된 약물의 유형에 따라 각각 다른 생리활성을 나타내기 때문이다. 또 한 쪽 유형이 유용할지라도, 다른 유형의 이성질체는 독약이 될 수도 있다. 하지만 유용한 이성질체만을 선택적으로 합성하는 비대칭반응(asymmetric synthesis)은 아직까지 현대 화학의 난제로 꼽히고 있다.
연구진은 새로운 촉매 개발로 이 난제를 해결했다. 연구팀은 2018년 3월 국제학술지 ‘사이언스(Science)’에 자연계에 풍부한 탄화수소를 고부가가치의 감마-락탐 화합물로 전환시키는 이리듐 촉매 개발 성과를 발표한 바 있다. 하지만 당시 개발된 촉매 역시 두 가지 형태의 거울상 이성질체가 선택성 없이 모두 얻어진다는 단점이 있었다.
이번 연구에서 연구진은 수십여 개의 후보 촉매 중 카이랄 다이아민(Chiral Diamine) 골격을 포함한 이리듐 촉매가 99% 이상의 정확도로 거울상을 선택할 수 있음을 발견했다. 개발된 촉매는 필요에 따라 카이랄성 감마-락탐을 골라서 합성할 수 있다. 왼손잡이성 이리듐 촉매를 사용할 경우엔 왼손잡이성 감마-락탐이, 오른잡이성 이리듐 촉매를 사용하면 오른손잡이성 감마-락탐을 제조할 수 있다.
이후 연구진은 계산화학 시뮬레이션 연구를 통해 높은 선택성의 원인을 분석했다. 가령, 왼손잡이성 촉매를 사용한 경우에는 락탐의 합성과정에서 카이랄 다이아민 촉매와 탄화수소화합물 사이에는 일시적인 수소 결합이 발생하고, 이로 인해 왼손잡이성 락탐 형성이 촉진된다는 사실을 확인했다.
연구진은 개발한 촉매를 통해 다양한 구조를 갖는 카이랄 락탐 화합물을 합성하는 데도 성공했다. 이렇게 합성된 카이랄 락탐은 독특한 입체적 특성 때문에 생체 단백질과의 상호작용이 유용하다. 특히 우리 신체를 구성하는 아미노산 유도체나, 천연물도 모두 카이랄성 분자인 만큼, 신체 내 생리활성을 효과적으로 높인 약물 개발이 가능할 것으로 기대된다.
이번 연구를 이끈 장석복 단장은 “약효를 갖는 의약품의 핵심 단위만 선택적으로 제조할 수 있는 기술로 향후 유기합성 및 의약분야 연구로 이어져 부작용을 덜고 효과는 높인 신약개발까지 이어지리라 기대한다”며 “자연계에 풍부한 탄화수소화합물을 재료로 고부가가치 원료를 제조할 수 있다는 경제적 효과도 있다”고 말했다.
연구성과는 화학분야 권위지인 네이처 카탈리시스(Nature Catalysis) 2월 19일자(한국시간) 온라인 판에 실렸다.
□ 그림 설명
그림1. 비대칭반응을 통한 카이랄성 감마-락탐 합성
그림2. 연구 성과 개요
2019.02.19 조회수 15781
장석복 교수, 한 종류의 분자만 선택적으로 합성할 수 있는 새 촉매 개발
〈 박윤수 연구원, 장석복 교수 〉
자연계의 많은 분자들은 자신과 똑 닮은 ‘쌍둥이 분자’를 갖고 있다. 이들은 구성하는 원소의 종류와 개수가 같아도 서로 완전히 다른 성질을 나타낸다. 특히 쌍둥이 분자가 서로를 거울에 비친 모습과 같은 형상을 띈 경우를 ‘거울상 이성질체’라고 한다.
우리 대학 화학과 장석복 교수(IBS 분자활성 촉매반응 연구단장)와 IBS 박윤수 연구원은 두 개의 거울상 이성질체 중 한 종류의 분자만을 선택적으로 합성할 수 있는 새로운 촉매를 개발했다. 또 이 촉매를 이용해 자연에 풍부한 탄화수소화합물을 의약품의 필수재료인 카이랄 락탐으로 제조하는 데도 성공했다.
거울상 이성질체는 왼손과 오른손처럼 서로를 거울에 비춰보면 같은 모양이지만, 아무리 회전시켜도 겹칠 수 없는 이성질체를 말한다. 거울상 이성질성 또는 카이랄성(Chirality)이라고 불리는 이 특성은 의약품 개발에도 매우 중요하다. DNA, 단백질 등 생체물질 역시 카이랄성을 지녀 개발된 약물의 유형에 따라 각각 다른 생리활성을 나타내기 때문이다. 또 한 쪽 유형이 유용할지라도, 다른 유형의 이성질체는 독약이 될 수도 있다. 하지만 유용한 이성질체만을 선택적으로 합성하는 비대칭반응(asymmetric synthesis)은 아직까지 현대 화학의 난제로 꼽히고 있다.
연구진은 새로운 촉매 개발로 이 난제를 해결했다. 연구팀은 2018년 3월 국제학술지 ‘사이언스(Science)’에 자연계에 풍부한 탄화수소를 고부가가치의 감마-락탐 화합물로 전환시키는 이리듐 촉매 개발 성과를 발표한 바 있다. 하지만 당시 개발된 촉매 역시 두 가지 형태의 거울상 이성질체가 선택성 없이 모두 얻어진다는 단점이 있었다.
이번 연구에서 연구진은 수십여 개의 후보 촉매 중 카이랄 다이아민(Chiral Diamine) 골격을 포함한 이리듐 촉매가 99% 이상의 정확도로 거울상을 선택할 수 있음을 발견했다. 개발된 촉매는 필요에 따라 카이랄성 감마-락탐을 골라서 합성할 수 있다. 왼손잡이성 이리듐 촉매를 사용할 경우엔 왼손잡이성 감마-락탐이, 오른잡이성 이리듐 촉매를 사용하면 오른손잡이성 감마-락탐을 제조할 수 있다.
이후 연구진은 계산화학 시뮬레이션 연구를 통해 높은 선택성의 원인을 분석했다. 가령, 왼손잡이성 촉매를 사용한 경우에는 락탐의 합성과정에서 카이랄 다이아민 촉매와 탄화수소화합물 사이에는 일시적인 수소 결합이 발생하고, 이로 인해 왼손잡이성 락탐 형성이 촉진된다는 사실을 확인했다.
연구진은 개발한 촉매를 통해 다양한 구조를 갖는 카이랄 락탐 화합물을 합성하는 데도 성공했다. 이렇게 합성된 카이랄 락탐은 독특한 입체적 특성 때문에 생체 단백질과의 상호작용이 유용하다. 특히 우리 신체를 구성하는 아미노산 유도체나, 천연물도 모두 카이랄성 분자인 만큼, 신체 내 생리활성을 효과적으로 높인 약물 개발이 가능할 것으로 기대된다.
이번 연구를 이끈 장석복 단장은 “약효를 갖는 의약품의 핵심 단위만 선택적으로 제조할 수 있는 기술로 향후 유기합성 및 의약분야 연구로 이어져 부작용을 덜고 효과는 높인 신약개발까지 이어지리라 기대한다”며 “자연계에 풍부한 탄화수소화합물을 재료로 고부가가치 원료를 제조할 수 있다는 경제적 효과도 있다”고 말했다.
연구성과는 화학분야 권위지인 네이처 카탈리시스(Nature Catalysis) 2월 19일자(한국시간) 온라인 판에 실렸다.
□ 그림 설명
그림1. 비대칭반응을 통한 카이랄성 감마-락탐 합성
그림2. 연구 성과 개요
2019.02.19 조회수 15781 유승협 교수, 초저전력 심박 및 산소포화도 센서 구현
〈 유승협 교수, 이현우 박사과정〉
우리 대학 전기및전자공학부 유승협 교수 연구팀이 유기발광다이오드(OLED)와 유기포토다이오드(OPD)를 이용해 초저전력 심박 및 산소포화도 센서 구현에 성공했다.
전기및전자공학부 유회준 교수 연구팀과의 협력을 통해 이뤄진 것으로 이 기술을 통해 심박 및 산소포화도 센서가 다양한 웨어러블 기기에 적용될 수 있는 계기가 될 것으로 기대된다.
이현우 박사과정이 1저자로 참여한 이번 연구는 ‘사이언스 어드밴스 (Science Advances)’11월 9일자 온라인 판에 게재됐다. (논문명 : Toward all-day wearable health monitoring: An ultralow-power, reflective organic pulse oximetry sensing patch)
심박 및 산소포화도 센서는 신체의 건강 상태를 나타내는 가장 중요한 생체 신호의 하나인 심장 박동과 혈액 내 산소와 결합한 헤모글로빈의 농도로서 신체 내 원활한 산소 공급 여부를 가늠할 수 있는 산소포화도를 측정하는 기기이다.
심박 및 산소포화도 센서에는 일반적으로 LED와 포토다이오드로 구성된 광학적 방법이 이용된다. 이 기술은 간단하고 소형화가 용이한 비 침습적 방법이면서 주요 생체신호의 모니터링이 가능하다는 이점이 있어 병원용 기기뿐 아니라 스마트 워치 등 웨어러블 기기에도 탑재되는 경우가 많다.
이러한 센서는 배터리 용량이 매우 제한적인 웨어러블 기기의 특성상 센서의 전력소모를 줄이는 것이 매우 중요하다.
그러나 현재 상용 심박 및 산소포화도 센서는 이산소자들의 배열로 구성돼 피부에서 산란으로 인해 전방위로 전달되는 빛을 효율적으로 감지하기 어렵다. 이러한 이유로 좀 더 강한 빛을 필요로 하기 때문에 장기간 실시간 모니터링에는 한계가 있다.
연구팀은 문제 해결을 위해 광원의 발광 파장에 따른 피부에서의 빛의 전달 형태를 실험과 피부 모델 시뮬레이션을 통해 검토했다. 유기소자의 경우 자유로운 패턴 구현이 용이한 점을 최대한 이용해 유기포토다이오드가 유기발광다이오드를 동심원 형태로 감싸 피부에서 전방위로 분포되는 빛을 효율적으로 감지하는 최적 구조를 갖는 유연 심박 및 산소포화도 센서를 구현했다.
이를 통해 평균소비전력 약 0.03밀리와트(mW)만으로도 심박 및 산소포화도를 측정할 수 있었다. 이는 LED와 PD가 일렬로 배치된 상용 센서가 갖는 통상 전력소모 양의 약 수십 분의 일에 해당하는 매우 작은 값으로 24시간 동작에도 1밀리와트시(mWh)가 채 되지 않는 양이다.
이 기술은 매우 낮은 전력 소모 외에도 유기소자가 갖는 유연 소자의 형태적 자유도도 그대로 갖는다. 따라서 스마트 워치부터 작게는 무선 이어폰, 스마트 반지, 인체 부착형 패치 등의 웨어러블 기기에서 배터리로 인한 제한을 최소화하면서 일상에 지장 없이 지속적인 생체 신호 모니터링을 가능하게 할 것으로 기대된다.
유승협 교수는 “생체 신호의 지속적인 모니터링은 건강의 이상 신호를 상시 검출 할 수 있게 할 뿐 아니라 향후 빅데이터 등과 연계하면 이들 생체신호의 특정 패턴과 질병 간의 상호 관계를 알아내는 등에도 활용될 수 있다.”고 말했다.
이번 연구는 과학기술정보통신부 한국연구재단-나노·소재원천기술개발사업 및 선도연구센터 사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 연구팀이 개발한 센서
2018.11.12 조회수 15619
유승협 교수, 초저전력 심박 및 산소포화도 센서 구현
〈 유승협 교수, 이현우 박사과정〉
우리 대학 전기및전자공학부 유승협 교수 연구팀이 유기발광다이오드(OLED)와 유기포토다이오드(OPD)를 이용해 초저전력 심박 및 산소포화도 센서 구현에 성공했다.
전기및전자공학부 유회준 교수 연구팀과의 협력을 통해 이뤄진 것으로 이 기술을 통해 심박 및 산소포화도 센서가 다양한 웨어러블 기기에 적용될 수 있는 계기가 될 것으로 기대된다.
이현우 박사과정이 1저자로 참여한 이번 연구는 ‘사이언스 어드밴스 (Science Advances)’11월 9일자 온라인 판에 게재됐다. (논문명 : Toward all-day wearable health monitoring: An ultralow-power, reflective organic pulse oximetry sensing patch)
심박 및 산소포화도 센서는 신체의 건강 상태를 나타내는 가장 중요한 생체 신호의 하나인 심장 박동과 혈액 내 산소와 결합한 헤모글로빈의 농도로서 신체 내 원활한 산소 공급 여부를 가늠할 수 있는 산소포화도를 측정하는 기기이다.
심박 및 산소포화도 센서에는 일반적으로 LED와 포토다이오드로 구성된 광학적 방법이 이용된다. 이 기술은 간단하고 소형화가 용이한 비 침습적 방법이면서 주요 생체신호의 모니터링이 가능하다는 이점이 있어 병원용 기기뿐 아니라 스마트 워치 등 웨어러블 기기에도 탑재되는 경우가 많다.
이러한 센서는 배터리 용량이 매우 제한적인 웨어러블 기기의 특성상 센서의 전력소모를 줄이는 것이 매우 중요하다.
그러나 현재 상용 심박 및 산소포화도 센서는 이산소자들의 배열로 구성돼 피부에서 산란으로 인해 전방위로 전달되는 빛을 효율적으로 감지하기 어렵다. 이러한 이유로 좀 더 강한 빛을 필요로 하기 때문에 장기간 실시간 모니터링에는 한계가 있다.
연구팀은 문제 해결을 위해 광원의 발광 파장에 따른 피부에서의 빛의 전달 형태를 실험과 피부 모델 시뮬레이션을 통해 검토했다. 유기소자의 경우 자유로운 패턴 구현이 용이한 점을 최대한 이용해 유기포토다이오드가 유기발광다이오드를 동심원 형태로 감싸 피부에서 전방위로 분포되는 빛을 효율적으로 감지하는 최적 구조를 갖는 유연 심박 및 산소포화도 센서를 구현했다.
이를 통해 평균소비전력 약 0.03밀리와트(mW)만으로도 심박 및 산소포화도를 측정할 수 있었다. 이는 LED와 PD가 일렬로 배치된 상용 센서가 갖는 통상 전력소모 양의 약 수십 분의 일에 해당하는 매우 작은 값으로 24시간 동작에도 1밀리와트시(mWh)가 채 되지 않는 양이다.
이 기술은 매우 낮은 전력 소모 외에도 유기소자가 갖는 유연 소자의 형태적 자유도도 그대로 갖는다. 따라서 스마트 워치부터 작게는 무선 이어폰, 스마트 반지, 인체 부착형 패치 등의 웨어러블 기기에서 배터리로 인한 제한을 최소화하면서 일상에 지장 없이 지속적인 생체 신호 모니터링을 가능하게 할 것으로 기대된다.
유승협 교수는 “생체 신호의 지속적인 모니터링은 건강의 이상 신호를 상시 검출 할 수 있게 할 뿐 아니라 향후 빅데이터 등과 연계하면 이들 생체신호의 특정 패턴과 질병 간의 상호 관계를 알아내는 등에도 활용될 수 있다.”고 말했다.
이번 연구는 과학기술정보통신부 한국연구재단-나노·소재원천기술개발사업 및 선도연구센터 사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 연구팀이 개발한 센서
2018.11.12 조회수 15619 김신현 교수, 달걀 속 살충제 성분, 현장 즉시 검출 기술 개발
〈 김신현 교수, 김동재 박사과정 〉
우리 대학 생명화학공학과 김신현 교수 연구팀과 재료연구소(소장 이정환) 김동호 박사 공동 연구팀이 생체 시료에 들어있는 미량의 분자를 직접 검출할 수 있는 센서를 개발했다.
연구팀은 개발한 센서를 통해 다양한 종류의 살충제 성분을 검출하는데 성공했다. 특히 국내 및 유럽에서 문제가 됐던 달걀 속 살충제 성분인 피프로닐 술폰(Fipronil sulfone)을 시료 전처리 없이 검출할 수 있음을 증명했다.
연구팀의 센서는 전하를 띠는 하이드로젤 미세입자 내부에 금 나노입자 응집체를 캡슐화한 형태로 생체 시료 내에 존재하는 분자를 직접 분석해야 하는 광범위한 분야에 적용 가능할 것으로 기대된다.
김동재 박사과정이 1저자로 참여한 이번 연구는 나노분야의 국제 학술지 ‘스몰(Small)’ 10월 4일자 내부표지 논문으로 게재됐다.(논문명 : SERS-Active Charged Microgels for Size- and Charge-Selective Molecular Analysis of Complex Biological Samples, 생체 시료의 분자 크기 및 전하 선택적 분석을 위한 표면증강라만산란용 마이크로젤)
분자가 레이저에 노출되면 ‘분자 지문’이라고 불리는 고유의 라만(Raman) 신호를 보인다. 하지만 일반적으로 라만 신호의 세기는 매우 낮아 실질적인 분자 감지에 사용이 어렵다.
연구팀은 금속 나노구조의 표면에서 발생하는 표면 플라즈몬 공명 현상이 강한 세기의 기장을 형성하는 점을 이용해 라만신호를 현저히 증가시켰다. 이를 표면증강라만산란 현상이라고 한다.
이 표면증강라만산란 현상에 의해 금속 나노구조 표면에 존재하는 분자의 라만신호는 크게 증가시킬 수 있지만 이를 일반적인 생체 시료에 직접 적용하는 것은 어렵다. 생체 시료에 존재하는 다양한 크기의 단백질들이 금속 표면에 비가역적으로 흡착해 실제 분석이 필요한 분자의 접근을 막기 때문이다.
일반적으로 사용되는 생체 시료 분석법은 대형 장비를 이용한 시료 전처리 과정이 필수이다. 하지만 이로 인해 시료의 신속한 현장 분석이 어려워 시간과 비용을 증가시킨다.
연구팀은 시료의 정제 과정 없이 분자를 직접 검출하기 위해 하이드로젤에 주목했다. 하이드로젤은 친수성(親水性) 나노 그물 구조를 이루고 있어 단백질처럼 크기가 큰 분자는 배제하고 작은 크기의 분자만을 내부로 확산시킨다. 또한 하이드로젤이 전하를 띠는 경우 반대 전하를 띠고 있는 분자를 선택적으로 흡착시켜 농축할 수 있다.
연구팀은 이러한 원리를 센서 구현에 적용시키기 위해 미세유체기술을 이용했다. 이를 통해 금 나노입자 응집체를 형성하는 동시에 전하를 띠는 하이드로젤 미세입자 안에 캡슐화 하는데 성공했다.
하이드로젤 미세 입자는 생체 시료에 도입돼 단백질로부터 금 나노입자 응집체를 보호하고, 동시에 반대 전하를 띠는 표적 분자를 응집체 표면에 선택적으로 농축시킨다. 이를 통해 표적 분자의 라만 신호는 단백질의 방해 없이 증대되며 시료의 전처리 과정 없이 빠르고 정확한 분자 검출이 가능해진다.
김신현 교수는 “새롭게 개발한 라만 센서는 식품 내 살충제 성분 검출 뿐 아니라 혈액과 소변, 땀 등 인체 속 시료에 들어있는 약물, 마약 성분 등 다양한 바이오마커의 직접 검출에도 사용 가능하다”고 말했다.
재료연구소 김동호 박사는 “시료 전처리가 필요없기 때문에 현장에서 시료의 직접 분석이 가능해 시간과 비용의 혁신적 절감이 가능해질 것이다”고 말했다.
이번 연구결과는 재료연구소의 기관 주요사업과 한국연구재단의 중견연구자지원사업 및 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. small 저널 내부표지
그림2. 시료 전처리 없이 분자 선택적 라만 분석이 가능한 하이드로젤 기반 라만 센서의 원리
그림3. 분자 전하 선택적 농축 및 배제를 보여주는 현미경 사진
2018.10.18 조회수 15238
김신현 교수, 달걀 속 살충제 성분, 현장 즉시 검출 기술 개발
〈 김신현 교수, 김동재 박사과정 〉
우리 대학 생명화학공학과 김신현 교수 연구팀과 재료연구소(소장 이정환) 김동호 박사 공동 연구팀이 생체 시료에 들어있는 미량의 분자를 직접 검출할 수 있는 센서를 개발했다.
연구팀은 개발한 센서를 통해 다양한 종류의 살충제 성분을 검출하는데 성공했다. 특히 국내 및 유럽에서 문제가 됐던 달걀 속 살충제 성분인 피프로닐 술폰(Fipronil sulfone)을 시료 전처리 없이 검출할 수 있음을 증명했다.
연구팀의 센서는 전하를 띠는 하이드로젤 미세입자 내부에 금 나노입자 응집체를 캡슐화한 형태로 생체 시료 내에 존재하는 분자를 직접 분석해야 하는 광범위한 분야에 적용 가능할 것으로 기대된다.
김동재 박사과정이 1저자로 참여한 이번 연구는 나노분야의 국제 학술지 ‘스몰(Small)’ 10월 4일자 내부표지 논문으로 게재됐다.(논문명 : SERS-Active Charged Microgels for Size- and Charge-Selective Molecular Analysis of Complex Biological Samples, 생체 시료의 분자 크기 및 전하 선택적 분석을 위한 표면증강라만산란용 마이크로젤)
분자가 레이저에 노출되면 ‘분자 지문’이라고 불리는 고유의 라만(Raman) 신호를 보인다. 하지만 일반적으로 라만 신호의 세기는 매우 낮아 실질적인 분자 감지에 사용이 어렵다.
연구팀은 금속 나노구조의 표면에서 발생하는 표면 플라즈몬 공명 현상이 강한 세기의 기장을 형성하는 점을 이용해 라만신호를 현저히 증가시켰다. 이를 표면증강라만산란 현상이라고 한다.
이 표면증강라만산란 현상에 의해 금속 나노구조 표면에 존재하는 분자의 라만신호는 크게 증가시킬 수 있지만 이를 일반적인 생체 시료에 직접 적용하는 것은 어렵다. 생체 시료에 존재하는 다양한 크기의 단백질들이 금속 표면에 비가역적으로 흡착해 실제 분석이 필요한 분자의 접근을 막기 때문이다.
일반적으로 사용되는 생체 시료 분석법은 대형 장비를 이용한 시료 전처리 과정이 필수이다. 하지만 이로 인해 시료의 신속한 현장 분석이 어려워 시간과 비용을 증가시킨다.
연구팀은 시료의 정제 과정 없이 분자를 직접 검출하기 위해 하이드로젤에 주목했다. 하이드로젤은 친수성(親水性) 나노 그물 구조를 이루고 있어 단백질처럼 크기가 큰 분자는 배제하고 작은 크기의 분자만을 내부로 확산시킨다. 또한 하이드로젤이 전하를 띠는 경우 반대 전하를 띠고 있는 분자를 선택적으로 흡착시켜 농축할 수 있다.
연구팀은 이러한 원리를 센서 구현에 적용시키기 위해 미세유체기술을 이용했다. 이를 통해 금 나노입자 응집체를 형성하는 동시에 전하를 띠는 하이드로젤 미세입자 안에 캡슐화 하는데 성공했다.
하이드로젤 미세 입자는 생체 시료에 도입돼 단백질로부터 금 나노입자 응집체를 보호하고, 동시에 반대 전하를 띠는 표적 분자를 응집체 표면에 선택적으로 농축시킨다. 이를 통해 표적 분자의 라만 신호는 단백질의 방해 없이 증대되며 시료의 전처리 과정 없이 빠르고 정확한 분자 검출이 가능해진다.
김신현 교수는 “새롭게 개발한 라만 센서는 식품 내 살충제 성분 검출 뿐 아니라 혈액과 소변, 땀 등 인체 속 시료에 들어있는 약물, 마약 성분 등 다양한 바이오마커의 직접 검출에도 사용 가능하다”고 말했다.
재료연구소 김동호 박사는 “시료 전처리가 필요없기 때문에 현장에서 시료의 직접 분석이 가능해 시간과 비용의 혁신적 절감이 가능해질 것이다”고 말했다.
이번 연구결과는 재료연구소의 기관 주요사업과 한국연구재단의 중견연구자지원사업 및 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. small 저널 내부표지
그림2. 시료 전처리 없이 분자 선택적 라만 분석이 가능한 하이드로젤 기반 라만 센서의 원리
그림3. 분자 전하 선택적 농축 및 배제를 보여주는 현미경 사진
2018.10.18 조회수 15238 이건재 교수, 유창동 교수, 유연 압전 화자인식 음성센서 개발
〈 이 건 재 교수 〉
우리 대학 신소재공학과 이건재 교수와 전기및전자공학부 유창동 교수 공동 연구팀이 인공지능 기반의 화자(話者) 인식용 유연 압전 음성센서를 개발했다.
이번 연구를 통해 개인별 음성 서비스를 스마트 홈 가전이나 인공지능 비서, 생체 인증 분야 등 차세대 기술에 활용 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘나노 에너지(Nano Energy)’ 9월호에 ‘민감도’와 ‘화자인식’ 논문 두 편으로 동시 게재됐고 현재 관련 기술은 실용화 단계에 있다. (민감도 논문 : Basilar Membrane-Inspired Self-Powered Acoustic Sensor Enabled by Highly Sensitive Multi Tunable Frequency Band, 화자인식 논문 : Machine Learning-based Self-powered Acoustic Sensor for Speaker Recognition)
음성 센서는 인간과 기계 사이의 자유로운 소통을 가능하게 만드는 가장 직관적인 수단으로 4차 산업혁명의 핵심 기술로 주목받고 있다. 음성센서 시장은 2021년 대략 160억 달러 규모로 커질 것으로 예상된다.
그러나 현재 산업계에서는 음성 신호 수신 시 정전용량을 측정하는 콘덴서 형식을 사용하기 때문에 민감도가 낮고 인식 거리가 짧아 화자 인식률에 한계가 있다.
이번 연구에서 이 교수 연구팀은 인간의 달팽이관을 모사해 주파수에 따라 다른 영역이 진동하는 사다리꼴의 얇은 막을 제작했다. 음성신호에 따른 공진형 진동을 유연 압전 물질을 통해 감지하는 자가발전 고민감 음성 센서를 개발했다.
연구팀의 음성 센서는 기존 기술 대비 2배 이상 높은 민감도를 가져 미세한 음성 신호를 원거리에서도 감지할 수 있다. 또한 다채널로 신호를 받아들여 하나의 언어에 대해 복수 개의 데이터를 얻을 수 있다.
이 기술을 기반으로 누가 이야기하는지 찾아내는 화자인식 시스템에 적용해 97.5%의 화자인식 성공률을 무향실에서 달성했고 기존 기술 대비 오류를 75% 이상 줄였다.
화자인식 서비스는 음성 분야에 세상을 바꿀 next big thing으로 기대를 받고 있다. 기존 기술은 소프트웨어 업그레이드를 통한 접근으로 인식률에 한계가 있었지만 연구팀의 기술은 하드웨어 센서를 개발함으로써 능력을 크게 향상시켰다. 추후 첨단 소프트웨어를 접목한다면 다양한 환경에서도 화자 및 음성 인식률을 높일 수 있을 것으로 예상된다.
이건재 교수는 “이번에 개발한 머신 러닝 기반 고민감 유연 압전 음성센서는 화자를 정확하게 구별할 수 있기 때문에 개인별 음성 서비스를 스마트 가전이나 인공지능 비서에 접목할 수 있을 것이며 생체 인증 및 핀테크와 같은 보안 분야에서도 큰 역할을 할 수 있을 것이다”고 말했다.
이번 연구는 스마트 IT 융합시스템 연구단의 지원을 받아 수행됐다.
<관련 영상>
https://www.youtube.com/watch?v=QGEVJxCFVpc&feature=youtu.be
□ 그림 설명
그림1. 인간의 달팽이관을 모사한 유연 압전 음성 센서 구조
그림2. 인공지능을 통한 화자 인식 개략도
2018.10.04 조회수 14539
이건재 교수, 유창동 교수, 유연 압전 화자인식 음성센서 개발
〈 이 건 재 교수 〉
우리 대학 신소재공학과 이건재 교수와 전기및전자공학부 유창동 교수 공동 연구팀이 인공지능 기반의 화자(話者) 인식용 유연 압전 음성센서를 개발했다.
이번 연구를 통해 개인별 음성 서비스를 스마트 홈 가전이나 인공지능 비서, 생체 인증 분야 등 차세대 기술에 활용 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘나노 에너지(Nano Energy)’ 9월호에 ‘민감도’와 ‘화자인식’ 논문 두 편으로 동시 게재됐고 현재 관련 기술은 실용화 단계에 있다. (민감도 논문 : Basilar Membrane-Inspired Self-Powered Acoustic Sensor Enabled by Highly Sensitive Multi Tunable Frequency Band, 화자인식 논문 : Machine Learning-based Self-powered Acoustic Sensor for Speaker Recognition)
음성 센서는 인간과 기계 사이의 자유로운 소통을 가능하게 만드는 가장 직관적인 수단으로 4차 산업혁명의 핵심 기술로 주목받고 있다. 음성센서 시장은 2021년 대략 160억 달러 규모로 커질 것으로 예상된다.
그러나 현재 산업계에서는 음성 신호 수신 시 정전용량을 측정하는 콘덴서 형식을 사용하기 때문에 민감도가 낮고 인식 거리가 짧아 화자 인식률에 한계가 있다.
이번 연구에서 이 교수 연구팀은 인간의 달팽이관을 모사해 주파수에 따라 다른 영역이 진동하는 사다리꼴의 얇은 막을 제작했다. 음성신호에 따른 공진형 진동을 유연 압전 물질을 통해 감지하는 자가발전 고민감 음성 센서를 개발했다.
연구팀의 음성 센서는 기존 기술 대비 2배 이상 높은 민감도를 가져 미세한 음성 신호를 원거리에서도 감지할 수 있다. 또한 다채널로 신호를 받아들여 하나의 언어에 대해 복수 개의 데이터를 얻을 수 있다.
이 기술을 기반으로 누가 이야기하는지 찾아내는 화자인식 시스템에 적용해 97.5%의 화자인식 성공률을 무향실에서 달성했고 기존 기술 대비 오류를 75% 이상 줄였다.
화자인식 서비스는 음성 분야에 세상을 바꿀 next big thing으로 기대를 받고 있다. 기존 기술은 소프트웨어 업그레이드를 통한 접근으로 인식률에 한계가 있었지만 연구팀의 기술은 하드웨어 센서를 개발함으로써 능력을 크게 향상시켰다. 추후 첨단 소프트웨어를 접목한다면 다양한 환경에서도 화자 및 음성 인식률을 높일 수 있을 것으로 예상된다.
이건재 교수는 “이번에 개발한 머신 러닝 기반 고민감 유연 압전 음성센서는 화자를 정확하게 구별할 수 있기 때문에 개인별 음성 서비스를 스마트 가전이나 인공지능 비서에 접목할 수 있을 것이며 생체 인증 및 핀테크와 같은 보안 분야에서도 큰 역할을 할 수 있을 것이다”고 말했다.
이번 연구는 스마트 IT 융합시스템 연구단의 지원을 받아 수행됐다.
<관련 영상>
https://www.youtube.com/watch?v=QGEVJxCFVpc&feature=youtu.be
□ 그림 설명
그림1. 인간의 달팽이관을 모사한 유연 압전 음성 센서 구조
그림2. 인공지능을 통한 화자 인식 개략도
2018.10.04 조회수 14539