-
 항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17
조회수 6041
-
 기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09
조회수 6378
-
 인공장기 생체 단백질 모방 금속 필름 개발
오랜 기간에 걸쳐 생체 구조체를 형틀로 삼아 다양한 무기물을 증착 및 성장시킴으로써 생체 모방 재료를 합성하는 연구들이 이루어져 왔는데, 이를 생체 형틀법이라고 한다. 이런 생체 형틀법은 생체에 있는 특정 구조체에 사용되어 오랜 시간 동안 에너지, 광학, 마이크로로봇, 의료 분야 등에 응용되어 왔다. 특히 생체 구조체를 사용하고 모방했다는 점에서 인체 내 활용이 용이하여 인공장기나 상처 치유 분야로 많이 연구되었다.
우리 대학 신소재공학과 장재범, 김일두 교수 연구팀이 생체 형틀법을 이용해 세포외 기질을 구성하는 여러 단백질 중 원하는 특정 단백질만을 선택해 해당 단백질 구조체를 모방한 금속 필름을 합성하고 전기 전달 특성을 확인하는 것에 성공했다고 16일 밝혔다.
세포외 기질이란 세포 밖에 존재하며 세포의 분화, 성장, 이동에 중요한 역할을 수행할 뿐만 아니라 생체 조직과 기관(organ)의 구조적·기계적 특성 유지에 필수적인 생체 구조물이다. 이러한 세포외 기질은 여러 단백질을 포함하며, 그 단백질 구조체를 원하는 형태로 변형하거나 최근에는 세포외 기질을 3D 프린팅을 위한 바이오잉크로 사용할 만큼 세포외 기질을 다루는 많은 기술 개발이 진행되고 있다. 따라서 세포외 기질은 생체 형틀법을 통해 다양한 구조의 재료 합성에 이용될 수 있지만, 현재까지 관련된 연구는 많이 이뤄지지 않았다.
연구팀은 2022년 항체(Antibody)를 활용한 신개념 생체 형틀법인 `항체 유도 생체 형틀‘을 개발해 최초로 다세포 생물 내부에 있는 특정 단백질 구조체를 모방한 금속 구조체를 합성하는 데 성공했다. 이번 연구에서는 이전 연구를 세포외 기질로 확장해 세포를 지탱하는 구조체를 구성하는 단백질 중 피브로넥틴(fibronectin)을 표적 단백질로 삼아 그물형 금속 필름 제작에 성공했다.
연구팀은 이에 더 나아가 합성한 그물형 금속 필름에 추가적 처리를 통해 금속을 통한 전기 전달이 가능하도록 만들었다. 이를 기반으로 물을 전기 분해하여 수소를 생산하거나, 또는 수소와 금속간 화학적 반응을 통해 수소를 검출할 수 있는 센서로 활용할 수 있었다.
해당 기술은 다양한 생물의 세포외 기질에도 적용 가능할 것으로 예상되어 더 큰 규모나 더 복잡한 생체 모방 재료 합성도 가능할 것으로 생각된다. 또한, 원하는 형태로 세포외 기질을 패턴화 및 정렬함으로써 본 기술로 전기 회로 제작도 가능할 것으로 생각된다.
우리 대학 신소재공학과 송창우 박사과정, 안재완 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'에 10월 18일 자로 온라인 공개되었으며, 전면 표지 논문(Front Cover)으로 선정됐다. (논문명 : Metallization of Targeted Protein Assemblies in Cell-Derived Extracellular Matrix by Antibody-Guided Biotemplating).
제1 저자인 송창우 박사과정은 "이번 연구는 기존에 개발한 항체 유도 생체 형틀법을 세포외 기질로 확장함으로써 합성된 생체 모방 재료가 더 다양한 분야에 활용 가능하다는 것을 보였다ˮ 라며 "이를 기반으로 조직 수준의 세포외 기질 및 원하는 형태로 변형된 세포외 기질을 이용해 조직 공학(Tissue engineering) 및 생체 조직 제조(Biofabrication)으로 활용 범주를 넓힐 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 과학난제도전 융합연구개발사업, 웨어러블 플랫폼소재 기술센터, 우수신진연구사업 등의 지원을 받아 수행됐다.
인공장기 생체 단백질 모방 금속 필름 개발
오랜 기간에 걸쳐 생체 구조체를 형틀로 삼아 다양한 무기물을 증착 및 성장시킴으로써 생체 모방 재료를 합성하는 연구들이 이루어져 왔는데, 이를 생체 형틀법이라고 한다. 이런 생체 형틀법은 생체에 있는 특정 구조체에 사용되어 오랜 시간 동안 에너지, 광학, 마이크로로봇, 의료 분야 등에 응용되어 왔다. 특히 생체 구조체를 사용하고 모방했다는 점에서 인체 내 활용이 용이하여 인공장기나 상처 치유 분야로 많이 연구되었다.
우리 대학 신소재공학과 장재범, 김일두 교수 연구팀이 생체 형틀법을 이용해 세포외 기질을 구성하는 여러 단백질 중 원하는 특정 단백질만을 선택해 해당 단백질 구조체를 모방한 금속 필름을 합성하고 전기 전달 특성을 확인하는 것에 성공했다고 16일 밝혔다.
세포외 기질이란 세포 밖에 존재하며 세포의 분화, 성장, 이동에 중요한 역할을 수행할 뿐만 아니라 생체 조직과 기관(organ)의 구조적·기계적 특성 유지에 필수적인 생체 구조물이다. 이러한 세포외 기질은 여러 단백질을 포함하며, 그 단백질 구조체를 원하는 형태로 변형하거나 최근에는 세포외 기질을 3D 프린팅을 위한 바이오잉크로 사용할 만큼 세포외 기질을 다루는 많은 기술 개발이 진행되고 있다. 따라서 세포외 기질은 생체 형틀법을 통해 다양한 구조의 재료 합성에 이용될 수 있지만, 현재까지 관련된 연구는 많이 이뤄지지 않았다.
연구팀은 2022년 항체(Antibody)를 활용한 신개념 생체 형틀법인 `항체 유도 생체 형틀‘을 개발해 최초로 다세포 생물 내부에 있는 특정 단백질 구조체를 모방한 금속 구조체를 합성하는 데 성공했다. 이번 연구에서는 이전 연구를 세포외 기질로 확장해 세포를 지탱하는 구조체를 구성하는 단백질 중 피브로넥틴(fibronectin)을 표적 단백질로 삼아 그물형 금속 필름 제작에 성공했다.
연구팀은 이에 더 나아가 합성한 그물형 금속 필름에 추가적 처리를 통해 금속을 통한 전기 전달이 가능하도록 만들었다. 이를 기반으로 물을 전기 분해하여 수소를 생산하거나, 또는 수소와 금속간 화학적 반응을 통해 수소를 검출할 수 있는 센서로 활용할 수 있었다.
해당 기술은 다양한 생물의 세포외 기질에도 적용 가능할 것으로 예상되어 더 큰 규모나 더 복잡한 생체 모방 재료 합성도 가능할 것으로 생각된다. 또한, 원하는 형태로 세포외 기질을 패턴화 및 정렬함으로써 본 기술로 전기 회로 제작도 가능할 것으로 생각된다.
우리 대학 신소재공학과 송창우 박사과정, 안재완 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'에 10월 18일 자로 온라인 공개되었으며, 전면 표지 논문(Front Cover)으로 선정됐다. (논문명 : Metallization of Targeted Protein Assemblies in Cell-Derived Extracellular Matrix by Antibody-Guided Biotemplating).
제1 저자인 송창우 박사과정은 "이번 연구는 기존에 개발한 항체 유도 생체 형틀법을 세포외 기질로 확장함으로써 합성된 생체 모방 재료가 더 다양한 분야에 활용 가능하다는 것을 보였다ˮ 라며 "이를 기반으로 조직 수준의 세포외 기질 및 원하는 형태로 변형된 세포외 기질을 이용해 조직 공학(Tissue engineering) 및 생체 조직 제조(Biofabrication)으로 활용 범주를 넓힐 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 과학난제도전 융합연구개발사업, 웨어러블 플랫폼소재 기술센터, 우수신진연구사업 등의 지원을 받아 수행됐다.
2023.11.17
조회수 7668
-
 화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
2023.11.09
조회수 7595
-
 이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
2023.11.07
조회수 5613
-
 뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16
조회수 7197
-
 인공지능으로 파킨슨병 맞춤형 치료 가능
파킨슨병 같은 만성 퇴행성 뇌 질환의 경우, 생존 환자의 뇌세포에 직접 접근이 제한적이기 때문에, 뇌 질환 환자의 세포 데이터를 토대로 환자 질병의 메커니즘 하위 유형을 인공지능으로 예측하는 것은 시도된 바가 없다.
우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 프랜시스 크릭 연구소(Francis Crick Institute)와의 공동 연구로 파킨슨병 환자의 개인별 질병 하위 유형을 예측하는 인공지능 기반의 플랫폼을 개발했다고 15일 밝혔다.
최민이 교수 연구팀이 개발한 플랫폼은 파킨슨병 환자의 역분화 만능 줄기세포(hiPSC)에서 분화된 신경 세포의 핵, 미토콘드리아, 리보솜 이미지 정보만 학습해 파킨슨 환자의 병리적 하위 유형을 정확하게 예측한다.
이 기술을 활용하면 환자별로 다르게 나타나는 파킨슨병 양상을 겉으로 보이는 발현형이 아닌 생물학적 메커니즘별로 분류할 수 있다. 이를 통해 원인 미상의 파킨슨병 환자가 속한 분자 세포적 하위 유형별로 진단이 가능해져 환자 맞춤형 치료의 길을 열 수 있다. 또 이 플랫폼은 고속의 대량 스크리닝 시스템을 사용하기 때문에 병리적 하위 유형에 적합한 맞춤형 약물 개발 파이프라인으로도 활용될 수 있다.
지금까지 파킨슨병의 치료는 환자 개별의 병리 상태를 고려하지 않고 확률에 기댄 ‘일률적 접근’ 방식을 사용해 왔다. 이러한 접근 방식은 병리적 원인과 치료 방법 사이의 불일치로 인해 치료 효과를 향상하기 어려웠다.
최민이 교수 연구팀이 개발한 플랫폼을 사용하면 개별 환자 뇌세포의 분자 및 세포 정보를 정밀하게 프로파일링할 수 있다. 이를 토대로 환자들의 질병 하위 유형을 정확히 진단할 수 있어서 궁극적으로 ‘정밀 의학 (Precise medicine)’이 가능해진다. 이는 각 개인에게 맞춤화된 치료 (Personalized medicine)로 이어져 치료 효과를 크게 향상할 수 있을 것으로 기대된다.
이 플랫폼은 2012년 노벨의학상 수상 기술인 유도만능줄기세포(iPSC: 성인 피부세포나 혈액에서 얻은 체세포를 태아기의 미분화 상태로 리프로그래밍한 세포. 어떤 장기 세포로도 분화가 가능)를 분화시켜 얻은 뇌세포를 사용하는 ‘접시 속 질병(disease in a dish)’ 패러다임이다. 이는 퇴행성 뇌 질환처럼 병변을 직접 얻을 수 없거나, 인간의 뇌를 정확하게 모사할 수 없는 동물 모델의 한계점을 극복할 수 있는 기술 중 하나로 주목받고 있다. 특히, 접시 속에 배양한 자신의 표적 질병 세포를 순차적으로 이미징하면 일련의 병리적 사건을 추적할 수 있어 질병 진행에 따른 약물 반응 결과를 예측할 수 있다는 이점이 있다.
교신 저자인 최민이 교수는 "이번 연구는 실험실에서 얻은 생물학적 데이터를 인공지능에 효과적으로 학습시켜, 정확도가 높은 질병 하위 유형 분류 모델을 생성하는 방법을 구체적으로 소개했다”며, "이 플랫폼은 자폐 스펙트럼과 같이 환자 개인별 증상이 뚜렷하게 다른 뇌 질환의 하위 유형을 분류하는 데에도 유용할 것이며, 이를 통해 효과적인 치료법 개발도 가능해질 것이다”라고 연구의 의의를 설명했다.
이번 논문은 영국 Medical Research Council (MRC)와 대교-KAIST 인지 향상 연구센터의 지원으로 수행됐으며, 국제 학술지 ‘네이처 머신 인텔리젼스 (Nature Machine Intelligence, IF = 25.8) 8월호에 출판됐다 (논문명: Prediction of mechanistic subtypes of Parkinson’s using patient-derived stem cell model)
인공지능으로 파킨슨병 맞춤형 치료 가능
파킨슨병 같은 만성 퇴행성 뇌 질환의 경우, 생존 환자의 뇌세포에 직접 접근이 제한적이기 때문에, 뇌 질환 환자의 세포 데이터를 토대로 환자 질병의 메커니즘 하위 유형을 인공지능으로 예측하는 것은 시도된 바가 없다.
우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 프랜시스 크릭 연구소(Francis Crick Institute)와의 공동 연구로 파킨슨병 환자의 개인별 질병 하위 유형을 예측하는 인공지능 기반의 플랫폼을 개발했다고 15일 밝혔다.
최민이 교수 연구팀이 개발한 플랫폼은 파킨슨병 환자의 역분화 만능 줄기세포(hiPSC)에서 분화된 신경 세포의 핵, 미토콘드리아, 리보솜 이미지 정보만 학습해 파킨슨 환자의 병리적 하위 유형을 정확하게 예측한다.
이 기술을 활용하면 환자별로 다르게 나타나는 파킨슨병 양상을 겉으로 보이는 발현형이 아닌 생물학적 메커니즘별로 분류할 수 있다. 이를 통해 원인 미상의 파킨슨병 환자가 속한 분자 세포적 하위 유형별로 진단이 가능해져 환자 맞춤형 치료의 길을 열 수 있다. 또 이 플랫폼은 고속의 대량 스크리닝 시스템을 사용하기 때문에 병리적 하위 유형에 적합한 맞춤형 약물 개발 파이프라인으로도 활용될 수 있다.
지금까지 파킨슨병의 치료는 환자 개별의 병리 상태를 고려하지 않고 확률에 기댄 ‘일률적 접근’ 방식을 사용해 왔다. 이러한 접근 방식은 병리적 원인과 치료 방법 사이의 불일치로 인해 치료 효과를 향상하기 어려웠다.
최민이 교수 연구팀이 개발한 플랫폼을 사용하면 개별 환자 뇌세포의 분자 및 세포 정보를 정밀하게 프로파일링할 수 있다. 이를 토대로 환자들의 질병 하위 유형을 정확히 진단할 수 있어서 궁극적으로 ‘정밀 의학 (Precise medicine)’이 가능해진다. 이는 각 개인에게 맞춤화된 치료 (Personalized medicine)로 이어져 치료 효과를 크게 향상할 수 있을 것으로 기대된다.
이 플랫폼은 2012년 노벨의학상 수상 기술인 유도만능줄기세포(iPSC: 성인 피부세포나 혈액에서 얻은 체세포를 태아기의 미분화 상태로 리프로그래밍한 세포. 어떤 장기 세포로도 분화가 가능)를 분화시켜 얻은 뇌세포를 사용하는 ‘접시 속 질병(disease in a dish)’ 패러다임이다. 이는 퇴행성 뇌 질환처럼 병변을 직접 얻을 수 없거나, 인간의 뇌를 정확하게 모사할 수 없는 동물 모델의 한계점을 극복할 수 있는 기술 중 하나로 주목받고 있다. 특히, 접시 속에 배양한 자신의 표적 질병 세포를 순차적으로 이미징하면 일련의 병리적 사건을 추적할 수 있어 질병 진행에 따른 약물 반응 결과를 예측할 수 있다는 이점이 있다.
교신 저자인 최민이 교수는 "이번 연구는 실험실에서 얻은 생물학적 데이터를 인공지능에 효과적으로 학습시켜, 정확도가 높은 질병 하위 유형 분류 모델을 생성하는 방법을 구체적으로 소개했다”며, "이 플랫폼은 자폐 스펙트럼과 같이 환자 개인별 증상이 뚜렷하게 다른 뇌 질환의 하위 유형을 분류하는 데에도 유용할 것이며, 이를 통해 효과적인 치료법 개발도 가능해질 것이다”라고 연구의 의의를 설명했다.
이번 논문은 영국 Medical Research Council (MRC)와 대교-KAIST 인지 향상 연구센터의 지원으로 수행됐으며, 국제 학술지 ‘네이처 머신 인텔리젼스 (Nature Machine Intelligence, IF = 25.8) 8월호에 출판됐다 (논문명: Prediction of mechanistic subtypes of Parkinson’s using patient-derived stem cell model)
2023.08.16
조회수 9448
-
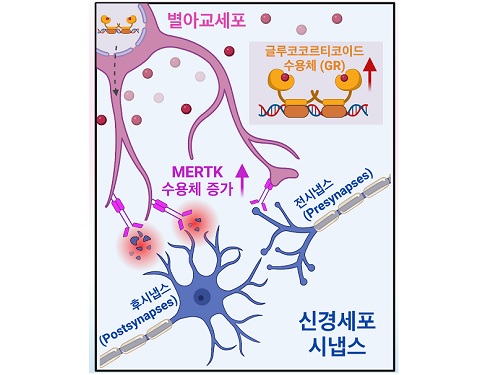 아동 학대로 인한 정신질환 발병 원인 최초 규명
아동기 시 부모에게서 떨어져서 방치되거나 학대를 받을 경우, 극심한 스트레스 현상이 일어난다. 이러한 스트레스 상황을 겪게 되면 성인으로 성장하는 과정 동안 뇌 신경 회로망 및 기능이 크게 변화되어 조현병 및 우울증과 같은 정신질환이 발생될 수 있다. 하지만 현재까지 아동기 스트레스에 따른 정신질환의 원인과 그 제어 방법에 대해서는 정확히 알려진 바가 없다.
우리 대학 생명과학과 정원석 교수 연구팀이 아동 학대 및 방임 등의 아동기 스트레스로 인해 발병되는 정신질환이 별아교세포의 과도한 시냅스 제거에서 기인함을 최초로 규명해 면역 관련 최고 국제 학술지인 ‘이뮤니티(Immunity)’에 발표했다고 1일 밝혔다.
정원석 교수 연구팀은 뇌에서 면역기능을 담당하는 별아교세포가 스트레스 호르몬에 반응하여 과도하게 흥분성 시냅스를 제거하는 현상이, 아동 학대 및 방임에 따른 정신질환 발병의 주요 원인임을 최초로 규명하였다. 과도한 스트레스가 다양한 정신질환의 원인으로 작용할 수 있음이 임상적으로 알려져 있었지만, 그 정확한 발병 기전은 알려지지 않았기 때문에 이번 연구는 스트레스로 인한 정신질환의 예방 및 치료에 크게 응용될 수 있을 것으로 기대된다.
연구팀은 미국식품의약국 (FDA)에서 승인된 임상 약물 스크리닝을 진행해 별아교세포의 외부 물질을 잡아 먹어 제거하는 역할(포식 작용)을 조절하는 새로운 기작을 발굴했다. 그 결과, 연구팀은 스트레스 호르몬이라 불리는 합성 글루코코르티코이드(synthetic glucocorticoid)가 별아교세포의 포식 작용을 비정상적으로 크게 높이는 것을 발견했다. 글루코코르티코이드는 당대사, 항염증 등 생명 유지에 필요한 역할을 하는 한편 스트레스와 같은 외부 자극에 의해 분비돼 신체가 대응할 수 있도록 한다. 하지만 만성 스트레스로 인해 글루코코르티코이드에 과도하게 장기간 노출되면 우울증, 인지장애, 불안 증세와 같은 다양한 정신질환이 발병할 수 있다.
연구팀은 아동기 스트레스로 인한 별아교세포의 기능 변화를 이해하고자 아동기 사회성 결핍(early social deprivation) 생쥐 모델을 활용했고, 그 결과 스트레스 호르몬이 별아교세포의 글루코코르티코이드 수용체 (glucocorticoid receptor; GR)와 결합해 별아교세포의 포식 작용에 중요한 역할을 하는 MERTK(Mer Tyrosine Kinase)라는 수용체의 발현을 크게 증가시킴을 알아냈다. 놀랍게도 별아교세포는 증가된 MERTK를 통해 다양한 대뇌 피질에 존재하는 특정 신경 세포의 흥분성 시냅스만을 선택적으로 잡아 먹어 감소시켰으며, 이로 인한 비정상적인 신경 회로망 형성으로 추후 성인기에 사회성 결핍과 우울증 같은 복합적인 행동 이상이 일어남을 발견했다.
뿐만 아니라 연구팀은 별아교세포와 함께 뇌 면역 기능에 중요한 역할을 담당하는 것으로 알려진 미세아교세포는 아동기 사회성 결핍 쥐 모델에서의 시냅스 제거에는 전혀 참여하고 있지 않음을 관찰했다. 이는 아동기 스트레스 상황에서 미세아교세포가 아닌 별아교세포가 특이적으로 스트레스 호르몬에 반응해 뇌의 환경을 조절하고 있음을 확인한 것이다.
연구팀은 이 같은 발견이 인간에게도 적용될 수 있는지를 알아보기 위해, 인간 만능 유도 줄기세포에서 유래한 뇌 오가노이드를 활용해 스트레스 호르몬에 대한 반응을 확인했다. 중요하게도 연구팀은 인간 뇌 오가노이드에서도 스트레스 호르몬에 의해 별아교세포의 글루코코르티코이드 수용체와 포식 수용체가 모두 활성화됨을 발견했으며, 또한 별아교세포가 흥분성 시냅스를 과도하게 제거함을 확인했다. 이로써 스트레스 반응에 대한 쥐와 인간의 시냅스 조절 메커니즘이 같음을 보임으로써, 연구팀은 이번 발견이 인간의 정신질환 치료에도 응용될 수 있음을 제시했다.
정원석 교수는 “지금까지 아동기 스트레스와 뇌 질환 발병의 메커니즘은 잘 밝혀져 있지 않았지만, 이번 연구를 통해 과도한 별아교세포의 포식 작용이 정신질환 발병에 있어 중요한 원인이 될 수 있음을 최초로 증명했다”고 언급하며 “추후 다양한 뇌 질환의 이해와 치료에 있어서 별아교세포의 면역기능 조절이 근본적인 타겟으로 응용될 수 있을 것”이라고 밝혔다.
우리 대학 생명과학과 변유경, 김규리 박사과정 학생과 김남식 박사후연구원이 공동 제1 저자로 참여한 이번 연구는 셀(Cell) 자매지이자 면역 관련 최고 국제 학술지인 `이뮤니티 (IMMUNITY)' 7월 31일 字 온라인 출판됐다. (논문명 : Stress induces behavioral abnormalities by increasing expression of phagocytic receptor MERTK in astrocytes to promote synapse phagocytosis).
한편 이번 연구는 연구재단 중견 연구, 뇌질환극복연구사업, 뇌기능 규명 조절 기술 개발사업의 지원을 받아 수행됐다.
아동 학대로 인한 정신질환 발병 원인 최초 규명
아동기 시 부모에게서 떨어져서 방치되거나 학대를 받을 경우, 극심한 스트레스 현상이 일어난다. 이러한 스트레스 상황을 겪게 되면 성인으로 성장하는 과정 동안 뇌 신경 회로망 및 기능이 크게 변화되어 조현병 및 우울증과 같은 정신질환이 발생될 수 있다. 하지만 현재까지 아동기 스트레스에 따른 정신질환의 원인과 그 제어 방법에 대해서는 정확히 알려진 바가 없다.
우리 대학 생명과학과 정원석 교수 연구팀이 아동 학대 및 방임 등의 아동기 스트레스로 인해 발병되는 정신질환이 별아교세포의 과도한 시냅스 제거에서 기인함을 최초로 규명해 면역 관련 최고 국제 학술지인 ‘이뮤니티(Immunity)’에 발표했다고 1일 밝혔다.
정원석 교수 연구팀은 뇌에서 면역기능을 담당하는 별아교세포가 스트레스 호르몬에 반응하여 과도하게 흥분성 시냅스를 제거하는 현상이, 아동 학대 및 방임에 따른 정신질환 발병의 주요 원인임을 최초로 규명하였다. 과도한 스트레스가 다양한 정신질환의 원인으로 작용할 수 있음이 임상적으로 알려져 있었지만, 그 정확한 발병 기전은 알려지지 않았기 때문에 이번 연구는 스트레스로 인한 정신질환의 예방 및 치료에 크게 응용될 수 있을 것으로 기대된다.
연구팀은 미국식품의약국 (FDA)에서 승인된 임상 약물 스크리닝을 진행해 별아교세포의 외부 물질을 잡아 먹어 제거하는 역할(포식 작용)을 조절하는 새로운 기작을 발굴했다. 그 결과, 연구팀은 스트레스 호르몬이라 불리는 합성 글루코코르티코이드(synthetic glucocorticoid)가 별아교세포의 포식 작용을 비정상적으로 크게 높이는 것을 발견했다. 글루코코르티코이드는 당대사, 항염증 등 생명 유지에 필요한 역할을 하는 한편 스트레스와 같은 외부 자극에 의해 분비돼 신체가 대응할 수 있도록 한다. 하지만 만성 스트레스로 인해 글루코코르티코이드에 과도하게 장기간 노출되면 우울증, 인지장애, 불안 증세와 같은 다양한 정신질환이 발병할 수 있다.
연구팀은 아동기 스트레스로 인한 별아교세포의 기능 변화를 이해하고자 아동기 사회성 결핍(early social deprivation) 생쥐 모델을 활용했고, 그 결과 스트레스 호르몬이 별아교세포의 글루코코르티코이드 수용체 (glucocorticoid receptor; GR)와 결합해 별아교세포의 포식 작용에 중요한 역할을 하는 MERTK(Mer Tyrosine Kinase)라는 수용체의 발현을 크게 증가시킴을 알아냈다. 놀랍게도 별아교세포는 증가된 MERTK를 통해 다양한 대뇌 피질에 존재하는 특정 신경 세포의 흥분성 시냅스만을 선택적으로 잡아 먹어 감소시켰으며, 이로 인한 비정상적인 신경 회로망 형성으로 추후 성인기에 사회성 결핍과 우울증 같은 복합적인 행동 이상이 일어남을 발견했다.
뿐만 아니라 연구팀은 별아교세포와 함께 뇌 면역 기능에 중요한 역할을 담당하는 것으로 알려진 미세아교세포는 아동기 사회성 결핍 쥐 모델에서의 시냅스 제거에는 전혀 참여하고 있지 않음을 관찰했다. 이는 아동기 스트레스 상황에서 미세아교세포가 아닌 별아교세포가 특이적으로 스트레스 호르몬에 반응해 뇌의 환경을 조절하고 있음을 확인한 것이다.
연구팀은 이 같은 발견이 인간에게도 적용될 수 있는지를 알아보기 위해, 인간 만능 유도 줄기세포에서 유래한 뇌 오가노이드를 활용해 스트레스 호르몬에 대한 반응을 확인했다. 중요하게도 연구팀은 인간 뇌 오가노이드에서도 스트레스 호르몬에 의해 별아교세포의 글루코코르티코이드 수용체와 포식 수용체가 모두 활성화됨을 발견했으며, 또한 별아교세포가 흥분성 시냅스를 과도하게 제거함을 확인했다. 이로써 스트레스 반응에 대한 쥐와 인간의 시냅스 조절 메커니즘이 같음을 보임으로써, 연구팀은 이번 발견이 인간의 정신질환 치료에도 응용될 수 있음을 제시했다.
정원석 교수는 “지금까지 아동기 스트레스와 뇌 질환 발병의 메커니즘은 잘 밝혀져 있지 않았지만, 이번 연구를 통해 과도한 별아교세포의 포식 작용이 정신질환 발병에 있어 중요한 원인이 될 수 있음을 최초로 증명했다”고 언급하며 “추후 다양한 뇌 질환의 이해와 치료에 있어서 별아교세포의 면역기능 조절이 근본적인 타겟으로 응용될 수 있을 것”이라고 밝혔다.
우리 대학 생명과학과 변유경, 김규리 박사과정 학생과 김남식 박사후연구원이 공동 제1 저자로 참여한 이번 연구는 셀(Cell) 자매지이자 면역 관련 최고 국제 학술지인 `이뮤니티 (IMMUNITY)' 7월 31일 字 온라인 출판됐다. (논문명 : Stress induces behavioral abnormalities by increasing expression of phagocytic receptor MERTK in astrocytes to promote synapse phagocytosis).
한편 이번 연구는 연구재단 중견 연구, 뇌질환극복연구사업, 뇌기능 규명 조절 기술 개발사업의 지원을 받아 수행됐다.
2023.08.01
조회수 7702
-
 대체육 풍미 향상 등 미생물 세포공장 제시
수십 년 동안 전 세계 인구 증가에도 불구하고 기후변화 및 이상기후의 심화로 인한 식량 생산성 감소와 전쟁 등의 국제적 분쟁으로 인한 식량 공급망의 파괴는 식량부족과 영양 불평등 문제를 심화시키며 세계적인 식량 위기를 가시화하고 있다. 그러나 아이러니하게도 다른 한편에서는 환경과 지속가능성에 대한 인식이 고조됨에 따라 보다 친환경적이면서 고품질을 자랑하는 식품 및 미용품에 대한 수요 증가가 동시에 관찰되고 있다. 미생물은 이러한 다면적인 문제들을 동시에 풀어낼 수 있는 열쇠로서 주목받고 있다.
우리 대학 생물공정연구센터 최경록 연구교수와 생명화학공학과 이상엽 특훈교수가 ‘식품 및 화장품 생산을 위한 미생물의 시스템 대사공학’논문을 발표했다고 26일 밝혔다. 이번 논문은 네이처(Nature) 誌가 발행하는 ‘네이처 생명공학 리뷰(Nature Reviews Bioengineering)’의 초청으로 준비한 것으로 동료심사를 거쳐 온라인 게재됐다.
※ 논문명 : Systems metabolic engineering of microorganisms for food and cosmetics production
※ 저자 정보 : 최경록(한국과학기술원, 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 2명
시스템 대사공학은 석유에 대한 의존도가 높은 기존의 화학산업을 대체할 바이오산업의 핵심인 미생물 세포공장을 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다. 연구진은 시스템 대사공학 전략을 적용함으로써 대체육의 풍미와 색감을 향상할 수 있는 천연물질인 헴철(heme)과 아연-프로토포르피린 IX(zinc protoporphyrin IX), 식품과 화장품에 폭넓게 활용할 수 있는 기능성 천연 색소인 라이코펜(lycopene)과 베타카로틴(β-carotene), 식품이나 음료 제조 시 포도향을 내기 위해 널리 활용되는 포도 유래 화합물인 메틸안트라닐산(methyl anthranilate) 등을 비롯해 다양한 식품 및 미용 화합물을 생산하는 고성능 미생물 세포공장들을 다수 개발한 바 있다.
연구진은 이번 네이처지로부터의 초청 논문을 통해 각종 식품과 화장품에 이용되는 아미노산과 단백질, 지방 및 지방산, 비타민, 향미료, 색소, 알코올, 기능성 화합물과 기타 식품 첨가물 등을 생산할 수 있는 괄목할만한 미생물 세포공장의 개발 사례들과 이러한 미생물 유래 물질들을 성공적으로 제품화해 시장에 공급하고 있는 전세계 기업들을 총망라했다. 더 나아가 보다 다양한 식품 및 미용 화합물들을 친환경적으로 생산하면서도 경제성도 갖춘 산업용 미생물 세포공장의 개발에 박차를 가할 수 있는 다양한 시스템 대사공학 전략을 정리 및 제시했다.
예를 들어, 미생물 발효 과정을 통해 동물의 사료로 이용되거나 비료로 이용되고 있는 비식용 바이오매스 등을 통해 영양학적으로 높은 가치를 지닌 단백질이나 아미노산을 생산함으로써 전세계 식량 생산량의 증대 및 안정적인 공급에 기여할 수 있다. 더 나아가 대체육 개발 등 동물성 단백질에 대한 의존도를 낮춤으로써 가축 사육이나 물고기 양식을 통해 발생하는 온실가스 및 환경오염을 줄이는 데에도 기여할 수 있다. 또한 바닐라 향이나 포도 향을 내는 바닐린(vanillin)이나 메틸안트라닐산(methyl anthranilate)은 다양한 식품에 널리 첨가되고 있으나, 식물로부터 분리정제한 천연 제품은 생산량이 적고 생산단가가 높기 때문에 대부분의 경우 석유화학물질로부터 유래한 바닐린과 메틸안트라닐산을 식품에 첨가하고 있다.
이러한 물질들 역시 미생물의 힘을 빌려 친환경적이고 인체 친화적인 방법을 통해 생산할 수 있다. 붉은색 립스틱이나 딸기맛 우유 등 다양한 화장품이나 식품에 첨가되지만 특정한 선인장에서만 서식하는 연지벌레로부터 추출해야 하는 칼민(코치닐색소), 피부 미용에 도움을 줄 수 있으나 닭벼슬이나 소의 안구에서 추출해야 하는 하이알루론산, 건강보조제로 널리 섭취되고 있지만 상어나 생선의 간 등에서 추출하는 오메가-3 지방산 등도 미생물을 이용하면 윤리적인 문제 없이 친환경적으로 생산할 수 있다.
이번 논문의 제1 저자인 우리 대학 최경록 연구교수는 “김치나 요거트와 같은 전통 발효식품뿐만 아니라, 카카오 콩을 발효시켜야만 얻을 수 있는 초콜릿의 원료인 카카오버터나 미생물 발효를 통해 생산하는 조미료인 글루탐산나트륨처럼 미생물의 도움을 받아 생산한 식품은 이미 우리에게 친숙한 존재”라면서 “앞으로 미생물 세포공장을 통해 친환경적이고 지속가능한 방법으로 생산한 더 다양한 종류의 식품과 화장품을 일상에서 더욱 쉽게 마주할 수 있을 것이다”고 말했다.
또한 이상엽 특훈교수는 “과학기술을 활용해 더 나은 세상을 만들어가는 것은 공학자의 숙명”이라며 “시스템 대사공학 기술의 꾸준한 발전과 적극적인 활용을 통해 식량 위기와 기후변화를 동시에 해결하는 데 크게 기여할 수 있을 것”이라고 밝혔다.
한편, 이번 연구는 농촌진흥청이 지원하는 농업미생물사업단(단장 장판식)의 ‘미생물 대사시스템 제어를 통한 무기물로부터의 단백질 생산 기술 개발’ 과제 (과제책임자 KAIST 최경록 연구교수) 및 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제 (과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
대체육 풍미 향상 등 미생물 세포공장 제시
수십 년 동안 전 세계 인구 증가에도 불구하고 기후변화 및 이상기후의 심화로 인한 식량 생산성 감소와 전쟁 등의 국제적 분쟁으로 인한 식량 공급망의 파괴는 식량부족과 영양 불평등 문제를 심화시키며 세계적인 식량 위기를 가시화하고 있다. 그러나 아이러니하게도 다른 한편에서는 환경과 지속가능성에 대한 인식이 고조됨에 따라 보다 친환경적이면서 고품질을 자랑하는 식품 및 미용품에 대한 수요 증가가 동시에 관찰되고 있다. 미생물은 이러한 다면적인 문제들을 동시에 풀어낼 수 있는 열쇠로서 주목받고 있다.
우리 대학 생물공정연구센터 최경록 연구교수와 생명화학공학과 이상엽 특훈교수가 ‘식품 및 화장품 생산을 위한 미생물의 시스템 대사공학’논문을 발표했다고 26일 밝혔다. 이번 논문은 네이처(Nature) 誌가 발행하는 ‘네이처 생명공학 리뷰(Nature Reviews Bioengineering)’의 초청으로 준비한 것으로 동료심사를 거쳐 온라인 게재됐다.
※ 논문명 : Systems metabolic engineering of microorganisms for food and cosmetics production
※ 저자 정보 : 최경록(한국과학기술원, 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 2명
시스템 대사공학은 석유에 대한 의존도가 높은 기존의 화학산업을 대체할 바이오산업의 핵심인 미생물 세포공장을 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다. 연구진은 시스템 대사공학 전략을 적용함으로써 대체육의 풍미와 색감을 향상할 수 있는 천연물질인 헴철(heme)과 아연-프로토포르피린 IX(zinc protoporphyrin IX), 식품과 화장품에 폭넓게 활용할 수 있는 기능성 천연 색소인 라이코펜(lycopene)과 베타카로틴(β-carotene), 식품이나 음료 제조 시 포도향을 내기 위해 널리 활용되는 포도 유래 화합물인 메틸안트라닐산(methyl anthranilate) 등을 비롯해 다양한 식품 및 미용 화합물을 생산하는 고성능 미생물 세포공장들을 다수 개발한 바 있다.
연구진은 이번 네이처지로부터의 초청 논문을 통해 각종 식품과 화장품에 이용되는 아미노산과 단백질, 지방 및 지방산, 비타민, 향미료, 색소, 알코올, 기능성 화합물과 기타 식품 첨가물 등을 생산할 수 있는 괄목할만한 미생물 세포공장의 개발 사례들과 이러한 미생물 유래 물질들을 성공적으로 제품화해 시장에 공급하고 있는 전세계 기업들을 총망라했다. 더 나아가 보다 다양한 식품 및 미용 화합물들을 친환경적으로 생산하면서도 경제성도 갖춘 산업용 미생물 세포공장의 개발에 박차를 가할 수 있는 다양한 시스템 대사공학 전략을 정리 및 제시했다.
예를 들어, 미생물 발효 과정을 통해 동물의 사료로 이용되거나 비료로 이용되고 있는 비식용 바이오매스 등을 통해 영양학적으로 높은 가치를 지닌 단백질이나 아미노산을 생산함으로써 전세계 식량 생산량의 증대 및 안정적인 공급에 기여할 수 있다. 더 나아가 대체육 개발 등 동물성 단백질에 대한 의존도를 낮춤으로써 가축 사육이나 물고기 양식을 통해 발생하는 온실가스 및 환경오염을 줄이는 데에도 기여할 수 있다. 또한 바닐라 향이나 포도 향을 내는 바닐린(vanillin)이나 메틸안트라닐산(methyl anthranilate)은 다양한 식품에 널리 첨가되고 있으나, 식물로부터 분리정제한 천연 제품은 생산량이 적고 생산단가가 높기 때문에 대부분의 경우 석유화학물질로부터 유래한 바닐린과 메틸안트라닐산을 식품에 첨가하고 있다.
이러한 물질들 역시 미생물의 힘을 빌려 친환경적이고 인체 친화적인 방법을 통해 생산할 수 있다. 붉은색 립스틱이나 딸기맛 우유 등 다양한 화장품이나 식품에 첨가되지만 특정한 선인장에서만 서식하는 연지벌레로부터 추출해야 하는 칼민(코치닐색소), 피부 미용에 도움을 줄 수 있으나 닭벼슬이나 소의 안구에서 추출해야 하는 하이알루론산, 건강보조제로 널리 섭취되고 있지만 상어나 생선의 간 등에서 추출하는 오메가-3 지방산 등도 미생물을 이용하면 윤리적인 문제 없이 친환경적으로 생산할 수 있다.
이번 논문의 제1 저자인 우리 대학 최경록 연구교수는 “김치나 요거트와 같은 전통 발효식품뿐만 아니라, 카카오 콩을 발효시켜야만 얻을 수 있는 초콜릿의 원료인 카카오버터나 미생물 발효를 통해 생산하는 조미료인 글루탐산나트륨처럼 미생물의 도움을 받아 생산한 식품은 이미 우리에게 친숙한 존재”라면서 “앞으로 미생물 세포공장을 통해 친환경적이고 지속가능한 방법으로 생산한 더 다양한 종류의 식품과 화장품을 일상에서 더욱 쉽게 마주할 수 있을 것이다”고 말했다.
또한 이상엽 특훈교수는 “과학기술을 활용해 더 나은 세상을 만들어가는 것은 공학자의 숙명”이라며 “시스템 대사공학 기술의 꾸준한 발전과 적극적인 활용을 통해 식량 위기와 기후변화를 동시에 해결하는 데 크게 기여할 수 있을 것”이라고 밝혔다.
한편, 이번 연구는 농촌진흥청이 지원하는 농업미생물사업단(단장 장판식)의 ‘미생물 대사시스템 제어를 통한 무기물로부터의 단백질 생산 기술 개발’ 과제 (과제책임자 KAIST 최경록 연구교수) 및 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제 (과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
2023.07.26
조회수 8812
-
 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24
조회수 8628
-
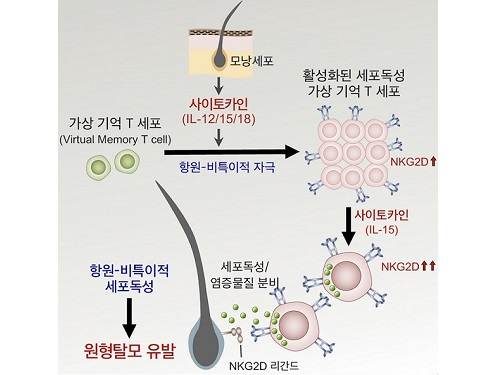 원형탈모증 일으키는 새로운 면역 T세포 발견
원형탈모는 1-2%의 유병률을 갖는 비교적 흔히 발생하는 질환으로 모낭을 침범하는 염증성 질환이다. 이는 원형의 탈모반을 특징으로 하며, 두발이나 우리 몸의 모든 털을 침범할 수 있는 비흉터성 자가면역성 탈모 질환으로, 앓고 있는 환자들은 외모에 많은 변화가 생겨 굉장한 스트레스를 받게 된다. 원형탈모증은 면역세포에 의해 발생되는 자가면역질환으로 알려져있지만 발병 기전은 지금까지 명확히 알려지지 않았다.
우리 대학 의과학대학원 박수형 교수(KAIST 전염병대비센터 센터장) 연구팀이 신의철 KAIST 의과학대학원 교수(IBS 한국바이러스기초연구소 바이러스면역연구센터장), 석준 중앙대학교병원 피부과 교수와 공동연구를 통해 만성 염증질환인 원형탈모증의 발병 기전을 발견하고 새로운 치료 전략을 제시했다고 4일 밝혔다.
연구진은 원형탈모 환자의 피부 조직 및 혈액과 원형탈모를 유도한 쥐의 피부와 림프절의 분석을 통해 가상기억 T 세포(Virtual memory T cell)로부터 유래된 새로운 면역세포군이 원형탈모증 발병의 핵심 원인임을 최초로 규명했다.
가상기억 T 세포는 항원 특이적인 자극을 받지 않았음에도 불구하고, 활성화된 면역기능을 이미 갖고 있는 세포군으로, 이들은이러스, 박테리아, 기생충 감염 등을 조절하거나 암세포를 제거하는데 도움을 준다고 알려져 왔다. 연구진은 피부에서 분비된 사이토카인(IL-12, IL-15, IL-18)이 가상기억 T세포를 활성화시켜 높은 세포독성 능력을 갖는 면역세포군으로의 분화를 일으키고, 이렇게 활성화된 면역세포는 수용체(NKG2D)를 통해 항원 비특이적인 세포독성 작용으로 모낭세포를 파괴하여 원형탈모증을 유발시키는 것을 발견하였다. 또한, 연구진은 사이토카인과 수용체(NKG2D)의 기능을 억제하여 원형탈모증의 발생을 막을 수 있음을 확인했다.
이번 연구 결과는 인체 내에서 만성 염증을 일으킬 수 있는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써, 만성 염증질환 및 자가면역질환의 병인 및 치료를 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
중앙대학교병원 석준 교수, 우리 대학 의과학대학원 조성동 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 세계적 권위지인 ‘네이처 이뮤놀로지(Nature Immunology)’에 게재됐다 (논문명: A virtual memory CD8+ T cell-originated distinct cell subset causes alopecia areata through innate-like cytotoxicity).
박수형 교수는 “이번 연구 결과는 가상기억 T 세포가 몸을 보호하는 역할을 하지 않고, 항원 비특이적인 자극에 의해 활성화된 후 오히려 염증질환을 유발할 수 있음을 최초로 보여주었다는 점에서 학문적으로나 의학적으로 큰 의미가 있다”고 말하고, “추가 연구를 통해 항체 치료제를 신약 개발한다면 다양한 만성 염증질환의 발생에 대한 새로운 치료 전략을 제시할 수 있을 것이다”라고 덧붙였다.
이번 연구는 과학기술정보통신부 중견연구자지원사업, 4대 과학기술원 공동연구프로젝트, 대한모발학회 기초분야 연구비의 지원을 받아 수행됐다.
원형탈모증 일으키는 새로운 면역 T세포 발견
원형탈모는 1-2%의 유병률을 갖는 비교적 흔히 발생하는 질환으로 모낭을 침범하는 염증성 질환이다. 이는 원형의 탈모반을 특징으로 하며, 두발이나 우리 몸의 모든 털을 침범할 수 있는 비흉터성 자가면역성 탈모 질환으로, 앓고 있는 환자들은 외모에 많은 변화가 생겨 굉장한 스트레스를 받게 된다. 원형탈모증은 면역세포에 의해 발생되는 자가면역질환으로 알려져있지만 발병 기전은 지금까지 명확히 알려지지 않았다.
우리 대학 의과학대학원 박수형 교수(KAIST 전염병대비센터 센터장) 연구팀이 신의철 KAIST 의과학대학원 교수(IBS 한국바이러스기초연구소 바이러스면역연구센터장), 석준 중앙대학교병원 피부과 교수와 공동연구를 통해 만성 염증질환인 원형탈모증의 발병 기전을 발견하고 새로운 치료 전략을 제시했다고 4일 밝혔다.
연구진은 원형탈모 환자의 피부 조직 및 혈액과 원형탈모를 유도한 쥐의 피부와 림프절의 분석을 통해 가상기억 T 세포(Virtual memory T cell)로부터 유래된 새로운 면역세포군이 원형탈모증 발병의 핵심 원인임을 최초로 규명했다.
가상기억 T 세포는 항원 특이적인 자극을 받지 않았음에도 불구하고, 활성화된 면역기능을 이미 갖고 있는 세포군으로, 이들은이러스, 박테리아, 기생충 감염 등을 조절하거나 암세포를 제거하는데 도움을 준다고 알려져 왔다. 연구진은 피부에서 분비된 사이토카인(IL-12, IL-15, IL-18)이 가상기억 T세포를 활성화시켜 높은 세포독성 능력을 갖는 면역세포군으로의 분화를 일으키고, 이렇게 활성화된 면역세포는 수용체(NKG2D)를 통해 항원 비특이적인 세포독성 작용으로 모낭세포를 파괴하여 원형탈모증을 유발시키는 것을 발견하였다. 또한, 연구진은 사이토카인과 수용체(NKG2D)의 기능을 억제하여 원형탈모증의 발생을 막을 수 있음을 확인했다.
이번 연구 결과는 인체 내에서 만성 염증을 일으킬 수 있는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써, 만성 염증질환 및 자가면역질환의 병인 및 치료를 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
중앙대학교병원 석준 교수, 우리 대학 의과학대학원 조성동 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 세계적 권위지인 ‘네이처 이뮤놀로지(Nature Immunology)’에 게재됐다 (논문명: A virtual memory CD8+ T cell-originated distinct cell subset causes alopecia areata through innate-like cytotoxicity).
박수형 교수는 “이번 연구 결과는 가상기억 T 세포가 몸을 보호하는 역할을 하지 않고, 항원 비특이적인 자극에 의해 활성화된 후 오히려 염증질환을 유발할 수 있음을 최초로 보여주었다는 점에서 학문적으로나 의학적으로 큰 의미가 있다”고 말하고, “추가 연구를 통해 항체 치료제를 신약 개발한다면 다양한 만성 염증질환의 발생에 대한 새로운 치료 전략을 제시할 수 있을 것이다”라고 덧붙였다.
이번 연구는 과학기술정보통신부 중견연구자지원사업, 4대 과학기술원 공동연구프로젝트, 대한모발학회 기초분야 연구비의 지원을 받아 수행됐다.
2023.07.04
조회수 7234
-
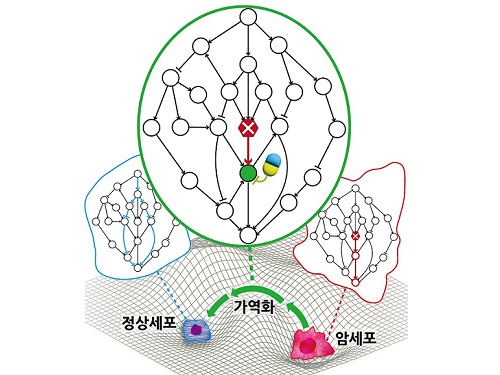 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08
조회수 10446
 항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 6041
항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 6041 기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6378
기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6378 인공장기 생체 단백질 모방 금속 필름 개발
오랜 기간에 걸쳐 생체 구조체를 형틀로 삼아 다양한 무기물을 증착 및 성장시킴으로써 생체 모방 재료를 합성하는 연구들이 이루어져 왔는데, 이를 생체 형틀법이라고 한다. 이런 생체 형틀법은 생체에 있는 특정 구조체에 사용되어 오랜 시간 동안 에너지, 광학, 마이크로로봇, 의료 분야 등에 응용되어 왔다. 특히 생체 구조체를 사용하고 모방했다는 점에서 인체 내 활용이 용이하여 인공장기나 상처 치유 분야로 많이 연구되었다.
우리 대학 신소재공학과 장재범, 김일두 교수 연구팀이 생체 형틀법을 이용해 세포외 기질을 구성하는 여러 단백질 중 원하는 특정 단백질만을 선택해 해당 단백질 구조체를 모방한 금속 필름을 합성하고 전기 전달 특성을 확인하는 것에 성공했다고 16일 밝혔다.
세포외 기질이란 세포 밖에 존재하며 세포의 분화, 성장, 이동에 중요한 역할을 수행할 뿐만 아니라 생체 조직과 기관(organ)의 구조적·기계적 특성 유지에 필수적인 생체 구조물이다. 이러한 세포외 기질은 여러 단백질을 포함하며, 그 단백질 구조체를 원하는 형태로 변형하거나 최근에는 세포외 기질을 3D 프린팅을 위한 바이오잉크로 사용할 만큼 세포외 기질을 다루는 많은 기술 개발이 진행되고 있다. 따라서 세포외 기질은 생체 형틀법을 통해 다양한 구조의 재료 합성에 이용될 수 있지만, 현재까지 관련된 연구는 많이 이뤄지지 않았다.
연구팀은 2022년 항체(Antibody)를 활용한 신개념 생체 형틀법인 `항체 유도 생체 형틀‘을 개발해 최초로 다세포 생물 내부에 있는 특정 단백질 구조체를 모방한 금속 구조체를 합성하는 데 성공했다. 이번 연구에서는 이전 연구를 세포외 기질로 확장해 세포를 지탱하는 구조체를 구성하는 단백질 중 피브로넥틴(fibronectin)을 표적 단백질로 삼아 그물형 금속 필름 제작에 성공했다.
연구팀은 이에 더 나아가 합성한 그물형 금속 필름에 추가적 처리를 통해 금속을 통한 전기 전달이 가능하도록 만들었다. 이를 기반으로 물을 전기 분해하여 수소를 생산하거나, 또는 수소와 금속간 화학적 반응을 통해 수소를 검출할 수 있는 센서로 활용할 수 있었다.
해당 기술은 다양한 생물의 세포외 기질에도 적용 가능할 것으로 예상되어 더 큰 규모나 더 복잡한 생체 모방 재료 합성도 가능할 것으로 생각된다. 또한, 원하는 형태로 세포외 기질을 패턴화 및 정렬함으로써 본 기술로 전기 회로 제작도 가능할 것으로 생각된다.
우리 대학 신소재공학과 송창우 박사과정, 안재완 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'에 10월 18일 자로 온라인 공개되었으며, 전면 표지 논문(Front Cover)으로 선정됐다. (논문명 : Metallization of Targeted Protein Assemblies in Cell-Derived Extracellular Matrix by Antibody-Guided Biotemplating).
제1 저자인 송창우 박사과정은 "이번 연구는 기존에 개발한 항체 유도 생체 형틀법을 세포외 기질로 확장함으로써 합성된 생체 모방 재료가 더 다양한 분야에 활용 가능하다는 것을 보였다ˮ 라며 "이를 기반으로 조직 수준의 세포외 기질 및 원하는 형태로 변형된 세포외 기질을 이용해 조직 공학(Tissue engineering) 및 생체 조직 제조(Biofabrication)으로 활용 범주를 넓힐 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 과학난제도전 융합연구개발사업, 웨어러블 플랫폼소재 기술센터, 우수신진연구사업 등의 지원을 받아 수행됐다.
2023.11.17 조회수 7668
인공장기 생체 단백질 모방 금속 필름 개발
오랜 기간에 걸쳐 생체 구조체를 형틀로 삼아 다양한 무기물을 증착 및 성장시킴으로써 생체 모방 재료를 합성하는 연구들이 이루어져 왔는데, 이를 생체 형틀법이라고 한다. 이런 생체 형틀법은 생체에 있는 특정 구조체에 사용되어 오랜 시간 동안 에너지, 광학, 마이크로로봇, 의료 분야 등에 응용되어 왔다. 특히 생체 구조체를 사용하고 모방했다는 점에서 인체 내 활용이 용이하여 인공장기나 상처 치유 분야로 많이 연구되었다.
우리 대학 신소재공학과 장재범, 김일두 교수 연구팀이 생체 형틀법을 이용해 세포외 기질을 구성하는 여러 단백질 중 원하는 특정 단백질만을 선택해 해당 단백질 구조체를 모방한 금속 필름을 합성하고 전기 전달 특성을 확인하는 것에 성공했다고 16일 밝혔다.
세포외 기질이란 세포 밖에 존재하며 세포의 분화, 성장, 이동에 중요한 역할을 수행할 뿐만 아니라 생체 조직과 기관(organ)의 구조적·기계적 특성 유지에 필수적인 생체 구조물이다. 이러한 세포외 기질은 여러 단백질을 포함하며, 그 단백질 구조체를 원하는 형태로 변형하거나 최근에는 세포외 기질을 3D 프린팅을 위한 바이오잉크로 사용할 만큼 세포외 기질을 다루는 많은 기술 개발이 진행되고 있다. 따라서 세포외 기질은 생체 형틀법을 통해 다양한 구조의 재료 합성에 이용될 수 있지만, 현재까지 관련된 연구는 많이 이뤄지지 않았다.
연구팀은 2022년 항체(Antibody)를 활용한 신개념 생체 형틀법인 `항체 유도 생체 형틀‘을 개발해 최초로 다세포 생물 내부에 있는 특정 단백질 구조체를 모방한 금속 구조체를 합성하는 데 성공했다. 이번 연구에서는 이전 연구를 세포외 기질로 확장해 세포를 지탱하는 구조체를 구성하는 단백질 중 피브로넥틴(fibronectin)을 표적 단백질로 삼아 그물형 금속 필름 제작에 성공했다.
연구팀은 이에 더 나아가 합성한 그물형 금속 필름에 추가적 처리를 통해 금속을 통한 전기 전달이 가능하도록 만들었다. 이를 기반으로 물을 전기 분해하여 수소를 생산하거나, 또는 수소와 금속간 화학적 반응을 통해 수소를 검출할 수 있는 센서로 활용할 수 있었다.
해당 기술은 다양한 생물의 세포외 기질에도 적용 가능할 것으로 예상되어 더 큰 규모나 더 복잡한 생체 모방 재료 합성도 가능할 것으로 생각된다. 또한, 원하는 형태로 세포외 기질을 패턴화 및 정렬함으로써 본 기술로 전기 회로 제작도 가능할 것으로 생각된다.
우리 대학 신소재공학과 송창우 박사과정, 안재완 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'에 10월 18일 자로 온라인 공개되었으며, 전면 표지 논문(Front Cover)으로 선정됐다. (논문명 : Metallization of Targeted Protein Assemblies in Cell-Derived Extracellular Matrix by Antibody-Guided Biotemplating).
제1 저자인 송창우 박사과정은 "이번 연구는 기존에 개발한 항체 유도 생체 형틀법을 세포외 기질로 확장함으로써 합성된 생체 모방 재료가 더 다양한 분야에 활용 가능하다는 것을 보였다ˮ 라며 "이를 기반으로 조직 수준의 세포외 기질 및 원하는 형태로 변형된 세포외 기질을 이용해 조직 공학(Tissue engineering) 및 생체 조직 제조(Biofabrication)으로 활용 범주를 넓힐 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 과학난제도전 융합연구개발사업, 웨어러블 플랫폼소재 기술센터, 우수신진연구사업 등의 지원을 받아 수행됐다.
2023.11.17 조회수 7668 화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
2023.11.09 조회수 7595
화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
2023.11.09 조회수 7595 이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
2023.11.07 조회수 5613
이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
2023.11.07 조회수 5613 뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16 조회수 7197
뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16 조회수 7197 인공지능으로 파킨슨병 맞춤형 치료 가능
파킨슨병 같은 만성 퇴행성 뇌 질환의 경우, 생존 환자의 뇌세포에 직접 접근이 제한적이기 때문에, 뇌 질환 환자의 세포 데이터를 토대로 환자 질병의 메커니즘 하위 유형을 인공지능으로 예측하는 것은 시도된 바가 없다.
우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 프랜시스 크릭 연구소(Francis Crick Institute)와의 공동 연구로 파킨슨병 환자의 개인별 질병 하위 유형을 예측하는 인공지능 기반의 플랫폼을 개발했다고 15일 밝혔다.
최민이 교수 연구팀이 개발한 플랫폼은 파킨슨병 환자의 역분화 만능 줄기세포(hiPSC)에서 분화된 신경 세포의 핵, 미토콘드리아, 리보솜 이미지 정보만 학습해 파킨슨 환자의 병리적 하위 유형을 정확하게 예측한다.
이 기술을 활용하면 환자별로 다르게 나타나는 파킨슨병 양상을 겉으로 보이는 발현형이 아닌 생물학적 메커니즘별로 분류할 수 있다. 이를 통해 원인 미상의 파킨슨병 환자가 속한 분자 세포적 하위 유형별로 진단이 가능해져 환자 맞춤형 치료의 길을 열 수 있다. 또 이 플랫폼은 고속의 대량 스크리닝 시스템을 사용하기 때문에 병리적 하위 유형에 적합한 맞춤형 약물 개발 파이프라인으로도 활용될 수 있다.
지금까지 파킨슨병의 치료는 환자 개별의 병리 상태를 고려하지 않고 확률에 기댄 ‘일률적 접근’ 방식을 사용해 왔다. 이러한 접근 방식은 병리적 원인과 치료 방법 사이의 불일치로 인해 치료 효과를 향상하기 어려웠다.
최민이 교수 연구팀이 개발한 플랫폼을 사용하면 개별 환자 뇌세포의 분자 및 세포 정보를 정밀하게 프로파일링할 수 있다. 이를 토대로 환자들의 질병 하위 유형을 정확히 진단할 수 있어서 궁극적으로 ‘정밀 의학 (Precise medicine)’이 가능해진다. 이는 각 개인에게 맞춤화된 치료 (Personalized medicine)로 이어져 치료 효과를 크게 향상할 수 있을 것으로 기대된다.
이 플랫폼은 2012년 노벨의학상 수상 기술인 유도만능줄기세포(iPSC: 성인 피부세포나 혈액에서 얻은 체세포를 태아기의 미분화 상태로 리프로그래밍한 세포. 어떤 장기 세포로도 분화가 가능)를 분화시켜 얻은 뇌세포를 사용하는 ‘접시 속 질병(disease in a dish)’ 패러다임이다. 이는 퇴행성 뇌 질환처럼 병변을 직접 얻을 수 없거나, 인간의 뇌를 정확하게 모사할 수 없는 동물 모델의 한계점을 극복할 수 있는 기술 중 하나로 주목받고 있다. 특히, 접시 속에 배양한 자신의 표적 질병 세포를 순차적으로 이미징하면 일련의 병리적 사건을 추적할 수 있어 질병 진행에 따른 약물 반응 결과를 예측할 수 있다는 이점이 있다.
교신 저자인 최민이 교수는 "이번 연구는 실험실에서 얻은 생물학적 데이터를 인공지능에 효과적으로 학습시켜, 정확도가 높은 질병 하위 유형 분류 모델을 생성하는 방법을 구체적으로 소개했다”며, "이 플랫폼은 자폐 스펙트럼과 같이 환자 개인별 증상이 뚜렷하게 다른 뇌 질환의 하위 유형을 분류하는 데에도 유용할 것이며, 이를 통해 효과적인 치료법 개발도 가능해질 것이다”라고 연구의 의의를 설명했다.
이번 논문은 영국 Medical Research Council (MRC)와 대교-KAIST 인지 향상 연구센터의 지원으로 수행됐으며, 국제 학술지 ‘네이처 머신 인텔리젼스 (Nature Machine Intelligence, IF = 25.8) 8월호에 출판됐다 (논문명: Prediction of mechanistic subtypes of Parkinson’s using patient-derived stem cell model)
2023.08.16 조회수 9448
인공지능으로 파킨슨병 맞춤형 치료 가능
파킨슨병 같은 만성 퇴행성 뇌 질환의 경우, 생존 환자의 뇌세포에 직접 접근이 제한적이기 때문에, 뇌 질환 환자의 세포 데이터를 토대로 환자 질병의 메커니즘 하위 유형을 인공지능으로 예측하는 것은 시도된 바가 없다.
우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 프랜시스 크릭 연구소(Francis Crick Institute)와의 공동 연구로 파킨슨병 환자의 개인별 질병 하위 유형을 예측하는 인공지능 기반의 플랫폼을 개발했다고 15일 밝혔다.
최민이 교수 연구팀이 개발한 플랫폼은 파킨슨병 환자의 역분화 만능 줄기세포(hiPSC)에서 분화된 신경 세포의 핵, 미토콘드리아, 리보솜 이미지 정보만 학습해 파킨슨 환자의 병리적 하위 유형을 정확하게 예측한다.
이 기술을 활용하면 환자별로 다르게 나타나는 파킨슨병 양상을 겉으로 보이는 발현형이 아닌 생물학적 메커니즘별로 분류할 수 있다. 이를 통해 원인 미상의 파킨슨병 환자가 속한 분자 세포적 하위 유형별로 진단이 가능해져 환자 맞춤형 치료의 길을 열 수 있다. 또 이 플랫폼은 고속의 대량 스크리닝 시스템을 사용하기 때문에 병리적 하위 유형에 적합한 맞춤형 약물 개발 파이프라인으로도 활용될 수 있다.
지금까지 파킨슨병의 치료는 환자 개별의 병리 상태를 고려하지 않고 확률에 기댄 ‘일률적 접근’ 방식을 사용해 왔다. 이러한 접근 방식은 병리적 원인과 치료 방법 사이의 불일치로 인해 치료 효과를 향상하기 어려웠다.
최민이 교수 연구팀이 개발한 플랫폼을 사용하면 개별 환자 뇌세포의 분자 및 세포 정보를 정밀하게 프로파일링할 수 있다. 이를 토대로 환자들의 질병 하위 유형을 정확히 진단할 수 있어서 궁극적으로 ‘정밀 의학 (Precise medicine)’이 가능해진다. 이는 각 개인에게 맞춤화된 치료 (Personalized medicine)로 이어져 치료 효과를 크게 향상할 수 있을 것으로 기대된다.
이 플랫폼은 2012년 노벨의학상 수상 기술인 유도만능줄기세포(iPSC: 성인 피부세포나 혈액에서 얻은 체세포를 태아기의 미분화 상태로 리프로그래밍한 세포. 어떤 장기 세포로도 분화가 가능)를 분화시켜 얻은 뇌세포를 사용하는 ‘접시 속 질병(disease in a dish)’ 패러다임이다. 이는 퇴행성 뇌 질환처럼 병변을 직접 얻을 수 없거나, 인간의 뇌를 정확하게 모사할 수 없는 동물 모델의 한계점을 극복할 수 있는 기술 중 하나로 주목받고 있다. 특히, 접시 속에 배양한 자신의 표적 질병 세포를 순차적으로 이미징하면 일련의 병리적 사건을 추적할 수 있어 질병 진행에 따른 약물 반응 결과를 예측할 수 있다는 이점이 있다.
교신 저자인 최민이 교수는 "이번 연구는 실험실에서 얻은 생물학적 데이터를 인공지능에 효과적으로 학습시켜, 정확도가 높은 질병 하위 유형 분류 모델을 생성하는 방법을 구체적으로 소개했다”며, "이 플랫폼은 자폐 스펙트럼과 같이 환자 개인별 증상이 뚜렷하게 다른 뇌 질환의 하위 유형을 분류하는 데에도 유용할 것이며, 이를 통해 효과적인 치료법 개발도 가능해질 것이다”라고 연구의 의의를 설명했다.
이번 논문은 영국 Medical Research Council (MRC)와 대교-KAIST 인지 향상 연구센터의 지원으로 수행됐으며, 국제 학술지 ‘네이처 머신 인텔리젼스 (Nature Machine Intelligence, IF = 25.8) 8월호에 출판됐다 (논문명: Prediction of mechanistic subtypes of Parkinson’s using patient-derived stem cell model)
2023.08.16 조회수 9448 아동 학대로 인한 정신질환 발병 원인 최초 규명
아동기 시 부모에게서 떨어져서 방치되거나 학대를 받을 경우, 극심한 스트레스 현상이 일어난다. 이러한 스트레스 상황을 겪게 되면 성인으로 성장하는 과정 동안 뇌 신경 회로망 및 기능이 크게 변화되어 조현병 및 우울증과 같은 정신질환이 발생될 수 있다. 하지만 현재까지 아동기 스트레스에 따른 정신질환의 원인과 그 제어 방법에 대해서는 정확히 알려진 바가 없다.
우리 대학 생명과학과 정원석 교수 연구팀이 아동 학대 및 방임 등의 아동기 스트레스로 인해 발병되는 정신질환이 별아교세포의 과도한 시냅스 제거에서 기인함을 최초로 규명해 면역 관련 최고 국제 학술지인 ‘이뮤니티(Immunity)’에 발표했다고 1일 밝혔다.
정원석 교수 연구팀은 뇌에서 면역기능을 담당하는 별아교세포가 스트레스 호르몬에 반응하여 과도하게 흥분성 시냅스를 제거하는 현상이, 아동 학대 및 방임에 따른 정신질환 발병의 주요 원인임을 최초로 규명하였다. 과도한 스트레스가 다양한 정신질환의 원인으로 작용할 수 있음이 임상적으로 알려져 있었지만, 그 정확한 발병 기전은 알려지지 않았기 때문에 이번 연구는 스트레스로 인한 정신질환의 예방 및 치료에 크게 응용될 수 있을 것으로 기대된다.
연구팀은 미국식품의약국 (FDA)에서 승인된 임상 약물 스크리닝을 진행해 별아교세포의 외부 물질을 잡아 먹어 제거하는 역할(포식 작용)을 조절하는 새로운 기작을 발굴했다. 그 결과, 연구팀은 스트레스 호르몬이라 불리는 합성 글루코코르티코이드(synthetic glucocorticoid)가 별아교세포의 포식 작용을 비정상적으로 크게 높이는 것을 발견했다. 글루코코르티코이드는 당대사, 항염증 등 생명 유지에 필요한 역할을 하는 한편 스트레스와 같은 외부 자극에 의해 분비돼 신체가 대응할 수 있도록 한다. 하지만 만성 스트레스로 인해 글루코코르티코이드에 과도하게 장기간 노출되면 우울증, 인지장애, 불안 증세와 같은 다양한 정신질환이 발병할 수 있다.
연구팀은 아동기 스트레스로 인한 별아교세포의 기능 변화를 이해하고자 아동기 사회성 결핍(early social deprivation) 생쥐 모델을 활용했고, 그 결과 스트레스 호르몬이 별아교세포의 글루코코르티코이드 수용체 (glucocorticoid receptor; GR)와 결합해 별아교세포의 포식 작용에 중요한 역할을 하는 MERTK(Mer Tyrosine Kinase)라는 수용체의 발현을 크게 증가시킴을 알아냈다. 놀랍게도 별아교세포는 증가된 MERTK를 통해 다양한 대뇌 피질에 존재하는 특정 신경 세포의 흥분성 시냅스만을 선택적으로 잡아 먹어 감소시켰으며, 이로 인한 비정상적인 신경 회로망 형성으로 추후 성인기에 사회성 결핍과 우울증 같은 복합적인 행동 이상이 일어남을 발견했다.
뿐만 아니라 연구팀은 별아교세포와 함께 뇌 면역 기능에 중요한 역할을 담당하는 것으로 알려진 미세아교세포는 아동기 사회성 결핍 쥐 모델에서의 시냅스 제거에는 전혀 참여하고 있지 않음을 관찰했다. 이는 아동기 스트레스 상황에서 미세아교세포가 아닌 별아교세포가 특이적으로 스트레스 호르몬에 반응해 뇌의 환경을 조절하고 있음을 확인한 것이다.
연구팀은 이 같은 발견이 인간에게도 적용될 수 있는지를 알아보기 위해, 인간 만능 유도 줄기세포에서 유래한 뇌 오가노이드를 활용해 스트레스 호르몬에 대한 반응을 확인했다. 중요하게도 연구팀은 인간 뇌 오가노이드에서도 스트레스 호르몬에 의해 별아교세포의 글루코코르티코이드 수용체와 포식 수용체가 모두 활성화됨을 발견했으며, 또한 별아교세포가 흥분성 시냅스를 과도하게 제거함을 확인했다. 이로써 스트레스 반응에 대한 쥐와 인간의 시냅스 조절 메커니즘이 같음을 보임으로써, 연구팀은 이번 발견이 인간의 정신질환 치료에도 응용될 수 있음을 제시했다.
정원석 교수는 “지금까지 아동기 스트레스와 뇌 질환 발병의 메커니즘은 잘 밝혀져 있지 않았지만, 이번 연구를 통해 과도한 별아교세포의 포식 작용이 정신질환 발병에 있어 중요한 원인이 될 수 있음을 최초로 증명했다”고 언급하며 “추후 다양한 뇌 질환의 이해와 치료에 있어서 별아교세포의 면역기능 조절이 근본적인 타겟으로 응용될 수 있을 것”이라고 밝혔다.
우리 대학 생명과학과 변유경, 김규리 박사과정 학생과 김남식 박사후연구원이 공동 제1 저자로 참여한 이번 연구는 셀(Cell) 자매지이자 면역 관련 최고 국제 학술지인 `이뮤니티 (IMMUNITY)' 7월 31일 字 온라인 출판됐다. (논문명 : Stress induces behavioral abnormalities by increasing expression of phagocytic receptor MERTK in astrocytes to promote synapse phagocytosis).
한편 이번 연구는 연구재단 중견 연구, 뇌질환극복연구사업, 뇌기능 규명 조절 기술 개발사업의 지원을 받아 수행됐다.
2023.08.01 조회수 7702
아동 학대로 인한 정신질환 발병 원인 최초 규명
아동기 시 부모에게서 떨어져서 방치되거나 학대를 받을 경우, 극심한 스트레스 현상이 일어난다. 이러한 스트레스 상황을 겪게 되면 성인으로 성장하는 과정 동안 뇌 신경 회로망 및 기능이 크게 변화되어 조현병 및 우울증과 같은 정신질환이 발생될 수 있다. 하지만 현재까지 아동기 스트레스에 따른 정신질환의 원인과 그 제어 방법에 대해서는 정확히 알려진 바가 없다.
우리 대학 생명과학과 정원석 교수 연구팀이 아동 학대 및 방임 등의 아동기 스트레스로 인해 발병되는 정신질환이 별아교세포의 과도한 시냅스 제거에서 기인함을 최초로 규명해 면역 관련 최고 국제 학술지인 ‘이뮤니티(Immunity)’에 발표했다고 1일 밝혔다.
정원석 교수 연구팀은 뇌에서 면역기능을 담당하는 별아교세포가 스트레스 호르몬에 반응하여 과도하게 흥분성 시냅스를 제거하는 현상이, 아동 학대 및 방임에 따른 정신질환 발병의 주요 원인임을 최초로 규명하였다. 과도한 스트레스가 다양한 정신질환의 원인으로 작용할 수 있음이 임상적으로 알려져 있었지만, 그 정확한 발병 기전은 알려지지 않았기 때문에 이번 연구는 스트레스로 인한 정신질환의 예방 및 치료에 크게 응용될 수 있을 것으로 기대된다.
연구팀은 미국식품의약국 (FDA)에서 승인된 임상 약물 스크리닝을 진행해 별아교세포의 외부 물질을 잡아 먹어 제거하는 역할(포식 작용)을 조절하는 새로운 기작을 발굴했다. 그 결과, 연구팀은 스트레스 호르몬이라 불리는 합성 글루코코르티코이드(synthetic glucocorticoid)가 별아교세포의 포식 작용을 비정상적으로 크게 높이는 것을 발견했다. 글루코코르티코이드는 당대사, 항염증 등 생명 유지에 필요한 역할을 하는 한편 스트레스와 같은 외부 자극에 의해 분비돼 신체가 대응할 수 있도록 한다. 하지만 만성 스트레스로 인해 글루코코르티코이드에 과도하게 장기간 노출되면 우울증, 인지장애, 불안 증세와 같은 다양한 정신질환이 발병할 수 있다.
연구팀은 아동기 스트레스로 인한 별아교세포의 기능 변화를 이해하고자 아동기 사회성 결핍(early social deprivation) 생쥐 모델을 활용했고, 그 결과 스트레스 호르몬이 별아교세포의 글루코코르티코이드 수용체 (glucocorticoid receptor; GR)와 결합해 별아교세포의 포식 작용에 중요한 역할을 하는 MERTK(Mer Tyrosine Kinase)라는 수용체의 발현을 크게 증가시킴을 알아냈다. 놀랍게도 별아교세포는 증가된 MERTK를 통해 다양한 대뇌 피질에 존재하는 특정 신경 세포의 흥분성 시냅스만을 선택적으로 잡아 먹어 감소시켰으며, 이로 인한 비정상적인 신경 회로망 형성으로 추후 성인기에 사회성 결핍과 우울증 같은 복합적인 행동 이상이 일어남을 발견했다.
뿐만 아니라 연구팀은 별아교세포와 함께 뇌 면역 기능에 중요한 역할을 담당하는 것으로 알려진 미세아교세포는 아동기 사회성 결핍 쥐 모델에서의 시냅스 제거에는 전혀 참여하고 있지 않음을 관찰했다. 이는 아동기 스트레스 상황에서 미세아교세포가 아닌 별아교세포가 특이적으로 스트레스 호르몬에 반응해 뇌의 환경을 조절하고 있음을 확인한 것이다.
연구팀은 이 같은 발견이 인간에게도 적용될 수 있는지를 알아보기 위해, 인간 만능 유도 줄기세포에서 유래한 뇌 오가노이드를 활용해 스트레스 호르몬에 대한 반응을 확인했다. 중요하게도 연구팀은 인간 뇌 오가노이드에서도 스트레스 호르몬에 의해 별아교세포의 글루코코르티코이드 수용체와 포식 수용체가 모두 활성화됨을 발견했으며, 또한 별아교세포가 흥분성 시냅스를 과도하게 제거함을 확인했다. 이로써 스트레스 반응에 대한 쥐와 인간의 시냅스 조절 메커니즘이 같음을 보임으로써, 연구팀은 이번 발견이 인간의 정신질환 치료에도 응용될 수 있음을 제시했다.
정원석 교수는 “지금까지 아동기 스트레스와 뇌 질환 발병의 메커니즘은 잘 밝혀져 있지 않았지만, 이번 연구를 통해 과도한 별아교세포의 포식 작용이 정신질환 발병에 있어 중요한 원인이 될 수 있음을 최초로 증명했다”고 언급하며 “추후 다양한 뇌 질환의 이해와 치료에 있어서 별아교세포의 면역기능 조절이 근본적인 타겟으로 응용될 수 있을 것”이라고 밝혔다.
우리 대학 생명과학과 변유경, 김규리 박사과정 학생과 김남식 박사후연구원이 공동 제1 저자로 참여한 이번 연구는 셀(Cell) 자매지이자 면역 관련 최고 국제 학술지인 `이뮤니티 (IMMUNITY)' 7월 31일 字 온라인 출판됐다. (논문명 : Stress induces behavioral abnormalities by increasing expression of phagocytic receptor MERTK in astrocytes to promote synapse phagocytosis).
한편 이번 연구는 연구재단 중견 연구, 뇌질환극복연구사업, 뇌기능 규명 조절 기술 개발사업의 지원을 받아 수행됐다.
2023.08.01 조회수 7702 대체육 풍미 향상 등 미생물 세포공장 제시
수십 년 동안 전 세계 인구 증가에도 불구하고 기후변화 및 이상기후의 심화로 인한 식량 생산성 감소와 전쟁 등의 국제적 분쟁으로 인한 식량 공급망의 파괴는 식량부족과 영양 불평등 문제를 심화시키며 세계적인 식량 위기를 가시화하고 있다. 그러나 아이러니하게도 다른 한편에서는 환경과 지속가능성에 대한 인식이 고조됨에 따라 보다 친환경적이면서 고품질을 자랑하는 식품 및 미용품에 대한 수요 증가가 동시에 관찰되고 있다. 미생물은 이러한 다면적인 문제들을 동시에 풀어낼 수 있는 열쇠로서 주목받고 있다.
우리 대학 생물공정연구센터 최경록 연구교수와 생명화학공학과 이상엽 특훈교수가 ‘식품 및 화장품 생산을 위한 미생물의 시스템 대사공학’논문을 발표했다고 26일 밝혔다. 이번 논문은 네이처(Nature) 誌가 발행하는 ‘네이처 생명공학 리뷰(Nature Reviews Bioengineering)’의 초청으로 준비한 것으로 동료심사를 거쳐 온라인 게재됐다.
※ 논문명 : Systems metabolic engineering of microorganisms for food and cosmetics production
※ 저자 정보 : 최경록(한국과학기술원, 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 2명
시스템 대사공학은 석유에 대한 의존도가 높은 기존의 화학산업을 대체할 바이오산업의 핵심인 미생물 세포공장을 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다. 연구진은 시스템 대사공학 전략을 적용함으로써 대체육의 풍미와 색감을 향상할 수 있는 천연물질인 헴철(heme)과 아연-프로토포르피린 IX(zinc protoporphyrin IX), 식품과 화장품에 폭넓게 활용할 수 있는 기능성 천연 색소인 라이코펜(lycopene)과 베타카로틴(β-carotene), 식품이나 음료 제조 시 포도향을 내기 위해 널리 활용되는 포도 유래 화합물인 메틸안트라닐산(methyl anthranilate) 등을 비롯해 다양한 식품 및 미용 화합물을 생산하는 고성능 미생물 세포공장들을 다수 개발한 바 있다.
연구진은 이번 네이처지로부터의 초청 논문을 통해 각종 식품과 화장품에 이용되는 아미노산과 단백질, 지방 및 지방산, 비타민, 향미료, 색소, 알코올, 기능성 화합물과 기타 식품 첨가물 등을 생산할 수 있는 괄목할만한 미생물 세포공장의 개발 사례들과 이러한 미생물 유래 물질들을 성공적으로 제품화해 시장에 공급하고 있는 전세계 기업들을 총망라했다. 더 나아가 보다 다양한 식품 및 미용 화합물들을 친환경적으로 생산하면서도 경제성도 갖춘 산업용 미생물 세포공장의 개발에 박차를 가할 수 있는 다양한 시스템 대사공학 전략을 정리 및 제시했다.
예를 들어, 미생물 발효 과정을 통해 동물의 사료로 이용되거나 비료로 이용되고 있는 비식용 바이오매스 등을 통해 영양학적으로 높은 가치를 지닌 단백질이나 아미노산을 생산함으로써 전세계 식량 생산량의 증대 및 안정적인 공급에 기여할 수 있다. 더 나아가 대체육 개발 등 동물성 단백질에 대한 의존도를 낮춤으로써 가축 사육이나 물고기 양식을 통해 발생하는 온실가스 및 환경오염을 줄이는 데에도 기여할 수 있다. 또한 바닐라 향이나 포도 향을 내는 바닐린(vanillin)이나 메틸안트라닐산(methyl anthranilate)은 다양한 식품에 널리 첨가되고 있으나, 식물로부터 분리정제한 천연 제품은 생산량이 적고 생산단가가 높기 때문에 대부분의 경우 석유화학물질로부터 유래한 바닐린과 메틸안트라닐산을 식품에 첨가하고 있다.
이러한 물질들 역시 미생물의 힘을 빌려 친환경적이고 인체 친화적인 방법을 통해 생산할 수 있다. 붉은색 립스틱이나 딸기맛 우유 등 다양한 화장품이나 식품에 첨가되지만 특정한 선인장에서만 서식하는 연지벌레로부터 추출해야 하는 칼민(코치닐색소), 피부 미용에 도움을 줄 수 있으나 닭벼슬이나 소의 안구에서 추출해야 하는 하이알루론산, 건강보조제로 널리 섭취되고 있지만 상어나 생선의 간 등에서 추출하는 오메가-3 지방산 등도 미생물을 이용하면 윤리적인 문제 없이 친환경적으로 생산할 수 있다.
이번 논문의 제1 저자인 우리 대학 최경록 연구교수는 “김치나 요거트와 같은 전통 발효식품뿐만 아니라, 카카오 콩을 발효시켜야만 얻을 수 있는 초콜릿의 원료인 카카오버터나 미생물 발효를 통해 생산하는 조미료인 글루탐산나트륨처럼 미생물의 도움을 받아 생산한 식품은 이미 우리에게 친숙한 존재”라면서 “앞으로 미생물 세포공장을 통해 친환경적이고 지속가능한 방법으로 생산한 더 다양한 종류의 식품과 화장품을 일상에서 더욱 쉽게 마주할 수 있을 것이다”고 말했다.
또한 이상엽 특훈교수는 “과학기술을 활용해 더 나은 세상을 만들어가는 것은 공학자의 숙명”이라며 “시스템 대사공학 기술의 꾸준한 발전과 적극적인 활용을 통해 식량 위기와 기후변화를 동시에 해결하는 데 크게 기여할 수 있을 것”이라고 밝혔다.
한편, 이번 연구는 농촌진흥청이 지원하는 농업미생물사업단(단장 장판식)의 ‘미생물 대사시스템 제어를 통한 무기물로부터의 단백질 생산 기술 개발’ 과제 (과제책임자 KAIST 최경록 연구교수) 및 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제 (과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
2023.07.26 조회수 8812
대체육 풍미 향상 등 미생물 세포공장 제시
수십 년 동안 전 세계 인구 증가에도 불구하고 기후변화 및 이상기후의 심화로 인한 식량 생산성 감소와 전쟁 등의 국제적 분쟁으로 인한 식량 공급망의 파괴는 식량부족과 영양 불평등 문제를 심화시키며 세계적인 식량 위기를 가시화하고 있다. 그러나 아이러니하게도 다른 한편에서는 환경과 지속가능성에 대한 인식이 고조됨에 따라 보다 친환경적이면서 고품질을 자랑하는 식품 및 미용품에 대한 수요 증가가 동시에 관찰되고 있다. 미생물은 이러한 다면적인 문제들을 동시에 풀어낼 수 있는 열쇠로서 주목받고 있다.
우리 대학 생물공정연구센터 최경록 연구교수와 생명화학공학과 이상엽 특훈교수가 ‘식품 및 화장품 생산을 위한 미생물의 시스템 대사공학’논문을 발표했다고 26일 밝혔다. 이번 논문은 네이처(Nature) 誌가 발행하는 ‘네이처 생명공학 리뷰(Nature Reviews Bioengineering)’의 초청으로 준비한 것으로 동료심사를 거쳐 온라인 게재됐다.
※ 논문명 : Systems metabolic engineering of microorganisms for food and cosmetics production
※ 저자 정보 : 최경록(한국과학기술원, 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 2명
시스템 대사공학은 석유에 대한 의존도가 높은 기존의 화학산업을 대체할 바이오산업의 핵심인 미생물 세포공장을 보다 효과적으로 개발하기 위해 KAIST 이상엽 특훈교수가 창시한 연구 분야다. 연구진은 시스템 대사공학 전략을 적용함으로써 대체육의 풍미와 색감을 향상할 수 있는 천연물질인 헴철(heme)과 아연-프로토포르피린 IX(zinc protoporphyrin IX), 식품과 화장품에 폭넓게 활용할 수 있는 기능성 천연 색소인 라이코펜(lycopene)과 베타카로틴(β-carotene), 식품이나 음료 제조 시 포도향을 내기 위해 널리 활용되는 포도 유래 화합물인 메틸안트라닐산(methyl anthranilate) 등을 비롯해 다양한 식품 및 미용 화합물을 생산하는 고성능 미생물 세포공장들을 다수 개발한 바 있다.
연구진은 이번 네이처지로부터의 초청 논문을 통해 각종 식품과 화장품에 이용되는 아미노산과 단백질, 지방 및 지방산, 비타민, 향미료, 색소, 알코올, 기능성 화합물과 기타 식품 첨가물 등을 생산할 수 있는 괄목할만한 미생물 세포공장의 개발 사례들과 이러한 미생물 유래 물질들을 성공적으로 제품화해 시장에 공급하고 있는 전세계 기업들을 총망라했다. 더 나아가 보다 다양한 식품 및 미용 화합물들을 친환경적으로 생산하면서도 경제성도 갖춘 산업용 미생물 세포공장의 개발에 박차를 가할 수 있는 다양한 시스템 대사공학 전략을 정리 및 제시했다.
예를 들어, 미생물 발효 과정을 통해 동물의 사료로 이용되거나 비료로 이용되고 있는 비식용 바이오매스 등을 통해 영양학적으로 높은 가치를 지닌 단백질이나 아미노산을 생산함으로써 전세계 식량 생산량의 증대 및 안정적인 공급에 기여할 수 있다. 더 나아가 대체육 개발 등 동물성 단백질에 대한 의존도를 낮춤으로써 가축 사육이나 물고기 양식을 통해 발생하는 온실가스 및 환경오염을 줄이는 데에도 기여할 수 있다. 또한 바닐라 향이나 포도 향을 내는 바닐린(vanillin)이나 메틸안트라닐산(methyl anthranilate)은 다양한 식품에 널리 첨가되고 있으나, 식물로부터 분리정제한 천연 제품은 생산량이 적고 생산단가가 높기 때문에 대부분의 경우 석유화학물질로부터 유래한 바닐린과 메틸안트라닐산을 식품에 첨가하고 있다.
이러한 물질들 역시 미생물의 힘을 빌려 친환경적이고 인체 친화적인 방법을 통해 생산할 수 있다. 붉은색 립스틱이나 딸기맛 우유 등 다양한 화장품이나 식품에 첨가되지만 특정한 선인장에서만 서식하는 연지벌레로부터 추출해야 하는 칼민(코치닐색소), 피부 미용에 도움을 줄 수 있으나 닭벼슬이나 소의 안구에서 추출해야 하는 하이알루론산, 건강보조제로 널리 섭취되고 있지만 상어나 생선의 간 등에서 추출하는 오메가-3 지방산 등도 미생물을 이용하면 윤리적인 문제 없이 친환경적으로 생산할 수 있다.
이번 논문의 제1 저자인 우리 대학 최경록 연구교수는 “김치나 요거트와 같은 전통 발효식품뿐만 아니라, 카카오 콩을 발효시켜야만 얻을 수 있는 초콜릿의 원료인 카카오버터나 미생물 발효를 통해 생산하는 조미료인 글루탐산나트륨처럼 미생물의 도움을 받아 생산한 식품은 이미 우리에게 친숙한 존재”라면서 “앞으로 미생물 세포공장을 통해 친환경적이고 지속가능한 방법으로 생산한 더 다양한 종류의 식품과 화장품을 일상에서 더욱 쉽게 마주할 수 있을 것이다”고 말했다.
또한 이상엽 특훈교수는 “과학기술을 활용해 더 나은 세상을 만들어가는 것은 공학자의 숙명”이라며 “시스템 대사공학 기술의 꾸준한 발전과 적극적인 활용을 통해 식량 위기와 기후변화를 동시에 해결하는 데 크게 기여할 수 있을 것”이라고 밝혔다.
한편, 이번 연구는 농촌진흥청이 지원하는 농업미생물사업단(단장 장판식)의 ‘미생물 대사시스템 제어를 통한 무기물로부터의 단백질 생산 기술 개발’ 과제 (과제책임자 KAIST 최경록 연구교수) 및 과기정통부가 지원하는 석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제 (과제책임자 KAIST 이상엽 특훈교수)의 지원을 받아 수행됐다.
2023.07.26 조회수 8812 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 8628
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 8628 원형탈모증 일으키는 새로운 면역 T세포 발견
원형탈모는 1-2%의 유병률을 갖는 비교적 흔히 발생하는 질환으로 모낭을 침범하는 염증성 질환이다. 이는 원형의 탈모반을 특징으로 하며, 두발이나 우리 몸의 모든 털을 침범할 수 있는 비흉터성 자가면역성 탈모 질환으로, 앓고 있는 환자들은 외모에 많은 변화가 생겨 굉장한 스트레스를 받게 된다. 원형탈모증은 면역세포에 의해 발생되는 자가면역질환으로 알려져있지만 발병 기전은 지금까지 명확히 알려지지 않았다.
우리 대학 의과학대학원 박수형 교수(KAIST 전염병대비센터 센터장) 연구팀이 신의철 KAIST 의과학대학원 교수(IBS 한국바이러스기초연구소 바이러스면역연구센터장), 석준 중앙대학교병원 피부과 교수와 공동연구를 통해 만성 염증질환인 원형탈모증의 발병 기전을 발견하고 새로운 치료 전략을 제시했다고 4일 밝혔다.
연구진은 원형탈모 환자의 피부 조직 및 혈액과 원형탈모를 유도한 쥐의 피부와 림프절의 분석을 통해 가상기억 T 세포(Virtual memory T cell)로부터 유래된 새로운 면역세포군이 원형탈모증 발병의 핵심 원인임을 최초로 규명했다.
가상기억 T 세포는 항원 특이적인 자극을 받지 않았음에도 불구하고, 활성화된 면역기능을 이미 갖고 있는 세포군으로, 이들은이러스, 박테리아, 기생충 감염 등을 조절하거나 암세포를 제거하는데 도움을 준다고 알려져 왔다. 연구진은 피부에서 분비된 사이토카인(IL-12, IL-15, IL-18)이 가상기억 T세포를 활성화시켜 높은 세포독성 능력을 갖는 면역세포군으로의 분화를 일으키고, 이렇게 활성화된 면역세포는 수용체(NKG2D)를 통해 항원 비특이적인 세포독성 작용으로 모낭세포를 파괴하여 원형탈모증을 유발시키는 것을 발견하였다. 또한, 연구진은 사이토카인과 수용체(NKG2D)의 기능을 억제하여 원형탈모증의 발생을 막을 수 있음을 확인했다.
이번 연구 결과는 인체 내에서 만성 염증을 일으킬 수 있는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써, 만성 염증질환 및 자가면역질환의 병인 및 치료를 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
중앙대학교병원 석준 교수, 우리 대학 의과학대학원 조성동 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 세계적 권위지인 ‘네이처 이뮤놀로지(Nature Immunology)’에 게재됐다 (논문명: A virtual memory CD8+ T cell-originated distinct cell subset causes alopecia areata through innate-like cytotoxicity).
박수형 교수는 “이번 연구 결과는 가상기억 T 세포가 몸을 보호하는 역할을 하지 않고, 항원 비특이적인 자극에 의해 활성화된 후 오히려 염증질환을 유발할 수 있음을 최초로 보여주었다는 점에서 학문적으로나 의학적으로 큰 의미가 있다”고 말하고, “추가 연구를 통해 항체 치료제를 신약 개발한다면 다양한 만성 염증질환의 발생에 대한 새로운 치료 전략을 제시할 수 있을 것이다”라고 덧붙였다.
이번 연구는 과학기술정보통신부 중견연구자지원사업, 4대 과학기술원 공동연구프로젝트, 대한모발학회 기초분야 연구비의 지원을 받아 수행됐다.
2023.07.04 조회수 7234
원형탈모증 일으키는 새로운 면역 T세포 발견
원형탈모는 1-2%의 유병률을 갖는 비교적 흔히 발생하는 질환으로 모낭을 침범하는 염증성 질환이다. 이는 원형의 탈모반을 특징으로 하며, 두발이나 우리 몸의 모든 털을 침범할 수 있는 비흉터성 자가면역성 탈모 질환으로, 앓고 있는 환자들은 외모에 많은 변화가 생겨 굉장한 스트레스를 받게 된다. 원형탈모증은 면역세포에 의해 발생되는 자가면역질환으로 알려져있지만 발병 기전은 지금까지 명확히 알려지지 않았다.
우리 대학 의과학대학원 박수형 교수(KAIST 전염병대비센터 센터장) 연구팀이 신의철 KAIST 의과학대학원 교수(IBS 한국바이러스기초연구소 바이러스면역연구센터장), 석준 중앙대학교병원 피부과 교수와 공동연구를 통해 만성 염증질환인 원형탈모증의 발병 기전을 발견하고 새로운 치료 전략을 제시했다고 4일 밝혔다.
연구진은 원형탈모 환자의 피부 조직 및 혈액과 원형탈모를 유도한 쥐의 피부와 림프절의 분석을 통해 가상기억 T 세포(Virtual memory T cell)로부터 유래된 새로운 면역세포군이 원형탈모증 발병의 핵심 원인임을 최초로 규명했다.
가상기억 T 세포는 항원 특이적인 자극을 받지 않았음에도 불구하고, 활성화된 면역기능을 이미 갖고 있는 세포군으로, 이들은이러스, 박테리아, 기생충 감염 등을 조절하거나 암세포를 제거하는데 도움을 준다고 알려져 왔다. 연구진은 피부에서 분비된 사이토카인(IL-12, IL-15, IL-18)이 가상기억 T세포를 활성화시켜 높은 세포독성 능력을 갖는 면역세포군으로의 분화를 일으키고, 이렇게 활성화된 면역세포는 수용체(NKG2D)를 통해 항원 비특이적인 세포독성 작용으로 모낭세포를 파괴하여 원형탈모증을 유발시키는 것을 발견하였다. 또한, 연구진은 사이토카인과 수용체(NKG2D)의 기능을 억제하여 원형탈모증의 발생을 막을 수 있음을 확인했다.
이번 연구 결과는 인체 내에서 만성 염증을 일으킬 수 있는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써, 만성 염증질환 및 자가면역질환의 병인 및 치료를 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
중앙대학교병원 석준 교수, 우리 대학 의과학대학원 조성동 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 세계적 권위지인 ‘네이처 이뮤놀로지(Nature Immunology)’에 게재됐다 (논문명: A virtual memory CD8+ T cell-originated distinct cell subset causes alopecia areata through innate-like cytotoxicity).
박수형 교수는 “이번 연구 결과는 가상기억 T 세포가 몸을 보호하는 역할을 하지 않고, 항원 비특이적인 자극에 의해 활성화된 후 오히려 염증질환을 유발할 수 있음을 최초로 보여주었다는 점에서 학문적으로나 의학적으로 큰 의미가 있다”고 말하고, “추가 연구를 통해 항체 치료제를 신약 개발한다면 다양한 만성 염증질환의 발생에 대한 새로운 치료 전략을 제시할 수 있을 것이다”라고 덧붙였다.
이번 연구는 과학기술정보통신부 중견연구자지원사업, 4대 과학기술원 공동연구프로젝트, 대한모발학회 기초분야 연구비의 지원을 받아 수행됐다.
2023.07.04 조회수 7234 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10446
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10446