-
 암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02
조회수 14485
-
 폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30
조회수 11797
-
 약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09
조회수 10340
-
 인공지능으로 정확한 세포 이미지 분석..세계 AI 생명과학 분야 대회 우승
우리 대학 김재철AI대학원 윤세영 교수 연구팀이 세계 최고 수준의 인공지능(AI) 학회인 `뉴립스(NeurIPS, 신경정보처리시스템학회) 2022'에서 개최된 `세포 인식기술 경진대회'에서 취리히 리서치센터, 베이징대, 칭화대, 미시간대 등 다수의 세계 연구팀을 모두 제치고 1위로 우승을 달성했다고 28일 밝혔다.
뉴립스는 국제머신러닝학회(ICML), 표현학습국제학회(ICLR)와 함께 세계적인 권위의 기계학습 및 인공지능 분야 학회로 꼽힌다. 뛰어난 연구자들이 제출하는 논문들도 승인될 확률이 25%에 불과할 정도로 학회의 심사를 통과하기 어려운 것으로 알려져 있다.
윤세영 교수 연구팀은 이번 학회에서 `세포 인식기술 경진대회(Cell Segmentation Challenge)'에 참가했다. 이기훈(박사과정), 김상묵(박사과정), 김준기(석사과정)의 3명의 연구원으로 구성된 OSILAB 팀은 초고해상도의 현미경 이미지에서 인공지능이 자동으로 세포를 인식하는 MEDIAR(메디아) 기술을 개발해 2위 팀과 큰 성능 격차로 1위를 달성했다.
세포 인식은 생명 및 의료 분야의 시작이 되는 중요한 기반 기술이지만, 현미경의 측정 기술과 세포의 종류 등에 따라 다양한 형태로 관찰될 수 있어 인공지능이 학습하기 어려운 분야로 알려져 있다. 세포 인식기술 경진대회는 이러한 한계를 극복하기 위해 초고해상도의 현미경 이미지에서 제한된 시간 안에 세포를 인식하는 기술을 주제로 개최됐다.
연구팀은 기계학습에서 소수의 학습 데이터를 더 효과적으로 활용해 성능을 높이는 데이터 기반(Data-Centric) 접근법과 인공신경망의 구조를 개선하는 모델 기반(Model-Centric) 접근법을 종합적으로 활용해 MEDIAR(메디아) 기술을 개발했다. 개발된 인공지능 기술을 통해 정확하게 세포를 인식하고 고해상도 이미지를 빠르게 연산함으로써 대회에서 좋은 성과를 얻을 수 있었다. 지도교수인 KAIST 김재철AI대학원 윤세영 교수는 “MEDIAR는 세포 인식기술 경진대회를 통해 개발됐지만 기상 예측이나 자율주행과 같이 이미지 속 다양한 형태의 개체 인식을 통해 정확한 예측이 필요한 많은 분야에 적용할 수 있다”라고 향후 다양한 활용을 기대했다.
팀을 이끌었던 이기훈 박사과정은 "처음 접하는 분야에서도 성과를 낼 수 있었던 것은 평소 기본기를 중요시하는 교수님의 가르침 덕분ˮ이라며 "새로운 문제에 끊임없이 도전하자는 것이 연구팀의 기본 정신ˮ이라고 강조했다. 이어 같은 연구실 김상묵 박사과정은 "연구 과정에서 많은 실패가 있었지만, 세상에 꼭 필요한 기술이라는 생각으로 끝까지 노력했다ˮ라며 "혼자서라면 절대 해내지 못했던 결과인 만큼 팀원들에게 정말 감사하다ˮ라고 수상 소감을 전했다. 같은 연구실 김준기 석사과정은 "팀원들과 이룬 성과가 의료 분야 인공지능이 겪는 현실의 문제를 해결하는 데 도움이 될 수 있기를 바란다”라고 밝혔다.
연구팀은 생명과학 분야 연구의 발전을 돕기 위해 개발된 기술을 전면 오픈소스로 공개한다고 밝혔다. 학습된 인공지능 모델과 인공지능을 구현하기 위한 프로그램의 소스 코드는 개발자 플랫폼인 깃허브 (GitHub)를 통해 이용할 수 있다.
인공지능으로 정확한 세포 이미지 분석..세계 AI 생명과학 분야 대회 우승
우리 대학 김재철AI대학원 윤세영 교수 연구팀이 세계 최고 수준의 인공지능(AI) 학회인 `뉴립스(NeurIPS, 신경정보처리시스템학회) 2022'에서 개최된 `세포 인식기술 경진대회'에서 취리히 리서치센터, 베이징대, 칭화대, 미시간대 등 다수의 세계 연구팀을 모두 제치고 1위로 우승을 달성했다고 28일 밝혔다.
뉴립스는 국제머신러닝학회(ICML), 표현학습국제학회(ICLR)와 함께 세계적인 권위의 기계학습 및 인공지능 분야 학회로 꼽힌다. 뛰어난 연구자들이 제출하는 논문들도 승인될 확률이 25%에 불과할 정도로 학회의 심사를 통과하기 어려운 것으로 알려져 있다.
윤세영 교수 연구팀은 이번 학회에서 `세포 인식기술 경진대회(Cell Segmentation Challenge)'에 참가했다. 이기훈(박사과정), 김상묵(박사과정), 김준기(석사과정)의 3명의 연구원으로 구성된 OSILAB 팀은 초고해상도의 현미경 이미지에서 인공지능이 자동으로 세포를 인식하는 MEDIAR(메디아) 기술을 개발해 2위 팀과 큰 성능 격차로 1위를 달성했다.
세포 인식은 생명 및 의료 분야의 시작이 되는 중요한 기반 기술이지만, 현미경의 측정 기술과 세포의 종류 등에 따라 다양한 형태로 관찰될 수 있어 인공지능이 학습하기 어려운 분야로 알려져 있다. 세포 인식기술 경진대회는 이러한 한계를 극복하기 위해 초고해상도의 현미경 이미지에서 제한된 시간 안에 세포를 인식하는 기술을 주제로 개최됐다.
연구팀은 기계학습에서 소수의 학습 데이터를 더 효과적으로 활용해 성능을 높이는 데이터 기반(Data-Centric) 접근법과 인공신경망의 구조를 개선하는 모델 기반(Model-Centric) 접근법을 종합적으로 활용해 MEDIAR(메디아) 기술을 개발했다. 개발된 인공지능 기술을 통해 정확하게 세포를 인식하고 고해상도 이미지를 빠르게 연산함으로써 대회에서 좋은 성과를 얻을 수 있었다. 지도교수인 KAIST 김재철AI대학원 윤세영 교수는 “MEDIAR는 세포 인식기술 경진대회를 통해 개발됐지만 기상 예측이나 자율주행과 같이 이미지 속 다양한 형태의 개체 인식을 통해 정확한 예측이 필요한 많은 분야에 적용할 수 있다”라고 향후 다양한 활용을 기대했다.
팀을 이끌었던 이기훈 박사과정은 "처음 접하는 분야에서도 성과를 낼 수 있었던 것은 평소 기본기를 중요시하는 교수님의 가르침 덕분ˮ이라며 "새로운 문제에 끊임없이 도전하자는 것이 연구팀의 기본 정신ˮ이라고 강조했다. 이어 같은 연구실 김상묵 박사과정은 "연구 과정에서 많은 실패가 있었지만, 세상에 꼭 필요한 기술이라는 생각으로 끝까지 노력했다ˮ라며 "혼자서라면 절대 해내지 못했던 결과인 만큼 팀원들에게 정말 감사하다ˮ라고 수상 소감을 전했다. 같은 연구실 김준기 석사과정은 "팀원들과 이룬 성과가 의료 분야 인공지능이 겪는 현실의 문제를 해결하는 데 도움이 될 수 있기를 바란다”라고 밝혔다.
연구팀은 생명과학 분야 연구의 발전을 돕기 위해 개발된 기술을 전면 오픈소스로 공개한다고 밝혔다. 학습된 인공지능 모델과 인공지능을 구현하기 위한 프로그램의 소스 코드는 개발자 플랫폼인 깃허브 (GitHub)를 통해 이용할 수 있다.
2022.12.28
조회수 11618
-
 생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07
조회수 8216
-
 면 발광 마이크로 LED 패치 개발로 피부 미백에 획기적 효과
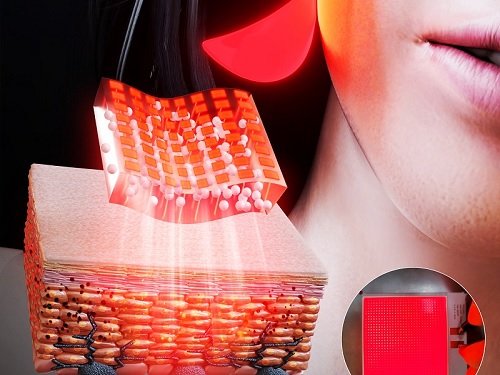
우리 대학 신소재공학과 이건재 교수팀과 세브란스 오상호 교수팀이 멜라닌 생성 억제를 위한 *면 발광 마이크로 LED 피부 패치를 개발했다고 10일 밝혔다.
☞ 면 발광 마이크로 LED 피부 패치: 인간의 머리카락의 ~1/100 의 두께를 가지는 매우 작은 LED 칩을 사용하여 제작한 인체에 부착 가능한 광치료 패치다. 기존의 점 발광의 특성을 가지는 LED와 달리, 구형 실리카 입자를 이용한 빛의 산란을 통해 면 발광의 특성을 갖는다.
멜라닌은 피부 내 존재하는 갈색 또는 흑색 색소로, 자외선 혹은 스트레스와 같은 외부 요인에 의해 비정상적으로 합성될 경우, 기미, 주근깨, 검버섯 등의 질환 형태로 나타나기 때문에 정상적으로 치료할 필요가 있다.
최근 피부질환 치료 및 미용을 위한 LED 기기들이 지속적으로 출시되고 있지만, 치료 효과에 있어서는 여전히 논란이 있다. 이는 LED가 피부에 밀착될 수 없어, 거리에 따른 광 손실 및 발열 문제로 인하여 역효과를 낼 수 있기 때문이다. 유의미한 피부 미용 효과를 얻기 위해서는 LED 광원을 피부에 밀착하여 조사함으로써, 균일한 빛을 피부 진피 내까지 효과적으로 전달해야 한다.
이에, 이건재 교수팀은 천여 개의 마이크로 LED를 4×4 cm2의 플라스틱 기판 위에서 구현하고, 빛의 확산을 위한 실리카 입자를 코팅함으로써 피부에 밀착하여 붙일 수 있는 면 발광 마이크로 LED 패치를 제작했다. 100 마이크로미터(μm) 크기의 마이크로 LED는 매우 작아 유연성을 가지며, 수직으로 배열된 전극은 LED의 발열을 줄여, 인간 피부 위에서 열적 손상 없이 장시간 구동 가능하다.
연구팀은 인간 피부 세포와 쥐의 등 피부에 면 발광 마이크로 LED 패치를 밀착시키고 조사하여 멜라닌 생성 억제 효능을 확인하였으며, 기존 상용 LED 대비, 피부 조직에 미치는 독성이 적을 뿐만 아니라, 효과적이고 일관된 경향으로 멜라닌 생성량을 감소시키는 데 성공했다. 또한, 피부 조직 분석을 통하여 멜라닌 생성에 관여하는 MITF (microphthalmia-associated transcription factor), Melan-A, 티로시나아제를 포함하는 단백질 및 효소 발현의 억제가 확인되었다.
이건재 교수는 "이번에 개발한 무기물 기반 면 발광 마이크로 LED 패치는 광 효율, 신뢰성, 수명 등이 우수하며, 기존 광 치료 기기와 달리 부작용은 줄이고 치료 효과를 극대화하여 코스메틱 분야에 큰 영향을 줄 것”이라고 말했다. 면 발광 마이크로 LED 패치는 현재 이 교수가 교원 창업한 ㈜프로닉스에 기술이전되어, 양산 장비를 갖추고 내년 3월 제품 출시를 앞두고 있다.
이번 연구는 웨어러블플랫폼 소재기술센터, 휴먼플러스 융합연구개발사업의 지원을 받아 수행됐으며, 국제 학술지 `어드밴스드 헬스케어 메터리얼즈(Advanced Healthcare Materials)'에 11월 게재됐다.
면 발광 마이크로 LED 패치 개발로 피부 미백에 획기적 효과
우리 대학 신소재공학과 이건재 교수팀과 세브란스 오상호 교수팀이 멜라닌 생성 억제를 위한 *면 발광 마이크로 LED 피부 패치를 개발했다고 10일 밝혔다.
☞ 면 발광 마이크로 LED 피부 패치: 인간의 머리카락의 ~1/100 의 두께를 가지는 매우 작은 LED 칩을 사용하여 제작한 인체에 부착 가능한 광치료 패치다. 기존의 점 발광의 특성을 가지는 LED와 달리, 구형 실리카 입자를 이용한 빛의 산란을 통해 면 발광의 특성을 갖는다.
멜라닌은 피부 내 존재하는 갈색 또는 흑색 색소로, 자외선 혹은 스트레스와 같은 외부 요인에 의해 비정상적으로 합성될 경우, 기미, 주근깨, 검버섯 등의 질환 형태로 나타나기 때문에 정상적으로 치료할 필요가 있다.
최근 피부질환 치료 및 미용을 위한 LED 기기들이 지속적으로 출시되고 있지만, 치료 효과에 있어서는 여전히 논란이 있다. 이는 LED가 피부에 밀착될 수 없어, 거리에 따른 광 손실 및 발열 문제로 인하여 역효과를 낼 수 있기 때문이다. 유의미한 피부 미용 효과를 얻기 위해서는 LED 광원을 피부에 밀착하여 조사함으로써, 균일한 빛을 피부 진피 내까지 효과적으로 전달해야 한다.
이에, 이건재 교수팀은 천여 개의 마이크로 LED를 4×4 cm2의 플라스틱 기판 위에서 구현하고, 빛의 확산을 위한 실리카 입자를 코팅함으로써 피부에 밀착하여 붙일 수 있는 면 발광 마이크로 LED 패치를 제작했다. 100 마이크로미터(μm) 크기의 마이크로 LED는 매우 작아 유연성을 가지며, 수직으로 배열된 전극은 LED의 발열을 줄여, 인간 피부 위에서 열적 손상 없이 장시간 구동 가능하다.
연구팀은 인간 피부 세포와 쥐의 등 피부에 면 발광 마이크로 LED 패치를 밀착시키고 조사하여 멜라닌 생성 억제 효능을 확인하였으며, 기존 상용 LED 대비, 피부 조직에 미치는 독성이 적을 뿐만 아니라, 효과적이고 일관된 경향으로 멜라닌 생성량을 감소시키는 데 성공했다. 또한, 피부 조직 분석을 통하여 멜라닌 생성에 관여하는 MITF (microphthalmia-associated transcription factor), Melan-A, 티로시나아제를 포함하는 단백질 및 효소 발현의 억제가 확인되었다.
이건재 교수는 "이번에 개발한 무기물 기반 면 발광 마이크로 LED 패치는 광 효율, 신뢰성, 수명 등이 우수하며, 기존 광 치료 기기와 달리 부작용은 줄이고 치료 효과를 극대화하여 코스메틱 분야에 큰 영향을 줄 것”이라고 말했다. 면 발광 마이크로 LED 패치는 현재 이 교수가 교원 창업한 ㈜프로닉스에 기술이전되어, 양산 장비를 갖추고 내년 3월 제품 출시를 앞두고 있다.
이번 연구는 웨어러블플랫폼 소재기술센터, 휴먼플러스 융합연구개발사업의 지원을 받아 수행됐으며, 국제 학술지 `어드밴스드 헬스케어 메터리얼즈(Advanced Healthcare Materials)'에 11월 게재됐다.
2022.11.10
조회수 9311
-
 RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
2022.10.31
조회수 10568
-
 악천후에서도 자율주행을 가능하게 하는 세계 최고의 4D 레이더 인공지능 기술 개발
우리 대학 조천식모빌리티대학원 공승현 교수 연구팀이 세계 최초로 악천후 상황에서 안정적인 자율주행을 가능하게 하는 4D 레이더(Radar)의 주변 객체 인지 인공지능 기술을 개발했다고 20일 밝혔다. 연구팀은 구축된 인공지능 학습 데이터셋(Dataset)인 KAIST-레이더(이하 K-레이더)와 개발된 인공지능 신경망(RTN4D) 그리고 전 세계 연구자를 위한 4D 레이더 인공지능 개발 플랫폼(Platform)과 관련 벤치마크(Benchmark)를 모두 공개한다고 밝혔다.
현재 전 세계적으로 개발되고 있는 자율주행 자동차는 주로 카메라와 라이다(LiDAR)에서 출력되는 이미지와 포인트 클라우드(Pointcloud) 데이터를 적절한 인공지능 신경망으로 처리해 자동차 주변의 객체들을 인식하는 방식으로 구현돼 있다. 그러나 카메라와 라이다는 각각 가시광선과 적외선을 사용하므로 눈비 또는 안개 상황에서 측정 성능이 크게 떨어지는데, 이로 인해 주변 객체들에 대한 인식이 어려워져 안전한 자율주행이 불가능하다.
더구나, 차내에 설치할 수 있는 카메라와 달리 자동차의 지붕에 설치하는 라이다는 외부 환경에 노출돼 있어서 그 표면에 눈비 또는 흙먼지가 묻는 경우 라이다를 이용한 전방 탐지가 어려워진다. 공승현 교수는 "젖은 도로에서 전방에 주행 차량이 있는 경우, 그 바퀴에서 일어나는 흙먼지가 섞인 물보라로 라이다 표면이 빠르게 더럽혀지고, 결과적으로 모든 전방 객체에 대한 라이다 측정이 불가능해진다ˮ고 설명한다. {그림 1 참조}
적외선을 사용하는 라이다와는 달리 77기가헤르츠(GHz) 대역의 자동차 레이더는 눈, 비, 안개 등의 악천후 상황에 매우 강건하며 표면에 눈비나 흙먼지가 묻은 상황에서도 안정적인 측정 결과를 보인다. 최근에는 고해상도의 4D 레이더(대상까지의 거리, 방위각, 높이, 도플러 주파수를 측정)가 개발돼 상용화되고 있으며, 그 성능도 빠르게 향상되고 있다.
이에 따라서 전 세계적으로 4D 레이더에 인공지능을 이용한 주변 인지 기술 연구가 시작되고 있지만, 4D 레이더에 필요한 인공지능 연구는 매우 더디게 진행되고 있다. 카메라나 라이다와 달리, 고성능 인공지능 개발에 필수적인 충분한 데이터셋이 구축되지 못하고 있기 때문이다. 2021년부터 4D 레이더의 포인트 클라우드 데이터셋이 일부 공개됐으나, 데이터의 양이 충분하지 않고 측정치가 매우 희소해 신뢰할 만한 객체 인식 인공지능 신경망 개발이 쉽지 않다.
연구팀이 공개하는 K-레이더는 악천후를 포함한 다양한 날씨 및 교통 상황에서 수집된 다양성 높은 데이터셋이며, 정확히 동기된 카메라와 라이다 측정 데이터와 함께 구축된 13테라바이트(TB)에 이르는 대용량으로 세계 최초의 4D 레이더 데이터셋이다. 특히, K-레이더는 포인트 클라우드 형태가 아닌 인공지능 신경망의 성능을 극대화할 수 있는 텐서(Tensor) 형태의 데이터셋으로, 이는 일반적인 레이더의 잡음 제거 방식을 사용하지 않아 잡음 수준의 미약한 미세 측정치를 온전히 담고 있는 형태의 데이터셋이다.
연구팀이 개발한 4D 레이더 인공지능 신경망(RTN4D)은 K-레이더로 수많은 학습을 진행했고, 그 결과 다양한 날씨와 도로 상황에서 70m 이내의 객체에 대해 객체 판별, 위치 추정 및 주행 방향 추정의 3가지 추정을 정확히 수행하는 경우가 최종 62.5%인 세계 최고의 성능을 가진다.
또한, 연구팀은 전 세계의 연구자들이 자체적으로 데이터를 추가 구축하고 신경망 기술을 개발하며 그 성능을 자체 평가할 수 있도록 레이더용 인공지능 신경망 개발 플랫폼과 벤치마크도 공개 제공한다.
조천식모빌리티대학원 공승현 교수는 "눈이나 비가 오는 날씨에서 4D 레이더 인공지능 신경망은 기존 라이다 인공지능 신경망 보다 훨씬 더 안정적인 주변 객체 인지 성능을 갖는데, 이는 4D 레이더가 악천후에서 자율주행을 위한 필수 센서임을 보여주는 결과이며{그림 2 참조}, 최근 미국의 웨이모(Waymo)와 이스라엘의 모빌아이(Mobileye)가 수년 내로 4D 레이더를 자율주행의 주요 인지 센서로 활용할 계획임을 공개적으로 밝힌 이유다ˮ라며 "우리 연구팀이 공개한 K-레이더와 4D 레이더 인공지능 개발 플랫폼 및 벤치마크를 통해, 향후 4D 레이더에 관한 인공지능 연구가 더욱 활발히 진행될 것으로 기대한다ˮ라고 말했다.
K-레이더, 4D 레이더 인공지능 신경망(RTN4D), 4D 레이더 인공지능 개발 플랫폼과 벤치마크는 연구실 홈페이지(http://ave.kaist.ac.kr/)와 깃허브(https://github.com/kaist-avelab/K-Radar)를 통해서 배포될 예정이다. 이번 연구는 한국연구재단(NRF) 및 정보통신기획평가원(IITP)의 지원과 ㈜스마트레이더시스템의 협력으로 수행됐으며, 연구 성과는 백동희 박사과정 학생이 2022년 12월에 열리는 세계적인 인공지능 컨퍼런스인 `뉴립스(NeurIPS) 2022' 데이터셋&벤치마크 트랙(Datasets and Benchmark Track)에서 발표할 예정이다(논문명: K-Radar: 4D Radar Object Detection Dataset and Benchmark for Autonomous Driving in Various Weather Conditions)
악천후에서도 자율주행을 가능하게 하는 세계 최고의 4D 레이더 인공지능 기술 개발
우리 대학 조천식모빌리티대학원 공승현 교수 연구팀이 세계 최초로 악천후 상황에서 안정적인 자율주행을 가능하게 하는 4D 레이더(Radar)의 주변 객체 인지 인공지능 기술을 개발했다고 20일 밝혔다. 연구팀은 구축된 인공지능 학습 데이터셋(Dataset)인 KAIST-레이더(이하 K-레이더)와 개발된 인공지능 신경망(RTN4D) 그리고 전 세계 연구자를 위한 4D 레이더 인공지능 개발 플랫폼(Platform)과 관련 벤치마크(Benchmark)를 모두 공개한다고 밝혔다.
현재 전 세계적으로 개발되고 있는 자율주행 자동차는 주로 카메라와 라이다(LiDAR)에서 출력되는 이미지와 포인트 클라우드(Pointcloud) 데이터를 적절한 인공지능 신경망으로 처리해 자동차 주변의 객체들을 인식하는 방식으로 구현돼 있다. 그러나 카메라와 라이다는 각각 가시광선과 적외선을 사용하므로 눈비 또는 안개 상황에서 측정 성능이 크게 떨어지는데, 이로 인해 주변 객체들에 대한 인식이 어려워져 안전한 자율주행이 불가능하다.
더구나, 차내에 설치할 수 있는 카메라와 달리 자동차의 지붕에 설치하는 라이다는 외부 환경에 노출돼 있어서 그 표면에 눈비 또는 흙먼지가 묻는 경우 라이다를 이용한 전방 탐지가 어려워진다. 공승현 교수는 "젖은 도로에서 전방에 주행 차량이 있는 경우, 그 바퀴에서 일어나는 흙먼지가 섞인 물보라로 라이다 표면이 빠르게 더럽혀지고, 결과적으로 모든 전방 객체에 대한 라이다 측정이 불가능해진다ˮ고 설명한다. {그림 1 참조}
적외선을 사용하는 라이다와는 달리 77기가헤르츠(GHz) 대역의 자동차 레이더는 눈, 비, 안개 등의 악천후 상황에 매우 강건하며 표면에 눈비나 흙먼지가 묻은 상황에서도 안정적인 측정 결과를 보인다. 최근에는 고해상도의 4D 레이더(대상까지의 거리, 방위각, 높이, 도플러 주파수를 측정)가 개발돼 상용화되고 있으며, 그 성능도 빠르게 향상되고 있다.
이에 따라서 전 세계적으로 4D 레이더에 인공지능을 이용한 주변 인지 기술 연구가 시작되고 있지만, 4D 레이더에 필요한 인공지능 연구는 매우 더디게 진행되고 있다. 카메라나 라이다와 달리, 고성능 인공지능 개발에 필수적인 충분한 데이터셋이 구축되지 못하고 있기 때문이다. 2021년부터 4D 레이더의 포인트 클라우드 데이터셋이 일부 공개됐으나, 데이터의 양이 충분하지 않고 측정치가 매우 희소해 신뢰할 만한 객체 인식 인공지능 신경망 개발이 쉽지 않다.
연구팀이 공개하는 K-레이더는 악천후를 포함한 다양한 날씨 및 교통 상황에서 수집된 다양성 높은 데이터셋이며, 정확히 동기된 카메라와 라이다 측정 데이터와 함께 구축된 13테라바이트(TB)에 이르는 대용량으로 세계 최초의 4D 레이더 데이터셋이다. 특히, K-레이더는 포인트 클라우드 형태가 아닌 인공지능 신경망의 성능을 극대화할 수 있는 텐서(Tensor) 형태의 데이터셋으로, 이는 일반적인 레이더의 잡음 제거 방식을 사용하지 않아 잡음 수준의 미약한 미세 측정치를 온전히 담고 있는 형태의 데이터셋이다.
연구팀이 개발한 4D 레이더 인공지능 신경망(RTN4D)은 K-레이더로 수많은 학습을 진행했고, 그 결과 다양한 날씨와 도로 상황에서 70m 이내의 객체에 대해 객체 판별, 위치 추정 및 주행 방향 추정의 3가지 추정을 정확히 수행하는 경우가 최종 62.5%인 세계 최고의 성능을 가진다.
또한, 연구팀은 전 세계의 연구자들이 자체적으로 데이터를 추가 구축하고 신경망 기술을 개발하며 그 성능을 자체 평가할 수 있도록 레이더용 인공지능 신경망 개발 플랫폼과 벤치마크도 공개 제공한다.
조천식모빌리티대학원 공승현 교수는 "눈이나 비가 오는 날씨에서 4D 레이더 인공지능 신경망은 기존 라이다 인공지능 신경망 보다 훨씬 더 안정적인 주변 객체 인지 성능을 갖는데, 이는 4D 레이더가 악천후에서 자율주행을 위한 필수 센서임을 보여주는 결과이며{그림 2 참조}, 최근 미국의 웨이모(Waymo)와 이스라엘의 모빌아이(Mobileye)가 수년 내로 4D 레이더를 자율주행의 주요 인지 센서로 활용할 계획임을 공개적으로 밝힌 이유다ˮ라며 "우리 연구팀이 공개한 K-레이더와 4D 레이더 인공지능 개발 플랫폼 및 벤치마크를 통해, 향후 4D 레이더에 관한 인공지능 연구가 더욱 활발히 진행될 것으로 기대한다ˮ라고 말했다.
K-레이더, 4D 레이더 인공지능 신경망(RTN4D), 4D 레이더 인공지능 개발 플랫폼과 벤치마크는 연구실 홈페이지(http://ave.kaist.ac.kr/)와 깃허브(https://github.com/kaist-avelab/K-Radar)를 통해서 배포될 예정이다. 이번 연구는 한국연구재단(NRF) 및 정보통신기획평가원(IITP)의 지원과 ㈜스마트레이더시스템의 협력으로 수행됐으며, 연구 성과는 백동희 박사과정 학생이 2022년 12월에 열리는 세계적인 인공지능 컨퍼런스인 `뉴립스(NeurIPS) 2022' 데이터셋&벤치마크 트랙(Datasets and Benchmark Track)에서 발표할 예정이다(논문명: K-Radar: 4D Radar Object Detection Dataset and Benchmark for Autonomous Driving in Various Weather Conditions)
2022.10.20
조회수 9182
-
 난치성 심혈관 질환인 폐동맥 고혈압의 새로운 모델 및 병리기전 제시
우리 대학 의과학대학원 및 의과학센터 연구진(책임자: 김인준 교수)과 서울대학교병원 연구진(책임자: 박준빈 교수)이 협력하여 폐동맥 고혈압(pulmonary arterial hypertension)의 새로운 동물모델을 구축하고 치료방법을 제시하였다고 지난 10월 7일 소개됐다.
연구팀은 혈관내피세포에서 Sox17 유전자가 결핍된 생쥐에 저산소 환경을 제공하여 새로운 폐동맥 고혈압 동물모델을 성공적으로 개발하였으며, 전사체 분석(transcriptomic analysis)으로 Sox17과 관련된 폐동맥 고혈압 발생의 병리현상에 Dll4/Notch 신호경로가 연관됨을 확인하였다. 또한 심혈관계 질환에서 역할이 잘 알려져 있지 않았던 HGF/c-Met 경로가 활성화됨을 발견하고, 기존의 폐동맥 고혈압 치료 약물 투여와 함께 해당 경로를 차단함으로써 동물모델에서 폐동맥 고혈압을 효과적으로 치료/예방할 수 있음을 확인하였다. 동물모델과 유사하게, 폐동맥 고혈압 환자의 폐조직에서 정상군에 비해 Sox17 발현이 감소하고 HGF 발현은 증가함을 확인하였다. 우리 대학 의과학대학원 졸업생 박찬순 박사가 (현 서울대병원 순환기내과 임상강사) 1저자로 주도한 이번 연구 결과는 심혈관 기초연구 분야 최고 학술지인 Circulation Research에 온라인 게재되었다.
기존 폐동맥 고혈압 동물모델은 실제 폐동맥 고혈압 환자들이 보이는 만성 진행성 임상양상을 잘 나타내지 못한다는 한계가 있었다. 예를 들어, 저산소-유발 폐동맥 고혈압 동물모델은 정상 산소 농도에 다시 두면 증상이 종종 호전되는데, 이는 환자의 질병 경과와는 차이가 있다. Sox17 내피결핍 생쥐에서 발생한 폐동맥 고혈압은 질병 상태가 만성적으로 유지되는 등 실제 병태생리를 잘 반영하였다. 이러한 장점으로 인해, 새로운 모델은 약제 개발 및 치료반응 확인에 보다 효과적으로 사용될 수 있을 것으로 기대된다. 더불어 이번 연구는 사망률을 경감시키는 효과적인 치료제가 없는 폐동맥 고혈압 치료 분야에 HGF/c-Met 신호경로를 새로운 약제 개발의 타겟으로 제시했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
난치성 심혈관 질환인 폐동맥 고혈압의 새로운 모델 및 병리기전 제시
우리 대학 의과학대학원 및 의과학센터 연구진(책임자: 김인준 교수)과 서울대학교병원 연구진(책임자: 박준빈 교수)이 협력하여 폐동맥 고혈압(pulmonary arterial hypertension)의 새로운 동물모델을 구축하고 치료방법을 제시하였다고 지난 10월 7일 소개됐다.
연구팀은 혈관내피세포에서 Sox17 유전자가 결핍된 생쥐에 저산소 환경을 제공하여 새로운 폐동맥 고혈압 동물모델을 성공적으로 개발하였으며, 전사체 분석(transcriptomic analysis)으로 Sox17과 관련된 폐동맥 고혈압 발생의 병리현상에 Dll4/Notch 신호경로가 연관됨을 확인하였다. 또한 심혈관계 질환에서 역할이 잘 알려져 있지 않았던 HGF/c-Met 경로가 활성화됨을 발견하고, 기존의 폐동맥 고혈압 치료 약물 투여와 함께 해당 경로를 차단함으로써 동물모델에서 폐동맥 고혈압을 효과적으로 치료/예방할 수 있음을 확인하였다. 동물모델과 유사하게, 폐동맥 고혈압 환자의 폐조직에서 정상군에 비해 Sox17 발현이 감소하고 HGF 발현은 증가함을 확인하였다. 우리 대학 의과학대학원 졸업생 박찬순 박사가 (현 서울대병원 순환기내과 임상강사) 1저자로 주도한 이번 연구 결과는 심혈관 기초연구 분야 최고 학술지인 Circulation Research에 온라인 게재되었다.
기존 폐동맥 고혈압 동물모델은 실제 폐동맥 고혈압 환자들이 보이는 만성 진행성 임상양상을 잘 나타내지 못한다는 한계가 있었다. 예를 들어, 저산소-유발 폐동맥 고혈압 동물모델은 정상 산소 농도에 다시 두면 증상이 종종 호전되는데, 이는 환자의 질병 경과와는 차이가 있다. Sox17 내피결핍 생쥐에서 발생한 폐동맥 고혈압은 질병 상태가 만성적으로 유지되는 등 실제 병태생리를 잘 반영하였다. 이러한 장점으로 인해, 새로운 모델은 약제 개발 및 치료반응 확인에 보다 효과적으로 사용될 수 있을 것으로 기대된다. 더불어 이번 연구는 사망률을 경감시키는 효과적인 치료제가 없는 폐동맥 고혈압 치료 분야에 HGF/c-Met 신호경로를 새로운 약제 개발의 타겟으로 제시했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
2022.10.12
조회수 7772
-
 장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06
조회수 10671
-
 기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29
조회수 11484
-
 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19
조회수 12541
 암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 14485
암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 14485 폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11797
폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11797 약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 10340
약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 10340 인공지능으로 정확한 세포 이미지 분석..세계 AI 생명과학 분야 대회 우승
우리 대학 김재철AI대학원 윤세영 교수 연구팀이 세계 최고 수준의 인공지능(AI) 학회인 `뉴립스(NeurIPS, 신경정보처리시스템학회) 2022'에서 개최된 `세포 인식기술 경진대회'에서 취리히 리서치센터, 베이징대, 칭화대, 미시간대 등 다수의 세계 연구팀을 모두 제치고 1위로 우승을 달성했다고 28일 밝혔다.
뉴립스는 국제머신러닝학회(ICML), 표현학습국제학회(ICLR)와 함께 세계적인 권위의 기계학습 및 인공지능 분야 학회로 꼽힌다. 뛰어난 연구자들이 제출하는 논문들도 승인될 확률이 25%에 불과할 정도로 학회의 심사를 통과하기 어려운 것으로 알려져 있다.
윤세영 교수 연구팀은 이번 학회에서 `세포 인식기술 경진대회(Cell Segmentation Challenge)'에 참가했다. 이기훈(박사과정), 김상묵(박사과정), 김준기(석사과정)의 3명의 연구원으로 구성된 OSILAB 팀은 초고해상도의 현미경 이미지에서 인공지능이 자동으로 세포를 인식하는 MEDIAR(메디아) 기술을 개발해 2위 팀과 큰 성능 격차로 1위를 달성했다.
세포 인식은 생명 및 의료 분야의 시작이 되는 중요한 기반 기술이지만, 현미경의 측정 기술과 세포의 종류 등에 따라 다양한 형태로 관찰될 수 있어 인공지능이 학습하기 어려운 분야로 알려져 있다. 세포 인식기술 경진대회는 이러한 한계를 극복하기 위해 초고해상도의 현미경 이미지에서 제한된 시간 안에 세포를 인식하는 기술을 주제로 개최됐다.
연구팀은 기계학습에서 소수의 학습 데이터를 더 효과적으로 활용해 성능을 높이는 데이터 기반(Data-Centric) 접근법과 인공신경망의 구조를 개선하는 모델 기반(Model-Centric) 접근법을 종합적으로 활용해 MEDIAR(메디아) 기술을 개발했다. 개발된 인공지능 기술을 통해 정확하게 세포를 인식하고 고해상도 이미지를 빠르게 연산함으로써 대회에서 좋은 성과를 얻을 수 있었다. 지도교수인 KAIST 김재철AI대학원 윤세영 교수는 “MEDIAR는 세포 인식기술 경진대회를 통해 개발됐지만 기상 예측이나 자율주행과 같이 이미지 속 다양한 형태의 개체 인식을 통해 정확한 예측이 필요한 많은 분야에 적용할 수 있다”라고 향후 다양한 활용을 기대했다.
팀을 이끌었던 이기훈 박사과정은 "처음 접하는 분야에서도 성과를 낼 수 있었던 것은 평소 기본기를 중요시하는 교수님의 가르침 덕분ˮ이라며 "새로운 문제에 끊임없이 도전하자는 것이 연구팀의 기본 정신ˮ이라고 강조했다. 이어 같은 연구실 김상묵 박사과정은 "연구 과정에서 많은 실패가 있었지만, 세상에 꼭 필요한 기술이라는 생각으로 끝까지 노력했다ˮ라며 "혼자서라면 절대 해내지 못했던 결과인 만큼 팀원들에게 정말 감사하다ˮ라고 수상 소감을 전했다. 같은 연구실 김준기 석사과정은 "팀원들과 이룬 성과가 의료 분야 인공지능이 겪는 현실의 문제를 해결하는 데 도움이 될 수 있기를 바란다”라고 밝혔다.
연구팀은 생명과학 분야 연구의 발전을 돕기 위해 개발된 기술을 전면 오픈소스로 공개한다고 밝혔다. 학습된 인공지능 모델과 인공지능을 구현하기 위한 프로그램의 소스 코드는 개발자 플랫폼인 깃허브 (GitHub)를 통해 이용할 수 있다.
2022.12.28 조회수 11618
인공지능으로 정확한 세포 이미지 분석..세계 AI 생명과학 분야 대회 우승
우리 대학 김재철AI대학원 윤세영 교수 연구팀이 세계 최고 수준의 인공지능(AI) 학회인 `뉴립스(NeurIPS, 신경정보처리시스템학회) 2022'에서 개최된 `세포 인식기술 경진대회'에서 취리히 리서치센터, 베이징대, 칭화대, 미시간대 등 다수의 세계 연구팀을 모두 제치고 1위로 우승을 달성했다고 28일 밝혔다.
뉴립스는 국제머신러닝학회(ICML), 표현학습국제학회(ICLR)와 함께 세계적인 권위의 기계학습 및 인공지능 분야 학회로 꼽힌다. 뛰어난 연구자들이 제출하는 논문들도 승인될 확률이 25%에 불과할 정도로 학회의 심사를 통과하기 어려운 것으로 알려져 있다.
윤세영 교수 연구팀은 이번 학회에서 `세포 인식기술 경진대회(Cell Segmentation Challenge)'에 참가했다. 이기훈(박사과정), 김상묵(박사과정), 김준기(석사과정)의 3명의 연구원으로 구성된 OSILAB 팀은 초고해상도의 현미경 이미지에서 인공지능이 자동으로 세포를 인식하는 MEDIAR(메디아) 기술을 개발해 2위 팀과 큰 성능 격차로 1위를 달성했다.
세포 인식은 생명 및 의료 분야의 시작이 되는 중요한 기반 기술이지만, 현미경의 측정 기술과 세포의 종류 등에 따라 다양한 형태로 관찰될 수 있어 인공지능이 학습하기 어려운 분야로 알려져 있다. 세포 인식기술 경진대회는 이러한 한계를 극복하기 위해 초고해상도의 현미경 이미지에서 제한된 시간 안에 세포를 인식하는 기술을 주제로 개최됐다.
연구팀은 기계학습에서 소수의 학습 데이터를 더 효과적으로 활용해 성능을 높이는 데이터 기반(Data-Centric) 접근법과 인공신경망의 구조를 개선하는 모델 기반(Model-Centric) 접근법을 종합적으로 활용해 MEDIAR(메디아) 기술을 개발했다. 개발된 인공지능 기술을 통해 정확하게 세포를 인식하고 고해상도 이미지를 빠르게 연산함으로써 대회에서 좋은 성과를 얻을 수 있었다. 지도교수인 KAIST 김재철AI대학원 윤세영 교수는 “MEDIAR는 세포 인식기술 경진대회를 통해 개발됐지만 기상 예측이나 자율주행과 같이 이미지 속 다양한 형태의 개체 인식을 통해 정확한 예측이 필요한 많은 분야에 적용할 수 있다”라고 향후 다양한 활용을 기대했다.
팀을 이끌었던 이기훈 박사과정은 "처음 접하는 분야에서도 성과를 낼 수 있었던 것은 평소 기본기를 중요시하는 교수님의 가르침 덕분ˮ이라며 "새로운 문제에 끊임없이 도전하자는 것이 연구팀의 기본 정신ˮ이라고 강조했다. 이어 같은 연구실 김상묵 박사과정은 "연구 과정에서 많은 실패가 있었지만, 세상에 꼭 필요한 기술이라는 생각으로 끝까지 노력했다ˮ라며 "혼자서라면 절대 해내지 못했던 결과인 만큼 팀원들에게 정말 감사하다ˮ라고 수상 소감을 전했다. 같은 연구실 김준기 석사과정은 "팀원들과 이룬 성과가 의료 분야 인공지능이 겪는 현실의 문제를 해결하는 데 도움이 될 수 있기를 바란다”라고 밝혔다.
연구팀은 생명과학 분야 연구의 발전을 돕기 위해 개발된 기술을 전면 오픈소스로 공개한다고 밝혔다. 학습된 인공지능 모델과 인공지능을 구현하기 위한 프로그램의 소스 코드는 개발자 플랫폼인 깃허브 (GitHub)를 통해 이용할 수 있다.
2022.12.28 조회수 11618 생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 8216
생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 8216 면 발광 마이크로 LED 패치 개발로 피부 미백에 획기적 효과
우리 대학 신소재공학과 이건재 교수팀과 세브란스 오상호 교수팀이 멜라닌 생성 억제를 위한 *면 발광 마이크로 LED 피부 패치를 개발했다고 10일 밝혔다.
☞ 면 발광 마이크로 LED 피부 패치: 인간의 머리카락의 ~1/100 의 두께를 가지는 매우 작은 LED 칩을 사용하여 제작한 인체에 부착 가능한 광치료 패치다. 기존의 점 발광의 특성을 가지는 LED와 달리, 구형 실리카 입자를 이용한 빛의 산란을 통해 면 발광의 특성을 갖는다.
멜라닌은 피부 내 존재하는 갈색 또는 흑색 색소로, 자외선 혹은 스트레스와 같은 외부 요인에 의해 비정상적으로 합성될 경우, 기미, 주근깨, 검버섯 등의 질환 형태로 나타나기 때문에 정상적으로 치료할 필요가 있다.
최근 피부질환 치료 및 미용을 위한 LED 기기들이 지속적으로 출시되고 있지만, 치료 효과에 있어서는 여전히 논란이 있다. 이는 LED가 피부에 밀착될 수 없어, 거리에 따른 광 손실 및 발열 문제로 인하여 역효과를 낼 수 있기 때문이다. 유의미한 피부 미용 효과를 얻기 위해서는 LED 광원을 피부에 밀착하여 조사함으로써, 균일한 빛을 피부 진피 내까지 효과적으로 전달해야 한다.
이에, 이건재 교수팀은 천여 개의 마이크로 LED를 4×4 cm2의 플라스틱 기판 위에서 구현하고, 빛의 확산을 위한 실리카 입자를 코팅함으로써 피부에 밀착하여 붙일 수 있는 면 발광 마이크로 LED 패치를 제작했다. 100 마이크로미터(μm) 크기의 마이크로 LED는 매우 작아 유연성을 가지며, 수직으로 배열된 전극은 LED의 발열을 줄여, 인간 피부 위에서 열적 손상 없이 장시간 구동 가능하다.
연구팀은 인간 피부 세포와 쥐의 등 피부에 면 발광 마이크로 LED 패치를 밀착시키고 조사하여 멜라닌 생성 억제 효능을 확인하였으며, 기존 상용 LED 대비, 피부 조직에 미치는 독성이 적을 뿐만 아니라, 효과적이고 일관된 경향으로 멜라닌 생성량을 감소시키는 데 성공했다. 또한, 피부 조직 분석을 통하여 멜라닌 생성에 관여하는 MITF (microphthalmia-associated transcription factor), Melan-A, 티로시나아제를 포함하는 단백질 및 효소 발현의 억제가 확인되었다.
이건재 교수는 "이번에 개발한 무기물 기반 면 발광 마이크로 LED 패치는 광 효율, 신뢰성, 수명 등이 우수하며, 기존 광 치료 기기와 달리 부작용은 줄이고 치료 효과를 극대화하여 코스메틱 분야에 큰 영향을 줄 것”이라고 말했다. 면 발광 마이크로 LED 패치는 현재 이 교수가 교원 창업한 ㈜프로닉스에 기술이전되어, 양산 장비를 갖추고 내년 3월 제품 출시를 앞두고 있다.
이번 연구는 웨어러블플랫폼 소재기술센터, 휴먼플러스 융합연구개발사업의 지원을 받아 수행됐으며, 국제 학술지 `어드밴스드 헬스케어 메터리얼즈(Advanced Healthcare Materials)'에 11월 게재됐다.
2022.11.10 조회수 9311
면 발광 마이크로 LED 패치 개발로 피부 미백에 획기적 효과
우리 대학 신소재공학과 이건재 교수팀과 세브란스 오상호 교수팀이 멜라닌 생성 억제를 위한 *면 발광 마이크로 LED 피부 패치를 개발했다고 10일 밝혔다.
☞ 면 발광 마이크로 LED 피부 패치: 인간의 머리카락의 ~1/100 의 두께를 가지는 매우 작은 LED 칩을 사용하여 제작한 인체에 부착 가능한 광치료 패치다. 기존의 점 발광의 특성을 가지는 LED와 달리, 구형 실리카 입자를 이용한 빛의 산란을 통해 면 발광의 특성을 갖는다.
멜라닌은 피부 내 존재하는 갈색 또는 흑색 색소로, 자외선 혹은 스트레스와 같은 외부 요인에 의해 비정상적으로 합성될 경우, 기미, 주근깨, 검버섯 등의 질환 형태로 나타나기 때문에 정상적으로 치료할 필요가 있다.
최근 피부질환 치료 및 미용을 위한 LED 기기들이 지속적으로 출시되고 있지만, 치료 효과에 있어서는 여전히 논란이 있다. 이는 LED가 피부에 밀착될 수 없어, 거리에 따른 광 손실 및 발열 문제로 인하여 역효과를 낼 수 있기 때문이다. 유의미한 피부 미용 효과를 얻기 위해서는 LED 광원을 피부에 밀착하여 조사함으로써, 균일한 빛을 피부 진피 내까지 효과적으로 전달해야 한다.
이에, 이건재 교수팀은 천여 개의 마이크로 LED를 4×4 cm2의 플라스틱 기판 위에서 구현하고, 빛의 확산을 위한 실리카 입자를 코팅함으로써 피부에 밀착하여 붙일 수 있는 면 발광 마이크로 LED 패치를 제작했다. 100 마이크로미터(μm) 크기의 마이크로 LED는 매우 작아 유연성을 가지며, 수직으로 배열된 전극은 LED의 발열을 줄여, 인간 피부 위에서 열적 손상 없이 장시간 구동 가능하다.
연구팀은 인간 피부 세포와 쥐의 등 피부에 면 발광 마이크로 LED 패치를 밀착시키고 조사하여 멜라닌 생성 억제 효능을 확인하였으며, 기존 상용 LED 대비, 피부 조직에 미치는 독성이 적을 뿐만 아니라, 효과적이고 일관된 경향으로 멜라닌 생성량을 감소시키는 데 성공했다. 또한, 피부 조직 분석을 통하여 멜라닌 생성에 관여하는 MITF (microphthalmia-associated transcription factor), Melan-A, 티로시나아제를 포함하는 단백질 및 효소 발현의 억제가 확인되었다.
이건재 교수는 "이번에 개발한 무기물 기반 면 발광 마이크로 LED 패치는 광 효율, 신뢰성, 수명 등이 우수하며, 기존 광 치료 기기와 달리 부작용은 줄이고 치료 효과를 극대화하여 코스메틱 분야에 큰 영향을 줄 것”이라고 말했다. 면 발광 마이크로 LED 패치는 현재 이 교수가 교원 창업한 ㈜프로닉스에 기술이전되어, 양산 장비를 갖추고 내년 3월 제품 출시를 앞두고 있다.
이번 연구는 웨어러블플랫폼 소재기술센터, 휴먼플러스 융합연구개발사업의 지원을 받아 수행됐으며, 국제 학술지 `어드밴스드 헬스케어 메터리얼즈(Advanced Healthcare Materials)'에 11월 게재됐다.
2022.11.10 조회수 9311 RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
2022.10.31 조회수 10568
RNA를 활용한 자가면역질환 조기진단 및 치료제 개발 앞장설 것
우리 대학 생명화학공학과 김유식 교수와 임성갑 교수, 분당서울대병원 류마티스내과 이윤종 교수 그리고 미국 플로리다주립대 차승희 교수 공동 연구팀이 희귀난치성 자가면역질환인 쉐그렌 증후군(Sjögren’s Syndrome)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
원인불명의 만성 전신 염증 질환인 쉐그렌 증후군은 눈물샘 및 침샘 등 외분비샘을 주로 침범하는 자가면역질환이다. 안구 및 구강건조증 등 외분비샘 기능 저하가 가장 흔한 증상이지만, 외분비샘 외 장기 침범이 다양하고 악성 림프종 합병증에 대한 위험이 특징적으로 수반되고 있다. 주로 중년 여성에게 나타나며 환자 중 약 3분의 1은 림프종, 관절염, 간 손상, 기관지염 등의 다양한 전신증상을 겪으며, 악성 림프종 및 폐 섬유화 합병증으로 조기 사망할 수 있는 무서운 질환이다.
연구팀은 쉐그렌 증후군에서 비정상적인 면역 활성을 유발해 외분비샘 조직 손상을 일으키는 물질로 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)를 제시했다.
이번 연구는 mt-dsRNA라는 쉐그렌 증후군 증상 조절 인자를 최초로 확립해 비침습성 조기 진단법 및 치료제 개발을 위한 이론적 기반을 제공할 것으로 기대된다.
우리 대학 생명화학공학과 윤지민 박사과정생과 이민석 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 `몰레큘러 테라피 뉴클레익 에시드(Molecular Therapy – Nucleic Acids)'에 지난 9월 27일 게재됐다. (논문명 : Mitochondrial double-stranded RNAs as a pivotal mediator in the pathogenesis of Sjögren’s syndrome)
쉐그렌 증후군은 질병의 심각성에도 불구하고 지금까지 질환의 병태생리를 대변하는 유전자 마커 없이 환자의 증상을 기반으로 진단이 이뤄지고 있으며 치료제 또한 존재하지 않는 희귀성 난치질환이다. 또한, 쉐그렌 증후군 진단은 이미 외분비샘 조직 손상이 상당히 진행된 후에 가능하고 진단법 역시 증상을 기반으로 해 낮은 질병 특이도를 갖고 있다. 이러한 한계점을 극복하기 위해 연구팀은 질병의 발병 및 진행 메커니즘을 분석해 쉐그렌 증후군의 조기 진단과 치료 효과를 기대할 수 있는 신규 면역 제어 표적 물질을 확립하고자 했다.
쉐그렌 증후군 환자에게서는 특히 이중나선 RNA(dsRNA)를 인지하는 선천성 면역 반응 단백질의 과활성화 그리고 이에 의한 항바이러스성 인터페론 반응이 관찰됐다. 하지만 지금까지 dsRNA가 실제 질환에 관여하는지는 보고된 바 없으며 dsRNA를 표적으로 하는 진단법 및 치료 방향을 탐색한 연구 또한 존재하지 않는다.
세포 내 자연적으로 존재하는 RNA도 dsRNA를 형성해 선천성 면역반응을 조절할 수 있다. 세포 내재 dsRNA를 생성하는 대표적인 세포 내 소기관은 미토콘드리아이며 mt-dsRNA 또한 선천성 면역반응 단백질에 의해 인지되어 인터페론 반응을 유도할 수 있다. 연구팀은 쉐그렌 증후군 환자에서 관찰된 과도한 면역 활성의 특징과 미토콘드리아 기능 이상 등을 고려해 mt-dsRNA가 질환 발병에서 중요한 기능을 할 것이라는 가설을 세우고 연구를 수행했다.
연구팀은 쉐그렌 증후군 환자의 누액과 타액을 분석한 결과 환자 특이적으로 mt-dsRNA의 과발현 현상을 확인했다. 이는 환자의 일차 세포 및 쉐그렌 증후군 모델 생쥐의 손상된 침샘에서도 확인됐다. 연구팀은 이에 mt-dsRNA의 기능을 분석하기 위해 세포 실험을 진행했다. 특히, 타액선 세포주의 3차원 스페로이드 배양 시스템을 구축해 보다 정확한 질병 환경을 모사했다. 그 결과 mt-dsRNA의 발현이 면역 활성이 유발되는 스트레스 상황에서 증가하며 이는 면역 활성의 촉진제 역할을 한다는 것을 연구팀은 규명했다. 특히, mt-dsRNA의 발현을 억제했을 때 면역 활성이 감소하며 질환의 특징이 일부 복원되는 것을 확인했다.
나아가 연구팀은 쉐그렌 증후군 환자의 증상 완화에 활용되는 필로카핀의 치료 메커니즘에서 mt-dsRNA의 기능을 분석했다. 연구팀은 M3R 수용체 작용제인 아세틸콜린이 mt-dsRNA 조절을 통해 면역 활성을 억제하며 쉐그렌 증후군 환자에서 추출된 자가항체가 아세틸콜린을 억제해 과도한 면역 활성을 유발한다는 것을 확인했다. 필로카핀이 아세틸콜린을 모방하는 M3R 작용제임을 고려했을 때, 연구팀은 약물의 효과를 대변할 수 있는 마커로서 mt-dsRNA의 기능성을 검증했다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 난치병으로 인식되고 있는 쉐그렌 증후군에서 mt-dsRNA라는 새로운 병인을 제시했다ˮ면서 "특히, mt-dsRNA 발현량 조절을 통한 면역 과활성화의 완화 효과를 고려했을 때 쉐그렌 증후군 외 기타 자가면역질환에서도 mt-dsRNA라는 새로운 생태 병리학적 마커를 활용해 진단 및 치료 전략을 마련할 수 있을 것ˮ이라고 말했다.
이번 연구는 KAIST-SNUBH End Run 협업 과제, 보건복지부 공익적 의료기술연구사업 및 산업통상자원부 기술혁신프로그램사업의 지원을 받아 수행됐다.
2022.10.31 조회수 10568 악천후에서도 자율주행을 가능하게 하는 세계 최고의 4D 레이더 인공지능 기술 개발
우리 대학 조천식모빌리티대학원 공승현 교수 연구팀이 세계 최초로 악천후 상황에서 안정적인 자율주행을 가능하게 하는 4D 레이더(Radar)의 주변 객체 인지 인공지능 기술을 개발했다고 20일 밝혔다. 연구팀은 구축된 인공지능 학습 데이터셋(Dataset)인 KAIST-레이더(이하 K-레이더)와 개발된 인공지능 신경망(RTN4D) 그리고 전 세계 연구자를 위한 4D 레이더 인공지능 개발 플랫폼(Platform)과 관련 벤치마크(Benchmark)를 모두 공개한다고 밝혔다.
현재 전 세계적으로 개발되고 있는 자율주행 자동차는 주로 카메라와 라이다(LiDAR)에서 출력되는 이미지와 포인트 클라우드(Pointcloud) 데이터를 적절한 인공지능 신경망으로 처리해 자동차 주변의 객체들을 인식하는 방식으로 구현돼 있다. 그러나 카메라와 라이다는 각각 가시광선과 적외선을 사용하므로 눈비 또는 안개 상황에서 측정 성능이 크게 떨어지는데, 이로 인해 주변 객체들에 대한 인식이 어려워져 안전한 자율주행이 불가능하다.
더구나, 차내에 설치할 수 있는 카메라와 달리 자동차의 지붕에 설치하는 라이다는 외부 환경에 노출돼 있어서 그 표면에 눈비 또는 흙먼지가 묻는 경우 라이다를 이용한 전방 탐지가 어려워진다. 공승현 교수는 "젖은 도로에서 전방에 주행 차량이 있는 경우, 그 바퀴에서 일어나는 흙먼지가 섞인 물보라로 라이다 표면이 빠르게 더럽혀지고, 결과적으로 모든 전방 객체에 대한 라이다 측정이 불가능해진다ˮ고 설명한다. {그림 1 참조}
적외선을 사용하는 라이다와는 달리 77기가헤르츠(GHz) 대역의 자동차 레이더는 눈, 비, 안개 등의 악천후 상황에 매우 강건하며 표면에 눈비나 흙먼지가 묻은 상황에서도 안정적인 측정 결과를 보인다. 최근에는 고해상도의 4D 레이더(대상까지의 거리, 방위각, 높이, 도플러 주파수를 측정)가 개발돼 상용화되고 있으며, 그 성능도 빠르게 향상되고 있다.
이에 따라서 전 세계적으로 4D 레이더에 인공지능을 이용한 주변 인지 기술 연구가 시작되고 있지만, 4D 레이더에 필요한 인공지능 연구는 매우 더디게 진행되고 있다. 카메라나 라이다와 달리, 고성능 인공지능 개발에 필수적인 충분한 데이터셋이 구축되지 못하고 있기 때문이다. 2021년부터 4D 레이더의 포인트 클라우드 데이터셋이 일부 공개됐으나, 데이터의 양이 충분하지 않고 측정치가 매우 희소해 신뢰할 만한 객체 인식 인공지능 신경망 개발이 쉽지 않다.
연구팀이 공개하는 K-레이더는 악천후를 포함한 다양한 날씨 및 교통 상황에서 수집된 다양성 높은 데이터셋이며, 정확히 동기된 카메라와 라이다 측정 데이터와 함께 구축된 13테라바이트(TB)에 이르는 대용량으로 세계 최초의 4D 레이더 데이터셋이다. 특히, K-레이더는 포인트 클라우드 형태가 아닌 인공지능 신경망의 성능을 극대화할 수 있는 텐서(Tensor) 형태의 데이터셋으로, 이는 일반적인 레이더의 잡음 제거 방식을 사용하지 않아 잡음 수준의 미약한 미세 측정치를 온전히 담고 있는 형태의 데이터셋이다.
연구팀이 개발한 4D 레이더 인공지능 신경망(RTN4D)은 K-레이더로 수많은 학습을 진행했고, 그 결과 다양한 날씨와 도로 상황에서 70m 이내의 객체에 대해 객체 판별, 위치 추정 및 주행 방향 추정의 3가지 추정을 정확히 수행하는 경우가 최종 62.5%인 세계 최고의 성능을 가진다.
또한, 연구팀은 전 세계의 연구자들이 자체적으로 데이터를 추가 구축하고 신경망 기술을 개발하며 그 성능을 자체 평가할 수 있도록 레이더용 인공지능 신경망 개발 플랫폼과 벤치마크도 공개 제공한다.
조천식모빌리티대학원 공승현 교수는 "눈이나 비가 오는 날씨에서 4D 레이더 인공지능 신경망은 기존 라이다 인공지능 신경망 보다 훨씬 더 안정적인 주변 객체 인지 성능을 갖는데, 이는 4D 레이더가 악천후에서 자율주행을 위한 필수 센서임을 보여주는 결과이며{그림 2 참조}, 최근 미국의 웨이모(Waymo)와 이스라엘의 모빌아이(Mobileye)가 수년 내로 4D 레이더를 자율주행의 주요 인지 센서로 활용할 계획임을 공개적으로 밝힌 이유다ˮ라며 "우리 연구팀이 공개한 K-레이더와 4D 레이더 인공지능 개발 플랫폼 및 벤치마크를 통해, 향후 4D 레이더에 관한 인공지능 연구가 더욱 활발히 진행될 것으로 기대한다ˮ라고 말했다.
K-레이더, 4D 레이더 인공지능 신경망(RTN4D), 4D 레이더 인공지능 개발 플랫폼과 벤치마크는 연구실 홈페이지(http://ave.kaist.ac.kr/)와 깃허브(https://github.com/kaist-avelab/K-Radar)를 통해서 배포될 예정이다. 이번 연구는 한국연구재단(NRF) 및 정보통신기획평가원(IITP)의 지원과 ㈜스마트레이더시스템의 협력으로 수행됐으며, 연구 성과는 백동희 박사과정 학생이 2022년 12월에 열리는 세계적인 인공지능 컨퍼런스인 `뉴립스(NeurIPS) 2022' 데이터셋&벤치마크 트랙(Datasets and Benchmark Track)에서 발표할 예정이다(논문명: K-Radar: 4D Radar Object Detection Dataset and Benchmark for Autonomous Driving in Various Weather Conditions)
2022.10.20 조회수 9182
악천후에서도 자율주행을 가능하게 하는 세계 최고의 4D 레이더 인공지능 기술 개발
우리 대학 조천식모빌리티대학원 공승현 교수 연구팀이 세계 최초로 악천후 상황에서 안정적인 자율주행을 가능하게 하는 4D 레이더(Radar)의 주변 객체 인지 인공지능 기술을 개발했다고 20일 밝혔다. 연구팀은 구축된 인공지능 학습 데이터셋(Dataset)인 KAIST-레이더(이하 K-레이더)와 개발된 인공지능 신경망(RTN4D) 그리고 전 세계 연구자를 위한 4D 레이더 인공지능 개발 플랫폼(Platform)과 관련 벤치마크(Benchmark)를 모두 공개한다고 밝혔다.
현재 전 세계적으로 개발되고 있는 자율주행 자동차는 주로 카메라와 라이다(LiDAR)에서 출력되는 이미지와 포인트 클라우드(Pointcloud) 데이터를 적절한 인공지능 신경망으로 처리해 자동차 주변의 객체들을 인식하는 방식으로 구현돼 있다. 그러나 카메라와 라이다는 각각 가시광선과 적외선을 사용하므로 눈비 또는 안개 상황에서 측정 성능이 크게 떨어지는데, 이로 인해 주변 객체들에 대한 인식이 어려워져 안전한 자율주행이 불가능하다.
더구나, 차내에 설치할 수 있는 카메라와 달리 자동차의 지붕에 설치하는 라이다는 외부 환경에 노출돼 있어서 그 표면에 눈비 또는 흙먼지가 묻는 경우 라이다를 이용한 전방 탐지가 어려워진다. 공승현 교수는 "젖은 도로에서 전방에 주행 차량이 있는 경우, 그 바퀴에서 일어나는 흙먼지가 섞인 물보라로 라이다 표면이 빠르게 더럽혀지고, 결과적으로 모든 전방 객체에 대한 라이다 측정이 불가능해진다ˮ고 설명한다. {그림 1 참조}
적외선을 사용하는 라이다와는 달리 77기가헤르츠(GHz) 대역의 자동차 레이더는 눈, 비, 안개 등의 악천후 상황에 매우 강건하며 표면에 눈비나 흙먼지가 묻은 상황에서도 안정적인 측정 결과를 보인다. 최근에는 고해상도의 4D 레이더(대상까지의 거리, 방위각, 높이, 도플러 주파수를 측정)가 개발돼 상용화되고 있으며, 그 성능도 빠르게 향상되고 있다.
이에 따라서 전 세계적으로 4D 레이더에 인공지능을 이용한 주변 인지 기술 연구가 시작되고 있지만, 4D 레이더에 필요한 인공지능 연구는 매우 더디게 진행되고 있다. 카메라나 라이다와 달리, 고성능 인공지능 개발에 필수적인 충분한 데이터셋이 구축되지 못하고 있기 때문이다. 2021년부터 4D 레이더의 포인트 클라우드 데이터셋이 일부 공개됐으나, 데이터의 양이 충분하지 않고 측정치가 매우 희소해 신뢰할 만한 객체 인식 인공지능 신경망 개발이 쉽지 않다.
연구팀이 공개하는 K-레이더는 악천후를 포함한 다양한 날씨 및 교통 상황에서 수집된 다양성 높은 데이터셋이며, 정확히 동기된 카메라와 라이다 측정 데이터와 함께 구축된 13테라바이트(TB)에 이르는 대용량으로 세계 최초의 4D 레이더 데이터셋이다. 특히, K-레이더는 포인트 클라우드 형태가 아닌 인공지능 신경망의 성능을 극대화할 수 있는 텐서(Tensor) 형태의 데이터셋으로, 이는 일반적인 레이더의 잡음 제거 방식을 사용하지 않아 잡음 수준의 미약한 미세 측정치를 온전히 담고 있는 형태의 데이터셋이다.
연구팀이 개발한 4D 레이더 인공지능 신경망(RTN4D)은 K-레이더로 수많은 학습을 진행했고, 그 결과 다양한 날씨와 도로 상황에서 70m 이내의 객체에 대해 객체 판별, 위치 추정 및 주행 방향 추정의 3가지 추정을 정확히 수행하는 경우가 최종 62.5%인 세계 최고의 성능을 가진다.
또한, 연구팀은 전 세계의 연구자들이 자체적으로 데이터를 추가 구축하고 신경망 기술을 개발하며 그 성능을 자체 평가할 수 있도록 레이더용 인공지능 신경망 개발 플랫폼과 벤치마크도 공개 제공한다.
조천식모빌리티대학원 공승현 교수는 "눈이나 비가 오는 날씨에서 4D 레이더 인공지능 신경망은 기존 라이다 인공지능 신경망 보다 훨씬 더 안정적인 주변 객체 인지 성능을 갖는데, 이는 4D 레이더가 악천후에서 자율주행을 위한 필수 센서임을 보여주는 결과이며{그림 2 참조}, 최근 미국의 웨이모(Waymo)와 이스라엘의 모빌아이(Mobileye)가 수년 내로 4D 레이더를 자율주행의 주요 인지 센서로 활용할 계획임을 공개적으로 밝힌 이유다ˮ라며 "우리 연구팀이 공개한 K-레이더와 4D 레이더 인공지능 개발 플랫폼 및 벤치마크를 통해, 향후 4D 레이더에 관한 인공지능 연구가 더욱 활발히 진행될 것으로 기대한다ˮ라고 말했다.
K-레이더, 4D 레이더 인공지능 신경망(RTN4D), 4D 레이더 인공지능 개발 플랫폼과 벤치마크는 연구실 홈페이지(http://ave.kaist.ac.kr/)와 깃허브(https://github.com/kaist-avelab/K-Radar)를 통해서 배포될 예정이다. 이번 연구는 한국연구재단(NRF) 및 정보통신기획평가원(IITP)의 지원과 ㈜스마트레이더시스템의 협력으로 수행됐으며, 연구 성과는 백동희 박사과정 학생이 2022년 12월에 열리는 세계적인 인공지능 컨퍼런스인 `뉴립스(NeurIPS) 2022' 데이터셋&벤치마크 트랙(Datasets and Benchmark Track)에서 발표할 예정이다(논문명: K-Radar: 4D Radar Object Detection Dataset and Benchmark for Autonomous Driving in Various Weather Conditions)
2022.10.20 조회수 9182 난치성 심혈관 질환인 폐동맥 고혈압의 새로운 모델 및 병리기전 제시
우리 대학 의과학대학원 및 의과학센터 연구진(책임자: 김인준 교수)과 서울대학교병원 연구진(책임자: 박준빈 교수)이 협력하여 폐동맥 고혈압(pulmonary arterial hypertension)의 새로운 동물모델을 구축하고 치료방법을 제시하였다고 지난 10월 7일 소개됐다.
연구팀은 혈관내피세포에서 Sox17 유전자가 결핍된 생쥐에 저산소 환경을 제공하여 새로운 폐동맥 고혈압 동물모델을 성공적으로 개발하였으며, 전사체 분석(transcriptomic analysis)으로 Sox17과 관련된 폐동맥 고혈압 발생의 병리현상에 Dll4/Notch 신호경로가 연관됨을 확인하였다. 또한 심혈관계 질환에서 역할이 잘 알려져 있지 않았던 HGF/c-Met 경로가 활성화됨을 발견하고, 기존의 폐동맥 고혈압 치료 약물 투여와 함께 해당 경로를 차단함으로써 동물모델에서 폐동맥 고혈압을 효과적으로 치료/예방할 수 있음을 확인하였다. 동물모델과 유사하게, 폐동맥 고혈압 환자의 폐조직에서 정상군에 비해 Sox17 발현이 감소하고 HGF 발현은 증가함을 확인하였다. 우리 대학 의과학대학원 졸업생 박찬순 박사가 (현 서울대병원 순환기내과 임상강사) 1저자로 주도한 이번 연구 결과는 심혈관 기초연구 분야 최고 학술지인 Circulation Research에 온라인 게재되었다.
기존 폐동맥 고혈압 동물모델은 실제 폐동맥 고혈압 환자들이 보이는 만성 진행성 임상양상을 잘 나타내지 못한다는 한계가 있었다. 예를 들어, 저산소-유발 폐동맥 고혈압 동물모델은 정상 산소 농도에 다시 두면 증상이 종종 호전되는데, 이는 환자의 질병 경과와는 차이가 있다. Sox17 내피결핍 생쥐에서 발생한 폐동맥 고혈압은 질병 상태가 만성적으로 유지되는 등 실제 병태생리를 잘 반영하였다. 이러한 장점으로 인해, 새로운 모델은 약제 개발 및 치료반응 확인에 보다 효과적으로 사용될 수 있을 것으로 기대된다. 더불어 이번 연구는 사망률을 경감시키는 효과적인 치료제가 없는 폐동맥 고혈압 치료 분야에 HGF/c-Met 신호경로를 새로운 약제 개발의 타겟으로 제시했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
2022.10.12 조회수 7772
난치성 심혈관 질환인 폐동맥 고혈압의 새로운 모델 및 병리기전 제시
우리 대학 의과학대학원 및 의과학센터 연구진(책임자: 김인준 교수)과 서울대학교병원 연구진(책임자: 박준빈 교수)이 협력하여 폐동맥 고혈압(pulmonary arterial hypertension)의 새로운 동물모델을 구축하고 치료방법을 제시하였다고 지난 10월 7일 소개됐다.
연구팀은 혈관내피세포에서 Sox17 유전자가 결핍된 생쥐에 저산소 환경을 제공하여 새로운 폐동맥 고혈압 동물모델을 성공적으로 개발하였으며, 전사체 분석(transcriptomic analysis)으로 Sox17과 관련된 폐동맥 고혈압 발생의 병리현상에 Dll4/Notch 신호경로가 연관됨을 확인하였다. 또한 심혈관계 질환에서 역할이 잘 알려져 있지 않았던 HGF/c-Met 경로가 활성화됨을 발견하고, 기존의 폐동맥 고혈압 치료 약물 투여와 함께 해당 경로를 차단함으로써 동물모델에서 폐동맥 고혈압을 효과적으로 치료/예방할 수 있음을 확인하였다. 동물모델과 유사하게, 폐동맥 고혈압 환자의 폐조직에서 정상군에 비해 Sox17 발현이 감소하고 HGF 발현은 증가함을 확인하였다. 우리 대학 의과학대학원 졸업생 박찬순 박사가 (현 서울대병원 순환기내과 임상강사) 1저자로 주도한 이번 연구 결과는 심혈관 기초연구 분야 최고 학술지인 Circulation Research에 온라인 게재되었다.
기존 폐동맥 고혈압 동물모델은 실제 폐동맥 고혈압 환자들이 보이는 만성 진행성 임상양상을 잘 나타내지 못한다는 한계가 있었다. 예를 들어, 저산소-유발 폐동맥 고혈압 동물모델은 정상 산소 농도에 다시 두면 증상이 종종 호전되는데, 이는 환자의 질병 경과와는 차이가 있다. Sox17 내피결핍 생쥐에서 발생한 폐동맥 고혈압은 질병 상태가 만성적으로 유지되는 등 실제 병태생리를 잘 반영하였다. 이러한 장점으로 인해, 새로운 모델은 약제 개발 및 치료반응 확인에 보다 효과적으로 사용될 수 있을 것으로 기대된다. 더불어 이번 연구는 사망률을 경감시키는 효과적인 치료제가 없는 폐동맥 고혈압 치료 분야에 HGF/c-Met 신호경로를 새로운 약제 개발의 타겟으로 제시했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
2022.10.12 조회수 7772 장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 10671
장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 10671 기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29 조회수 11484
기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29 조회수 11484 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12541
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12541