-
 상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
2022.10.24
조회수 9506
-
 카이캐치(KaiCatch), 악성 동영상 위변조 탐지 기술 개발
우리 대학 전산학부 이흥규 명예교수 연구팀이 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 악성 위변조에 활용되는 프레임 업 변환, 보간법에 의해 생성된 프레임, 영상내 위변조 영역 등을 탐지하는 동영상 위변조 탐지 기술을 개발했다.
위변조 분야 최상위 저명 논문지인 Forensic Science International 11월호에 논문으로도 발표했다.
CCTV의 대량 보급과 함께 동영상은 수많은 분쟁시 주요 증거물로 사용되고 있다. 그러나 동영상에 대한 편집 도구 기술과 인공지능 기술 발전과 함께 동영상의 편집, 프레임 삭제 및 추가 등의 위변조를 포함하여 프레임 업 변환 이라는 기술을 사용하여 위변조 동영상을 고품질 영상으로 변환함으로써 위변조 동영상을 원본과 유사하게 변환함으로써 위변조 탐지를 더욱 어렵게 하는 악성 변조 기술 등도 등장하고 있다.
이번 연구에서는 동영상내 특정 영역들의 편집 변조를 포함하여 프레임 추가, 삭제, 프레임률 변환 탐지를 포함하여 공간정보와 시간정보를 연속적으로 활용하는 프레임-업 변환을 탐지하기 위해 프레임-업 특징들을 추출하는 4개 유형의 네트워크블럭들과 보팅(voting) 기능을 채택한 프레임-업 탐지 뉴럴 네트워크를 제시하였다.
개발된 기술은 특히 동영상의 극히 작은 영역들의 정보를 사용하여 무결성 여부를 판독하기 때문에 동영상 위변조 탐지를 고속으로 수행할 수 있어 기존 기술들과 비교하여 기술의 유용성과 실용성이 매우 뛰어나다.
이번 연구는 KAIST 윤민석 박사, ㈜네이버웹튠AI의 남승훈 박사 등이 참여하였으며 KAIST에서 위변조를 잡아낸다는 의미인 카이캐치(KaiCatch) 위변조 탐지 소프트웨어 기능을 동영상으로도 크게 확장 했다는 점에서 그 의미가 있다.
개발된 기술은 영상 위변조 분야 최상위 저명 논문지인 Forensic Science International 2022년 11월호(Vol 340)에 ‘Frame-rate Up-conversion Detection based on Convolutional Neural Network for Learning Spatiotemporal Features’ 논문으로 발표 되었다. 본 연구는 한국연구재단 창의도전연구기반지원사업과 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 수행하였다.
카이캐치(KaiCatch), 악성 동영상 위변조 탐지 기술 개발
우리 대학 전산학부 이흥규 명예교수 연구팀이 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 악성 위변조에 활용되는 프레임 업 변환, 보간법에 의해 생성된 프레임, 영상내 위변조 영역 등을 탐지하는 동영상 위변조 탐지 기술을 개발했다.
위변조 분야 최상위 저명 논문지인 Forensic Science International 11월호에 논문으로도 발표했다.
CCTV의 대량 보급과 함께 동영상은 수많은 분쟁시 주요 증거물로 사용되고 있다. 그러나 동영상에 대한 편집 도구 기술과 인공지능 기술 발전과 함께 동영상의 편집, 프레임 삭제 및 추가 등의 위변조를 포함하여 프레임 업 변환 이라는 기술을 사용하여 위변조 동영상을 고품질 영상으로 변환함으로써 위변조 동영상을 원본과 유사하게 변환함으로써 위변조 탐지를 더욱 어렵게 하는 악성 변조 기술 등도 등장하고 있다.
이번 연구에서는 동영상내 특정 영역들의 편집 변조를 포함하여 프레임 추가, 삭제, 프레임률 변환 탐지를 포함하여 공간정보와 시간정보를 연속적으로 활용하는 프레임-업 변환을 탐지하기 위해 프레임-업 특징들을 추출하는 4개 유형의 네트워크블럭들과 보팅(voting) 기능을 채택한 프레임-업 탐지 뉴럴 네트워크를 제시하였다.
개발된 기술은 특히 동영상의 극히 작은 영역들의 정보를 사용하여 무결성 여부를 판독하기 때문에 동영상 위변조 탐지를 고속으로 수행할 수 있어 기존 기술들과 비교하여 기술의 유용성과 실용성이 매우 뛰어나다.
이번 연구는 KAIST 윤민석 박사, ㈜네이버웹튠AI의 남승훈 박사 등이 참여하였으며 KAIST에서 위변조를 잡아낸다는 의미인 카이캐치(KaiCatch) 위변조 탐지 소프트웨어 기능을 동영상으로도 크게 확장 했다는 점에서 그 의미가 있다.
개발된 기술은 영상 위변조 분야 최상위 저명 논문지인 Forensic Science International 2022년 11월호(Vol 340)에 ‘Frame-rate Up-conversion Detection based on Convolutional Neural Network for Learning Spatiotemporal Features’ 논문으로 발표 되었다. 본 연구는 한국연구재단 창의도전연구기반지원사업과 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 수행하였다.
2022.10.20
조회수 10022
-
 RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
2022.09.07
조회수 11879
-
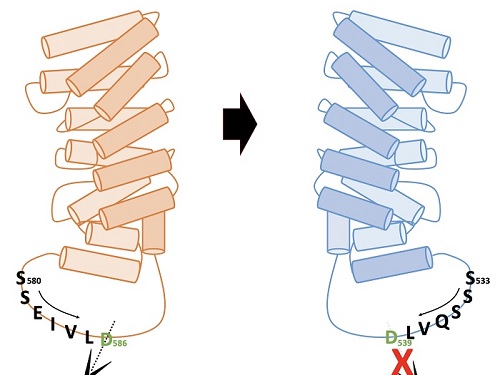 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02
조회수 8015
-
 RNA 활용해 퇴행성 관절염 획기적 조기진단 가능성 열어
우리 대학 생명화학공학과 김유식 교수와 분당서울대병원 류마티스내과 이윤종 교수 공동 연구팀이 골관절염(Osteoarthritis)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
골관절염은 뼈의 관절면을 감싸고 있는 관절 연골이 마모돼 연골 밑의 뼈가 노출되고, 관절 주변 활액막에 염증이 생겨서 통증과 변형이 발생하는 질환이다. 흔히 퇴행성 관절염이라고도 불리며, 관절 질환 중에서 가장 많이 발생하는 질환이다.
연구팀은 골관절염의 발병 과정 중 손상된 연골에서 염증을 일으켜 세포사멸을 촉진하는 물질이 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)라는 것을 밝혔다.
이번 연구는 골관절염에서 발견되는 다양한 증상들의 원인을 mt-dsRNA라는 개념을 통해 하나로 통합함으로써 골관절염 진단 및 치료에 획기적인 방안을 제시할 것으로 기대된다.
생명화학공학과 박사과정에 재학 중인 김수진 학생과 이건용 학생이 공동 제1 저자로 참여한 이번 연구는 국제학술지 `셀 리포트(Cell Reports)' 지난 8월 9일 字에 게재됐다. (논문명 : Mitochondrial double-stranded RNAs govern the stress response in chondrocytes to promote osteoarthritis development)
골관절염은 우리나라 70세 이상의 여성 인구에서 약 50%의 유병률을 보이는 매우 흔한 질환이다. 골관절염은 일반적으로 노화와 함께 진행되기 때문에 초기에 이들을 구분하는 데 한계가 있다. 골관절염의 진행을 늦추기 위해 증상의 심각성에 따라 약물을 활용한 보존적 치료 혹은 수술을 비롯한 다양한 시도를 활발히 하고 있지만, 기존 접근방법으로 골관절염이 완치될 것이라는 기대를 하기는 어려운 상황이다. 연구팀은 질병의 발병 및 진행 메커니즘을 분석함으로써 골관절염의 조기진단과 완치에 한 걸음 다가갈 수 있는 완전히 새로운 표적 물질을 찾고자 했다.
이중나선 RNA(dsRNA)는 비정상적인 면역반응을 유발해 세포사멸 및 염증반응을 촉진한다고 알려져 있다. dsRNA의 과발현은 다양한 퇴행성 질환과 밀접한 관련이 있어 dsRNA의 조절은 건강한 세포를 유지하기 위해 필수적이다. 세포에서 dsRNA를 생성하는 대표적인 기관은 세포에 에너지를 제공한다고 알려진 미토콘드리아다. 미토콘드리아는 자체 생산하는 dsRNA를 세포질로부터 분리해 dsRNA의 노출과 이에 따른 면역반응을 막는다. 하지만 자극 혹은 세포 스트레스에 의해 mt-dsRNA가 세포질에 노출되면 RNA가 면역반응 단백질에 의해 인지돼 비정상적인 면역반응을 일으킬 수 있다.
연구팀은 골관절염에서 미토콘드리아의 손상과 원인을 알 수 없는 면역반응 단백질의 활성화가 관찰된다는 점에 착안해 mt-dsRNA가 골관절염 발병에서 중요한 기능을 할 것이라는 가설을 세웠다.
연구팀은 연골세포에서 구축한 골관절염 모사 환경에서 mt-dsRNA가 미토콘드리아 외부로 노출돼 선천성 면역반응 단백질에 의해 인지됨에 따라 면역반응을 일으킨다는 것을 확인했다. 또한 골관절염 환자들의 무릎 활막액 및 연골 조직과 골관절염 생쥐 모델의 연골에서도 mt-dsRNA가 유의미하게 증가해 있는 것을 확인했다.
특히, 다른 관절 질환인 류마티스 관절염과 통풍 환자들의 활막액과 비교했을 때 골관절염 환자들의 활막액에서 더 많은 양의 mt-dsRNA가 검출됐다. 또한 초기 골관절염을 앓고 있는 환자들의 연골에서 mt-dsRNA가 많이 증가했다. 따라서 연구팀은 골관절염을 특이적으로 조기진단 할 수 있는 바이오마커로서 mt-dsRNA의 가능성을 제시했다.
더 나아가 연구팀은 골관절염의 전도유망한 치료법 중 하나인 자가포식(Autophagy)의 치료 메커니즘에서 mt-dsRNA의 역할을 규명했다. 연구팀은 자가포식이 세포질에서 mt-dsRNA를 제거함으로써 골관절염의 증상을 완화할 수 있다는 사실을 밝힘으로써 골관절염 치료를 위한 신개념의 표적 물질로서 mt-dsRNA을 제시했다.
생명화학공학과 김유식 교수는 "이번 연구는 세포 수준의 골관절염 모사 환경에서 mt-dsRNA의 기능 규명을 넘어서 실제 골관절염 생쥐 모델의 연골 및 환자의 인체유래물에서 mt-dsRNA의 특이적인 발현 증가를 검증했다ˮ면서 "골관절염처럼 미토콘드리아 손상이 관찰되는 알츠하이머를 비롯한 퇴행성 질환의 발병 메커니즘 분석에 mt-dsRNA를 활용한다면 효과적인 치료전략을 마련하는데 유용할 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 박사과정생 연구장려금 지원사업의 지원을 받아 수행했다.
RNA 활용해 퇴행성 관절염 획기적 조기진단 가능성 열어
우리 대학 생명화학공학과 김유식 교수와 분당서울대병원 류마티스내과 이윤종 교수 공동 연구팀이 골관절염(Osteoarthritis)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
골관절염은 뼈의 관절면을 감싸고 있는 관절 연골이 마모돼 연골 밑의 뼈가 노출되고, 관절 주변 활액막에 염증이 생겨서 통증과 변형이 발생하는 질환이다. 흔히 퇴행성 관절염이라고도 불리며, 관절 질환 중에서 가장 많이 발생하는 질환이다.
연구팀은 골관절염의 발병 과정 중 손상된 연골에서 염증을 일으켜 세포사멸을 촉진하는 물질이 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)라는 것을 밝혔다.
이번 연구는 골관절염에서 발견되는 다양한 증상들의 원인을 mt-dsRNA라는 개념을 통해 하나로 통합함으로써 골관절염 진단 및 치료에 획기적인 방안을 제시할 것으로 기대된다.
생명화학공학과 박사과정에 재학 중인 김수진 학생과 이건용 학생이 공동 제1 저자로 참여한 이번 연구는 국제학술지 `셀 리포트(Cell Reports)' 지난 8월 9일 字에 게재됐다. (논문명 : Mitochondrial double-stranded RNAs govern the stress response in chondrocytes to promote osteoarthritis development)
골관절염은 우리나라 70세 이상의 여성 인구에서 약 50%의 유병률을 보이는 매우 흔한 질환이다. 골관절염은 일반적으로 노화와 함께 진행되기 때문에 초기에 이들을 구분하는 데 한계가 있다. 골관절염의 진행을 늦추기 위해 증상의 심각성에 따라 약물을 활용한 보존적 치료 혹은 수술을 비롯한 다양한 시도를 활발히 하고 있지만, 기존 접근방법으로 골관절염이 완치될 것이라는 기대를 하기는 어려운 상황이다. 연구팀은 질병의 발병 및 진행 메커니즘을 분석함으로써 골관절염의 조기진단과 완치에 한 걸음 다가갈 수 있는 완전히 새로운 표적 물질을 찾고자 했다.
이중나선 RNA(dsRNA)는 비정상적인 면역반응을 유발해 세포사멸 및 염증반응을 촉진한다고 알려져 있다. dsRNA의 과발현은 다양한 퇴행성 질환과 밀접한 관련이 있어 dsRNA의 조절은 건강한 세포를 유지하기 위해 필수적이다. 세포에서 dsRNA를 생성하는 대표적인 기관은 세포에 에너지를 제공한다고 알려진 미토콘드리아다. 미토콘드리아는 자체 생산하는 dsRNA를 세포질로부터 분리해 dsRNA의 노출과 이에 따른 면역반응을 막는다. 하지만 자극 혹은 세포 스트레스에 의해 mt-dsRNA가 세포질에 노출되면 RNA가 면역반응 단백질에 의해 인지돼 비정상적인 면역반응을 일으킬 수 있다.
연구팀은 골관절염에서 미토콘드리아의 손상과 원인을 알 수 없는 면역반응 단백질의 활성화가 관찰된다는 점에 착안해 mt-dsRNA가 골관절염 발병에서 중요한 기능을 할 것이라는 가설을 세웠다.
연구팀은 연골세포에서 구축한 골관절염 모사 환경에서 mt-dsRNA가 미토콘드리아 외부로 노출돼 선천성 면역반응 단백질에 의해 인지됨에 따라 면역반응을 일으킨다는 것을 확인했다. 또한 골관절염 환자들의 무릎 활막액 및 연골 조직과 골관절염 생쥐 모델의 연골에서도 mt-dsRNA가 유의미하게 증가해 있는 것을 확인했다.
특히, 다른 관절 질환인 류마티스 관절염과 통풍 환자들의 활막액과 비교했을 때 골관절염 환자들의 활막액에서 더 많은 양의 mt-dsRNA가 검출됐다. 또한 초기 골관절염을 앓고 있는 환자들의 연골에서 mt-dsRNA가 많이 증가했다. 따라서 연구팀은 골관절염을 특이적으로 조기진단 할 수 있는 바이오마커로서 mt-dsRNA의 가능성을 제시했다.
더 나아가 연구팀은 골관절염의 전도유망한 치료법 중 하나인 자가포식(Autophagy)의 치료 메커니즘에서 mt-dsRNA의 역할을 규명했다. 연구팀은 자가포식이 세포질에서 mt-dsRNA를 제거함으로써 골관절염의 증상을 완화할 수 있다는 사실을 밝힘으로써 골관절염 치료를 위한 신개념의 표적 물질로서 mt-dsRNA을 제시했다.
생명화학공학과 김유식 교수는 "이번 연구는 세포 수준의 골관절염 모사 환경에서 mt-dsRNA의 기능 규명을 넘어서 실제 골관절염 생쥐 모델의 연골 및 환자의 인체유래물에서 mt-dsRNA의 특이적인 발현 증가를 검증했다ˮ면서 "골관절염처럼 미토콘드리아 손상이 관찰되는 알츠하이머를 비롯한 퇴행성 질환의 발병 메커니즘 분석에 mt-dsRNA를 활용한다면 효과적인 치료전략을 마련하는데 유용할 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 박사과정생 연구장려금 지원사업의 지원을 받아 수행했다.
2022.08.31
조회수 7714
-
 암의 조기 진단, 치료방향 결정 등을 위한 표적 마이크로RNA 다중 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수, 신소재공학과 정연식 교수 공동 연구팀이 암 관련 마이크로RNA를 다중 검출할 수 있는 다색 양자점(퀀텀닷) 어레이를 개발했다고 20일 밝혔다.
신소재공학과 남태원 박사와 생명화학공학과 박연경 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회(American Chemical Society)가 발행하는 국제 학술지 `ACS 나노(ACS Nano)'에 2022년도 6월 15일 字 온라인판에 게재됐다. (논문명: Polychromatic quantum dot array to compose a community signal ensemble for multiplexed miRNA detection)
마이크로RNA는 18~25개의 염기서열로 이루어진 짧은 RNA로, 유전자 발현을 조절함으로써 세포 성장 및 분화와 같은 다양한 세포 활동을 제어한다. 마이크로RNA의 비정상적인 발현은 암을 포함한 다양한 질병과 밀접하게 연관돼있어, 여러 가지 질병을 진단하는 차세대 바이오마커로 크게 주목을 받고 있다.
마이크로RNA를 검출하는 가장 일반적인 기존의 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 하지만 이 기술은 역전사 반응을 수반하기 때문에 정량의 정확도가 떨어지고 다중 분석이 제한된다. 다중 핵산 분석에 특화되어 개발된 마이크로 어레이 기술 또한 여전히 역전사 단계를 수반하고 있으며 민감도와 특이도에 있어서 한계가 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 트랜스퍼 프린팅 기법을 활용해 초고해상도의 다색 양자점 어레이(이하 PQDA)를 제작했고 이를 마이크로RNA를 분석하는 기술로 발전시켰다. 그 결과 연구팀은 표적 마이크로RNA를 높은 민감도와 특이도로 다중 검출하는 데 성공하였다.
PQDA는 표적 마이크로RNA에 상보적인 DNA프로브/양자점 복합체가 고정된 고분자 패턴으로, 이중가닥 특이적 뉴클레아제(이하 DSN) 효소에 의해서 표적 마이크로RNA에 특이적인 양자점을 방출하도록 설계됐다. 연구팀은 방출된 양자점들의 형광 신호 앙상블을 기반으로 유방암에 관련된 세 종류의 마이크로RNA를 펨토(10-15) 몰 수준으로 검출하는 데 성공했다. 또한, 혈청과 유방암세포로부터 마이크로RNA를 검출함으로써 기술의 임상 활용도를 입증했다.
PQDA는 각각 독립적인 정량화가 가능한 DNA프로브-양자점 모듈로 이뤄져 있다는 점에서 다중 분석에 적합하다. 특히, PQDA 기반 검출은 역전사 단계 없이 원상태의 마이크로RNA에서 수행하기 때문에 정확한 정량 분석이 가능하고, DSN 효소를 활용해 별도의 증폭 절차 없이 높은 감도를 달성했다. 또한, DSN 효소의 우수한 표적 식별 능력을 이용해 매우 높은 특이도로 표적 마이크로RNA를 검출할 수 있었다.
연구팀 관계자는 "특히 마이크로RNA는 혈액, 타액 및 소변과 같은 체액에도 존재하기 때문에 액체생검(Liquid biopsy)을 위한 핵심 바이오마커로 작용할 수 있다ˮ며 "따라서 이번 기술은 암의 조기 진단, 치료 방향 결정, 치료 효과 모니터링 등을 위한 액체생검 기술로 널리 활용될 수 있을 것으로 기대된다ˮ고 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 기초연구사업, 글로벌프론티어사업, 중견연구자지원사업의 일환으로 수행됐다.
암의 조기 진단, 치료방향 결정 등을 위한 표적 마이크로RNA 다중 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수, 신소재공학과 정연식 교수 공동 연구팀이 암 관련 마이크로RNA를 다중 검출할 수 있는 다색 양자점(퀀텀닷) 어레이를 개발했다고 20일 밝혔다.
신소재공학과 남태원 박사와 생명화학공학과 박연경 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회(American Chemical Society)가 발행하는 국제 학술지 `ACS 나노(ACS Nano)'에 2022년도 6월 15일 字 온라인판에 게재됐다. (논문명: Polychromatic quantum dot array to compose a community signal ensemble for multiplexed miRNA detection)
마이크로RNA는 18~25개의 염기서열로 이루어진 짧은 RNA로, 유전자 발현을 조절함으로써 세포 성장 및 분화와 같은 다양한 세포 활동을 제어한다. 마이크로RNA의 비정상적인 발현은 암을 포함한 다양한 질병과 밀접하게 연관돼있어, 여러 가지 질병을 진단하는 차세대 바이오마커로 크게 주목을 받고 있다.
마이크로RNA를 검출하는 가장 일반적인 기존의 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 하지만 이 기술은 역전사 반응을 수반하기 때문에 정량의 정확도가 떨어지고 다중 분석이 제한된다. 다중 핵산 분석에 특화되어 개발된 마이크로 어레이 기술 또한 여전히 역전사 단계를 수반하고 있으며 민감도와 특이도에 있어서 한계가 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 트랜스퍼 프린팅 기법을 활용해 초고해상도의 다색 양자점 어레이(이하 PQDA)를 제작했고 이를 마이크로RNA를 분석하는 기술로 발전시켰다. 그 결과 연구팀은 표적 마이크로RNA를 높은 민감도와 특이도로 다중 검출하는 데 성공하였다.
PQDA는 표적 마이크로RNA에 상보적인 DNA프로브/양자점 복합체가 고정된 고분자 패턴으로, 이중가닥 특이적 뉴클레아제(이하 DSN) 효소에 의해서 표적 마이크로RNA에 특이적인 양자점을 방출하도록 설계됐다. 연구팀은 방출된 양자점들의 형광 신호 앙상블을 기반으로 유방암에 관련된 세 종류의 마이크로RNA를 펨토(10-15) 몰 수준으로 검출하는 데 성공했다. 또한, 혈청과 유방암세포로부터 마이크로RNA를 검출함으로써 기술의 임상 활용도를 입증했다.
PQDA는 각각 독립적인 정량화가 가능한 DNA프로브-양자점 모듈로 이뤄져 있다는 점에서 다중 분석에 적합하다. 특히, PQDA 기반 검출은 역전사 단계 없이 원상태의 마이크로RNA에서 수행하기 때문에 정확한 정량 분석이 가능하고, DSN 효소를 활용해 별도의 증폭 절차 없이 높은 감도를 달성했다. 또한, DSN 효소의 우수한 표적 식별 능력을 이용해 매우 높은 특이도로 표적 마이크로RNA를 검출할 수 있었다.
연구팀 관계자는 "특히 마이크로RNA는 혈액, 타액 및 소변과 같은 체액에도 존재하기 때문에 액체생검(Liquid biopsy)을 위한 핵심 바이오마커로 작용할 수 있다ˮ며 "따라서 이번 기술은 암의 조기 진단, 치료 방향 결정, 치료 효과 모니터링 등을 위한 액체생검 기술로 널리 활용될 수 있을 것으로 기대된다ˮ고 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 기초연구사업, 글로벌프론티어사업, 중견연구자지원사업의 일환으로 수행됐다.
2022.07.20
조회수 9244
-
 대량의 고농도 일산화탄소를 고부가가치 바이오케미칼로 전환하는 기술 개발
우리 대학 생명과학과 조병관 교수 연구팀이 산업 부생가스 등으로 대량 발생하는 고농도의 일산화탄소를 고부가가치 바이오케미칼로 전환할 수 있는 생체촉매 기반 C1 바이오 리파이너리 기술*을 개발했다고 14일 밝혔다.
* 제철 공정과 같은 산업공정에서 발생하는 부생가스, 합성가스는 다량의 일산화탄소, 이산화탄소 등의 탄소 1개로 이루어진 C1 가스로 구성되어 있음. 이러한 C1 가스를 미생물과 같은 생체촉매를 활용하여 다양한 화학물질로 전환하는 공정을 C1 가스 바이오 리파이너리(bio-refinery) 기술이라고 함.
최근 탄소 포집 및 전환과 같은 기술들에 대한 산업계의 요구가 커지는 가운데, 미생물을 활용한 친환경 생체촉매 기술이 크게 성장하고 있다.
조병관 교수 연구팀은 아세토젠 미생물을 생체촉매로 활용한 C1 가스 바이오 리파이너리 기술을 개발했다. 이 미생물들은 혐기성 미생물들로 우드-융달 대사회로라는 매우 독특한 대사회로를 이용하여 C1 가스로부터 아세트산을 만드는 미생물로 알려져 있다.
이러한 아세토젠 미생물을 생체촉매로 활용해 산업 부생가스를 활용하는 기술에는 한 가지 문제가 있는데, 바로 독성가스인 일산화탄소의 농도다. 이 미생물은 60% 이상의 고농도 일산화탄소 조건에서는 생명 활동이 크게 저해를 받기 때문에, 생체촉매로써 사용할 수 없게 된다. 다양한 산업에서 발생하는 C1 가스는 공정 과정에 따라 10~70% 정도의 일산화탄소가 포함돼있는데, 특히 철강산업 공정에서 발생하는 고로가스(BFG)에는 약 60%가 넘는 일산화탄소가 포함돼 있다. 따라서, 미생물 기반 고효율 생체촉매 개발을 위해서는 일산화탄소에 대한 저항성을 높이는 것이 필수적으로 선행돼야 한다.
연구팀은 아세토젠 미생물 중 하나인 유박테리움 리모좀(Eubacterium limosum) 균주를 고농도 일산화탄소 조건에 지속적으로 노출해 일산화탄소에 대한 내성이 뛰어난 돌연변이체(ECO2)를 발굴했는데, 해당 돌연변이체는 일산화탄소가 약 60% 이상 포함된 합성가스 조건에서 야생형 미생물보다 약 6배 정도 빠른 성장 속도를 보였다. 이러한 성장 속도는 현재까지 보고된 아세토젠 미생물 중 고농도 일산화탄소 조건(CO 함량 60% 이상)에서 전 세계에서 가장 빠른 속도다.
연구팀은 위의 돌연변이 미생물의 유전체 서열분석을 통해 아세틸 조효소 A 합성 단백질(acetyl-CoA synthase)을 암호화하는 유전자(acsB) 내 돌연변이가 발생한 것을 규명하고, 인공지능 기반의 구조예측을 통해 이러한 변이가 일산화탄소 내성 및 고정률 향상을 유도했음을 밝혔다.
연구팀은 일산화탄소에 대한 내성이 향상된 ECO2 돌연변이 미생물에 2,3-부탄다이올(2,3-butanediol, 2,3-BDO)* 생합성 경로를 도입해 C1 가스를 C4 화학물질로 전환할 수 있는 미생물 기반 생체촉매 시스템을 개발했다. ECO2 기반의 생체촉매가 가스 발효과정을 통해 야생형 미생물 대비 약 6.5배 정도의 높은 2,3-BDO 생산성을 보여줌으로써, C1 가스를 효율적으로 C4 화학연료로 전환하는데 성공했다.
*2,3-부탄다이올(2,3-butanediol, 2,3-BDO): 농업용 자재, 식품첨가제, 의약품 첨가제, 고분자 첨가제 등 활용 범위가 광범위한 바이오케미칼
연구를 주도한 조병관 교수는 “산업공정 과정에서 발생하는 C1 가스는 일산화탄소, 이산화탄소 등의 혼합가스로, 이를 직접적으로 미생물이 이용하기 위해서는 일산화탄소에 대한 내성 및 전환율 향상이 필수적이다”라고 설명했으며, “다양한 합성생물학 기술들 활용하면 아세토젠 미생물 생체촉매의 활용도를 더욱 개선할 수 있으며, 이러한 고효율 C1 가스 전환 생체촉매 연구는 C1 가스 바이오 리파이너리의 핵심 원천기술로 다양한 산업현장에 적용할 수 있을 것”라고 밝혔다.
생명과학과 진상락(석박사통합과정), 강슬기(박사과정) 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘화학 공학 저널(Chemical Engineering Journal, 영향력지수 14.66)’에 6월 22일 字 온라인판에 게재됐다. (논문명: Development of CO gas conversion system using high CO tolerance biocatalyst)
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업단의 지원을 받아 수행됐다.
대량의 고농도 일산화탄소를 고부가가치 바이오케미칼로 전환하는 기술 개발
우리 대학 생명과학과 조병관 교수 연구팀이 산업 부생가스 등으로 대량 발생하는 고농도의 일산화탄소를 고부가가치 바이오케미칼로 전환할 수 있는 생체촉매 기반 C1 바이오 리파이너리 기술*을 개발했다고 14일 밝혔다.
* 제철 공정과 같은 산업공정에서 발생하는 부생가스, 합성가스는 다량의 일산화탄소, 이산화탄소 등의 탄소 1개로 이루어진 C1 가스로 구성되어 있음. 이러한 C1 가스를 미생물과 같은 생체촉매를 활용하여 다양한 화학물질로 전환하는 공정을 C1 가스 바이오 리파이너리(bio-refinery) 기술이라고 함.
최근 탄소 포집 및 전환과 같은 기술들에 대한 산업계의 요구가 커지는 가운데, 미생물을 활용한 친환경 생체촉매 기술이 크게 성장하고 있다.
조병관 교수 연구팀은 아세토젠 미생물을 생체촉매로 활용한 C1 가스 바이오 리파이너리 기술을 개발했다. 이 미생물들은 혐기성 미생물들로 우드-융달 대사회로라는 매우 독특한 대사회로를 이용하여 C1 가스로부터 아세트산을 만드는 미생물로 알려져 있다.
이러한 아세토젠 미생물을 생체촉매로 활용해 산업 부생가스를 활용하는 기술에는 한 가지 문제가 있는데, 바로 독성가스인 일산화탄소의 농도다. 이 미생물은 60% 이상의 고농도 일산화탄소 조건에서는 생명 활동이 크게 저해를 받기 때문에, 생체촉매로써 사용할 수 없게 된다. 다양한 산업에서 발생하는 C1 가스는 공정 과정에 따라 10~70% 정도의 일산화탄소가 포함돼있는데, 특히 철강산업 공정에서 발생하는 고로가스(BFG)에는 약 60%가 넘는 일산화탄소가 포함돼 있다. 따라서, 미생물 기반 고효율 생체촉매 개발을 위해서는 일산화탄소에 대한 저항성을 높이는 것이 필수적으로 선행돼야 한다.
연구팀은 아세토젠 미생물 중 하나인 유박테리움 리모좀(Eubacterium limosum) 균주를 고농도 일산화탄소 조건에 지속적으로 노출해 일산화탄소에 대한 내성이 뛰어난 돌연변이체(ECO2)를 발굴했는데, 해당 돌연변이체는 일산화탄소가 약 60% 이상 포함된 합성가스 조건에서 야생형 미생물보다 약 6배 정도 빠른 성장 속도를 보였다. 이러한 성장 속도는 현재까지 보고된 아세토젠 미생물 중 고농도 일산화탄소 조건(CO 함량 60% 이상)에서 전 세계에서 가장 빠른 속도다.
연구팀은 위의 돌연변이 미생물의 유전체 서열분석을 통해 아세틸 조효소 A 합성 단백질(acetyl-CoA synthase)을 암호화하는 유전자(acsB) 내 돌연변이가 발생한 것을 규명하고, 인공지능 기반의 구조예측을 통해 이러한 변이가 일산화탄소 내성 및 고정률 향상을 유도했음을 밝혔다.
연구팀은 일산화탄소에 대한 내성이 향상된 ECO2 돌연변이 미생물에 2,3-부탄다이올(2,3-butanediol, 2,3-BDO)* 생합성 경로를 도입해 C1 가스를 C4 화학물질로 전환할 수 있는 미생물 기반 생체촉매 시스템을 개발했다. ECO2 기반의 생체촉매가 가스 발효과정을 통해 야생형 미생물 대비 약 6.5배 정도의 높은 2,3-BDO 생산성을 보여줌으로써, C1 가스를 효율적으로 C4 화학연료로 전환하는데 성공했다.
*2,3-부탄다이올(2,3-butanediol, 2,3-BDO): 농업용 자재, 식품첨가제, 의약품 첨가제, 고분자 첨가제 등 활용 범위가 광범위한 바이오케미칼
연구를 주도한 조병관 교수는 “산업공정 과정에서 발생하는 C1 가스는 일산화탄소, 이산화탄소 등의 혼합가스로, 이를 직접적으로 미생물이 이용하기 위해서는 일산화탄소에 대한 내성 및 전환율 향상이 필수적이다”라고 설명했으며, “다양한 합성생물학 기술들 활용하면 아세토젠 미생물 생체촉매의 활용도를 더욱 개선할 수 있으며, 이러한 고효율 C1 가스 전환 생체촉매 연구는 C1 가스 바이오 리파이너리의 핵심 원천기술로 다양한 산업현장에 적용할 수 있을 것”라고 밝혔다.
생명과학과 진상락(석박사통합과정), 강슬기(박사과정) 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘화학 공학 저널(Chemical Engineering Journal, 영향력지수 14.66)’에 6월 22일 字 온라인판에 게재됐다. (논문명: Development of CO gas conversion system using high CO tolerance biocatalyst)
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업단의 지원을 받아 수행됐다.
2022.07.15
조회수 10591
-
 질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14
조회수 14349
-
 기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08
조회수 9448
-
 RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30
조회수 10012
-
 유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14
조회수 12211
-
 빛에 담긴 비대칭성을 증폭하는 카이랄 초분자 형성원리 규명
우리 대학 화학과 서명은 교수를 주축으로 한 연구팀이 분자 자기조립 시스템에 대한 연구를 통해 빛으로부터 *초분자 나선 방향이 결정되는 원리를 규명했다고 16일 밝혔다.
☞초분자(supermolecule): 분자 간 결합 또는 인력을 통해 둘 또는 그 이상의 작은 분자들이 모여 생성된 거대한 분자들의 집합을 말한다. 효소 등 기능성 생체 분자들도 초분자로 볼 수 있다.
단백질을 이루는 아미노산 분자는 오른손과 왼손처럼 모양은 같지만 서로 겹칠 수 없는 거울상이 존재할 수 있다. 그러나 지구상에서 탄생한 생명은 한 종류의 거울상 아미노산만을 선택해 단일한 *카이랄성을 띠게끔 진화했다. 아미노산에 담긴 카이랄 정보가 단백질로 전달되면 한쪽으로 꼬인 나선과 같이 분자를 넘어선 초분자 수준에서 증폭돼 나타나며, 이는 단일 카이랄성이 만들어지는 데 중요했을 것으로 여겨진다. 즉, 어떻게 카이랄성이 탄생하고 증폭됐는지는 자연이 단일 카이랄성을 지니게 된 이유와 연관 지을 수 있어, 생명의 기원과 깊게 관련된 문제다.
☞ 카이랄(Chiral): 수학, 화학, 물리학, 생물학 등 다양한 과학 분야에서 비대칭성을 가리키는 용어중 하나다. 이는 어떤 대상의 모양이 거울에 비춘 모양과 일치되지 않을 때 카이랄 성이 존재한다고 일컫는다. (Ex) 오른손 & 왼손)
태초에 같은 양씩 존재했을 거울상 분자 한 쌍 중에 한쪽의 비율이 높아질 수 있는 원인으로 시계 방향 혹은 반대로 회전하면서 나아가는 빛인 원편광이 흔히 거론되는데, 거울상 분자가 원편광을 흡수하는 정도가 서로 다르기 때문이다. 자연적으로 지구에 내리쬐는 원편광은 그 회전 방향이 무작위할 것이므로 분자와 원편광에 담긴 카이랄 정보가 서로 경쟁하는 가운데 어느 순간 한쪽 거울상이 과잉되면서 단일한 카이랄성이 출현했을 것으로 추론할 수 있으나, 분자와 원편광으로부터 카이랄 정보가 동시에 전달될 때 어떤 현상이 일어나는지는 거의 연구된 바 없었다.
우리 대학 서명은 교수 연구팀은 빛에 반응해 자기조립되는 프로펠러 모양의 분자를 찾고, 분자와 빛에 담긴 카이랄 정보가 전달돼 초분자 나선으로 나타날 때 각각 얼마나 효과적인지 연구했다. 먼저 원편광의 회전 방향과 분자 프로펠러 방향이 맞을 때 광화학 반응이 우세하게 일어나고, 이는 자기조립을 유도해 정해진 나선 방향으로 성장함을 밝혔다.
나아가 한쪽 거울상 분자가 과잉된 조건에서 원편광을 쬐어 나선 방향이 어느 쪽을 따라가는지 살핀 결과, 양자의 정보가 일치할 때 초분자 카이랄성이 증폭되고 반대일 때 상쇄되며, 심지어 빛으로 분자 카이랄 정보를 눌러 나선 방향을 반전할 수 있음을 정량적으로 보였다. 또한 일정 비율 이상의 거울상 분자가 축적되면 빛과 관계없이 단일한 나선 방향이 유지되는 것 역시 확인했다.
원편광을 선택적으로 걸러내는 소재는 현재 OLED, 3D 안경 등 디스플레이에 널리 쓰이고 있고, 원편광을 내는 재료 등은 차세대 디스플레이용 소재로 떠오르고 있다. 초분자 나선 구조는 개개의 분자에 비해 원편광을 훨씬 효과적으로 흡수하고 방출할 수 있다. 따라서 초분자 나선 구조를 한번 더 조립하여 분자-초분자-거시적 스케일에서 모두 카이랄성을 띠는 멀티스케일 카이랄 구조체를 구현한다면 카이랄성을 극도로 증폭할 수 있는 소재를 만들 수 있을 것으로 기대된다. 또한 약물로 쓰이는 화합물은 탈리도마이드처럼 반대 거울상 분자가 기형을 유발하는 등의 부작용을 일으킬 수 있는 만큼, 한쪽 카이랄성만을 가지게끔 합성하는 것이 필수적이다. 멀티스케일 카이랄 구조체는 이러한 비대칭 합성에서도 강력한 카이랄 환경을 제공하여 입체 선택성이 높은 촉매를 제조하거나, 거울상 분자를 효과적으로 검출할 수 있는 센서를 만드는 플랫폼이 될 수 있다.
연구진은 "이번 연구를 통해 빛에 담긴 비대칭성이 어떻게 분자 및 초분자 수준으로 전달되고 증폭될 수 있는지를 이해할 수 있었을 뿐 아니라, 분자에 담긴 정보와 별개로 초분자 카이랄성을 제어할 수 있는 가능성을 보였다는 데 큰 의의가 있다ˮ며, "이번 연구를 발판으로 카이랄 광학 소재, 비대칭 촉매 등 미래 먹거리가 될 수 있는 멀티스케일 카이랄 신소재 개발로 연구를 확장하겠다ˮ고 소감을 밝혔다.
우리 대학 화학과 강준수 석박사통합과정 학생이 제1 저자로 연구를 주도하고, 화학과 김우연 교수, 임미희 교수, 윤동기 교수 연구팀이 협업한 이번 연구 결과는 미국화학회가 발행하는 국제 학술지 `미국화학회지(Journal of the American Chemical Society)'에 2월 4일 字로 온라인 게재됐다. (논문명 : Circularly Polarized Light Can Override and Amplify Asymmetry in Supramolecular Helices)
이번 연구는 한국연구재단(NRF)에서 선정한 선도연구센터인 카이스트 화학과 멀티스케일 카이랄 구조체 연구센터의 지원을 받아 주로 진행됐다.
빛에 담긴 비대칭성을 증폭하는 카이랄 초분자 형성원리 규명
우리 대학 화학과 서명은 교수를 주축으로 한 연구팀이 분자 자기조립 시스템에 대한 연구를 통해 빛으로부터 *초분자 나선 방향이 결정되는 원리를 규명했다고 16일 밝혔다.
☞초분자(supermolecule): 분자 간 결합 또는 인력을 통해 둘 또는 그 이상의 작은 분자들이 모여 생성된 거대한 분자들의 집합을 말한다. 효소 등 기능성 생체 분자들도 초분자로 볼 수 있다.
단백질을 이루는 아미노산 분자는 오른손과 왼손처럼 모양은 같지만 서로 겹칠 수 없는 거울상이 존재할 수 있다. 그러나 지구상에서 탄생한 생명은 한 종류의 거울상 아미노산만을 선택해 단일한 *카이랄성을 띠게끔 진화했다. 아미노산에 담긴 카이랄 정보가 단백질로 전달되면 한쪽으로 꼬인 나선과 같이 분자를 넘어선 초분자 수준에서 증폭돼 나타나며, 이는 단일 카이랄성이 만들어지는 데 중요했을 것으로 여겨진다. 즉, 어떻게 카이랄성이 탄생하고 증폭됐는지는 자연이 단일 카이랄성을 지니게 된 이유와 연관 지을 수 있어, 생명의 기원과 깊게 관련된 문제다.
☞ 카이랄(Chiral): 수학, 화학, 물리학, 생물학 등 다양한 과학 분야에서 비대칭성을 가리키는 용어중 하나다. 이는 어떤 대상의 모양이 거울에 비춘 모양과 일치되지 않을 때 카이랄 성이 존재한다고 일컫는다. (Ex) 오른손 & 왼손)
태초에 같은 양씩 존재했을 거울상 분자 한 쌍 중에 한쪽의 비율이 높아질 수 있는 원인으로 시계 방향 혹은 반대로 회전하면서 나아가는 빛인 원편광이 흔히 거론되는데, 거울상 분자가 원편광을 흡수하는 정도가 서로 다르기 때문이다. 자연적으로 지구에 내리쬐는 원편광은 그 회전 방향이 무작위할 것이므로 분자와 원편광에 담긴 카이랄 정보가 서로 경쟁하는 가운데 어느 순간 한쪽 거울상이 과잉되면서 단일한 카이랄성이 출현했을 것으로 추론할 수 있으나, 분자와 원편광으로부터 카이랄 정보가 동시에 전달될 때 어떤 현상이 일어나는지는 거의 연구된 바 없었다.
우리 대학 서명은 교수 연구팀은 빛에 반응해 자기조립되는 프로펠러 모양의 분자를 찾고, 분자와 빛에 담긴 카이랄 정보가 전달돼 초분자 나선으로 나타날 때 각각 얼마나 효과적인지 연구했다. 먼저 원편광의 회전 방향과 분자 프로펠러 방향이 맞을 때 광화학 반응이 우세하게 일어나고, 이는 자기조립을 유도해 정해진 나선 방향으로 성장함을 밝혔다.
나아가 한쪽 거울상 분자가 과잉된 조건에서 원편광을 쬐어 나선 방향이 어느 쪽을 따라가는지 살핀 결과, 양자의 정보가 일치할 때 초분자 카이랄성이 증폭되고 반대일 때 상쇄되며, 심지어 빛으로 분자 카이랄 정보를 눌러 나선 방향을 반전할 수 있음을 정량적으로 보였다. 또한 일정 비율 이상의 거울상 분자가 축적되면 빛과 관계없이 단일한 나선 방향이 유지되는 것 역시 확인했다.
원편광을 선택적으로 걸러내는 소재는 현재 OLED, 3D 안경 등 디스플레이에 널리 쓰이고 있고, 원편광을 내는 재료 등은 차세대 디스플레이용 소재로 떠오르고 있다. 초분자 나선 구조는 개개의 분자에 비해 원편광을 훨씬 효과적으로 흡수하고 방출할 수 있다. 따라서 초분자 나선 구조를 한번 더 조립하여 분자-초분자-거시적 스케일에서 모두 카이랄성을 띠는 멀티스케일 카이랄 구조체를 구현한다면 카이랄성을 극도로 증폭할 수 있는 소재를 만들 수 있을 것으로 기대된다. 또한 약물로 쓰이는 화합물은 탈리도마이드처럼 반대 거울상 분자가 기형을 유발하는 등의 부작용을 일으킬 수 있는 만큼, 한쪽 카이랄성만을 가지게끔 합성하는 것이 필수적이다. 멀티스케일 카이랄 구조체는 이러한 비대칭 합성에서도 강력한 카이랄 환경을 제공하여 입체 선택성이 높은 촉매를 제조하거나, 거울상 분자를 효과적으로 검출할 수 있는 센서를 만드는 플랫폼이 될 수 있다.
연구진은 "이번 연구를 통해 빛에 담긴 비대칭성이 어떻게 분자 및 초분자 수준으로 전달되고 증폭될 수 있는지를 이해할 수 있었을 뿐 아니라, 분자에 담긴 정보와 별개로 초분자 카이랄성을 제어할 수 있는 가능성을 보였다는 데 큰 의의가 있다ˮ며, "이번 연구를 발판으로 카이랄 광학 소재, 비대칭 촉매 등 미래 먹거리가 될 수 있는 멀티스케일 카이랄 신소재 개발로 연구를 확장하겠다ˮ고 소감을 밝혔다.
우리 대학 화학과 강준수 석박사통합과정 학생이 제1 저자로 연구를 주도하고, 화학과 김우연 교수, 임미희 교수, 윤동기 교수 연구팀이 협업한 이번 연구 결과는 미국화학회가 발행하는 국제 학술지 `미국화학회지(Journal of the American Chemical Society)'에 2월 4일 字로 온라인 게재됐다. (논문명 : Circularly Polarized Light Can Override and Amplify Asymmetry in Supramolecular Helices)
이번 연구는 한국연구재단(NRF)에서 선정한 선도연구센터인 카이스트 화학과 멀티스케일 카이랄 구조체 연구센터의 지원을 받아 주로 진행됐다.
2022.02.16
조회수 13445
 상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
2022.10.24 조회수 9506
상상만으로 원하는 방향으로 사용가능한 로봇 팔 뇌-기계 인터페이스 개발
우리 대학 뇌인지과학과 정재승 교수 연구팀이 인간의 뇌 신호를 해독해 장기간의 훈련 없이 생각만으로 로봇 팔을 원하는 방향으로 제어하는 뇌-기계 인터페이스 시스템을 개발했다고 24일 밝혔다.
서울의대 신경외과 정천기 교수 연구팀과 공동연구로 진행된 이번 연구에서 정 교수 연구팀은 뇌전증 환자를 대상으로 팔을 뻗는 동작을 상상할 때 관측되는 대뇌 피질 신호를 분석해 환자가 의도한 팔 움직임을 예측하는 팔 동작 방향 상상 뇌 신호 디코딩 기술을 개발했다. 이러한 디코딩 기술은 실제 움직임이나 복잡한 운동 상상이 필요하지 않기 때문에 운동장애를 겪는 환자가 장기간 훈련 없이도 자연스럽고 쉽게 로봇 팔을 제어할 수 있어 앞으로 다양한 의료기기에 폭넓게 적용되리라 기대된다.
바이오및뇌공학과 장상진 박사과정이 제1 저자로 참여한 이번 연구는 뇌공학 분야의 세계적인 국제 학술지 `저널 오브 뉴럴 엔지니어링 (Journal of Neural Engineering)' 9월 19권 5호에 출판됐다. (논문명 : Decoding trajectories of imagined hand movement using electrocorticograms for brain-machine interface).
뇌-기계 인터페이스는 인간이 생각만으로 기계를 제어할 수 있는 기술로, 팔을 움직이는 데 장애가 있거나 절단된 환자가 로봇 팔을 제어해 일상에 필요한 팔 동작을 회복할 수 있는 보조기술로 크게 주목받고 있다.
로봇 팔 제어를 위한 뇌-기계 인터페이스를 구현하기 위해서는 인간이 팔을 움직일 때 뇌에서 발생하는 전기신호를 측정하고 기계학습 등 다양한 인공지능 분석기법으로 뇌 신호를 해독해 의도한 움직임을 뇌 신호로부터 예측할 수 있는 디코딩 기술이 필요하다.
그러나 상지 절단 등으로 운동장애를 겪는 환자는 팔을 실제로 움직이기 어려우므로, 상상만으로 로봇 팔의 방향을 지시할 수 있는 인터페이스가 절실히 요구된다. 뇌 신호 디코딩 기술은 팔의 실제 움직임이 아닌 상상 뇌 신호에서 어느 방향으로 사용자가 상상했는지 예측할 수 있어야 하는데, 상상 뇌 신호는 실제 움직임 뇌 신호보다 신호대잡음비(signal to noise ratio)가 현저히 낮아 팔의 정확한 방향을 예측하기 어려운 문제점이 오랫동안 난제였다. 이러한 문제점을 극복하고자 기존 연구들에서는 팔을 움직이기 위해 신호대잡음비가 더 높은 다른 신체 동작을 상상하는 방법을 시도했으나, 의도하고자 하는 팔 뻗기와 인지적 동작 간의 부자연스러운 괴리로 인해 사용자가 장기간 훈련해야 하는 불편함을 초래했다.
따라서 팔을 뻗는 상상을 할 때 어느 방향으로 뻗었는지 예측하는 디코딩 기술은 정확도가 떨어지고 환자가 사용법을 습득하기 어려운 문제점이 있다. 이 문제가 오랫동안 뇌-기계 인터페이스 분야에서 해결해야 할 난제였다.
연구팀은 문제 해결을 위해 사용자의 자연스러운 팔 동작 상상을 공간해상도가 우수한 대뇌 피질 신호(electrocorticogram)로 측정하고, 변분 베이지안 최소제곱(variational Bayesian least square) 기계학습 기법을 활용해 직접 측정이 어려운 팔 동작의 방향 정보를 계산할 수 있는 디코딩 기술을 처음으로 개발했다.
연구팀의 팔 동작 상상 신호 분석기술은 운동피질을 비롯한 특정 대뇌 영역에 국한되지 않아, 사용자마다 상이할 수 있는 상상 신호와 대뇌 영역 특성을 맞춤형으로 학습해 최적의 계산모델 파라미터 결괏값을 출력할 수 있다.
연구팀은 대뇌 피질 신호 디코딩을 통해 환자가 상상한 팔 뻗기 방향을 최대 80% 이상의 정확도로 예측할 수 있음을 확인했다.
나아가 계산모델을 분석함으로써 방향 상상에 중요한 대뇌의 시공간적 특성을 밝혔고, 상상하는 인지적 과정이 팔을 실제로 뻗는 과정에 근접할수록 방향 예측정확도가 상당히 더 높아질 수 있음을 연구팀은 확인했다.
연구팀은 지난 2월 인공지능과 유전자 알고리즘 기반 고 정확도 로봇 팔 제어 뇌-기계 인터페이스 선행 연구 결과를 세계적인 학술지 `어플라이드 소프트 컴퓨팅(Applied soft computing)'에 발표한 바 있다. 이번 후속 연구는 그에 기반해 계산 알고리즘 간소화, 로봇 팔 구동 테스트, 환자의 상상 전략 개선 등 실전에 근접한 사용환경을 조성해 실제로 로봇 팔을 구동하고 의도한 방향으로 로봇 팔이 이동하는지 테스트를 진행했고, 네 가지 방향에 대한 의도를 읽어 정확하게 목표물에 도달하는 시연에 성공했다.
연구팀이 개발한 팔 동작 방향 상상 뇌 신호 분석기술은 향후 사지마비 환자를 비롯한 운동장애를 겪는 환자를 대상으로 로봇 팔을 제어할 수 있는 뇌-기계 인터페이스 정확도 향상, 효율성 개선 등에 이바지할 수 있을 것으로 기대된다.
연구책임자 정재승 교수는 "장애인마다 상이한 뇌 신호를 맞춤형으로 분석해 장기간 훈련을 받지 않더라도 로봇 팔을 제어할 수 있는 기술은 혁신적인 결과이며, 이번 기술은 향후 의수를 대신할 로봇팔을 상용화하는 데에도 크게 기여할 것으로 기대된다ˮ고 말했다.
2022.10.24 조회수 9506 카이캐치(KaiCatch), 악성 동영상 위변조 탐지 기술 개발
우리 대학 전산학부 이흥규 명예교수 연구팀이 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 악성 위변조에 활용되는 프레임 업 변환, 보간법에 의해 생성된 프레임, 영상내 위변조 영역 등을 탐지하는 동영상 위변조 탐지 기술을 개발했다.
위변조 분야 최상위 저명 논문지인 Forensic Science International 11월호에 논문으로도 발표했다.
CCTV의 대량 보급과 함께 동영상은 수많은 분쟁시 주요 증거물로 사용되고 있다. 그러나 동영상에 대한 편집 도구 기술과 인공지능 기술 발전과 함께 동영상의 편집, 프레임 삭제 및 추가 등의 위변조를 포함하여 프레임 업 변환 이라는 기술을 사용하여 위변조 동영상을 고품질 영상으로 변환함으로써 위변조 동영상을 원본과 유사하게 변환함으로써 위변조 탐지를 더욱 어렵게 하는 악성 변조 기술 등도 등장하고 있다.
이번 연구에서는 동영상내 특정 영역들의 편집 변조를 포함하여 프레임 추가, 삭제, 프레임률 변환 탐지를 포함하여 공간정보와 시간정보를 연속적으로 활용하는 프레임-업 변환을 탐지하기 위해 프레임-업 특징들을 추출하는 4개 유형의 네트워크블럭들과 보팅(voting) 기능을 채택한 프레임-업 탐지 뉴럴 네트워크를 제시하였다.
개발된 기술은 특히 동영상의 극히 작은 영역들의 정보를 사용하여 무결성 여부를 판독하기 때문에 동영상 위변조 탐지를 고속으로 수행할 수 있어 기존 기술들과 비교하여 기술의 유용성과 실용성이 매우 뛰어나다.
이번 연구는 KAIST 윤민석 박사, ㈜네이버웹튠AI의 남승훈 박사 등이 참여하였으며 KAIST에서 위변조를 잡아낸다는 의미인 카이캐치(KaiCatch) 위변조 탐지 소프트웨어 기능을 동영상으로도 크게 확장 했다는 점에서 그 의미가 있다.
개발된 기술은 영상 위변조 분야 최상위 저명 논문지인 Forensic Science International 2022년 11월호(Vol 340)에 ‘Frame-rate Up-conversion Detection based on Convolutional Neural Network for Learning Spatiotemporal Features’ 논문으로 발표 되었다. 본 연구는 한국연구재단 창의도전연구기반지원사업과 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 수행하였다.
2022.10.20 조회수 10022
카이캐치(KaiCatch), 악성 동영상 위변조 탐지 기술 개발
우리 대학 전산학부 이흥규 명예교수 연구팀이 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 악성 위변조에 활용되는 프레임 업 변환, 보간법에 의해 생성된 프레임, 영상내 위변조 영역 등을 탐지하는 동영상 위변조 탐지 기술을 개발했다.
위변조 분야 최상위 저명 논문지인 Forensic Science International 11월호에 논문으로도 발표했다.
CCTV의 대량 보급과 함께 동영상은 수많은 분쟁시 주요 증거물로 사용되고 있다. 그러나 동영상에 대한 편집 도구 기술과 인공지능 기술 발전과 함께 동영상의 편집, 프레임 삭제 및 추가 등의 위변조를 포함하여 프레임 업 변환 이라는 기술을 사용하여 위변조 동영상을 고품질 영상으로 변환함으로써 위변조 동영상을 원본과 유사하게 변환함으로써 위변조 탐지를 더욱 어렵게 하는 악성 변조 기술 등도 등장하고 있다.
이번 연구에서는 동영상내 특정 영역들의 편집 변조를 포함하여 프레임 추가, 삭제, 프레임률 변환 탐지를 포함하여 공간정보와 시간정보를 연속적으로 활용하는 프레임-업 변환을 탐지하기 위해 프레임-업 특징들을 추출하는 4개 유형의 네트워크블럭들과 보팅(voting) 기능을 채택한 프레임-업 탐지 뉴럴 네트워크를 제시하였다.
개발된 기술은 특히 동영상의 극히 작은 영역들의 정보를 사용하여 무결성 여부를 판독하기 때문에 동영상 위변조 탐지를 고속으로 수행할 수 있어 기존 기술들과 비교하여 기술의 유용성과 실용성이 매우 뛰어나다.
이번 연구는 KAIST 윤민석 박사, ㈜네이버웹튠AI의 남승훈 박사 등이 참여하였으며 KAIST에서 위변조를 잡아낸다는 의미인 카이캐치(KaiCatch) 위변조 탐지 소프트웨어 기능을 동영상으로도 크게 확장 했다는 점에서 그 의미가 있다.
개발된 기술은 영상 위변조 분야 최상위 저명 논문지인 Forensic Science International 2022년 11월호(Vol 340)에 ‘Frame-rate Up-conversion Detection based on Convolutional Neural Network for Learning Spatiotemporal Features’ 논문으로 발표 되었다. 본 연구는 한국연구재단 창의도전연구기반지원사업과 KAIST 창업기업인 ㈜디지탈이노텍의 후원으로 수행하였다.
2022.10.20 조회수 10022 RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
2022.09.07 조회수 11879
RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
2022.09.07 조회수 11879 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 8015
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 8015 RNA 활용해 퇴행성 관절염 획기적 조기진단 가능성 열어
우리 대학 생명화학공학과 김유식 교수와 분당서울대병원 류마티스내과 이윤종 교수 공동 연구팀이 골관절염(Osteoarthritis)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
골관절염은 뼈의 관절면을 감싸고 있는 관절 연골이 마모돼 연골 밑의 뼈가 노출되고, 관절 주변 활액막에 염증이 생겨서 통증과 변형이 발생하는 질환이다. 흔히 퇴행성 관절염이라고도 불리며, 관절 질환 중에서 가장 많이 발생하는 질환이다.
연구팀은 골관절염의 발병 과정 중 손상된 연골에서 염증을 일으켜 세포사멸을 촉진하는 물질이 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)라는 것을 밝혔다.
이번 연구는 골관절염에서 발견되는 다양한 증상들의 원인을 mt-dsRNA라는 개념을 통해 하나로 통합함으로써 골관절염 진단 및 치료에 획기적인 방안을 제시할 것으로 기대된다.
생명화학공학과 박사과정에 재학 중인 김수진 학생과 이건용 학생이 공동 제1 저자로 참여한 이번 연구는 국제학술지 `셀 리포트(Cell Reports)' 지난 8월 9일 字에 게재됐다. (논문명 : Mitochondrial double-stranded RNAs govern the stress response in chondrocytes to promote osteoarthritis development)
골관절염은 우리나라 70세 이상의 여성 인구에서 약 50%의 유병률을 보이는 매우 흔한 질환이다. 골관절염은 일반적으로 노화와 함께 진행되기 때문에 초기에 이들을 구분하는 데 한계가 있다. 골관절염의 진행을 늦추기 위해 증상의 심각성에 따라 약물을 활용한 보존적 치료 혹은 수술을 비롯한 다양한 시도를 활발히 하고 있지만, 기존 접근방법으로 골관절염이 완치될 것이라는 기대를 하기는 어려운 상황이다. 연구팀은 질병의 발병 및 진행 메커니즘을 분석함으로써 골관절염의 조기진단과 완치에 한 걸음 다가갈 수 있는 완전히 새로운 표적 물질을 찾고자 했다.
이중나선 RNA(dsRNA)는 비정상적인 면역반응을 유발해 세포사멸 및 염증반응을 촉진한다고 알려져 있다. dsRNA의 과발현은 다양한 퇴행성 질환과 밀접한 관련이 있어 dsRNA의 조절은 건강한 세포를 유지하기 위해 필수적이다. 세포에서 dsRNA를 생성하는 대표적인 기관은 세포에 에너지를 제공한다고 알려진 미토콘드리아다. 미토콘드리아는 자체 생산하는 dsRNA를 세포질로부터 분리해 dsRNA의 노출과 이에 따른 면역반응을 막는다. 하지만 자극 혹은 세포 스트레스에 의해 mt-dsRNA가 세포질에 노출되면 RNA가 면역반응 단백질에 의해 인지돼 비정상적인 면역반응을 일으킬 수 있다.
연구팀은 골관절염에서 미토콘드리아의 손상과 원인을 알 수 없는 면역반응 단백질의 활성화가 관찰된다는 점에 착안해 mt-dsRNA가 골관절염 발병에서 중요한 기능을 할 것이라는 가설을 세웠다.
연구팀은 연골세포에서 구축한 골관절염 모사 환경에서 mt-dsRNA가 미토콘드리아 외부로 노출돼 선천성 면역반응 단백질에 의해 인지됨에 따라 면역반응을 일으킨다는 것을 확인했다. 또한 골관절염 환자들의 무릎 활막액 및 연골 조직과 골관절염 생쥐 모델의 연골에서도 mt-dsRNA가 유의미하게 증가해 있는 것을 확인했다.
특히, 다른 관절 질환인 류마티스 관절염과 통풍 환자들의 활막액과 비교했을 때 골관절염 환자들의 활막액에서 더 많은 양의 mt-dsRNA가 검출됐다. 또한 초기 골관절염을 앓고 있는 환자들의 연골에서 mt-dsRNA가 많이 증가했다. 따라서 연구팀은 골관절염을 특이적으로 조기진단 할 수 있는 바이오마커로서 mt-dsRNA의 가능성을 제시했다.
더 나아가 연구팀은 골관절염의 전도유망한 치료법 중 하나인 자가포식(Autophagy)의 치료 메커니즘에서 mt-dsRNA의 역할을 규명했다. 연구팀은 자가포식이 세포질에서 mt-dsRNA를 제거함으로써 골관절염의 증상을 완화할 수 있다는 사실을 밝힘으로써 골관절염 치료를 위한 신개념의 표적 물질로서 mt-dsRNA을 제시했다.
생명화학공학과 김유식 교수는 "이번 연구는 세포 수준의 골관절염 모사 환경에서 mt-dsRNA의 기능 규명을 넘어서 실제 골관절염 생쥐 모델의 연골 및 환자의 인체유래물에서 mt-dsRNA의 특이적인 발현 증가를 검증했다ˮ면서 "골관절염처럼 미토콘드리아 손상이 관찰되는 알츠하이머를 비롯한 퇴행성 질환의 발병 메커니즘 분석에 mt-dsRNA를 활용한다면 효과적인 치료전략을 마련하는데 유용할 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 박사과정생 연구장려금 지원사업의 지원을 받아 수행했다.
2022.08.31 조회수 7714
RNA 활용해 퇴행성 관절염 획기적 조기진단 가능성 열어
우리 대학 생명화학공학과 김유식 교수와 분당서울대병원 류마티스내과 이윤종 교수 공동 연구팀이 골관절염(Osteoarthritis)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
골관절염은 뼈의 관절면을 감싸고 있는 관절 연골이 마모돼 연골 밑의 뼈가 노출되고, 관절 주변 활액막에 염증이 생겨서 통증과 변형이 발생하는 질환이다. 흔히 퇴행성 관절염이라고도 불리며, 관절 질환 중에서 가장 많이 발생하는 질환이다.
연구팀은 골관절염의 발병 과정 중 손상된 연골에서 염증을 일으켜 세포사멸을 촉진하는 물질이 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)라는 것을 밝혔다.
이번 연구는 골관절염에서 발견되는 다양한 증상들의 원인을 mt-dsRNA라는 개념을 통해 하나로 통합함으로써 골관절염 진단 및 치료에 획기적인 방안을 제시할 것으로 기대된다.
생명화학공학과 박사과정에 재학 중인 김수진 학생과 이건용 학생이 공동 제1 저자로 참여한 이번 연구는 국제학술지 `셀 리포트(Cell Reports)' 지난 8월 9일 字에 게재됐다. (논문명 : Mitochondrial double-stranded RNAs govern the stress response in chondrocytes to promote osteoarthritis development)
골관절염은 우리나라 70세 이상의 여성 인구에서 약 50%의 유병률을 보이는 매우 흔한 질환이다. 골관절염은 일반적으로 노화와 함께 진행되기 때문에 초기에 이들을 구분하는 데 한계가 있다. 골관절염의 진행을 늦추기 위해 증상의 심각성에 따라 약물을 활용한 보존적 치료 혹은 수술을 비롯한 다양한 시도를 활발히 하고 있지만, 기존 접근방법으로 골관절염이 완치될 것이라는 기대를 하기는 어려운 상황이다. 연구팀은 질병의 발병 및 진행 메커니즘을 분석함으로써 골관절염의 조기진단과 완치에 한 걸음 다가갈 수 있는 완전히 새로운 표적 물질을 찾고자 했다.
이중나선 RNA(dsRNA)는 비정상적인 면역반응을 유발해 세포사멸 및 염증반응을 촉진한다고 알려져 있다. dsRNA의 과발현은 다양한 퇴행성 질환과 밀접한 관련이 있어 dsRNA의 조절은 건강한 세포를 유지하기 위해 필수적이다. 세포에서 dsRNA를 생성하는 대표적인 기관은 세포에 에너지를 제공한다고 알려진 미토콘드리아다. 미토콘드리아는 자체 생산하는 dsRNA를 세포질로부터 분리해 dsRNA의 노출과 이에 따른 면역반응을 막는다. 하지만 자극 혹은 세포 스트레스에 의해 mt-dsRNA가 세포질에 노출되면 RNA가 면역반응 단백질에 의해 인지돼 비정상적인 면역반응을 일으킬 수 있다.
연구팀은 골관절염에서 미토콘드리아의 손상과 원인을 알 수 없는 면역반응 단백질의 활성화가 관찰된다는 점에 착안해 mt-dsRNA가 골관절염 발병에서 중요한 기능을 할 것이라는 가설을 세웠다.
연구팀은 연골세포에서 구축한 골관절염 모사 환경에서 mt-dsRNA가 미토콘드리아 외부로 노출돼 선천성 면역반응 단백질에 의해 인지됨에 따라 면역반응을 일으킨다는 것을 확인했다. 또한 골관절염 환자들의 무릎 활막액 및 연골 조직과 골관절염 생쥐 모델의 연골에서도 mt-dsRNA가 유의미하게 증가해 있는 것을 확인했다.
특히, 다른 관절 질환인 류마티스 관절염과 통풍 환자들의 활막액과 비교했을 때 골관절염 환자들의 활막액에서 더 많은 양의 mt-dsRNA가 검출됐다. 또한 초기 골관절염을 앓고 있는 환자들의 연골에서 mt-dsRNA가 많이 증가했다. 따라서 연구팀은 골관절염을 특이적으로 조기진단 할 수 있는 바이오마커로서 mt-dsRNA의 가능성을 제시했다.
더 나아가 연구팀은 골관절염의 전도유망한 치료법 중 하나인 자가포식(Autophagy)의 치료 메커니즘에서 mt-dsRNA의 역할을 규명했다. 연구팀은 자가포식이 세포질에서 mt-dsRNA를 제거함으로써 골관절염의 증상을 완화할 수 있다는 사실을 밝힘으로써 골관절염 치료를 위한 신개념의 표적 물질로서 mt-dsRNA을 제시했다.
생명화학공학과 김유식 교수는 "이번 연구는 세포 수준의 골관절염 모사 환경에서 mt-dsRNA의 기능 규명을 넘어서 실제 골관절염 생쥐 모델의 연골 및 환자의 인체유래물에서 mt-dsRNA의 특이적인 발현 증가를 검증했다ˮ면서 "골관절염처럼 미토콘드리아 손상이 관찰되는 알츠하이머를 비롯한 퇴행성 질환의 발병 메커니즘 분석에 mt-dsRNA를 활용한다면 효과적인 치료전략을 마련하는데 유용할 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 박사과정생 연구장려금 지원사업의 지원을 받아 수행했다.
2022.08.31 조회수 7714 암의 조기 진단, 치료방향 결정 등을 위한 표적 마이크로RNA 다중 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수, 신소재공학과 정연식 교수 공동 연구팀이 암 관련 마이크로RNA를 다중 검출할 수 있는 다색 양자점(퀀텀닷) 어레이를 개발했다고 20일 밝혔다.
신소재공학과 남태원 박사와 생명화학공학과 박연경 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회(American Chemical Society)가 발행하는 국제 학술지 `ACS 나노(ACS Nano)'에 2022년도 6월 15일 字 온라인판에 게재됐다. (논문명: Polychromatic quantum dot array to compose a community signal ensemble for multiplexed miRNA detection)
마이크로RNA는 18~25개의 염기서열로 이루어진 짧은 RNA로, 유전자 발현을 조절함으로써 세포 성장 및 분화와 같은 다양한 세포 활동을 제어한다. 마이크로RNA의 비정상적인 발현은 암을 포함한 다양한 질병과 밀접하게 연관돼있어, 여러 가지 질병을 진단하는 차세대 바이오마커로 크게 주목을 받고 있다.
마이크로RNA를 검출하는 가장 일반적인 기존의 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 하지만 이 기술은 역전사 반응을 수반하기 때문에 정량의 정확도가 떨어지고 다중 분석이 제한된다. 다중 핵산 분석에 특화되어 개발된 마이크로 어레이 기술 또한 여전히 역전사 단계를 수반하고 있으며 민감도와 특이도에 있어서 한계가 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 트랜스퍼 프린팅 기법을 활용해 초고해상도의 다색 양자점 어레이(이하 PQDA)를 제작했고 이를 마이크로RNA를 분석하는 기술로 발전시켰다. 그 결과 연구팀은 표적 마이크로RNA를 높은 민감도와 특이도로 다중 검출하는 데 성공하였다.
PQDA는 표적 마이크로RNA에 상보적인 DNA프로브/양자점 복합체가 고정된 고분자 패턴으로, 이중가닥 특이적 뉴클레아제(이하 DSN) 효소에 의해서 표적 마이크로RNA에 특이적인 양자점을 방출하도록 설계됐다. 연구팀은 방출된 양자점들의 형광 신호 앙상블을 기반으로 유방암에 관련된 세 종류의 마이크로RNA를 펨토(10-15) 몰 수준으로 검출하는 데 성공했다. 또한, 혈청과 유방암세포로부터 마이크로RNA를 검출함으로써 기술의 임상 활용도를 입증했다.
PQDA는 각각 독립적인 정량화가 가능한 DNA프로브-양자점 모듈로 이뤄져 있다는 점에서 다중 분석에 적합하다. 특히, PQDA 기반 검출은 역전사 단계 없이 원상태의 마이크로RNA에서 수행하기 때문에 정확한 정량 분석이 가능하고, DSN 효소를 활용해 별도의 증폭 절차 없이 높은 감도를 달성했다. 또한, DSN 효소의 우수한 표적 식별 능력을 이용해 매우 높은 특이도로 표적 마이크로RNA를 검출할 수 있었다.
연구팀 관계자는 "특히 마이크로RNA는 혈액, 타액 및 소변과 같은 체액에도 존재하기 때문에 액체생검(Liquid biopsy)을 위한 핵심 바이오마커로 작용할 수 있다ˮ며 "따라서 이번 기술은 암의 조기 진단, 치료 방향 결정, 치료 효과 모니터링 등을 위한 액체생검 기술로 널리 활용될 수 있을 것으로 기대된다ˮ고 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 기초연구사업, 글로벌프론티어사업, 중견연구자지원사업의 일환으로 수행됐다.
2022.07.20 조회수 9244
암의 조기 진단, 치료방향 결정 등을 위한 표적 마이크로RNA 다중 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수, 신소재공학과 정연식 교수 공동 연구팀이 암 관련 마이크로RNA를 다중 검출할 수 있는 다색 양자점(퀀텀닷) 어레이를 개발했다고 20일 밝혔다.
신소재공학과 남태원 박사와 생명화학공학과 박연경 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회(American Chemical Society)가 발행하는 국제 학술지 `ACS 나노(ACS Nano)'에 2022년도 6월 15일 字 온라인판에 게재됐다. (논문명: Polychromatic quantum dot array to compose a community signal ensemble for multiplexed miRNA detection)
마이크로RNA는 18~25개의 염기서열로 이루어진 짧은 RNA로, 유전자 발현을 조절함으로써 세포 성장 및 분화와 같은 다양한 세포 활동을 제어한다. 마이크로RNA의 비정상적인 발현은 암을 포함한 다양한 질병과 밀접하게 연관돼있어, 여러 가지 질병을 진단하는 차세대 바이오마커로 크게 주목을 받고 있다.
마이크로RNA를 검출하는 가장 일반적인 기존의 방법은 역전사 중합효소 연쇄반응(qRT-PCR)이다. 하지만 이 기술은 역전사 반응을 수반하기 때문에 정량의 정확도가 떨어지고 다중 분석이 제한된다. 다중 핵산 분석에 특화되어 개발된 마이크로 어레이 기술 또한 여전히 역전사 단계를 수반하고 있으며 민감도와 특이도에 있어서 한계가 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 트랜스퍼 프린팅 기법을 활용해 초고해상도의 다색 양자점 어레이(이하 PQDA)를 제작했고 이를 마이크로RNA를 분석하는 기술로 발전시켰다. 그 결과 연구팀은 표적 마이크로RNA를 높은 민감도와 특이도로 다중 검출하는 데 성공하였다.
PQDA는 표적 마이크로RNA에 상보적인 DNA프로브/양자점 복합체가 고정된 고분자 패턴으로, 이중가닥 특이적 뉴클레아제(이하 DSN) 효소에 의해서 표적 마이크로RNA에 특이적인 양자점을 방출하도록 설계됐다. 연구팀은 방출된 양자점들의 형광 신호 앙상블을 기반으로 유방암에 관련된 세 종류의 마이크로RNA를 펨토(10-15) 몰 수준으로 검출하는 데 성공했다. 또한, 혈청과 유방암세포로부터 마이크로RNA를 검출함으로써 기술의 임상 활용도를 입증했다.
PQDA는 각각 독립적인 정량화가 가능한 DNA프로브-양자점 모듈로 이뤄져 있다는 점에서 다중 분석에 적합하다. 특히, PQDA 기반 검출은 역전사 단계 없이 원상태의 마이크로RNA에서 수행하기 때문에 정확한 정량 분석이 가능하고, DSN 효소를 활용해 별도의 증폭 절차 없이 높은 감도를 달성했다. 또한, DSN 효소의 우수한 표적 식별 능력을 이용해 매우 높은 특이도로 표적 마이크로RNA를 검출할 수 있었다.
연구팀 관계자는 "특히 마이크로RNA는 혈액, 타액 및 소변과 같은 체액에도 존재하기 때문에 액체생검(Liquid biopsy)을 위한 핵심 바이오마커로 작용할 수 있다ˮ며 "따라서 이번 기술은 암의 조기 진단, 치료 방향 결정, 치료 효과 모니터링 등을 위한 액체생검 기술로 널리 활용될 수 있을 것으로 기대된다ˮ고 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 기초연구사업, 글로벌프론티어사업, 중견연구자지원사업의 일환으로 수행됐다.
2022.07.20 조회수 9244 대량의 고농도 일산화탄소를 고부가가치 바이오케미칼로 전환하는 기술 개발
우리 대학 생명과학과 조병관 교수 연구팀이 산업 부생가스 등으로 대량 발생하는 고농도의 일산화탄소를 고부가가치 바이오케미칼로 전환할 수 있는 생체촉매 기반 C1 바이오 리파이너리 기술*을 개발했다고 14일 밝혔다.
* 제철 공정과 같은 산업공정에서 발생하는 부생가스, 합성가스는 다량의 일산화탄소, 이산화탄소 등의 탄소 1개로 이루어진 C1 가스로 구성되어 있음. 이러한 C1 가스를 미생물과 같은 생체촉매를 활용하여 다양한 화학물질로 전환하는 공정을 C1 가스 바이오 리파이너리(bio-refinery) 기술이라고 함.
최근 탄소 포집 및 전환과 같은 기술들에 대한 산업계의 요구가 커지는 가운데, 미생물을 활용한 친환경 생체촉매 기술이 크게 성장하고 있다.
조병관 교수 연구팀은 아세토젠 미생물을 생체촉매로 활용한 C1 가스 바이오 리파이너리 기술을 개발했다. 이 미생물들은 혐기성 미생물들로 우드-융달 대사회로라는 매우 독특한 대사회로를 이용하여 C1 가스로부터 아세트산을 만드는 미생물로 알려져 있다.
이러한 아세토젠 미생물을 생체촉매로 활용해 산업 부생가스를 활용하는 기술에는 한 가지 문제가 있는데, 바로 독성가스인 일산화탄소의 농도다. 이 미생물은 60% 이상의 고농도 일산화탄소 조건에서는 생명 활동이 크게 저해를 받기 때문에, 생체촉매로써 사용할 수 없게 된다. 다양한 산업에서 발생하는 C1 가스는 공정 과정에 따라 10~70% 정도의 일산화탄소가 포함돼있는데, 특히 철강산업 공정에서 발생하는 고로가스(BFG)에는 약 60%가 넘는 일산화탄소가 포함돼 있다. 따라서, 미생물 기반 고효율 생체촉매 개발을 위해서는 일산화탄소에 대한 저항성을 높이는 것이 필수적으로 선행돼야 한다.
연구팀은 아세토젠 미생물 중 하나인 유박테리움 리모좀(Eubacterium limosum) 균주를 고농도 일산화탄소 조건에 지속적으로 노출해 일산화탄소에 대한 내성이 뛰어난 돌연변이체(ECO2)를 발굴했는데, 해당 돌연변이체는 일산화탄소가 약 60% 이상 포함된 합성가스 조건에서 야생형 미생물보다 약 6배 정도 빠른 성장 속도를 보였다. 이러한 성장 속도는 현재까지 보고된 아세토젠 미생물 중 고농도 일산화탄소 조건(CO 함량 60% 이상)에서 전 세계에서 가장 빠른 속도다.
연구팀은 위의 돌연변이 미생물의 유전체 서열분석을 통해 아세틸 조효소 A 합성 단백질(acetyl-CoA synthase)을 암호화하는 유전자(acsB) 내 돌연변이가 발생한 것을 규명하고, 인공지능 기반의 구조예측을 통해 이러한 변이가 일산화탄소 내성 및 고정률 향상을 유도했음을 밝혔다.
연구팀은 일산화탄소에 대한 내성이 향상된 ECO2 돌연변이 미생물에 2,3-부탄다이올(2,3-butanediol, 2,3-BDO)* 생합성 경로를 도입해 C1 가스를 C4 화학물질로 전환할 수 있는 미생물 기반 생체촉매 시스템을 개발했다. ECO2 기반의 생체촉매가 가스 발효과정을 통해 야생형 미생물 대비 약 6.5배 정도의 높은 2,3-BDO 생산성을 보여줌으로써, C1 가스를 효율적으로 C4 화학연료로 전환하는데 성공했다.
*2,3-부탄다이올(2,3-butanediol, 2,3-BDO): 농업용 자재, 식품첨가제, 의약품 첨가제, 고분자 첨가제 등 활용 범위가 광범위한 바이오케미칼
연구를 주도한 조병관 교수는 “산업공정 과정에서 발생하는 C1 가스는 일산화탄소, 이산화탄소 등의 혼합가스로, 이를 직접적으로 미생물이 이용하기 위해서는 일산화탄소에 대한 내성 및 전환율 향상이 필수적이다”라고 설명했으며, “다양한 합성생물학 기술들 활용하면 아세토젠 미생물 생체촉매의 활용도를 더욱 개선할 수 있으며, 이러한 고효율 C1 가스 전환 생체촉매 연구는 C1 가스 바이오 리파이너리의 핵심 원천기술로 다양한 산업현장에 적용할 수 있을 것”라고 밝혔다.
생명과학과 진상락(석박사통합과정), 강슬기(박사과정) 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘화학 공학 저널(Chemical Engineering Journal, 영향력지수 14.66)’에 6월 22일 字 온라인판에 게재됐다. (논문명: Development of CO gas conversion system using high CO tolerance biocatalyst)
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업단의 지원을 받아 수행됐다.
2022.07.15 조회수 10591
대량의 고농도 일산화탄소를 고부가가치 바이오케미칼로 전환하는 기술 개발
우리 대학 생명과학과 조병관 교수 연구팀이 산업 부생가스 등으로 대량 발생하는 고농도의 일산화탄소를 고부가가치 바이오케미칼로 전환할 수 있는 생체촉매 기반 C1 바이오 리파이너리 기술*을 개발했다고 14일 밝혔다.
* 제철 공정과 같은 산업공정에서 발생하는 부생가스, 합성가스는 다량의 일산화탄소, 이산화탄소 등의 탄소 1개로 이루어진 C1 가스로 구성되어 있음. 이러한 C1 가스를 미생물과 같은 생체촉매를 활용하여 다양한 화학물질로 전환하는 공정을 C1 가스 바이오 리파이너리(bio-refinery) 기술이라고 함.
최근 탄소 포집 및 전환과 같은 기술들에 대한 산업계의 요구가 커지는 가운데, 미생물을 활용한 친환경 생체촉매 기술이 크게 성장하고 있다.
조병관 교수 연구팀은 아세토젠 미생물을 생체촉매로 활용한 C1 가스 바이오 리파이너리 기술을 개발했다. 이 미생물들은 혐기성 미생물들로 우드-융달 대사회로라는 매우 독특한 대사회로를 이용하여 C1 가스로부터 아세트산을 만드는 미생물로 알려져 있다.
이러한 아세토젠 미생물을 생체촉매로 활용해 산업 부생가스를 활용하는 기술에는 한 가지 문제가 있는데, 바로 독성가스인 일산화탄소의 농도다. 이 미생물은 60% 이상의 고농도 일산화탄소 조건에서는 생명 활동이 크게 저해를 받기 때문에, 생체촉매로써 사용할 수 없게 된다. 다양한 산업에서 발생하는 C1 가스는 공정 과정에 따라 10~70% 정도의 일산화탄소가 포함돼있는데, 특히 철강산업 공정에서 발생하는 고로가스(BFG)에는 약 60%가 넘는 일산화탄소가 포함돼 있다. 따라서, 미생물 기반 고효율 생체촉매 개발을 위해서는 일산화탄소에 대한 저항성을 높이는 것이 필수적으로 선행돼야 한다.
연구팀은 아세토젠 미생물 중 하나인 유박테리움 리모좀(Eubacterium limosum) 균주를 고농도 일산화탄소 조건에 지속적으로 노출해 일산화탄소에 대한 내성이 뛰어난 돌연변이체(ECO2)를 발굴했는데, 해당 돌연변이체는 일산화탄소가 약 60% 이상 포함된 합성가스 조건에서 야생형 미생물보다 약 6배 정도 빠른 성장 속도를 보였다. 이러한 성장 속도는 현재까지 보고된 아세토젠 미생물 중 고농도 일산화탄소 조건(CO 함량 60% 이상)에서 전 세계에서 가장 빠른 속도다.
연구팀은 위의 돌연변이 미생물의 유전체 서열분석을 통해 아세틸 조효소 A 합성 단백질(acetyl-CoA synthase)을 암호화하는 유전자(acsB) 내 돌연변이가 발생한 것을 규명하고, 인공지능 기반의 구조예측을 통해 이러한 변이가 일산화탄소 내성 및 고정률 향상을 유도했음을 밝혔다.
연구팀은 일산화탄소에 대한 내성이 향상된 ECO2 돌연변이 미생물에 2,3-부탄다이올(2,3-butanediol, 2,3-BDO)* 생합성 경로를 도입해 C1 가스를 C4 화학물질로 전환할 수 있는 미생물 기반 생체촉매 시스템을 개발했다. ECO2 기반의 생체촉매가 가스 발효과정을 통해 야생형 미생물 대비 약 6.5배 정도의 높은 2,3-BDO 생산성을 보여줌으로써, C1 가스를 효율적으로 C4 화학연료로 전환하는데 성공했다.
*2,3-부탄다이올(2,3-butanediol, 2,3-BDO): 농업용 자재, 식품첨가제, 의약품 첨가제, 고분자 첨가제 등 활용 범위가 광범위한 바이오케미칼
연구를 주도한 조병관 교수는 “산업공정 과정에서 발생하는 C1 가스는 일산화탄소, 이산화탄소 등의 혼합가스로, 이를 직접적으로 미생물이 이용하기 위해서는 일산화탄소에 대한 내성 및 전환율 향상이 필수적이다”라고 설명했으며, “다양한 합성생물학 기술들 활용하면 아세토젠 미생물 생체촉매의 활용도를 더욱 개선할 수 있으며, 이러한 고효율 C1 가스 전환 생체촉매 연구는 C1 가스 바이오 리파이너리의 핵심 원천기술로 다양한 산업현장에 적용할 수 있을 것”라고 밝혔다.
생명과학과 진상락(석박사통합과정), 강슬기(박사과정) 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘화학 공학 저널(Chemical Engineering Journal, 영향력지수 14.66)’에 6월 22일 字 온라인판에 게재됐다. (논문명: Development of CO gas conversion system using high CO tolerance biocatalyst)
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업단의 지원을 받아 수행됐다.
2022.07.15 조회수 10591 질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 14349
질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 14349 기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08 조회수 9448
기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08 조회수 9448 RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10012
RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10012 유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 12211
유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 12211 빛에 담긴 비대칭성을 증폭하는 카이랄 초분자 형성원리 규명
우리 대학 화학과 서명은 교수를 주축으로 한 연구팀이 분자 자기조립 시스템에 대한 연구를 통해 빛으로부터 *초분자 나선 방향이 결정되는 원리를 규명했다고 16일 밝혔다.
☞초분자(supermolecule): 분자 간 결합 또는 인력을 통해 둘 또는 그 이상의 작은 분자들이 모여 생성된 거대한 분자들의 집합을 말한다. 효소 등 기능성 생체 분자들도 초분자로 볼 수 있다.
단백질을 이루는 아미노산 분자는 오른손과 왼손처럼 모양은 같지만 서로 겹칠 수 없는 거울상이 존재할 수 있다. 그러나 지구상에서 탄생한 생명은 한 종류의 거울상 아미노산만을 선택해 단일한 *카이랄성을 띠게끔 진화했다. 아미노산에 담긴 카이랄 정보가 단백질로 전달되면 한쪽으로 꼬인 나선과 같이 분자를 넘어선 초분자 수준에서 증폭돼 나타나며, 이는 단일 카이랄성이 만들어지는 데 중요했을 것으로 여겨진다. 즉, 어떻게 카이랄성이 탄생하고 증폭됐는지는 자연이 단일 카이랄성을 지니게 된 이유와 연관 지을 수 있어, 생명의 기원과 깊게 관련된 문제다.
☞ 카이랄(Chiral): 수학, 화학, 물리학, 생물학 등 다양한 과학 분야에서 비대칭성을 가리키는 용어중 하나다. 이는 어떤 대상의 모양이 거울에 비춘 모양과 일치되지 않을 때 카이랄 성이 존재한다고 일컫는다. (Ex) 오른손 & 왼손)
태초에 같은 양씩 존재했을 거울상 분자 한 쌍 중에 한쪽의 비율이 높아질 수 있는 원인으로 시계 방향 혹은 반대로 회전하면서 나아가는 빛인 원편광이 흔히 거론되는데, 거울상 분자가 원편광을 흡수하는 정도가 서로 다르기 때문이다. 자연적으로 지구에 내리쬐는 원편광은 그 회전 방향이 무작위할 것이므로 분자와 원편광에 담긴 카이랄 정보가 서로 경쟁하는 가운데 어느 순간 한쪽 거울상이 과잉되면서 단일한 카이랄성이 출현했을 것으로 추론할 수 있으나, 분자와 원편광으로부터 카이랄 정보가 동시에 전달될 때 어떤 현상이 일어나는지는 거의 연구된 바 없었다.
우리 대학 서명은 교수 연구팀은 빛에 반응해 자기조립되는 프로펠러 모양의 분자를 찾고, 분자와 빛에 담긴 카이랄 정보가 전달돼 초분자 나선으로 나타날 때 각각 얼마나 효과적인지 연구했다. 먼저 원편광의 회전 방향과 분자 프로펠러 방향이 맞을 때 광화학 반응이 우세하게 일어나고, 이는 자기조립을 유도해 정해진 나선 방향으로 성장함을 밝혔다.
나아가 한쪽 거울상 분자가 과잉된 조건에서 원편광을 쬐어 나선 방향이 어느 쪽을 따라가는지 살핀 결과, 양자의 정보가 일치할 때 초분자 카이랄성이 증폭되고 반대일 때 상쇄되며, 심지어 빛으로 분자 카이랄 정보를 눌러 나선 방향을 반전할 수 있음을 정량적으로 보였다. 또한 일정 비율 이상의 거울상 분자가 축적되면 빛과 관계없이 단일한 나선 방향이 유지되는 것 역시 확인했다.
원편광을 선택적으로 걸러내는 소재는 현재 OLED, 3D 안경 등 디스플레이에 널리 쓰이고 있고, 원편광을 내는 재료 등은 차세대 디스플레이용 소재로 떠오르고 있다. 초분자 나선 구조는 개개의 분자에 비해 원편광을 훨씬 효과적으로 흡수하고 방출할 수 있다. 따라서 초분자 나선 구조를 한번 더 조립하여 분자-초분자-거시적 스케일에서 모두 카이랄성을 띠는 멀티스케일 카이랄 구조체를 구현한다면 카이랄성을 극도로 증폭할 수 있는 소재를 만들 수 있을 것으로 기대된다. 또한 약물로 쓰이는 화합물은 탈리도마이드처럼 반대 거울상 분자가 기형을 유발하는 등의 부작용을 일으킬 수 있는 만큼, 한쪽 카이랄성만을 가지게끔 합성하는 것이 필수적이다. 멀티스케일 카이랄 구조체는 이러한 비대칭 합성에서도 강력한 카이랄 환경을 제공하여 입체 선택성이 높은 촉매를 제조하거나, 거울상 분자를 효과적으로 검출할 수 있는 센서를 만드는 플랫폼이 될 수 있다.
연구진은 "이번 연구를 통해 빛에 담긴 비대칭성이 어떻게 분자 및 초분자 수준으로 전달되고 증폭될 수 있는지를 이해할 수 있었을 뿐 아니라, 분자에 담긴 정보와 별개로 초분자 카이랄성을 제어할 수 있는 가능성을 보였다는 데 큰 의의가 있다ˮ며, "이번 연구를 발판으로 카이랄 광학 소재, 비대칭 촉매 등 미래 먹거리가 될 수 있는 멀티스케일 카이랄 신소재 개발로 연구를 확장하겠다ˮ고 소감을 밝혔다.
우리 대학 화학과 강준수 석박사통합과정 학생이 제1 저자로 연구를 주도하고, 화학과 김우연 교수, 임미희 교수, 윤동기 교수 연구팀이 협업한 이번 연구 결과는 미국화학회가 발행하는 국제 학술지 `미국화학회지(Journal of the American Chemical Society)'에 2월 4일 字로 온라인 게재됐다. (논문명 : Circularly Polarized Light Can Override and Amplify Asymmetry in Supramolecular Helices)
이번 연구는 한국연구재단(NRF)에서 선정한 선도연구센터인 카이스트 화학과 멀티스케일 카이랄 구조체 연구센터의 지원을 받아 주로 진행됐다.
2022.02.16 조회수 13445
빛에 담긴 비대칭성을 증폭하는 카이랄 초분자 형성원리 규명
우리 대학 화학과 서명은 교수를 주축으로 한 연구팀이 분자 자기조립 시스템에 대한 연구를 통해 빛으로부터 *초분자 나선 방향이 결정되는 원리를 규명했다고 16일 밝혔다.
☞초분자(supermolecule): 분자 간 결합 또는 인력을 통해 둘 또는 그 이상의 작은 분자들이 모여 생성된 거대한 분자들의 집합을 말한다. 효소 등 기능성 생체 분자들도 초분자로 볼 수 있다.
단백질을 이루는 아미노산 분자는 오른손과 왼손처럼 모양은 같지만 서로 겹칠 수 없는 거울상이 존재할 수 있다. 그러나 지구상에서 탄생한 생명은 한 종류의 거울상 아미노산만을 선택해 단일한 *카이랄성을 띠게끔 진화했다. 아미노산에 담긴 카이랄 정보가 단백질로 전달되면 한쪽으로 꼬인 나선과 같이 분자를 넘어선 초분자 수준에서 증폭돼 나타나며, 이는 단일 카이랄성이 만들어지는 데 중요했을 것으로 여겨진다. 즉, 어떻게 카이랄성이 탄생하고 증폭됐는지는 자연이 단일 카이랄성을 지니게 된 이유와 연관 지을 수 있어, 생명의 기원과 깊게 관련된 문제다.
☞ 카이랄(Chiral): 수학, 화학, 물리학, 생물학 등 다양한 과학 분야에서 비대칭성을 가리키는 용어중 하나다. 이는 어떤 대상의 모양이 거울에 비춘 모양과 일치되지 않을 때 카이랄 성이 존재한다고 일컫는다. (Ex) 오른손 & 왼손)
태초에 같은 양씩 존재했을 거울상 분자 한 쌍 중에 한쪽의 비율이 높아질 수 있는 원인으로 시계 방향 혹은 반대로 회전하면서 나아가는 빛인 원편광이 흔히 거론되는데, 거울상 분자가 원편광을 흡수하는 정도가 서로 다르기 때문이다. 자연적으로 지구에 내리쬐는 원편광은 그 회전 방향이 무작위할 것이므로 분자와 원편광에 담긴 카이랄 정보가 서로 경쟁하는 가운데 어느 순간 한쪽 거울상이 과잉되면서 단일한 카이랄성이 출현했을 것으로 추론할 수 있으나, 분자와 원편광으로부터 카이랄 정보가 동시에 전달될 때 어떤 현상이 일어나는지는 거의 연구된 바 없었다.
우리 대학 서명은 교수 연구팀은 빛에 반응해 자기조립되는 프로펠러 모양의 분자를 찾고, 분자와 빛에 담긴 카이랄 정보가 전달돼 초분자 나선으로 나타날 때 각각 얼마나 효과적인지 연구했다. 먼저 원편광의 회전 방향과 분자 프로펠러 방향이 맞을 때 광화학 반응이 우세하게 일어나고, 이는 자기조립을 유도해 정해진 나선 방향으로 성장함을 밝혔다.
나아가 한쪽 거울상 분자가 과잉된 조건에서 원편광을 쬐어 나선 방향이 어느 쪽을 따라가는지 살핀 결과, 양자의 정보가 일치할 때 초분자 카이랄성이 증폭되고 반대일 때 상쇄되며, 심지어 빛으로 분자 카이랄 정보를 눌러 나선 방향을 반전할 수 있음을 정량적으로 보였다. 또한 일정 비율 이상의 거울상 분자가 축적되면 빛과 관계없이 단일한 나선 방향이 유지되는 것 역시 확인했다.
원편광을 선택적으로 걸러내는 소재는 현재 OLED, 3D 안경 등 디스플레이에 널리 쓰이고 있고, 원편광을 내는 재료 등은 차세대 디스플레이용 소재로 떠오르고 있다. 초분자 나선 구조는 개개의 분자에 비해 원편광을 훨씬 효과적으로 흡수하고 방출할 수 있다. 따라서 초분자 나선 구조를 한번 더 조립하여 분자-초분자-거시적 스케일에서 모두 카이랄성을 띠는 멀티스케일 카이랄 구조체를 구현한다면 카이랄성을 극도로 증폭할 수 있는 소재를 만들 수 있을 것으로 기대된다. 또한 약물로 쓰이는 화합물은 탈리도마이드처럼 반대 거울상 분자가 기형을 유발하는 등의 부작용을 일으킬 수 있는 만큼, 한쪽 카이랄성만을 가지게끔 합성하는 것이 필수적이다. 멀티스케일 카이랄 구조체는 이러한 비대칭 합성에서도 강력한 카이랄 환경을 제공하여 입체 선택성이 높은 촉매를 제조하거나, 거울상 분자를 효과적으로 검출할 수 있는 센서를 만드는 플랫폼이 될 수 있다.
연구진은 "이번 연구를 통해 빛에 담긴 비대칭성이 어떻게 분자 및 초분자 수준으로 전달되고 증폭될 수 있는지를 이해할 수 있었을 뿐 아니라, 분자에 담긴 정보와 별개로 초분자 카이랄성을 제어할 수 있는 가능성을 보였다는 데 큰 의의가 있다ˮ며, "이번 연구를 발판으로 카이랄 광학 소재, 비대칭 촉매 등 미래 먹거리가 될 수 있는 멀티스케일 카이랄 신소재 개발로 연구를 확장하겠다ˮ고 소감을 밝혔다.
우리 대학 화학과 강준수 석박사통합과정 학생이 제1 저자로 연구를 주도하고, 화학과 김우연 교수, 임미희 교수, 윤동기 교수 연구팀이 협업한 이번 연구 결과는 미국화학회가 발행하는 국제 학술지 `미국화학회지(Journal of the American Chemical Society)'에 2월 4일 字로 온라인 게재됐다. (논문명 : Circularly Polarized Light Can Override and Amplify Asymmetry in Supramolecular Helices)
이번 연구는 한국연구재단(NRF)에서 선정한 선도연구센터인 카이스트 화학과 멀티스케일 카이랄 구조체 연구센터의 지원을 받아 주로 진행됐다.
2022.02.16 조회수 13445