
< (왼쪽부터) 생명과학과 이승재 교수, 함석진 박사, 김시은 박사과정 >
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
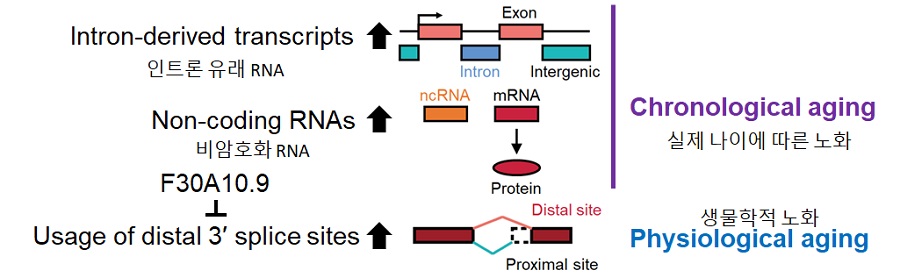
< 그림 1. 연구 요약 >
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
< 그림 2. 예쁜꼬마선충 사진 >
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
-
행사 의과학대학원, 노벨생리의학상 수상자 드루 와이즈만 초청 강연 24일(목) 개최
우리 대학 의과학대학원이 오는 24일(목) 오후 2시에 대전 KAIST 본원에서 2023년 노벨생리의학상 수상자인 드루 와이즈만(Drew Weissmann) 교수 초청 강연을 개최한다. 의과학대학원이 주관하고 대학과 KAI-X의 지원을 받아 마련된 이번 초청 강연은 mRNA 기술을 이용한 백신과 신약 개발 기술에 관심이 있는 우리 대학 학생들에게 자신감과 도전 의식을 심어주고, 대중의 과학 흥미를 고취하고자 추진됐다. 드루 와이즈만 교수는 핵산 변형(nucleotide modification)을 통해 mRNA의 면역 과반응 억제를 유도하고 이를 통한 mRNA 백신 개발에 기여한 공로로 2023년 노벨생리의학상을 카리코 카탈린 교수와 함께 공동 수상했다. 일반적으로 위부에서 세포 내로 주입된 RNA는 선천성 면역반응을 강하게 유도하여 단백질 생산을 억제하고 과도한 염증 반응을 일으킬 수 있다. 드루 와이즈만 교수와 카리코 카탈린 교수 공동연구팀은 이 RNA 구성요소인 핵
2024-10-17 -
연구 기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다. 우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다. 연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다. iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미
2024-10-10 -
연구 미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다. 최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다. 아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다. 이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학
2024-07-22 -
연구 바이러스와 세균의 진화를 규명하다
바이러스는 특정 세포 안에 침투했을 때만 증식의 생명력을 띠고 그 외에는 무생물 같으며, 사람 세포를 감염시키는 코로나19 바이러스, 세균을 잡아먹으며 증식하는 세균바이러스 등이 있다. 국내 연구진이 세균바이러스가 RNA 합성을 마무리 짓는 방식에 해체종결(1)만 있고 재생종결(2)은 없다는 사실을 밝히고 RNA 의약품 개발에 응용될 가능성을 높였다. (1)해체종결: 합성 복합체가 중합효소, DNA, RNA로 해체 (2)재생종결: RNA만 분리되고 중합효소는 DNA에 남아 재생 우리 대학 생명과학과 강창원 명예교수(줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동연구팀이 세균의 리보핵산(RNA) 합성방식 두 가지 중 하나가 바이러스에는 없다는 것을 발견해, 세균이 바이러스로부터 진화하면서 획득한 방식을 처음 밝힌 연구 논문을 핵산 분야 최상급 국제학술지에 게재했다고 19일 밝혔다. 유전자 DNA의 유전정보에 따라 RNA를 합성하는 효소가 RNA 중합효
2024-07-19 -
인물 2024 독일 iF 디자인 어워드 5개 상 수상
우리 대학 산업디자인학과 디자인팀이 세계 3대 디자인 어워드 중 하나인 ‘독일 2024 iF 디자인 어워드(International Forum Design Awards)'에서 총 5개의 본상을 수상했다고 5일 밝혔다. iF 디자인 어워드는 독일의 레드닷 어워드, 미국의 IDEA와 함께 세계에서 가장 권위있는 디자인상 중 하나다. 제품 · 패키지 · 커뮤니케이션 · 서비스디자인 · 사용자 경험(UX) · 사용자 인터페이스 (UI ) · 콘셉트 · 인테리어 · 건축 등 총 9개 부문에서 디자인 차별성과 영향력 등을 종합적으로 평가해 혁신적이고 우수한 디자인을 선정하고 매년 상을 수여한다. 대학에서 구성된 디자인팀이 일반 기업 경쟁 부문에 참가해 다수의 상을 받는 것은 국제적으로 매우 드문 사례로, KAIST 산업디자인학과는 2022년 8개, 2023년 7개의 수상 성
2024-04-05