%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B3%BC
-
 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 7830
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 7830 -
 생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 7303
생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 7303 -
 장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 9434
장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 9434 -
 기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29 조회수 10179
기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29 조회수 10179 -
 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 7989
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 7989 -
 심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
2022.08.22 조회수 9505
심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
2022.08.22 조회수 9505 -
 인공지능 기반 약물 가상 스크리닝 기술로 신규 항암 치료제 발굴 성공
우리 대학 생명과학과 김세윤 교수 연구팀이 `약물 가상 스크리닝 기술을 이용한 신규 항암 치료제 개발'에 성공했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지인 `세포 사멸과 질병(Cell Death & Disease)'에 지난 7월 12일 字 온라인 게재됐다.
※ 논문명 : Lomitapide, a cholesterol-lowering drug, is an anticancer agent that induces autophagic cell death via inhibiting mTOR
※ 저자 정보 : 이보아 (한국과학기술원, 공동 제1 저자), 박승주 (한국과학기술원, 공동 제1 저자), 이슬기 (한국과학기술원, 제2 저자), 오병철 (가천대학교 의과대학, 공동 저자), 정원석 (한국과학기술원, 공동 저자), 손종우 (한국과학기술원, 공동 저자), 김세윤 (한국과학기술원, 교신저자), 포함 총 10명
`엠토르(mTOR)'라고 알려진 신호전달 단백질은 많은 암세포에서 활성이 비정상적으로 높아져 있으며 또한 암뿐만 아니라 당뇨, 염증 및 노화와 같은 다양한 질병에서 핵심적인 역할을 한다. 특히 암을 유발하는 다양한 신호전달 경로가 엠토르 단백질을 통해 매개되기 때문에 많은 제약사에서 항암 치료제 개발의 목적으로 엠토르 저해제 개발에 많은 투자를 하고 있다.
자가포식(autophagy, 오토파지)으로 알려진 생명 현상은 세포 내 엠토르 단백질에 의해 활성 조절이 정교하게 매개되는 것으로 잘 알려져 있다. 자가포식이란 `세포가 자기 살을 먹는다'는 의미로, 영양분이 과도하게 부족하거나 세포 내외적 스트레스 조건에 처한 경우, 세포가 스스로 내부 구성물질들을 파괴해 활용함으로써 세포 내 항상성을 유지하는 일종의 방어기전이다.
이러한 자가포식 활성의 조절은 양날의 칼과 같이 작용하는 것으로 알려져 있으며, 이는 암, 당뇨와 같은 질환의 발생 및 치료에 이용 가능하다고 주목받고 있다. 암세포에 과도하게 활성화돼있는 엠토르 단백질의 활성을 저해하면 자가포식을 과도하게 증가시킬 수 있으며 이를 통해 암세포의 세포 사멸이 유도될 수 있다는 사실이 알려져 있으며 이를 바탕으로 자가포식 강화에 기반한 항암제 약물의 개발전략이 제시되고 있다.
이에 김세윤 교수 연구팀은 단백질의 3차원적 구조를 활용해 화합물과 표적 단백질 사이의 물리적 상호작용을 모델링하는 유효 결합 판별 기술에 기반한 약물 재창출 전략으로 엠토르 억제성 항암제 개발 연구를 수행했다.
약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물군을 대상으로 새로운 적응증을 찾는 신약 개발 방식이다. 이 전략은 전통적으로 10년 이상 소요되는 신약 개발의 막대한 시간과 투자를 혁신적으로 단축할 수 있는 미래 시대 신약 개발전략이다.
연구팀은 FDA 승인 약물 또는 임상 시험 중인 약물에 기반한 데이터베이스를 통해 3,391종의 약물 라이브러리를 활용했다. 라이브러리의 모든 약물을 실험적으로 검증하기에는 연구비용과 시간이 많이 소요되므로, 3차 구조 모델링을 통한 유효 결합 판별 기술을 적용해 엠토르 활성 저해능력을 보이는 약물만 신속하게 스크리닝했다.
연구팀은 엠토르 단백질의 활성을 담당하는 효소 활성부위의 3차 구조 분석과 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이는 데 성공했다. 그리고 3차 구조를 타깃으로 약물 결합 분석 모듈을 도입해 가상 스크리닝의 정확도와 예측도를 높이는 데 성공했다. 이번 연구를 통해 개발된 기술의 가장 큰 특징은 타깃 단백질과 약물 간의 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부를 예측할 수 있는 것이다.
우리 대학 생명과학과 이보아 박사, 박승주 박사는 현재 가족성 고콜레스테롤혈증(familial hypercholesterolemia) 치료제로서 임상에서 판매, 활용되고 있는 로미타피드(lomitapide) 약물의 엠토르 활성 억제 가능성을 예측했다. 연구팀은 생화학적 및 세포 생물학적 분석을 통해 로미타피드에 의한 엠토르 효소활성의 억제효능을 검증하는 데 성공했다. 대장암, 피부암 등의 암세포에 로미타피드를 처리할 경우, 암세포의 엠토르 활성이 효과적으로 억제되고 이후 과도한 자가포식이 유도됨으로써 암세포 사멸효과가 발생함을 다각적으로 확인해 로미타피드의 항암 효능을 확립했다.
또한 대장암 환자로부터 유래한 암 오가노이드(organoid)에 로미타피드를 처리할 경우, 기존의 화학 항암 치료제 대비 우수한 암세포 사멸 능력을 보였다. 나아가 최근 차세대 고형암 치료용 항암 전략으로 주목받고 있는 면역관문억제제(immune checkpoint inhibitor)와 로미티피드를 병행할 경우, 면역관문억제제의 단독 처리 대비 비약적으로 개선된 시너지 항암효과를 나타냄을 동물모델 연구를 통해 검증하는 데 성공했다.
연구팀이 발굴한 로미타피드의 항암 효능 성과는 향후 엠토르 억제 및 자가포식 기반 항암제 개발 및 임상적 활용에 적극 활용될 것으로 기대된다.
이러한 연구성과는 벤처창업으로 연계돼 이보아 박사, 박승주 박사, 이슬기 박사는 인공지능 기반 신약개발 전문기업 `에아스텍'을 공동창업했으며 중소벤처기업부 팁스(TIPS) 창업지원 프로그램에 선정되는 등 활발한 연구개발을 수행하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 창의도전연구사업 및 KAIX 포스트닥펠로사업의 지원을 받아 수행됐다.
2022.08.12 조회수 10411
인공지능 기반 약물 가상 스크리닝 기술로 신규 항암 치료제 발굴 성공
우리 대학 생명과학과 김세윤 교수 연구팀이 `약물 가상 스크리닝 기술을 이용한 신규 항암 치료제 개발'에 성공했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지인 `세포 사멸과 질병(Cell Death & Disease)'에 지난 7월 12일 字 온라인 게재됐다.
※ 논문명 : Lomitapide, a cholesterol-lowering drug, is an anticancer agent that induces autophagic cell death via inhibiting mTOR
※ 저자 정보 : 이보아 (한국과학기술원, 공동 제1 저자), 박승주 (한국과학기술원, 공동 제1 저자), 이슬기 (한국과학기술원, 제2 저자), 오병철 (가천대학교 의과대학, 공동 저자), 정원석 (한국과학기술원, 공동 저자), 손종우 (한국과학기술원, 공동 저자), 김세윤 (한국과학기술원, 교신저자), 포함 총 10명
`엠토르(mTOR)'라고 알려진 신호전달 단백질은 많은 암세포에서 활성이 비정상적으로 높아져 있으며 또한 암뿐만 아니라 당뇨, 염증 및 노화와 같은 다양한 질병에서 핵심적인 역할을 한다. 특히 암을 유발하는 다양한 신호전달 경로가 엠토르 단백질을 통해 매개되기 때문에 많은 제약사에서 항암 치료제 개발의 목적으로 엠토르 저해제 개발에 많은 투자를 하고 있다.
자가포식(autophagy, 오토파지)으로 알려진 생명 현상은 세포 내 엠토르 단백질에 의해 활성 조절이 정교하게 매개되는 것으로 잘 알려져 있다. 자가포식이란 `세포가 자기 살을 먹는다'는 의미로, 영양분이 과도하게 부족하거나 세포 내외적 스트레스 조건에 처한 경우, 세포가 스스로 내부 구성물질들을 파괴해 활용함으로써 세포 내 항상성을 유지하는 일종의 방어기전이다.
이러한 자가포식 활성의 조절은 양날의 칼과 같이 작용하는 것으로 알려져 있으며, 이는 암, 당뇨와 같은 질환의 발생 및 치료에 이용 가능하다고 주목받고 있다. 암세포에 과도하게 활성화돼있는 엠토르 단백질의 활성을 저해하면 자가포식을 과도하게 증가시킬 수 있으며 이를 통해 암세포의 세포 사멸이 유도될 수 있다는 사실이 알려져 있으며 이를 바탕으로 자가포식 강화에 기반한 항암제 약물의 개발전략이 제시되고 있다.
이에 김세윤 교수 연구팀은 단백질의 3차원적 구조를 활용해 화합물과 표적 단백질 사이의 물리적 상호작용을 모델링하는 유효 결합 판별 기술에 기반한 약물 재창출 전략으로 엠토르 억제성 항암제 개발 연구를 수행했다.
약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물군을 대상으로 새로운 적응증을 찾는 신약 개발 방식이다. 이 전략은 전통적으로 10년 이상 소요되는 신약 개발의 막대한 시간과 투자를 혁신적으로 단축할 수 있는 미래 시대 신약 개발전략이다.
연구팀은 FDA 승인 약물 또는 임상 시험 중인 약물에 기반한 데이터베이스를 통해 3,391종의 약물 라이브러리를 활용했다. 라이브러리의 모든 약물을 실험적으로 검증하기에는 연구비용과 시간이 많이 소요되므로, 3차 구조 모델링을 통한 유효 결합 판별 기술을 적용해 엠토르 활성 저해능력을 보이는 약물만 신속하게 스크리닝했다.
연구팀은 엠토르 단백질의 활성을 담당하는 효소 활성부위의 3차 구조 분석과 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이는 데 성공했다. 그리고 3차 구조를 타깃으로 약물 결합 분석 모듈을 도입해 가상 스크리닝의 정확도와 예측도를 높이는 데 성공했다. 이번 연구를 통해 개발된 기술의 가장 큰 특징은 타깃 단백질과 약물 간의 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부를 예측할 수 있는 것이다.
우리 대학 생명과학과 이보아 박사, 박승주 박사는 현재 가족성 고콜레스테롤혈증(familial hypercholesterolemia) 치료제로서 임상에서 판매, 활용되고 있는 로미타피드(lomitapide) 약물의 엠토르 활성 억제 가능성을 예측했다. 연구팀은 생화학적 및 세포 생물학적 분석을 통해 로미타피드에 의한 엠토르 효소활성의 억제효능을 검증하는 데 성공했다. 대장암, 피부암 등의 암세포에 로미타피드를 처리할 경우, 암세포의 엠토르 활성이 효과적으로 억제되고 이후 과도한 자가포식이 유도됨으로써 암세포 사멸효과가 발생함을 다각적으로 확인해 로미타피드의 항암 효능을 확립했다.
또한 대장암 환자로부터 유래한 암 오가노이드(organoid)에 로미타피드를 처리할 경우, 기존의 화학 항암 치료제 대비 우수한 암세포 사멸 능력을 보였다. 나아가 최근 차세대 고형암 치료용 항암 전략으로 주목받고 있는 면역관문억제제(immune checkpoint inhibitor)와 로미티피드를 병행할 경우, 면역관문억제제의 단독 처리 대비 비약적으로 개선된 시너지 항암효과를 나타냄을 동물모델 연구를 통해 검증하는 데 성공했다.
연구팀이 발굴한 로미타피드의 항암 효능 성과는 향후 엠토르 억제 및 자가포식 기반 항암제 개발 및 임상적 활용에 적극 활용될 것으로 기대된다.
이러한 연구성과는 벤처창업으로 연계돼 이보아 박사, 박승주 박사, 이슬기 박사는 인공지능 기반 신약개발 전문기업 `에아스텍'을 공동창업했으며 중소벤처기업부 팁스(TIPS) 창업지원 프로그램에 선정되는 등 활발한 연구개발을 수행하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 창의도전연구사업 및 KAIX 포스트닥펠로사업의 지원을 받아 수행됐다.
2022.08.12 조회수 10411 -
 노화된 뇌에서 생겨난 비정상적 별아교세포 '아프다(APDA)' 발견
우리 연구진이 노화 및 치매 뇌에서 기억 중추인 해마 특이적으로 비정상적 별아교세포가 생겨나는 것을 최초로 관찰하고 그 원인을 규명했으며 이들은 신경 세포의 연결점인 시냅스의 숫자 및 기능 유지에 악영향을 줄 수 있음을 밝혔다. 이는 노화에 따른 인지 기능 저하를 일으키는 새로운 원인을 제시해 뇌 기능 회복에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 이은별 박사, 정연주 박사 연구팀이 노화된 뇌에서 기존에 알려지지 않은 새로운 종류의 별아교세포를 발견했고, 이들이 세포 내 단백질 항상성이 손상돼 시냅스 생성 및 제거와 같은 기본적 능력이 결여돼있음을 밝혀 노화 관련 네이처 자매지인 `네이처 에이징(Nature Aging)'에 공개했다고 8일 밝혔다.
정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포가 신경세포의 시냅스를 만들 수도 또는 제거할 수도 있음을 밝힌 바 있다. 하지만, 이 같은 별아교세포의 기능이 노화 과정에서 어떻게 변화하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 노화된 뇌에서 별아교세포의 기능 변화를 이해하고자 단일 세포RNA 시퀀싱을 수행했고, 그 결과 기존에 노화 및 질병 뇌에서 존재한다고 알려진 염증성 별아교세포가 아닌 새로운 종류의 별아교세포가 존재함을 발견했다.
흥미롭게도 이들은 뇌에서 단기 기억을 저장한다고 알려진 해마에서만 노화 과정에서 선택적으로 생겨났으며, 이들 세포 내에는 불필요한 단백질을 제거하는 기전으로 알려진 자가포식(autophagy) 과정에서 생겨나는 오토파고좀(autophagosome)이 무분별하게 축적돼 있음을 밝혔다. 오토파고좀은 자가포식 과정에서 생겨나는 주머니 형태의 세포 소기관으로 세포내 불필요한 물질을 제거하기 위한 자가포식소체를 일컫는다. 이 같은 특징을 나타내기 위해서 연구진들은 중의적인 표현으로 새로 발견한 별아교세포를 `아프다(APDA: AutoPhagy-Dysregulated Astrocyte)' 세포로 명명했다.
별아교세포는 미세한 잔가지들을 통해서 수만 개의 시냅스를 감싸고 있으며, 글루타메이트(glutamate) 및 가바(GABA)와 같은 신경 전달 물질 및 다양한 이온들의 농도를 조절하는 역할을 수행함이 알려져 있다. 놀랍게도 APDA 세포들에서는 다양한 단백질들이 본래 위치에서 벗어나 오토파고좀에 갇혀 있는 현상이 발견됐으며 이로 인해 별아교세포가 시냅스를 만들거나 제거하는 능력이 모두 상실돼있음을 발견했다.
연구진은 자가포식 작용이 비정상적으로 조절되고 있음에 착안해 자가포식 작용에 영향을 주는 다양한 기전을 연구한 결과, 노화가 진행될수록 해마에 존재하는 별아교세포에서만 엠토르 (mTOR: 세포의 성장과 분열을 조절하는 단백질 합성의 신호체계)와 프로테아좀 (proteasome: 단백질 분해 효소 복합체) 활성도가 크게 감소함을 확인하였다. 이 두 기전은 원래 자가포식 작용을 제어하는 기전으로 알려져 있었는데 노화가 진행됨에 따라 다른 세포보다도 별아교세포에서 엠토르와 프로테아좀 기능이 감소함에 따라 자가포식 작용이 무분별하게 발생함을 밝힌 것이다. 그뿐만 아니라 이렇게 만들어진 오토파고좀들이 원래는 리소좀(lysosome)에 의해 분해돼 제거되나, APDA 세포들은 리소좀의 활성마저도 감소해 있음을 보였다.
이로써 세포 내 단백질 항상성을 조절하는 중요한 세 가지 기전 (엠토르, 프로테아좀, 리소좀)들이 모두 해마에 존재하는 별아교세포에서 노화에 따라 선택적으로 감소함에 따라, APDA 세포가 생겨남을 연구진은 보였다. 연구진은 실제 노화가 일어나지 않은 9개월령 쥐에게서도 엠토르 및 프로테아좀을 약물로써 감소시켰을 때 인위적으로 노화된 뇌에서 발견되는 APDA 세포를 만들 수 있음을 확인했다.
놀랍게도 연구진은 이러한 비정상적인 APDA 세포의 주변에 있는 시냅스들이 제대로 배열돼 있지 못하고 또한 그 숫자가 감소해 있음을 발견해 노화된 뇌에서 발생하는 시냅스 손상 및 뇌인지 기능 저하가 비정상적인 기능을 가진 APDA 세포에서 기인 할 수 있음을 제시했다. 또한 연구진은 치매 모델 쥐에서는 이 같은 APDA 세포가 정상 쥐의 노화 과정에서 보다 훨씬 더 빨리 해마에서 생겨남을 발견해 이들이 치매에서 나타나는 인지 기능 저하에도 역할을 할 수 있음을 보였다.
현재 노화된 뇌나 퇴행성 뇌 질환에서 교세포의 연구는 주로 염증성 교세포와 이들의 역할에 집중돼왔다. 연구팀의 이번 발견은 노화 및 치매 뇌에서 염증성 별아교세포와는 전혀 다른 종류의 비정상적 별아교세포가 존재함을 밝힌 첫 번째 연구 결과이며, 이들이 시냅스의 항상성을 무너뜨릴 수 있음을 제시했다.
연구팀은 이번 연구가 현재 노화를 극복하기 위해 엠토르를 전체적으로 억제하려는 현재 패러다임이 오히려 비정상적인 APDA 세포의 생성을 촉진할 수도 있음을 시사한다고 언급하며, 향후 연구에서는 노화 극복 방안이 세포 특이적으로 세분화돼야 함을 강조했다.
우리 대학 생명과학과 이은별 박사과정 학생과 정연주 박사 후 연구원이 공동 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `네이쳐 에이징 (Nature Aging)'에 지난 8월 1일 자로 온라인 공개됐으며 (논문명: A distinct astrocyte subtype in the aging mouse brain characterized by impaired protein homeostasis), 같은 저널에 News & Views (Astrocytic traffiic jams in the aging brain)에도 소개됐다.
한편, 이번 연구는 삼성미래기술육성재단과 치매극복연구개발사업단의 도움을 받아 진행됐다.
2022.08.08 조회수 10039
노화된 뇌에서 생겨난 비정상적 별아교세포 '아프다(APDA)' 발견
우리 연구진이 노화 및 치매 뇌에서 기억 중추인 해마 특이적으로 비정상적 별아교세포가 생겨나는 것을 최초로 관찰하고 그 원인을 규명했으며 이들은 신경 세포의 연결점인 시냅스의 숫자 및 기능 유지에 악영향을 줄 수 있음을 밝혔다. 이는 노화에 따른 인지 기능 저하를 일으키는 새로운 원인을 제시해 뇌 기능 회복에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 이은별 박사, 정연주 박사 연구팀이 노화된 뇌에서 기존에 알려지지 않은 새로운 종류의 별아교세포를 발견했고, 이들이 세포 내 단백질 항상성이 손상돼 시냅스 생성 및 제거와 같은 기본적 능력이 결여돼있음을 밝혀 노화 관련 네이처 자매지인 `네이처 에이징(Nature Aging)'에 공개했다고 8일 밝혔다.
정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포가 신경세포의 시냅스를 만들 수도 또는 제거할 수도 있음을 밝힌 바 있다. 하지만, 이 같은 별아교세포의 기능이 노화 과정에서 어떻게 변화하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 노화된 뇌에서 별아교세포의 기능 변화를 이해하고자 단일 세포RNA 시퀀싱을 수행했고, 그 결과 기존에 노화 및 질병 뇌에서 존재한다고 알려진 염증성 별아교세포가 아닌 새로운 종류의 별아교세포가 존재함을 발견했다.
흥미롭게도 이들은 뇌에서 단기 기억을 저장한다고 알려진 해마에서만 노화 과정에서 선택적으로 생겨났으며, 이들 세포 내에는 불필요한 단백질을 제거하는 기전으로 알려진 자가포식(autophagy) 과정에서 생겨나는 오토파고좀(autophagosome)이 무분별하게 축적돼 있음을 밝혔다. 오토파고좀은 자가포식 과정에서 생겨나는 주머니 형태의 세포 소기관으로 세포내 불필요한 물질을 제거하기 위한 자가포식소체를 일컫는다. 이 같은 특징을 나타내기 위해서 연구진들은 중의적인 표현으로 새로 발견한 별아교세포를 `아프다(APDA: AutoPhagy-Dysregulated Astrocyte)' 세포로 명명했다.
별아교세포는 미세한 잔가지들을 통해서 수만 개의 시냅스를 감싸고 있으며, 글루타메이트(glutamate) 및 가바(GABA)와 같은 신경 전달 물질 및 다양한 이온들의 농도를 조절하는 역할을 수행함이 알려져 있다. 놀랍게도 APDA 세포들에서는 다양한 단백질들이 본래 위치에서 벗어나 오토파고좀에 갇혀 있는 현상이 발견됐으며 이로 인해 별아교세포가 시냅스를 만들거나 제거하는 능력이 모두 상실돼있음을 발견했다.
연구진은 자가포식 작용이 비정상적으로 조절되고 있음에 착안해 자가포식 작용에 영향을 주는 다양한 기전을 연구한 결과, 노화가 진행될수록 해마에 존재하는 별아교세포에서만 엠토르 (mTOR: 세포의 성장과 분열을 조절하는 단백질 합성의 신호체계)와 프로테아좀 (proteasome: 단백질 분해 효소 복합체) 활성도가 크게 감소함을 확인하였다. 이 두 기전은 원래 자가포식 작용을 제어하는 기전으로 알려져 있었는데 노화가 진행됨에 따라 다른 세포보다도 별아교세포에서 엠토르와 프로테아좀 기능이 감소함에 따라 자가포식 작용이 무분별하게 발생함을 밝힌 것이다. 그뿐만 아니라 이렇게 만들어진 오토파고좀들이 원래는 리소좀(lysosome)에 의해 분해돼 제거되나, APDA 세포들은 리소좀의 활성마저도 감소해 있음을 보였다.
이로써 세포 내 단백질 항상성을 조절하는 중요한 세 가지 기전 (엠토르, 프로테아좀, 리소좀)들이 모두 해마에 존재하는 별아교세포에서 노화에 따라 선택적으로 감소함에 따라, APDA 세포가 생겨남을 연구진은 보였다. 연구진은 실제 노화가 일어나지 않은 9개월령 쥐에게서도 엠토르 및 프로테아좀을 약물로써 감소시켰을 때 인위적으로 노화된 뇌에서 발견되는 APDA 세포를 만들 수 있음을 확인했다.
놀랍게도 연구진은 이러한 비정상적인 APDA 세포의 주변에 있는 시냅스들이 제대로 배열돼 있지 못하고 또한 그 숫자가 감소해 있음을 발견해 노화된 뇌에서 발생하는 시냅스 손상 및 뇌인지 기능 저하가 비정상적인 기능을 가진 APDA 세포에서 기인 할 수 있음을 제시했다. 또한 연구진은 치매 모델 쥐에서는 이 같은 APDA 세포가 정상 쥐의 노화 과정에서 보다 훨씬 더 빨리 해마에서 생겨남을 발견해 이들이 치매에서 나타나는 인지 기능 저하에도 역할을 할 수 있음을 보였다.
현재 노화된 뇌나 퇴행성 뇌 질환에서 교세포의 연구는 주로 염증성 교세포와 이들의 역할에 집중돼왔다. 연구팀의 이번 발견은 노화 및 치매 뇌에서 염증성 별아교세포와는 전혀 다른 종류의 비정상적 별아교세포가 존재함을 밝힌 첫 번째 연구 결과이며, 이들이 시냅스의 항상성을 무너뜨릴 수 있음을 제시했다.
연구팀은 이번 연구가 현재 노화를 극복하기 위해 엠토르를 전체적으로 억제하려는 현재 패러다임이 오히려 비정상적인 APDA 세포의 생성을 촉진할 수도 있음을 시사한다고 언급하며, 향후 연구에서는 노화 극복 방안이 세포 특이적으로 세분화돼야 함을 강조했다.
우리 대학 생명과학과 이은별 박사과정 학생과 정연주 박사 후 연구원이 공동 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `네이쳐 에이징 (Nature Aging)'에 지난 8월 1일 자로 온라인 공개됐으며 (논문명: A distinct astrocyte subtype in the aging mouse brain characterized by impaired protein homeostasis), 같은 저널에 News & Views (Astrocytic traffiic jams in the aging brain)에도 소개됐다.
한편, 이번 연구는 삼성미래기술육성재단과 치매극복연구개발사업단의 도움을 받아 진행됐다.
2022.08.08 조회수 10039 -
 대량의 고농도 일산화탄소를 고부가가치 바이오케미칼로 전환하는 기술 개발
우리 대학 생명과학과 조병관 교수 연구팀이 산업 부생가스 등으로 대량 발생하는 고농도의 일산화탄소를 고부가가치 바이오케미칼로 전환할 수 있는 생체촉매 기반 C1 바이오 리파이너리 기술*을 개발했다고 14일 밝혔다.
* 제철 공정과 같은 산업공정에서 발생하는 부생가스, 합성가스는 다량의 일산화탄소, 이산화탄소 등의 탄소 1개로 이루어진 C1 가스로 구성되어 있음. 이러한 C1 가스를 미생물과 같은 생체촉매를 활용하여 다양한 화학물질로 전환하는 공정을 C1 가스 바이오 리파이너리(bio-refinery) 기술이라고 함.
최근 탄소 포집 및 전환과 같은 기술들에 대한 산업계의 요구가 커지는 가운데, 미생물을 활용한 친환경 생체촉매 기술이 크게 성장하고 있다.
조병관 교수 연구팀은 아세토젠 미생물을 생체촉매로 활용한 C1 가스 바이오 리파이너리 기술을 개발했다. 이 미생물들은 혐기성 미생물들로 우드-융달 대사회로라는 매우 독특한 대사회로를 이용하여 C1 가스로부터 아세트산을 만드는 미생물로 알려져 있다.
이러한 아세토젠 미생물을 생체촉매로 활용해 산업 부생가스를 활용하는 기술에는 한 가지 문제가 있는데, 바로 독성가스인 일산화탄소의 농도다. 이 미생물은 60% 이상의 고농도 일산화탄소 조건에서는 생명 활동이 크게 저해를 받기 때문에, 생체촉매로써 사용할 수 없게 된다. 다양한 산업에서 발생하는 C1 가스는 공정 과정에 따라 10~70% 정도의 일산화탄소가 포함돼있는데, 특히 철강산업 공정에서 발생하는 고로가스(BFG)에는 약 60%가 넘는 일산화탄소가 포함돼 있다. 따라서, 미생물 기반 고효율 생체촉매 개발을 위해서는 일산화탄소에 대한 저항성을 높이는 것이 필수적으로 선행돼야 한다.
연구팀은 아세토젠 미생물 중 하나인 유박테리움 리모좀(Eubacterium limosum) 균주를 고농도 일산화탄소 조건에 지속적으로 노출해 일산화탄소에 대한 내성이 뛰어난 돌연변이체(ECO2)를 발굴했는데, 해당 돌연변이체는 일산화탄소가 약 60% 이상 포함된 합성가스 조건에서 야생형 미생물보다 약 6배 정도 빠른 성장 속도를 보였다. 이러한 성장 속도는 현재까지 보고된 아세토젠 미생물 중 고농도 일산화탄소 조건(CO 함량 60% 이상)에서 전 세계에서 가장 빠른 속도다.
연구팀은 위의 돌연변이 미생물의 유전체 서열분석을 통해 아세틸 조효소 A 합성 단백질(acetyl-CoA synthase)을 암호화하는 유전자(acsB) 내 돌연변이가 발생한 것을 규명하고, 인공지능 기반의 구조예측을 통해 이러한 변이가 일산화탄소 내성 및 고정률 향상을 유도했음을 밝혔다.
연구팀은 일산화탄소에 대한 내성이 향상된 ECO2 돌연변이 미생물에 2,3-부탄다이올(2,3-butanediol, 2,3-BDO)* 생합성 경로를 도입해 C1 가스를 C4 화학물질로 전환할 수 있는 미생물 기반 생체촉매 시스템을 개발했다. ECO2 기반의 생체촉매가 가스 발효과정을 통해 야생형 미생물 대비 약 6.5배 정도의 높은 2,3-BDO 생산성을 보여줌으로써, C1 가스를 효율적으로 C4 화학연료로 전환하는데 성공했다.
*2,3-부탄다이올(2,3-butanediol, 2,3-BDO): 농업용 자재, 식품첨가제, 의약품 첨가제, 고분자 첨가제 등 활용 범위가 광범위한 바이오케미칼
연구를 주도한 조병관 교수는 “산업공정 과정에서 발생하는 C1 가스는 일산화탄소, 이산화탄소 등의 혼합가스로, 이를 직접적으로 미생물이 이용하기 위해서는 일산화탄소에 대한 내성 및 전환율 향상이 필수적이다”라고 설명했으며, “다양한 합성생물학 기술들 활용하면 아세토젠 미생물 생체촉매의 활용도를 더욱 개선할 수 있으며, 이러한 고효율 C1 가스 전환 생체촉매 연구는 C1 가스 바이오 리파이너리의 핵심 원천기술로 다양한 산업현장에 적용할 수 있을 것”라고 밝혔다.
생명과학과 진상락(석박사통합과정), 강슬기(박사과정) 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘화학 공학 저널(Chemical Engineering Journal, 영향력지수 14.66)’에 6월 22일 字 온라인판에 게재됐다. (논문명: Development of CO gas conversion system using high CO tolerance biocatalyst)
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업단의 지원을 받아 수행됐다.
2022.07.15 조회수 10567
대량의 고농도 일산화탄소를 고부가가치 바이오케미칼로 전환하는 기술 개발
우리 대학 생명과학과 조병관 교수 연구팀이 산업 부생가스 등으로 대량 발생하는 고농도의 일산화탄소를 고부가가치 바이오케미칼로 전환할 수 있는 생체촉매 기반 C1 바이오 리파이너리 기술*을 개발했다고 14일 밝혔다.
* 제철 공정과 같은 산업공정에서 발생하는 부생가스, 합성가스는 다량의 일산화탄소, 이산화탄소 등의 탄소 1개로 이루어진 C1 가스로 구성되어 있음. 이러한 C1 가스를 미생물과 같은 생체촉매를 활용하여 다양한 화학물질로 전환하는 공정을 C1 가스 바이오 리파이너리(bio-refinery) 기술이라고 함.
최근 탄소 포집 및 전환과 같은 기술들에 대한 산업계의 요구가 커지는 가운데, 미생물을 활용한 친환경 생체촉매 기술이 크게 성장하고 있다.
조병관 교수 연구팀은 아세토젠 미생물을 생체촉매로 활용한 C1 가스 바이오 리파이너리 기술을 개발했다. 이 미생물들은 혐기성 미생물들로 우드-융달 대사회로라는 매우 독특한 대사회로를 이용하여 C1 가스로부터 아세트산을 만드는 미생물로 알려져 있다.
이러한 아세토젠 미생물을 생체촉매로 활용해 산업 부생가스를 활용하는 기술에는 한 가지 문제가 있는데, 바로 독성가스인 일산화탄소의 농도다. 이 미생물은 60% 이상의 고농도 일산화탄소 조건에서는 생명 활동이 크게 저해를 받기 때문에, 생체촉매로써 사용할 수 없게 된다. 다양한 산업에서 발생하는 C1 가스는 공정 과정에 따라 10~70% 정도의 일산화탄소가 포함돼있는데, 특히 철강산업 공정에서 발생하는 고로가스(BFG)에는 약 60%가 넘는 일산화탄소가 포함돼 있다. 따라서, 미생물 기반 고효율 생체촉매 개발을 위해서는 일산화탄소에 대한 저항성을 높이는 것이 필수적으로 선행돼야 한다.
연구팀은 아세토젠 미생물 중 하나인 유박테리움 리모좀(Eubacterium limosum) 균주를 고농도 일산화탄소 조건에 지속적으로 노출해 일산화탄소에 대한 내성이 뛰어난 돌연변이체(ECO2)를 발굴했는데, 해당 돌연변이체는 일산화탄소가 약 60% 이상 포함된 합성가스 조건에서 야생형 미생물보다 약 6배 정도 빠른 성장 속도를 보였다. 이러한 성장 속도는 현재까지 보고된 아세토젠 미생물 중 고농도 일산화탄소 조건(CO 함량 60% 이상)에서 전 세계에서 가장 빠른 속도다.
연구팀은 위의 돌연변이 미생물의 유전체 서열분석을 통해 아세틸 조효소 A 합성 단백질(acetyl-CoA synthase)을 암호화하는 유전자(acsB) 내 돌연변이가 발생한 것을 규명하고, 인공지능 기반의 구조예측을 통해 이러한 변이가 일산화탄소 내성 및 고정률 향상을 유도했음을 밝혔다.
연구팀은 일산화탄소에 대한 내성이 향상된 ECO2 돌연변이 미생물에 2,3-부탄다이올(2,3-butanediol, 2,3-BDO)* 생합성 경로를 도입해 C1 가스를 C4 화학물질로 전환할 수 있는 미생물 기반 생체촉매 시스템을 개발했다. ECO2 기반의 생체촉매가 가스 발효과정을 통해 야생형 미생물 대비 약 6.5배 정도의 높은 2,3-BDO 생산성을 보여줌으로써, C1 가스를 효율적으로 C4 화학연료로 전환하는데 성공했다.
*2,3-부탄다이올(2,3-butanediol, 2,3-BDO): 농업용 자재, 식품첨가제, 의약품 첨가제, 고분자 첨가제 등 활용 범위가 광범위한 바이오케미칼
연구를 주도한 조병관 교수는 “산업공정 과정에서 발생하는 C1 가스는 일산화탄소, 이산화탄소 등의 혼합가스로, 이를 직접적으로 미생물이 이용하기 위해서는 일산화탄소에 대한 내성 및 전환율 향상이 필수적이다”라고 설명했으며, “다양한 합성생물학 기술들 활용하면 아세토젠 미생물 생체촉매의 활용도를 더욱 개선할 수 있으며, 이러한 고효율 C1 가스 전환 생체촉매 연구는 C1 가스 바이오 리파이너리의 핵심 원천기술로 다양한 산업현장에 적용할 수 있을 것”라고 밝혔다.
생명과학과 진상락(석박사통합과정), 강슬기(박사과정) 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘화학 공학 저널(Chemical Engineering Journal, 영향력지수 14.66)’에 6월 22일 字 온라인판에 게재됐다. (논문명: Development of CO gas conversion system using high CO tolerance biocatalyst)
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업단의 지원을 받아 수행됐다.
2022.07.15 조회수 10567 -
 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 10805
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 10805 -
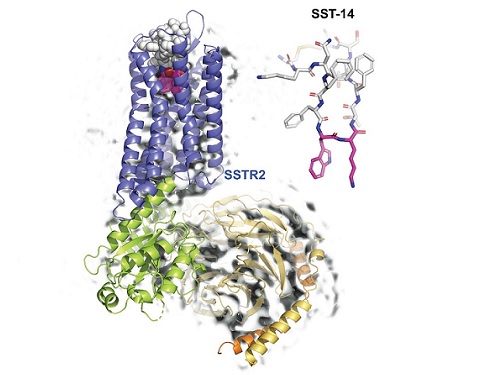 호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 8369
호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 8369 -
 합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
2022.04.17 조회수 11884
합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
2022.04.17 조회수 11884