-
 인공지능 이용 면역항암 세포 3차원 분석기술 개발
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀이 면역항암 세포의 활동을 정밀하게 측정하고 분석할 수 있는 새로운 3차원 인공지능 분석기술을 개발했다고 28일 밝혔다.
체내에서 면역세포를 추출한 후, 외부에서 면역 능력을 강화시키고 다시 환자에게 주입해 암을 치료하는 방식을 `입양전달 면역세포 치료(adoptive immune cell therapy)'라고 부른다. 이 치료방식은 면역세포 치료법 중 가장 많은 주목을 받는 기술이다. `키메릭 항원 수용체' 또는 `CAR(Chimeric Antigen Receptor)'라고도 불리는 데 유전자 재조합기술을 이용해 T세포와 같은 면역세포를 변형해 암세포와의 반응을 유도해 사멸시키는 치료 방법이다.
특히 CAR-T세포 치료는 높은 치료 효과를 보여 차세대 암 치료제로 급부상하고 있다. 2017년 난치성 B세포 급성 림프구성 백혈병 치료제 판매 승인을 시작으로 현재 3종의 CAR-T 치료제가 판매 승인을 받았으며, 전 세계적으로 약 1,000건 이상의 임상 시험이 진행 중이다. 그러나 아직 우리나라에서는 진행 중인 임상 시험이 전무한 실정이다.
CAR-T 기술을 이용한 암 치료 방법들이 속속 개발되고 있지만, CAR-T세포에 대한 세포‧분자 생물학적 메커니즘은 아직 많은 부분이 알려지지 않았다. 특히, CAR-T세포가 표적 암세포를 인지해 결합한 후 `면역 시냅스 (immunological synapse, 이하 IS)'를 형성해 물질을 전달하고 암세포의 사멸을 유도하는데, 두 세포 간의 거리와 같은 IS의 형태 정보는 T세포 활성화 유도와 관련이 높다고 알려져 있지만 구체적인 내용을 파악하기 어렵기 때문에 이에 대한 연구가 활발히 진행 중이다.
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀은 CAR-T세포의 IS를 정밀하고 체계적으로 연구할 수 있는 새로운 기술을 개발했다. 3D 홀로그래피 현미경 기술을 이용해, 염색이나 전처리 없이 살아있는 상태의 CAR-T세포와 표적 암세포 간의 상호작용을 고속으로 측정하고 기존에는 관찰하기 어려운 CAR-T와 암세포 간의 IS를 고해상도로 실시간 측정했다. 또한 이렇게 측정한 3D 세포 영상을 인공지능 신경망(Convolutional Neural Network, CNN)을 이용해 분석하고, 3차원 공간에서 정확하게 IS 정보를 정량적으로 추출할 수 있는 기술을 자체 개발했다.
공동연구팀은 또 이 기술을 활용해 빠른 CAR-T 면역 관문 형성 메커니즘을 추적할 수 있었을 뿐만 아니라, IS의 형태학적 특성이 CAR-T의 항암 효능과 연관이 있음을 확인했다. 연구팀은 3차원 IS 정보가 새로운 표적 항암 치료제의 초기 연구에 필요한 정량적 지표를 제공할 것이라고 기대하고 있다.
이번 연구에는 우리 대학 기술을 바탕으로 창업한 2개 기업이 공동으로 참여했다. 3차원 홀로그래픽 현미경을 상업화한 토모큐브 社의 현미경 장비를 이용해 면역세포를 측정하는 한편 토모큐브 社의 인공지능 연구팀이 알고리즘 개발에 참여했다. 이밖에 국내 최초 CAR-T 기반 치료제 기업인 ㈜큐로셀도 연구에 함께 참여해 이 같은 성과를 거두는 데 성공했다.
물리학과 이무성 박사과정 학생, 생명과학과 이영호 박사, 물리학과 송진엽 학부생 (現 메사추세츠 공과대학(MIT) 물리학과 박사과정)이 공동 제1 저자로 참여한 이번 연구는 국제적으로 권위를 인정받는 생물학술지인 `이라이프(eLife)' 12월 17일 字 온라인판을 통해 공개됐으며 지난 21일 字에 공식 게재됐다.
(논문명 : Deep-learning based three-dimensional label-free tracking and analysis of immunological synapses of CAR-T cells)
한편 이번 연구는 한국연구재단 리더연구사업, 바이오·의료기술개발사업, 중견연구자지원사업, KAIST Up program의 지원을 받아 수행됐다.
인공지능 이용 면역항암 세포 3차원 분석기술 개발
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀이 면역항암 세포의 활동을 정밀하게 측정하고 분석할 수 있는 새로운 3차원 인공지능 분석기술을 개발했다고 28일 밝혔다.
체내에서 면역세포를 추출한 후, 외부에서 면역 능력을 강화시키고 다시 환자에게 주입해 암을 치료하는 방식을 `입양전달 면역세포 치료(adoptive immune cell therapy)'라고 부른다. 이 치료방식은 면역세포 치료법 중 가장 많은 주목을 받는 기술이다. `키메릭 항원 수용체' 또는 `CAR(Chimeric Antigen Receptor)'라고도 불리는 데 유전자 재조합기술을 이용해 T세포와 같은 면역세포를 변형해 암세포와의 반응을 유도해 사멸시키는 치료 방법이다.
특히 CAR-T세포 치료는 높은 치료 효과를 보여 차세대 암 치료제로 급부상하고 있다. 2017년 난치성 B세포 급성 림프구성 백혈병 치료제 판매 승인을 시작으로 현재 3종의 CAR-T 치료제가 판매 승인을 받았으며, 전 세계적으로 약 1,000건 이상의 임상 시험이 진행 중이다. 그러나 아직 우리나라에서는 진행 중인 임상 시험이 전무한 실정이다.
CAR-T 기술을 이용한 암 치료 방법들이 속속 개발되고 있지만, CAR-T세포에 대한 세포‧분자 생물학적 메커니즘은 아직 많은 부분이 알려지지 않았다. 특히, CAR-T세포가 표적 암세포를 인지해 결합한 후 `면역 시냅스 (immunological synapse, 이하 IS)'를 형성해 물질을 전달하고 암세포의 사멸을 유도하는데, 두 세포 간의 거리와 같은 IS의 형태 정보는 T세포 활성화 유도와 관련이 높다고 알려져 있지만 구체적인 내용을 파악하기 어렵기 때문에 이에 대한 연구가 활발히 진행 중이다.
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀은 CAR-T세포의 IS를 정밀하고 체계적으로 연구할 수 있는 새로운 기술을 개발했다. 3D 홀로그래피 현미경 기술을 이용해, 염색이나 전처리 없이 살아있는 상태의 CAR-T세포와 표적 암세포 간의 상호작용을 고속으로 측정하고 기존에는 관찰하기 어려운 CAR-T와 암세포 간의 IS를 고해상도로 실시간 측정했다. 또한 이렇게 측정한 3D 세포 영상을 인공지능 신경망(Convolutional Neural Network, CNN)을 이용해 분석하고, 3차원 공간에서 정확하게 IS 정보를 정량적으로 추출할 수 있는 기술을 자체 개발했다.
공동연구팀은 또 이 기술을 활용해 빠른 CAR-T 면역 관문 형성 메커니즘을 추적할 수 있었을 뿐만 아니라, IS의 형태학적 특성이 CAR-T의 항암 효능과 연관이 있음을 확인했다. 연구팀은 3차원 IS 정보가 새로운 표적 항암 치료제의 초기 연구에 필요한 정량적 지표를 제공할 것이라고 기대하고 있다.
이번 연구에는 우리 대학 기술을 바탕으로 창업한 2개 기업이 공동으로 참여했다. 3차원 홀로그래픽 현미경을 상업화한 토모큐브 社의 현미경 장비를 이용해 면역세포를 측정하는 한편 토모큐브 社의 인공지능 연구팀이 알고리즘 개발에 참여했다. 이밖에 국내 최초 CAR-T 기반 치료제 기업인 ㈜큐로셀도 연구에 함께 참여해 이 같은 성과를 거두는 데 성공했다.
물리학과 이무성 박사과정 학생, 생명과학과 이영호 박사, 물리학과 송진엽 학부생 (現 메사추세츠 공과대학(MIT) 물리학과 박사과정)이 공동 제1 저자로 참여한 이번 연구는 국제적으로 권위를 인정받는 생물학술지인 `이라이프(eLife)' 12월 17일 字 온라인판을 통해 공개됐으며 지난 21일 字에 공식 게재됐다.
(논문명 : Deep-learning based three-dimensional label-free tracking and analysis of immunological synapses of CAR-T cells)
한편 이번 연구는 한국연구재단 리더연구사업, 바이오·의료기술개발사업, 중견연구자지원사업, KAIST Up program의 지원을 받아 수행됐다.
2021.01.29
조회수 77645
-
 이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11
조회수 28893
-
 코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
2020.09.07
조회수 29592
-
 중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
2020.07.14
조회수 33936
-
 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16
조회수 25185
-
 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25
조회수 17655
-
 신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
2019.11.13
조회수 12978
-
 박수형 교수, 간암 복합면역치료 적용 가능성 확인
〈 박 수 형 교수 〉
우리 대학 의과학대학원 박수형 교수와 서울아산병원 황신, 송기원 교수 공동연구팀이 간암 환자의 탈진(exhausted)된 종양 침투 면역세포 구성의 차이에 따른 간암 환자군을 구분하는 데 성공했다.
이번 연구를 통해 간암 환자의 새로운 면역치료법 적용 가능성을 확인함으로써 향후 맞춤 의학의 근거를 제시할 수 있는 기반이 될 것으로 기대된다.
특히 이번 연구는 서울아산병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 임상을 통해 새 면역 항암 치료법을 위한 협업을 진행한 것으로 중개 연구(translational research)의 우수 모델로 평가받는다.
김형돈 박사과정이 1저자로 참여한 이번 연구는 국제 학술지 ‘소화기학(Gastroenterology)’ 12월 4일 자에 게재됐다.
암이 발생하면 인체는 암세포를 제거하기 위해 면역세포인 ‘T세포’를 활성화하는데, 종양은 T세포의 기능을 억제하기 위한 환경을 구성한다. 이때 침투한 T세포들은 ‘피디-1(PD-1)’ 단백질과 같은 면역 관문 수용체를 세포 표면에 발현하면서 활성이 저하되고 탈진된 상태가 된다.
‘PD-1 억제제’로 대표되는 면역 관문 억제제는 PD-1 신호에 의해 저하된 T세포의 활성을 회복시키는 역할을 한다. 암세포는 생존을 위해 면역세포로부터 몸을 숨기는데, 면역 관문 억제제는 암세포가 숨는 데 도움을 주는 PD-1, PD-L1의 작용을 차단함으로써 면역세포가 정상적으로 암세포를 공격할 수 있게 되는 것이다.
그러나 면역 관문 억제제는 약 2~30%의 환자에게만 효능이 있고 70% 이상의 환자에게는 효과가 없어 면역항암제의 치료 효능을 높이기 위한 연구가 계속되고 있다.
연구팀은 간암 환자의 탈진한 T세포 중에서 PD-1 단백질을 많이 발현하는 T세포가 그렇지 않은 T세포에 비해 면역세포의 기능이 더 많이 저하돼 있고, PD-1 이외의 다양한 면역 관문 수용체를 동시에 발현하는 것을 발견했다.
특히 간암 환자 중에서 약 절반 정도의 환자만이 PD-1을 많이 발현하는 탈진 T세포를 갖고 있으며, 이러한 환자들이 복합 면역 관문 억제제에 의해 T세포의 기능이 효과적으로 회복됨을 확인했다.
이번 결과를 통해 복합 면역 관문 억제제의 대상이 되는 환자군을 제시함으로써 효과적인 면역 치료를 효율적으로 적용하는 데 기여할 것으로 예상된다.
박 교수는 “이번에 새롭게 제시된 환자군은 현재 적용 중인 면역 관문 억제제 치료의 반응을 예측할 수 있는 바이오 마커로서 유용하게 활용될 수 있다”라며 “복합 면역 관문 억제제가 특정 환자에게만 효능이 있음을 제시해 맞춤 의학의 근거가 될 수 있다는 임상적 의의를 갖는다”라고 말했다.
이번 연구는 보건복지부 첨단의료기술개발 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. PD-1 발현에 따른 각 세포군의 특징적인 유전자 발현 양상
그림2. PD-1을 과발현하는 세포군의 존재 유무에 따른 특징적인 두가지 환자군
박수형 교수, 간암 복합면역치료 적용 가능성 확인
〈 박 수 형 교수 〉
우리 대학 의과학대학원 박수형 교수와 서울아산병원 황신, 송기원 교수 공동연구팀이 간암 환자의 탈진(exhausted)된 종양 침투 면역세포 구성의 차이에 따른 간암 환자군을 구분하는 데 성공했다.
이번 연구를 통해 간암 환자의 새로운 면역치료법 적용 가능성을 확인함으로써 향후 맞춤 의학의 근거를 제시할 수 있는 기반이 될 것으로 기대된다.
특히 이번 연구는 서울아산병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 임상을 통해 새 면역 항암 치료법을 위한 협업을 진행한 것으로 중개 연구(translational research)의 우수 모델로 평가받는다.
김형돈 박사과정이 1저자로 참여한 이번 연구는 국제 학술지 ‘소화기학(Gastroenterology)’ 12월 4일 자에 게재됐다.
암이 발생하면 인체는 암세포를 제거하기 위해 면역세포인 ‘T세포’를 활성화하는데, 종양은 T세포의 기능을 억제하기 위한 환경을 구성한다. 이때 침투한 T세포들은 ‘피디-1(PD-1)’ 단백질과 같은 면역 관문 수용체를 세포 표면에 발현하면서 활성이 저하되고 탈진된 상태가 된다.
‘PD-1 억제제’로 대표되는 면역 관문 억제제는 PD-1 신호에 의해 저하된 T세포의 활성을 회복시키는 역할을 한다. 암세포는 생존을 위해 면역세포로부터 몸을 숨기는데, 면역 관문 억제제는 암세포가 숨는 데 도움을 주는 PD-1, PD-L1의 작용을 차단함으로써 면역세포가 정상적으로 암세포를 공격할 수 있게 되는 것이다.
그러나 면역 관문 억제제는 약 2~30%의 환자에게만 효능이 있고 70% 이상의 환자에게는 효과가 없어 면역항암제의 치료 효능을 높이기 위한 연구가 계속되고 있다.
연구팀은 간암 환자의 탈진한 T세포 중에서 PD-1 단백질을 많이 발현하는 T세포가 그렇지 않은 T세포에 비해 면역세포의 기능이 더 많이 저하돼 있고, PD-1 이외의 다양한 면역 관문 수용체를 동시에 발현하는 것을 발견했다.
특히 간암 환자 중에서 약 절반 정도의 환자만이 PD-1을 많이 발현하는 탈진 T세포를 갖고 있으며, 이러한 환자들이 복합 면역 관문 억제제에 의해 T세포의 기능이 효과적으로 회복됨을 확인했다.
이번 결과를 통해 복합 면역 관문 억제제의 대상이 되는 환자군을 제시함으로써 효과적인 면역 치료를 효율적으로 적용하는 데 기여할 것으로 예상된다.
박 교수는 “이번에 새롭게 제시된 환자군은 현재 적용 중인 면역 관문 억제제 치료의 반응을 예측할 수 있는 바이오 마커로서 유용하게 활용될 수 있다”라며 “복합 면역 관문 억제제가 특정 환자에게만 효능이 있음을 제시해 맞춤 의학의 근거가 될 수 있다는 임상적 의의를 갖는다”라고 말했다.
이번 연구는 보건복지부 첨단의료기술개발 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. PD-1 발현에 따른 각 세포군의 특징적인 유전자 발현 양상
그림2. PD-1을 과발현하는 세포군의 존재 유무에 따른 특징적인 두가지 환자군
2018.12.12
조회수 11044
-
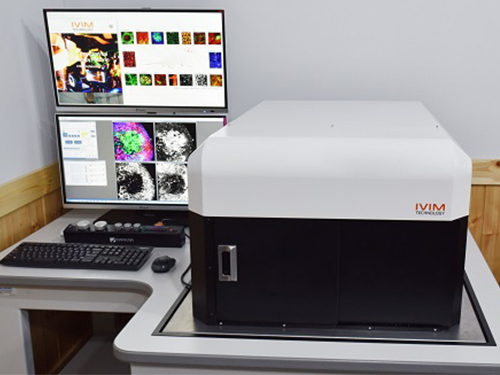 김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
2018.09.05
조회수 15556
-
 신의철, 박수형 교수, 방관자 면역세포의 인체 손상 원리 발견
우리 대학 의과학대학원 신의철, 박수형 교수, 중앙대학교병원 김형준, 이현웅 교수 공동 연구팀이 바이러스 질환에서 방관자 면역세포에 의해 인체 조직이 손상되는 과정을 발견했다.
이번 연구를 통해 바이러스 질환, 면역 질환이 인체를 손상시키는 원리를 이해하고 이를 신약 개발에 적용할 수 있을 것으로 기대된다.
이번 연구 결과는 면역학 분야 국제 학술지 ‘이뮤니티(Immunity)’ 1월자 최신호에 게재됐다.
바이러스에 감염되면 바이러스 증식 자체로 인해 인체 세포가 파괴되지만, 바이러스가 증식해도 직접적으로 인체 세포를 파괴하지 않기도 한다.
하지만 이러한 경우에도 인체 조직은 손상돼 질병을 일으키게 되는데 그 원인이나 과정은 상세히 밝혀지지 않았다. 다만 간염 바이러스에 감염됐을 때 이와 같은 현상이 잘 발생한다는 사실만 알려져 있었다.
면역계의 가장 중요한 특성은 특이성(specificity)으로 바이러스에 감염되면 해당 바이러스에 특이적인 면역세포만 활성화돼 작동을 하고 다른 바이러스들에 특이적인 면역세포들은 활성화되지 않는 것이 일반적이다.
감염된 바이러스가 아닌 다른 바이러스와 관련된 면역세포들이 활성화되는 경우도 있다. 이런 현상은 흔히 ‘방관자 면역세포의 활성화’라는 이름으로 오래 전부터 알려진 현상이다. 하지만 이 현상의 의학적 의미는 불투명했다.
공동 연구팀은 A형 간염 바이러스에 감염된 환자를 분석했다. 연구팀은 해당 바이러스에 특이적인 면역세포뿐 아니라 다른 바이러스에 특이적인 엉뚱한 면역세포들까지 활성화되는 것을 발견했고 이러한 엉뚱한 면역세포에 의해 간 조직이 손상되고 간염이 유발되는 것을 확인했다.
연구팀의 발견은 방관자 면역세포가 인체 손상을 일으키는 데 관여한다는 점을 규명했다는 의의를 갖는다.
이번 발견의 핵심은 바이러스에 감염되면 감염된 인체 조직에서 과다하게 생성되는 면역 사이토카인 물질인 IL-15가 방관자 면역세포들을 활성화시키고, 활성화된 면역세포들은 NKG2D 및 NKp30이라는 수용체를 통해 인체 세포들을 무작위로 파괴할 수 있다는 것이다.
이러한 결과는 IL-15 사이토카인, NKG2D, NKp30 수용체와 결합하는 항체 치료제를 신약 개발하면 바이러스 및 면역 질환에서 발생하는 인체 손상을 막을 수 있다는 중요한 의미를 갖는다.
이번 연구는 중앙대학교 병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 인체에서 새로운 면역학적 원리를 직접 밝히기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과이다.
신 교수는 “면역학에서 불투명했던 방관자 면역세포 활성화의 의학적 의미를 새롭게 발견한 첫 연구사례이다”며 “향후 바이러스 질환 및 면역질환의 인체 손상을 막기 위한 치료제 연구를 계속하겠다”고 말했다.
이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 방관자 면역세포에 의한 인체 손상 과정 개념도
신의철, 박수형 교수, 방관자 면역세포의 인체 손상 원리 발견
우리 대학 의과학대학원 신의철, 박수형 교수, 중앙대학교병원 김형준, 이현웅 교수 공동 연구팀이 바이러스 질환에서 방관자 면역세포에 의해 인체 조직이 손상되는 과정을 발견했다.
이번 연구를 통해 바이러스 질환, 면역 질환이 인체를 손상시키는 원리를 이해하고 이를 신약 개발에 적용할 수 있을 것으로 기대된다.
이번 연구 결과는 면역학 분야 국제 학술지 ‘이뮤니티(Immunity)’ 1월자 최신호에 게재됐다.
바이러스에 감염되면 바이러스 증식 자체로 인해 인체 세포가 파괴되지만, 바이러스가 증식해도 직접적으로 인체 세포를 파괴하지 않기도 한다.
하지만 이러한 경우에도 인체 조직은 손상돼 질병을 일으키게 되는데 그 원인이나 과정은 상세히 밝혀지지 않았다. 다만 간염 바이러스에 감염됐을 때 이와 같은 현상이 잘 발생한다는 사실만 알려져 있었다.
면역계의 가장 중요한 특성은 특이성(specificity)으로 바이러스에 감염되면 해당 바이러스에 특이적인 면역세포만 활성화돼 작동을 하고 다른 바이러스들에 특이적인 면역세포들은 활성화되지 않는 것이 일반적이다.
감염된 바이러스가 아닌 다른 바이러스와 관련된 면역세포들이 활성화되는 경우도 있다. 이런 현상은 흔히 ‘방관자 면역세포의 활성화’라는 이름으로 오래 전부터 알려진 현상이다. 하지만 이 현상의 의학적 의미는 불투명했다.
공동 연구팀은 A형 간염 바이러스에 감염된 환자를 분석했다. 연구팀은 해당 바이러스에 특이적인 면역세포뿐 아니라 다른 바이러스에 특이적인 엉뚱한 면역세포들까지 활성화되는 것을 발견했고 이러한 엉뚱한 면역세포에 의해 간 조직이 손상되고 간염이 유발되는 것을 확인했다.
연구팀의 발견은 방관자 면역세포가 인체 손상을 일으키는 데 관여한다는 점을 규명했다는 의의를 갖는다.
이번 발견의 핵심은 바이러스에 감염되면 감염된 인체 조직에서 과다하게 생성되는 면역 사이토카인 물질인 IL-15가 방관자 면역세포들을 활성화시키고, 활성화된 면역세포들은 NKG2D 및 NKp30이라는 수용체를 통해 인체 세포들을 무작위로 파괴할 수 있다는 것이다.
이러한 결과는 IL-15 사이토카인, NKG2D, NKp30 수용체와 결합하는 항체 치료제를 신약 개발하면 바이러스 및 면역 질환에서 발생하는 인체 손상을 막을 수 있다는 중요한 의미를 갖는다.
이번 연구는 중앙대학교 병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 인체에서 새로운 면역학적 원리를 직접 밝히기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과이다.
신 교수는 “면역학에서 불투명했던 방관자 면역세포 활성화의 의학적 의미를 새롭게 발견한 첫 연구사례이다”며 “향후 바이러스 질환 및 면역질환의 인체 손상을 막기 위한 치료제 연구를 계속하겠다”고 말했다.
이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 방관자 면역세포에 의한 인체 손상 과정 개념도
2018.02.21
조회수 19396
-
 김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27
조회수 21799
-
 신의철, 박수형 교수, 네이처 리뷰 면역학에 초청 리뷰논문 게재
우리 대학 의과학대학원 신의철, 박수형 교수와 카톨릭의대 서울성모병원의 성필수 박사가 국내 과학자로는 최초로 ‘네이처 리뷰 면역학(Nature Reviews Immunology)’8월호에 초청 리뷰논문을 게재했다.
‘네이처 리뷰’저널은 네이처 리뷰로부터 초청받은 세계적 석학들이 해당 분야의 전반적인 내용을 총정리 하는 저널이다. 그 중 ‘네이처 리뷰 면역학’은 면역학 분야의 최고 학술지 중 하나로 불린다.
신 교수와 박 교수는 간염 바이러스 면역에 대한 리뷰논문을 작성했다. 사람에게 간염을 일으키는 A형 및 B형, C형 간염 바이러스에 대한 면역반응의 유사점과 차이점을 총체적으로 고찰하고 미래 연구의 방향을 제시했다.
전 세계에서 3억 5천만 명이 B형 간염 바이러스에, 1억 7천만 명이 C형 간염 바이러스에 감염돼 있다. 그러나 B형 간염 바이러스는 체내에서 바이러스를 완전히 제거하는 치료제가 개발되지 않았고 C형 간염은 예방 백신이 개발되지 않았다.
반면 A형 간염은 간 손상을 일으키는 경우가 있긴 하지만 B, C형과 달리 저절로 완치되는 경우가 많다.
신 교수, 박 교수, 성 박사는 이에 주목해 이번 논문에서 A형 간염 바이러스에 대한 면역반응의 특성을 기반으로 B형 간염 바이러스 완치 치료제 및 C형 간염 바이러스 예방 백신을 개발할 수 있음을 논리적으로 제시했다.
신 교수와 박 교수는 지난 15년간 C형 간염 바이러스에 대한 인체 면역반응 연구에 매진했다. 최근에는 국내에서도 유행했던 A형 간염 바이러스 면역에 대한 새 연구 결과들을 발표했고 공로를 인정받아 초청 리뷰논문을 게재했다.
신 교수는 “이번 초청 리뷰는 KAIST 의과학대학원의 면역학 연구가 세계적 수준으로 도약하고 있음을 증명한 것이다” 며 “면역학 연구에 정진해 인간 질병 해결에 도움이 되겠다”고 말했다.
이번 연구의 C형 간염 관련 연구는 한국연구재단의 지원으로 이뤄졌고, 신 교수는 삼성미래기술육성재단의 지원을 통해 A형 간염 바이러스까지 연구를 확장했다.
신의철, 박수형 교수, 네이처 리뷰 면역학에 초청 리뷰논문 게재
우리 대학 의과학대학원 신의철, 박수형 교수와 카톨릭의대 서울성모병원의 성필수 박사가 국내 과학자로는 최초로 ‘네이처 리뷰 면역학(Nature Reviews Immunology)’8월호에 초청 리뷰논문을 게재했다.
‘네이처 리뷰’저널은 네이처 리뷰로부터 초청받은 세계적 석학들이 해당 분야의 전반적인 내용을 총정리 하는 저널이다. 그 중 ‘네이처 리뷰 면역학’은 면역학 분야의 최고 학술지 중 하나로 불린다.
신 교수와 박 교수는 간염 바이러스 면역에 대한 리뷰논문을 작성했다. 사람에게 간염을 일으키는 A형 및 B형, C형 간염 바이러스에 대한 면역반응의 유사점과 차이점을 총체적으로 고찰하고 미래 연구의 방향을 제시했다.
전 세계에서 3억 5천만 명이 B형 간염 바이러스에, 1억 7천만 명이 C형 간염 바이러스에 감염돼 있다. 그러나 B형 간염 바이러스는 체내에서 바이러스를 완전히 제거하는 치료제가 개발되지 않았고 C형 간염은 예방 백신이 개발되지 않았다.
반면 A형 간염은 간 손상을 일으키는 경우가 있긴 하지만 B, C형과 달리 저절로 완치되는 경우가 많다.
신 교수, 박 교수, 성 박사는 이에 주목해 이번 논문에서 A형 간염 바이러스에 대한 면역반응의 특성을 기반으로 B형 간염 바이러스 완치 치료제 및 C형 간염 바이러스 예방 백신을 개발할 수 있음을 논리적으로 제시했다.
신 교수와 박 교수는 지난 15년간 C형 간염 바이러스에 대한 인체 면역반응 연구에 매진했다. 최근에는 국내에서도 유행했던 A형 간염 바이러스 면역에 대한 새 연구 결과들을 발표했고 공로를 인정받아 초청 리뷰논문을 게재했다.
신 교수는 “이번 초청 리뷰는 KAIST 의과학대학원의 면역학 연구가 세계적 수준으로 도약하고 있음을 증명한 것이다” 며 “면역학 연구에 정진해 인간 질병 해결에 도움이 되겠다”고 말했다.
이번 연구의 C형 간염 관련 연구는 한국연구재단의 지원으로 이뤄졌고, 신 교수는 삼성미래기술육성재단의 지원을 통해 A형 간염 바이러스까지 연구를 확장했다.
2016.08.10
조회수 13620
 인공지능 이용 면역항암 세포 3차원 분석기술 개발
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀이 면역항암 세포의 활동을 정밀하게 측정하고 분석할 수 있는 새로운 3차원 인공지능 분석기술을 개발했다고 28일 밝혔다.
체내에서 면역세포를 추출한 후, 외부에서 면역 능력을 강화시키고 다시 환자에게 주입해 암을 치료하는 방식을 `입양전달 면역세포 치료(adoptive immune cell therapy)'라고 부른다. 이 치료방식은 면역세포 치료법 중 가장 많은 주목을 받는 기술이다. `키메릭 항원 수용체' 또는 `CAR(Chimeric Antigen Receptor)'라고도 불리는 데 유전자 재조합기술을 이용해 T세포와 같은 면역세포를 변형해 암세포와의 반응을 유도해 사멸시키는 치료 방법이다.
특히 CAR-T세포 치료는 높은 치료 효과를 보여 차세대 암 치료제로 급부상하고 있다. 2017년 난치성 B세포 급성 림프구성 백혈병 치료제 판매 승인을 시작으로 현재 3종의 CAR-T 치료제가 판매 승인을 받았으며, 전 세계적으로 약 1,000건 이상의 임상 시험이 진행 중이다. 그러나 아직 우리나라에서는 진행 중인 임상 시험이 전무한 실정이다.
CAR-T 기술을 이용한 암 치료 방법들이 속속 개발되고 있지만, CAR-T세포에 대한 세포‧분자 생물학적 메커니즘은 아직 많은 부분이 알려지지 않았다. 특히, CAR-T세포가 표적 암세포를 인지해 결합한 후 `면역 시냅스 (immunological synapse, 이하 IS)'를 형성해 물질을 전달하고 암세포의 사멸을 유도하는데, 두 세포 간의 거리와 같은 IS의 형태 정보는 T세포 활성화 유도와 관련이 높다고 알려져 있지만 구체적인 내용을 파악하기 어렵기 때문에 이에 대한 연구가 활발히 진행 중이다.
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀은 CAR-T세포의 IS를 정밀하고 체계적으로 연구할 수 있는 새로운 기술을 개발했다. 3D 홀로그래피 현미경 기술을 이용해, 염색이나 전처리 없이 살아있는 상태의 CAR-T세포와 표적 암세포 간의 상호작용을 고속으로 측정하고 기존에는 관찰하기 어려운 CAR-T와 암세포 간의 IS를 고해상도로 실시간 측정했다. 또한 이렇게 측정한 3D 세포 영상을 인공지능 신경망(Convolutional Neural Network, CNN)을 이용해 분석하고, 3차원 공간에서 정확하게 IS 정보를 정량적으로 추출할 수 있는 기술을 자체 개발했다.
공동연구팀은 또 이 기술을 활용해 빠른 CAR-T 면역 관문 형성 메커니즘을 추적할 수 있었을 뿐만 아니라, IS의 형태학적 특성이 CAR-T의 항암 효능과 연관이 있음을 확인했다. 연구팀은 3차원 IS 정보가 새로운 표적 항암 치료제의 초기 연구에 필요한 정량적 지표를 제공할 것이라고 기대하고 있다.
이번 연구에는 우리 대학 기술을 바탕으로 창업한 2개 기업이 공동으로 참여했다. 3차원 홀로그래픽 현미경을 상업화한 토모큐브 社의 현미경 장비를 이용해 면역세포를 측정하는 한편 토모큐브 社의 인공지능 연구팀이 알고리즘 개발에 참여했다. 이밖에 국내 최초 CAR-T 기반 치료제 기업인 ㈜큐로셀도 연구에 함께 참여해 이 같은 성과를 거두는 데 성공했다.
물리학과 이무성 박사과정 학생, 생명과학과 이영호 박사, 물리학과 송진엽 학부생 (現 메사추세츠 공과대학(MIT) 물리학과 박사과정)이 공동 제1 저자로 참여한 이번 연구는 국제적으로 권위를 인정받는 생물학술지인 `이라이프(eLife)' 12월 17일 字 온라인판을 통해 공개됐으며 지난 21일 字에 공식 게재됐다.
(논문명 : Deep-learning based three-dimensional label-free tracking and analysis of immunological synapses of CAR-T cells)
한편 이번 연구는 한국연구재단 리더연구사업, 바이오·의료기술개발사업, 중견연구자지원사업, KAIST Up program의 지원을 받아 수행됐다.
2021.01.29 조회수 77645
인공지능 이용 면역항암 세포 3차원 분석기술 개발
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀이 면역항암 세포의 활동을 정밀하게 측정하고 분석할 수 있는 새로운 3차원 인공지능 분석기술을 개발했다고 28일 밝혔다.
체내에서 면역세포를 추출한 후, 외부에서 면역 능력을 강화시키고 다시 환자에게 주입해 암을 치료하는 방식을 `입양전달 면역세포 치료(adoptive immune cell therapy)'라고 부른다. 이 치료방식은 면역세포 치료법 중 가장 많은 주목을 받는 기술이다. `키메릭 항원 수용체' 또는 `CAR(Chimeric Antigen Receptor)'라고도 불리는 데 유전자 재조합기술을 이용해 T세포와 같은 면역세포를 변형해 암세포와의 반응을 유도해 사멸시키는 치료 방법이다.
특히 CAR-T세포 치료는 높은 치료 효과를 보여 차세대 암 치료제로 급부상하고 있다. 2017년 난치성 B세포 급성 림프구성 백혈병 치료제 판매 승인을 시작으로 현재 3종의 CAR-T 치료제가 판매 승인을 받았으며, 전 세계적으로 약 1,000건 이상의 임상 시험이 진행 중이다. 그러나 아직 우리나라에서는 진행 중인 임상 시험이 전무한 실정이다.
CAR-T 기술을 이용한 암 치료 방법들이 속속 개발되고 있지만, CAR-T세포에 대한 세포‧분자 생물학적 메커니즘은 아직 많은 부분이 알려지지 않았다. 특히, CAR-T세포가 표적 암세포를 인지해 결합한 후 `면역 시냅스 (immunological synapse, 이하 IS)'를 형성해 물질을 전달하고 암세포의 사멸을 유도하는데, 두 세포 간의 거리와 같은 IS의 형태 정보는 T세포 활성화 유도와 관련이 높다고 알려져 있지만 구체적인 내용을 파악하기 어렵기 때문에 이에 대한 연구가 활발히 진행 중이다.
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀은 CAR-T세포의 IS를 정밀하고 체계적으로 연구할 수 있는 새로운 기술을 개발했다. 3D 홀로그래피 현미경 기술을 이용해, 염색이나 전처리 없이 살아있는 상태의 CAR-T세포와 표적 암세포 간의 상호작용을 고속으로 측정하고 기존에는 관찰하기 어려운 CAR-T와 암세포 간의 IS를 고해상도로 실시간 측정했다. 또한 이렇게 측정한 3D 세포 영상을 인공지능 신경망(Convolutional Neural Network, CNN)을 이용해 분석하고, 3차원 공간에서 정확하게 IS 정보를 정량적으로 추출할 수 있는 기술을 자체 개발했다.
공동연구팀은 또 이 기술을 활용해 빠른 CAR-T 면역 관문 형성 메커니즘을 추적할 수 있었을 뿐만 아니라, IS의 형태학적 특성이 CAR-T의 항암 효능과 연관이 있음을 확인했다. 연구팀은 3차원 IS 정보가 새로운 표적 항암 치료제의 초기 연구에 필요한 정량적 지표를 제공할 것이라고 기대하고 있다.
이번 연구에는 우리 대학 기술을 바탕으로 창업한 2개 기업이 공동으로 참여했다. 3차원 홀로그래픽 현미경을 상업화한 토모큐브 社의 현미경 장비를 이용해 면역세포를 측정하는 한편 토모큐브 社의 인공지능 연구팀이 알고리즘 개발에 참여했다. 이밖에 국내 최초 CAR-T 기반 치료제 기업인 ㈜큐로셀도 연구에 함께 참여해 이 같은 성과를 거두는 데 성공했다.
물리학과 이무성 박사과정 학생, 생명과학과 이영호 박사, 물리학과 송진엽 학부생 (現 메사추세츠 공과대학(MIT) 물리학과 박사과정)이 공동 제1 저자로 참여한 이번 연구는 국제적으로 권위를 인정받는 생물학술지인 `이라이프(eLife)' 12월 17일 字 온라인판을 통해 공개됐으며 지난 21일 字에 공식 게재됐다.
(논문명 : Deep-learning based three-dimensional label-free tracking and analysis of immunological synapses of CAR-T cells)
한편 이번 연구는 한국연구재단 리더연구사업, 바이오·의료기술개발사업, 중견연구자지원사업, KAIST Up program의 지원을 받아 수행됐다.
2021.01.29 조회수 77645 이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11 조회수 28893
이흥규 교수 연구팀, 수지상세포 자식작용의 역할 규명
우리 연구진에 의해 세포 항상성을 유지해주는 '자식작용'*의 또 다른 기능이 보고됐다. 의과학대학원 이흥규 교수 연구팀이 T세포*의 항바이러스 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다고 밝혔다.
* 자식작용(自食作用, autophagy) : 세포 내 노폐물 및 손상된 세포 소기관을 제거하여 세포의 항상성을 유지하는 과정이다. 자식작용을 처음 발견한 오스미 요시노리(Ohsumi Yoshinori) 교수가 2016년 노벨 생리의학상을 수상하는 등 세계적으로 활발한 연구가 진행되고 있으며, 최근에는 다양한 병원균을 이기는 면역 반응에서도 중요한 기능을 한다고 보고됐다.
* T세포 : 흉선에서 유래하는 림프구로, 세포의 면역에서 주된 역할을 한다.
수지상세포는 병원균이나 암 항원을 인지해 T세포*의 면역반응을 유도하는 세포이다. 바이러스 항원을 수지상세포가 흡수하고, 자신의 표면에 항원을 제시하여 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용을 통한 세포대사 조절이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항바이러스 효과를 높일 수 있는 원리를 제시했다.
실험결과, 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 해당작용이 증가하고, 이를 통해 T세포 활성화 기능이 높아지고 항바이러스 면역반응이 증가했다.
Atg5가 결손되면 수지상세포의 해당작용이 증가하는데, 이로 인해 MHC 클래스 I 분자가 과발현되고 항원 제시를 통한 T 세포 활성화가 증가한다. 이로 인해 호흡기세포융합바이러스(RSV) 감염 시 항바이러스 면역반응이 더 활성화되어 바이러스가 더 빨리 제거되었다.
이흥규 교수는 "이번 연구를 통해 자식작용이 T세포의 항바이러스 면역반응에 관여하는 기능을 새롭게 규명했다”라고 연구의 의의를 설명하며, “향후 자식작용과 세포 대사를 표적으로하는 항바이러스 치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이번 연구 성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행되었다. 저명한 국제학술지 ‘오토파지(Autophagy)’ 8월 28일 자에 온라인 게재됐다.
수지상세포는 바이러스를 받아들여 이들을 분해해 MHC class I에 항원을 제시하고 CD8+ T세포를 활성화해 항바이러스 면역반응을 유도함. Atg5 유전자 결손 시 해당작용 의존적인 항원 제시 및 사이토카인 분비가 과활성화되어 MHC class I을 통한 CD8+ T세포의 활성이 증가됨. 수지상세포에서 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가되어 바이러스 제거를 촉진시킴.
가. Atg5 유전자 결손 시 정상과 다른 특이한 특징을 갖는 수지상세포가 폐에 유입됨.
나. 수지상 세포 특이적으로 Atg5 결손 시, 항원제시, 해당작용과 대사와 관련된 유전자들이 증가됨.
다. 수지상 세포 특이적으로 Atg5 결손 시, 수지상세포의 해당작용이 증가함.
라. 바이러스 감염 시 항원제시에 중요한 MHC 클래스 I의 발현이 증가함. 반면, 해당작용 억제제(2-DG) 처리 시 발현이 감소함. 즉, MHC 클래스 I의 발현에 해당작용이 중요한 역할을 함.
마. 수지상세포 특이적 Atg5 유전자 결손 시 CD8+ T 세포의 활성화가 증가함.
바. 수지상세포 특이적 Atg5 유전자 결손 시 바이러스의 제거가 더 빠르게 일어남.
2020.09.11 조회수 28893 코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
2020.09.07 조회수 29592
코로나19 감염 중증도 결정하는 인자 발견
코로나19로 위중, 중증 상태인 중환자가 6일 0시 기준 163명을 기록했다. 지난달 19일 12명이었던 위중, 중증 환자는 20여일 만에 13배 넘게 늘어났다. 이러한 심각한 상황에서 우리 연구진이 코로나19 중증 환자와 경증 환자를 쉽게 판별할 수 있는 바이오 마커(표시물)를 발견해 중증 코로나19에 대한 치료제 개발에 기대감을 높였다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 *'호중구'와 *'당질코르티코이드'의 연관성을 밝혀 코로나19의 중증도를 결정짓는 인자를 발견했다고 7일 밝혔다.
☞ 호중구(neutrophil) : 혈액의 전체 백혈구 중 50~70%를 차지하는 선천 면역세포로, 세균이나 곰팡이 감염 등에 대응하는 면역세포이다.
☞ 당질코르티코이드(glucocorticoid) : 글루코코르티코이드라고도 하며 콩팥 근처 부신의 부신 겉질에서 생성되는 호르몬으로, 다양한 신체 기능 조절에 관여한다. 특히, 면역반응을 억제하는 호르몬으로도 알려져 있다.
WHO에 의해 세계적 대유행(팬데믹)으로 지정된 코로나바이러스감염증(COVID-19)은 사람마다 증상이 판이하다. 따라서, 환자의 중증도를 예상 및 판별하기 위해서는 확실한 바이오 마커의 활용이 중요하며, 이들을 선별적으로 치료할 수 있는 표적 치료제가 매우 중요하다.
중증 코로나19 환자들은 급성 호흡곤란 증후군의 증상을 보이고 특히 폐 조직의 심한 손상이 관찰된다. 이에 대응해 호중구 등 다양한 면역세포들이 바이러스 감염으로부터 숙주를 보호하기 위해 면역반응을 보이지만 사이토카인 폭풍(과잉 염증반응)처럼 과도한 면역반응으로 오히려 장기를 손상시킬 수도 있다.
이 교수 연구팀은 유전자 발현 옴니버스(GEO)에 공개된 코로나19 감염 경증 및 중증 환자의 기관지 폐포 세척액에 존재하는 단일세포 유전 정보를 분석했다. 그 결과, 그동안 곰팡이나 세균 감염에서만 중요성이 알려졌고 바이러스 감염 시에는 상대적으로 중요성이 알려지지 않았던 호중구의 과활성화로 인해 중증 코로나19가 발생함을 밝혔다.
특히 연구팀은 대식세포 등의 골수 유래 면역세포 내에서 발현하는 CXCL8과 같은 *케모카인에 의해 호중구 유입이 증가함을 밝혔다. 연구팀은 골수에서 유래한 면역세포 내의 당질코르티코이드 수용체 발현에 따라 CXCL8의 생성이 조절받으며, 이것이 결과적으로 호중구의 유입 및 활성도와 연관됨을 밝혔다.
☞ 케모카인(chemokine): 백혈구유주작용, 활성화작용을 하는 염기성헤파린 결합성 저분자 단백질
이 교수는 "이번 연구 결과는 코로나19의 중증도를 결정하는 바이오 마커를 발굴한 것 뿐만 아니라, 덱사메타손 등의 당질코르티코이드 억제제를 활용해 중증도를 개선할 치료제 개발에 단초를 제공할 수 있을 것으로 기대한다"고 밝혔다.
의과학대학원 박장현 석박사통합과정 대학원생이 제1 저자로 참여한 이번 연구는 국제면역학회연합에서 발간하는 면역학 전문 학술지인 '프론티어스 인 이뮤놀로지(Frontiers in Immunology)' 8월 28일 字 온라인판에 게재됐다. (논문명: Re-analysis of Single Cell Transcriptome Reveals That the NR3C1-CXCL8-Neutrophil Axis Determines the Severity of COVID-19)
한편 이번 연구는 과학기술정보통신부의 코리아 바이오 그랜드 챌린지사업, 신약타겟발굴 및 검증사업 및 KAIST 코로나 대응 과학기술 뉴딜사업을 받아 수행됐다.
2020.09.07 조회수 29592 중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
2020.07.14 조회수 33936
중증 코로나19 환자의 사이토카인 폭풍 원인 찾았다
우리 대학 의과학대학원 신의철 교수와 생명과학과 정인경 교수 연구팀이 서울아산병원 김성한 교수·연세대 세브란스병원 최준용·안진영 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 중증 코로나19 환자에서 나타나는 과잉 염증반응을 일으키는 원인을 발견했다.
과잉 염증반응이란 흔히 '사이토카인 폭풍'이라고도 불리는 증상인데 면역 물질인 사이토카인(cytokine)이 과다하게 분비돼 이 물질이 정상 세포를 공격하는 현상이다.
☞ 사이토카인(cytokine): 면역세포로부터 분비되는 단백질 면역조절제로서 자가분비형 신호전달(autocrine signaling), 측분비 신호전달(paracrine signaling), 내분비 신호전달(endocrine signaling) 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 세포의 증식, 분화, 세포사멸 또는 상처 치료 등에 관여하는 다양한 종류의 사이토카인이 존재하며, 특히 면역과 염증에 관여하는 것이 많다. 세포를 의미하는 접두어인 ‘cyto’와 그리스어로 ‘움직이다’를 의미하는 ‘kinein’으로부터 cytokine이 명명됐다.
☞ 사이토카인 폭풍(cytokine storm): 인체에 바이러스가 침투하였을 때 면역 물질인 사이토카인이 과다하게 분비되어 정상 세포를 공격하는 현상
빠르게 확산하고 있는 코로나19 바이러스는 전 세계적으로 이미 1,300만 명 이상이 감염됐고 이 중 50만 명 이상이 사망했다. 코로나19 바이러스에 감염된 환자들은 경증 질환만을 앓고 자연적으로 회복되는 경우가 많으나, 어떤 환자들은 중증 질환으로 발전해 심한 경우 사망하기도 한다. 흔히 사이토카인 폭풍 때문에 중증 코로나19가 유발된다는 사실이 널리 알려져 있다. 하지만 어떤 이유에서 과잉 염증반응이 일어나는지 구체적인 원인은 아직도 알려지지 않아 중증 코로나19 환자의 치료에 많은 어려움을 겪고 있다.
우리 대학 의과학대학원 이정석 연구원 및 생명과학과 박성완 연구원이 주도한 이번 연구에서 공동연구팀은 중증 및 경증 코로나19 환자로부터 혈액을 얻은 후 면역세포들을 분리하고 단일 세포 유전자발현 분석이라는 최신 연구기법을 적용해 그 특성을 상세히 분석했다. 그 결과, 중증 또는 경증을 막론하고 코로나19 환자의 면역세포에서 염증성 사이토카인의 일종인 종양괴사인자(TNF)와 인터류킨-1(IL-1)이 공통으로 나타나는 현상을 발견했다. 연구팀은 특히 중증과 경증 환자를 비교 분석한 결과, 인터페론이라는 사이토카인 반응이 중증 환자에게서만 특징적으로 강하게 나타남을 확인했다.
☞ 인터페론(interferon): 사이토카인(cytokine)의 일종으로 숙주 세포가 바이러스, 세균, 기생균 등 다양한 병원체에 감염되거나 혹은 암세포 존재 하에서 합성되고 분비되는 당단백질이다. 일반적으로 바이러스에 감염된 세포에서 분비되는 제 1형 인터페론이 많이 알려져 있으며 주변 세포들이 항바이러스 방어 효과를 나타낼 수 있도록 돕는다.
지금까지 인터페론은 항바이러스 작용을 하는 착한(?) 사이토카인으로 알려져 있으나, 공동연구팀은 인터페론 반응이 코로나19 환자에서는 오히려 과도한 염증반응을 촉발하는 원인이 될 수 있다는 사실을 다양한 방법을 통해 이를 증명했다.
삼성미래기술육성재단과 서경배과학재단의 지원을 받아 수행한 공동연구팀의 이번 연구결과는 면역학 분야 국제 학술지인 사이언스 면역학(Science Immunology)誌 7월 10일 字에 게재됐다(논문명: Immunophenotyping of COVID-19 and Influenza Highlights the Role of Type I Interferons in Development of Severe COVID-19).
연구팀은 중증 코로나19 환자의 과잉 염증반응 완화를 위해 현재에는 스테로이드제와 같은 비특이적 항염증 약물이 사용하고 있는데 이번 연구 성과를 계기로 인터페론을 표적으로 하는 새로운 치료방법도 고려할 수 있음을 보여준다며 중증 코로나19 환자 치료에 새로운 패러다임을 제시한 획기적인 연구라고 이 연구에 대한 의미를 부여했다.
관련 학계와 의료계에서도 코로나19의 재확산 등 팬데믹이 지속되는 현 상황에서 KAIST와 대학병원 연구팀이 긴밀한 협력을 통해 코로나19의 면역학적 원리를 밝히고 새로운 치료전략을 제시한 이번 연구를 중개 연구(translational research)의 주요 성과로 높게 평가했다.
공동연구팀은 현재 중증 코로나19 환자의 과잉 염증반응을 완화해 환자 생존율을 높일 수 있는 약물을 시험관 내에서 효율적으로 검색하고 발굴하는 방법을 개발하는 후속연구를 진행중에 있다.
이번 연구를 주도한 이정석 연구원은 내과 전문의로서 의과학대학원 박사과정에 재학 중인데 "중증 코로나19 환자의 의료적 문제를 해결하기 위해 정인경 교수 연구팀과 함께 이번 연구를 긴박하게 시작했는데 서울아산병원과 연세대 세브란스병원·충북대병원의 적극적인 지원에 힘입어 불과 3개월 만에 마칠 수 있게 됐다ˮ고 말했다.
정인경 교수는 "코로나19와 같은 신규 질환의 특성을 신속하게 규명하는데 있어 최신 단일세포 전사체 빅데이터 분석법이 매우 효과적ˮ이었음을 밝혔다.
신의철 교수도 "이번 연구는 코로나19 환자의 면역세포에서 어떤 일이 벌어지는지 상세히 연구함으로써 향후 치료전략을 설계할 수 있는 토대를 마련했다는 점에서 매우 중요하고 의미가 있는 연구ˮ라고 평가했다.
신의철 교수와 정인경 교수는 이와 함께 "중증 코로나19 환자의 생존율을 높일 수 있도록 새로운 면역기전 연구 및 환자 맞춤 항염증 약물 사용에 관한 연구를 지속적으로 수행할 것ˮ이라고 강조했다.
2020.07.14 조회수 33936 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25185
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25185 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17655
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17655 신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
2019.11.13 조회수 12978
신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
2019.11.13 조회수 12978 박수형 교수, 간암 복합면역치료 적용 가능성 확인
〈 박 수 형 교수 〉
우리 대학 의과학대학원 박수형 교수와 서울아산병원 황신, 송기원 교수 공동연구팀이 간암 환자의 탈진(exhausted)된 종양 침투 면역세포 구성의 차이에 따른 간암 환자군을 구분하는 데 성공했다.
이번 연구를 통해 간암 환자의 새로운 면역치료법 적용 가능성을 확인함으로써 향후 맞춤 의학의 근거를 제시할 수 있는 기반이 될 것으로 기대된다.
특히 이번 연구는 서울아산병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 임상을 통해 새 면역 항암 치료법을 위한 협업을 진행한 것으로 중개 연구(translational research)의 우수 모델로 평가받는다.
김형돈 박사과정이 1저자로 참여한 이번 연구는 국제 학술지 ‘소화기학(Gastroenterology)’ 12월 4일 자에 게재됐다.
암이 발생하면 인체는 암세포를 제거하기 위해 면역세포인 ‘T세포’를 활성화하는데, 종양은 T세포의 기능을 억제하기 위한 환경을 구성한다. 이때 침투한 T세포들은 ‘피디-1(PD-1)’ 단백질과 같은 면역 관문 수용체를 세포 표면에 발현하면서 활성이 저하되고 탈진된 상태가 된다.
‘PD-1 억제제’로 대표되는 면역 관문 억제제는 PD-1 신호에 의해 저하된 T세포의 활성을 회복시키는 역할을 한다. 암세포는 생존을 위해 면역세포로부터 몸을 숨기는데, 면역 관문 억제제는 암세포가 숨는 데 도움을 주는 PD-1, PD-L1의 작용을 차단함으로써 면역세포가 정상적으로 암세포를 공격할 수 있게 되는 것이다.
그러나 면역 관문 억제제는 약 2~30%의 환자에게만 효능이 있고 70% 이상의 환자에게는 효과가 없어 면역항암제의 치료 효능을 높이기 위한 연구가 계속되고 있다.
연구팀은 간암 환자의 탈진한 T세포 중에서 PD-1 단백질을 많이 발현하는 T세포가 그렇지 않은 T세포에 비해 면역세포의 기능이 더 많이 저하돼 있고, PD-1 이외의 다양한 면역 관문 수용체를 동시에 발현하는 것을 발견했다.
특히 간암 환자 중에서 약 절반 정도의 환자만이 PD-1을 많이 발현하는 탈진 T세포를 갖고 있으며, 이러한 환자들이 복합 면역 관문 억제제에 의해 T세포의 기능이 효과적으로 회복됨을 확인했다.
이번 결과를 통해 복합 면역 관문 억제제의 대상이 되는 환자군을 제시함으로써 효과적인 면역 치료를 효율적으로 적용하는 데 기여할 것으로 예상된다.
박 교수는 “이번에 새롭게 제시된 환자군은 현재 적용 중인 면역 관문 억제제 치료의 반응을 예측할 수 있는 바이오 마커로서 유용하게 활용될 수 있다”라며 “복합 면역 관문 억제제가 특정 환자에게만 효능이 있음을 제시해 맞춤 의학의 근거가 될 수 있다는 임상적 의의를 갖는다”라고 말했다.
이번 연구는 보건복지부 첨단의료기술개발 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. PD-1 발현에 따른 각 세포군의 특징적인 유전자 발현 양상
그림2. PD-1을 과발현하는 세포군의 존재 유무에 따른 특징적인 두가지 환자군
2018.12.12 조회수 11044
박수형 교수, 간암 복합면역치료 적용 가능성 확인
〈 박 수 형 교수 〉
우리 대학 의과학대학원 박수형 교수와 서울아산병원 황신, 송기원 교수 공동연구팀이 간암 환자의 탈진(exhausted)된 종양 침투 면역세포 구성의 차이에 따른 간암 환자군을 구분하는 데 성공했다.
이번 연구를 통해 간암 환자의 새로운 면역치료법 적용 가능성을 확인함으로써 향후 맞춤 의학의 근거를 제시할 수 있는 기반이 될 것으로 기대된다.
특히 이번 연구는 서울아산병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 임상을 통해 새 면역 항암 치료법을 위한 협업을 진행한 것으로 중개 연구(translational research)의 우수 모델로 평가받는다.
김형돈 박사과정이 1저자로 참여한 이번 연구는 국제 학술지 ‘소화기학(Gastroenterology)’ 12월 4일 자에 게재됐다.
암이 발생하면 인체는 암세포를 제거하기 위해 면역세포인 ‘T세포’를 활성화하는데, 종양은 T세포의 기능을 억제하기 위한 환경을 구성한다. 이때 침투한 T세포들은 ‘피디-1(PD-1)’ 단백질과 같은 면역 관문 수용체를 세포 표면에 발현하면서 활성이 저하되고 탈진된 상태가 된다.
‘PD-1 억제제’로 대표되는 면역 관문 억제제는 PD-1 신호에 의해 저하된 T세포의 활성을 회복시키는 역할을 한다. 암세포는 생존을 위해 면역세포로부터 몸을 숨기는데, 면역 관문 억제제는 암세포가 숨는 데 도움을 주는 PD-1, PD-L1의 작용을 차단함으로써 면역세포가 정상적으로 암세포를 공격할 수 있게 되는 것이다.
그러나 면역 관문 억제제는 약 2~30%의 환자에게만 효능이 있고 70% 이상의 환자에게는 효과가 없어 면역항암제의 치료 효능을 높이기 위한 연구가 계속되고 있다.
연구팀은 간암 환자의 탈진한 T세포 중에서 PD-1 단백질을 많이 발현하는 T세포가 그렇지 않은 T세포에 비해 면역세포의 기능이 더 많이 저하돼 있고, PD-1 이외의 다양한 면역 관문 수용체를 동시에 발현하는 것을 발견했다.
특히 간암 환자 중에서 약 절반 정도의 환자만이 PD-1을 많이 발현하는 탈진 T세포를 갖고 있으며, 이러한 환자들이 복합 면역 관문 억제제에 의해 T세포의 기능이 효과적으로 회복됨을 확인했다.
이번 결과를 통해 복합 면역 관문 억제제의 대상이 되는 환자군을 제시함으로써 효과적인 면역 치료를 효율적으로 적용하는 데 기여할 것으로 예상된다.
박 교수는 “이번에 새롭게 제시된 환자군은 현재 적용 중인 면역 관문 억제제 치료의 반응을 예측할 수 있는 바이오 마커로서 유용하게 활용될 수 있다”라며 “복합 면역 관문 억제제가 특정 환자에게만 효능이 있음을 제시해 맞춤 의학의 근거가 될 수 있다는 임상적 의의를 갖는다”라고 말했다.
이번 연구는 보건복지부 첨단의료기술개발 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. PD-1 발현에 따른 각 세포군의 특징적인 유전자 발현 양상
그림2. PD-1을 과발현하는 세포군의 존재 유무에 따른 특징적인 두가지 환자군
2018.12.12 조회수 11044 김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
2018.09.05 조회수 15556
김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
2018.09.05 조회수 15556 신의철, 박수형 교수, 방관자 면역세포의 인체 손상 원리 발견
우리 대학 의과학대학원 신의철, 박수형 교수, 중앙대학교병원 김형준, 이현웅 교수 공동 연구팀이 바이러스 질환에서 방관자 면역세포에 의해 인체 조직이 손상되는 과정을 발견했다.
이번 연구를 통해 바이러스 질환, 면역 질환이 인체를 손상시키는 원리를 이해하고 이를 신약 개발에 적용할 수 있을 것으로 기대된다.
이번 연구 결과는 면역학 분야 국제 학술지 ‘이뮤니티(Immunity)’ 1월자 최신호에 게재됐다.
바이러스에 감염되면 바이러스 증식 자체로 인해 인체 세포가 파괴되지만, 바이러스가 증식해도 직접적으로 인체 세포를 파괴하지 않기도 한다.
하지만 이러한 경우에도 인체 조직은 손상돼 질병을 일으키게 되는데 그 원인이나 과정은 상세히 밝혀지지 않았다. 다만 간염 바이러스에 감염됐을 때 이와 같은 현상이 잘 발생한다는 사실만 알려져 있었다.
면역계의 가장 중요한 특성은 특이성(specificity)으로 바이러스에 감염되면 해당 바이러스에 특이적인 면역세포만 활성화돼 작동을 하고 다른 바이러스들에 특이적인 면역세포들은 활성화되지 않는 것이 일반적이다.
감염된 바이러스가 아닌 다른 바이러스와 관련된 면역세포들이 활성화되는 경우도 있다. 이런 현상은 흔히 ‘방관자 면역세포의 활성화’라는 이름으로 오래 전부터 알려진 현상이다. 하지만 이 현상의 의학적 의미는 불투명했다.
공동 연구팀은 A형 간염 바이러스에 감염된 환자를 분석했다. 연구팀은 해당 바이러스에 특이적인 면역세포뿐 아니라 다른 바이러스에 특이적인 엉뚱한 면역세포들까지 활성화되는 것을 발견했고 이러한 엉뚱한 면역세포에 의해 간 조직이 손상되고 간염이 유발되는 것을 확인했다.
연구팀의 발견은 방관자 면역세포가 인체 손상을 일으키는 데 관여한다는 점을 규명했다는 의의를 갖는다.
이번 발견의 핵심은 바이러스에 감염되면 감염된 인체 조직에서 과다하게 생성되는 면역 사이토카인 물질인 IL-15가 방관자 면역세포들을 활성화시키고, 활성화된 면역세포들은 NKG2D 및 NKp30이라는 수용체를 통해 인체 세포들을 무작위로 파괴할 수 있다는 것이다.
이러한 결과는 IL-15 사이토카인, NKG2D, NKp30 수용체와 결합하는 항체 치료제를 신약 개발하면 바이러스 및 면역 질환에서 발생하는 인체 손상을 막을 수 있다는 중요한 의미를 갖는다.
이번 연구는 중앙대학교 병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 인체에서 새로운 면역학적 원리를 직접 밝히기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과이다.
신 교수는 “면역학에서 불투명했던 방관자 면역세포 활성화의 의학적 의미를 새롭게 발견한 첫 연구사례이다”며 “향후 바이러스 질환 및 면역질환의 인체 손상을 막기 위한 치료제 연구를 계속하겠다”고 말했다.
이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 방관자 면역세포에 의한 인체 손상 과정 개념도
2018.02.21 조회수 19396
신의철, 박수형 교수, 방관자 면역세포의 인체 손상 원리 발견
우리 대학 의과학대학원 신의철, 박수형 교수, 중앙대학교병원 김형준, 이현웅 교수 공동 연구팀이 바이러스 질환에서 방관자 면역세포에 의해 인체 조직이 손상되는 과정을 발견했다.
이번 연구를 통해 바이러스 질환, 면역 질환이 인체를 손상시키는 원리를 이해하고 이를 신약 개발에 적용할 수 있을 것으로 기대된다.
이번 연구 결과는 면역학 분야 국제 학술지 ‘이뮤니티(Immunity)’ 1월자 최신호에 게재됐다.
바이러스에 감염되면 바이러스 증식 자체로 인해 인체 세포가 파괴되지만, 바이러스가 증식해도 직접적으로 인체 세포를 파괴하지 않기도 한다.
하지만 이러한 경우에도 인체 조직은 손상돼 질병을 일으키게 되는데 그 원인이나 과정은 상세히 밝혀지지 않았다. 다만 간염 바이러스에 감염됐을 때 이와 같은 현상이 잘 발생한다는 사실만 알려져 있었다.
면역계의 가장 중요한 특성은 특이성(specificity)으로 바이러스에 감염되면 해당 바이러스에 특이적인 면역세포만 활성화돼 작동을 하고 다른 바이러스들에 특이적인 면역세포들은 활성화되지 않는 것이 일반적이다.
감염된 바이러스가 아닌 다른 바이러스와 관련된 면역세포들이 활성화되는 경우도 있다. 이런 현상은 흔히 ‘방관자 면역세포의 활성화’라는 이름으로 오래 전부터 알려진 현상이다. 하지만 이 현상의 의학적 의미는 불투명했다.
공동 연구팀은 A형 간염 바이러스에 감염된 환자를 분석했다. 연구팀은 해당 바이러스에 특이적인 면역세포뿐 아니라 다른 바이러스에 특이적인 엉뚱한 면역세포들까지 활성화되는 것을 발견했고 이러한 엉뚱한 면역세포에 의해 간 조직이 손상되고 간염이 유발되는 것을 확인했다.
연구팀의 발견은 방관자 면역세포가 인체 손상을 일으키는 데 관여한다는 점을 규명했다는 의의를 갖는다.
이번 발견의 핵심은 바이러스에 감염되면 감염된 인체 조직에서 과다하게 생성되는 면역 사이토카인 물질인 IL-15가 방관자 면역세포들을 활성화시키고, 활성화된 면역세포들은 NKG2D 및 NKp30이라는 수용체를 통해 인체 세포들을 무작위로 파괴할 수 있다는 것이다.
이러한 결과는 IL-15 사이토카인, NKG2D, NKp30 수용체와 결합하는 항체 치료제를 신약 개발하면 바이러스 및 면역 질환에서 발생하는 인체 손상을 막을 수 있다는 중요한 의미를 갖는다.
이번 연구는 중앙대학교 병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 인체에서 새로운 면역학적 원리를 직접 밝히기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과이다.
신 교수는 “면역학에서 불투명했던 방관자 면역세포 활성화의 의학적 의미를 새롭게 발견한 첫 연구사례이다”며 “향후 바이러스 질환 및 면역질환의 인체 손상을 막기 위한 치료제 연구를 계속하겠다”고 말했다.
이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 방관자 면역세포에 의한 인체 손상 과정 개념도
2018.02.21 조회수 19396 김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21799
김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21799 신의철, 박수형 교수, 네이처 리뷰 면역학에 초청 리뷰논문 게재
우리 대학 의과학대학원 신의철, 박수형 교수와 카톨릭의대 서울성모병원의 성필수 박사가 국내 과학자로는 최초로 ‘네이처 리뷰 면역학(Nature Reviews Immunology)’8월호에 초청 리뷰논문을 게재했다.
‘네이처 리뷰’저널은 네이처 리뷰로부터 초청받은 세계적 석학들이 해당 분야의 전반적인 내용을 총정리 하는 저널이다. 그 중 ‘네이처 리뷰 면역학’은 면역학 분야의 최고 학술지 중 하나로 불린다.
신 교수와 박 교수는 간염 바이러스 면역에 대한 리뷰논문을 작성했다. 사람에게 간염을 일으키는 A형 및 B형, C형 간염 바이러스에 대한 면역반응의 유사점과 차이점을 총체적으로 고찰하고 미래 연구의 방향을 제시했다.
전 세계에서 3억 5천만 명이 B형 간염 바이러스에, 1억 7천만 명이 C형 간염 바이러스에 감염돼 있다. 그러나 B형 간염 바이러스는 체내에서 바이러스를 완전히 제거하는 치료제가 개발되지 않았고 C형 간염은 예방 백신이 개발되지 않았다.
반면 A형 간염은 간 손상을 일으키는 경우가 있긴 하지만 B, C형과 달리 저절로 완치되는 경우가 많다.
신 교수, 박 교수, 성 박사는 이에 주목해 이번 논문에서 A형 간염 바이러스에 대한 면역반응의 특성을 기반으로 B형 간염 바이러스 완치 치료제 및 C형 간염 바이러스 예방 백신을 개발할 수 있음을 논리적으로 제시했다.
신 교수와 박 교수는 지난 15년간 C형 간염 바이러스에 대한 인체 면역반응 연구에 매진했다. 최근에는 국내에서도 유행했던 A형 간염 바이러스 면역에 대한 새 연구 결과들을 발표했고 공로를 인정받아 초청 리뷰논문을 게재했다.
신 교수는 “이번 초청 리뷰는 KAIST 의과학대학원의 면역학 연구가 세계적 수준으로 도약하고 있음을 증명한 것이다” 며 “면역학 연구에 정진해 인간 질병 해결에 도움이 되겠다”고 말했다.
이번 연구의 C형 간염 관련 연구는 한국연구재단의 지원으로 이뤄졌고, 신 교수는 삼성미래기술육성재단의 지원을 통해 A형 간염 바이러스까지 연구를 확장했다.
2016.08.10 조회수 13620
신의철, 박수형 교수, 네이처 리뷰 면역학에 초청 리뷰논문 게재
우리 대학 의과학대학원 신의철, 박수형 교수와 카톨릭의대 서울성모병원의 성필수 박사가 국내 과학자로는 최초로 ‘네이처 리뷰 면역학(Nature Reviews Immunology)’8월호에 초청 리뷰논문을 게재했다.
‘네이처 리뷰’저널은 네이처 리뷰로부터 초청받은 세계적 석학들이 해당 분야의 전반적인 내용을 총정리 하는 저널이다. 그 중 ‘네이처 리뷰 면역학’은 면역학 분야의 최고 학술지 중 하나로 불린다.
신 교수와 박 교수는 간염 바이러스 면역에 대한 리뷰논문을 작성했다. 사람에게 간염을 일으키는 A형 및 B형, C형 간염 바이러스에 대한 면역반응의 유사점과 차이점을 총체적으로 고찰하고 미래 연구의 방향을 제시했다.
전 세계에서 3억 5천만 명이 B형 간염 바이러스에, 1억 7천만 명이 C형 간염 바이러스에 감염돼 있다. 그러나 B형 간염 바이러스는 체내에서 바이러스를 완전히 제거하는 치료제가 개발되지 않았고 C형 간염은 예방 백신이 개발되지 않았다.
반면 A형 간염은 간 손상을 일으키는 경우가 있긴 하지만 B, C형과 달리 저절로 완치되는 경우가 많다.
신 교수, 박 교수, 성 박사는 이에 주목해 이번 논문에서 A형 간염 바이러스에 대한 면역반응의 특성을 기반으로 B형 간염 바이러스 완치 치료제 및 C형 간염 바이러스 예방 백신을 개발할 수 있음을 논리적으로 제시했다.
신 교수와 박 교수는 지난 15년간 C형 간염 바이러스에 대한 인체 면역반응 연구에 매진했다. 최근에는 국내에서도 유행했던 A형 간염 바이러스 면역에 대한 새 연구 결과들을 발표했고 공로를 인정받아 초청 리뷰논문을 게재했다.
신 교수는 “이번 초청 리뷰는 KAIST 의과학대학원의 면역학 연구가 세계적 수준으로 도약하고 있음을 증명한 것이다” 며 “면역학 연구에 정진해 인간 질병 해결에 도움이 되겠다”고 말했다.
이번 연구의 C형 간염 관련 연구는 한국연구재단의 지원으로 이뤄졌고, 신 교수는 삼성미래기술육성재단의 지원을 통해 A형 간염 바이러스까지 연구를 확장했다.
2016.08.10 조회수 13620