-
 박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06
조회수 20406
-
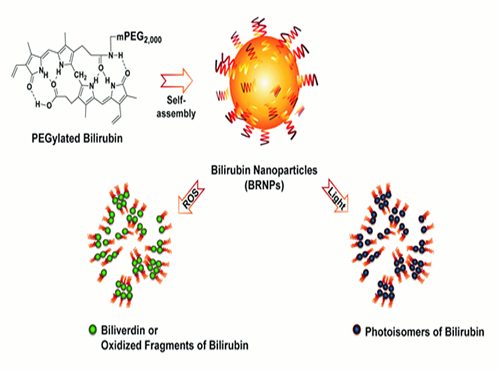 전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18
조회수 18806
-
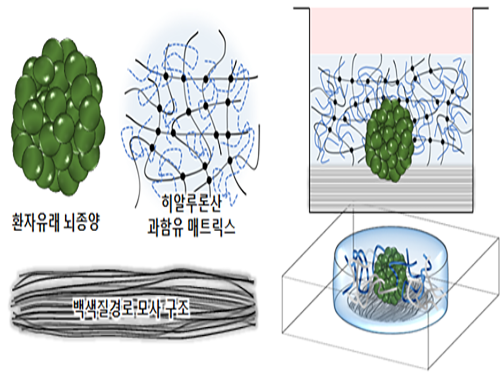 김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
2016.05.11
조회수 16881
-
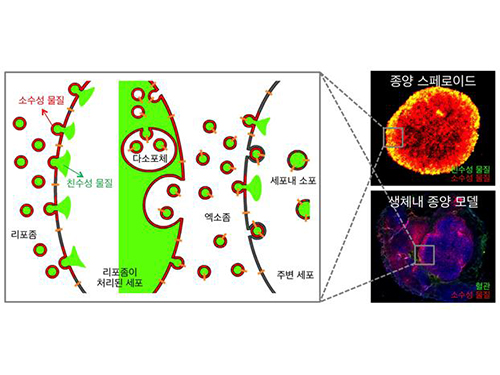 종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
2015.04.06
조회수 17729
-
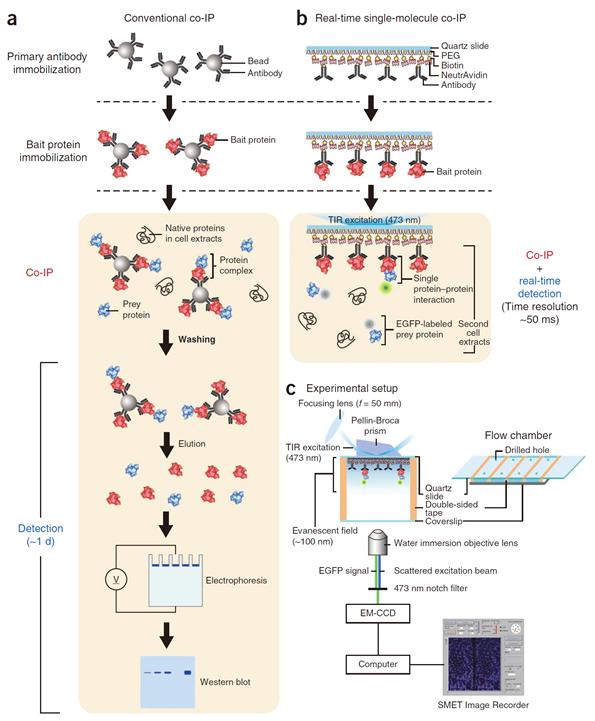 단분자 수준 단백질 상호작용 측정 성공
- 하나의 분자 수준에서 두 단백질 상호작용 실시간 관찰 성공 -- 면역침강 기법의 측정한계와 시간분해능 십만 배 향상 -
우리 학교 물리학과 윤태영 교수 연구팀이 하나의 분자 수준에서 실시간으로 두 단백질 사이의 상호작용을 관찰하는 기술을 개발한 연구 결과가 ‘네이처 프로토콜스 (Nature Protocols)’ 10월 호에 초청 논문으로 게재됐다.
윤 교수 연구팀은 먼저 하나의 분자까지 관찰할 수 있는 형광현미경을 개발했다.
연구팀은 분자생물학에서 단백질 상호작용 분석에 전통적으로 사용되는 ‘면역침강기법’을 개발한 현미경과 접목함으로써 ‘실시간 단분자 면역침강기법’을 개발해냈다. 이를 통해 연구팀은 순간적으로 상호작용이 반복되는 두 단백질의 반응을 수십 밀리 초 단위에서 정밀하게 관측하는데 성공하였다.
기존의 면역침강기법은 두 단백질 사이의 상호작용을 검출하기 위해 최소 1일 이상의 시간이 소요되었다. 이로 인해 약한 상호작용이나 순간적인 작용을 검출해 내는데 있어 그 한계가 있었다. 또한 결과로 나타난 그림이 단백질 밴드의 세기로 측정되므로 정량적인 분석이 어렵고, 실시간 관측이 불가능한 단점이 있었다.
연구팀은 이러한 기존 방법을 대폭 개량함과 동시에 단분자 수준에서 정밀한 기법을 개발해 내고자 하였다. 새롭게 개발된 기술을 사용하면, 1시간 이내에 원하는 단백질 사이의 상호작용을 관측할 수 있게 된다. 또한 두 단백질의 상호작용을 실시간으로 측정할 수 있으므로 상호작용의 현상을 보다 심도있게 측정하고, 계량할 수 있는 것이다.
또한 실험에 사용되는 모든 프로그램을 연구팀에서 직접 제작, 배포하여 본 기법에 대한 원천기술을 확보함과 동시에, 세계적인 인프라를 구축하는데 있어 토대를 마련하기도 하였다.
윤태영 교수는 “이번에 개발한 기술은 별도의 단백질 발현이나 정제과정을 필요로 하지 않아 매우 미량의 단백질 샘플만 주어져도 그 상호작용을 단분자 동역학 수준에서 매우 정밀하게 분석할 수 있다”며 “암 환자 조직에서 얻어진 발암 단백질도 정확히 분석할 수 있어 향후 맞춤형 항암제 개발을 위한 플랫폼을 마련할 수 있다”고 전했다.
그림1. 기존의 면역침강법과 새로이 개발된 실시간 단분자 면역침강법의 비교 모식도
단분자 수준 단백질 상호작용 측정 성공
- 하나의 분자 수준에서 두 단백질 상호작용 실시간 관찰 성공 -- 면역침강 기법의 측정한계와 시간분해능 십만 배 향상 -
우리 학교 물리학과 윤태영 교수 연구팀이 하나의 분자 수준에서 실시간으로 두 단백질 사이의 상호작용을 관찰하는 기술을 개발한 연구 결과가 ‘네이처 프로토콜스 (Nature Protocols)’ 10월 호에 초청 논문으로 게재됐다.
윤 교수 연구팀은 먼저 하나의 분자까지 관찰할 수 있는 형광현미경을 개발했다.
연구팀은 분자생물학에서 단백질 상호작용 분석에 전통적으로 사용되는 ‘면역침강기법’을 개발한 현미경과 접목함으로써 ‘실시간 단분자 면역침강기법’을 개발해냈다. 이를 통해 연구팀은 순간적으로 상호작용이 반복되는 두 단백질의 반응을 수십 밀리 초 단위에서 정밀하게 관측하는데 성공하였다.
기존의 면역침강기법은 두 단백질 사이의 상호작용을 검출하기 위해 최소 1일 이상의 시간이 소요되었다. 이로 인해 약한 상호작용이나 순간적인 작용을 검출해 내는데 있어 그 한계가 있었다. 또한 결과로 나타난 그림이 단백질 밴드의 세기로 측정되므로 정량적인 분석이 어렵고, 실시간 관측이 불가능한 단점이 있었다.
연구팀은 이러한 기존 방법을 대폭 개량함과 동시에 단분자 수준에서 정밀한 기법을 개발해 내고자 하였다. 새롭게 개발된 기술을 사용하면, 1시간 이내에 원하는 단백질 사이의 상호작용을 관측할 수 있게 된다. 또한 두 단백질의 상호작용을 실시간으로 측정할 수 있으므로 상호작용의 현상을 보다 심도있게 측정하고, 계량할 수 있는 것이다.
또한 실험에 사용되는 모든 프로그램을 연구팀에서 직접 제작, 배포하여 본 기법에 대한 원천기술을 확보함과 동시에, 세계적인 인프라를 구축하는데 있어 토대를 마련하기도 하였다.
윤태영 교수는 “이번에 개발한 기술은 별도의 단백질 발현이나 정제과정을 필요로 하지 않아 매우 미량의 단백질 샘플만 주어져도 그 상호작용을 단분자 동역학 수준에서 매우 정밀하게 분석할 수 있다”며 “암 환자 조직에서 얻어진 발암 단백질도 정확히 분석할 수 있어 향후 맞춤형 항암제 개발을 위한 플랫폼을 마련할 수 있다”고 전했다.
그림1. 기존의 면역침강법과 새로이 개발된 실시간 단분자 면역침강법의 비교 모식도
2013.11.25
조회수 20054
-
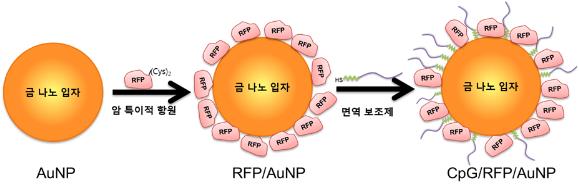 금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
2012.08.16
조회수 18658
-
 시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12
조회수 26898
-
 난소암환자의 보다 정확한 생존기간 예측 가능해져
- “개인 맞춤형 의약품 개발에 핵심 기술이 될 것” -
난소암환자의 생존기간 예측이 한층 더 정확해진다!
우리 학교 바이오 및 뇌공학과 이도헌 교수 연구팀이 난소암환자의 선천적 유전특징과 후천적 유전자 발현특성이 복합적으로 영향을 미친다는 결과를 이용해 암환자의 생존기간을 보다 정확하게 예측하는 기술을 개발했다.
이번 연구 결과는 개인맞춤형 의약품개발에 핵심기술이 될 전망이다.
기존의 난소암환자 생존기간 예측을 위해 특이 유전자형과 유전자 발현 특성을 각각 찾는 데 초점을 맞추고 있었다. 그러나 암과 같이 개인의 유전적 특성과 후천적 요인에 따른 유전자 발현 패턴이 복합적으로 작용하는 복합질환의 치료효과와 생존기간을 예측하기에는 역부족이었다.
연구팀은 생물정보학(Bioinformatics) 기술 중 하나인 상호연관 네트워크 모델링을 이용해 개인별 유전자의 특징과 발현특성을 분석했다. 이를 생존기간의 인자로 사용해 난소암환자 생존기간 예측의 정확도를 13% 이상 높일 수 있었다.
또한, 항암치료 후 결과의 개인차를 유발하는 유전적 특성과 유전자 발현패턴의 상호작용모델을 제시함으로써 개인차에 의한 항암 치료 생존기간의 예측이 가능해졌다.
이도헌 교수는 “최근 전 세계적으로 차세대 유전자 연구와 개인 맞춤형 치료제 개발이 본격화되고 있는 시기”라며 “이번 연구 결과는 난소암 환자의 생존기간 예측 및 개인별 특성에 따른 맞춤형 치료의 기반이 될 것이다”라고 말했다.
KAIST 바이오 및 뇌공학과 이도헌 교수, 백효정 박사과정 학생, 김준호 박사과정 학생, 하버드대 이은정 박사, 삼성SDS 박인호 박사가 공동으로 실시한 이번 연구는 세계적 학술지인 ‘지노믹스(Genomics)’지 6월호 표지 논문으로 선정됐다.
난소암환자의 보다 정확한 생존기간 예측 가능해져
- “개인 맞춤형 의약품 개발에 핵심 기술이 될 것” -
난소암환자의 생존기간 예측이 한층 더 정확해진다!
우리 학교 바이오 및 뇌공학과 이도헌 교수 연구팀이 난소암환자의 선천적 유전특징과 후천적 유전자 발현특성이 복합적으로 영향을 미친다는 결과를 이용해 암환자의 생존기간을 보다 정확하게 예측하는 기술을 개발했다.
이번 연구 결과는 개인맞춤형 의약품개발에 핵심기술이 될 전망이다.
기존의 난소암환자 생존기간 예측을 위해 특이 유전자형과 유전자 발현 특성을 각각 찾는 데 초점을 맞추고 있었다. 그러나 암과 같이 개인의 유전적 특성과 후천적 요인에 따른 유전자 발현 패턴이 복합적으로 작용하는 복합질환의 치료효과와 생존기간을 예측하기에는 역부족이었다.
연구팀은 생물정보학(Bioinformatics) 기술 중 하나인 상호연관 네트워크 모델링을 이용해 개인별 유전자의 특징과 발현특성을 분석했다. 이를 생존기간의 인자로 사용해 난소암환자 생존기간 예측의 정확도를 13% 이상 높일 수 있었다.
또한, 항암치료 후 결과의 개인차를 유발하는 유전적 특성과 유전자 발현패턴의 상호작용모델을 제시함으로써 개인차에 의한 항암 치료 생존기간의 예측이 가능해졌다.
이도헌 교수는 “최근 전 세계적으로 차세대 유전자 연구와 개인 맞춤형 치료제 개발이 본격화되고 있는 시기”라며 “이번 연구 결과는 난소암 환자의 생존기간 예측 및 개인별 특성에 따른 맞춤형 치료의 기반이 될 것이다”라고 말했다.
KAIST 바이오 및 뇌공학과 이도헌 교수, 백효정 박사과정 학생, 김준호 박사과정 학생, 하버드대 이은정 박사, 삼성SDS 박인호 박사가 공동으로 실시한 이번 연구는 세계적 학술지인 ‘지노믹스(Genomics)’지 6월호 표지 논문으로 선정됐다.
2011.06.28
조회수 19638
-
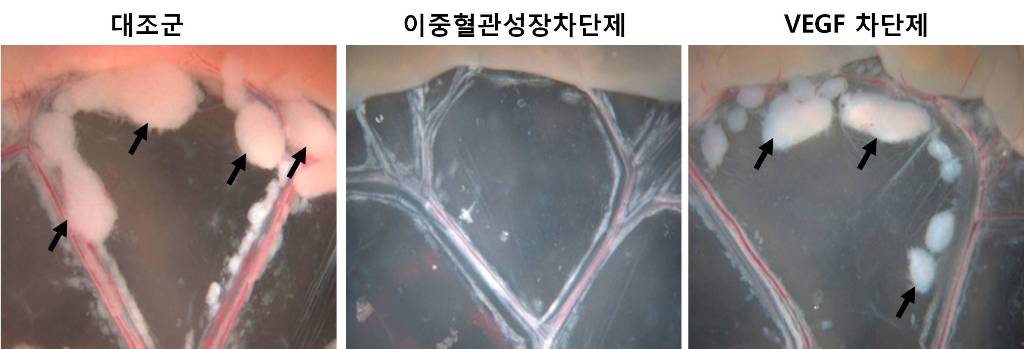 암 성장과 전이를 억제하는 혈관신생차단제 개발
-캔서 셀誌 표지논문 선정, “부작용 적고 효과 탁월한 신개념 항암치료제 개발 가능성 열어”-
국내 연구진이 암 성장과 전이에 필수적인 혈관신생*에 관여하는 새로운 인자를 발견하고 이를 효과적으로 차단하는 제재를 개발하여, 신개념 암 치료제 개발에 전기를 마련하였다. * 혈관신생(angiogenesis) : 몸속에 새로운 혈관이 만들어지는 현상으로, 악성 종양(암)의 성장과 전이에 매우 중요한 과정
우리학교 의과학대학원 고규영 교수와 삼성의료원 남도현 교수가 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원사업(도약연구)과 삼성의료원의 난치암정복연구사업의 지원을 받아 수행되었다.
이번 연구결과는 암 분야 최고 권위의 학술지인 ‘캔서 셀(Cancer Cell, IF=25.3)’ 표지 논문(8월 17일자)에 선정되었으며, 국내 연구진이 주도한 연구업적이 “캔서 셀”에 표지 논문으로 게재된 것은 이번이 처음이다.
고규영 교수팀은 기존의 혈관성장인자*(VEGF) 이외에 또 다른 성장인자(안지오포이에틴-2, Ang2)가 혈관신생을 촉진한다는 사실을 새롭게 발견하고, 두 인자를 효과적으로 차단하는 “이중혈관성장차단제”를 개발하는데 성공하였다. * 혈관성장인자 : 혈관신생을 촉진하는 인자로, 지금까지 VEGF가 대표적인 인자로 인식되었으나, 고 교수팀이 Ang2도 암의 혈관신생을 촉진한다는 사실을 새롭게 발견함.
지금까지 의학계에서는 VEGF가 혈관신생에 중추적인 역할을 수행하는 것으로 인식하여, 이를 억제하는 항암제인 아바스틴(Avastin)을 개발하여 암 환자들에게 투여해왔다. 그러나 항암 효과가 크지 않고 오히려 암을 촉진시키는(전체 환자 50%) 등 부작용이 적지 않아 치료에 어려움이 있었다.
고 교수팀은 VEGF 억제제를 투여하자 Ang2가 급격히 증가한다는 사실을 발견하고, VEGF과 Ang2을 동시에 차단하는 “이중혈관성장 차단제”를 제작하여 환자에게 투여한 결과, 기존의 VEGF만을 차단했던 제재보다 암 성장(2.1배)과 전이(6.5배)를 효과적으로 차단한다는 사실을 검증하였다.
고 교수는 “Ang2가 VEGF 못지않게 중요한 혈관신생인자라는 사실을 새롭게 확인하여, 두 인자를 동시에 효과적으로 차단하는 ‘이중 혈관성장차단제’ 개발에 성공함으로써, 효과는 탁월하지만 부작용은 적은 신개념 항암치료제 신약 개발에 새로운 가능성을 제시하였다”라고 연구의의를 밝혔다.
암 성장과 전이를 억제하는 혈관신생차단제 개발
-캔서 셀誌 표지논문 선정, “부작용 적고 효과 탁월한 신개념 항암치료제 개발 가능성 열어”-
국내 연구진이 암 성장과 전이에 필수적인 혈관신생*에 관여하는 새로운 인자를 발견하고 이를 효과적으로 차단하는 제재를 개발하여, 신개념 암 치료제 개발에 전기를 마련하였다. * 혈관신생(angiogenesis) : 몸속에 새로운 혈관이 만들어지는 현상으로, 악성 종양(암)의 성장과 전이에 매우 중요한 과정
우리학교 의과학대학원 고규영 교수와 삼성의료원 남도현 교수가 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원사업(도약연구)과 삼성의료원의 난치암정복연구사업의 지원을 받아 수행되었다.
이번 연구결과는 암 분야 최고 권위의 학술지인 ‘캔서 셀(Cancer Cell, IF=25.3)’ 표지 논문(8월 17일자)에 선정되었으며, 국내 연구진이 주도한 연구업적이 “캔서 셀”에 표지 논문으로 게재된 것은 이번이 처음이다.
고규영 교수팀은 기존의 혈관성장인자*(VEGF) 이외에 또 다른 성장인자(안지오포이에틴-2, Ang2)가 혈관신생을 촉진한다는 사실을 새롭게 발견하고, 두 인자를 효과적으로 차단하는 “이중혈관성장차단제”를 개발하는데 성공하였다. * 혈관성장인자 : 혈관신생을 촉진하는 인자로, 지금까지 VEGF가 대표적인 인자로 인식되었으나, 고 교수팀이 Ang2도 암의 혈관신생을 촉진한다는 사실을 새롭게 발견함.
지금까지 의학계에서는 VEGF가 혈관신생에 중추적인 역할을 수행하는 것으로 인식하여, 이를 억제하는 항암제인 아바스틴(Avastin)을 개발하여 암 환자들에게 투여해왔다. 그러나 항암 효과가 크지 않고 오히려 암을 촉진시키는(전체 환자 50%) 등 부작용이 적지 않아 치료에 어려움이 있었다.
고 교수팀은 VEGF 억제제를 투여하자 Ang2가 급격히 증가한다는 사실을 발견하고, VEGF과 Ang2을 동시에 차단하는 “이중혈관성장 차단제”를 제작하여 환자에게 투여한 결과, 기존의 VEGF만을 차단했던 제재보다 암 성장(2.1배)과 전이(6.5배)를 효과적으로 차단한다는 사실을 검증하였다.
고 교수는 “Ang2가 VEGF 못지않게 중요한 혈관신생인자라는 사실을 새롭게 확인하여, 두 인자를 동시에 효과적으로 차단하는 ‘이중 혈관성장차단제’ 개발에 성공함으로써, 효과는 탁월하지만 부작용은 적은 신개념 항암치료제 신약 개발에 새로운 가능성을 제시하였다”라고 연구의의를 밝혔다.
2010.08.18
조회수 19461
-
 박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10
조회수 22089
 박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06 조회수 20406
박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06 조회수 20406 전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18806
전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18806 김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
2016.05.11 조회수 16881
김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
2016.05.11 조회수 16881 종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
2015.04.06 조회수 17729
종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
2015.04.06 조회수 17729 단분자 수준 단백질 상호작용 측정 성공
- 하나의 분자 수준에서 두 단백질 상호작용 실시간 관찰 성공 -- 면역침강 기법의 측정한계와 시간분해능 십만 배 향상 -
우리 학교 물리학과 윤태영 교수 연구팀이 하나의 분자 수준에서 실시간으로 두 단백질 사이의 상호작용을 관찰하는 기술을 개발한 연구 결과가 ‘네이처 프로토콜스 (Nature Protocols)’ 10월 호에 초청 논문으로 게재됐다.
윤 교수 연구팀은 먼저 하나의 분자까지 관찰할 수 있는 형광현미경을 개발했다.
연구팀은 분자생물학에서 단백질 상호작용 분석에 전통적으로 사용되는 ‘면역침강기법’을 개발한 현미경과 접목함으로써 ‘실시간 단분자 면역침강기법’을 개발해냈다. 이를 통해 연구팀은 순간적으로 상호작용이 반복되는 두 단백질의 반응을 수십 밀리 초 단위에서 정밀하게 관측하는데 성공하였다.
기존의 면역침강기법은 두 단백질 사이의 상호작용을 검출하기 위해 최소 1일 이상의 시간이 소요되었다. 이로 인해 약한 상호작용이나 순간적인 작용을 검출해 내는데 있어 그 한계가 있었다. 또한 결과로 나타난 그림이 단백질 밴드의 세기로 측정되므로 정량적인 분석이 어렵고, 실시간 관측이 불가능한 단점이 있었다.
연구팀은 이러한 기존 방법을 대폭 개량함과 동시에 단분자 수준에서 정밀한 기법을 개발해 내고자 하였다. 새롭게 개발된 기술을 사용하면, 1시간 이내에 원하는 단백질 사이의 상호작용을 관측할 수 있게 된다. 또한 두 단백질의 상호작용을 실시간으로 측정할 수 있으므로 상호작용의 현상을 보다 심도있게 측정하고, 계량할 수 있는 것이다.
또한 실험에 사용되는 모든 프로그램을 연구팀에서 직접 제작, 배포하여 본 기법에 대한 원천기술을 확보함과 동시에, 세계적인 인프라를 구축하는데 있어 토대를 마련하기도 하였다.
윤태영 교수는 “이번에 개발한 기술은 별도의 단백질 발현이나 정제과정을 필요로 하지 않아 매우 미량의 단백질 샘플만 주어져도 그 상호작용을 단분자 동역학 수준에서 매우 정밀하게 분석할 수 있다”며 “암 환자 조직에서 얻어진 발암 단백질도 정확히 분석할 수 있어 향후 맞춤형 항암제 개발을 위한 플랫폼을 마련할 수 있다”고 전했다.
그림1. 기존의 면역침강법과 새로이 개발된 실시간 단분자 면역침강법의 비교 모식도
2013.11.25 조회수 20054
단분자 수준 단백질 상호작용 측정 성공
- 하나의 분자 수준에서 두 단백질 상호작용 실시간 관찰 성공 -- 면역침강 기법의 측정한계와 시간분해능 십만 배 향상 -
우리 학교 물리학과 윤태영 교수 연구팀이 하나의 분자 수준에서 실시간으로 두 단백질 사이의 상호작용을 관찰하는 기술을 개발한 연구 결과가 ‘네이처 프로토콜스 (Nature Protocols)’ 10월 호에 초청 논문으로 게재됐다.
윤 교수 연구팀은 먼저 하나의 분자까지 관찰할 수 있는 형광현미경을 개발했다.
연구팀은 분자생물학에서 단백질 상호작용 분석에 전통적으로 사용되는 ‘면역침강기법’을 개발한 현미경과 접목함으로써 ‘실시간 단분자 면역침강기법’을 개발해냈다. 이를 통해 연구팀은 순간적으로 상호작용이 반복되는 두 단백질의 반응을 수십 밀리 초 단위에서 정밀하게 관측하는데 성공하였다.
기존의 면역침강기법은 두 단백질 사이의 상호작용을 검출하기 위해 최소 1일 이상의 시간이 소요되었다. 이로 인해 약한 상호작용이나 순간적인 작용을 검출해 내는데 있어 그 한계가 있었다. 또한 결과로 나타난 그림이 단백질 밴드의 세기로 측정되므로 정량적인 분석이 어렵고, 실시간 관측이 불가능한 단점이 있었다.
연구팀은 이러한 기존 방법을 대폭 개량함과 동시에 단분자 수준에서 정밀한 기법을 개발해 내고자 하였다. 새롭게 개발된 기술을 사용하면, 1시간 이내에 원하는 단백질 사이의 상호작용을 관측할 수 있게 된다. 또한 두 단백질의 상호작용을 실시간으로 측정할 수 있으므로 상호작용의 현상을 보다 심도있게 측정하고, 계량할 수 있는 것이다.
또한 실험에 사용되는 모든 프로그램을 연구팀에서 직접 제작, 배포하여 본 기법에 대한 원천기술을 확보함과 동시에, 세계적인 인프라를 구축하는데 있어 토대를 마련하기도 하였다.
윤태영 교수는 “이번에 개발한 기술은 별도의 단백질 발현이나 정제과정을 필요로 하지 않아 매우 미량의 단백질 샘플만 주어져도 그 상호작용을 단분자 동역학 수준에서 매우 정밀하게 분석할 수 있다”며 “암 환자 조직에서 얻어진 발암 단백질도 정확히 분석할 수 있어 향후 맞춤형 항암제 개발을 위한 플랫폼을 마련할 수 있다”고 전했다.
그림1. 기존의 면역침강법과 새로이 개발된 실시간 단분자 면역침강법의 비교 모식도
2013.11.25 조회수 20054 금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
2012.08.16 조회수 18658
금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
2012.08.16 조회수 18658 시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26898
시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26898 난소암환자의 보다 정확한 생존기간 예측 가능해져
- “개인 맞춤형 의약품 개발에 핵심 기술이 될 것” -
난소암환자의 생존기간 예측이 한층 더 정확해진다!
우리 학교 바이오 및 뇌공학과 이도헌 교수 연구팀이 난소암환자의 선천적 유전특징과 후천적 유전자 발현특성이 복합적으로 영향을 미친다는 결과를 이용해 암환자의 생존기간을 보다 정확하게 예측하는 기술을 개발했다.
이번 연구 결과는 개인맞춤형 의약품개발에 핵심기술이 될 전망이다.
기존의 난소암환자 생존기간 예측을 위해 특이 유전자형과 유전자 발현 특성을 각각 찾는 데 초점을 맞추고 있었다. 그러나 암과 같이 개인의 유전적 특성과 후천적 요인에 따른 유전자 발현 패턴이 복합적으로 작용하는 복합질환의 치료효과와 생존기간을 예측하기에는 역부족이었다.
연구팀은 생물정보학(Bioinformatics) 기술 중 하나인 상호연관 네트워크 모델링을 이용해 개인별 유전자의 특징과 발현특성을 분석했다. 이를 생존기간의 인자로 사용해 난소암환자 생존기간 예측의 정확도를 13% 이상 높일 수 있었다.
또한, 항암치료 후 결과의 개인차를 유발하는 유전적 특성과 유전자 발현패턴의 상호작용모델을 제시함으로써 개인차에 의한 항암 치료 생존기간의 예측이 가능해졌다.
이도헌 교수는 “최근 전 세계적으로 차세대 유전자 연구와 개인 맞춤형 치료제 개발이 본격화되고 있는 시기”라며 “이번 연구 결과는 난소암 환자의 생존기간 예측 및 개인별 특성에 따른 맞춤형 치료의 기반이 될 것이다”라고 말했다.
KAIST 바이오 및 뇌공학과 이도헌 교수, 백효정 박사과정 학생, 김준호 박사과정 학생, 하버드대 이은정 박사, 삼성SDS 박인호 박사가 공동으로 실시한 이번 연구는 세계적 학술지인 ‘지노믹스(Genomics)’지 6월호 표지 논문으로 선정됐다.
2011.06.28 조회수 19638
난소암환자의 보다 정확한 생존기간 예측 가능해져
- “개인 맞춤형 의약품 개발에 핵심 기술이 될 것” -
난소암환자의 생존기간 예측이 한층 더 정확해진다!
우리 학교 바이오 및 뇌공학과 이도헌 교수 연구팀이 난소암환자의 선천적 유전특징과 후천적 유전자 발현특성이 복합적으로 영향을 미친다는 결과를 이용해 암환자의 생존기간을 보다 정확하게 예측하는 기술을 개발했다.
이번 연구 결과는 개인맞춤형 의약품개발에 핵심기술이 될 전망이다.
기존의 난소암환자 생존기간 예측을 위해 특이 유전자형과 유전자 발현 특성을 각각 찾는 데 초점을 맞추고 있었다. 그러나 암과 같이 개인의 유전적 특성과 후천적 요인에 따른 유전자 발현 패턴이 복합적으로 작용하는 복합질환의 치료효과와 생존기간을 예측하기에는 역부족이었다.
연구팀은 생물정보학(Bioinformatics) 기술 중 하나인 상호연관 네트워크 모델링을 이용해 개인별 유전자의 특징과 발현특성을 분석했다. 이를 생존기간의 인자로 사용해 난소암환자 생존기간 예측의 정확도를 13% 이상 높일 수 있었다.
또한, 항암치료 후 결과의 개인차를 유발하는 유전적 특성과 유전자 발현패턴의 상호작용모델을 제시함으로써 개인차에 의한 항암 치료 생존기간의 예측이 가능해졌다.
이도헌 교수는 “최근 전 세계적으로 차세대 유전자 연구와 개인 맞춤형 치료제 개발이 본격화되고 있는 시기”라며 “이번 연구 결과는 난소암 환자의 생존기간 예측 및 개인별 특성에 따른 맞춤형 치료의 기반이 될 것이다”라고 말했다.
KAIST 바이오 및 뇌공학과 이도헌 교수, 백효정 박사과정 학생, 김준호 박사과정 학생, 하버드대 이은정 박사, 삼성SDS 박인호 박사가 공동으로 실시한 이번 연구는 세계적 학술지인 ‘지노믹스(Genomics)’지 6월호 표지 논문으로 선정됐다.
2011.06.28 조회수 19638 암 성장과 전이를 억제하는 혈관신생차단제 개발
-캔서 셀誌 표지논문 선정, “부작용 적고 효과 탁월한 신개념 항암치료제 개발 가능성 열어”-
국내 연구진이 암 성장과 전이에 필수적인 혈관신생*에 관여하는 새로운 인자를 발견하고 이를 효과적으로 차단하는 제재를 개발하여, 신개념 암 치료제 개발에 전기를 마련하였다. * 혈관신생(angiogenesis) : 몸속에 새로운 혈관이 만들어지는 현상으로, 악성 종양(암)의 성장과 전이에 매우 중요한 과정
우리학교 의과학대학원 고규영 교수와 삼성의료원 남도현 교수가 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원사업(도약연구)과 삼성의료원의 난치암정복연구사업의 지원을 받아 수행되었다.
이번 연구결과는 암 분야 최고 권위의 학술지인 ‘캔서 셀(Cancer Cell, IF=25.3)’ 표지 논문(8월 17일자)에 선정되었으며, 국내 연구진이 주도한 연구업적이 “캔서 셀”에 표지 논문으로 게재된 것은 이번이 처음이다.
고규영 교수팀은 기존의 혈관성장인자*(VEGF) 이외에 또 다른 성장인자(안지오포이에틴-2, Ang2)가 혈관신생을 촉진한다는 사실을 새롭게 발견하고, 두 인자를 효과적으로 차단하는 “이중혈관성장차단제”를 개발하는데 성공하였다. * 혈관성장인자 : 혈관신생을 촉진하는 인자로, 지금까지 VEGF가 대표적인 인자로 인식되었으나, 고 교수팀이 Ang2도 암의 혈관신생을 촉진한다는 사실을 새롭게 발견함.
지금까지 의학계에서는 VEGF가 혈관신생에 중추적인 역할을 수행하는 것으로 인식하여, 이를 억제하는 항암제인 아바스틴(Avastin)을 개발하여 암 환자들에게 투여해왔다. 그러나 항암 효과가 크지 않고 오히려 암을 촉진시키는(전체 환자 50%) 등 부작용이 적지 않아 치료에 어려움이 있었다.
고 교수팀은 VEGF 억제제를 투여하자 Ang2가 급격히 증가한다는 사실을 발견하고, VEGF과 Ang2을 동시에 차단하는 “이중혈관성장 차단제”를 제작하여 환자에게 투여한 결과, 기존의 VEGF만을 차단했던 제재보다 암 성장(2.1배)과 전이(6.5배)를 효과적으로 차단한다는 사실을 검증하였다.
고 교수는 “Ang2가 VEGF 못지않게 중요한 혈관신생인자라는 사실을 새롭게 확인하여, 두 인자를 동시에 효과적으로 차단하는 ‘이중 혈관성장차단제’ 개발에 성공함으로써, 효과는 탁월하지만 부작용은 적은 신개념 항암치료제 신약 개발에 새로운 가능성을 제시하였다”라고 연구의의를 밝혔다.
2010.08.18 조회수 19461
암 성장과 전이를 억제하는 혈관신생차단제 개발
-캔서 셀誌 표지논문 선정, “부작용 적고 효과 탁월한 신개념 항암치료제 개발 가능성 열어”-
국내 연구진이 암 성장과 전이에 필수적인 혈관신생*에 관여하는 새로운 인자를 발견하고 이를 효과적으로 차단하는 제재를 개발하여, 신개념 암 치료제 개발에 전기를 마련하였다. * 혈관신생(angiogenesis) : 몸속에 새로운 혈관이 만들어지는 현상으로, 악성 종양(암)의 성장과 전이에 매우 중요한 과정
우리학교 의과학대학원 고규영 교수와 삼성의료원 남도현 교수가 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원사업(도약연구)과 삼성의료원의 난치암정복연구사업의 지원을 받아 수행되었다.
이번 연구결과는 암 분야 최고 권위의 학술지인 ‘캔서 셀(Cancer Cell, IF=25.3)’ 표지 논문(8월 17일자)에 선정되었으며, 국내 연구진이 주도한 연구업적이 “캔서 셀”에 표지 논문으로 게재된 것은 이번이 처음이다.
고규영 교수팀은 기존의 혈관성장인자*(VEGF) 이외에 또 다른 성장인자(안지오포이에틴-2, Ang2)가 혈관신생을 촉진한다는 사실을 새롭게 발견하고, 두 인자를 효과적으로 차단하는 “이중혈관성장차단제”를 개발하는데 성공하였다. * 혈관성장인자 : 혈관신생을 촉진하는 인자로, 지금까지 VEGF가 대표적인 인자로 인식되었으나, 고 교수팀이 Ang2도 암의 혈관신생을 촉진한다는 사실을 새롭게 발견함.
지금까지 의학계에서는 VEGF가 혈관신생에 중추적인 역할을 수행하는 것으로 인식하여, 이를 억제하는 항암제인 아바스틴(Avastin)을 개발하여 암 환자들에게 투여해왔다. 그러나 항암 효과가 크지 않고 오히려 암을 촉진시키는(전체 환자 50%) 등 부작용이 적지 않아 치료에 어려움이 있었다.
고 교수팀은 VEGF 억제제를 투여하자 Ang2가 급격히 증가한다는 사실을 발견하고, VEGF과 Ang2을 동시에 차단하는 “이중혈관성장 차단제”를 제작하여 환자에게 투여한 결과, 기존의 VEGF만을 차단했던 제재보다 암 성장(2.1배)과 전이(6.5배)를 효과적으로 차단한다는 사실을 검증하였다.
고 교수는 “Ang2가 VEGF 못지않게 중요한 혈관신생인자라는 사실을 새롭게 확인하여, 두 인자를 동시에 효과적으로 차단하는 ‘이중 혈관성장차단제’ 개발에 성공함으로써, 효과는 탁월하지만 부작용은 적은 신개념 항암치료제 신약 개발에 새로운 가능성을 제시하였다”라고 연구의의를 밝혔다.
2010.08.18 조회수 19461 박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10 조회수 22089
박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10 조회수 22089