%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B8%B0%EC%88%A0%EB%8C%80%ED%95%99
-
 희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
2023.07.13 조회수 7515
희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
2023.07.13 조회수 7515 -
 생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
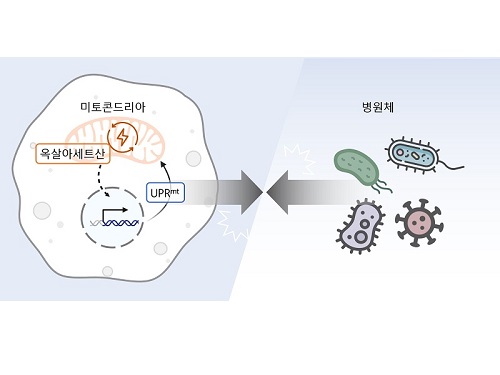
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 8047
생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 8047 -
 원형탈모증 일으키는 새로운 면역 T세포 발견
원형탈모는 1-2%의 유병률을 갖는 비교적 흔히 발생하는 질환으로 모낭을 침범하는 염증성 질환이다. 이는 원형의 탈모반을 특징으로 하며, 두발이나 우리 몸의 모든 털을 침범할 수 있는 비흉터성 자가면역성 탈모 질환으로, 앓고 있는 환자들은 외모에 많은 변화가 생겨 굉장한 스트레스를 받게 된다. 원형탈모증은 면역세포에 의해 발생되는 자가면역질환으로 알려져있지만 발병 기전은 지금까지 명확히 알려지지 않았다.
우리 대학 의과학대학원 박수형 교수(KAIST 전염병대비센터 센터장) 연구팀이 신의철 KAIST 의과학대학원 교수(IBS 한국바이러스기초연구소 바이러스면역연구센터장), 석준 중앙대학교병원 피부과 교수와 공동연구를 통해 만성 염증질환인 원형탈모증의 발병 기전을 발견하고 새로운 치료 전략을 제시했다고 4일 밝혔다.
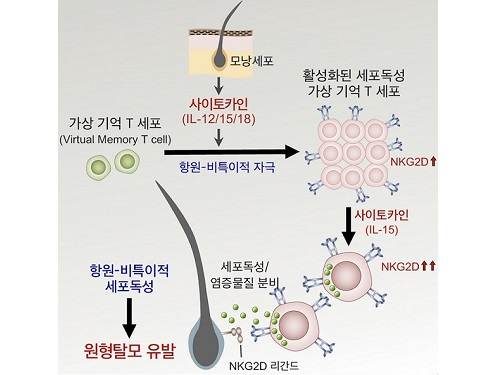
연구진은 원형탈모 환자의 피부 조직 및 혈액과 원형탈모를 유도한 쥐의 피부와 림프절의 분석을 통해 가상기억 T 세포(Virtual memory T cell)로부터 유래된 새로운 면역세포군이 원형탈모증 발병의 핵심 원인임을 최초로 규명했다.
가상기억 T 세포는 항원 특이적인 자극을 받지 않았음에도 불구하고, 활성화된 면역기능을 이미 갖고 있는 세포군으로, 이들은이러스, 박테리아, 기생충 감염 등을 조절하거나 암세포를 제거하는데 도움을 준다고 알려져 왔다. 연구진은 피부에서 분비된 사이토카인(IL-12, IL-15, IL-18)이 가상기억 T세포를 활성화시켜 높은 세포독성 능력을 갖는 면역세포군으로의 분화를 일으키고, 이렇게 활성화된 면역세포는 수용체(NKG2D)를 통해 항원 비특이적인 세포독성 작용으로 모낭세포를 파괴하여 원형탈모증을 유발시키는 것을 발견하였다. 또한, 연구진은 사이토카인과 수용체(NKG2D)의 기능을 억제하여 원형탈모증의 발생을 막을 수 있음을 확인했다.
이번 연구 결과는 인체 내에서 만성 염증을 일으킬 수 있는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써, 만성 염증질환 및 자가면역질환의 병인 및 치료를 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
중앙대학교병원 석준 교수, 우리 대학 의과학대학원 조성동 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 세계적 권위지인 ‘네이처 이뮤놀로지(Nature Immunology)’에 게재됐다 (논문명: A virtual memory CD8+ T cell-originated distinct cell subset causes alopecia areata through innate-like cytotoxicity).
박수형 교수는 “이번 연구 결과는 가상기억 T 세포가 몸을 보호하는 역할을 하지 않고, 항원 비특이적인 자극에 의해 활성화된 후 오히려 염증질환을 유발할 수 있음을 최초로 보여주었다는 점에서 학문적으로나 의학적으로 큰 의미가 있다”고 말하고, “추가 연구를 통해 항체 치료제를 신약 개발한다면 다양한 만성 염증질환의 발생에 대한 새로운 치료 전략을 제시할 수 있을 것이다”라고 덧붙였다.
이번 연구는 과학기술정보통신부 중견연구자지원사업, 4대 과학기술원 공동연구프로젝트, 대한모발학회 기초분야 연구비의 지원을 받아 수행됐다.
2023.07.04 조회수 7119
원형탈모증 일으키는 새로운 면역 T세포 발견
원형탈모는 1-2%의 유병률을 갖는 비교적 흔히 발생하는 질환으로 모낭을 침범하는 염증성 질환이다. 이는 원형의 탈모반을 특징으로 하며, 두발이나 우리 몸의 모든 털을 침범할 수 있는 비흉터성 자가면역성 탈모 질환으로, 앓고 있는 환자들은 외모에 많은 변화가 생겨 굉장한 스트레스를 받게 된다. 원형탈모증은 면역세포에 의해 발생되는 자가면역질환으로 알려져있지만 발병 기전은 지금까지 명확히 알려지지 않았다.
우리 대학 의과학대학원 박수형 교수(KAIST 전염병대비센터 센터장) 연구팀이 신의철 KAIST 의과학대학원 교수(IBS 한국바이러스기초연구소 바이러스면역연구센터장), 석준 중앙대학교병원 피부과 교수와 공동연구를 통해 만성 염증질환인 원형탈모증의 발병 기전을 발견하고 새로운 치료 전략을 제시했다고 4일 밝혔다.
연구진은 원형탈모 환자의 피부 조직 및 혈액과 원형탈모를 유도한 쥐의 피부와 림프절의 분석을 통해 가상기억 T 세포(Virtual memory T cell)로부터 유래된 새로운 면역세포군이 원형탈모증 발병의 핵심 원인임을 최초로 규명했다.
가상기억 T 세포는 항원 특이적인 자극을 받지 않았음에도 불구하고, 활성화된 면역기능을 이미 갖고 있는 세포군으로, 이들은이러스, 박테리아, 기생충 감염 등을 조절하거나 암세포를 제거하는데 도움을 준다고 알려져 왔다. 연구진은 피부에서 분비된 사이토카인(IL-12, IL-15, IL-18)이 가상기억 T세포를 활성화시켜 높은 세포독성 능력을 갖는 면역세포군으로의 분화를 일으키고, 이렇게 활성화된 면역세포는 수용체(NKG2D)를 통해 항원 비특이적인 세포독성 작용으로 모낭세포를 파괴하여 원형탈모증을 유발시키는 것을 발견하였다. 또한, 연구진은 사이토카인과 수용체(NKG2D)의 기능을 억제하여 원형탈모증의 발생을 막을 수 있음을 확인했다.
이번 연구 결과는 인체 내에서 만성 염증을 일으킬 수 있는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써, 만성 염증질환 및 자가면역질환의 병인 및 치료를 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
중앙대학교병원 석준 교수, 우리 대학 의과학대학원 조성동 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 세계적 권위지인 ‘네이처 이뮤놀로지(Nature Immunology)’에 게재됐다 (논문명: A virtual memory CD8+ T cell-originated distinct cell subset causes alopecia areata through innate-like cytotoxicity).
박수형 교수는 “이번 연구 결과는 가상기억 T 세포가 몸을 보호하는 역할을 하지 않고, 항원 비특이적인 자극에 의해 활성화된 후 오히려 염증질환을 유발할 수 있음을 최초로 보여주었다는 점에서 학문적으로나 의학적으로 큰 의미가 있다”고 말하고, “추가 연구를 통해 항체 치료제를 신약 개발한다면 다양한 만성 염증질환의 발생에 대한 새로운 치료 전략을 제시할 수 있을 것이다”라고 덧붙였다.
이번 연구는 과학기술정보통신부 중견연구자지원사업, 4대 과학기술원 공동연구프로젝트, 대한모발학회 기초분야 연구비의 지원을 받아 수행됐다.
2023.07.04 조회수 7119 -
 호흡기부터 강력 차단하는 코로나19 백신 개발
코로나바이러스감염증-19는 3년 4개월 만에 비상사태가 해제됐으나, 잦은 돌연변이로 인해 발생한 변이들이 계속해서 보고되고 있어 재유행이 시작될 가능성은 여전히 남아 있다. 이 변이들은 백신 접종이나 감염으로 인해 숙주가 획득한 기존의 면역반응을 회피하는 방향으로 진화하고 있다. 현재 시판되는 근육 접종 백신으로는 바이러스의 확산을 억제할 수 있는 점막 면역은 충분히 일으키기 어렵다는 한계가 있으므로 장기간 지속되는 강력한 점막 면역을 유도할 수 있는 백신의 필요성은 여전하다.
우리 대학 의과학대학원 이흥규 교수 연구팀과 한국화학연구원(원장 이영국)은 아데노바이러스 벡터 플랫폼의 비강 접종 코로나19 백신을 개발하고 마우스 모델을 이용해 이 백신이 장기간 지속되는 강력한 점막 면역을 유도함을 규명했다고 29일 밝혔다.
점막 면역이란 면역 체계를 구성하는 요소 중에서도 호흡기, 소화기, 생식기관 등을 구성하는 체내 상피 조직인 점막에서 작용하는 면역을 말한다. 이는 체내와 체외의 접점이 되는 점막에 침입한 외부 인자를 인지하고 제거해 인체를 감염으로부터 보호하는 방어체계다. 점막이 병원체나 외부 항원이 침입하는 주요 경로라는 점에서 점막 면역은 전신적 면역반응에 비해 병원체의 침입에 빠르게 대응해 감염 및 확산을 막을 수 있다는 장점이 있다.
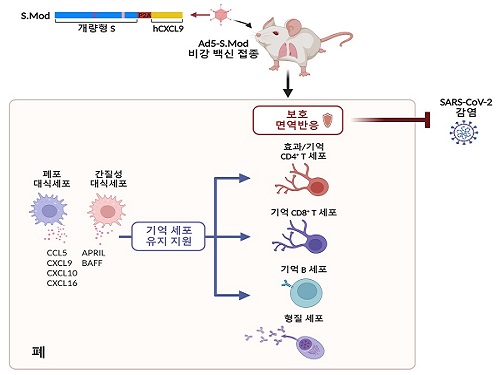
의과학대학원 연수연구원 정희은 박사가 주도하고 박사과정 구근본, 강병훈 연구원, 김현철 박사, 박장현 박사 및 한국화학연구원 김균도 박사가 참여한 이번 연구에서 연구팀은 아데노바이러스 벡터 플랫폼을 기반으로, 개량된 스파이크 단백질 항원 및 인간 유래 면역증강제(CXCL9)을 탑재한 비강 접종 코로나19 백신(Ad5-S.Mod)을 개발해 그 효능을 실험용 쥐를 이용해 검증했다. 연구팀은 인간 유래 면역증강제가 활성화된 T세포를 특정 위치로 이동하도록 유인한다는 점에 주목해, 이를 백신의 효능을 높이기 위한 면역증강제로 이용하였다.
연구팀은 1회 단일 비강 접종, 혹은 근육-비강 2회 접종하여 백신의 효능을 검증했다. 그 결과 비강 백신이 호흡기 점막의 항체 반응 및 기억 T세포 반응을 높은 수준으로 유도할 수 있음을 확인하였으며, 백신 투여군은 1회 단일 접종만으로도 신종 코로나바이러스 감염 시 100% 생존하였다. 또한 백신 접종으로 만들어진 면역반응은 최소 1년간은 유지된다는 것을 규명해 백신의 강력한 점막 면역반응 유도 능력을 입증했다.
또한, 연구팀은 단일세포 전사체 분석법을 이용해 백신을 접종한 실험용 쥐의 폐 대식세포가 기억 T세포 및 B세포를 유지를 돕는 인자들의 주 생산자이며, 폐 대식세포가 제거되면 기억 T세포 및 B세포가 폐 속에서 확연히 감소함을 확인해 이 세포들이 점막 백신 접종으로 만들어진 호흡기 기억 세포의 유지를 돕고 있음을 규명했다.
이번 연구는 인간 유래 면역증강제(CXCL9)로서 활용해 백신의 효능을 강화한 새로운 백신 설계 전략을 제시하고 있다는 점과, 폐 대식세포가 점막 백신에 의해 형성되는 기억 면역반응을 유지하는 데 중요한 역할을 한다는 사실을 새로이 규명하여 다양한 병원체에 대한 비강 백신 개발에 이용할 수 있는 새로운 타겟을 제시하고 있다는 점에서 그 의의가 있다.
의과학대학원 박사후연수연구원 정희은 박사가 제1 저자로 참여한 이번 연구는 바이러스 분야 국제 학술지 `앤티바이럴 리서치(Antiviral Research)' 온라인판으로 6월 14일에 게재됐다. (논문명: Intranasal delivery of an adenovirus-vector vaccine co-expressing a modified spike protein and a genetic adjuvant confers lasting mucosal immunity against SARS-CoV-2, 논문링크: https://doi.org/10.1016/j.antiviral.2023.105656)
한편 이번 연구는 KAIST 코로나 대응 과학기술 뉴딜사업, 2020 과기원공동연구 프로젝트, 한국연구재단 바이오의료기술개발사업, 창의·도전연구 기반지원 사업 및 한국화학연구원 감염병 예방 융합 플랫폼 개발 과제 및 GO! KRICT 사업의 지원을 받아 수행됐다.
2023.07.01 조회수 7027
호흡기부터 강력 차단하는 코로나19 백신 개발
코로나바이러스감염증-19는 3년 4개월 만에 비상사태가 해제됐으나, 잦은 돌연변이로 인해 발생한 변이들이 계속해서 보고되고 있어 재유행이 시작될 가능성은 여전히 남아 있다. 이 변이들은 백신 접종이나 감염으로 인해 숙주가 획득한 기존의 면역반응을 회피하는 방향으로 진화하고 있다. 현재 시판되는 근육 접종 백신으로는 바이러스의 확산을 억제할 수 있는 점막 면역은 충분히 일으키기 어렵다는 한계가 있으므로 장기간 지속되는 강력한 점막 면역을 유도할 수 있는 백신의 필요성은 여전하다.
우리 대학 의과학대학원 이흥규 교수 연구팀과 한국화학연구원(원장 이영국)은 아데노바이러스 벡터 플랫폼의 비강 접종 코로나19 백신을 개발하고 마우스 모델을 이용해 이 백신이 장기간 지속되는 강력한 점막 면역을 유도함을 규명했다고 29일 밝혔다.
점막 면역이란 면역 체계를 구성하는 요소 중에서도 호흡기, 소화기, 생식기관 등을 구성하는 체내 상피 조직인 점막에서 작용하는 면역을 말한다. 이는 체내와 체외의 접점이 되는 점막에 침입한 외부 인자를 인지하고 제거해 인체를 감염으로부터 보호하는 방어체계다. 점막이 병원체나 외부 항원이 침입하는 주요 경로라는 점에서 점막 면역은 전신적 면역반응에 비해 병원체의 침입에 빠르게 대응해 감염 및 확산을 막을 수 있다는 장점이 있다.
의과학대학원 연수연구원 정희은 박사가 주도하고 박사과정 구근본, 강병훈 연구원, 김현철 박사, 박장현 박사 및 한국화학연구원 김균도 박사가 참여한 이번 연구에서 연구팀은 아데노바이러스 벡터 플랫폼을 기반으로, 개량된 스파이크 단백질 항원 및 인간 유래 면역증강제(CXCL9)을 탑재한 비강 접종 코로나19 백신(Ad5-S.Mod)을 개발해 그 효능을 실험용 쥐를 이용해 검증했다. 연구팀은 인간 유래 면역증강제가 활성화된 T세포를 특정 위치로 이동하도록 유인한다는 점에 주목해, 이를 백신의 효능을 높이기 위한 면역증강제로 이용하였다.
연구팀은 1회 단일 비강 접종, 혹은 근육-비강 2회 접종하여 백신의 효능을 검증했다. 그 결과 비강 백신이 호흡기 점막의 항체 반응 및 기억 T세포 반응을 높은 수준으로 유도할 수 있음을 확인하였으며, 백신 투여군은 1회 단일 접종만으로도 신종 코로나바이러스 감염 시 100% 생존하였다. 또한 백신 접종으로 만들어진 면역반응은 최소 1년간은 유지된다는 것을 규명해 백신의 강력한 점막 면역반응 유도 능력을 입증했다.
또한, 연구팀은 단일세포 전사체 분석법을 이용해 백신을 접종한 실험용 쥐의 폐 대식세포가 기억 T세포 및 B세포를 유지를 돕는 인자들의 주 생산자이며, 폐 대식세포가 제거되면 기억 T세포 및 B세포가 폐 속에서 확연히 감소함을 확인해 이 세포들이 점막 백신 접종으로 만들어진 호흡기 기억 세포의 유지를 돕고 있음을 규명했다.
이번 연구는 인간 유래 면역증강제(CXCL9)로서 활용해 백신의 효능을 강화한 새로운 백신 설계 전략을 제시하고 있다는 점과, 폐 대식세포가 점막 백신에 의해 형성되는 기억 면역반응을 유지하는 데 중요한 역할을 한다는 사실을 새로이 규명하여 다양한 병원체에 대한 비강 백신 개발에 이용할 수 있는 새로운 타겟을 제시하고 있다는 점에서 그 의의가 있다.
의과학대학원 박사후연수연구원 정희은 박사가 제1 저자로 참여한 이번 연구는 바이러스 분야 국제 학술지 `앤티바이럴 리서치(Antiviral Research)' 온라인판으로 6월 14일에 게재됐다. (논문명: Intranasal delivery of an adenovirus-vector vaccine co-expressing a modified spike protein and a genetic adjuvant confers lasting mucosal immunity against SARS-CoV-2, 논문링크: https://doi.org/10.1016/j.antiviral.2023.105656)
한편 이번 연구는 KAIST 코로나 대응 과학기술 뉴딜사업, 2020 과기원공동연구 프로젝트, 한국연구재단 바이오의료기술개발사업, 창의·도전연구 기반지원 사업 및 한국화학연구원 감염병 예방 융합 플랫폼 개발 과제 및 GO! KRICT 사업의 지원을 받아 수행됐다.
2023.07.01 조회수 7027 -
 나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 6554
나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 6554 -
 정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15 조회수 9091
정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15 조회수 9091 -
 파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
2023.05.08 조회수 7081
파킨슨병 발병 3차원 게놈 지도 최초 제시
파킨슨병은 60세 이상 인구의 1.2% 이상 발병하는 흔한 퇴행성 뇌 질환으로 급격한 인구 고령화에 따라 전 세계적으로 발병률이 증가하고 있어, 2040년 약 1,420만 명의 환자가 발병할 것으로 예측되고 있다. 현재 파킨슨병의 다양한 발병 원인이 명확하게 규명되지 않은 상황에서, 비정상적으로 발생하는 후성 유전학적 특징들이 파킨슨병 발병에 관여하는 것을 최초로 확인되어 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 미국 국립보건원(National Institute of Health, NIH) 산하 국립노화연구소(National Institute on Aging, NIA) 엘리에자 매슬리아(Eliezer Masliah) 교수와의 공동연구를 통해 전 세계 최초로 파킨슨병 발병 뇌 조직의 단일세포 3차원 후성유전체 지도를 작성하고, 이를 토대로 656개의 파킨슨병 연관 신규 유전자들을 제시했다고 8일 밝혔다.
이번 연구에서 연구팀은 최신 개발된 단일세포 유전체 기술과 3차원 후성 유전체 기술을 접목하여 신경세포 뿐 아니라 뇌 환경 유지에 주요한 역할을 하는 것으로 알려진 신경교세포 (희소돌기아교세포, 미세아교세포 등)의 후성유전적 변화들이 3차원 게놈 구조를 통해 파킨슨병 발병에 관여하는 것을 밝혔다. 이러한 비정상적인 후성유전학적 특징들은 파킨슨병의 원인 또는 진행에 관여하는 유전자 발현 조절에 핵심적인 역할을 하기 때문에, 본 연구 결과는 차후 진단과 치료 연구에 중요한 단서를 제공하게 될 것이라고 연구팀은 전했다.
이번 연구를 수행한 생명과학과 이정운 박사는 단일세포 수준에서 환자 뇌조직을 분석한 결과 기존의 신경세포에 국한된 연구에서 한발 나아가, 신경교세포 또한 파킨슨병에 중요한 역할을 할 수 있다는 단서를 제시하였다는 점에서 중요한 발견이라고 밝혔다.
이번 연구 결과는 국제 학술지, ‘사이언스 어드벤시스(Science Advances, IF=14.14)'에 4월 14일 게재됐다. (논문명 : Characterization of altered molecular mechanisms in Parkinson’s disease through cell type-resolved multi-omics analyses)
교신 저자인 정인경 교수는 "이번 연구 결과는 퇴행성 뇌 질환의 표적 발굴에 있어 3차원 후성유전체 지도 작성의 중요성을 보였기에 차후 다양한 복합유전질환 규명에도 중요하게 활용될 것이다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부의 지원을 받아 수행됐다.
2023.05.08 조회수 7081 -
 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 13804
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 13804 -
 천식 등 만성질환 염증 조절 실마리 풀어
우리 몸에 침입한 병원균이나 암세포를 치료할 수 있는 면역세포인 T세포 중 CD4+ T세포는 적응면역계의 지휘관과 같은 역할을 하며, 이러한 CD4+ T세포의 활성 정도에 따라서 천식과 같은 만성질환의 진행 양상과 예후가 달라지게 된다. T세포의 활성화 증폭을 위해서는 마치 과녁 모양처럼 면역학적 시냅스 형성이 필요하다는 보고들이 있으나 어떠한 메커니즘으로 면역학적 시냅스가 형성이 되는지는 잘 알려져 있지 않았다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 면역학적 시냅스 형성에 섬모 형성 단백질(IFT20)과 엔도솜 형성 단백질(TSG101)의 결합이 중요한 역할을 한다고 26일 밝혔다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사), 강인 박사과정, 생명과학과 김유민 박사과정 등이 주도한 이번 연구에서 연구팀은 단일세포 전사체 분석법을 활용해 활성화된 CD4+ T세포에서 섬모 형성 단백질(IFT20)의 발현이 증가해 있음을 확인했다.
연구팀은 T세포에 국한되어 섬모 형성 단백질(IFT20)이 결핍된 마우스를 제작해 해당 마우스가 정상 마우스보다 천식 증상의 특징이 감소함을 확인했고, 이는 정상 CD4+ T세포와 비교했을 때 섬모 형성 단백질(IFT20) 결핍 CD4+ T세포가 면역학적 시냅스 형성을 감소시켜 T세포 증식, 해당작용 및 세포호흡이 감소하기 때문임을 확인했다.
또한, 연구팀은 섬모 형성 단백질(IFT20)에 결합하는 단백질을 찾기 위해 효모단백질잡종법과 면역침강법을 이용함으로써 섬모 형성 단백질(IFT20)이 엔도솜 형성단백질(TSG101)과 서로 결합한다는 것을 세계 최초로 규명했다.
이를 입증하기 위해 연구팀은 T세포에 국한되어 엔도솜 형성단백질(TSG101)이 결핍된 마우스를 제작해 엔도솜 형성단백질(TSG101)이 결핍된 CD4+ T세포가 정상 CD4+ T세포에 비해 면역학적 시냅스 형성이 감소함을 확인했다. 결과적으로 기존에 알려지지 않았던 면역학적 시냅스 형성에 기여하는 섬모형성 단백질(IFT20)과 엔도솜 형성단백질(TSG101)의 역할을 밝힘으로써 T세포 활성화를 조절할 수 있는 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 정지웅 박사는 "그동안 잘 알려지지 않은 면역학적 시냅스 형성을 조절하는 단백질을 확인하는 중요한 연구”라고 설명했다. 이흥규 교수는 “면역학적 시냅스 형성의 변화를 통해 천식의 염증 정도가 변화할 수 있음을 확인했고, 향후 면역학적 시냅스를 조절함으로써 천식을 비롯한 다양한 면역 질환 등에서 질환의 염증을 조절하는 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사)가 제1 저자로 참여한 이번 연구는 면역학 분야 국제 학술지 `세포 및 분자 면역학(Cellular & Molecular Immunology, JCR IF = 22.10)'에 4월 7일 字 온라인판에 게재됐다. (논문명: Regulation of c-SMAC formation and AKT-mTOR signaling by the TSG101-IFT20 axis in CD4+ T cells)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업 및 글로벌박사양성사업의 지원을 받아 수행됐다.
2023.04.26 조회수 7697
천식 등 만성질환 염증 조절 실마리 풀어
우리 몸에 침입한 병원균이나 암세포를 치료할 수 있는 면역세포인 T세포 중 CD4+ T세포는 적응면역계의 지휘관과 같은 역할을 하며, 이러한 CD4+ T세포의 활성 정도에 따라서 천식과 같은 만성질환의 진행 양상과 예후가 달라지게 된다. T세포의 활성화 증폭을 위해서는 마치 과녁 모양처럼 면역학적 시냅스 형성이 필요하다는 보고들이 있으나 어떠한 메커니즘으로 면역학적 시냅스가 형성이 되는지는 잘 알려져 있지 않았다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 면역학적 시냅스 형성에 섬모 형성 단백질(IFT20)과 엔도솜 형성 단백질(TSG101)의 결합이 중요한 역할을 한다고 26일 밝혔다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사), 강인 박사과정, 생명과학과 김유민 박사과정 등이 주도한 이번 연구에서 연구팀은 단일세포 전사체 분석법을 활용해 활성화된 CD4+ T세포에서 섬모 형성 단백질(IFT20)의 발현이 증가해 있음을 확인했다.
연구팀은 T세포에 국한되어 섬모 형성 단백질(IFT20)이 결핍된 마우스를 제작해 해당 마우스가 정상 마우스보다 천식 증상의 특징이 감소함을 확인했고, 이는 정상 CD4+ T세포와 비교했을 때 섬모 형성 단백질(IFT20) 결핍 CD4+ T세포가 면역학적 시냅스 형성을 감소시켜 T세포 증식, 해당작용 및 세포호흡이 감소하기 때문임을 확인했다.
또한, 연구팀은 섬모 형성 단백질(IFT20)에 결합하는 단백질을 찾기 위해 효모단백질잡종법과 면역침강법을 이용함으로써 섬모 형성 단백질(IFT20)이 엔도솜 형성단백질(TSG101)과 서로 결합한다는 것을 세계 최초로 규명했다.
이를 입증하기 위해 연구팀은 T세포에 국한되어 엔도솜 형성단백질(TSG101)이 결핍된 마우스를 제작해 엔도솜 형성단백질(TSG101)이 결핍된 CD4+ T세포가 정상 CD4+ T세포에 비해 면역학적 시냅스 형성이 감소함을 확인했다. 결과적으로 기존에 알려지지 않았던 면역학적 시냅스 형성에 기여하는 섬모형성 단백질(IFT20)과 엔도솜 형성단백질(TSG101)의 역할을 밝힘으로써 T세포 활성화를 조절할 수 있는 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 정지웅 박사는 "그동안 잘 알려지지 않은 면역학적 시냅스 형성을 조절하는 단백질을 확인하는 중요한 연구”라고 설명했다. 이흥규 교수는 “면역학적 시냅스 형성의 변화를 통해 천식의 염증 정도가 변화할 수 있음을 확인했고, 향후 면역학적 시냅스를 조절함으로써 천식을 비롯한 다양한 면역 질환 등에서 질환의 염증을 조절하는 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 정지웅 박사(현, 서울대병원 알레르기내과 임상강사)가 제1 저자로 참여한 이번 연구는 면역학 분야 국제 학술지 `세포 및 분자 면역학(Cellular & Molecular Immunology, JCR IF = 22.10)'에 4월 7일 字 온라인판에 게재됐다. (논문명: Regulation of c-SMAC formation and AKT-mTOR signaling by the TSG101-IFT20 axis in CD4+ T cells)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업 및 글로벌박사양성사업의 지원을 받아 수행됐다.
2023.04.26 조회수 7697 -
 말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 8933
말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 8933 -
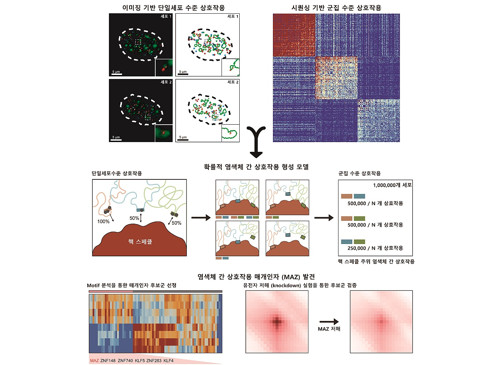 암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 7765
암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 7765 -
 KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 7631
KAIST, 암세포에만 약물 전달 가능한 클라트린 조립체 개발
암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다. 단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
우리 대학 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.
생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다. (그림 1)
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
우리 대학 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일 자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Construction and Functionalization of a Clathrin Assembly for a Targeted Protein Delivery)
제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.03.14 조회수 7631