-
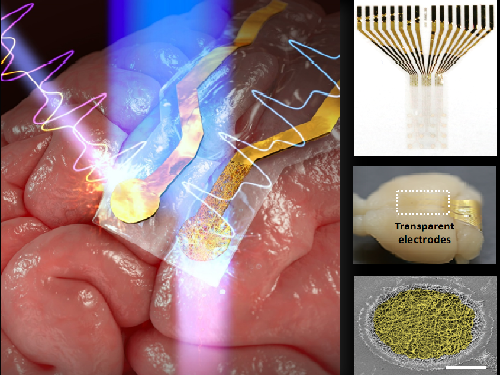 광유전학 · 광치료 연구를 위한 투명 전극 개발
우리 대학 전기및전자공학부 이현주 교수와 이정용 교수, 의과학대학원 이정호 교수 공동연구팀이 폴리머 전기방사 기술을 미세 전자 기계 시스템(MEMS, Micro Electro Mechanical Systems) 공정에 접목해 실시간으로 뇌피질 전도 측정이 가능한 투명하고 유연한 미세전극 어레이(배열)를 개발했다고 15일 밝혔다.
☞ 폴리머: 한 종류 또는 수 종류의 구성단위가 서로에게 많은 수의 화학결합으로 중합돼 연결된 상태의 분자로 구성된 화합물. 통상적으로 고분자 화합물(분자량이 1만 이상의 화합물)과 같은 의미로 사용되는 경우가 많은데 고분자를 영어로는 폴리머(polymer)라고 부른다.
☞ 전기방사: 폴리머(고분자) 용액에 고전압을 인가해 나노파이버(나노섬유)를 생산하는 첨단 기술
☞ 미세 전자 기계 시스템: 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품 및 시스템을 설계·제작하고 응용하는 기술을 의미
이번에 개발된 뇌피질 전도 미세전극 어레이는 기존의 불투명한 금속 전극과는 달리 빛에 의해 발생하는 잡음 신호가 매우 작고 자유로운 빛의 전달이 가능해 광유전학 및 광 치료 연구에 큰 도움을 줄 것으로 기대된다.
최근 빛의 새로운 활용법과 생체 내 효능에 대한 발견으로 인해 빛을 생체 내의 특정 영역에 조사해 생기는 반응과 효과에 관한 연구들이 주목을 받고 있다. 대표적인 예가 광유전학, 광 치료 기술 등이다. 광유전학은 기존 신경 자극기술과는 달리 매우 국소적인 부위의 신경 세포를 자극하고, 광 치료법은 수면장애와 알츠하이머병의 치료 가능성으로 이 분야에 관한 연구들이 활발히 진행되고 있다.
빛에 의한 생체 내 반응을 측정하는 대표적인 방법으로는 체내에 센서 등을 장착해서 호르몬의 분비과정에서 발생하는 전기생리 신호를 측정하는 방법이다. 통상적으로 전기생리 신호 측정을 위해 사용하는 일반적인 금속 박막 전극은 높은 반사도와 낮은 투과도 때문에 빛의 전달을 방해할 뿐만 아니라 빛을 쬘 때 베크렐 효과(금속 전극이 빛을 받으면 전극에 전위차가 생겨 전류가 흐르는 현상)에 의해 '포토일렉트릭 아티팩트'라는 잡음 신호가 발생한다. 따라서 일반 금속 박막 전극은 정확한 전기생리 신호를 측정하기가 어렵다.
이현주 교수팀은 그간 이런 문제해결을 위해 MEMS 공정을 통해 제작되는 미세전극 어레이를 투명화하기 위한 연구를 지속적으로 수행해왔는데 최근 폴리머 전기방사 기술을 MEMS 공정에 접목해 뇌피질 전도(ECoG, ElectroCorticoGram)측정을 위한 유연하고 투명한 미세전극 어레이를 제작하는데 성공했다. 이 장치는 높은 투과도를 지니고 있어 '포토일렉트릭 아티팩트'가 매우 약하고 또 빛의 전달이 매우 용이하기 때문에 다른 투명 미세전극 어레이와 비교해 보면 전기화학 임피던스가 낮아 뇌피질 전도 측정이 매우 유리하다.
연구팀은 자체개발한 유연·투명한 미세전극 어레이 성능평가를 위해 외부 변형에 따른 저항 변화와 전기방사 시간에 따른 전기화학 임피던스, 전하 저장 용량 등을 측정한 결과, 전극 자체의 특성을 쉽게 조절이 가능한 점 등 여러 면에서 우수한 성능을 보였다고 설명했다. 연구팀은 특히 미세 전극에서 발생하는 `포토일렉트릭 아티팩트'를 비교 분석했는데 10배 이상 감쇄 효과가 있음을 확인했다. 이와 함께 쥐 뇌의 다양한 피질 영역에 걸쳐 유연·투명한 미세전극 어레이를 위치시킨 후 광 자극을 통해 발생하는 뇌피질 전도 신호를 측정한 결과, 신호를 정량적으로 비교하고 빛이 원활하게 전달되는 현상을 관측하는데 성공했다.
연구팀은 현재 이 신기술을 기반으로 광 자극과 함께 정확한 뇌피질 전도를 실시간으로 측정할 수 있는 미세전극과 미세광원이 집적된 다기능성 미세전극 어레이 개발을 위한 후속연구를 진행 중이다. 광원과 전극이 함께 집적된 다기능성 소자 개발에 성공할 경우 광유전학이나 광 치료 등의 연구를 진행하는 뇌과학자들이 편하게 사용할 수 있는 뉴로 툴(Tool) 개발로 이어질 것으로 전문가들은 예상하고 있다.
이현주 교수는 "기존에는 광전 효과로 인해 불가피하게 발생하는 잡음 신호로 인해서 광 자극과 동시에 뇌피질 전도 측정이 불가능했지만 유연하고 투명한 미세전극 개발을 계기로 광 자극과는 무관하게 실시간으로 뇌피질 전도 측정이 가능하게 됐다”고 말했다.
이현주 교수 연구팀의 서지원 박사와 김기업 박사과정생, 그리고 이정용 교수 연구팀의 서기원 박사과정생이 각각 주도하고 의과학대학원 이정호 교수와 김정욱 박사가 참여한 이번 연구결과는 국제 학술지 '어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials)'誌 7월 2일 字에 게재됐으며 표지논문(Front Cover)으로 선정됐다. (논문명: Artifact-Free 2D Mapping of Neural Activity In Vivo through Transparent Gold Nanonetwork Array)
한편, 이 연구는 과학기술정보통신부 한국연구재단의 선도연구센터 사업의 지원으로 수행됐다.
광유전학 · 광치료 연구를 위한 투명 전극 개발
우리 대학 전기및전자공학부 이현주 교수와 이정용 교수, 의과학대학원 이정호 교수 공동연구팀이 폴리머 전기방사 기술을 미세 전자 기계 시스템(MEMS, Micro Electro Mechanical Systems) 공정에 접목해 실시간으로 뇌피질 전도 측정이 가능한 투명하고 유연한 미세전극 어레이(배열)를 개발했다고 15일 밝혔다.
☞ 폴리머: 한 종류 또는 수 종류의 구성단위가 서로에게 많은 수의 화학결합으로 중합돼 연결된 상태의 분자로 구성된 화합물. 통상적으로 고분자 화합물(분자량이 1만 이상의 화합물)과 같은 의미로 사용되는 경우가 많은데 고분자를 영어로는 폴리머(polymer)라고 부른다.
☞ 전기방사: 폴리머(고분자) 용액에 고전압을 인가해 나노파이버(나노섬유)를 생산하는 첨단 기술
☞ 미세 전자 기계 시스템: 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품 및 시스템을 설계·제작하고 응용하는 기술을 의미
이번에 개발된 뇌피질 전도 미세전극 어레이는 기존의 불투명한 금속 전극과는 달리 빛에 의해 발생하는 잡음 신호가 매우 작고 자유로운 빛의 전달이 가능해 광유전학 및 광 치료 연구에 큰 도움을 줄 것으로 기대된다.
최근 빛의 새로운 활용법과 생체 내 효능에 대한 발견으로 인해 빛을 생체 내의 특정 영역에 조사해 생기는 반응과 효과에 관한 연구들이 주목을 받고 있다. 대표적인 예가 광유전학, 광 치료 기술 등이다. 광유전학은 기존 신경 자극기술과는 달리 매우 국소적인 부위의 신경 세포를 자극하고, 광 치료법은 수면장애와 알츠하이머병의 치료 가능성으로 이 분야에 관한 연구들이 활발히 진행되고 있다.
빛에 의한 생체 내 반응을 측정하는 대표적인 방법으로는 체내에 센서 등을 장착해서 호르몬의 분비과정에서 발생하는 전기생리 신호를 측정하는 방법이다. 통상적으로 전기생리 신호 측정을 위해 사용하는 일반적인 금속 박막 전극은 높은 반사도와 낮은 투과도 때문에 빛의 전달을 방해할 뿐만 아니라 빛을 쬘 때 베크렐 효과(금속 전극이 빛을 받으면 전극에 전위차가 생겨 전류가 흐르는 현상)에 의해 '포토일렉트릭 아티팩트'라는 잡음 신호가 발생한다. 따라서 일반 금속 박막 전극은 정확한 전기생리 신호를 측정하기가 어렵다.
이현주 교수팀은 그간 이런 문제해결을 위해 MEMS 공정을 통해 제작되는 미세전극 어레이를 투명화하기 위한 연구를 지속적으로 수행해왔는데 최근 폴리머 전기방사 기술을 MEMS 공정에 접목해 뇌피질 전도(ECoG, ElectroCorticoGram)측정을 위한 유연하고 투명한 미세전극 어레이를 제작하는데 성공했다. 이 장치는 높은 투과도를 지니고 있어 '포토일렉트릭 아티팩트'가 매우 약하고 또 빛의 전달이 매우 용이하기 때문에 다른 투명 미세전극 어레이와 비교해 보면 전기화학 임피던스가 낮아 뇌피질 전도 측정이 매우 유리하다.
연구팀은 자체개발한 유연·투명한 미세전극 어레이 성능평가를 위해 외부 변형에 따른 저항 변화와 전기방사 시간에 따른 전기화학 임피던스, 전하 저장 용량 등을 측정한 결과, 전극 자체의 특성을 쉽게 조절이 가능한 점 등 여러 면에서 우수한 성능을 보였다고 설명했다. 연구팀은 특히 미세 전극에서 발생하는 `포토일렉트릭 아티팩트'를 비교 분석했는데 10배 이상 감쇄 효과가 있음을 확인했다. 이와 함께 쥐 뇌의 다양한 피질 영역에 걸쳐 유연·투명한 미세전극 어레이를 위치시킨 후 광 자극을 통해 발생하는 뇌피질 전도 신호를 측정한 결과, 신호를 정량적으로 비교하고 빛이 원활하게 전달되는 현상을 관측하는데 성공했다.
연구팀은 현재 이 신기술을 기반으로 광 자극과 함께 정확한 뇌피질 전도를 실시간으로 측정할 수 있는 미세전극과 미세광원이 집적된 다기능성 미세전극 어레이 개발을 위한 후속연구를 진행 중이다. 광원과 전극이 함께 집적된 다기능성 소자 개발에 성공할 경우 광유전학이나 광 치료 등의 연구를 진행하는 뇌과학자들이 편하게 사용할 수 있는 뉴로 툴(Tool) 개발로 이어질 것으로 전문가들은 예상하고 있다.
이현주 교수는 "기존에는 광전 효과로 인해 불가피하게 발생하는 잡음 신호로 인해서 광 자극과 동시에 뇌피질 전도 측정이 불가능했지만 유연하고 투명한 미세전극 개발을 계기로 광 자극과는 무관하게 실시간으로 뇌피질 전도 측정이 가능하게 됐다”고 말했다.
이현주 교수 연구팀의 서지원 박사와 김기업 박사과정생, 그리고 이정용 교수 연구팀의 서기원 박사과정생이 각각 주도하고 의과학대학원 이정호 교수와 김정욱 박사가 참여한 이번 연구결과는 국제 학술지 '어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials)'誌 7월 2일 字에 게재됐으며 표지논문(Front Cover)으로 선정됐다. (논문명: Artifact-Free 2D Mapping of Neural Activity In Vivo through Transparent Gold Nanonetwork Array)
한편, 이 연구는 과학기술정보통신부 한국연구재단의 선도연구센터 사업의 지원으로 수행됐다.
2020.07.15
조회수 32450
-
 뇌 구조를 정확히 볼 수 있는 3차원 분석기술 개발
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 뇌신경과학 연구에서 광범위하게 사용되는 실험용 쥐의 뇌 절편 영상을 자동으로 보정하고 규격화하여 신경세포의 3차원 분포정보를 정확하게 얻을 수 있는 핵심 분석 기술을 개발했다.
이 기술은 실험자의 경험에 의존하던 기존 분석 방식의 문제점을 해결하는 한편 여러 개체에서 얻은 뇌 이미지를 표준적인 3차원 지도상에서 비교 분석할 수 있도록 한다. 이는 기존의 개체별 분석에서는 관측하기 힘든 뇌세포 간 상호 연결 형태의 정확한 공간적 분포를 발견할 수 있는 길을 열었다는 점에서 의미가 크다.
연구팀은 생명과학과 이승희 교수팀과의 협력 연구를 통해 실험에서 얻어진 쥐의 뇌 절편 데이터를 분석했는데, 이 기술을 적용한 결과 시각시스템의 초기구조인 외측 슬상핵(Lateral geniculate nucleus)과 시각피질 (Visual cortex) 사이의 정확한 연결 구조 분포를 측정할 수 있었다. 기존 분석 방식으로는 불가능했던 다중 개체로부터 얻어진 데이터의 표준화를 통해 뇌 전역에 걸친 신경세포의 연결성을 분석할 수 있음을 확인한 것이다.
뇌인지공학프로그램 최우철 박사과정과 송준호 연구원이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `셀(cell)'의 온라인 자매지 `셀 리포츠(Cell Reports)' 5월 26일 자에 게재됐다. (논문명 : Precise mapping of single neurons by calibrated 3-D reconstruction of brain slices reveals topographic projection in mouse visual cortex).
이에 앞서 연구팀은 이 기술을 활용해 UC 버클리대학의 양단(Yang Dan) 교수와의 공동연구에도 참여했고 그 결과를 국제 학술지 `사이언스 (Science)' 1월 24일 자에 발표했다. (논문명: A Common Hub for Sleep and Motor Control in the Substantia Nigra).
통상 쥐의 뇌 절편 영상을 이용한 연구에서는 특정 단백질에 형광물질을 발현시킨 뇌를 잘라 신경세포의 분포 등을 분석하는 방법이 광범위하게 사용된다. 이때 형광을 발현하는 신경세포를 현미경을 통해 연구자의 육안으로 관측하고, 얼마나 많은 신경세포가 뇌의 어느 특정 영역에 위치하는지 일일이 수동적으로 분석한다. 이런 방법은 연구자의 경험에 크게 의존하여 오차가 클 수밖에 없고, 각각의 개체에서 관측된 신경세포의 위치나 수량을 표준적인 공통의 방법으로 동시에 분석할 수 없다는 한계를 갖고 있다.
백 교수 연구팀은 미국의 Allen Brain Atlas 프로젝트에서 제공한 쥐 두뇌의 3차원 표준 데이터에 기반하여, 임의의 각도에서 잘라낸 뇌 절편 이미지들을 SURF(Speeded Up Robust Feature Points) 특징점과 HOG(Histogram of Oriented Gradients descriptor) 형상 기술자를 이용하여 데이터베이스와 비교하는 계산적인 분석 방법을 사용했다.
그 결과, 실험에서 얻은 뇌 이미지와 가장 잘 일치하는 데이터베이스의 3차원 위치를 100마이크로미터(μm), 1도 이내의 오차로 찾아낼 수 있었다. 연구팀은 이를 통해 각 2차원 뇌 이미지의 위치 정보를 3차원 공간상의 위치로 정확히 계산하고, 여러 개체에서 얻어진 신경 세포의 위치를 동일한 3차원 공간에 투영해 정확하게 분석할 수 있음을 확인했다.
따라서 이 기술을 활용하면 다양한 기법으로 생성된 뇌 슬라이스 이미지를 이용해 신경세포의 3차원 위치를 뇌 전체에서 자동적으로 계산할 수 있어, 기존의 방법으로는 분석하기 어려운 수천~수만 개의 신경세포들의 정확한 뇌 내 분포 위치 및 상대적 공간 배열을 한번에 분석하는 것이 가능하다.
또 신경세포들의 연결성을 표준적으로 보정된 3차원 공간에서 표현할 수 있어 특정 뇌 영역 간의 연결은 물론 뇌 전역의 네트워크 분포를 여러 개체의 데이터를 사용해 동시분석도 가능하다. 따라서 기존 방식의 동물실험 분석에서 요구되던 시간과 비용을 크게 줄일 수 있을 것으로 기대된다.
올 6월 현재 백 교수 연구팀의 이 기술은 KAIST내 여러 실험실과 미국 MIT, 하버드(Harvard), 칼텍(Caltech), UC 샌디에고(San Diego) 등 세계 유수 대학의 연구 그룹에서 진행하는 뇌 신경 세포의 네트워크 분석에 활용되고 있다.
백세범 교수는 "이번 연구를 통해 개발된 기술은 형광 뇌 이미지를 이용하는 모든 연구에 바로 적용할 수 있을 뿐만 아니라 그 밖에 다양한 종류의 이미지 데이터에도 광범위하게 적용 가능하다ˮ면서 "향후 쥐의 뇌 슬라이스를 이용하는 다양한 분석에 표준적인 기법으로 자리 잡을 수 있을 것으로 기대된다ˮ고 말했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST의 모험연구사업의 지원을 받아 수행됐다.
뇌 구조를 정확히 볼 수 있는 3차원 분석기술 개발
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 뇌신경과학 연구에서 광범위하게 사용되는 실험용 쥐의 뇌 절편 영상을 자동으로 보정하고 규격화하여 신경세포의 3차원 분포정보를 정확하게 얻을 수 있는 핵심 분석 기술을 개발했다.
이 기술은 실험자의 경험에 의존하던 기존 분석 방식의 문제점을 해결하는 한편 여러 개체에서 얻은 뇌 이미지를 표준적인 3차원 지도상에서 비교 분석할 수 있도록 한다. 이는 기존의 개체별 분석에서는 관측하기 힘든 뇌세포 간 상호 연결 형태의 정확한 공간적 분포를 발견할 수 있는 길을 열었다는 점에서 의미가 크다.
연구팀은 생명과학과 이승희 교수팀과의 협력 연구를 통해 실험에서 얻어진 쥐의 뇌 절편 데이터를 분석했는데, 이 기술을 적용한 결과 시각시스템의 초기구조인 외측 슬상핵(Lateral geniculate nucleus)과 시각피질 (Visual cortex) 사이의 정확한 연결 구조 분포를 측정할 수 있었다. 기존 분석 방식으로는 불가능했던 다중 개체로부터 얻어진 데이터의 표준화를 통해 뇌 전역에 걸친 신경세포의 연결성을 분석할 수 있음을 확인한 것이다.
뇌인지공학프로그램 최우철 박사과정과 송준호 연구원이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `셀(cell)'의 온라인 자매지 `셀 리포츠(Cell Reports)' 5월 26일 자에 게재됐다. (논문명 : Precise mapping of single neurons by calibrated 3-D reconstruction of brain slices reveals topographic projection in mouse visual cortex).
이에 앞서 연구팀은 이 기술을 활용해 UC 버클리대학의 양단(Yang Dan) 교수와의 공동연구에도 참여했고 그 결과를 국제 학술지 `사이언스 (Science)' 1월 24일 자에 발표했다. (논문명: A Common Hub for Sleep and Motor Control in the Substantia Nigra).
통상 쥐의 뇌 절편 영상을 이용한 연구에서는 특정 단백질에 형광물질을 발현시킨 뇌를 잘라 신경세포의 분포 등을 분석하는 방법이 광범위하게 사용된다. 이때 형광을 발현하는 신경세포를 현미경을 통해 연구자의 육안으로 관측하고, 얼마나 많은 신경세포가 뇌의 어느 특정 영역에 위치하는지 일일이 수동적으로 분석한다. 이런 방법은 연구자의 경험에 크게 의존하여 오차가 클 수밖에 없고, 각각의 개체에서 관측된 신경세포의 위치나 수량을 표준적인 공통의 방법으로 동시에 분석할 수 없다는 한계를 갖고 있다.
백 교수 연구팀은 미국의 Allen Brain Atlas 프로젝트에서 제공한 쥐 두뇌의 3차원 표준 데이터에 기반하여, 임의의 각도에서 잘라낸 뇌 절편 이미지들을 SURF(Speeded Up Robust Feature Points) 특징점과 HOG(Histogram of Oriented Gradients descriptor) 형상 기술자를 이용하여 데이터베이스와 비교하는 계산적인 분석 방법을 사용했다.
그 결과, 실험에서 얻은 뇌 이미지와 가장 잘 일치하는 데이터베이스의 3차원 위치를 100마이크로미터(μm), 1도 이내의 오차로 찾아낼 수 있었다. 연구팀은 이를 통해 각 2차원 뇌 이미지의 위치 정보를 3차원 공간상의 위치로 정확히 계산하고, 여러 개체에서 얻어진 신경 세포의 위치를 동일한 3차원 공간에 투영해 정확하게 분석할 수 있음을 확인했다.
따라서 이 기술을 활용하면 다양한 기법으로 생성된 뇌 슬라이스 이미지를 이용해 신경세포의 3차원 위치를 뇌 전체에서 자동적으로 계산할 수 있어, 기존의 방법으로는 분석하기 어려운 수천~수만 개의 신경세포들의 정확한 뇌 내 분포 위치 및 상대적 공간 배열을 한번에 분석하는 것이 가능하다.
또 신경세포들의 연결성을 표준적으로 보정된 3차원 공간에서 표현할 수 있어 특정 뇌 영역 간의 연결은 물론 뇌 전역의 네트워크 분포를 여러 개체의 데이터를 사용해 동시분석도 가능하다. 따라서 기존 방식의 동물실험 분석에서 요구되던 시간과 비용을 크게 줄일 수 있을 것으로 기대된다.
올 6월 현재 백 교수 연구팀의 이 기술은 KAIST내 여러 실험실과 미국 MIT, 하버드(Harvard), 칼텍(Caltech), UC 샌디에고(San Diego) 등 세계 유수 대학의 연구 그룹에서 진행하는 뇌 신경 세포의 네트워크 분석에 활용되고 있다.
백세범 교수는 "이번 연구를 통해 개발된 기술은 형광 뇌 이미지를 이용하는 모든 연구에 바로 적용할 수 있을 뿐만 아니라 그 밖에 다양한 종류의 이미지 데이터에도 광범위하게 적용 가능하다ˮ면서 "향후 쥐의 뇌 슬라이스를 이용하는 다양한 분석에 표준적인 기법으로 자리 잡을 수 있을 것으로 기대된다ˮ고 말했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST의 모험연구사업의 지원을 받아 수행됐다.
2020.06.08
조회수 17769
-
 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11
조회수 19502
-
 머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27
조회수 15970
-
 두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23
조회수 17598
-
 포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
2020.03.11
조회수 16295
-
 허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22
조회수 10566
-
 임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25
조회수 12094
-
 서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24
조회수 16228
-
 심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13
조회수 16665
-
 정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
2019.08.08
조회수 27950
-
 박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17
조회수 19339
 광유전학 · 광치료 연구를 위한 투명 전극 개발
우리 대학 전기및전자공학부 이현주 교수와 이정용 교수, 의과학대학원 이정호 교수 공동연구팀이 폴리머 전기방사 기술을 미세 전자 기계 시스템(MEMS, Micro Electro Mechanical Systems) 공정에 접목해 실시간으로 뇌피질 전도 측정이 가능한 투명하고 유연한 미세전극 어레이(배열)를 개발했다고 15일 밝혔다.
☞ 폴리머: 한 종류 또는 수 종류의 구성단위가 서로에게 많은 수의 화학결합으로 중합돼 연결된 상태의 분자로 구성된 화합물. 통상적으로 고분자 화합물(분자량이 1만 이상의 화합물)과 같은 의미로 사용되는 경우가 많은데 고분자를 영어로는 폴리머(polymer)라고 부른다.
☞ 전기방사: 폴리머(고분자) 용액에 고전압을 인가해 나노파이버(나노섬유)를 생산하는 첨단 기술
☞ 미세 전자 기계 시스템: 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품 및 시스템을 설계·제작하고 응용하는 기술을 의미
이번에 개발된 뇌피질 전도 미세전극 어레이는 기존의 불투명한 금속 전극과는 달리 빛에 의해 발생하는 잡음 신호가 매우 작고 자유로운 빛의 전달이 가능해 광유전학 및 광 치료 연구에 큰 도움을 줄 것으로 기대된다.
최근 빛의 새로운 활용법과 생체 내 효능에 대한 발견으로 인해 빛을 생체 내의 특정 영역에 조사해 생기는 반응과 효과에 관한 연구들이 주목을 받고 있다. 대표적인 예가 광유전학, 광 치료 기술 등이다. 광유전학은 기존 신경 자극기술과는 달리 매우 국소적인 부위의 신경 세포를 자극하고, 광 치료법은 수면장애와 알츠하이머병의 치료 가능성으로 이 분야에 관한 연구들이 활발히 진행되고 있다.
빛에 의한 생체 내 반응을 측정하는 대표적인 방법으로는 체내에 센서 등을 장착해서 호르몬의 분비과정에서 발생하는 전기생리 신호를 측정하는 방법이다. 통상적으로 전기생리 신호 측정을 위해 사용하는 일반적인 금속 박막 전극은 높은 반사도와 낮은 투과도 때문에 빛의 전달을 방해할 뿐만 아니라 빛을 쬘 때 베크렐 효과(금속 전극이 빛을 받으면 전극에 전위차가 생겨 전류가 흐르는 현상)에 의해 '포토일렉트릭 아티팩트'라는 잡음 신호가 발생한다. 따라서 일반 금속 박막 전극은 정확한 전기생리 신호를 측정하기가 어렵다.
이현주 교수팀은 그간 이런 문제해결을 위해 MEMS 공정을 통해 제작되는 미세전극 어레이를 투명화하기 위한 연구를 지속적으로 수행해왔는데 최근 폴리머 전기방사 기술을 MEMS 공정에 접목해 뇌피질 전도(ECoG, ElectroCorticoGram)측정을 위한 유연하고 투명한 미세전극 어레이를 제작하는데 성공했다. 이 장치는 높은 투과도를 지니고 있어 '포토일렉트릭 아티팩트'가 매우 약하고 또 빛의 전달이 매우 용이하기 때문에 다른 투명 미세전극 어레이와 비교해 보면 전기화학 임피던스가 낮아 뇌피질 전도 측정이 매우 유리하다.
연구팀은 자체개발한 유연·투명한 미세전극 어레이 성능평가를 위해 외부 변형에 따른 저항 변화와 전기방사 시간에 따른 전기화학 임피던스, 전하 저장 용량 등을 측정한 결과, 전극 자체의 특성을 쉽게 조절이 가능한 점 등 여러 면에서 우수한 성능을 보였다고 설명했다. 연구팀은 특히 미세 전극에서 발생하는 `포토일렉트릭 아티팩트'를 비교 분석했는데 10배 이상 감쇄 효과가 있음을 확인했다. 이와 함께 쥐 뇌의 다양한 피질 영역에 걸쳐 유연·투명한 미세전극 어레이를 위치시킨 후 광 자극을 통해 발생하는 뇌피질 전도 신호를 측정한 결과, 신호를 정량적으로 비교하고 빛이 원활하게 전달되는 현상을 관측하는데 성공했다.
연구팀은 현재 이 신기술을 기반으로 광 자극과 함께 정확한 뇌피질 전도를 실시간으로 측정할 수 있는 미세전극과 미세광원이 집적된 다기능성 미세전극 어레이 개발을 위한 후속연구를 진행 중이다. 광원과 전극이 함께 집적된 다기능성 소자 개발에 성공할 경우 광유전학이나 광 치료 등의 연구를 진행하는 뇌과학자들이 편하게 사용할 수 있는 뉴로 툴(Tool) 개발로 이어질 것으로 전문가들은 예상하고 있다.
이현주 교수는 "기존에는 광전 효과로 인해 불가피하게 발생하는 잡음 신호로 인해서 광 자극과 동시에 뇌피질 전도 측정이 불가능했지만 유연하고 투명한 미세전극 개발을 계기로 광 자극과는 무관하게 실시간으로 뇌피질 전도 측정이 가능하게 됐다”고 말했다.
이현주 교수 연구팀의 서지원 박사와 김기업 박사과정생, 그리고 이정용 교수 연구팀의 서기원 박사과정생이 각각 주도하고 의과학대학원 이정호 교수와 김정욱 박사가 참여한 이번 연구결과는 국제 학술지 '어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials)'誌 7월 2일 字에 게재됐으며 표지논문(Front Cover)으로 선정됐다. (논문명: Artifact-Free 2D Mapping of Neural Activity In Vivo through Transparent Gold Nanonetwork Array)
한편, 이 연구는 과학기술정보통신부 한국연구재단의 선도연구센터 사업의 지원으로 수행됐다.
2020.07.15 조회수 32450
광유전학 · 광치료 연구를 위한 투명 전극 개발
우리 대학 전기및전자공학부 이현주 교수와 이정용 교수, 의과학대학원 이정호 교수 공동연구팀이 폴리머 전기방사 기술을 미세 전자 기계 시스템(MEMS, Micro Electro Mechanical Systems) 공정에 접목해 실시간으로 뇌피질 전도 측정이 가능한 투명하고 유연한 미세전극 어레이(배열)를 개발했다고 15일 밝혔다.
☞ 폴리머: 한 종류 또는 수 종류의 구성단위가 서로에게 많은 수의 화학결합으로 중합돼 연결된 상태의 분자로 구성된 화합물. 통상적으로 고분자 화합물(분자량이 1만 이상의 화합물)과 같은 의미로 사용되는 경우가 많은데 고분자를 영어로는 폴리머(polymer)라고 부른다.
☞ 전기방사: 폴리머(고분자) 용액에 고전압을 인가해 나노파이버(나노섬유)를 생산하는 첨단 기술
☞ 미세 전자 기계 시스템: 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품 및 시스템을 설계·제작하고 응용하는 기술을 의미
이번에 개발된 뇌피질 전도 미세전극 어레이는 기존의 불투명한 금속 전극과는 달리 빛에 의해 발생하는 잡음 신호가 매우 작고 자유로운 빛의 전달이 가능해 광유전학 및 광 치료 연구에 큰 도움을 줄 것으로 기대된다.
최근 빛의 새로운 활용법과 생체 내 효능에 대한 발견으로 인해 빛을 생체 내의 특정 영역에 조사해 생기는 반응과 효과에 관한 연구들이 주목을 받고 있다. 대표적인 예가 광유전학, 광 치료 기술 등이다. 광유전학은 기존 신경 자극기술과는 달리 매우 국소적인 부위의 신경 세포를 자극하고, 광 치료법은 수면장애와 알츠하이머병의 치료 가능성으로 이 분야에 관한 연구들이 활발히 진행되고 있다.
빛에 의한 생체 내 반응을 측정하는 대표적인 방법으로는 체내에 센서 등을 장착해서 호르몬의 분비과정에서 발생하는 전기생리 신호를 측정하는 방법이다. 통상적으로 전기생리 신호 측정을 위해 사용하는 일반적인 금속 박막 전극은 높은 반사도와 낮은 투과도 때문에 빛의 전달을 방해할 뿐만 아니라 빛을 쬘 때 베크렐 효과(금속 전극이 빛을 받으면 전극에 전위차가 생겨 전류가 흐르는 현상)에 의해 '포토일렉트릭 아티팩트'라는 잡음 신호가 발생한다. 따라서 일반 금속 박막 전극은 정확한 전기생리 신호를 측정하기가 어렵다.
이현주 교수팀은 그간 이런 문제해결을 위해 MEMS 공정을 통해 제작되는 미세전극 어레이를 투명화하기 위한 연구를 지속적으로 수행해왔는데 최근 폴리머 전기방사 기술을 MEMS 공정에 접목해 뇌피질 전도(ECoG, ElectroCorticoGram)측정을 위한 유연하고 투명한 미세전극 어레이를 제작하는데 성공했다. 이 장치는 높은 투과도를 지니고 있어 '포토일렉트릭 아티팩트'가 매우 약하고 또 빛의 전달이 매우 용이하기 때문에 다른 투명 미세전극 어레이와 비교해 보면 전기화학 임피던스가 낮아 뇌피질 전도 측정이 매우 유리하다.
연구팀은 자체개발한 유연·투명한 미세전극 어레이 성능평가를 위해 외부 변형에 따른 저항 변화와 전기방사 시간에 따른 전기화학 임피던스, 전하 저장 용량 등을 측정한 결과, 전극 자체의 특성을 쉽게 조절이 가능한 점 등 여러 면에서 우수한 성능을 보였다고 설명했다. 연구팀은 특히 미세 전극에서 발생하는 `포토일렉트릭 아티팩트'를 비교 분석했는데 10배 이상 감쇄 효과가 있음을 확인했다. 이와 함께 쥐 뇌의 다양한 피질 영역에 걸쳐 유연·투명한 미세전극 어레이를 위치시킨 후 광 자극을 통해 발생하는 뇌피질 전도 신호를 측정한 결과, 신호를 정량적으로 비교하고 빛이 원활하게 전달되는 현상을 관측하는데 성공했다.
연구팀은 현재 이 신기술을 기반으로 광 자극과 함께 정확한 뇌피질 전도를 실시간으로 측정할 수 있는 미세전극과 미세광원이 집적된 다기능성 미세전극 어레이 개발을 위한 후속연구를 진행 중이다. 광원과 전극이 함께 집적된 다기능성 소자 개발에 성공할 경우 광유전학이나 광 치료 등의 연구를 진행하는 뇌과학자들이 편하게 사용할 수 있는 뉴로 툴(Tool) 개발로 이어질 것으로 전문가들은 예상하고 있다.
이현주 교수는 "기존에는 광전 효과로 인해 불가피하게 발생하는 잡음 신호로 인해서 광 자극과 동시에 뇌피질 전도 측정이 불가능했지만 유연하고 투명한 미세전극 개발을 계기로 광 자극과는 무관하게 실시간으로 뇌피질 전도 측정이 가능하게 됐다”고 말했다.
이현주 교수 연구팀의 서지원 박사와 김기업 박사과정생, 그리고 이정용 교수 연구팀의 서기원 박사과정생이 각각 주도하고 의과학대학원 이정호 교수와 김정욱 박사가 참여한 이번 연구결과는 국제 학술지 '어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials)'誌 7월 2일 字에 게재됐으며 표지논문(Front Cover)으로 선정됐다. (논문명: Artifact-Free 2D Mapping of Neural Activity In Vivo through Transparent Gold Nanonetwork Array)
한편, 이 연구는 과학기술정보통신부 한국연구재단의 선도연구센터 사업의 지원으로 수행됐다.
2020.07.15 조회수 32450 뇌 구조를 정확히 볼 수 있는 3차원 분석기술 개발
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 뇌신경과학 연구에서 광범위하게 사용되는 실험용 쥐의 뇌 절편 영상을 자동으로 보정하고 규격화하여 신경세포의 3차원 분포정보를 정확하게 얻을 수 있는 핵심 분석 기술을 개발했다.
이 기술은 실험자의 경험에 의존하던 기존 분석 방식의 문제점을 해결하는 한편 여러 개체에서 얻은 뇌 이미지를 표준적인 3차원 지도상에서 비교 분석할 수 있도록 한다. 이는 기존의 개체별 분석에서는 관측하기 힘든 뇌세포 간 상호 연결 형태의 정확한 공간적 분포를 발견할 수 있는 길을 열었다는 점에서 의미가 크다.
연구팀은 생명과학과 이승희 교수팀과의 협력 연구를 통해 실험에서 얻어진 쥐의 뇌 절편 데이터를 분석했는데, 이 기술을 적용한 결과 시각시스템의 초기구조인 외측 슬상핵(Lateral geniculate nucleus)과 시각피질 (Visual cortex) 사이의 정확한 연결 구조 분포를 측정할 수 있었다. 기존 분석 방식으로는 불가능했던 다중 개체로부터 얻어진 데이터의 표준화를 통해 뇌 전역에 걸친 신경세포의 연결성을 분석할 수 있음을 확인한 것이다.
뇌인지공학프로그램 최우철 박사과정과 송준호 연구원이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `셀(cell)'의 온라인 자매지 `셀 리포츠(Cell Reports)' 5월 26일 자에 게재됐다. (논문명 : Precise mapping of single neurons by calibrated 3-D reconstruction of brain slices reveals topographic projection in mouse visual cortex).
이에 앞서 연구팀은 이 기술을 활용해 UC 버클리대학의 양단(Yang Dan) 교수와의 공동연구에도 참여했고 그 결과를 국제 학술지 `사이언스 (Science)' 1월 24일 자에 발표했다. (논문명: A Common Hub for Sleep and Motor Control in the Substantia Nigra).
통상 쥐의 뇌 절편 영상을 이용한 연구에서는 특정 단백질에 형광물질을 발현시킨 뇌를 잘라 신경세포의 분포 등을 분석하는 방법이 광범위하게 사용된다. 이때 형광을 발현하는 신경세포를 현미경을 통해 연구자의 육안으로 관측하고, 얼마나 많은 신경세포가 뇌의 어느 특정 영역에 위치하는지 일일이 수동적으로 분석한다. 이런 방법은 연구자의 경험에 크게 의존하여 오차가 클 수밖에 없고, 각각의 개체에서 관측된 신경세포의 위치나 수량을 표준적인 공통의 방법으로 동시에 분석할 수 없다는 한계를 갖고 있다.
백 교수 연구팀은 미국의 Allen Brain Atlas 프로젝트에서 제공한 쥐 두뇌의 3차원 표준 데이터에 기반하여, 임의의 각도에서 잘라낸 뇌 절편 이미지들을 SURF(Speeded Up Robust Feature Points) 특징점과 HOG(Histogram of Oriented Gradients descriptor) 형상 기술자를 이용하여 데이터베이스와 비교하는 계산적인 분석 방법을 사용했다.
그 결과, 실험에서 얻은 뇌 이미지와 가장 잘 일치하는 데이터베이스의 3차원 위치를 100마이크로미터(μm), 1도 이내의 오차로 찾아낼 수 있었다. 연구팀은 이를 통해 각 2차원 뇌 이미지의 위치 정보를 3차원 공간상의 위치로 정확히 계산하고, 여러 개체에서 얻어진 신경 세포의 위치를 동일한 3차원 공간에 투영해 정확하게 분석할 수 있음을 확인했다.
따라서 이 기술을 활용하면 다양한 기법으로 생성된 뇌 슬라이스 이미지를 이용해 신경세포의 3차원 위치를 뇌 전체에서 자동적으로 계산할 수 있어, 기존의 방법으로는 분석하기 어려운 수천~수만 개의 신경세포들의 정확한 뇌 내 분포 위치 및 상대적 공간 배열을 한번에 분석하는 것이 가능하다.
또 신경세포들의 연결성을 표준적으로 보정된 3차원 공간에서 표현할 수 있어 특정 뇌 영역 간의 연결은 물론 뇌 전역의 네트워크 분포를 여러 개체의 데이터를 사용해 동시분석도 가능하다. 따라서 기존 방식의 동물실험 분석에서 요구되던 시간과 비용을 크게 줄일 수 있을 것으로 기대된다.
올 6월 현재 백 교수 연구팀의 이 기술은 KAIST내 여러 실험실과 미국 MIT, 하버드(Harvard), 칼텍(Caltech), UC 샌디에고(San Diego) 등 세계 유수 대학의 연구 그룹에서 진행하는 뇌 신경 세포의 네트워크 분석에 활용되고 있다.
백세범 교수는 "이번 연구를 통해 개발된 기술은 형광 뇌 이미지를 이용하는 모든 연구에 바로 적용할 수 있을 뿐만 아니라 그 밖에 다양한 종류의 이미지 데이터에도 광범위하게 적용 가능하다ˮ면서 "향후 쥐의 뇌 슬라이스를 이용하는 다양한 분석에 표준적인 기법으로 자리 잡을 수 있을 것으로 기대된다ˮ고 말했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST의 모험연구사업의 지원을 받아 수행됐다.
2020.06.08 조회수 17769
뇌 구조를 정확히 볼 수 있는 3차원 분석기술 개발
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 뇌신경과학 연구에서 광범위하게 사용되는 실험용 쥐의 뇌 절편 영상을 자동으로 보정하고 규격화하여 신경세포의 3차원 분포정보를 정확하게 얻을 수 있는 핵심 분석 기술을 개발했다.
이 기술은 실험자의 경험에 의존하던 기존 분석 방식의 문제점을 해결하는 한편 여러 개체에서 얻은 뇌 이미지를 표준적인 3차원 지도상에서 비교 분석할 수 있도록 한다. 이는 기존의 개체별 분석에서는 관측하기 힘든 뇌세포 간 상호 연결 형태의 정확한 공간적 분포를 발견할 수 있는 길을 열었다는 점에서 의미가 크다.
연구팀은 생명과학과 이승희 교수팀과의 협력 연구를 통해 실험에서 얻어진 쥐의 뇌 절편 데이터를 분석했는데, 이 기술을 적용한 결과 시각시스템의 초기구조인 외측 슬상핵(Lateral geniculate nucleus)과 시각피질 (Visual cortex) 사이의 정확한 연결 구조 분포를 측정할 수 있었다. 기존 분석 방식으로는 불가능했던 다중 개체로부터 얻어진 데이터의 표준화를 통해 뇌 전역에 걸친 신경세포의 연결성을 분석할 수 있음을 확인한 것이다.
뇌인지공학프로그램 최우철 박사과정과 송준호 연구원이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `셀(cell)'의 온라인 자매지 `셀 리포츠(Cell Reports)' 5월 26일 자에 게재됐다. (논문명 : Precise mapping of single neurons by calibrated 3-D reconstruction of brain slices reveals topographic projection in mouse visual cortex).
이에 앞서 연구팀은 이 기술을 활용해 UC 버클리대학의 양단(Yang Dan) 교수와의 공동연구에도 참여했고 그 결과를 국제 학술지 `사이언스 (Science)' 1월 24일 자에 발표했다. (논문명: A Common Hub for Sleep and Motor Control in the Substantia Nigra).
통상 쥐의 뇌 절편 영상을 이용한 연구에서는 특정 단백질에 형광물질을 발현시킨 뇌를 잘라 신경세포의 분포 등을 분석하는 방법이 광범위하게 사용된다. 이때 형광을 발현하는 신경세포를 현미경을 통해 연구자의 육안으로 관측하고, 얼마나 많은 신경세포가 뇌의 어느 특정 영역에 위치하는지 일일이 수동적으로 분석한다. 이런 방법은 연구자의 경험에 크게 의존하여 오차가 클 수밖에 없고, 각각의 개체에서 관측된 신경세포의 위치나 수량을 표준적인 공통의 방법으로 동시에 분석할 수 없다는 한계를 갖고 있다.
백 교수 연구팀은 미국의 Allen Brain Atlas 프로젝트에서 제공한 쥐 두뇌의 3차원 표준 데이터에 기반하여, 임의의 각도에서 잘라낸 뇌 절편 이미지들을 SURF(Speeded Up Robust Feature Points) 특징점과 HOG(Histogram of Oriented Gradients descriptor) 형상 기술자를 이용하여 데이터베이스와 비교하는 계산적인 분석 방법을 사용했다.
그 결과, 실험에서 얻은 뇌 이미지와 가장 잘 일치하는 데이터베이스의 3차원 위치를 100마이크로미터(μm), 1도 이내의 오차로 찾아낼 수 있었다. 연구팀은 이를 통해 각 2차원 뇌 이미지의 위치 정보를 3차원 공간상의 위치로 정확히 계산하고, 여러 개체에서 얻어진 신경 세포의 위치를 동일한 3차원 공간에 투영해 정확하게 분석할 수 있음을 확인했다.
따라서 이 기술을 활용하면 다양한 기법으로 생성된 뇌 슬라이스 이미지를 이용해 신경세포의 3차원 위치를 뇌 전체에서 자동적으로 계산할 수 있어, 기존의 방법으로는 분석하기 어려운 수천~수만 개의 신경세포들의 정확한 뇌 내 분포 위치 및 상대적 공간 배열을 한번에 분석하는 것이 가능하다.
또 신경세포들의 연결성을 표준적으로 보정된 3차원 공간에서 표현할 수 있어 특정 뇌 영역 간의 연결은 물론 뇌 전역의 네트워크 분포를 여러 개체의 데이터를 사용해 동시분석도 가능하다. 따라서 기존 방식의 동물실험 분석에서 요구되던 시간과 비용을 크게 줄일 수 있을 것으로 기대된다.
올 6월 현재 백 교수 연구팀의 이 기술은 KAIST내 여러 실험실과 미국 MIT, 하버드(Harvard), 칼텍(Caltech), UC 샌디에고(San Diego) 등 세계 유수 대학의 연구 그룹에서 진행하는 뇌 신경 세포의 네트워크 분석에 활용되고 있다.
백세범 교수는 "이번 연구를 통해 개발된 기술은 형광 뇌 이미지를 이용하는 모든 연구에 바로 적용할 수 있을 뿐만 아니라 그 밖에 다양한 종류의 이미지 데이터에도 광범위하게 적용 가능하다ˮ면서 "향후 쥐의 뇌 슬라이스를 이용하는 다양한 분석에 표준적인 기법으로 자리 잡을 수 있을 것으로 기대된다ˮ고 말했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST의 모험연구사업의 지원을 받아 수행됐다.
2020.06.08 조회수 17769 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19502
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19502 머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 15970
머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 15970 두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23 조회수 17598
두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23 조회수 17598 포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
2020.03.11 조회수 16295
포유류 종마다 시각 뇌신경망 구조 다른 원인 밝혀
바이오및뇌공학과 백세범 교수 연구팀이 포유류 종들의 시각피질에서 서로 다른 뇌신경망 구조가 형성되는 원리를 밝혔다.
이번 연구결과는 시스템 뇌신경과학 분야에서 수십 년간 설명되지 못했던 문제를 이론적 접근과 계산적 모델 시뮬레이션을 통해 해답을 제시한 계산뇌과학 연구의 성공적인 예시로 평가된다.
연구팀은 두뇌의 시각피질과 망막에 분포하는 신경세포들 간의 정보 추출 비율을 분석함으로써 특정 포유류 종이 갖는 시각피질의 기능적 구조를 예측할 수 있음을 밝혀냈다.
연구팀은 서로 다른 크기의 망막과 시각피질 사이의 신경망 연결 모델을 시뮬레이션 해 두 정보 처리 영역 사이에 대응되는 신경세포의 비율이 달라짐에 따라 완전히 다른 두 가지 구조의 기능성 뇌지도가 형성됨을 보이고, 이 결과가 실제 실험에서 관측되는 신경망 구조와 일치함을 증명했다.
장재선, 송민 박사과정이 공동 1저자로 참여한 이번 연구는 국제 학술지 ‘셀(cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 3월 10일 자에 게재됐다. (논문명 : Retino-cortical mapping ratio predicts columnar and salt-and-pepper organization in mammalian visual cortex)
포유류의 시각피질에서는 시각 자극의 방향에 따라 반응의 정도가 달라지는 성질인 방향 선택성(orientation selectivity)을 갖는 세포들이 관측된다. 원숭이, 고양이 등의 종에서는 이 세포들의 선호 방향이 연속적, 주기적인 형태로 변하는 방향성 지도(orientation map) 구조를 형성하는 반면, 생쥐 등의 설치류에서는 마치 소금과 후추를 뿌려 놓은 듯한 무작위에 가까운 형태로 분포해, 이를 소금-후추 구조(salt-and-pepper organization)라 한다.
동일한 역할을 수행하는 것으로 보이는 기능성 뇌신경망이 이렇게 종에 따라 다른 구조를 갖는 원인을 찾기 위해 지난 수십여 년 간 다양한 연구가 진행됐으나, 아직까지도 이를 결정하는 요인에 대해서는 명확하게 알려진 바가 없었다.
이러한 원리를 규명하기 위해 연구팀은 서로 다른 크기의 망막과 시각피질이 연결될 때 동일한 망막 신호를 샘플링하는 시각피질 세포의 비율이 달라지게 된다고 가정했다. 이러한 조건에서 망막-시각피질 신호의 샘플링 형태를 시뮬레이션 하여 샘플링 비율에 따라 시각피질에서 형성되는 기능성 지도의 구조가 완전히 다르게 결정될 수 있음을 발견했다.
이 결과를 기반으로 연구팀은 다양한 종들에 대한 망막 및 시각피질 데이터를 종합적으로 비교해 시각피질이 클수록, 또 망막이 작을수록 연속적인 방향성 지도가 형성되는 경향이 있음을 확인했다.
또한, 기존의 연구에서 확인된 포유류 여덟 종의 시각피질-망막 크기 비율을 기반으로 한 모델을 정량적으로 시뮬레이션하고, 이 결과가 실험에서 관측된 것과 같이 방향성 지도 존재 여부에 따라 두 그룹으로 명확히 나누어짐을 확인했다.
이러한 결과는 다른 종으로 진화가 이뤄질 때, 감각기관의 크기와 같은 지극히 단순한 물리적인 조건의 차이에 의해서도 뇌신경망의 구조가 완전히 다른 방향으로 변화될 수 있음을 뜻한다. 이는 다양한 생물학적 구조가 기존의 생각보다 훨씬 단순한 물리적 요소들의 차이에 의해 예측되거나 설명될 수 있음을 보여준다.
백세범 교수는 “이미 오랫동안 알려져 있었으나 그 의미를 찾아내지 못했던 데이터들과 이론적인 모델을 결합해 새로운 발견을 도출해낸 의미 있는 연구이다”라며 “뇌 과학뿐만 아니라 계통분류학, 진화생물학 등 생물의 기능적 구조와 관련된 다양한 생물학 분야에서 이론적 모델 연구의 역할에 대한 중요한 시각을 제공할 것이다”라고 언급했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업의 지원을 받아 수행됐다.
2020.03.11 조회수 16295 허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22 조회수 10566
허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22 조회수 10566 임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25 조회수 12094
임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25 조회수 12094 서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24 조회수 16228
서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24 조회수 16228 심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13 조회수 16665
심남석 연구원, 난치성 뇌전증의 새로운 유전자 진단법 개발
〈 심남석 연구원 〉
우리 대학 의과학대학원 심남석 박사과정(지도교수 : 이정호 교수), 연세대학교 의료원(의료원장 윤도흠) 세브란스 어린이병원 신경외과 김동석 교수, 소아신경과 강훈철 교수 공동 연구팀이 난치성 뇌전증의 원인 돌연변이를 정확하게 분석할 수 있는 새로운 진단법을 개발했다.
이번 연구를 통해 기초 과학 분야와 임상 진료 영역 간 차이로 환자에게 쉽게 적용하지 못했던 난치성 뇌전증 원인 유전자 진단을 실제 임상 영역에서 시행할 수 있을 것으로 보이며, 이를 통해 환자들에게 더 나은 치료법을 제시할 수 있을 것으로 기대된다.
심남석 박사과정이 1 저자로 참여한 이번 연구는 뇌병리 분야 국제 학술지 ‘악타 뉴로패쏠로지카 (Acta Neuropathologica)’ 8월 3일 자 온라인판에 게재됐다. (논문명 : Precise detection of low-level somatic mutation in resected epilepsy brain tissue)
뇌전증은 전 세계적으로 4번째로 높은 유병률을 보이는 신경학적 질환으로 높은 사회 경제적 비용이 소모된다. 그중 전체 뇌전증의 3~40%를 차지하는 난치성 뇌전증은 약물치료로 조절되지 않고 위험성이 높아 수술 치료가 요구되는 질병이다.
최근 연구팀은 이 난치성 뇌전증이 뇌 체성(사람의 신체적 성질) 돌연변이에 의해 발생한다는 사실을 규명해 새 치료법을 제안한 바 있다. 그러나 뇌 국소 부위에서 발생한 소량의 돌연변이를 찾는 기존 진단법은 정확도가 30% 이하로 매우 낮아 실제 사용에는 어려움이 많다.
연구팀은 세브란스 병원에서 뇌수술을 받은 난치성 뇌전증 환자 232명의 뇌 조직 및 말초 조직(혈액 또는 침)을 분석해 돌연변이가 자주 발생하는 타겟 유전자를 확보했다. 이 타겟 유전자를 대상으로 표적 유전자 복제 염기서열 분석법을 적용해 체성 돌연변이를 분석했다.
연구팀은 고심도 유전체 분석을 통해 최적의 표적 유전자 선별, 고심도 시퀀싱 분석 및 방법의 조합을 찾아 진단 정확도를 50%에서 최대 100%까지 높이는 데 성공했다.
특히 임상에서 쉽게 확보할 수 있는 뇌 조직 절편만으로도 정확도가 100%에 가까운 체성 돌연변이 유전자 진단이 가능함을 확인했다.
1 저자인 심남석 연구원은 “난치성 뇌전증의 유전자 진단은 현재 임상시험 중인 새로운 치료법의 필수적인 과정이다”라며 “높은 효율, 낮은 비용으로 유전자 진단을 할 수 있게 만들어 고통받는 환아들에게 도움을 주고 싶다”라고 말했다.
연구팀은 이번 연구 결과를 바탕으로 교원창업 기업(소바젠, 대표 김병태)을 통해 빠르고 정확한 난치성 뇌전증 원인 유전자 진단 제공할 예정이다.
이번 연구는 서경배 과학재단, 한국연구재단, 보건복지부, 교원창업 기업 소바젠의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구에서 발견한 체세포성 돌연변이
2019.08.13 조회수 16665 정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
2019.08.08 조회수 27950
정재웅 교수, 스마트폰으로 뇌 신경회로 무선 제어 기술 개발
〈 김충연, 변상혁 박사과정, 정재웅 교수〉
우리 대학 전기및전자공학부 정재웅 교수와 미국 워싱턴대(University of Washington) 마이클 브루카스(Michael Bruchas) 교수 공동 연구팀이 스마트폰 앱 조작을 통해 약물과 빛을 뇌 특정 부위에 전달함으로써 신경회로를 정교하게 조절할 수 있는 뇌 이식용 무선 기기를 개발했다.
이번 기술 개발을 통해 장기간의 동물 실험이 필요한 신약 개발뿐 아니라 치매, 파킨슨병 등 뇌 질환 치료에도 적용할 수 있을 것으로 기대된다.
라자 콰지(Raza Qazi, 1저자), 김충연, 변상혁 연구원이 개발하고 워싱턴대 신경과학 연구원들이 공동으로 참여한 이번 연구는 의공학 분야 국제 학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 8월 6일 자에 게재됐다. (논문명 : Wireless optofluidic brain probes for chronic neuropharmacology and photostimulation).
광유전학과 신경약물학은 주변 신경회로에 영향을 주지 않고 목표로 하는 뉴런이나 신경회로만을 빛 또는 약물, 혹은 그 둘의 조합을 이용해 정교하게 제어할 수 있다. 기존의 전기자극을 활용한 방법에 비해 훨씬 더 높은 시공간적 해상도를 가져 최근 뇌 연구 및 뇌 질병 치료 목적으로 주목받고 있다.
하지만 현재 뇌 연구에 일반적으로 쓰는 기기는 상대적으로 크기가 커 뇌 조직 손상, 정교한 선택적 신경회로 제어 불가, 하나의 다기능성 프로브(probe) 형태로 구현이 어렵다. 또한, 기존 기기는 실리카(silica)와 금속 등 고강성 재료로 제작돼 부드러운 뇌 조직과의 기계 특성적 간극이 있다. 이러한 특성으로 인해 염증반응을 악화시켜 장기간 이식용으로 적합하지 않다.
무엇보다 일반적으로 연구실에서 쓰이고 있는 광섬유, 약물주입관 등은 뇌 이식 후 외부기기에 선이 연결된 형태로 사용해야 해 자유로운 행동을 크게 제약하게 된다.
연구팀은 중합체(polymer) 미세유체관과 마이크로 LED를 결합해 머리카락 두께의 유연한 탐침을 만들고, 이를 소형 블루투스 기반 제어 회로와 교체 가능한 약물 카트리지와 결합했다. 이를 통해 스마트폰 앱을 통해 무선으로 마이크로 LED와 약물 전달을 제어할 수 있는 무게 2g의 뇌 이식용 기기를 구현했다.
특히 약물 카트리지는 레고의 원리를 모사해 탐침 부분과 쉽게 조립 및 분리할 수 있도록 제작해, 필요할 때마다 새로운 약물 카트리지를 결합함으로써 원하는 약물을 장기간에 걸쳐 뇌의 특정 부위에 반복 전달할 수 있도록 만들었다.
연구팀은 이 기기를 쥐의 뇌 보상회로에 이식한 후 도파민 활성 약물과 억제 약물이 든 카트리지를 기기와 결합했다. 그 후 간단한 스마트폰 앱 제어와 도파민 활성 약물을 이용해 원하는 타이밍에 자유롭게 움직이는 쥐의 행동을 증가, 억제하는 데 성공했다.
또한, 연구팀은 쥐의 뇌에서 장소 선호도를 유도할 수 있는 부위에 빛에 반응하는 단백질을 주입해 신경세포가 빛에 반응하도록 처리했다.
그 후 쥐가 특정 장소로 이동했을 때 마이크로 LED를 켜 빛 자극을 통해 쥐가 그 장소에 계속 머물고 싶게 만들었다. 반대로 약물 전달을 통해 뇌 신경회로를 제어함으로써 쥐의 특정 장소 선호도를 없애는 데도 성공했다.
정 교수는 “빛과 약물을 이용한 신경회로 제어는 기존의 전기자극 방법보다 훨씬 더 정교해 부작용 없는 뇌 제어가 가능하다”라며 “개발된 기기는 간단한 스마트폰 조작으로 뇌의 특정 회로를 빛과 약물을 이용해 반복적, 장기적으로 무선 제어가 가능해 뇌 기능을 밝혀내기 위한 연구나 향후 뇌 질환의 치료에도 유용하게 적용할 수 있을 것이다”라고 말했다.
연구팀은 이 기술을 인체에 적용하기 위해 두개골 내에 완전히 이식할 수 있고 반영구적 사용이 가능한 형태로 디자인을 발전시키는 확장 연구를 계획하고 있다.
이번 연구는 한국연구재단 신진연구자지원사업(완전 이식 가능한 무선 유연성 광유체 뉴럴 임플랜트 개발 및 뇌 연구를 위한 광유전학/광약물학에의 적용) 및 기초연구실 지원사업(유전자 및 신경회로 조절 기반 중독 행동 제어 기초연구실)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 디바이스가 이식된 쥐의 사진
그림2. 스마트폰앱을 이용한 마이크로 LED 컨트롤
그림3. 개발된 뇌 이식용 무선 디바이스
2019.08.08 조회수 27950 박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17 조회수 19339
박준성 연구원, 알츠하이머병의 새로운 원인 규명
〈 박준성 박사 〉
우리 대학 의과학대학원 박준성 박사(지도교수 : 이정호 교수), KISTI(한국과학기술정보연구원) 국가슈퍼컴퓨팅본부 유석종 박사 공동 연구팀이 노화 과정에서 발생하는 후천적 뇌 돌연변이가 알츠하이머병의 새 원인이 될 수 있다는 이론을 제시했다.
연구팀은 52명의 알츠하이머병 환자에게 얻은 사후 뇌 조직에서 전장 엑솜 유전체 서열(whole-exome sequencing) 데이터 분석을 통해 알츠하이머병에 존재하는 뇌 체성 유전변이를 찾아냈다. 또한, 뇌 체성 돌연변이가 알츠하이머병의 중요 원인으로 알려진 신경섬유다발 형성을 비정상적으로 증가시킴을 확인했다.
박준성 박사와 KISTI 이준학 박사가 공동 1 저자로 참여한 이번 연구는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 7월 12일자 온라인판에 게재됐다. (논문명 : Brain somatic mutations observed in Alzheimer's disease associated with aging and dysregulation of tau phosphorylation)
노인성 치매의 가장 흔한 원인으로 알려진 알츠하이머병은 전 세계 GDP의 1%를 차지할 정도로 사회, 경제적 소모비용이 큰 질환이다. 하지만 여전히 알츠하이머병을 일으키는 분자 유전학적 원인은 명확하게 규명되지 않고 있다.
기존의 알츠하이머병 유전체 연구는 주로 환자의 말초조직인 혈액에서 전장유전체 연관분석(Genome-wide association study)을 하거나, 이미 가족력이 있는 환자에서 발견된 일부 유전자들(e.g., APP, PSEN1/2)에 대한 유전자 패널 분석 등이 주를 이루었다.
연구팀은 산발성 알츠하이머병 환자들에게 내후각피질에서 신경섬유다발이 공통으로 나타나는 현상에 주목해 알츠하이머병 환자의 뇌 조직에서 직접 엑솜 유전체 데이터를 생성해 알츠하이머병 뇌-특이적 체성 유전변이를 발굴했다.
연구팀은 알츠하이머병 환자와 정상인의 해마 형성체 부위를 레이저 현미 해부법을 통해 정밀하게 오려냈고, 저빈도의 체성 유전변이(Somatic mutation)를 정확하게 찾아내기 위해 대용량 고심도 엑솜 시퀀싱 데이터를 생성하고 저빈도 체성 유전변이 분석에 특화된 분석 파이프라인을 독자적으로 구축했다.
이러한 새 방법론을 통해 실제로 알츠하이머병 환자의 뇌에 체성 유전변이가 실제로 존재함을 체계적으로 규명함과 동시에 체성 유전변이의 누적속도 및 신경섬유다발 형성과의 관련성도 함께 밝혀냈다.
연구팀의 발견은 알츠하이머병의 발병에 체성 유전변이가 주요한 역할을 할 수 있음을 강력하게 시사하는 것으로, 알츠하이머병 유전체 연구에 대한 새로운 틀을 제시함과 동시에 향후 다른 신경퇴행성뇌질환의 연구에도 기여할 수 있을 것으로 기대된다.
연구팀은 이번 연구 결과를 바탕으로 교원 창업 기업(소바젠, 대표 김병태)을 통해 알츠하이머 질환의 진단과 치료제 개발에 나설 예정이다.
KISTI 유석종 박사는 연구팀이 구축한 저빈도 체성 유전변이 분석 파이프라인 및 빅데이터 분석을 위한 슈퍼컴퓨팅 기술을 통해 알츠하이머병의 새로운 발병 원리를 밝혀냈다라며 타 유전체 기반 연구에 활용할 수 있는 기반을 마련했다라고 말했다.
이번 연구는 서경배 과학재단, 보건복지부 및 한국과학기술정보연구원의 지원을 받아 수행됐고, 신속한 유전체 빅데이터 분석을 위해 KISTI의 슈퍼컴퓨터 5호기 누리온 시스템이 활용됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 체성 유전변이 분석 파이프라인
그림2. 신경섬유성다발 형성에 관여하는 체성 유전변이
그림3. PIN1 유전자에 발생한 병원성 뇌 체성유전변이와 신경섬유다발 형성과의 관계 규명
2019.07.17 조회수 19339