%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B8%B0%EC%88%A0%EB%8C%80%ED%95%99
-
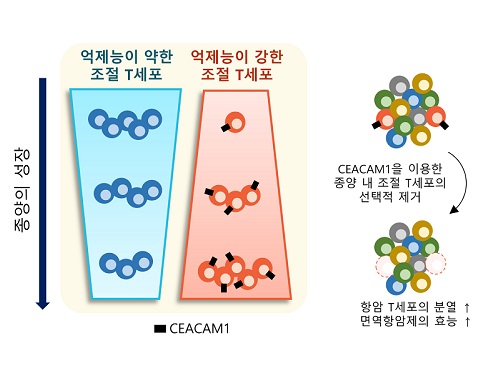 표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 7650
표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 7650 -
 왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
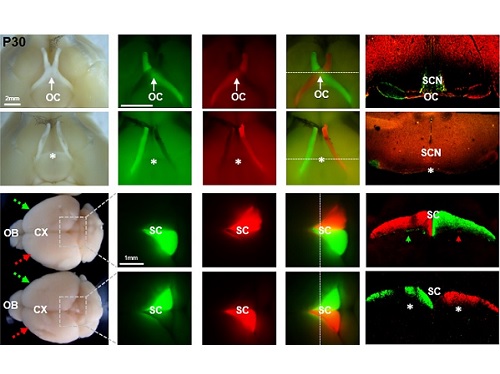
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 8913
왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 8913 -
 새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
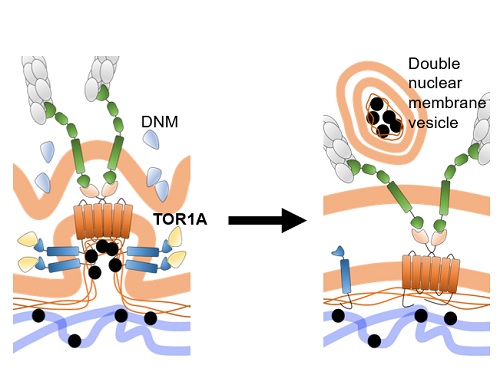
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 9625
새로운 세포핵 단백질의 이동 루트 발견
인간의 생명 정보를 담고 있는 DNA는 세포핵(nucleus) 내에 존재하며 이 정보는 전령 RNA(messenger RNA, mRNA)에 담겨 세포질로 이동 후 단백질 생성의 기초가 된다는 것이 소위 유전자 발현의 센트럴 도그마(central dogma of eukaryotic gene expression)다. 이 과정이 온전히 이루어지기 위해서는 유전자 발현의 최종 산물인 단백질 중 DNA 정보를 유지 및 활용하는 단백질들이 다시 세포핵으로 이동하여 작용하는 순환의 과정이 필요하다.
세포핵은 단백질의 투과가 불가능한 이중의 지질막(double-layered lipid membrane)으로 둘러싸인 구조이기 때문에 세포질에서 생성된 단백질이 핵으로 이동하기 위해서는 핵공(nuclear pore)라는 작은 구멍을 통과해야만 가능한 것으로 알려져 있다. 그리고, 핵공을 통해 세포핵으로 이동이 가능한 단백질들은 핵 이동 신호(nuclear localization signal, NLS)라는 부위를 포함하고 있는 것으로 잘 알려져 있다. 이 단백질 이동 신호 발견의 공로로 군터 블로벨 (Gunter Blobel)교수가 1999년에 노벨 생리의학상을 수상한 바도 있다.
다만, 세포핵은 특정한 크기로 유지가 되고 있기 때문에 세포질에서 생성된 단백질들이 지속적으로 핵으로 운송이 되기만 해서는 안 되고, 기능을 완수한 단백질들은 핵공을 통해 다시 세포질로 이동하거나 핵 내에서 분해되어 핵 내에 특정 농도 이상 단백질이 쌓이는 것을 방지해야 한다. 문제는 핵 이동 신호는 대부분 핵단백질들에 공통적으로 존재하지만 핵 탈출 신호(nuclear export signal)는 일부 핵단백질에만 존재하기 때문에 세포핵에서 세포질로 단백질 방출에 대해서는 명확한 설명이 어려운 상황이었다.
우리 대학 생명과학과 김진우 교수 연구실에서는 특정 DNA 정보를 인식해 유전자 발현을 유도 또는 억제하는 전사인자의 한 종류인 호메오단백질의 기능에 대한 연구를 수행하고 있다. 인간에 200여 종이나 있는 호메오단백질은 동물 배아의 특정한 부분에서만 집중적으로 작용하여 머리, 몸통, 팔, 다리 등 다양한 신체 기관과 조직들을 생성하는데 핵심적인 역할을 한다. 따라서 특정 호메오단백질이 정상적 기능을 하지 못하면 여러 신체 기관들이 정상적으로 만들어지지 못하는 심각한 발달 이상이 나타난다.
호메오단백질들은 세포핵 내에서 전형적 전사인자 기능을 하는 것 외에도 세포와 세포 사이를 이동하여 작용하는 세포 간 신호전달자의 기능도 있다는 것을 김진우 교수 연구실이 규명한 바 있다. 김 교수 연구팀은 호메오단백질들의 세포 외부로의 분비는 이들 단백질 생성되는 세포질이 아니라 기능을 수행하는 세포핵에서 시작된다는 점을 확인했다. 또, 이 과정은 핵공을 통한 세포핵-세포질 경로가 아니라 세포막 구조를 매개할 것이라는 간접 증거도 확인했다. 결국, OTX2라는 호메오단백질이 세포핵 내부에서 이중층 핵막 돌기(double-layered nuclear membrane bud)에 포집되는 모습을 전자현미경 분석을 통해 확인했다. 별첨한 모식도에서 설명되어 있듯이, OTX2가 핵막 돌기에 포집되는 과정은 여러 분자의 OTX2 단백질이 핵막 이중층의 내막에 있는 SUN1이라는 단백질에 직접 결합을 하는 것에서부터 시작이 되는데, SUN1은 핵막 외막의 SYNE2라는 단백질과 연결이 되어 있기 때문에 핵막의 변형이 이중층에 걸쳐 이루어지게 된다. 그 후 OTX2가 포집된 핵막 돌기의 내막을 TORSINA1(TOR1A)이라는 세포막 절단 단백질이 한번 자르고 DYNAMIN(DNM)이라는 또다른 세포막 절단 단백질이 외막을 잘라서 이중층의 세포 소낭(double-layered membrane vesicle)으로 만들어 세포질에 방출하는 새로운 방식의 핵단백질의 세포질 운송 방식을 증명하였다.
더 나아가 김 교수팀은 이렇게 만들어진 OTX2 포집 세포소낭의 외막은 세포의 물질 소각 공장이라고 할 수 있는 리소좀(lysosome) 막과 융합되어 리소좀 내부의 지질 분해효소와 단백질 분해효소가 남은 소낭의 내막과 OTX2 단백질을 순차적으로 분해하도록 하는 기존의 핵단백질 분해 과정과 완전히 다른 방식의 핵단백질 분해 루트를 증명했다. 이러한 일련의 세포핵 탈출 과정 중 일부에 문제가 생기면 핵 내부에 과도하게 쌓인 OTX2가 응집체를 만들어 해당 세포의 핵 내 기능에 문제를 일으키는 한편 주변 세포로 이동도 되지 않아 이를 필요로 하는 동물의 시각 기능 발달에 문제가 생기는 것을 증명했다.
이 연구를 통해 김 교수팀은 세포핵과 세포질 사이의 단백질 이동 과정이 기존 알려진 핵공을 통한 루트보다 훨씬 다양한 방식으로 이루어질 수 있음을 제시하였고, 이 논문에서 예시로 증명한 OTX2 이외에도 많은 핵단백질들이 핵막 소포를 통해 이동할 가능성이 있어 이에 대한 추가 연구를 진행할 예정이다. 특히 핵막 소포를 통한 핵단백질의 방출이 원활하지 않을 때 암이나 퇴행성질환 등이 유발될 수 있어서, 이와 관련된 질병 연구도 병행할 예정이다.
이번 연구는 국제학술지인 Nature Communcations(https://doi.org/10.1038/s41467-023-36697-5)에 2월 27일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 박준우 박사가 제1 저자로 연구를 주도하였고, 한국기초과학지원연구원 권희석 박사 연구팀과 가톨릭의과대학 김인범 교수 연구팀이 함께 참여했다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.02.28 조회수 9625 -
 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 8692
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 8692 -
 뇌 속 자명종 신경회로 발견
우리 대학 생명과학과 김대수 교수 연구팀이 한국과학기술연구원(KIST) 김정진 박사팀과 공동연구를 통해 동물이 잠을 자는 동안에도 소리에 반응해 각성하는 원리를 규명했다고 20일 밝혔다.
수면은 뇌의 활동을 정비하고 건강을 유지하는 매우 중요한 생리작용이다. 잠을 자는 동안 감각신경의 작용이 차단되므로 주변의 위험을 감지하는 능력이 감소하게 된다. 그러나 많은 동물은 잠자는 동안에도 포식자의 접근을 감지하고 반응한다. 과학자들은 동물이 깊은 잠과 낮은 잠을 번갈아 자면서 언제 있을지 모를 위험에 대비한다고 생각했다.
김대수 교수 연구팀은 깊은 잠을 자는 동안에도 동물이 소리에 반응하는 신경회로가 있다는 사실을 발견했다. 깨어 있을 때는 청각 시상핵 (Medial geniculate thalamus)이 소리에 반응하지만 깊은 잠 즉 비 램수면 (Non-REM) 동안에는 배내측 시상핵(Mediodorsal thalamus)이 소리에 반응해 뇌를 깨운다는 사실을 밝혔다.
연구 결과 쥐가 깊은 잠에 빠졌을 때 청각 시상핵 신경도 잠을 자고 있었지만 배내측 시상핵 신경은 깨어 있어 소리를 들려주자 곧바로 반응했다. 또한 배내측 시상핵을 억제하면 소리를 들려줘도 쥐가 잠에서 깨어나지 못했으며 배내측 시상핵을 자극하면 소리 없이도 쥐가 수초 이내에 잠에서 깨어나는 것을 관찰할 수 있었다.
이것은 수면상태와 각성상태가 서로 다른 신경회로를 통해 청각신호를 전달 할 수 있다는 최초의 연구로서 국제 학술지 ‘커런트 바이올로지 (Current Biology)’에 2월 7일자로 보고됐으며 (https://www.nature.com/articles/d41586-023-00354-0) 국제학술지 네이처에 하이라이트 되었다. ( https://www.nature.com/articles/d41586-023-00354-0)
김대수 교수는 “이번 연구를 통해 수면 질환 등 다양한 뇌 질환에서 보이는 각성 및 감각장애에 대한 이해를 증진하고 향후 감각을 조절할 수 있는 디지털 헬스케어 개발 등 다양한 분야로 활용이 가능하다”라고 설명했다.
한편 이번 연구는 한국연구재단 중견연구재단 과제로 지원됐다.
2023.02.20 조회수 8958
뇌 속 자명종 신경회로 발견
우리 대학 생명과학과 김대수 교수 연구팀이 한국과학기술연구원(KIST) 김정진 박사팀과 공동연구를 통해 동물이 잠을 자는 동안에도 소리에 반응해 각성하는 원리를 규명했다고 20일 밝혔다.
수면은 뇌의 활동을 정비하고 건강을 유지하는 매우 중요한 생리작용이다. 잠을 자는 동안 감각신경의 작용이 차단되므로 주변의 위험을 감지하는 능력이 감소하게 된다. 그러나 많은 동물은 잠자는 동안에도 포식자의 접근을 감지하고 반응한다. 과학자들은 동물이 깊은 잠과 낮은 잠을 번갈아 자면서 언제 있을지 모를 위험에 대비한다고 생각했다.
김대수 교수 연구팀은 깊은 잠을 자는 동안에도 동물이 소리에 반응하는 신경회로가 있다는 사실을 발견했다. 깨어 있을 때는 청각 시상핵 (Medial geniculate thalamus)이 소리에 반응하지만 깊은 잠 즉 비 램수면 (Non-REM) 동안에는 배내측 시상핵(Mediodorsal thalamus)이 소리에 반응해 뇌를 깨운다는 사실을 밝혔다.
연구 결과 쥐가 깊은 잠에 빠졌을 때 청각 시상핵 신경도 잠을 자고 있었지만 배내측 시상핵 신경은 깨어 있어 소리를 들려주자 곧바로 반응했다. 또한 배내측 시상핵을 억제하면 소리를 들려줘도 쥐가 잠에서 깨어나지 못했으며 배내측 시상핵을 자극하면 소리 없이도 쥐가 수초 이내에 잠에서 깨어나는 것을 관찰할 수 있었다.
이것은 수면상태와 각성상태가 서로 다른 신경회로를 통해 청각신호를 전달 할 수 있다는 최초의 연구로서 국제 학술지 ‘커런트 바이올로지 (Current Biology)’에 2월 7일자로 보고됐으며 (https://www.nature.com/articles/d41586-023-00354-0) 국제학술지 네이처에 하이라이트 되었다. ( https://www.nature.com/articles/d41586-023-00354-0)
김대수 교수는 “이번 연구를 통해 수면 질환 등 다양한 뇌 질환에서 보이는 각성 및 감각장애에 대한 이해를 증진하고 향후 감각을 조절할 수 있는 디지털 헬스케어 개발 등 다양한 분야로 활용이 가능하다”라고 설명했다.
한편 이번 연구는 한국연구재단 중견연구재단 과제로 지원됐다.
2023.02.20 조회수 8958 -
 난치성 뇌전증 80%까지 유전자 진단 성공
우리 대학 의과학대학원 이정호 교수팀이 소아 난치성 뇌전증인 국소피질이형성증 환자 뇌 조직 연구를 통해 극미량의 뇌세포에 존재하는 돌연변이 검출하는 방법을 개발하고, 이를 통해 질병 발생의 메커니즘을 이해하고 치료의 초석을 마련했다고 15일 밝혔다.
이번 연구내용은 세계적 신경의학 학술지 `신경학 연보(Annals of Neurology)'에 지난 1월 26일 字 게재됐다.
뇌전증은 반복적인 발작을 특징으로 하는 신경질환이다. 뇌전증 유병률은약 0.5~1%로, 전세계적으로 5000만명이 넘는 환자가 있고, 국내에서는 30~40만명 정도로 치매, 뇌졸중 다음으로 많은 신경질환이다. 뇌전증 발작을 억제시키는 FDA(미국 식품의약국)에서 허가받은 항경련제가 20개가 넘는데도 불구하고, 발작이 조절되지 않아 일상생활에 지장을 초래하는 난치성 뇌전증 환자의 비율이 전체 뇌전증 환자의 30%에 이른다. 기존 항경련제는 뇌의 과도한 흥분을 억제해 발작 증상을 예방, 조절할 뿐, 질환의 원인, 질환 자체에는 영향을 주지는 못하고 있고, 뇌전증 발생 원인은 유전적 요인, 뇌염, 뇌종양 등 다양하지만 아직도 뇌전증 환자의 과반수 이상은 정확한 원인을 모르기 때문이다. 특히, 소아 난치성 뇌전증의 경우, 발작이 조절되지 않으면 뇌손상으로 이어져 지적장애, 발달장애로 인해 평생 장애를 갖고 살아가야 될 수 있으며 그들을 케어할 사회적 비용 또한 높아 치료제 개발이 절실하다.
국소피질이형성증은 태아의 뇌 발달과정 중에 생긴 이상으로 대뇌 피질이 국소적으로 비정상적인 구조를 띄며 뇌전증 발작을 동반하는 대표적인 소아 난치성 뇌전증 질환이다. 국소피질이형성증 난치성 뇌전증은 치료제가 없으며, 뇌절제술이 현재로서는 유일한 치료법이지만, 수술 후에도 재발하는 환자 비율이 30~40%로 높고, 수술이 불가능한 환자도 적지 않다.
연구팀은 기존에 전혀 원인을 알지 못했던 국소피질이형성증이 엠토르(이하 mTOR)* 경로 관련 유전자들에 뇌 세포 특이적으로 돌연변이가 생겨 발작이 발생된다는 사실을 2015년 네이쳐 메디슨 (Nature Medicine)에 세계 최초로 보고한 바 있다. 국제 뇌전증 협회 (ILAE)는 이를 반영하여 국소피질이형성증의 새로운 진단 기준을 2022년 개정하였다. 그러나 기존 뇌 돌연변이 분석 방법으로는 약 50%의 환자에게서만 유전적 진단이 가능하다는 한계를 갖고 있다.
* 엠토르(mTOR): 세포의 성장과 분열을 조절하는 신호전달 단백질
연구팀은 동물 실험 연구에서 전체 뇌세포의 1% 이하에 해당하는 극미량의 뇌세포만 해당 유전변이를 가져도 뇌 전체 발작 활성도를 변화시켜 발작을 초래한다는 것을 이미 확인한 바 있다. 이를 착안해 연구팀은 기존 뇌 조직 유전자 진단에서는 음성이 나온 환자 뇌조직에서 mTOR 경로의 발현 이상을 갖는 뇌 신경세포만 선택적으로 수집하는 방식으로 기존의 진단 방법의 한계를 극복하고자 했다.
기존방법으로 원인을 찾지 못한 국소피질이형성증 19명 환자 뇌 신경세포의 mTOR 활성화 신호를 표시하여 유세포 분석기를 통해 수집했고 유전체 염기서열 분석을 진행했다. (그림 1) 이 중 30%의 환자는 극미량의 돌연변이를 갖고 있었으며, 20%의 환자는 mTOR의 억제 유전자인 GATOR1 복합체의 생식세포 돌연변이를 갖고 있음을 밝혔다. 네덜란드 뇌 은행으로부터 공여받은 3명의 환자 뇌 조직에서 연구팀의 방법을 통해 3명 모두에서 유전적 진단이 가능했다.
이러한 진단적 접근은 기존 방식과 비교해 돌연변이를 약 34배까지 민감하게 검출하는 것과 동시에 전체 국소피질이형성증 환자의 유전적 진단율을 80%까지 끌어올릴 수 있었다. (그림 2) 이는 국소피질이형성증의 근본 원인을 규명하는 새로운 접근법을 제시하고, 난치성 뇌전증의 치료에 주요한 전기를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜을 통해 국소피질이형성증 환자의 정확한 유전자 진단을 돕고 해당 환자에서 돌연변이 유전자를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
KAIST 의과학대학원 졸업생으로 현재 서울 아산병원 소아청소년과에 근무하고 있는 의사과학자인 논문의 제1 저자 김자혜 박사는 "극미량의 체성돌연변이를 검출하는 새로운 접근을 통해 국소피질이형성증 발생의 정확한 원인을 이해하고, 이를 바탕으로 난치성 뇌전증 치료제 개발을 위한 작은 발판이 되길 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2023.02.15 조회수 8225
난치성 뇌전증 80%까지 유전자 진단 성공
우리 대학 의과학대학원 이정호 교수팀이 소아 난치성 뇌전증인 국소피질이형성증 환자 뇌 조직 연구를 통해 극미량의 뇌세포에 존재하는 돌연변이 검출하는 방법을 개발하고, 이를 통해 질병 발생의 메커니즘을 이해하고 치료의 초석을 마련했다고 15일 밝혔다.
이번 연구내용은 세계적 신경의학 학술지 `신경학 연보(Annals of Neurology)'에 지난 1월 26일 字 게재됐다.
뇌전증은 반복적인 발작을 특징으로 하는 신경질환이다. 뇌전증 유병률은약 0.5~1%로, 전세계적으로 5000만명이 넘는 환자가 있고, 국내에서는 30~40만명 정도로 치매, 뇌졸중 다음으로 많은 신경질환이다. 뇌전증 발작을 억제시키는 FDA(미국 식품의약국)에서 허가받은 항경련제가 20개가 넘는데도 불구하고, 발작이 조절되지 않아 일상생활에 지장을 초래하는 난치성 뇌전증 환자의 비율이 전체 뇌전증 환자의 30%에 이른다. 기존 항경련제는 뇌의 과도한 흥분을 억제해 발작 증상을 예방, 조절할 뿐, 질환의 원인, 질환 자체에는 영향을 주지는 못하고 있고, 뇌전증 발생 원인은 유전적 요인, 뇌염, 뇌종양 등 다양하지만 아직도 뇌전증 환자의 과반수 이상은 정확한 원인을 모르기 때문이다. 특히, 소아 난치성 뇌전증의 경우, 발작이 조절되지 않으면 뇌손상으로 이어져 지적장애, 발달장애로 인해 평생 장애를 갖고 살아가야 될 수 있으며 그들을 케어할 사회적 비용 또한 높아 치료제 개발이 절실하다.
국소피질이형성증은 태아의 뇌 발달과정 중에 생긴 이상으로 대뇌 피질이 국소적으로 비정상적인 구조를 띄며 뇌전증 발작을 동반하는 대표적인 소아 난치성 뇌전증 질환이다. 국소피질이형성증 난치성 뇌전증은 치료제가 없으며, 뇌절제술이 현재로서는 유일한 치료법이지만, 수술 후에도 재발하는 환자 비율이 30~40%로 높고, 수술이 불가능한 환자도 적지 않다.
연구팀은 기존에 전혀 원인을 알지 못했던 국소피질이형성증이 엠토르(이하 mTOR)* 경로 관련 유전자들에 뇌 세포 특이적으로 돌연변이가 생겨 발작이 발생된다는 사실을 2015년 네이쳐 메디슨 (Nature Medicine)에 세계 최초로 보고한 바 있다. 국제 뇌전증 협회 (ILAE)는 이를 반영하여 국소피질이형성증의 새로운 진단 기준을 2022년 개정하였다. 그러나 기존 뇌 돌연변이 분석 방법으로는 약 50%의 환자에게서만 유전적 진단이 가능하다는 한계를 갖고 있다.
* 엠토르(mTOR): 세포의 성장과 분열을 조절하는 신호전달 단백질
연구팀은 동물 실험 연구에서 전체 뇌세포의 1% 이하에 해당하는 극미량의 뇌세포만 해당 유전변이를 가져도 뇌 전체 발작 활성도를 변화시켜 발작을 초래한다는 것을 이미 확인한 바 있다. 이를 착안해 연구팀은 기존 뇌 조직 유전자 진단에서는 음성이 나온 환자 뇌조직에서 mTOR 경로의 발현 이상을 갖는 뇌 신경세포만 선택적으로 수집하는 방식으로 기존의 진단 방법의 한계를 극복하고자 했다.
기존방법으로 원인을 찾지 못한 국소피질이형성증 19명 환자 뇌 신경세포의 mTOR 활성화 신호를 표시하여 유세포 분석기를 통해 수집했고 유전체 염기서열 분석을 진행했다. (그림 1) 이 중 30%의 환자는 극미량의 돌연변이를 갖고 있었으며, 20%의 환자는 mTOR의 억제 유전자인 GATOR1 복합체의 생식세포 돌연변이를 갖고 있음을 밝혔다. 네덜란드 뇌 은행으로부터 공여받은 3명의 환자 뇌 조직에서 연구팀의 방법을 통해 3명 모두에서 유전적 진단이 가능했다.
이러한 진단적 접근은 기존 방식과 비교해 돌연변이를 약 34배까지 민감하게 검출하는 것과 동시에 전체 국소피질이형성증 환자의 유전적 진단율을 80%까지 끌어올릴 수 있었다. (그림 2) 이는 국소피질이형성증의 근본 원인을 규명하는 새로운 접근법을 제시하고, 난치성 뇌전증의 치료에 주요한 전기를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜을 통해 국소피질이형성증 환자의 정확한 유전자 진단을 돕고 해당 환자에서 돌연변이 유전자를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
KAIST 의과학대학원 졸업생으로 현재 서울 아산병원 소아청소년과에 근무하고 있는 의사과학자인 논문의 제1 저자 김자혜 박사는 "극미량의 체성돌연변이를 검출하는 새로운 접근을 통해 국소피질이형성증 발생의 정확한 원인을 이해하고, 이를 바탕으로 난치성 뇌전증 치료제 개발을 위한 작은 발판이 되길 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2023.02.15 조회수 8225 -
 획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
2023.02.01 조회수 8992
획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
2023.02.01 조회수 8992 -
 생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 8025
생체 노화 정도를 측정할 수 있는 새로운 RNA 지표 발견
우리 대학 생명과학과 이승재 교수 연구진(RNA 매개 건강장수 연구센터)이 동물의 생체 나이를 알려주는 지표로 새로운 *RNA 변화를 발견했다고 7일 밝혔다.
*RNA: DNA에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다. DNA에서 만들어진 RNA는 스플라이싱(RNA에서 단백질 정보가 없는 인트론을 제거하고 단백질로 번역되는 엑손을 연결하는 과정)을 통해 여러 조합을 가진 형태로 형성된다.
연구진은 수명이 짧고 노화 속도가 빨라 노화 및 장수 연구에 널리 사용되는 작은 동물인 예쁜꼬마선충을 활용해 노화 과정에서 RNA의 총체적인 변화를 분석했다. 연구진은 생체 노화가 진행됨에 따라 RNA가 잘려 최종 형태로 만들어질 때 오른쪽 끝부분에서 뒤쪽이 앞쪽보다 더욱 많이 쓰임을 밝혔고, 이를 억제하면 장수를 유도할 수 있음을 보였다. 이번 연구는 새로운 생리학적 노화 지표로서 RNA의 변화를 찾았고 이를 제어해 건강하게 오래 살 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 "이번 연구는 RNA 형성의 특정한 변화가 노화의 시계로 작동할 수 있음을 밝혔다는 점에서 의의가 있고, 이를 제어함으로써 향후 인간을 비롯한 생명체의 노화를 제어하여 건강한 장수를 추구하는 데 기여할 것이다ˮ고 연구의 중요성을 설명했다.
이번 연구는 우리 대학 생명과학과 함석진 박사, 김시은 박사과정생이 공동 제1 저자로 참여해 세계적인 과학학술지 `지놈 리서치(Genome Research)'에 지난 11월 9일 날짜로 게재됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Systematic transcriptome analysis associated with physiological and chronological aging in Caenorhabditis elegans)
2022.12.07 조회수 8025 -
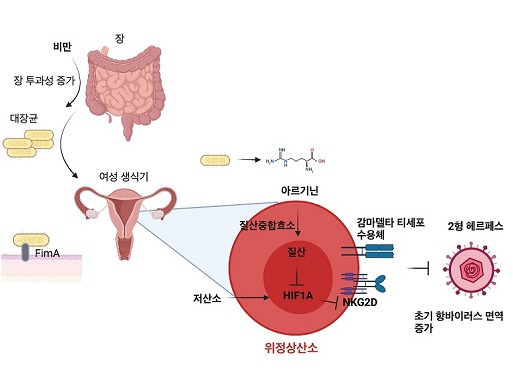 비만이 성병 헤르페스를 억제하는 메커니즘 규명
우리 연구진이 성병을 일으키는 2형 헤르페스 감염에 대해 비만인 암컷 생쥐가 더 높은 저항성을 갖는다는 사실을 밝혔다. 나쁘기만 할 것 같은 비만이 오히려 도움이 되는 역설적인 현상을 관찰한 것이다.
※ 2형 헤르페스: 헤르페스 바이러스의 일종으로 주로 성병을 일으키는 것으로 알려짐. 여성이 남성보다 더 높은 감염률을 보이는 것으로 알려짐.
의과학대학원 이흥규 교수 연구팀이 비만이 여성 생식기를 통한 단순 2형 헤르페스 바이러스(herpes simplex virus type 2) 감염에 대해 저항성을 강화하는 현상을 발견했으며, 그 메커니즘을 규명했음을 6일 밝혔다.
비만은 종양 등 각종 질병에 대해 안 좋은 영향을 끼치는 인자로 잘 알려져 있다. 하지만, 여성 생식기를 통한 2형 헤르페스 감염 시 질 내 공생미생물과 감마델타 T세포의 상호작용을 통해 바이러스에 저항성이 생긴다는 사실을 연구팀은 발견했다.
여성의 생식기 내에는 젖산균을 포함한 공생미생물이 서식하고 있다. 비만인 여성은 마른 여성과는 질 내 공생미생물의 조성이 다른 것으로 알려져 있는데, 연구팀은 비만인 암컷 생쥐의 질 내에는 장에서 유래한 것으로 보이는 균들이 섞여 있는 것을 발견했다.
연구팀은 장에서 유래된 것으로 보이는 비만 암컷 생쥐의 질 내에 유입된 균들이 아미노산의 일종인 아르기닌을 활발하게 생산하고 있다는 사실을 발견했고, 아르기닌이 바이러스 초기 감염에 중요한 역할을 한다는 사실을 발견했다.
연구팀은 이어서 아르기닌이 질 내의 감마델타 T 세포의 항바이러스 면역반응을 강화하고, 적응 면역세포가 활성화되는 시기보다 이른 시기에 바이러스 감염과 전파를 이미 억제하고 있음을 발견했다.
연구를 주도한 의과학대학원 이흥규 교수는 "이번 연구는 비만이 특정 감염 질병에는 도움이 될 수도 있다는 사실을 밝혔다는 점에서 의의가 있고, 앞으로 비만인 환자들의 바이러스 감염증 치료에 참고가 될 것이며, 연구 결과를 바탕으로 분자 메커니즘을 응용해 항바이러스제 개발에 박차를 가할 것이다ˮ고 연구의 중요성을 설명했다.
비만이 바이러스를 억제하는 현상을 발견하고 그 메커니즘을 규명한 이번 연구는 한국연구재단의 중견연구지원사업 및 바이오의료기술개발사업의 지원으로 수행됐으며, 의과학대학원 박장현 박사가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제학술지 `셀 리포트(Cell Reports)'에 지난 11월 8일 字 게재됐다.
2022.12.06 조회수 9137
비만이 성병 헤르페스를 억제하는 메커니즘 규명
우리 연구진이 성병을 일으키는 2형 헤르페스 감염에 대해 비만인 암컷 생쥐가 더 높은 저항성을 갖는다는 사실을 밝혔다. 나쁘기만 할 것 같은 비만이 오히려 도움이 되는 역설적인 현상을 관찰한 것이다.
※ 2형 헤르페스: 헤르페스 바이러스의 일종으로 주로 성병을 일으키는 것으로 알려짐. 여성이 남성보다 더 높은 감염률을 보이는 것으로 알려짐.
의과학대학원 이흥규 교수 연구팀이 비만이 여성 생식기를 통한 단순 2형 헤르페스 바이러스(herpes simplex virus type 2) 감염에 대해 저항성을 강화하는 현상을 발견했으며, 그 메커니즘을 규명했음을 6일 밝혔다.
비만은 종양 등 각종 질병에 대해 안 좋은 영향을 끼치는 인자로 잘 알려져 있다. 하지만, 여성 생식기를 통한 2형 헤르페스 감염 시 질 내 공생미생물과 감마델타 T세포의 상호작용을 통해 바이러스에 저항성이 생긴다는 사실을 연구팀은 발견했다.
여성의 생식기 내에는 젖산균을 포함한 공생미생물이 서식하고 있다. 비만인 여성은 마른 여성과는 질 내 공생미생물의 조성이 다른 것으로 알려져 있는데, 연구팀은 비만인 암컷 생쥐의 질 내에는 장에서 유래한 것으로 보이는 균들이 섞여 있는 것을 발견했다.
연구팀은 장에서 유래된 것으로 보이는 비만 암컷 생쥐의 질 내에 유입된 균들이 아미노산의 일종인 아르기닌을 활발하게 생산하고 있다는 사실을 발견했고, 아르기닌이 바이러스 초기 감염에 중요한 역할을 한다는 사실을 발견했다.
연구팀은 이어서 아르기닌이 질 내의 감마델타 T 세포의 항바이러스 면역반응을 강화하고, 적응 면역세포가 활성화되는 시기보다 이른 시기에 바이러스 감염과 전파를 이미 억제하고 있음을 발견했다.
연구를 주도한 의과학대학원 이흥규 교수는 "이번 연구는 비만이 특정 감염 질병에는 도움이 될 수도 있다는 사실을 밝혔다는 점에서 의의가 있고, 앞으로 비만인 환자들의 바이러스 감염증 치료에 참고가 될 것이며, 연구 결과를 바탕으로 분자 메커니즘을 응용해 항바이러스제 개발에 박차를 가할 것이다ˮ고 연구의 중요성을 설명했다.
비만이 바이러스를 억제하는 현상을 발견하고 그 메커니즘을 규명한 이번 연구는 한국연구재단의 중견연구지원사업 및 바이오의료기술개발사업의 지원으로 수행됐으며, 의과학대학원 박장현 박사가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제학술지 `셀 리포트(Cell Reports)'에 지난 11월 8일 字 게재됐다.
2022.12.06 조회수 9137 -
 악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04 조회수 10803
악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04 조회수 10803 -
 난치성 심혈관 질환인 폐동맥 고혈압의 새로운 모델 및 병리기전 제시
우리 대학 의과학대학원 및 의과학센터 연구진(책임자: 김인준 교수)과 서울대학교병원 연구진(책임자: 박준빈 교수)이 협력하여 폐동맥 고혈압(pulmonary arterial hypertension)의 새로운 동물모델을 구축하고 치료방법을 제시하였다고 지난 10월 7일 소개됐다.
연구팀은 혈관내피세포에서 Sox17 유전자가 결핍된 생쥐에 저산소 환경을 제공하여 새로운 폐동맥 고혈압 동물모델을 성공적으로 개발하였으며, 전사체 분석(transcriptomic analysis)으로 Sox17과 관련된 폐동맥 고혈압 발생의 병리현상에 Dll4/Notch 신호경로가 연관됨을 확인하였다. 또한 심혈관계 질환에서 역할이 잘 알려져 있지 않았던 HGF/c-Met 경로가 활성화됨을 발견하고, 기존의 폐동맥 고혈압 치료 약물 투여와 함께 해당 경로를 차단함으로써 동물모델에서 폐동맥 고혈압을 효과적으로 치료/예방할 수 있음을 확인하였다. 동물모델과 유사하게, 폐동맥 고혈압 환자의 폐조직에서 정상군에 비해 Sox17 발현이 감소하고 HGF 발현은 증가함을 확인하였다. 우리 대학 의과학대학원 졸업생 박찬순 박사가 (현 서울대병원 순환기내과 임상강사) 1저자로 주도한 이번 연구 결과는 심혈관 기초연구 분야 최고 학술지인 Circulation Research에 온라인 게재되었다.
기존 폐동맥 고혈압 동물모델은 실제 폐동맥 고혈압 환자들이 보이는 만성 진행성 임상양상을 잘 나타내지 못한다는 한계가 있었다. 예를 들어, 저산소-유발 폐동맥 고혈압 동물모델은 정상 산소 농도에 다시 두면 증상이 종종 호전되는데, 이는 환자의 질병 경과와는 차이가 있다. Sox17 내피결핍 생쥐에서 발생한 폐동맥 고혈압은 질병 상태가 만성적으로 유지되는 등 실제 병태생리를 잘 반영하였다. 이러한 장점으로 인해, 새로운 모델은 약제 개발 및 치료반응 확인에 보다 효과적으로 사용될 수 있을 것으로 기대된다. 더불어 이번 연구는 사망률을 경감시키는 효과적인 치료제가 없는 폐동맥 고혈압 치료 분야에 HGF/c-Met 신호경로를 새로운 약제 개발의 타겟으로 제시했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
2022.10.12 조회수 7509
난치성 심혈관 질환인 폐동맥 고혈압의 새로운 모델 및 병리기전 제시
우리 대학 의과학대학원 및 의과학센터 연구진(책임자: 김인준 교수)과 서울대학교병원 연구진(책임자: 박준빈 교수)이 협력하여 폐동맥 고혈압(pulmonary arterial hypertension)의 새로운 동물모델을 구축하고 치료방법을 제시하였다고 지난 10월 7일 소개됐다.
연구팀은 혈관내피세포에서 Sox17 유전자가 결핍된 생쥐에 저산소 환경을 제공하여 새로운 폐동맥 고혈압 동물모델을 성공적으로 개발하였으며, 전사체 분석(transcriptomic analysis)으로 Sox17과 관련된 폐동맥 고혈압 발생의 병리현상에 Dll4/Notch 신호경로가 연관됨을 확인하였다. 또한 심혈관계 질환에서 역할이 잘 알려져 있지 않았던 HGF/c-Met 경로가 활성화됨을 발견하고, 기존의 폐동맥 고혈압 치료 약물 투여와 함께 해당 경로를 차단함으로써 동물모델에서 폐동맥 고혈압을 효과적으로 치료/예방할 수 있음을 확인하였다. 동물모델과 유사하게, 폐동맥 고혈압 환자의 폐조직에서 정상군에 비해 Sox17 발현이 감소하고 HGF 발현은 증가함을 확인하였다. 우리 대학 의과학대학원 졸업생 박찬순 박사가 (현 서울대병원 순환기내과 임상강사) 1저자로 주도한 이번 연구 결과는 심혈관 기초연구 분야 최고 학술지인 Circulation Research에 온라인 게재되었다.
기존 폐동맥 고혈압 동물모델은 실제 폐동맥 고혈압 환자들이 보이는 만성 진행성 임상양상을 잘 나타내지 못한다는 한계가 있었다. 예를 들어, 저산소-유발 폐동맥 고혈압 동물모델은 정상 산소 농도에 다시 두면 증상이 종종 호전되는데, 이는 환자의 질병 경과와는 차이가 있다. Sox17 내피결핍 생쥐에서 발생한 폐동맥 고혈압은 질병 상태가 만성적으로 유지되는 등 실제 병태생리를 잘 반영하였다. 이러한 장점으로 인해, 새로운 모델은 약제 개발 및 치료반응 확인에 보다 효과적으로 사용될 수 있을 것으로 기대된다. 더불어 이번 연구는 사망률을 경감시키는 효과적인 치료제가 없는 폐동맥 고혈압 치료 분야에 HGF/c-Met 신호경로를 새로운 약제 개발의 타겟으로 제시했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
2022.10.12 조회수 7509 -
 장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 10365
장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 10365