-
 이상엽 특훈교수, 병원균이 항생제에 내성을 갖는 원리 규명
〈 이 상 엽 교수 〉
우리 대학 생명화학공학과 이상엽 교수와 덴마크 공대(DTU) 노보 노르디스크 바이오지속가능센터(Novo Nordist Foundation Center for Biosustainability) 공동 연구팀이 박테리아 병원균이 항생제에 대한 내성을 획득하는 작동 원리를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
항생제 남용 등으로 인해 항생제 내성균이 점점 더 늘어나고 있다. 이는 인류의 생존을 위협하는 문제로 그 심각성이 전 세계적으로 점점 커지고 있다.
인체 감염균이 항생제 내성을 갖는 방식에는 항생제를 분해하는 효소를 갖거나 다시 뱉어내는 등 다양한 방식이 있다. 그 중 대표적인 것은 항생제 내성 유전자를 획득해 항생제를 무용지물로 만드는 것이다.
내성 유전자는 보통 항생제를 생산하는 곰팡이나 악티노박테리아에서 발견된다. 이는 해당 항생제를 만드는 곰팡이와 박테리아가 자기 스스로를 항생제로부터 보호하기 위해 갖고 있는 것이다.
이 내성 유전자를 인체 감염균이 획득하면 항생제 내성을 갖게 된다. 이러한 사실은 게놈 정보 등을 통해 이미 알려져 있는 사실이다.
그러나 어떤 방식으로 항생제 내성 유전자들이 인체 감염균에 전달되는지는 밝혀지지 않았다.
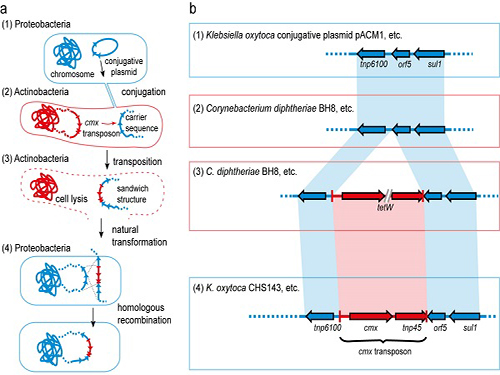
이상엽 교수와 덴마크 공대 공동 연구팀은 항생제 내성 유전자가 직접적으로 인체 감염균에 전달되는 것이 아니라 연구팀이 캐리백(carry-back)이라고 이름 지은 복잡한 과정을 통해 이뤄지는 것을 규명했다.
우선 인체 감염균과 방선균이 박테리아간의 성교에 해당하는 접합(conjugation)에 의해 인체 감염균의 DNA 일부가 방선균으로 들어간다.
그 와중에 항생제 내성 유전자 양쪽 주위에도 감염균의 DNA가 들어가는경우가 생긴다. 이 상태에서 방선균이 죽어 세포가 깨지면 항생제 내성 유전자와 감염균의 DNA 조각이 포함된 DNA들도 함께 나오게 된다.
이렇게 배출된 항생제 내성 유전자에는 인체 감염균의 일부 DNA가 양쪽에 공존하고 있다. 이 때문에 인체 감염균은 자신의 게놈에 재삽입이 가능해지고 이를 통해 항생제 내성을 획득한다.
연구팀은 생물정보학적 분석과 실제 실험을 통해 이를 증명했다.
이 교수는 “이번 연구결과는 인체 감염 유해균들이 항생제 내성을 획득하는 방식 중 한 가지를 제시한 것이다”며 “병원 내, 외부의 감염과 예방 관리시스템, 항생제의 올바른 사용에 대해 다시 한 번 생각할 수 있는 기회를 제공할 것이다”고 말했다.
이번 연구는 노보 노르디스크 재단과 미래창조과학부 원천기술과(바이오리파이너리를 위한 시스템대사공학 연구사업)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 항생제 내성 유전자가 전달되는 캐리백 현상의 모식도
이상엽 특훈교수, 병원균이 항생제에 내성을 갖는 원리 규명
〈 이 상 엽 교수 〉
우리 대학 생명화학공학과 이상엽 교수와 덴마크 공대(DTU) 노보 노르디스크 바이오지속가능센터(Novo Nordist Foundation Center for Biosustainability) 공동 연구팀이 박테리아 병원균이 항생제에 대한 내성을 획득하는 작동 원리를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
항생제 남용 등으로 인해 항생제 내성균이 점점 더 늘어나고 있다. 이는 인류의 생존을 위협하는 문제로 그 심각성이 전 세계적으로 점점 커지고 있다.
인체 감염균이 항생제 내성을 갖는 방식에는 항생제를 분해하는 효소를 갖거나 다시 뱉어내는 등 다양한 방식이 있다. 그 중 대표적인 것은 항생제 내성 유전자를 획득해 항생제를 무용지물로 만드는 것이다.
내성 유전자는 보통 항생제를 생산하는 곰팡이나 악티노박테리아에서 발견된다. 이는 해당 항생제를 만드는 곰팡이와 박테리아가 자기 스스로를 항생제로부터 보호하기 위해 갖고 있는 것이다.
이 내성 유전자를 인체 감염균이 획득하면 항생제 내성을 갖게 된다. 이러한 사실은 게놈 정보 등을 통해 이미 알려져 있는 사실이다.
그러나 어떤 방식으로 항생제 내성 유전자들이 인체 감염균에 전달되는지는 밝혀지지 않았다.
이상엽 교수와 덴마크 공대 공동 연구팀은 항생제 내성 유전자가 직접적으로 인체 감염균에 전달되는 것이 아니라 연구팀이 캐리백(carry-back)이라고 이름 지은 복잡한 과정을 통해 이뤄지는 것을 규명했다.
우선 인체 감염균과 방선균이 박테리아간의 성교에 해당하는 접합(conjugation)에 의해 인체 감염균의 DNA 일부가 방선균으로 들어간다.
그 와중에 항생제 내성 유전자 양쪽 주위에도 감염균의 DNA가 들어가는경우가 생긴다. 이 상태에서 방선균이 죽어 세포가 깨지면 항생제 내성 유전자와 감염균의 DNA 조각이 포함된 DNA들도 함께 나오게 된다.
이렇게 배출된 항생제 내성 유전자에는 인체 감염균의 일부 DNA가 양쪽에 공존하고 있다. 이 때문에 인체 감염균은 자신의 게놈에 재삽입이 가능해지고 이를 통해 항생제 내성을 획득한다.
연구팀은 생물정보학적 분석과 실제 실험을 통해 이를 증명했다.
이 교수는 “이번 연구결과는 인체 감염 유해균들이 항생제 내성을 획득하는 방식 중 한 가지를 제시한 것이다”며 “병원 내, 외부의 감염과 예방 관리시스템, 항생제의 올바른 사용에 대해 다시 한 번 생각할 수 있는 기회를 제공할 것이다”고 말했다.
이번 연구는 노보 노르디스크 재단과 미래창조과학부 원천기술과(바이오리파이너리를 위한 시스템대사공학 연구사업)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 항생제 내성 유전자가 전달되는 캐리백 현상의 모식도
2017.06.19
조회수 23084
-
 유회준 교수, 인공지능 얼굴인식 시스템 K-EYE 개발
우리 대학 전기및전자공학과 유회준 교수 연구팀이 딥러닝 알고리즘을 세계 최소 전력으로 구현하는 인공지능 반도체 칩 CNNP를 개발했다. 그리고 이를 내장한 얼굴인식 시스템 K-Eye 시리즈를 개발했다.
연구팀이 개발한 K-Eye 시리즈는 웨어러블 디바이스와 동글 타입 2가지로 구성된다. 웨어러블 타입인 K-Eye는 블루투스로 스마트폰과 연동 가능하다.
봉경렬 박사과정이 주도하고 ㈜유엑스팩토리(대표 박준영)과 공동으로 개발한 이번 연구는 지난 2월 미국에서 열린 국제고체회로설계학회(ISSCC)에서 세계 최저전력 CNN칩으로 발표돼 주목을 받았다.
최근 글로벌 IT 기업들이 알파고를 비롯한 인공지능 관련 기술들을 경쟁적으로 발표하고 있다. 그러나 대부분은 소프트웨어 기술이라 속도가 느리고 모바일 환경에서는 구현이 어렵다는 한계가 있다.
따라서 이를 고속 및 저전력으로 구동하기 위해 인공지능 반도체 칩 개발이 필수적이다.
연구팀의 K-Eye 시리즈는 1mW 내외의 적은 전력만으로도 항상 얼굴 인식을 수행하는 상태를 유지하면서 사람의 얼굴을 먼저 알아보고 반응할 수 있다는 특징을 갖는다.
K-Eye의 핵심 기술인 얼웨이즈 온(Always-On) 이미지 센서와 CNNP라는 얼굴 인식 처리 칩이 있었기 때문에 위와 같은 세계 최저전력 기술이 가능했다.
첫 번째 칩인 얼웨이즈 온(Always-On) 이미지 센서는 얼굴이 있는지 없는지 스스로 판단할 수 있어 얼굴 인식이 될 때에만 작동하게 해 대기 전력을 대폭 낮출 수 있다.
얼굴 검출 이미지 센서는 아날로그 프로세싱으로 디지털 프로세싱을 제어해 센서 자체의 출력 소모를 줄였다. 픽셀과 결합된 아날로그 프로세서는 배경 부분과 얼굴 부분을 구분하는 역할을 하고 디지털 프로세서는 선택된 일부 영역에서만 얼굴 검출을 수행하면 돼 효율적인 작업이 가능하다.
두 번째 칩인 CNNP는 딥러닝을 회로, 구조, 알고리즘 전반에 도입하고 재해석을 진행해 최저 수준의 전력을 구현하는 역할을 했다.
특히 CNNP칩은 3가지의 핵심 기술을 사용했는데 ▲알파고 인공지능 알고리즘에서 사용하는 2차원 계산을 1차원 계산으로 바꿔 고속 저전력화 ▲분산형으로 배치된 칩 내 메모리가 가로방향 뿐 아니라 세로방향도 읽어낼 수 있는 특수 저전력 분산 메모리로의 설계 ▲1024개의 곱셈기와 덧셈기가 동시에 구동돼 막강한 계산력을 가지면서 외부 통신망을 거치지 않고 직접 계산 결과를 주고받을 수 있게 한 점이다.
CNNP는 97%의 인식률을 가지면서도 알파고에 사용된 GPU에 비해 5천분의 1정도의 낮은 전력인 0.6mW만을 소모한다.
K-Eye를 목에 건 사용자는 앞에서 다가오는 상대방의 얼굴이 화면에 떠오르면 미리 저장된 정보와 실시간으로 찍힌 사진을 비교해 상대방의 이름 등 정보를 자연스럽게 확인할 수 있다.
동글 타입인 K-EyeQ는 스마트폰에 장착해 이용할 수 있는데 사용자를 알아보고 반응하는 기능을 한다. 미리 기억시킨 사용자의 얼굴이 화면을 향하기만 하면 스마트폰 화면이 저절로 켜지면서 그와 관련된 정보를 제공한다.
또한 입력된 얼굴이 사진인지 실제 사람인지도 구분할 수 있어 사용자의 얼굴 대신 사진을 보여주면 스마트폰은 반응하지 않는다.
유 교수는 “인공지능 반도체 프로세서가 4차 산업혁명시대를 주도할 것으로 기대된다”며 “이번 인공지능 칩과 인식기의 개발로 인해 세계시장에서 한국이 인공지능 산업의 주도권을 갖길 기대한다”고 말했다.
□ 사진 설명.
사진1. K-EYE 사진
사진2. K-EYEQ 사진
사진3. CNNP 칩 사진
유회준 교수, 인공지능 얼굴인식 시스템 K-EYE 개발
우리 대학 전기및전자공학과 유회준 교수 연구팀이 딥러닝 알고리즘을 세계 최소 전력으로 구현하는 인공지능 반도체 칩 CNNP를 개발했다. 그리고 이를 내장한 얼굴인식 시스템 K-Eye 시리즈를 개발했다.
연구팀이 개발한 K-Eye 시리즈는 웨어러블 디바이스와 동글 타입 2가지로 구성된다. 웨어러블 타입인 K-Eye는 블루투스로 스마트폰과 연동 가능하다.
봉경렬 박사과정이 주도하고 ㈜유엑스팩토리(대표 박준영)과 공동으로 개발한 이번 연구는 지난 2월 미국에서 열린 국제고체회로설계학회(ISSCC)에서 세계 최저전력 CNN칩으로 발표돼 주목을 받았다.
최근 글로벌 IT 기업들이 알파고를 비롯한 인공지능 관련 기술들을 경쟁적으로 발표하고 있다. 그러나 대부분은 소프트웨어 기술이라 속도가 느리고 모바일 환경에서는 구현이 어렵다는 한계가 있다.
따라서 이를 고속 및 저전력으로 구동하기 위해 인공지능 반도체 칩 개발이 필수적이다.
연구팀의 K-Eye 시리즈는 1mW 내외의 적은 전력만으로도 항상 얼굴 인식을 수행하는 상태를 유지하면서 사람의 얼굴을 먼저 알아보고 반응할 수 있다는 특징을 갖는다.
K-Eye의 핵심 기술인 얼웨이즈 온(Always-On) 이미지 센서와 CNNP라는 얼굴 인식 처리 칩이 있었기 때문에 위와 같은 세계 최저전력 기술이 가능했다.
첫 번째 칩인 얼웨이즈 온(Always-On) 이미지 센서는 얼굴이 있는지 없는지 스스로 판단할 수 있어 얼굴 인식이 될 때에만 작동하게 해 대기 전력을 대폭 낮출 수 있다.
얼굴 검출 이미지 센서는 아날로그 프로세싱으로 디지털 프로세싱을 제어해 센서 자체의 출력 소모를 줄였다. 픽셀과 결합된 아날로그 프로세서는 배경 부분과 얼굴 부분을 구분하는 역할을 하고 디지털 프로세서는 선택된 일부 영역에서만 얼굴 검출을 수행하면 돼 효율적인 작업이 가능하다.
두 번째 칩인 CNNP는 딥러닝을 회로, 구조, 알고리즘 전반에 도입하고 재해석을 진행해 최저 수준의 전력을 구현하는 역할을 했다.
특히 CNNP칩은 3가지의 핵심 기술을 사용했는데 ▲알파고 인공지능 알고리즘에서 사용하는 2차원 계산을 1차원 계산으로 바꿔 고속 저전력화 ▲분산형으로 배치된 칩 내 메모리가 가로방향 뿐 아니라 세로방향도 읽어낼 수 있는 특수 저전력 분산 메모리로의 설계 ▲1024개의 곱셈기와 덧셈기가 동시에 구동돼 막강한 계산력을 가지면서 외부 통신망을 거치지 않고 직접 계산 결과를 주고받을 수 있게 한 점이다.
CNNP는 97%의 인식률을 가지면서도 알파고에 사용된 GPU에 비해 5천분의 1정도의 낮은 전력인 0.6mW만을 소모한다.
K-Eye를 목에 건 사용자는 앞에서 다가오는 상대방의 얼굴이 화면에 떠오르면 미리 저장된 정보와 실시간으로 찍힌 사진을 비교해 상대방의 이름 등 정보를 자연스럽게 확인할 수 있다.
동글 타입인 K-EyeQ는 스마트폰에 장착해 이용할 수 있는데 사용자를 알아보고 반응하는 기능을 한다. 미리 기억시킨 사용자의 얼굴이 화면을 향하기만 하면 스마트폰 화면이 저절로 켜지면서 그와 관련된 정보를 제공한다.
또한 입력된 얼굴이 사진인지 실제 사람인지도 구분할 수 있어 사용자의 얼굴 대신 사진을 보여주면 스마트폰은 반응하지 않는다.
유 교수는 “인공지능 반도체 프로세서가 4차 산업혁명시대를 주도할 것으로 기대된다”며 “이번 인공지능 칩과 인식기의 개발로 인해 세계시장에서 한국이 인공지능 산업의 주도권을 갖길 기대한다”고 말했다.
□ 사진 설명.
사진1. K-EYE 사진
사진2. K-EYEQ 사진
사진3. CNNP 칩 사진
2017.06.14
조회수 18967
-
 윤동기 교수, 액정 결함의 변이 과정 관찰에 성공
우리 대학 나노과학기술대학원 윤동기 교수 연구팀이 액정의 결함이 온도에 따라 변화하는 과정을 규명했다.
액정 결함에 관한 연구는 20세기 초반부터 약 100여 년 간 위상기하학을 연구하는 물리, 수학자들에 의해 연구됐지만 결함의 형태 전이를 세밀하게 직접적으로 관찰한 것은 이번 연구가 처음이다.
이 액정에서의 결함은 위상학적(topology)으로 우주에서 발생하는 블랙홀과 같은 위상학적 현상과 비슷한 구조를 갖기 때문에 우주의 원리를 연구하는 데 도움이 될 것으로 기대된다.
김민준 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications) 5월 30일자 온라인 판에 게재됐다. (논문명 : Morphogenesis of liquid crystal topological defects during the nematic-smectic A phase transition)
일반적으로 액정 재료는 손쉬운 배향 제어, 빠른 반응속도, 이방적(anisotropic)인 광학 특성을 갖고 있어 액정표시장치(LCD)나 광학 센서 등에 사용된다. 이 때 액정의 결함을 최소화하는 것이 성능 측면에서 유리한 것으로 알려져 있으나 물질 특성 상 액정의 결함은 불가피하게 발생한다.
윤 교수 연구팀은 이 결함을 단순히 없애는 데만 집중하지 않고 결함의 구조를 이해하고 형성 원리를 명확하게 규명하는 기초연구에 집중했다.
이러한 노력을 바탕으로 액정재료의 위상학적 결함이 안정적으로 발생하는 플랫폼을 구성해 온도 변화에 따른 상전이(phase transition)를 직접적으로 관찰했다.
위상학적 결함의 상전이는 2016년도 노벨물리학상의 주제이기도 할 만큼 기초과학 분야에서 중요하다. 우주 은하의 위상학적 구조적 원리도 이에 바탕하고 있어 많은 연구자들이 집중하고 있는 분야이다.
우주 은하의 위상학적 결함을 관찰하기에는 너무 범위가 크고 시간이 오래 걸린다. 하지만 윤 교수팀이 고안한 플랫폼의 위상학적 결함 구조는 광학 현미경으로 관찰이 가능한 수준의 크기이다. 또한 결함의 상전이가 일어나는 시간도 수초에서 수분 단위이기 때문에 관찰이 용이하다.
여기서 액정 재료들이 형성하는 결함 구조는 하나의 특이점(singularity)을 중심으로 방사형, 원형, 나선형 등의 형태를 갖는다. 특이점은 영화 ‘인터스텔라’에서도 나온 것처럼 우주의 블랙홀의 중심부 부분에 해당한다.
이 액정 재료는 일반적으로 딱딱한 두 유리판 사이에 모세관 현상을 통해 주입해 그 시료를 준비하게 된다. 그러나 이 과정에서 유리판처럼 단단한 기판은 표면효과 때문에 액정 물질의 움직임을 제한시키고 이는 결함의 상전이를 관찰하는 장애물이었다.
연구팀은 물 위에 기름이 떠다니는 현상을 이용해 물 위에 얇은 액정재료 막을 형성함으로써 액정 분자들의 움직임이 제한적이지 않은 환경을 조성했다.
이런 환경에서 온도를 변화시키면 그 구조체를 구성하는 분자와 분자 사이의 미세한 상호작용이 기판에 의한 표면효과보다 훨씬 크기 때문에 위상학적 결함의 상전이를 연속적, 직접적으로 관찰할 수 있다.
이 연구 방식은 온도 변화를 통해 위상학적 결함의 형성과정을 순서대로 혹은 역으로 조절할 수 있다. 따라서 전이과정을 면밀하게 관찰하면 중간 상태의 결함구조를 통해 최초의 그 결함 형태와 구성 분자들의 배열을 정확히 역추적 할 수 있다.
이는 위상학적 결함의 형성 원리를 근본적으로 이해할 수 있는 연구 수단이 될 것으로 기대된다.
윤 교수는 이번 연구에 대해 “연구에 대한 발상의 전환을 통해 남들이 보지 못한 것을 볼 수 있었다”며 “액정 결함에 대한 이번 연구 결과는 산업적 측면 뿐 아니라 기초 학문에 세계적 공헌을 할 수 있을 것이다”고 말했다.
또한 “우리나라가 액정 디스플레이 산업의 강국이지만 액정에 대한 기초연구는 세계적 수준에 비해 높지 않다”며 “이번 연구를 계기로 국내 관련 기초연구에 대한 관심을 촉발시키는 계기가 되길 바란다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단이 추진하는 미래유망융합기술파이오니어사업과 신진연구지원사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 물 위에 형성된 액정 결함의 냉각에 의한 위상학적 결함의 상전이 현상의 편광현미경 사진
그림 2. 액정 분자들이 모이는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도와 액정 분자들이 퍼지는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도
윤동기 교수, 액정 결함의 변이 과정 관찰에 성공
우리 대학 나노과학기술대학원 윤동기 교수 연구팀이 액정의 결함이 온도에 따라 변화하는 과정을 규명했다.
액정 결함에 관한 연구는 20세기 초반부터 약 100여 년 간 위상기하학을 연구하는 물리, 수학자들에 의해 연구됐지만 결함의 형태 전이를 세밀하게 직접적으로 관찰한 것은 이번 연구가 처음이다.
이 액정에서의 결함은 위상학적(topology)으로 우주에서 발생하는 블랙홀과 같은 위상학적 현상과 비슷한 구조를 갖기 때문에 우주의 원리를 연구하는 데 도움이 될 것으로 기대된다.
김민준 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications) 5월 30일자 온라인 판에 게재됐다. (논문명 : Morphogenesis of liquid crystal topological defects during the nematic-smectic A phase transition)
일반적으로 액정 재료는 손쉬운 배향 제어, 빠른 반응속도, 이방적(anisotropic)인 광학 특성을 갖고 있어 액정표시장치(LCD)나 광학 센서 등에 사용된다. 이 때 액정의 결함을 최소화하는 것이 성능 측면에서 유리한 것으로 알려져 있으나 물질 특성 상 액정의 결함은 불가피하게 발생한다.
윤 교수 연구팀은 이 결함을 단순히 없애는 데만 집중하지 않고 결함의 구조를 이해하고 형성 원리를 명확하게 규명하는 기초연구에 집중했다.
이러한 노력을 바탕으로 액정재료의 위상학적 결함이 안정적으로 발생하는 플랫폼을 구성해 온도 변화에 따른 상전이(phase transition)를 직접적으로 관찰했다.
위상학적 결함의 상전이는 2016년도 노벨물리학상의 주제이기도 할 만큼 기초과학 분야에서 중요하다. 우주 은하의 위상학적 구조적 원리도 이에 바탕하고 있어 많은 연구자들이 집중하고 있는 분야이다.
우주 은하의 위상학적 결함을 관찰하기에는 너무 범위가 크고 시간이 오래 걸린다. 하지만 윤 교수팀이 고안한 플랫폼의 위상학적 결함 구조는 광학 현미경으로 관찰이 가능한 수준의 크기이다. 또한 결함의 상전이가 일어나는 시간도 수초에서 수분 단위이기 때문에 관찰이 용이하다.
여기서 액정 재료들이 형성하는 결함 구조는 하나의 특이점(singularity)을 중심으로 방사형, 원형, 나선형 등의 형태를 갖는다. 특이점은 영화 ‘인터스텔라’에서도 나온 것처럼 우주의 블랙홀의 중심부 부분에 해당한다.
이 액정 재료는 일반적으로 딱딱한 두 유리판 사이에 모세관 현상을 통해 주입해 그 시료를 준비하게 된다. 그러나 이 과정에서 유리판처럼 단단한 기판은 표면효과 때문에 액정 물질의 움직임을 제한시키고 이는 결함의 상전이를 관찰하는 장애물이었다.
연구팀은 물 위에 기름이 떠다니는 현상을 이용해 물 위에 얇은 액정재료 막을 형성함으로써 액정 분자들의 움직임이 제한적이지 않은 환경을 조성했다.
이런 환경에서 온도를 변화시키면 그 구조체를 구성하는 분자와 분자 사이의 미세한 상호작용이 기판에 의한 표면효과보다 훨씬 크기 때문에 위상학적 결함의 상전이를 연속적, 직접적으로 관찰할 수 있다.
이 연구 방식은 온도 변화를 통해 위상학적 결함의 형성과정을 순서대로 혹은 역으로 조절할 수 있다. 따라서 전이과정을 면밀하게 관찰하면 중간 상태의 결함구조를 통해 최초의 그 결함 형태와 구성 분자들의 배열을 정확히 역추적 할 수 있다.
이는 위상학적 결함의 형성 원리를 근본적으로 이해할 수 있는 연구 수단이 될 것으로 기대된다.
윤 교수는 이번 연구에 대해 “연구에 대한 발상의 전환을 통해 남들이 보지 못한 것을 볼 수 있었다”며 “액정 결함에 대한 이번 연구 결과는 산업적 측면 뿐 아니라 기초 학문에 세계적 공헌을 할 수 있을 것이다”고 말했다.
또한 “우리나라가 액정 디스플레이 산업의 강국이지만 액정에 대한 기초연구는 세계적 수준에 비해 높지 않다”며 “이번 연구를 계기로 국내 관련 기초연구에 대한 관심을 촉발시키는 계기가 되길 바란다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단이 추진하는 미래유망융합기술파이오니어사업과 신진연구지원사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 물 위에 형성된 액정 결함의 냉각에 의한 위상학적 결함의 상전이 현상의 편광현미경 사진
그림 2. 액정 분자들이 모이는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도와 액정 분자들이 퍼지는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도
2017.06.01
조회수 20940
-
 박용근 교수, 세포 자유롭게 변형 가능한 홀로그래피 기술 개발
우리 대학 물리학과 박용근 교수 연구팀이 세포와 같이 복잡한 3차원 물체를 빛을 통해 자유자재로 제어할 수 있는 홀로그래피 기술을 개발했다.
이 기술은 복잡한 형상을 갖는 물체들을 포획하고 조립하면서 실시간 촬영이 가능해 세포들 간의 상호를 연구하거나 미세한 물체를 제작하고 조립하는 새로운 응용 분야를 개척할 수 있을 있을 것으로 보인다.
이번 연구 결과는 네이처 자매지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 5월 22일자 온라인 판에 게재됐다.
광학 집게라고 불리는 기존 광 제어 기술은 레이저로 광 초점을 만들어 그 초점에 구형 물체를 포획하는 방식이다. 렌즈를 이용해 작은 레이저 광 초점을 만들면 이 광초점에 자석에 철가루가 끌려오듯 주변 미세 물체를 달라붙게 하는 기술이다.
또한 이 기술은 초점의 위치를 옮기거나 힘을 가하는 방식으로 포획된 구형 물체의 3차원 위치를 조절할 수 있다. 1997년 노벨 물리학상의 공적인 이 기술은 물리학 및 광학 분야 등에 널리 이용된다.
그러나 이 광학 집게 기술은 물체의 모양이 복잡해지는 경우에는 물체를 안정적으로 포획하기 어렵다. 제어할 수 있는 물체의 방향이 제한적이기 때문에 생명 세포처럼 복잡한 3차원 형상을 가진 미세 물체를 광 제어하는 데는 한계가 있었다.
연구팀은 문제 해결을 위해 임의의 형상을 가진 복잡한 물체도 포획할 수 있는 새로운 레이저 포획 기술을 개발했다.
이 기술은 우선 3차원 홀로그래픽 현미경을 이용해 물체의 3차원 정보를 실시간 측정한 뒤 그 정보를 바탕으로 물체를 효과적으로 제어할 수 있는 광학 패턴을 정밀히 계산해 입사하는 방식이다.
기존 광학 집게 기술이 단순한 광 초점을 이용한 수동적 방식이라면 이 기술은 물체에 따라 능동적으로 적용할 수 있다.
빛과 물체의 모양이 같아질 때 물체가 갖는 에너지가 최소화돼 복잡한 형상의 물체더라도 안정적으로 포획할 수 있음을 확인했다. 이는 물리적으로는 에너지를 최소화하는 방향으로 현상이 발생하는 원리와 같다.
연구팀은 물체가 다양한 위치, 방향, 모양을 갖게 제어해 물체의 3차원 운동을 자유자재로 제어하고 원하는 모양으로 만들 수 있었다. 마치 거푸집을 자유롭게 제작해 원하는 석고상을 만들어내는 것과 같다.
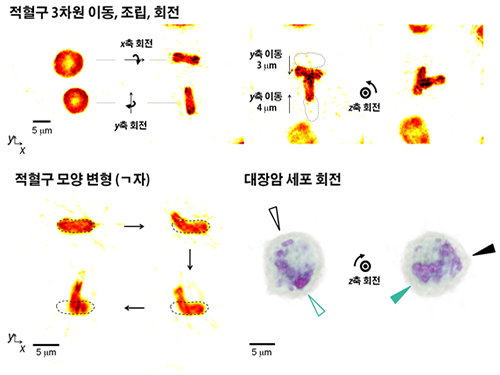
연구팀은 이 기술을 통해 적혈구 세포를 안정적으로 집어 원하는 각도로의 회전, 기역자 모양으로 변형, 두 개의 적혈구를 조립해 새로운 구조물 제작 등을 구현하는 데 성공했다. 또한 복잡한 구조인 대장암 세포를 안정적으로 포획하고 원하는 각도로 회전시킬 수 있었다.
이 기술은 안정적인 상태에서 세포를 원하는 모양으로 변형시킬 수 있어 세포에 힘을 가하여 변형시킬 때의 세포 반응을 정량적으로 분석할 수 있다.
논문의 1저자인 김규현 박사는 “복잡한 형상을 가진 물체의 모양, 특성 등 사전 정보를 몰라도 물체의 운동을 자유자재로 제어할 수 있는 기술이다”며 “생물 물리학 연구, 부유 물질 및 나노 물체 조립 등의 다양한 분야에 응용 가능할 것이다”고 말했다.
□ 그림 설명
그림1. 3차원 능동 광 제어 기술의 모식도
그림2. 복잡한 형태의 생명 세포들의 3차원 운동 및 모양 제어 결과
박용근 교수, 세포 자유롭게 변형 가능한 홀로그래피 기술 개발
우리 대학 물리학과 박용근 교수 연구팀이 세포와 같이 복잡한 3차원 물체를 빛을 통해 자유자재로 제어할 수 있는 홀로그래피 기술을 개발했다.
이 기술은 복잡한 형상을 갖는 물체들을 포획하고 조립하면서 실시간 촬영이 가능해 세포들 간의 상호를 연구하거나 미세한 물체를 제작하고 조립하는 새로운 응용 분야를 개척할 수 있을 있을 것으로 보인다.
이번 연구 결과는 네이처 자매지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 5월 22일자 온라인 판에 게재됐다.
광학 집게라고 불리는 기존 광 제어 기술은 레이저로 광 초점을 만들어 그 초점에 구형 물체를 포획하는 방식이다. 렌즈를 이용해 작은 레이저 광 초점을 만들면 이 광초점에 자석에 철가루가 끌려오듯 주변 미세 물체를 달라붙게 하는 기술이다.
또한 이 기술은 초점의 위치를 옮기거나 힘을 가하는 방식으로 포획된 구형 물체의 3차원 위치를 조절할 수 있다. 1997년 노벨 물리학상의 공적인 이 기술은 물리학 및 광학 분야 등에 널리 이용된다.
그러나 이 광학 집게 기술은 물체의 모양이 복잡해지는 경우에는 물체를 안정적으로 포획하기 어렵다. 제어할 수 있는 물체의 방향이 제한적이기 때문에 생명 세포처럼 복잡한 3차원 형상을 가진 미세 물체를 광 제어하는 데는 한계가 있었다.
연구팀은 문제 해결을 위해 임의의 형상을 가진 복잡한 물체도 포획할 수 있는 새로운 레이저 포획 기술을 개발했다.
이 기술은 우선 3차원 홀로그래픽 현미경을 이용해 물체의 3차원 정보를 실시간 측정한 뒤 그 정보를 바탕으로 물체를 효과적으로 제어할 수 있는 광학 패턴을 정밀히 계산해 입사하는 방식이다.
기존 광학 집게 기술이 단순한 광 초점을 이용한 수동적 방식이라면 이 기술은 물체에 따라 능동적으로 적용할 수 있다.
빛과 물체의 모양이 같아질 때 물체가 갖는 에너지가 최소화돼 복잡한 형상의 물체더라도 안정적으로 포획할 수 있음을 확인했다. 이는 물리적으로는 에너지를 최소화하는 방향으로 현상이 발생하는 원리와 같다.
연구팀은 물체가 다양한 위치, 방향, 모양을 갖게 제어해 물체의 3차원 운동을 자유자재로 제어하고 원하는 모양으로 만들 수 있었다. 마치 거푸집을 자유롭게 제작해 원하는 석고상을 만들어내는 것과 같다.
연구팀은 이 기술을 통해 적혈구 세포를 안정적으로 집어 원하는 각도로의 회전, 기역자 모양으로 변형, 두 개의 적혈구를 조립해 새로운 구조물 제작 등을 구현하는 데 성공했다. 또한 복잡한 구조인 대장암 세포를 안정적으로 포획하고 원하는 각도로 회전시킬 수 있었다.
이 기술은 안정적인 상태에서 세포를 원하는 모양으로 변형시킬 수 있어 세포에 힘을 가하여 변형시킬 때의 세포 반응을 정량적으로 분석할 수 있다.
논문의 1저자인 김규현 박사는 “복잡한 형상을 가진 물체의 모양, 특성 등 사전 정보를 몰라도 물체의 운동을 자유자재로 제어할 수 있는 기술이다”며 “생물 물리학 연구, 부유 물질 및 나노 물체 조립 등의 다양한 분야에 응용 가능할 것이다”고 말했다.
□ 그림 설명
그림1. 3차원 능동 광 제어 기술의 모식도
그림2. 복잡한 형태의 생명 세포들의 3차원 운동 및 모양 제어 결과
2017.05.25
조회수 14939
-
 류호진 교수, 금속 칵테일로 핵융합에 사용가능한 신소재 개발
우리 대학 원자력 및 양자공학과 류호진 교수 연구팀이 칵테일처럼 여러 원소를 혼합하는 방식을 통해 핵융합 플라즈마의 대면재로 적용 가능한 신소재 합금을 개발했다.
이번 연구를 통해 핵융합 발전과 같은 극한적 환경에서 사용되는 금속의 범위가 다양하게 확장될 것으로 기대된다.
오와이스 왓심 박사과정이 1저자로 참여한 이번 연구는 온라인 국제 학술지 ‘사이언티픽 리포트(Scientific Report)’ 5월 16일자에 게재됐다.
미래 에너지원으로 여겨지는 핵융합 발전을 실현하기 위해서는 고온의 플라즈마를 가두고 있는 토카막(tokamak) 용기의 내구성이 중요하다. 도넛 모양의 토카막은 강력한 자기장을 통해 1억℃가 넘는 플라즈마를 안정적으로 유지시켜주는 역할을 한다.
그럼에도 불구하고 플라즈마의 고온에 따른 열부하, 플라즈마 이온, 중성자 등으로 인해 토카막 용기는 손상이 발생한다. 이 토카막 용기를 보호하기 위한 대면재로 텅스텐 등의 금속이 쓰이고 있으나 완벽한 핵융합 발전을 위해서는 고성능 신소재의 개발이 필수적이다.
류 교수 연구팀은 텅스텐에 소량의 금속을 첨가해 물성을 개량하는 기존 방법들보다 한 발 더 나아가 다량의 금속을 동시에 혼합하는 기술을 활용했다.
이는 마치 칵테일처럼 여러 금속 분말을 혼합한 후 소결하는 분말야금 기술로 이를 통해 텅스텐보다 경도와 강도가 2배 이상 향상된 신소재 합금을 제조하는 데 성공했다.
핵융합에서는 다양한 물질을 함께 혼합하는 위와 같은 방식이 역효과를 발생시키기도 한다. 몰리브덴, 니오븀 등은 핵융합을 하면서 발생하는 중성자와 반응을 해 방사성이 높은 원소로 탈바꿈하는 방사화 현상이 발생해 방사능을 발산하기도 한다.
류 교수 연구팀은 이러한 제약들을 고려해 크롬, 티타늄 등을 첨가했고 이는 경도 향상 뿐 아니라 제조 공정의 촉진, 방사화 방지 등의 효과도 얻어냈다.
연구팀은 고온 기계적 특성과 더불어 열전도도, 플라즈마 상호작용, 중성자 조사취화, 트리튬 흡수 억제, 고온 내산화 특성 등을 최적화하는 합금 조성을 찾기 위한 연구를 계속 진행할 예정이다.
류 교수는 “핵융합 플라즈마 대면재는 열 충격과 플라즈마 및 중성자로 인한 손상이 극심해 이를 견딜만한 금속이 없을 정도로 극한적 환경에 노출된다”며 “이번 연구결과로 핵융합 및 원자력용 고융점 저 방사화 금속을 개발하고자 하는 시도가 전 세계적으로 활발해질 것으로 예상된다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단의 핵융합기초연구사업과 전략구조소재 신공정설계 연구센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구를 통해 제조된 텅스텐 기반 고강도 신합금
그림2. 고융점 금속 혼합 공정을 통한 핵융합 플라즈마 대면재 개발 개요
류호진 교수, 금속 칵테일로 핵융합에 사용가능한 신소재 개발
우리 대학 원자력 및 양자공학과 류호진 교수 연구팀이 칵테일처럼 여러 원소를 혼합하는 방식을 통해 핵융합 플라즈마의 대면재로 적용 가능한 신소재 합금을 개발했다.
이번 연구를 통해 핵융합 발전과 같은 극한적 환경에서 사용되는 금속의 범위가 다양하게 확장될 것으로 기대된다.
오와이스 왓심 박사과정이 1저자로 참여한 이번 연구는 온라인 국제 학술지 ‘사이언티픽 리포트(Scientific Report)’ 5월 16일자에 게재됐다.
미래 에너지원으로 여겨지는 핵융합 발전을 실현하기 위해서는 고온의 플라즈마를 가두고 있는 토카막(tokamak) 용기의 내구성이 중요하다. 도넛 모양의 토카막은 강력한 자기장을 통해 1억℃가 넘는 플라즈마를 안정적으로 유지시켜주는 역할을 한다.
그럼에도 불구하고 플라즈마의 고온에 따른 열부하, 플라즈마 이온, 중성자 등으로 인해 토카막 용기는 손상이 발생한다. 이 토카막 용기를 보호하기 위한 대면재로 텅스텐 등의 금속이 쓰이고 있으나 완벽한 핵융합 발전을 위해서는 고성능 신소재의 개발이 필수적이다.
류 교수 연구팀은 텅스텐에 소량의 금속을 첨가해 물성을 개량하는 기존 방법들보다 한 발 더 나아가 다량의 금속을 동시에 혼합하는 기술을 활용했다.
이는 마치 칵테일처럼 여러 금속 분말을 혼합한 후 소결하는 분말야금 기술로 이를 통해 텅스텐보다 경도와 강도가 2배 이상 향상된 신소재 합금을 제조하는 데 성공했다.
핵융합에서는 다양한 물질을 함께 혼합하는 위와 같은 방식이 역효과를 발생시키기도 한다. 몰리브덴, 니오븀 등은 핵융합을 하면서 발생하는 중성자와 반응을 해 방사성이 높은 원소로 탈바꿈하는 방사화 현상이 발생해 방사능을 발산하기도 한다.
류 교수 연구팀은 이러한 제약들을 고려해 크롬, 티타늄 등을 첨가했고 이는 경도 향상 뿐 아니라 제조 공정의 촉진, 방사화 방지 등의 효과도 얻어냈다.
연구팀은 고온 기계적 특성과 더불어 열전도도, 플라즈마 상호작용, 중성자 조사취화, 트리튬 흡수 억제, 고온 내산화 특성 등을 최적화하는 합금 조성을 찾기 위한 연구를 계속 진행할 예정이다.
류 교수는 “핵융합 플라즈마 대면재는 열 충격과 플라즈마 및 중성자로 인한 손상이 극심해 이를 견딜만한 금속이 없을 정도로 극한적 환경에 노출된다”며 “이번 연구결과로 핵융합 및 원자력용 고융점 저 방사화 금속을 개발하고자 하는 시도가 전 세계적으로 활발해질 것으로 예상된다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단의 핵융합기초연구사업과 전략구조소재 신공정설계 연구센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구를 통해 제조된 텅스텐 기반 고강도 신합금
그림2. 고융점 금속 혼합 공정을 통한 핵융합 플라즈마 대면재 개발 개요
2017.05.24
조회수 17834
-
 방효충 교수 연구팀, 지구 저궤도 관측 큐브위성 궤도진입 및 교신 성공
우리 대학 항공우주공학과 방효충 교수 연구팀이 큐브위성 궤도진입 및 첫 교신을 성공적으로 수행했다.
방 교수 연구팀에서 개발한 LINK(Little Intelligent Nanosatellite of KAIST)는 4월 18일에 발사돼 국제우주정거장으로 배송된 바 있다.
궤도진입은 5월 18일 오전 10시에 NRCSD(NanoRacks CubeSat Deployer)를 통해 이뤄졌으며 한국 시각으로 같은 날 23시 5분 첫 교신에 성공했다. 지상국에서 확인한 큐브위성의 상태는 양호하다.
LINK는 벨기에 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50는 큰 대기항력 때문에 관측이 덜 이루어진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하고자 하는 국제 공동 프로젝트로 전 세계 23개 이상의 국가에서 참여하고 있다.
LINK는 2unit(20x10x10cm3) 크기로 무게가 약 2kg이며 지구관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재하고 있다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
궤도진입을 마친 큐브위성은 초기 한 달 동안 지상국을 통해 시스템 점검을 수행한 뒤 두 달에 걸쳐 저궤도 대기관측 데이터를 수집할 예정이다.
LINK 큐브위성의 개발은 항공우주연구원 '2012년 큐브위성대회'의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. NRCSD(NanoRacks CubeSat Deployer) 큐브위성 사출 장면
그림2. LINK 비콘신호 수신
방효충 교수 연구팀, 지구 저궤도 관측 큐브위성 궤도진입 및 교신 성공
우리 대학 항공우주공학과 방효충 교수 연구팀이 큐브위성 궤도진입 및 첫 교신을 성공적으로 수행했다.
방 교수 연구팀에서 개발한 LINK(Little Intelligent Nanosatellite of KAIST)는 4월 18일에 발사돼 국제우주정거장으로 배송된 바 있다.
궤도진입은 5월 18일 오전 10시에 NRCSD(NanoRacks CubeSat Deployer)를 통해 이뤄졌으며 한국 시각으로 같은 날 23시 5분 첫 교신에 성공했다. 지상국에서 확인한 큐브위성의 상태는 양호하다.
LINK는 벨기에 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50는 큰 대기항력 때문에 관측이 덜 이루어진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하고자 하는 국제 공동 프로젝트로 전 세계 23개 이상의 국가에서 참여하고 있다.
LINK는 2unit(20x10x10cm3) 크기로 무게가 약 2kg이며 지구관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재하고 있다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
궤도진입을 마친 큐브위성은 초기 한 달 동안 지상국을 통해 시스템 점검을 수행한 뒤 두 달에 걸쳐 저궤도 대기관측 데이터를 수집할 예정이다.
LINK 큐브위성의 개발은 항공우주연구원 '2012년 큐브위성대회'의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. NRCSD(NanoRacks CubeSat Deployer) 큐브위성 사출 장면
그림2. LINK 비콘신호 수신
2017.05.24
조회수 15467
-
 우운택 교수, 스마트 관광 증강현실 어플리케이션 개발
〈 우 운 택 교수 〉
우리 대학 문화기술대학원 우운택 교수 연구팀이 스마트 관광 지원을 위한 증강 및 가상현실 어플리케이션을 개발했다.
‘케이 컬처 타임머신(K-Culture Time Machine)’ 어플리케이션은 창덕궁을 대상으로 한 시범 서비스로 iOS 앱스토어에 5월 23일 공개됐다.
개발된 케이 컬처 타임머신은 웨어러블 360도 비디오를 통해 문화유산이나 유적지에 대한 시공간을 넘는 원격 체험을 제공한다.
사용자는 VR기기에 스마트폰을 장착해 제공되는 360도 비디오로 문화 유적지를 원격으로 체험하고 해당 문화유산 및 연관관계가 있는 인물, 장소, 사건 등에 대한 정보를 확인할 수 있다. 또한 소실된 문화유산에 대한 3차원 디지털 복원도 체험할 수 있다.
웨어러블 기기 활용 없이도 모바일 모드를 통해 사용자 주변 유적지 확인, 카메라에 인식된 문화유산을 인식하고 관련된 정보와 콘텐츠를 제공하는 증강현실 기반의 문화유산 가이드가 가능하다.
사용자는 자신의 위치에서 창덕궁 돈화문을 시작으로 인정문, 인정전, 희정당에 이르는 창덕궁 내부를 이동하며 360도 파노라마 이미지나 비디오를 통해 현장을 가상체험 할 수 있다.
현재는 존재하지 않는 인정전 동쪽의 궐내 곽사 지역에는 3D모델을 통한 승정원의 가상 복원을 확인할 수 있다.
위 기능은 웨어러블 기기 없이 스마트폰 상에서도 체험 가능하며 개발 중인 증강현실 기능이 완성되면 현장에서 활용 가능한 수준의 어플리케이션이 될 것으로 기대된다.
우 교수 연구팀은 문화유산 데이터베이스와 증강-가상현실 콘텐츠의 표준화된 메타데이터를 구축하고 이를 적용했다. 이를 활용해 일시적으로 개발 후 소비되는 기존 어플리케이션과는 달리 추가적인 콘텐츠 생성 및 추가가 가능하다.
우 교수는 “증강현실 콘텐츠의 상호 활용성과 재활용성을 증진해 스마트관광 분야의 새로운 시장을 선점할 수 있을 것이다”며 “콘텐츠 개발 비용 절감과 증강현실 콘텐츠 생태계 활성화를 가능하게 하는 다양한 부가 효과도 기대한다”고 말했다.
이번 연구는 ㈜포스트미디어(대표 홍승모)와 문화체육관광부 CT R&D 사업과의 공동 수행을 통해 이뤄졌으며, 관련 연구 성과는 올 7월 캐나다에서 진행되는 HCII 2017 학회를 통해 발표될 예정이다.
□ 그림 설명
그림1. 360 VR 서비스 개념도
그림2. K-Culture Time Machine의 모바일 증강현실 기능 구동 화면
그림3. K-Culture Time Machine의 360도 파노라마 이미지-비디오 기능 화면
우운택 교수, 스마트 관광 증강현실 어플리케이션 개발
〈 우 운 택 교수 〉
우리 대학 문화기술대학원 우운택 교수 연구팀이 스마트 관광 지원을 위한 증강 및 가상현실 어플리케이션을 개발했다.
‘케이 컬처 타임머신(K-Culture Time Machine)’ 어플리케이션은 창덕궁을 대상으로 한 시범 서비스로 iOS 앱스토어에 5월 23일 공개됐다.
개발된 케이 컬처 타임머신은 웨어러블 360도 비디오를 통해 문화유산이나 유적지에 대한 시공간을 넘는 원격 체험을 제공한다.
사용자는 VR기기에 스마트폰을 장착해 제공되는 360도 비디오로 문화 유적지를 원격으로 체험하고 해당 문화유산 및 연관관계가 있는 인물, 장소, 사건 등에 대한 정보를 확인할 수 있다. 또한 소실된 문화유산에 대한 3차원 디지털 복원도 체험할 수 있다.
웨어러블 기기 활용 없이도 모바일 모드를 통해 사용자 주변 유적지 확인, 카메라에 인식된 문화유산을 인식하고 관련된 정보와 콘텐츠를 제공하는 증강현실 기반의 문화유산 가이드가 가능하다.
사용자는 자신의 위치에서 창덕궁 돈화문을 시작으로 인정문, 인정전, 희정당에 이르는 창덕궁 내부를 이동하며 360도 파노라마 이미지나 비디오를 통해 현장을 가상체험 할 수 있다.
현재는 존재하지 않는 인정전 동쪽의 궐내 곽사 지역에는 3D모델을 통한 승정원의 가상 복원을 확인할 수 있다.
위 기능은 웨어러블 기기 없이 스마트폰 상에서도 체험 가능하며 개발 중인 증강현실 기능이 완성되면 현장에서 활용 가능한 수준의 어플리케이션이 될 것으로 기대된다.
우 교수 연구팀은 문화유산 데이터베이스와 증강-가상현실 콘텐츠의 표준화된 메타데이터를 구축하고 이를 적용했다. 이를 활용해 일시적으로 개발 후 소비되는 기존 어플리케이션과는 달리 추가적인 콘텐츠 생성 및 추가가 가능하다.
우 교수는 “증강현실 콘텐츠의 상호 활용성과 재활용성을 증진해 스마트관광 분야의 새로운 시장을 선점할 수 있을 것이다”며 “콘텐츠 개발 비용 절감과 증강현실 콘텐츠 생태계 활성화를 가능하게 하는 다양한 부가 효과도 기대한다”고 말했다.
이번 연구는 ㈜포스트미디어(대표 홍승모)와 문화체육관광부 CT R&D 사업과의 공동 수행을 통해 이뤄졌으며, 관련 연구 성과는 올 7월 캐나다에서 진행되는 HCII 2017 학회를 통해 발표될 예정이다.
□ 그림 설명
그림1. 360 VR 서비스 개념도
그림2. K-Culture Time Machine의 모바일 증강현실 기능 구동 화면
그림3. K-Culture Time Machine의 360도 파노라마 이미지-비디오 기능 화면
2017.05.23
조회수 20342
-
 한순규 교수, 천연 물질인 플루게닌C 합성에 성공
우리 대학 화학과 한순규 교수 연구팀이 새로운 방식의 화학반응을 이용해 자연 상태에서 존재하는 천연물을 인위적으로 제작하는 데 성공했다.
연구팀은 분자 간 화학반응의 일종인 라우훗-쿠리어 반응(Rauhut-Currier 반응, RC 반응)을 이용해 이합체 천연물인 플루게닌 C를 합성했다.
전상빈 석박사통합과정이 1저자로 참여한 이번 연구는 화학 분야의 국제 학술지 ‘미국화학회지(JACS : Journal of the American Chemical Society)’ 5월 10일자에 게재됐다.
천연물 전합성(Total Synthesis)은 순차적 화학반응을 통해 자연에 존재하는 천연 물질을 실험실에서 인위적으로 합성해내는 연구 분야이다.
이 과정은 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 분자에 도달할 수 있어 높은 수준의 인내심, 창의성 등이 요구된다. 학계에서는 천연물 전합성 학자를 가리켜 ‘분자를 다루는 예술가’로 부르기도 한다.
이번 연구는 분자 간 라우훗-쿠리어 반응을 전합성에 응용한 최초의 사례이다. 라우훗-쿠리어 반응은 1963년 라우훗과 쿠리어에 의해 보고된 반응으로 친핵체 촉매에 의해 진행되는 현상이다.
기존의 분자 간 라우훗-쿠리어 반응은 150도 이상의 고온 및 고농도 용액에서 유독한 촉매를 통해 비 선택적으로 진행된다는 한계가 있어 천연물 전합성에 적합하지 않았다.
연구팀은 문제 해결을 위해 반응물 내부에 친핵체를 위치시켰다. 이를 통해 상온의 옅은 용액에서 촉매 없이 간단한 염기성 시료를 첨가시키는 것만으로도 라우훗-쿠리어 반응을 이끌어 낼 수 있음을 확인했다.
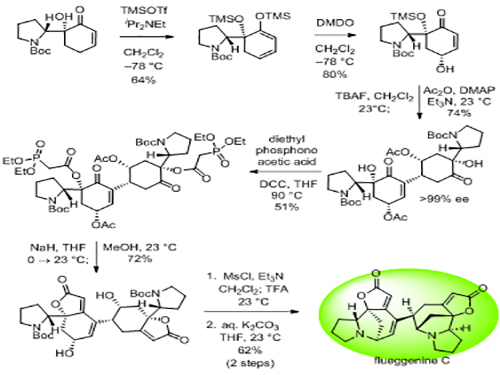
연구팀은 이 반응 조건을 이용해 시중에서 구입 가능한 아미노산 유도체를 12단계를 거쳐 플루게닌 C라는 천연물질로 합성하는 데 성공했다.
한 교수는 “이번 연구는 라우훗-쿠리어 반응의 효율성과 선택성을 획기적으로 향상시킨 발견이다”며 “기존에는 합성할 수 없었던 다양한 천연물, 신약 또는 유기재료를 합성할 수 있는 길이 열렸다”고 말했다.
이번 연구는 KAIST의 정착 연구비, 하이리스크하이리턴(HRHR) 및 RED&B(Research, Education, Development & Business) 과제, 한국연구재단의 신진연구자 지원사업, 기초과학연구원 분자활성 촉매반응 연구단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 대표적인 이합체-소중합체 세큐리네가 알칼로이드
그림2. 플루게닌 C의 합성 경로
한순규 교수, 천연 물질인 플루게닌C 합성에 성공
우리 대학 화학과 한순규 교수 연구팀이 새로운 방식의 화학반응을 이용해 자연 상태에서 존재하는 천연물을 인위적으로 제작하는 데 성공했다.
연구팀은 분자 간 화학반응의 일종인 라우훗-쿠리어 반응(Rauhut-Currier 반응, RC 반응)을 이용해 이합체 천연물인 플루게닌 C를 합성했다.
전상빈 석박사통합과정이 1저자로 참여한 이번 연구는 화학 분야의 국제 학술지 ‘미국화학회지(JACS : Journal of the American Chemical Society)’ 5월 10일자에 게재됐다.
천연물 전합성(Total Synthesis)은 순차적 화학반응을 통해 자연에 존재하는 천연 물질을 실험실에서 인위적으로 합성해내는 연구 분야이다.
이 과정은 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 분자에 도달할 수 있어 높은 수준의 인내심, 창의성 등이 요구된다. 학계에서는 천연물 전합성 학자를 가리켜 ‘분자를 다루는 예술가’로 부르기도 한다.
이번 연구는 분자 간 라우훗-쿠리어 반응을 전합성에 응용한 최초의 사례이다. 라우훗-쿠리어 반응은 1963년 라우훗과 쿠리어에 의해 보고된 반응으로 친핵체 촉매에 의해 진행되는 현상이다.
기존의 분자 간 라우훗-쿠리어 반응은 150도 이상의 고온 및 고농도 용액에서 유독한 촉매를 통해 비 선택적으로 진행된다는 한계가 있어 천연물 전합성에 적합하지 않았다.
연구팀은 문제 해결을 위해 반응물 내부에 친핵체를 위치시켰다. 이를 통해 상온의 옅은 용액에서 촉매 없이 간단한 염기성 시료를 첨가시키는 것만으로도 라우훗-쿠리어 반응을 이끌어 낼 수 있음을 확인했다.
연구팀은 이 반응 조건을 이용해 시중에서 구입 가능한 아미노산 유도체를 12단계를 거쳐 플루게닌 C라는 천연물질로 합성하는 데 성공했다.
한 교수는 “이번 연구는 라우훗-쿠리어 반응의 효율성과 선택성을 획기적으로 향상시킨 발견이다”며 “기존에는 합성할 수 없었던 다양한 천연물, 신약 또는 유기재료를 합성할 수 있는 길이 열렸다”고 말했다.
이번 연구는 KAIST의 정착 연구비, 하이리스크하이리턴(HRHR) 및 RED&B(Research, Education, Development & Business) 과제, 한국연구재단의 신진연구자 지원사업, 기초과학연구원 분자활성 촉매반응 연구단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 대표적인 이합체-소중합체 세큐리네가 알칼로이드
그림2. 플루게닌 C의 합성 경로
2017.05.19
조회수 22325
-
 김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
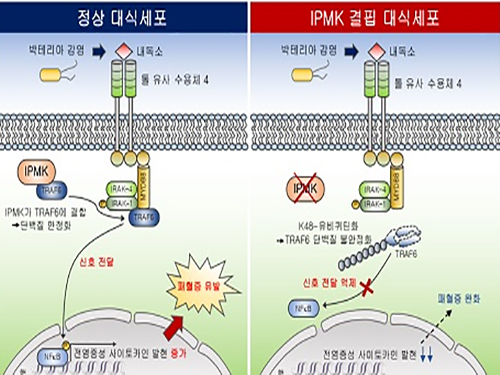
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25
조회수 22644
-
 방효충 교수, 지구 저궤도의 관측 위한 큐브위성 발사
우리 대학 항공우주공학과 방효충 교수 연구팀이 지구 저궤도 관측을 위한 초소형 큐브위성을 발사했다.
방 교수 연구팀에서 개발한 큐브위성인 LINK(Little Intelligent Nanosatellite of KAIST)를 포함한 총 28개의 큐브위성이 아틀라스 V(Atlas V) 발사체(NASA CRS-7 미션)에 탑재돼 미 동부시간 4월 18일 오전 11시 11분에 미국 Space Launch Complex 41에서 성공적으로 발사됐다.
큐브위성들은 국제우주정거장에서 보관 후 약 한 달 뒤에 궤도 진입 예정이며 이후 약 3달 동안 과학임무를 수행한다.
LINK는 벨기에의 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50 프로젝트는 큰 대기항력 때문에 관측이 덜 이뤄진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하는 국제 공동 프로젝트이다. 2012년에 시작된 이 프로젝트는 전 세계 23개 이상의 국가가 참여하고 있다.
LINK는 2유닛(20x10x10㎤) 크기로 무게는 2kg 정도이며 지구 관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재했다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
방 교수는 “QB50 프로젝트는 교육용으로만 쓰이던 큐브위성이 의미있는 과학임무를 수행하기 위한 도구로 도약하는 계기가 될 것이다”며 “다수의 큐브위성을 이용해 저궤도 대기 관측을 한 첫 사례로 의미있는 데이터를 얻을 것으로 기대한다”고 말했다.
또한 “이 노하우를 이용해 앞으로 위성을 추가 개발해 연구 내용을 우주에서 직접 검증할 수 있을 것이다”고 말했다.
현재 큐브위성을 실은 Cygnus 모듈이 궤도에서 대기 중이며 미 동부시간 4월 22일 오전 8시 39분 국제우주정거장과 도킹을 완료했다.
방효충 교수, 지구 저궤도의 관측 위한 큐브위성 발사
우리 대학 항공우주공학과 방효충 교수 연구팀이 지구 저궤도 관측을 위한 초소형 큐브위성을 발사했다.
방 교수 연구팀에서 개발한 큐브위성인 LINK(Little Intelligent Nanosatellite of KAIST)를 포함한 총 28개의 큐브위성이 아틀라스 V(Atlas V) 발사체(NASA CRS-7 미션)에 탑재돼 미 동부시간 4월 18일 오전 11시 11분에 미국 Space Launch Complex 41에서 성공적으로 발사됐다.
큐브위성들은 국제우주정거장에서 보관 후 약 한 달 뒤에 궤도 진입 예정이며 이후 약 3달 동안 과학임무를 수행한다.
LINK는 벨기에의 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50 프로젝트는 큰 대기항력 때문에 관측이 덜 이뤄진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하는 국제 공동 프로젝트이다. 2012년에 시작된 이 프로젝트는 전 세계 23개 이상의 국가가 참여하고 있다.
LINK는 2유닛(20x10x10㎤) 크기로 무게는 2kg 정도이며 지구 관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재했다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
방 교수는 “QB50 프로젝트는 교육용으로만 쓰이던 큐브위성이 의미있는 과학임무를 수행하기 위한 도구로 도약하는 계기가 될 것이다”며 “다수의 큐브위성을 이용해 저궤도 대기 관측을 한 첫 사례로 의미있는 데이터를 얻을 것으로 기대한다”고 말했다.
또한 “이 노하우를 이용해 앞으로 위성을 추가 개발해 연구 내용을 우주에서 직접 검증할 수 있을 것이다”고 말했다.
현재 큐브위성을 실은 Cygnus 모듈이 궤도에서 대기 중이며 미 동부시간 4월 22일 오전 8시 39분 국제우주정거장과 도킹을 완료했다.
2017.04.24
조회수 17887
-
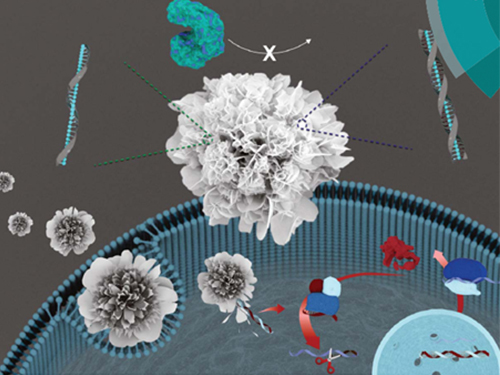 박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14
조회수 21285
-
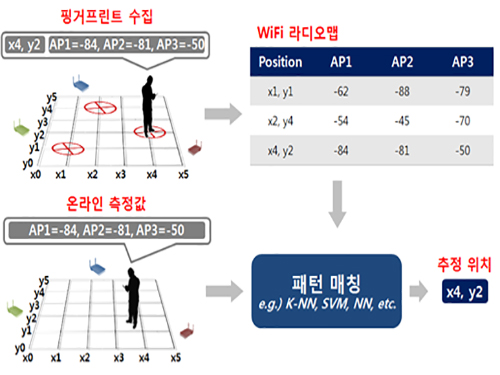 한동수 교수, 크라우드소싱 기반 실내 위치인식 시스템 개발
〈 한 동 수 교수 〉
우리 대학 전산학부 한동수 교수 연구팀(지능형 서비스통합 연구실)이 실내 공간에서 획득한 와이파이 신호의 수집 위치정보를 자동으로 파악할 수 있는 기술을 개발했다.
이 기술은 글로벌 실내 위치인식 시스템 구축에 필요한 핵심 기술로 다수의 스마트폰에서 수집된 무선랜 핑거프린트의 수집 위치를 자동으로 라벨링하는 인공지능 기법이다. 비용을 절감하면서 높은 정확도를 가질 수 있고 무선랜 핑거프린트 수집이 가능한 건물이라면 어느 곳에도 적용 가능하다.
여러 글로벌 기업들이 실내 GPS를 실현하기 위해 전 세계 주요도시에서 수만 건의 실내 지도를 수집했다. 실내 지도와 함께 신호 지도 수집도 시도했지만 높은 정확도를 갖지 못했고 그 결과 실내에서의 위치 인식 서비스 질이 떨어진다.
연구팀은 문제 해결을 위해 실내를 이동 공간과 체류 공간으로 구분하고 각각의 공간에 최적화된 수집 위치 라벨링을 자동화하는 기술을 개발했다.
연구팀이 개발한 기술은 복도, 로비, 계단과 같은 이동 공간에서도 수집된 신호의 위치정보를 별도의 외부 정도 없이도 자동으로 라벨링하는 새로운 자율학습(Unsupervised Learning) 인공지능 기술이다.
이 기술을 토대로 기초실험연구동(N5)과 김병호-김삼열IT융합빌딩(N1)에서 실험을 실시했고, 충분한 양의 학습 데이터가 주어진다는 가정 하에 오차범위 3~4미터 수준의 정확도를 보였다.
이는 수작업을 통해 수집 위치를 라벨링한 결과와 비슷한 정확도로 연구팀이 함께 개발한 지자기 신호, 3축 가속기, 자이로스코프 기반의 딥러닝을 활용한 새로운 센서 퓨전 기법을 통하면 정확도가 더욱 상승하는 결과를 보였다.
그 동안 스마트폰을 통해 수집된 핑거프린트는 활용되지 못하고 버려졌지만 개발된 기술을 통해 무선랜 핑거프린트 빅데이터 영역이 새롭게 열릴 것으로 기대된다.
개발된 GPS 구축 기술은 글로벌 기업이나 국내 위치정보 서비스 기업 등이 전국 범위에서 위치정보 서비스를 제공할 때 도입해 효과적으로 사용할 수 있을 것으로 예상된다.
GPS 신호가 도달하지 않는 실내 환경에서 위치인식 정확도가 높아짐에 따라 포켓몬고 등의 O2O(online to offline) 위치기반 게임도 실내에서 실행 가능할 것으로 기대된다.
또한 다양한 위치기반 SNS, 사물인터넷 등 서비스가 활성화되고 위급한 상황에서 112나 119에 구조요청을 할 시 정확한 위치 파악이 가능할 것으로 보인다.
한 교수는 “개발된 글로벌 실내 위치인식 시스템 구축 기술을 KAIST 실내 위치인식 시스템인 카이로스(KAILOS)에 탑재해 서비스 할 예정이다”며 “전 세계 어느 건물에서든 정확도 높은 실내 위치인식 시스템을 손쉽게 구축할 수 있고 장래에 대부분 실내 공간에서도 위치인식 서비스가 제공 가능할 것이다”고 말했다.
카이로스는 2014년 KAIST에서 출시한 개방형 실내 위치인식 서비스 플랫폼이다. 자신이 원하는 건물의 실내지도를 카이로스에 등록하고 해당 건물의 핑거프린트를 수집해 실내 위치인식 시스템을 구축하도록 지원 중이다.
□ 그림 설명
그림1. 핑거프린트를 수집하여 신호지도를 구축한 뒤, 구축된 신호지도를 기반으로 위치를 추정하는 과정
그림2. KAILOS가 여러 가지 신호와 센서를 복합적으로 사용하였을 때 예상되는 정확도
한동수 교수, 크라우드소싱 기반 실내 위치인식 시스템 개발
〈 한 동 수 교수 〉
우리 대학 전산학부 한동수 교수 연구팀(지능형 서비스통합 연구실)이 실내 공간에서 획득한 와이파이 신호의 수집 위치정보를 자동으로 파악할 수 있는 기술을 개발했다.
이 기술은 글로벌 실내 위치인식 시스템 구축에 필요한 핵심 기술로 다수의 스마트폰에서 수집된 무선랜 핑거프린트의 수집 위치를 자동으로 라벨링하는 인공지능 기법이다. 비용을 절감하면서 높은 정확도를 가질 수 있고 무선랜 핑거프린트 수집이 가능한 건물이라면 어느 곳에도 적용 가능하다.
여러 글로벌 기업들이 실내 GPS를 실현하기 위해 전 세계 주요도시에서 수만 건의 실내 지도를 수집했다. 실내 지도와 함께 신호 지도 수집도 시도했지만 높은 정확도를 갖지 못했고 그 결과 실내에서의 위치 인식 서비스 질이 떨어진다.
연구팀은 문제 해결을 위해 실내를 이동 공간과 체류 공간으로 구분하고 각각의 공간에 최적화된 수집 위치 라벨링을 자동화하는 기술을 개발했다.
연구팀이 개발한 기술은 복도, 로비, 계단과 같은 이동 공간에서도 수집된 신호의 위치정보를 별도의 외부 정도 없이도 자동으로 라벨링하는 새로운 자율학습(Unsupervised Learning) 인공지능 기술이다.
이 기술을 토대로 기초실험연구동(N5)과 김병호-김삼열IT융합빌딩(N1)에서 실험을 실시했고, 충분한 양의 학습 데이터가 주어진다는 가정 하에 오차범위 3~4미터 수준의 정확도를 보였다.
이는 수작업을 통해 수집 위치를 라벨링한 결과와 비슷한 정확도로 연구팀이 함께 개발한 지자기 신호, 3축 가속기, 자이로스코프 기반의 딥러닝을 활용한 새로운 센서 퓨전 기법을 통하면 정확도가 더욱 상승하는 결과를 보였다.
그 동안 스마트폰을 통해 수집된 핑거프린트는 활용되지 못하고 버려졌지만 개발된 기술을 통해 무선랜 핑거프린트 빅데이터 영역이 새롭게 열릴 것으로 기대된다.
개발된 GPS 구축 기술은 글로벌 기업이나 국내 위치정보 서비스 기업 등이 전국 범위에서 위치정보 서비스를 제공할 때 도입해 효과적으로 사용할 수 있을 것으로 예상된다.
GPS 신호가 도달하지 않는 실내 환경에서 위치인식 정확도가 높아짐에 따라 포켓몬고 등의 O2O(online to offline) 위치기반 게임도 실내에서 실행 가능할 것으로 기대된다.
또한 다양한 위치기반 SNS, 사물인터넷 등 서비스가 활성화되고 위급한 상황에서 112나 119에 구조요청을 할 시 정확한 위치 파악이 가능할 것으로 보인다.
한 교수는 “개발된 글로벌 실내 위치인식 시스템 구축 기술을 KAIST 실내 위치인식 시스템인 카이로스(KAILOS)에 탑재해 서비스 할 예정이다”며 “전 세계 어느 건물에서든 정확도 높은 실내 위치인식 시스템을 손쉽게 구축할 수 있고 장래에 대부분 실내 공간에서도 위치인식 서비스가 제공 가능할 것이다”고 말했다.
카이로스는 2014년 KAIST에서 출시한 개방형 실내 위치인식 서비스 플랫폼이다. 자신이 원하는 건물의 실내지도를 카이로스에 등록하고 해당 건물의 핑거프린트를 수집해 실내 위치인식 시스템을 구축하도록 지원 중이다.
□ 그림 설명
그림1. 핑거프린트를 수집하여 신호지도를 구축한 뒤, 구축된 신호지도를 기반으로 위치를 추정하는 과정
그림2. KAILOS가 여러 가지 신호와 센서를 복합적으로 사용하였을 때 예상되는 정확도
2017.04.12
조회수 18394
 이상엽 특훈교수, 병원균이 항생제에 내성을 갖는 원리 규명
〈 이 상 엽 교수 〉
우리 대학 생명화학공학과 이상엽 교수와 덴마크 공대(DTU) 노보 노르디스크 바이오지속가능센터(Novo Nordist Foundation Center for Biosustainability) 공동 연구팀이 박테리아 병원균이 항생제에 대한 내성을 획득하는 작동 원리를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
항생제 남용 등으로 인해 항생제 내성균이 점점 더 늘어나고 있다. 이는 인류의 생존을 위협하는 문제로 그 심각성이 전 세계적으로 점점 커지고 있다.
인체 감염균이 항생제 내성을 갖는 방식에는 항생제를 분해하는 효소를 갖거나 다시 뱉어내는 등 다양한 방식이 있다. 그 중 대표적인 것은 항생제 내성 유전자를 획득해 항생제를 무용지물로 만드는 것이다.
내성 유전자는 보통 항생제를 생산하는 곰팡이나 악티노박테리아에서 발견된다. 이는 해당 항생제를 만드는 곰팡이와 박테리아가 자기 스스로를 항생제로부터 보호하기 위해 갖고 있는 것이다.
이 내성 유전자를 인체 감염균이 획득하면 항생제 내성을 갖게 된다. 이러한 사실은 게놈 정보 등을 통해 이미 알려져 있는 사실이다.
그러나 어떤 방식으로 항생제 내성 유전자들이 인체 감염균에 전달되는지는 밝혀지지 않았다.
이상엽 교수와 덴마크 공대 공동 연구팀은 항생제 내성 유전자가 직접적으로 인체 감염균에 전달되는 것이 아니라 연구팀이 캐리백(carry-back)이라고 이름 지은 복잡한 과정을 통해 이뤄지는 것을 규명했다.
우선 인체 감염균과 방선균이 박테리아간의 성교에 해당하는 접합(conjugation)에 의해 인체 감염균의 DNA 일부가 방선균으로 들어간다.
그 와중에 항생제 내성 유전자 양쪽 주위에도 감염균의 DNA가 들어가는경우가 생긴다. 이 상태에서 방선균이 죽어 세포가 깨지면 항생제 내성 유전자와 감염균의 DNA 조각이 포함된 DNA들도 함께 나오게 된다.
이렇게 배출된 항생제 내성 유전자에는 인체 감염균의 일부 DNA가 양쪽에 공존하고 있다. 이 때문에 인체 감염균은 자신의 게놈에 재삽입이 가능해지고 이를 통해 항생제 내성을 획득한다.
연구팀은 생물정보학적 분석과 실제 실험을 통해 이를 증명했다.
이 교수는 “이번 연구결과는 인체 감염 유해균들이 항생제 내성을 획득하는 방식 중 한 가지를 제시한 것이다”며 “병원 내, 외부의 감염과 예방 관리시스템, 항생제의 올바른 사용에 대해 다시 한 번 생각할 수 있는 기회를 제공할 것이다”고 말했다.
이번 연구는 노보 노르디스크 재단과 미래창조과학부 원천기술과(바이오리파이너리를 위한 시스템대사공학 연구사업)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 항생제 내성 유전자가 전달되는 캐리백 현상의 모식도
2017.06.19 조회수 23084
이상엽 특훈교수, 병원균이 항생제에 내성을 갖는 원리 규명
〈 이 상 엽 교수 〉
우리 대학 생명화학공학과 이상엽 교수와 덴마크 공대(DTU) 노보 노르디스크 바이오지속가능센터(Novo Nordist Foundation Center for Biosustainability) 공동 연구팀이 박테리아 병원균이 항생제에 대한 내성을 획득하는 작동 원리를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
항생제 남용 등으로 인해 항생제 내성균이 점점 더 늘어나고 있다. 이는 인류의 생존을 위협하는 문제로 그 심각성이 전 세계적으로 점점 커지고 있다.
인체 감염균이 항생제 내성을 갖는 방식에는 항생제를 분해하는 효소를 갖거나 다시 뱉어내는 등 다양한 방식이 있다. 그 중 대표적인 것은 항생제 내성 유전자를 획득해 항생제를 무용지물로 만드는 것이다.
내성 유전자는 보통 항생제를 생산하는 곰팡이나 악티노박테리아에서 발견된다. 이는 해당 항생제를 만드는 곰팡이와 박테리아가 자기 스스로를 항생제로부터 보호하기 위해 갖고 있는 것이다.
이 내성 유전자를 인체 감염균이 획득하면 항생제 내성을 갖게 된다. 이러한 사실은 게놈 정보 등을 통해 이미 알려져 있는 사실이다.
그러나 어떤 방식으로 항생제 내성 유전자들이 인체 감염균에 전달되는지는 밝혀지지 않았다.
이상엽 교수와 덴마크 공대 공동 연구팀은 항생제 내성 유전자가 직접적으로 인체 감염균에 전달되는 것이 아니라 연구팀이 캐리백(carry-back)이라고 이름 지은 복잡한 과정을 통해 이뤄지는 것을 규명했다.
우선 인체 감염균과 방선균이 박테리아간의 성교에 해당하는 접합(conjugation)에 의해 인체 감염균의 DNA 일부가 방선균으로 들어간다.
그 와중에 항생제 내성 유전자 양쪽 주위에도 감염균의 DNA가 들어가는경우가 생긴다. 이 상태에서 방선균이 죽어 세포가 깨지면 항생제 내성 유전자와 감염균의 DNA 조각이 포함된 DNA들도 함께 나오게 된다.
이렇게 배출된 항생제 내성 유전자에는 인체 감염균의 일부 DNA가 양쪽에 공존하고 있다. 이 때문에 인체 감염균은 자신의 게놈에 재삽입이 가능해지고 이를 통해 항생제 내성을 획득한다.
연구팀은 생물정보학적 분석과 실제 실험을 통해 이를 증명했다.
이 교수는 “이번 연구결과는 인체 감염 유해균들이 항생제 내성을 획득하는 방식 중 한 가지를 제시한 것이다”며 “병원 내, 외부의 감염과 예방 관리시스템, 항생제의 올바른 사용에 대해 다시 한 번 생각할 수 있는 기회를 제공할 것이다”고 말했다.
이번 연구는 노보 노르디스크 재단과 미래창조과학부 원천기술과(바이오리파이너리를 위한 시스템대사공학 연구사업)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 항생제 내성 유전자가 전달되는 캐리백 현상의 모식도
2017.06.19 조회수 23084 유회준 교수, 인공지능 얼굴인식 시스템 K-EYE 개발
우리 대학 전기및전자공학과 유회준 교수 연구팀이 딥러닝 알고리즘을 세계 최소 전력으로 구현하는 인공지능 반도체 칩 CNNP를 개발했다. 그리고 이를 내장한 얼굴인식 시스템 K-Eye 시리즈를 개발했다.
연구팀이 개발한 K-Eye 시리즈는 웨어러블 디바이스와 동글 타입 2가지로 구성된다. 웨어러블 타입인 K-Eye는 블루투스로 스마트폰과 연동 가능하다.
봉경렬 박사과정이 주도하고 ㈜유엑스팩토리(대표 박준영)과 공동으로 개발한 이번 연구는 지난 2월 미국에서 열린 국제고체회로설계학회(ISSCC)에서 세계 최저전력 CNN칩으로 발표돼 주목을 받았다.
최근 글로벌 IT 기업들이 알파고를 비롯한 인공지능 관련 기술들을 경쟁적으로 발표하고 있다. 그러나 대부분은 소프트웨어 기술이라 속도가 느리고 모바일 환경에서는 구현이 어렵다는 한계가 있다.
따라서 이를 고속 및 저전력으로 구동하기 위해 인공지능 반도체 칩 개발이 필수적이다.
연구팀의 K-Eye 시리즈는 1mW 내외의 적은 전력만으로도 항상 얼굴 인식을 수행하는 상태를 유지하면서 사람의 얼굴을 먼저 알아보고 반응할 수 있다는 특징을 갖는다.
K-Eye의 핵심 기술인 얼웨이즈 온(Always-On) 이미지 센서와 CNNP라는 얼굴 인식 처리 칩이 있었기 때문에 위와 같은 세계 최저전력 기술이 가능했다.
첫 번째 칩인 얼웨이즈 온(Always-On) 이미지 센서는 얼굴이 있는지 없는지 스스로 판단할 수 있어 얼굴 인식이 될 때에만 작동하게 해 대기 전력을 대폭 낮출 수 있다.
얼굴 검출 이미지 센서는 아날로그 프로세싱으로 디지털 프로세싱을 제어해 센서 자체의 출력 소모를 줄였다. 픽셀과 결합된 아날로그 프로세서는 배경 부분과 얼굴 부분을 구분하는 역할을 하고 디지털 프로세서는 선택된 일부 영역에서만 얼굴 검출을 수행하면 돼 효율적인 작업이 가능하다.
두 번째 칩인 CNNP는 딥러닝을 회로, 구조, 알고리즘 전반에 도입하고 재해석을 진행해 최저 수준의 전력을 구현하는 역할을 했다.
특히 CNNP칩은 3가지의 핵심 기술을 사용했는데 ▲알파고 인공지능 알고리즘에서 사용하는 2차원 계산을 1차원 계산으로 바꿔 고속 저전력화 ▲분산형으로 배치된 칩 내 메모리가 가로방향 뿐 아니라 세로방향도 읽어낼 수 있는 특수 저전력 분산 메모리로의 설계 ▲1024개의 곱셈기와 덧셈기가 동시에 구동돼 막강한 계산력을 가지면서 외부 통신망을 거치지 않고 직접 계산 결과를 주고받을 수 있게 한 점이다.
CNNP는 97%의 인식률을 가지면서도 알파고에 사용된 GPU에 비해 5천분의 1정도의 낮은 전력인 0.6mW만을 소모한다.
K-Eye를 목에 건 사용자는 앞에서 다가오는 상대방의 얼굴이 화면에 떠오르면 미리 저장된 정보와 실시간으로 찍힌 사진을 비교해 상대방의 이름 등 정보를 자연스럽게 확인할 수 있다.
동글 타입인 K-EyeQ는 스마트폰에 장착해 이용할 수 있는데 사용자를 알아보고 반응하는 기능을 한다. 미리 기억시킨 사용자의 얼굴이 화면을 향하기만 하면 스마트폰 화면이 저절로 켜지면서 그와 관련된 정보를 제공한다.
또한 입력된 얼굴이 사진인지 실제 사람인지도 구분할 수 있어 사용자의 얼굴 대신 사진을 보여주면 스마트폰은 반응하지 않는다.
유 교수는 “인공지능 반도체 프로세서가 4차 산업혁명시대를 주도할 것으로 기대된다”며 “이번 인공지능 칩과 인식기의 개발로 인해 세계시장에서 한국이 인공지능 산업의 주도권을 갖길 기대한다”고 말했다.
□ 사진 설명.
사진1. K-EYE 사진
사진2. K-EYEQ 사진
사진3. CNNP 칩 사진
2017.06.14 조회수 18967
유회준 교수, 인공지능 얼굴인식 시스템 K-EYE 개발
우리 대학 전기및전자공학과 유회준 교수 연구팀이 딥러닝 알고리즘을 세계 최소 전력으로 구현하는 인공지능 반도체 칩 CNNP를 개발했다. 그리고 이를 내장한 얼굴인식 시스템 K-Eye 시리즈를 개발했다.
연구팀이 개발한 K-Eye 시리즈는 웨어러블 디바이스와 동글 타입 2가지로 구성된다. 웨어러블 타입인 K-Eye는 블루투스로 스마트폰과 연동 가능하다.
봉경렬 박사과정이 주도하고 ㈜유엑스팩토리(대표 박준영)과 공동으로 개발한 이번 연구는 지난 2월 미국에서 열린 국제고체회로설계학회(ISSCC)에서 세계 최저전력 CNN칩으로 발표돼 주목을 받았다.
최근 글로벌 IT 기업들이 알파고를 비롯한 인공지능 관련 기술들을 경쟁적으로 발표하고 있다. 그러나 대부분은 소프트웨어 기술이라 속도가 느리고 모바일 환경에서는 구현이 어렵다는 한계가 있다.
따라서 이를 고속 및 저전력으로 구동하기 위해 인공지능 반도체 칩 개발이 필수적이다.
연구팀의 K-Eye 시리즈는 1mW 내외의 적은 전력만으로도 항상 얼굴 인식을 수행하는 상태를 유지하면서 사람의 얼굴을 먼저 알아보고 반응할 수 있다는 특징을 갖는다.
K-Eye의 핵심 기술인 얼웨이즈 온(Always-On) 이미지 센서와 CNNP라는 얼굴 인식 처리 칩이 있었기 때문에 위와 같은 세계 최저전력 기술이 가능했다.
첫 번째 칩인 얼웨이즈 온(Always-On) 이미지 센서는 얼굴이 있는지 없는지 스스로 판단할 수 있어 얼굴 인식이 될 때에만 작동하게 해 대기 전력을 대폭 낮출 수 있다.
얼굴 검출 이미지 센서는 아날로그 프로세싱으로 디지털 프로세싱을 제어해 센서 자체의 출력 소모를 줄였다. 픽셀과 결합된 아날로그 프로세서는 배경 부분과 얼굴 부분을 구분하는 역할을 하고 디지털 프로세서는 선택된 일부 영역에서만 얼굴 검출을 수행하면 돼 효율적인 작업이 가능하다.
두 번째 칩인 CNNP는 딥러닝을 회로, 구조, 알고리즘 전반에 도입하고 재해석을 진행해 최저 수준의 전력을 구현하는 역할을 했다.
특히 CNNP칩은 3가지의 핵심 기술을 사용했는데 ▲알파고 인공지능 알고리즘에서 사용하는 2차원 계산을 1차원 계산으로 바꿔 고속 저전력화 ▲분산형으로 배치된 칩 내 메모리가 가로방향 뿐 아니라 세로방향도 읽어낼 수 있는 특수 저전력 분산 메모리로의 설계 ▲1024개의 곱셈기와 덧셈기가 동시에 구동돼 막강한 계산력을 가지면서 외부 통신망을 거치지 않고 직접 계산 결과를 주고받을 수 있게 한 점이다.
CNNP는 97%의 인식률을 가지면서도 알파고에 사용된 GPU에 비해 5천분의 1정도의 낮은 전력인 0.6mW만을 소모한다.
K-Eye를 목에 건 사용자는 앞에서 다가오는 상대방의 얼굴이 화면에 떠오르면 미리 저장된 정보와 실시간으로 찍힌 사진을 비교해 상대방의 이름 등 정보를 자연스럽게 확인할 수 있다.
동글 타입인 K-EyeQ는 스마트폰에 장착해 이용할 수 있는데 사용자를 알아보고 반응하는 기능을 한다. 미리 기억시킨 사용자의 얼굴이 화면을 향하기만 하면 스마트폰 화면이 저절로 켜지면서 그와 관련된 정보를 제공한다.
또한 입력된 얼굴이 사진인지 실제 사람인지도 구분할 수 있어 사용자의 얼굴 대신 사진을 보여주면 스마트폰은 반응하지 않는다.
유 교수는 “인공지능 반도체 프로세서가 4차 산업혁명시대를 주도할 것으로 기대된다”며 “이번 인공지능 칩과 인식기의 개발로 인해 세계시장에서 한국이 인공지능 산업의 주도권을 갖길 기대한다”고 말했다.
□ 사진 설명.
사진1. K-EYE 사진
사진2. K-EYEQ 사진
사진3. CNNP 칩 사진
2017.06.14 조회수 18967 윤동기 교수, 액정 결함의 변이 과정 관찰에 성공
우리 대학 나노과학기술대학원 윤동기 교수 연구팀이 액정의 결함이 온도에 따라 변화하는 과정을 규명했다.
액정 결함에 관한 연구는 20세기 초반부터 약 100여 년 간 위상기하학을 연구하는 물리, 수학자들에 의해 연구됐지만 결함의 형태 전이를 세밀하게 직접적으로 관찰한 것은 이번 연구가 처음이다.
이 액정에서의 결함은 위상학적(topology)으로 우주에서 발생하는 블랙홀과 같은 위상학적 현상과 비슷한 구조를 갖기 때문에 우주의 원리를 연구하는 데 도움이 될 것으로 기대된다.
김민준 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications) 5월 30일자 온라인 판에 게재됐다. (논문명 : Morphogenesis of liquid crystal topological defects during the nematic-smectic A phase transition)
일반적으로 액정 재료는 손쉬운 배향 제어, 빠른 반응속도, 이방적(anisotropic)인 광학 특성을 갖고 있어 액정표시장치(LCD)나 광학 센서 등에 사용된다. 이 때 액정의 결함을 최소화하는 것이 성능 측면에서 유리한 것으로 알려져 있으나 물질 특성 상 액정의 결함은 불가피하게 발생한다.
윤 교수 연구팀은 이 결함을 단순히 없애는 데만 집중하지 않고 결함의 구조를 이해하고 형성 원리를 명확하게 규명하는 기초연구에 집중했다.
이러한 노력을 바탕으로 액정재료의 위상학적 결함이 안정적으로 발생하는 플랫폼을 구성해 온도 변화에 따른 상전이(phase transition)를 직접적으로 관찰했다.
위상학적 결함의 상전이는 2016년도 노벨물리학상의 주제이기도 할 만큼 기초과학 분야에서 중요하다. 우주 은하의 위상학적 구조적 원리도 이에 바탕하고 있어 많은 연구자들이 집중하고 있는 분야이다.
우주 은하의 위상학적 결함을 관찰하기에는 너무 범위가 크고 시간이 오래 걸린다. 하지만 윤 교수팀이 고안한 플랫폼의 위상학적 결함 구조는 광학 현미경으로 관찰이 가능한 수준의 크기이다. 또한 결함의 상전이가 일어나는 시간도 수초에서 수분 단위이기 때문에 관찰이 용이하다.
여기서 액정 재료들이 형성하는 결함 구조는 하나의 특이점(singularity)을 중심으로 방사형, 원형, 나선형 등의 형태를 갖는다. 특이점은 영화 ‘인터스텔라’에서도 나온 것처럼 우주의 블랙홀의 중심부 부분에 해당한다.
이 액정 재료는 일반적으로 딱딱한 두 유리판 사이에 모세관 현상을 통해 주입해 그 시료를 준비하게 된다. 그러나 이 과정에서 유리판처럼 단단한 기판은 표면효과 때문에 액정 물질의 움직임을 제한시키고 이는 결함의 상전이를 관찰하는 장애물이었다.
연구팀은 물 위에 기름이 떠다니는 현상을 이용해 물 위에 얇은 액정재료 막을 형성함으로써 액정 분자들의 움직임이 제한적이지 않은 환경을 조성했다.
이런 환경에서 온도를 변화시키면 그 구조체를 구성하는 분자와 분자 사이의 미세한 상호작용이 기판에 의한 표면효과보다 훨씬 크기 때문에 위상학적 결함의 상전이를 연속적, 직접적으로 관찰할 수 있다.
이 연구 방식은 온도 변화를 통해 위상학적 결함의 형성과정을 순서대로 혹은 역으로 조절할 수 있다. 따라서 전이과정을 면밀하게 관찰하면 중간 상태의 결함구조를 통해 최초의 그 결함 형태와 구성 분자들의 배열을 정확히 역추적 할 수 있다.
이는 위상학적 결함의 형성 원리를 근본적으로 이해할 수 있는 연구 수단이 될 것으로 기대된다.
윤 교수는 이번 연구에 대해 “연구에 대한 발상의 전환을 통해 남들이 보지 못한 것을 볼 수 있었다”며 “액정 결함에 대한 이번 연구 결과는 산업적 측면 뿐 아니라 기초 학문에 세계적 공헌을 할 수 있을 것이다”고 말했다.
또한 “우리나라가 액정 디스플레이 산업의 강국이지만 액정에 대한 기초연구는 세계적 수준에 비해 높지 않다”며 “이번 연구를 계기로 국내 관련 기초연구에 대한 관심을 촉발시키는 계기가 되길 바란다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단이 추진하는 미래유망융합기술파이오니어사업과 신진연구지원사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 물 위에 형성된 액정 결함의 냉각에 의한 위상학적 결함의 상전이 현상의 편광현미경 사진
그림 2. 액정 분자들이 모이는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도와 액정 분자들이 퍼지는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도
2017.06.01 조회수 20940
윤동기 교수, 액정 결함의 변이 과정 관찰에 성공
우리 대학 나노과학기술대학원 윤동기 교수 연구팀이 액정의 결함이 온도에 따라 변화하는 과정을 규명했다.
액정 결함에 관한 연구는 20세기 초반부터 약 100여 년 간 위상기하학을 연구하는 물리, 수학자들에 의해 연구됐지만 결함의 형태 전이를 세밀하게 직접적으로 관찰한 것은 이번 연구가 처음이다.
이 액정에서의 결함은 위상학적(topology)으로 우주에서 발생하는 블랙홀과 같은 위상학적 현상과 비슷한 구조를 갖기 때문에 우주의 원리를 연구하는 데 도움이 될 것으로 기대된다.
김민준 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications) 5월 30일자 온라인 판에 게재됐다. (논문명 : Morphogenesis of liquid crystal topological defects during the nematic-smectic A phase transition)
일반적으로 액정 재료는 손쉬운 배향 제어, 빠른 반응속도, 이방적(anisotropic)인 광학 특성을 갖고 있어 액정표시장치(LCD)나 광학 센서 등에 사용된다. 이 때 액정의 결함을 최소화하는 것이 성능 측면에서 유리한 것으로 알려져 있으나 물질 특성 상 액정의 결함은 불가피하게 발생한다.
윤 교수 연구팀은 이 결함을 단순히 없애는 데만 집중하지 않고 결함의 구조를 이해하고 형성 원리를 명확하게 규명하는 기초연구에 집중했다.
이러한 노력을 바탕으로 액정재료의 위상학적 결함이 안정적으로 발생하는 플랫폼을 구성해 온도 변화에 따른 상전이(phase transition)를 직접적으로 관찰했다.
위상학적 결함의 상전이는 2016년도 노벨물리학상의 주제이기도 할 만큼 기초과학 분야에서 중요하다. 우주 은하의 위상학적 구조적 원리도 이에 바탕하고 있어 많은 연구자들이 집중하고 있는 분야이다.
우주 은하의 위상학적 결함을 관찰하기에는 너무 범위가 크고 시간이 오래 걸린다. 하지만 윤 교수팀이 고안한 플랫폼의 위상학적 결함 구조는 광학 현미경으로 관찰이 가능한 수준의 크기이다. 또한 결함의 상전이가 일어나는 시간도 수초에서 수분 단위이기 때문에 관찰이 용이하다.
여기서 액정 재료들이 형성하는 결함 구조는 하나의 특이점(singularity)을 중심으로 방사형, 원형, 나선형 등의 형태를 갖는다. 특이점은 영화 ‘인터스텔라’에서도 나온 것처럼 우주의 블랙홀의 중심부 부분에 해당한다.
이 액정 재료는 일반적으로 딱딱한 두 유리판 사이에 모세관 현상을 통해 주입해 그 시료를 준비하게 된다. 그러나 이 과정에서 유리판처럼 단단한 기판은 표면효과 때문에 액정 물질의 움직임을 제한시키고 이는 결함의 상전이를 관찰하는 장애물이었다.
연구팀은 물 위에 기름이 떠다니는 현상을 이용해 물 위에 얇은 액정재료 막을 형성함으로써 액정 분자들의 움직임이 제한적이지 않은 환경을 조성했다.
이런 환경에서 온도를 변화시키면 그 구조체를 구성하는 분자와 분자 사이의 미세한 상호작용이 기판에 의한 표면효과보다 훨씬 크기 때문에 위상학적 결함의 상전이를 연속적, 직접적으로 관찰할 수 있다.
이 연구 방식은 온도 변화를 통해 위상학적 결함의 형성과정을 순서대로 혹은 역으로 조절할 수 있다. 따라서 전이과정을 면밀하게 관찰하면 중간 상태의 결함구조를 통해 최초의 그 결함 형태와 구성 분자들의 배열을 정확히 역추적 할 수 있다.
이는 위상학적 결함의 형성 원리를 근본적으로 이해할 수 있는 연구 수단이 될 것으로 기대된다.
윤 교수는 이번 연구에 대해 “연구에 대한 발상의 전환을 통해 남들이 보지 못한 것을 볼 수 있었다”며 “액정 결함에 대한 이번 연구 결과는 산업적 측면 뿐 아니라 기초 학문에 세계적 공헌을 할 수 있을 것이다”고 말했다.
또한 “우리나라가 액정 디스플레이 산업의 강국이지만 액정에 대한 기초연구는 세계적 수준에 비해 높지 않다”며 “이번 연구를 계기로 국내 관련 기초연구에 대한 관심을 촉발시키는 계기가 되길 바란다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단이 추진하는 미래유망융합기술파이오니어사업과 신진연구지원사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 물 위에 형성된 액정 결함의 냉각에 의한 위상학적 결함의 상전이 현상의 편광현미경 사진
그림 2. 액정 분자들이 모이는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도와 액정 분자들이 퍼지는 위상학적 결함의 편광현미경 이미지와 그에 대한 모식도
2017.06.01 조회수 20940 박용근 교수, 세포 자유롭게 변형 가능한 홀로그래피 기술 개발
우리 대학 물리학과 박용근 교수 연구팀이 세포와 같이 복잡한 3차원 물체를 빛을 통해 자유자재로 제어할 수 있는 홀로그래피 기술을 개발했다.
이 기술은 복잡한 형상을 갖는 물체들을 포획하고 조립하면서 실시간 촬영이 가능해 세포들 간의 상호를 연구하거나 미세한 물체를 제작하고 조립하는 새로운 응용 분야를 개척할 수 있을 있을 것으로 보인다.
이번 연구 결과는 네이처 자매지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 5월 22일자 온라인 판에 게재됐다.
광학 집게라고 불리는 기존 광 제어 기술은 레이저로 광 초점을 만들어 그 초점에 구형 물체를 포획하는 방식이다. 렌즈를 이용해 작은 레이저 광 초점을 만들면 이 광초점에 자석에 철가루가 끌려오듯 주변 미세 물체를 달라붙게 하는 기술이다.
또한 이 기술은 초점의 위치를 옮기거나 힘을 가하는 방식으로 포획된 구형 물체의 3차원 위치를 조절할 수 있다. 1997년 노벨 물리학상의 공적인 이 기술은 물리학 및 광학 분야 등에 널리 이용된다.
그러나 이 광학 집게 기술은 물체의 모양이 복잡해지는 경우에는 물체를 안정적으로 포획하기 어렵다. 제어할 수 있는 물체의 방향이 제한적이기 때문에 생명 세포처럼 복잡한 3차원 형상을 가진 미세 물체를 광 제어하는 데는 한계가 있었다.
연구팀은 문제 해결을 위해 임의의 형상을 가진 복잡한 물체도 포획할 수 있는 새로운 레이저 포획 기술을 개발했다.
이 기술은 우선 3차원 홀로그래픽 현미경을 이용해 물체의 3차원 정보를 실시간 측정한 뒤 그 정보를 바탕으로 물체를 효과적으로 제어할 수 있는 광학 패턴을 정밀히 계산해 입사하는 방식이다.
기존 광학 집게 기술이 단순한 광 초점을 이용한 수동적 방식이라면 이 기술은 물체에 따라 능동적으로 적용할 수 있다.
빛과 물체의 모양이 같아질 때 물체가 갖는 에너지가 최소화돼 복잡한 형상의 물체더라도 안정적으로 포획할 수 있음을 확인했다. 이는 물리적으로는 에너지를 최소화하는 방향으로 현상이 발생하는 원리와 같다.
연구팀은 물체가 다양한 위치, 방향, 모양을 갖게 제어해 물체의 3차원 운동을 자유자재로 제어하고 원하는 모양으로 만들 수 있었다. 마치 거푸집을 자유롭게 제작해 원하는 석고상을 만들어내는 것과 같다.
연구팀은 이 기술을 통해 적혈구 세포를 안정적으로 집어 원하는 각도로의 회전, 기역자 모양으로 변형, 두 개의 적혈구를 조립해 새로운 구조물 제작 등을 구현하는 데 성공했다. 또한 복잡한 구조인 대장암 세포를 안정적으로 포획하고 원하는 각도로 회전시킬 수 있었다.
이 기술은 안정적인 상태에서 세포를 원하는 모양으로 변형시킬 수 있어 세포에 힘을 가하여 변형시킬 때의 세포 반응을 정량적으로 분석할 수 있다.
논문의 1저자인 김규현 박사는 “복잡한 형상을 가진 물체의 모양, 특성 등 사전 정보를 몰라도 물체의 운동을 자유자재로 제어할 수 있는 기술이다”며 “생물 물리학 연구, 부유 물질 및 나노 물체 조립 등의 다양한 분야에 응용 가능할 것이다”고 말했다.
□ 그림 설명
그림1. 3차원 능동 광 제어 기술의 모식도
그림2. 복잡한 형태의 생명 세포들의 3차원 운동 및 모양 제어 결과
2017.05.25 조회수 14939
박용근 교수, 세포 자유롭게 변형 가능한 홀로그래피 기술 개발
우리 대학 물리학과 박용근 교수 연구팀이 세포와 같이 복잡한 3차원 물체를 빛을 통해 자유자재로 제어할 수 있는 홀로그래피 기술을 개발했다.
이 기술은 복잡한 형상을 갖는 물체들을 포획하고 조립하면서 실시간 촬영이 가능해 세포들 간의 상호를 연구하거나 미세한 물체를 제작하고 조립하는 새로운 응용 분야를 개척할 수 있을 있을 것으로 보인다.
이번 연구 결과는 네이처 자매지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 5월 22일자 온라인 판에 게재됐다.
광학 집게라고 불리는 기존 광 제어 기술은 레이저로 광 초점을 만들어 그 초점에 구형 물체를 포획하는 방식이다. 렌즈를 이용해 작은 레이저 광 초점을 만들면 이 광초점에 자석에 철가루가 끌려오듯 주변 미세 물체를 달라붙게 하는 기술이다.
또한 이 기술은 초점의 위치를 옮기거나 힘을 가하는 방식으로 포획된 구형 물체의 3차원 위치를 조절할 수 있다. 1997년 노벨 물리학상의 공적인 이 기술은 물리학 및 광학 분야 등에 널리 이용된다.
그러나 이 광학 집게 기술은 물체의 모양이 복잡해지는 경우에는 물체를 안정적으로 포획하기 어렵다. 제어할 수 있는 물체의 방향이 제한적이기 때문에 생명 세포처럼 복잡한 3차원 형상을 가진 미세 물체를 광 제어하는 데는 한계가 있었다.
연구팀은 문제 해결을 위해 임의의 형상을 가진 복잡한 물체도 포획할 수 있는 새로운 레이저 포획 기술을 개발했다.
이 기술은 우선 3차원 홀로그래픽 현미경을 이용해 물체의 3차원 정보를 실시간 측정한 뒤 그 정보를 바탕으로 물체를 효과적으로 제어할 수 있는 광학 패턴을 정밀히 계산해 입사하는 방식이다.
기존 광학 집게 기술이 단순한 광 초점을 이용한 수동적 방식이라면 이 기술은 물체에 따라 능동적으로 적용할 수 있다.
빛과 물체의 모양이 같아질 때 물체가 갖는 에너지가 최소화돼 복잡한 형상의 물체더라도 안정적으로 포획할 수 있음을 확인했다. 이는 물리적으로는 에너지를 최소화하는 방향으로 현상이 발생하는 원리와 같다.
연구팀은 물체가 다양한 위치, 방향, 모양을 갖게 제어해 물체의 3차원 운동을 자유자재로 제어하고 원하는 모양으로 만들 수 있었다. 마치 거푸집을 자유롭게 제작해 원하는 석고상을 만들어내는 것과 같다.
연구팀은 이 기술을 통해 적혈구 세포를 안정적으로 집어 원하는 각도로의 회전, 기역자 모양으로 변형, 두 개의 적혈구를 조립해 새로운 구조물 제작 등을 구현하는 데 성공했다. 또한 복잡한 구조인 대장암 세포를 안정적으로 포획하고 원하는 각도로 회전시킬 수 있었다.
이 기술은 안정적인 상태에서 세포를 원하는 모양으로 변형시킬 수 있어 세포에 힘을 가하여 변형시킬 때의 세포 반응을 정량적으로 분석할 수 있다.
논문의 1저자인 김규현 박사는 “복잡한 형상을 가진 물체의 모양, 특성 등 사전 정보를 몰라도 물체의 운동을 자유자재로 제어할 수 있는 기술이다”며 “생물 물리학 연구, 부유 물질 및 나노 물체 조립 등의 다양한 분야에 응용 가능할 것이다”고 말했다.
□ 그림 설명
그림1. 3차원 능동 광 제어 기술의 모식도
그림2. 복잡한 형태의 생명 세포들의 3차원 운동 및 모양 제어 결과
2017.05.25 조회수 14939 류호진 교수, 금속 칵테일로 핵융합에 사용가능한 신소재 개발
우리 대학 원자력 및 양자공학과 류호진 교수 연구팀이 칵테일처럼 여러 원소를 혼합하는 방식을 통해 핵융합 플라즈마의 대면재로 적용 가능한 신소재 합금을 개발했다.
이번 연구를 통해 핵융합 발전과 같은 극한적 환경에서 사용되는 금속의 범위가 다양하게 확장될 것으로 기대된다.
오와이스 왓심 박사과정이 1저자로 참여한 이번 연구는 온라인 국제 학술지 ‘사이언티픽 리포트(Scientific Report)’ 5월 16일자에 게재됐다.
미래 에너지원으로 여겨지는 핵융합 발전을 실현하기 위해서는 고온의 플라즈마를 가두고 있는 토카막(tokamak) 용기의 내구성이 중요하다. 도넛 모양의 토카막은 강력한 자기장을 통해 1억℃가 넘는 플라즈마를 안정적으로 유지시켜주는 역할을 한다.
그럼에도 불구하고 플라즈마의 고온에 따른 열부하, 플라즈마 이온, 중성자 등으로 인해 토카막 용기는 손상이 발생한다. 이 토카막 용기를 보호하기 위한 대면재로 텅스텐 등의 금속이 쓰이고 있으나 완벽한 핵융합 발전을 위해서는 고성능 신소재의 개발이 필수적이다.
류 교수 연구팀은 텅스텐에 소량의 금속을 첨가해 물성을 개량하는 기존 방법들보다 한 발 더 나아가 다량의 금속을 동시에 혼합하는 기술을 활용했다.
이는 마치 칵테일처럼 여러 금속 분말을 혼합한 후 소결하는 분말야금 기술로 이를 통해 텅스텐보다 경도와 강도가 2배 이상 향상된 신소재 합금을 제조하는 데 성공했다.
핵융합에서는 다양한 물질을 함께 혼합하는 위와 같은 방식이 역효과를 발생시키기도 한다. 몰리브덴, 니오븀 등은 핵융합을 하면서 발생하는 중성자와 반응을 해 방사성이 높은 원소로 탈바꿈하는 방사화 현상이 발생해 방사능을 발산하기도 한다.
류 교수 연구팀은 이러한 제약들을 고려해 크롬, 티타늄 등을 첨가했고 이는 경도 향상 뿐 아니라 제조 공정의 촉진, 방사화 방지 등의 효과도 얻어냈다.
연구팀은 고온 기계적 특성과 더불어 열전도도, 플라즈마 상호작용, 중성자 조사취화, 트리튬 흡수 억제, 고온 내산화 특성 등을 최적화하는 합금 조성을 찾기 위한 연구를 계속 진행할 예정이다.
류 교수는 “핵융합 플라즈마 대면재는 열 충격과 플라즈마 및 중성자로 인한 손상이 극심해 이를 견딜만한 금속이 없을 정도로 극한적 환경에 노출된다”며 “이번 연구결과로 핵융합 및 원자력용 고융점 저 방사화 금속을 개발하고자 하는 시도가 전 세계적으로 활발해질 것으로 예상된다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단의 핵융합기초연구사업과 전략구조소재 신공정설계 연구센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구를 통해 제조된 텅스텐 기반 고강도 신합금
그림2. 고융점 금속 혼합 공정을 통한 핵융합 플라즈마 대면재 개발 개요
2017.05.24 조회수 17834
류호진 교수, 금속 칵테일로 핵융합에 사용가능한 신소재 개발
우리 대학 원자력 및 양자공학과 류호진 교수 연구팀이 칵테일처럼 여러 원소를 혼합하는 방식을 통해 핵융합 플라즈마의 대면재로 적용 가능한 신소재 합금을 개발했다.
이번 연구를 통해 핵융합 발전과 같은 극한적 환경에서 사용되는 금속의 범위가 다양하게 확장될 것으로 기대된다.
오와이스 왓심 박사과정이 1저자로 참여한 이번 연구는 온라인 국제 학술지 ‘사이언티픽 리포트(Scientific Report)’ 5월 16일자에 게재됐다.
미래 에너지원으로 여겨지는 핵융합 발전을 실현하기 위해서는 고온의 플라즈마를 가두고 있는 토카막(tokamak) 용기의 내구성이 중요하다. 도넛 모양의 토카막은 강력한 자기장을 통해 1억℃가 넘는 플라즈마를 안정적으로 유지시켜주는 역할을 한다.
그럼에도 불구하고 플라즈마의 고온에 따른 열부하, 플라즈마 이온, 중성자 등으로 인해 토카막 용기는 손상이 발생한다. 이 토카막 용기를 보호하기 위한 대면재로 텅스텐 등의 금속이 쓰이고 있으나 완벽한 핵융합 발전을 위해서는 고성능 신소재의 개발이 필수적이다.
류 교수 연구팀은 텅스텐에 소량의 금속을 첨가해 물성을 개량하는 기존 방법들보다 한 발 더 나아가 다량의 금속을 동시에 혼합하는 기술을 활용했다.
이는 마치 칵테일처럼 여러 금속 분말을 혼합한 후 소결하는 분말야금 기술로 이를 통해 텅스텐보다 경도와 강도가 2배 이상 향상된 신소재 합금을 제조하는 데 성공했다.
핵융합에서는 다양한 물질을 함께 혼합하는 위와 같은 방식이 역효과를 발생시키기도 한다. 몰리브덴, 니오븀 등은 핵융합을 하면서 발생하는 중성자와 반응을 해 방사성이 높은 원소로 탈바꿈하는 방사화 현상이 발생해 방사능을 발산하기도 한다.
류 교수 연구팀은 이러한 제약들을 고려해 크롬, 티타늄 등을 첨가했고 이는 경도 향상 뿐 아니라 제조 공정의 촉진, 방사화 방지 등의 효과도 얻어냈다.
연구팀은 고온 기계적 특성과 더불어 열전도도, 플라즈마 상호작용, 중성자 조사취화, 트리튬 흡수 억제, 고온 내산화 특성 등을 최적화하는 합금 조성을 찾기 위한 연구를 계속 진행할 예정이다.
류 교수는 “핵융합 플라즈마 대면재는 열 충격과 플라즈마 및 중성자로 인한 손상이 극심해 이를 견딜만한 금속이 없을 정도로 극한적 환경에 노출된다”며 “이번 연구결과로 핵융합 및 원자력용 고융점 저 방사화 금속을 개발하고자 하는 시도가 전 세계적으로 활발해질 것으로 예상된다”고 말했다.
이번 연구는 미래창조과학부와 한국연구재단의 핵융합기초연구사업과 전략구조소재 신공정설계 연구센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 연구를 통해 제조된 텅스텐 기반 고강도 신합금
그림2. 고융점 금속 혼합 공정을 통한 핵융합 플라즈마 대면재 개발 개요
2017.05.24 조회수 17834 방효충 교수 연구팀, 지구 저궤도 관측 큐브위성 궤도진입 및 교신 성공
우리 대학 항공우주공학과 방효충 교수 연구팀이 큐브위성 궤도진입 및 첫 교신을 성공적으로 수행했다.
방 교수 연구팀에서 개발한 LINK(Little Intelligent Nanosatellite of KAIST)는 4월 18일에 발사돼 국제우주정거장으로 배송된 바 있다.
궤도진입은 5월 18일 오전 10시에 NRCSD(NanoRacks CubeSat Deployer)를 통해 이뤄졌으며 한국 시각으로 같은 날 23시 5분 첫 교신에 성공했다. 지상국에서 확인한 큐브위성의 상태는 양호하다.
LINK는 벨기에 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50는 큰 대기항력 때문에 관측이 덜 이루어진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하고자 하는 국제 공동 프로젝트로 전 세계 23개 이상의 국가에서 참여하고 있다.
LINK는 2unit(20x10x10cm3) 크기로 무게가 약 2kg이며 지구관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재하고 있다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
궤도진입을 마친 큐브위성은 초기 한 달 동안 지상국을 통해 시스템 점검을 수행한 뒤 두 달에 걸쳐 저궤도 대기관측 데이터를 수집할 예정이다.
LINK 큐브위성의 개발은 항공우주연구원 '2012년 큐브위성대회'의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. NRCSD(NanoRacks CubeSat Deployer) 큐브위성 사출 장면
그림2. LINK 비콘신호 수신
2017.05.24 조회수 15467
방효충 교수 연구팀, 지구 저궤도 관측 큐브위성 궤도진입 및 교신 성공
우리 대학 항공우주공학과 방효충 교수 연구팀이 큐브위성 궤도진입 및 첫 교신을 성공적으로 수행했다.
방 교수 연구팀에서 개발한 LINK(Little Intelligent Nanosatellite of KAIST)는 4월 18일에 발사돼 국제우주정거장으로 배송된 바 있다.
궤도진입은 5월 18일 오전 10시에 NRCSD(NanoRacks CubeSat Deployer)를 통해 이뤄졌으며 한국 시각으로 같은 날 23시 5분 첫 교신에 성공했다. 지상국에서 확인한 큐브위성의 상태는 양호하다.
LINK는 벨기에 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50는 큰 대기항력 때문에 관측이 덜 이루어진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하고자 하는 국제 공동 프로젝트로 전 세계 23개 이상의 국가에서 참여하고 있다.
LINK는 2unit(20x10x10cm3) 크기로 무게가 약 2kg이며 지구관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재하고 있다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
궤도진입을 마친 큐브위성은 초기 한 달 동안 지상국을 통해 시스템 점검을 수행한 뒤 두 달에 걸쳐 저궤도 대기관측 데이터를 수집할 예정이다.
LINK 큐브위성의 개발은 항공우주연구원 '2012년 큐브위성대회'의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. NRCSD(NanoRacks CubeSat Deployer) 큐브위성 사출 장면
그림2. LINK 비콘신호 수신
2017.05.24 조회수 15467 우운택 교수, 스마트 관광 증강현실 어플리케이션 개발
〈 우 운 택 교수 〉
우리 대학 문화기술대학원 우운택 교수 연구팀이 스마트 관광 지원을 위한 증강 및 가상현실 어플리케이션을 개발했다.
‘케이 컬처 타임머신(K-Culture Time Machine)’ 어플리케이션은 창덕궁을 대상으로 한 시범 서비스로 iOS 앱스토어에 5월 23일 공개됐다.
개발된 케이 컬처 타임머신은 웨어러블 360도 비디오를 통해 문화유산이나 유적지에 대한 시공간을 넘는 원격 체험을 제공한다.
사용자는 VR기기에 스마트폰을 장착해 제공되는 360도 비디오로 문화 유적지를 원격으로 체험하고 해당 문화유산 및 연관관계가 있는 인물, 장소, 사건 등에 대한 정보를 확인할 수 있다. 또한 소실된 문화유산에 대한 3차원 디지털 복원도 체험할 수 있다.
웨어러블 기기 활용 없이도 모바일 모드를 통해 사용자 주변 유적지 확인, 카메라에 인식된 문화유산을 인식하고 관련된 정보와 콘텐츠를 제공하는 증강현실 기반의 문화유산 가이드가 가능하다.
사용자는 자신의 위치에서 창덕궁 돈화문을 시작으로 인정문, 인정전, 희정당에 이르는 창덕궁 내부를 이동하며 360도 파노라마 이미지나 비디오를 통해 현장을 가상체험 할 수 있다.
현재는 존재하지 않는 인정전 동쪽의 궐내 곽사 지역에는 3D모델을 통한 승정원의 가상 복원을 확인할 수 있다.
위 기능은 웨어러블 기기 없이 스마트폰 상에서도 체험 가능하며 개발 중인 증강현실 기능이 완성되면 현장에서 활용 가능한 수준의 어플리케이션이 될 것으로 기대된다.
우 교수 연구팀은 문화유산 데이터베이스와 증강-가상현실 콘텐츠의 표준화된 메타데이터를 구축하고 이를 적용했다. 이를 활용해 일시적으로 개발 후 소비되는 기존 어플리케이션과는 달리 추가적인 콘텐츠 생성 및 추가가 가능하다.
우 교수는 “증강현실 콘텐츠의 상호 활용성과 재활용성을 증진해 스마트관광 분야의 새로운 시장을 선점할 수 있을 것이다”며 “콘텐츠 개발 비용 절감과 증강현실 콘텐츠 생태계 활성화를 가능하게 하는 다양한 부가 효과도 기대한다”고 말했다.
이번 연구는 ㈜포스트미디어(대표 홍승모)와 문화체육관광부 CT R&D 사업과의 공동 수행을 통해 이뤄졌으며, 관련 연구 성과는 올 7월 캐나다에서 진행되는 HCII 2017 학회를 통해 발표될 예정이다.
□ 그림 설명
그림1. 360 VR 서비스 개념도
그림2. K-Culture Time Machine의 모바일 증강현실 기능 구동 화면
그림3. K-Culture Time Machine의 360도 파노라마 이미지-비디오 기능 화면
2017.05.23 조회수 20342
우운택 교수, 스마트 관광 증강현실 어플리케이션 개발
〈 우 운 택 교수 〉
우리 대학 문화기술대학원 우운택 교수 연구팀이 스마트 관광 지원을 위한 증강 및 가상현실 어플리케이션을 개발했다.
‘케이 컬처 타임머신(K-Culture Time Machine)’ 어플리케이션은 창덕궁을 대상으로 한 시범 서비스로 iOS 앱스토어에 5월 23일 공개됐다.
개발된 케이 컬처 타임머신은 웨어러블 360도 비디오를 통해 문화유산이나 유적지에 대한 시공간을 넘는 원격 체험을 제공한다.
사용자는 VR기기에 스마트폰을 장착해 제공되는 360도 비디오로 문화 유적지를 원격으로 체험하고 해당 문화유산 및 연관관계가 있는 인물, 장소, 사건 등에 대한 정보를 확인할 수 있다. 또한 소실된 문화유산에 대한 3차원 디지털 복원도 체험할 수 있다.
웨어러블 기기 활용 없이도 모바일 모드를 통해 사용자 주변 유적지 확인, 카메라에 인식된 문화유산을 인식하고 관련된 정보와 콘텐츠를 제공하는 증강현실 기반의 문화유산 가이드가 가능하다.
사용자는 자신의 위치에서 창덕궁 돈화문을 시작으로 인정문, 인정전, 희정당에 이르는 창덕궁 내부를 이동하며 360도 파노라마 이미지나 비디오를 통해 현장을 가상체험 할 수 있다.
현재는 존재하지 않는 인정전 동쪽의 궐내 곽사 지역에는 3D모델을 통한 승정원의 가상 복원을 확인할 수 있다.
위 기능은 웨어러블 기기 없이 스마트폰 상에서도 체험 가능하며 개발 중인 증강현실 기능이 완성되면 현장에서 활용 가능한 수준의 어플리케이션이 될 것으로 기대된다.
우 교수 연구팀은 문화유산 데이터베이스와 증강-가상현실 콘텐츠의 표준화된 메타데이터를 구축하고 이를 적용했다. 이를 활용해 일시적으로 개발 후 소비되는 기존 어플리케이션과는 달리 추가적인 콘텐츠 생성 및 추가가 가능하다.
우 교수는 “증강현실 콘텐츠의 상호 활용성과 재활용성을 증진해 스마트관광 분야의 새로운 시장을 선점할 수 있을 것이다”며 “콘텐츠 개발 비용 절감과 증강현실 콘텐츠 생태계 활성화를 가능하게 하는 다양한 부가 효과도 기대한다”고 말했다.
이번 연구는 ㈜포스트미디어(대표 홍승모)와 문화체육관광부 CT R&D 사업과의 공동 수행을 통해 이뤄졌으며, 관련 연구 성과는 올 7월 캐나다에서 진행되는 HCII 2017 학회를 통해 발표될 예정이다.
□ 그림 설명
그림1. 360 VR 서비스 개념도
그림2. K-Culture Time Machine의 모바일 증강현실 기능 구동 화면
그림3. K-Culture Time Machine의 360도 파노라마 이미지-비디오 기능 화면
2017.05.23 조회수 20342 한순규 교수, 천연 물질인 플루게닌C 합성에 성공
우리 대학 화학과 한순규 교수 연구팀이 새로운 방식의 화학반응을 이용해 자연 상태에서 존재하는 천연물을 인위적으로 제작하는 데 성공했다.
연구팀은 분자 간 화학반응의 일종인 라우훗-쿠리어 반응(Rauhut-Currier 반응, RC 반응)을 이용해 이합체 천연물인 플루게닌 C를 합성했다.
전상빈 석박사통합과정이 1저자로 참여한 이번 연구는 화학 분야의 국제 학술지 ‘미국화학회지(JACS : Journal of the American Chemical Society)’ 5월 10일자에 게재됐다.
천연물 전합성(Total Synthesis)은 순차적 화학반응을 통해 자연에 존재하는 천연 물질을 실험실에서 인위적으로 합성해내는 연구 분야이다.
이 과정은 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 분자에 도달할 수 있어 높은 수준의 인내심, 창의성 등이 요구된다. 학계에서는 천연물 전합성 학자를 가리켜 ‘분자를 다루는 예술가’로 부르기도 한다.
이번 연구는 분자 간 라우훗-쿠리어 반응을 전합성에 응용한 최초의 사례이다. 라우훗-쿠리어 반응은 1963년 라우훗과 쿠리어에 의해 보고된 반응으로 친핵체 촉매에 의해 진행되는 현상이다.
기존의 분자 간 라우훗-쿠리어 반응은 150도 이상의 고온 및 고농도 용액에서 유독한 촉매를 통해 비 선택적으로 진행된다는 한계가 있어 천연물 전합성에 적합하지 않았다.
연구팀은 문제 해결을 위해 반응물 내부에 친핵체를 위치시켰다. 이를 통해 상온의 옅은 용액에서 촉매 없이 간단한 염기성 시료를 첨가시키는 것만으로도 라우훗-쿠리어 반응을 이끌어 낼 수 있음을 확인했다.
연구팀은 이 반응 조건을 이용해 시중에서 구입 가능한 아미노산 유도체를 12단계를 거쳐 플루게닌 C라는 천연물질로 합성하는 데 성공했다.
한 교수는 “이번 연구는 라우훗-쿠리어 반응의 효율성과 선택성을 획기적으로 향상시킨 발견이다”며 “기존에는 합성할 수 없었던 다양한 천연물, 신약 또는 유기재료를 합성할 수 있는 길이 열렸다”고 말했다.
이번 연구는 KAIST의 정착 연구비, 하이리스크하이리턴(HRHR) 및 RED&B(Research, Education, Development & Business) 과제, 한국연구재단의 신진연구자 지원사업, 기초과학연구원 분자활성 촉매반응 연구단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 대표적인 이합체-소중합체 세큐리네가 알칼로이드
그림2. 플루게닌 C의 합성 경로
2017.05.19 조회수 22325
한순규 교수, 천연 물질인 플루게닌C 합성에 성공
우리 대학 화학과 한순규 교수 연구팀이 새로운 방식의 화학반응을 이용해 자연 상태에서 존재하는 천연물을 인위적으로 제작하는 데 성공했다.
연구팀은 분자 간 화학반응의 일종인 라우훗-쿠리어 반응(Rauhut-Currier 반응, RC 반응)을 이용해 이합체 천연물인 플루게닌 C를 합성했다.
전상빈 석박사통합과정이 1저자로 참여한 이번 연구는 화학 분야의 국제 학술지 ‘미국화학회지(JACS : Journal of the American Chemical Society)’ 5월 10일자에 게재됐다.
천연물 전합성(Total Synthesis)은 순차적 화학반응을 통해 자연에 존재하는 천연 물질을 실험실에서 인위적으로 합성해내는 연구 분야이다.
이 과정은 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 분자에 도달할 수 있어 높은 수준의 인내심, 창의성 등이 요구된다. 학계에서는 천연물 전합성 학자를 가리켜 ‘분자를 다루는 예술가’로 부르기도 한다.
이번 연구는 분자 간 라우훗-쿠리어 반응을 전합성에 응용한 최초의 사례이다. 라우훗-쿠리어 반응은 1963년 라우훗과 쿠리어에 의해 보고된 반응으로 친핵체 촉매에 의해 진행되는 현상이다.
기존의 분자 간 라우훗-쿠리어 반응은 150도 이상의 고온 및 고농도 용액에서 유독한 촉매를 통해 비 선택적으로 진행된다는 한계가 있어 천연물 전합성에 적합하지 않았다.
연구팀은 문제 해결을 위해 반응물 내부에 친핵체를 위치시켰다. 이를 통해 상온의 옅은 용액에서 촉매 없이 간단한 염기성 시료를 첨가시키는 것만으로도 라우훗-쿠리어 반응을 이끌어 낼 수 있음을 확인했다.
연구팀은 이 반응 조건을 이용해 시중에서 구입 가능한 아미노산 유도체를 12단계를 거쳐 플루게닌 C라는 천연물질로 합성하는 데 성공했다.
한 교수는 “이번 연구는 라우훗-쿠리어 반응의 효율성과 선택성을 획기적으로 향상시킨 발견이다”며 “기존에는 합성할 수 없었던 다양한 천연물, 신약 또는 유기재료를 합성할 수 있는 길이 열렸다”고 말했다.
이번 연구는 KAIST의 정착 연구비, 하이리스크하이리턴(HRHR) 및 RED&B(Research, Education, Development & Business) 과제, 한국연구재단의 신진연구자 지원사업, 기초과학연구원 분자활성 촉매반응 연구단의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 대표적인 이합체-소중합체 세큐리네가 알칼로이드
그림2. 플루게닌 C의 합성 경로
2017.05.19 조회수 22325 김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25 조회수 22644
김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25 조회수 22644 방효충 교수, 지구 저궤도의 관측 위한 큐브위성 발사
우리 대학 항공우주공학과 방효충 교수 연구팀이 지구 저궤도 관측을 위한 초소형 큐브위성을 발사했다.
방 교수 연구팀에서 개발한 큐브위성인 LINK(Little Intelligent Nanosatellite of KAIST)를 포함한 총 28개의 큐브위성이 아틀라스 V(Atlas V) 발사체(NASA CRS-7 미션)에 탑재돼 미 동부시간 4월 18일 오전 11시 11분에 미국 Space Launch Complex 41에서 성공적으로 발사됐다.
큐브위성들은 국제우주정거장에서 보관 후 약 한 달 뒤에 궤도 진입 예정이며 이후 약 3달 동안 과학임무를 수행한다.
LINK는 벨기에의 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50 프로젝트는 큰 대기항력 때문에 관측이 덜 이뤄진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하는 국제 공동 프로젝트이다. 2012년에 시작된 이 프로젝트는 전 세계 23개 이상의 국가가 참여하고 있다.
LINK는 2유닛(20x10x10㎤) 크기로 무게는 2kg 정도이며 지구 관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재했다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
방 교수는 “QB50 프로젝트는 교육용으로만 쓰이던 큐브위성이 의미있는 과학임무를 수행하기 위한 도구로 도약하는 계기가 될 것이다”며 “다수의 큐브위성을 이용해 저궤도 대기 관측을 한 첫 사례로 의미있는 데이터를 얻을 것으로 기대한다”고 말했다.
또한 “이 노하우를 이용해 앞으로 위성을 추가 개발해 연구 내용을 우주에서 직접 검증할 수 있을 것이다”고 말했다.
현재 큐브위성을 실은 Cygnus 모듈이 궤도에서 대기 중이며 미 동부시간 4월 22일 오전 8시 39분 국제우주정거장과 도킹을 완료했다.
2017.04.24 조회수 17887
방효충 교수, 지구 저궤도의 관측 위한 큐브위성 발사
우리 대학 항공우주공학과 방효충 교수 연구팀이 지구 저궤도 관측을 위한 초소형 큐브위성을 발사했다.
방 교수 연구팀에서 개발한 큐브위성인 LINK(Little Intelligent Nanosatellite of KAIST)를 포함한 총 28개의 큐브위성이 아틀라스 V(Atlas V) 발사체(NASA CRS-7 미션)에 탑재돼 미 동부시간 4월 18일 오전 11시 11분에 미국 Space Launch Complex 41에서 성공적으로 발사됐다.
큐브위성들은 국제우주정거장에서 보관 후 약 한 달 뒤에 궤도 진입 예정이며 이후 약 3달 동안 과학임무를 수행한다.
LINK는 벨기에의 Von Karman Institute에서 주관하는 QB50 프로젝트의 일환으로 개발됐다.
QB50 프로젝트는 큰 대기항력 때문에 관측이 덜 이뤄진 200~400km 구간의 지구 저궤도 대기를 개발비용이 저렴한 큐브위성을 다수 발사해 관측하는 국제 공동 프로젝트이다. 2012년에 시작된 이 프로젝트는 전 세계 23개 이상의 국가가 참여하고 있다.
LINK는 2유닛(20x10x10㎤) 크기로 무게는 2kg 정도이며 지구 관측을 위해 이온-중성자 질량 분광기 및 랑뮈어 탐침을 탑재했다. 랑뮈어 탐침은 우리 대학 물리학과 민경욱 교수 연구팀이 개발했다.
방 교수는 “QB50 프로젝트는 교육용으로만 쓰이던 큐브위성이 의미있는 과학임무를 수행하기 위한 도구로 도약하는 계기가 될 것이다”며 “다수의 큐브위성을 이용해 저궤도 대기 관측을 한 첫 사례로 의미있는 데이터를 얻을 것으로 기대한다”고 말했다.
또한 “이 노하우를 이용해 앞으로 위성을 추가 개발해 연구 내용을 우주에서 직접 검증할 수 있을 것이다”고 말했다.
현재 큐브위성을 실은 Cygnus 모듈이 궤도에서 대기 중이며 미 동부시간 4월 22일 오전 8시 39분 국제우주정거장과 도킹을 완료했다.
2017.04.24 조회수 17887 박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14 조회수 21285
박현규 교수, DNA 통한 나노 꽃 구조체 제작 기술 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 가천대학교 김문일 교수와의 공동 연구를 통해 DNA를 이용해 상온에서 꽃 모양의 나노입자를 합성하는 기술을 개발했다.
이 기술은 아민과 아마이드 구조를 포함한 DNA와 구리 이온의 상호작용을 기반으로 개발됐으며, 이를 이용해 환경 친화적 조건에서 DNA를 고농도로 포집한 꽃 모양의 나노 구조체를 합성하는데 성공했다.
생명화학공학과 출신의 박기수 박사(현 건국대 교수)가 제1저자로 참여한 이번 연구는 영국왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 학술지 ‘저널 오브 머티리얼즈 케미스트리 B(Journal of Materials Chemistry B) 2017년 12호 표지논문으로 선정됐다.
나노 꽃(nanoflowers)이라 불리는 꽃 모양의 나노 물질은 표면이 거칠고 넓은 표면적으로 인해 촉매, 전자기술 및 분석 화학을 비롯해 여러 분야에서 주목받고 있다.
최근에는 단백질을 이용한 유, 무기 복합 나노 꽃 제작이 이뤄지고 있으며 이는 일반적인 효소에 비해 높은 활성, 안정성 및 내구성을 지닌다는 것이 증명되고 있다.
그러나 일반적인 단백질 나노 꽃 합성은 고온에서 열수 처리를 통해야만 가능했기 때문에 DNA를 효과적으로 포집하지 못한다는 한계를 갖는다.
연구팀은 문제 해결을 위해 생체 고분자 물질인 핵산이 아마이드 결합 및 아민 그룹을 갖고 있다는 사실에 주목했다. 이를 통해 단백질 기반의 나노 꽃 제작 원리를 바탕으로 핵산을 이용한 유, 무기 복합 나노 꽃 구조물 제작이 상온의 친환경적 조건에서 가능함을 증명했다.
연구팀은 다양한 염기서열의 DNA를 이용해 이 기술을 범용적으로 적용 가능함을 확인했다. 이번에 개발된 DNA 기반 나노 꽃 구조물은 기존 기술에 비해 여러 장점을 갖는다. 유해한 화학물질 없이 친환경 제작이 가능하고 낮은 세포독성을 갖는다.
또한 고효율의 DNA 포집이 가능하고 나노 꽃 내부에 포집된 DNA는 핵산 분해효소에 대해 높은 저항성을 보임을 증명했다.
특히 연구팀은 합성된 나노 꽃 입자의 넓은 표면적이 입자 내부 구리의 과산화효소 활성을 크게 향상시킴을 발견했고, 이를 과산화수소를 검출하는 센싱 분야에도 활용 가능할 것으로 예상하고 있다.
연구팀은 향후 다양한 핵산을 이용해 나노 꽃 입자를 합성하고 이를 유전자 치료 및 바이오센서 개발에 응용할 예정이다.
박 교수는 “이번 연구에서 개발된 DNA를 이용해 상온에서 합성된 나노 꽃 입자는 낮은 세포독성 특성을 띠면서 DNA를 핵산 절단효소로부터 효과적으로 보호하는 특성이 있다”며 “이를 통해 향후 유전자 치료용 전달체 등에 응용 가능하다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 글로벌프론티어 지원사업의 일환으로 수행됐다.
□ 그림 설명
그림1. journal of Materials Chemistry B 표지
그림2. 다양한 염기서열 및 길이를 가지는 DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 결과를 나타내는 SEM 사진
그림3. DNA를 이용한 유, 무기 복합 나노 꽃 구조물의 제작 과정을 나타내는 모식도
2017.04.14 조회수 21285 한동수 교수, 크라우드소싱 기반 실내 위치인식 시스템 개발
〈 한 동 수 교수 〉
우리 대학 전산학부 한동수 교수 연구팀(지능형 서비스통합 연구실)이 실내 공간에서 획득한 와이파이 신호의 수집 위치정보를 자동으로 파악할 수 있는 기술을 개발했다.
이 기술은 글로벌 실내 위치인식 시스템 구축에 필요한 핵심 기술로 다수의 스마트폰에서 수집된 무선랜 핑거프린트의 수집 위치를 자동으로 라벨링하는 인공지능 기법이다. 비용을 절감하면서 높은 정확도를 가질 수 있고 무선랜 핑거프린트 수집이 가능한 건물이라면 어느 곳에도 적용 가능하다.
여러 글로벌 기업들이 실내 GPS를 실현하기 위해 전 세계 주요도시에서 수만 건의 실내 지도를 수집했다. 실내 지도와 함께 신호 지도 수집도 시도했지만 높은 정확도를 갖지 못했고 그 결과 실내에서의 위치 인식 서비스 질이 떨어진다.
연구팀은 문제 해결을 위해 실내를 이동 공간과 체류 공간으로 구분하고 각각의 공간에 최적화된 수집 위치 라벨링을 자동화하는 기술을 개발했다.
연구팀이 개발한 기술은 복도, 로비, 계단과 같은 이동 공간에서도 수집된 신호의 위치정보를 별도의 외부 정도 없이도 자동으로 라벨링하는 새로운 자율학습(Unsupervised Learning) 인공지능 기술이다.
이 기술을 토대로 기초실험연구동(N5)과 김병호-김삼열IT융합빌딩(N1)에서 실험을 실시했고, 충분한 양의 학습 데이터가 주어진다는 가정 하에 오차범위 3~4미터 수준의 정확도를 보였다.
이는 수작업을 통해 수집 위치를 라벨링한 결과와 비슷한 정확도로 연구팀이 함께 개발한 지자기 신호, 3축 가속기, 자이로스코프 기반의 딥러닝을 활용한 새로운 센서 퓨전 기법을 통하면 정확도가 더욱 상승하는 결과를 보였다.
그 동안 스마트폰을 통해 수집된 핑거프린트는 활용되지 못하고 버려졌지만 개발된 기술을 통해 무선랜 핑거프린트 빅데이터 영역이 새롭게 열릴 것으로 기대된다.
개발된 GPS 구축 기술은 글로벌 기업이나 국내 위치정보 서비스 기업 등이 전국 범위에서 위치정보 서비스를 제공할 때 도입해 효과적으로 사용할 수 있을 것으로 예상된다.
GPS 신호가 도달하지 않는 실내 환경에서 위치인식 정확도가 높아짐에 따라 포켓몬고 등의 O2O(online to offline) 위치기반 게임도 실내에서 실행 가능할 것으로 기대된다.
또한 다양한 위치기반 SNS, 사물인터넷 등 서비스가 활성화되고 위급한 상황에서 112나 119에 구조요청을 할 시 정확한 위치 파악이 가능할 것으로 보인다.
한 교수는 “개발된 글로벌 실내 위치인식 시스템 구축 기술을 KAIST 실내 위치인식 시스템인 카이로스(KAILOS)에 탑재해 서비스 할 예정이다”며 “전 세계 어느 건물에서든 정확도 높은 실내 위치인식 시스템을 손쉽게 구축할 수 있고 장래에 대부분 실내 공간에서도 위치인식 서비스가 제공 가능할 것이다”고 말했다.
카이로스는 2014년 KAIST에서 출시한 개방형 실내 위치인식 서비스 플랫폼이다. 자신이 원하는 건물의 실내지도를 카이로스에 등록하고 해당 건물의 핑거프린트를 수집해 실내 위치인식 시스템을 구축하도록 지원 중이다.
□ 그림 설명
그림1. 핑거프린트를 수집하여 신호지도를 구축한 뒤, 구축된 신호지도를 기반으로 위치를 추정하는 과정
그림2. KAILOS가 여러 가지 신호와 센서를 복합적으로 사용하였을 때 예상되는 정확도
2017.04.12 조회수 18394
한동수 교수, 크라우드소싱 기반 실내 위치인식 시스템 개발
〈 한 동 수 교수 〉
우리 대학 전산학부 한동수 교수 연구팀(지능형 서비스통합 연구실)이 실내 공간에서 획득한 와이파이 신호의 수집 위치정보를 자동으로 파악할 수 있는 기술을 개발했다.
이 기술은 글로벌 실내 위치인식 시스템 구축에 필요한 핵심 기술로 다수의 스마트폰에서 수집된 무선랜 핑거프린트의 수집 위치를 자동으로 라벨링하는 인공지능 기법이다. 비용을 절감하면서 높은 정확도를 가질 수 있고 무선랜 핑거프린트 수집이 가능한 건물이라면 어느 곳에도 적용 가능하다.
여러 글로벌 기업들이 실내 GPS를 실현하기 위해 전 세계 주요도시에서 수만 건의 실내 지도를 수집했다. 실내 지도와 함께 신호 지도 수집도 시도했지만 높은 정확도를 갖지 못했고 그 결과 실내에서의 위치 인식 서비스 질이 떨어진다.
연구팀은 문제 해결을 위해 실내를 이동 공간과 체류 공간으로 구분하고 각각의 공간에 최적화된 수집 위치 라벨링을 자동화하는 기술을 개발했다.
연구팀이 개발한 기술은 복도, 로비, 계단과 같은 이동 공간에서도 수집된 신호의 위치정보를 별도의 외부 정도 없이도 자동으로 라벨링하는 새로운 자율학습(Unsupervised Learning) 인공지능 기술이다.
이 기술을 토대로 기초실험연구동(N5)과 김병호-김삼열IT융합빌딩(N1)에서 실험을 실시했고, 충분한 양의 학습 데이터가 주어진다는 가정 하에 오차범위 3~4미터 수준의 정확도를 보였다.
이는 수작업을 통해 수집 위치를 라벨링한 결과와 비슷한 정확도로 연구팀이 함께 개발한 지자기 신호, 3축 가속기, 자이로스코프 기반의 딥러닝을 활용한 새로운 센서 퓨전 기법을 통하면 정확도가 더욱 상승하는 결과를 보였다.
그 동안 스마트폰을 통해 수집된 핑거프린트는 활용되지 못하고 버려졌지만 개발된 기술을 통해 무선랜 핑거프린트 빅데이터 영역이 새롭게 열릴 것으로 기대된다.
개발된 GPS 구축 기술은 글로벌 기업이나 국내 위치정보 서비스 기업 등이 전국 범위에서 위치정보 서비스를 제공할 때 도입해 효과적으로 사용할 수 있을 것으로 예상된다.
GPS 신호가 도달하지 않는 실내 환경에서 위치인식 정확도가 높아짐에 따라 포켓몬고 등의 O2O(online to offline) 위치기반 게임도 실내에서 실행 가능할 것으로 기대된다.
또한 다양한 위치기반 SNS, 사물인터넷 등 서비스가 활성화되고 위급한 상황에서 112나 119에 구조요청을 할 시 정확한 위치 파악이 가능할 것으로 보인다.
한 교수는 “개발된 글로벌 실내 위치인식 시스템 구축 기술을 KAIST 실내 위치인식 시스템인 카이로스(KAILOS)에 탑재해 서비스 할 예정이다”며 “전 세계 어느 건물에서든 정확도 높은 실내 위치인식 시스템을 손쉽게 구축할 수 있고 장래에 대부분 실내 공간에서도 위치인식 서비스가 제공 가능할 것이다”고 말했다.
카이로스는 2014년 KAIST에서 출시한 개방형 실내 위치인식 서비스 플랫폼이다. 자신이 원하는 건물의 실내지도를 카이로스에 등록하고 해당 건물의 핑거프린트를 수집해 실내 위치인식 시스템을 구축하도록 지원 중이다.
□ 그림 설명
그림1. 핑거프린트를 수집하여 신호지도를 구축한 뒤, 구축된 신호지도를 기반으로 위치를 추정하는 과정
그림2. KAILOS가 여러 가지 신호와 센서를 복합적으로 사용하였을 때 예상되는 정확도
2017.04.12 조회수 18394