%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B8%B0%EC%88%A0%EB%8C%80%ED%95%99
-
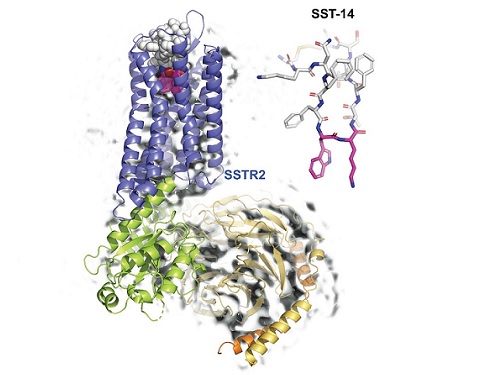 호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 9133
호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 9133 -
 체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 8995
체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 8995 -
 췌장 내 미토콘드리아 기능 장애, 췌장염에 이어 췌장암 위험성 높여
우리 대학 의과학대학원 서재명 교수 연구팀은 Salk 연구소 로날드 에반스(Ronald M. Evans) 교수, Harbor-UCLA 병원 에이지 요시하라(Eiji Yoshihara) 교수와 국제공동 연구를 통해 에너지 대사 및 생리기능 조절에 중요한 에스트로겐 관련 수용체 감마(ERRγ)의 기능부전이 췌장염 및 췌장 외분비선 질환을 유발할 수 있음을 22일 밝혔다.
췌장조직에서는 하루 동안 한 컵 정도의 소화액을 생산하고 분비한다. 그러나 소화액이 장으로 이동하기 전에 활성화되면 췌장조직 자체에 심각한 손상이 일어나며, 이로 인해 췌장염이 발생하게 된다. 대표적인 췌장염의 원인은 담석이 담췌관을 막아 소화액이 역류하거나 과도한 음주로 인해 췌장 세포의 에너지 항상성이 무너지면서 세포사멸을 유발함으로써 발병한다고 알려져 있다. 만성적인 췌장염은 극심한 고통을 수반함과 더불어 치사율 높은 췌장암의 원인이 될 수도 있어서 학계에서는 주목하고 있는 분야다.
연구팀은 “다량의 소화액을 분비하는 췌장 세포는 많은 양의 에너지를 소모하기 때문에, 에너지대사 기능이 저하되면 췌장염을 비롯한 다양한 췌장 질환에 노출될 수 있다. 건강한 췌장기능을 유지하기 위해 강력한 미토콘드리아의 에너지 생산 체계가 필요하다고 알려져 있었으나 췌장 미토콘드리아 에너지대사의 핵심 조절인자는 알려져 있지 않았다. 본 연구 결과는 ERRγ가 췌장 에너지 생성에 필수적일 뿐만 아니라 ERRγ의 기능이상이 췌장염과 췌장암 초기 발병기전에 관여한다는 점을 보여준다”고 밝혔다.
연구진은 췌장염 환자의 췌장 세포가 정상세포에 비해 ERRγ 유전자 활성이 감소하여 있음을 밝혀 임상적 연결고리를 보여주었으며, 이러한 발견은 ERRγ의 유전자 활성 조절을 통해 췌장염과 췌장암을 예방하거나 치료할 새로운 가능성을 열었다.
현재 연구팀은 미토콘드리아 조절 장애 및 췌장염이 초래하는 초기 췌장암을 예방하거나 치료하는 데 있어 ERRγ 활성 조절을 활용한 후속 연구를 이어가고 있다고 전했다.
우리 대학 의과학대학원 최진혁 박사와 Salk 연구소 오태규 박사가 공동 제1저자로 참여한 이번 연구는 4월 21일 소화기분야 최고 권위 저널인 ‘가스트로엔터롤로지 (Gastroenterology, IF 22.682)’ 온라인판에 게재됐다. (논문명: Estrogen-Related Receptor γ maintains pancreatic acinar cell function and identity by regulating cellular metabolism).
이번 연구는 과학기술정보통신부와 대구경북첨단의료산업진흥재단 원천기술개발사업, 과학기술정보통신부 글로벌연구실사업 및 한국과학기술원 국제공동연구지원사업의 지원을 받아 수행됐다.
2022.04.22 조회수 9184
췌장 내 미토콘드리아 기능 장애, 췌장염에 이어 췌장암 위험성 높여
우리 대학 의과학대학원 서재명 교수 연구팀은 Salk 연구소 로날드 에반스(Ronald M. Evans) 교수, Harbor-UCLA 병원 에이지 요시하라(Eiji Yoshihara) 교수와 국제공동 연구를 통해 에너지 대사 및 생리기능 조절에 중요한 에스트로겐 관련 수용체 감마(ERRγ)의 기능부전이 췌장염 및 췌장 외분비선 질환을 유발할 수 있음을 22일 밝혔다.
췌장조직에서는 하루 동안 한 컵 정도의 소화액을 생산하고 분비한다. 그러나 소화액이 장으로 이동하기 전에 활성화되면 췌장조직 자체에 심각한 손상이 일어나며, 이로 인해 췌장염이 발생하게 된다. 대표적인 췌장염의 원인은 담석이 담췌관을 막아 소화액이 역류하거나 과도한 음주로 인해 췌장 세포의 에너지 항상성이 무너지면서 세포사멸을 유발함으로써 발병한다고 알려져 있다. 만성적인 췌장염은 극심한 고통을 수반함과 더불어 치사율 높은 췌장암의 원인이 될 수도 있어서 학계에서는 주목하고 있는 분야다.
연구팀은 “다량의 소화액을 분비하는 췌장 세포는 많은 양의 에너지를 소모하기 때문에, 에너지대사 기능이 저하되면 췌장염을 비롯한 다양한 췌장 질환에 노출될 수 있다. 건강한 췌장기능을 유지하기 위해 강력한 미토콘드리아의 에너지 생산 체계가 필요하다고 알려져 있었으나 췌장 미토콘드리아 에너지대사의 핵심 조절인자는 알려져 있지 않았다. 본 연구 결과는 ERRγ가 췌장 에너지 생성에 필수적일 뿐만 아니라 ERRγ의 기능이상이 췌장염과 췌장암 초기 발병기전에 관여한다는 점을 보여준다”고 밝혔다.
연구진은 췌장염 환자의 췌장 세포가 정상세포에 비해 ERRγ 유전자 활성이 감소하여 있음을 밝혀 임상적 연결고리를 보여주었으며, 이러한 발견은 ERRγ의 유전자 활성 조절을 통해 췌장염과 췌장암을 예방하거나 치료할 새로운 가능성을 열었다.
현재 연구팀은 미토콘드리아 조절 장애 및 췌장염이 초래하는 초기 췌장암을 예방하거나 치료하는 데 있어 ERRγ 활성 조절을 활용한 후속 연구를 이어가고 있다고 전했다.
우리 대학 의과학대학원 최진혁 박사와 Salk 연구소 오태규 박사가 공동 제1저자로 참여한 이번 연구는 4월 21일 소화기분야 최고 권위 저널인 ‘가스트로엔터롤로지 (Gastroenterology, IF 22.682)’ 온라인판에 게재됐다. (논문명: Estrogen-Related Receptor γ maintains pancreatic acinar cell function and identity by regulating cellular metabolism).
이번 연구는 과학기술정보통신부와 대구경북첨단의료산업진흥재단 원천기술개발사업, 과학기술정보통신부 글로벌연구실사업 및 한국과학기술원 국제공동연구지원사업의 지원을 받아 수행됐다.
2022.04.22 조회수 9184 -
 합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
2022.04.17 조회수 13067
합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
2022.04.17 조회수 13067 -
 RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10592
RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10592 -
 단일세포 RNA 시퀀싱을 통한 꽃향기 합성 유전자 발굴
우리 대학 생명과학과 김상규 교수 연구팀이 꽃향기 합성 유전자를 발굴하기 위해 꽃잎 단일세포 RNA 시퀀싱 기술을 개발하고 벤질아세톤(benzylacetone) 꽃향기 합성 경로를 밝혔다.
벤질아세톤은 코요테담배(Nicotiana attenuata) 꽃에서 합성되고 밤에 분비가 되는 향기 물질이다. 이 향기물질은 밤에 활동하는 박각시나방을 유인한다. 그리고 꽃은 꿀을 제공하고 그 대가로 나방은 화분pollen을 멀리 날라준다. 또한 벤질아세톤은 코요테담배 꽃을 먹는 해충을 쫓아내는 기능을 하고 있다. 생태적으로 재미있는 기능을 하고 있는 물질이지만 생합성 경로에 대해서는 완전히 알려진 상태가 아니었다.
일반적으로 식물이 만들어내는 대사물질의 생합성 유전자를 밝히기 위해 사용하는 방법의 단점을 극복하기 위해서 꽃잎 단일세포에서 발현되는 유전자의 연관도를 이용하여 물질대사 경로를 밝힐 수 있다는 것을 이번 연구를 통해서 증명하였다. 특히 유전정보가 제한적으로 알려져 있고 다양한 생태형 ecotype을 가진 식물 집단이 없어도 비모델 식물에서 물질합성 경로에 있는 효소와 그 효소의 발현을 조절하는 전사인자 등도 찾을 수 있는 가능성을 제시하였다.
단일세포 RNA 시퀀싱의 장점을 활용하여 향기합성 유전자가 만들어지는 세포를 구별하고 꽃잎에서 향기가 합성되는 위치도 밝힐 수 있었다.
우리 대학 생명과학과 강문영 석박사통합과정 학생이 제1 저자로 참여한 이번 연구 결과는 'New Phytologist' 학술지에 게재됐다. (관련 논문명: Single-cell RNA-sequencing of Nicotiana attenuata corolla cells reveals the biosynthetic pathway of a floral scent)
한편 이번 연구는 삼성미래기술육성사업과 포스코사이언스펠로십 지원을 받아 수행됐다.
2022.02.14 조회수 8523
단일세포 RNA 시퀀싱을 통한 꽃향기 합성 유전자 발굴
우리 대학 생명과학과 김상규 교수 연구팀이 꽃향기 합성 유전자를 발굴하기 위해 꽃잎 단일세포 RNA 시퀀싱 기술을 개발하고 벤질아세톤(benzylacetone) 꽃향기 합성 경로를 밝혔다.
벤질아세톤은 코요테담배(Nicotiana attenuata) 꽃에서 합성되고 밤에 분비가 되는 향기 물질이다. 이 향기물질은 밤에 활동하는 박각시나방을 유인한다. 그리고 꽃은 꿀을 제공하고 그 대가로 나방은 화분pollen을 멀리 날라준다. 또한 벤질아세톤은 코요테담배 꽃을 먹는 해충을 쫓아내는 기능을 하고 있다. 생태적으로 재미있는 기능을 하고 있는 물질이지만 생합성 경로에 대해서는 완전히 알려진 상태가 아니었다.
일반적으로 식물이 만들어내는 대사물질의 생합성 유전자를 밝히기 위해 사용하는 방법의 단점을 극복하기 위해서 꽃잎 단일세포에서 발현되는 유전자의 연관도를 이용하여 물질대사 경로를 밝힐 수 있다는 것을 이번 연구를 통해서 증명하였다. 특히 유전정보가 제한적으로 알려져 있고 다양한 생태형 ecotype을 가진 식물 집단이 없어도 비모델 식물에서 물질합성 경로에 있는 효소와 그 효소의 발현을 조절하는 전사인자 등도 찾을 수 있는 가능성을 제시하였다.
단일세포 RNA 시퀀싱의 장점을 활용하여 향기합성 유전자가 만들어지는 세포를 구별하고 꽃잎에서 향기가 합성되는 위치도 밝힐 수 있었다.
우리 대학 생명과학과 강문영 석박사통합과정 학생이 제1 저자로 참여한 이번 연구 결과는 'New Phytologist' 학술지에 게재됐다. (관련 논문명: Single-cell RNA-sequencing of Nicotiana attenuata corolla cells reveals the biosynthetic pathway of a floral scent)
한편 이번 연구는 삼성미래기술육성사업과 포스코사이언스펠로십 지원을 받아 수행됐다.
2022.02.14 조회수 8523 -
 코로나19 바이러스의 높은 전파율은 위중증화 비율을 낮춘다는 연구 결과를 수리 모델로 입증
우리 대학 의과학대학원 신의철 교수, 수리과학과 김재경 교수 공동연구팀은 수학 모델 연구를 통해 ‘높은 바이러스 전파율은 궁극적으로 코로나19 위중증화 비율을 낮춘다’는 역설적인 연구결과를 발표했다.
2년 전부터 시작된 코로나19 팬데믹이 아직 종식되지 않은 가운데, 오미크론 변이주가 우세 종이 되면서 한국을 비롯한 세계 각국에서는 코로나19 환자 수가 급증하고 있다. 한편, 이러한 오미크론의 유행이 오히려 코로나19가 경증 호흡기 질환으로 토착화되는 것을 앞당기면서 코로나19 팬데믹의 종식을 가져올 수 있다는 조심스러운 전망들도 나오고 있다. 이와 동시에, 일부 유럽 국가들에서는 사회적 거리두기 등의 방역 대책을 완화하고 코로나19 이전의 일상생활로 돌아가는 정책을 취하기 시작하고 있다.
이렇게 코로나19 팬데믹의 미래가 아직 불분명하고 혼돈스러운 상황에서, 김재경 교수 및 홍혁표 석박사통합과정, 고려대 구로병원 감염내과 노지윤 교수, 신의철 교수 등으로 구성된 공동연구팀은 ‘바이러스 전파율이 변화하면 코로나19 토착화의 과정에서 어떤 일이 일어날까?’하는 질문에 대한 답을 구하기 위해 수학 모델을 만들어 분석했다.
이번 연구에서는 코로나19 바이러스에 대한 인체 면역반응을, 짧게 유지되는 중화항체 면역반응과 오래 유지되는 T 세포 면역반응으로 나누어 수학 모델에 적용하는 새로운 접근법을 택했다. 그리고 돌파감염이 빈번히 일어날 수 있지만, 돌파감염 후 회복하고 나면 면역반응이 다시 증강된다는 사실을 바탕으로 분석했다.
그 결과, 백신 접종률이 높은 상황에서는 바이러스 전파율이 높아지면 일시적으로는 코로나19 환자 수는 증가하지만 궁극적으로 코로나19 위중증화 비율이 낮아지면서 위중증 코로나19 환자 수는 줄어들고 결과적으로 코로나19가 경증 호흡기 질환으로 토착화되는 과정이 오히려 빨라질 수 있다는 역설적인 연구 결과를 얻었다.
연구팀이 가정한 바이러스 전파율이 높아지는 상황은, 실제에서는 사회적 거리두기 완화나 오미크론 등 전파가 잘 되는 변이주의 출현으로 일어날 수 있다. 이번 연구 결과는 오미크론 자체의 낮은 위중증 성질은 배제하고, 높은 전파율이 일으키는 결과를 예측한 것으로서 코로나19 토착화 과정에서 일어날 수 있는 일들을 잘 설명해 주고 있다.
연구팀은 연령이나 기저질환 유무에 따라 다르게 나타나는 위중증률을 수학 모델에서 고려하지 않은 제한점을 이야기하며, 특히 고위험군 집단을 대상으로 이번 연구 결과를 적용할 때는 주의가 필요하다고 설명했다. 또한 바이러스 전파율이 높아지는 상황에서 일시적으로 증가하는 코로나19 환자 수가 너무 많아지면 의료체계가 붕괴될 수도 있으므로, 이러한 점을 고려해 연구 결과를 신중하게 해석, 적용할 필요가 있다고 연구팀은 설명하였다. 따라서 향후 단계적 일상회복 정책으로 다시 전환할 때는 그 무엇보다도 위중증 환자를 수용할 병상 확보 등 의료체계의 정비가 중요하다는 점을 강조했다.
김재경 교수와 홍혁표 대학원생은 ‘코로나19 팬데믹과 같이 미래가 불투명한 상황에서 수학 모델을 잘 활용함으로써 인간의 직관으로는 유추하기 어려운 역설적인 연구결과를 얻었다’며 앞으로도 의학 연구에서 수학 모델을 적극적으로 이용하는 것이 중요하다는 점을 역설했다.
노지윤 교수와 신의철 교수는 ‘오미크론이 우세 종이 되고 코로나19 환자 수가 급증하는 현 상황에서 무조건 두려워만 할 것이 아니라 과학적 접근을 통해 미래를 예측하고 이를 정책에 반영하는 것이 매우 중요하다’고 강조했다.
이번 연구 결과는 2월 11일 字로 메드아카이브(medRxiv)에 공개됐다(논문 제목: Increasing viral transmission paradoxically reduces progression rates to severe COVID-19 during endemic transition).
한편, 이번 연구는 기초과학연구원, 한국보건산업진흥원, 한국연구재단의 지원을 받아 수행됐다.
2022.02.14 조회수 10193
코로나19 바이러스의 높은 전파율은 위중증화 비율을 낮춘다는 연구 결과를 수리 모델로 입증
우리 대학 의과학대학원 신의철 교수, 수리과학과 김재경 교수 공동연구팀은 수학 모델 연구를 통해 ‘높은 바이러스 전파율은 궁극적으로 코로나19 위중증화 비율을 낮춘다’는 역설적인 연구결과를 발표했다.
2년 전부터 시작된 코로나19 팬데믹이 아직 종식되지 않은 가운데, 오미크론 변이주가 우세 종이 되면서 한국을 비롯한 세계 각국에서는 코로나19 환자 수가 급증하고 있다. 한편, 이러한 오미크론의 유행이 오히려 코로나19가 경증 호흡기 질환으로 토착화되는 것을 앞당기면서 코로나19 팬데믹의 종식을 가져올 수 있다는 조심스러운 전망들도 나오고 있다. 이와 동시에, 일부 유럽 국가들에서는 사회적 거리두기 등의 방역 대책을 완화하고 코로나19 이전의 일상생활로 돌아가는 정책을 취하기 시작하고 있다.
이렇게 코로나19 팬데믹의 미래가 아직 불분명하고 혼돈스러운 상황에서, 김재경 교수 및 홍혁표 석박사통합과정, 고려대 구로병원 감염내과 노지윤 교수, 신의철 교수 등으로 구성된 공동연구팀은 ‘바이러스 전파율이 변화하면 코로나19 토착화의 과정에서 어떤 일이 일어날까?’하는 질문에 대한 답을 구하기 위해 수학 모델을 만들어 분석했다.
이번 연구에서는 코로나19 바이러스에 대한 인체 면역반응을, 짧게 유지되는 중화항체 면역반응과 오래 유지되는 T 세포 면역반응으로 나누어 수학 모델에 적용하는 새로운 접근법을 택했다. 그리고 돌파감염이 빈번히 일어날 수 있지만, 돌파감염 후 회복하고 나면 면역반응이 다시 증강된다는 사실을 바탕으로 분석했다.
그 결과, 백신 접종률이 높은 상황에서는 바이러스 전파율이 높아지면 일시적으로는 코로나19 환자 수는 증가하지만 궁극적으로 코로나19 위중증화 비율이 낮아지면서 위중증 코로나19 환자 수는 줄어들고 결과적으로 코로나19가 경증 호흡기 질환으로 토착화되는 과정이 오히려 빨라질 수 있다는 역설적인 연구 결과를 얻었다.
연구팀이 가정한 바이러스 전파율이 높아지는 상황은, 실제에서는 사회적 거리두기 완화나 오미크론 등 전파가 잘 되는 변이주의 출현으로 일어날 수 있다. 이번 연구 결과는 오미크론 자체의 낮은 위중증 성질은 배제하고, 높은 전파율이 일으키는 결과를 예측한 것으로서 코로나19 토착화 과정에서 일어날 수 있는 일들을 잘 설명해 주고 있다.
연구팀은 연령이나 기저질환 유무에 따라 다르게 나타나는 위중증률을 수학 모델에서 고려하지 않은 제한점을 이야기하며, 특히 고위험군 집단을 대상으로 이번 연구 결과를 적용할 때는 주의가 필요하다고 설명했다. 또한 바이러스 전파율이 높아지는 상황에서 일시적으로 증가하는 코로나19 환자 수가 너무 많아지면 의료체계가 붕괴될 수도 있으므로, 이러한 점을 고려해 연구 결과를 신중하게 해석, 적용할 필요가 있다고 연구팀은 설명하였다. 따라서 향후 단계적 일상회복 정책으로 다시 전환할 때는 그 무엇보다도 위중증 환자를 수용할 병상 확보 등 의료체계의 정비가 중요하다는 점을 강조했다.
김재경 교수와 홍혁표 대학원생은 ‘코로나19 팬데믹과 같이 미래가 불투명한 상황에서 수학 모델을 잘 활용함으로써 인간의 직관으로는 유추하기 어려운 역설적인 연구결과를 얻었다’며 앞으로도 의학 연구에서 수학 모델을 적극적으로 이용하는 것이 중요하다는 점을 역설했다.
노지윤 교수와 신의철 교수는 ‘오미크론이 우세 종이 되고 코로나19 환자 수가 급증하는 현 상황에서 무조건 두려워만 할 것이 아니라 과학적 접근을 통해 미래를 예측하고 이를 정책에 반영하는 것이 매우 중요하다’고 강조했다.
이번 연구 결과는 2월 11일 字로 메드아카이브(medRxiv)에 공개됐다(논문 제목: Increasing viral transmission paradoxically reduces progression rates to severe COVID-19 during endemic transition).
한편, 이번 연구는 기초과학연구원, 한국보건산업진흥원, 한국연구재단의 지원을 받아 수행됐다.
2022.02.14 조회수 10193 -
 계산적 항체 디자인을 통한 범용성 코로나바이러스 중화항체 개발
우리 대학 생명과학과 오병하 교수 연구팀이 계산적 항체 디자인을 개발하고 이를 적용해 오미크론을 포함해 현재 유행 중인 모든 코로나19 변종 바이러스에 뛰어난 효과를 나타내는 중화항체*를 개발했다고 밝혔다.
*병원체가 신체에 침투했을 때 생화학적으로 미치는 영향을 중화하여 세포를 방어하는 치료용 항체.
코로나19 감염을 유발하는 바이러스로 알려진 SARS-CoV-2 바이러스*는 스파이크 당단백질 부위에 있는 수용체 결합 부위(이하 항원)를 인간 세포막에 붙어있는 hACE2(human Angiotensin Converting Enzyme2) 수용체에 결합시켜 세포 내로 침입하는 기전을 보인다. 이러한 기전에 착안해 세계 유수의 제약회사들의 연구진은 수용체 결합 부위에 붙는 중화항체 에테세비맙(Etesevimab), 밤라니비맙(Bamlanivimab) 등을 개발했다.
*현재 중증급성호흡기 증후군 팬데믹을 일으키고 있는 코로나바이러스. RNA 바이러스이며 바이러스 표면 스파이크 단백질을 통해 인간 ACE2 단백질과 결합하여 세포 내로 침투.
하지만, 이 항체들은 최초에 유행한 코로나바이러스에 효과적인 것과 다르게 알파, 베타, 델타 등과 같은 변이에는 중화능이 없거나 떨어지는 것으로 보고됐다. 변이 바이러스의 등장으로 기존 항체들의 중화능이 떨어지는 이유는 바이러스의 항체 인식부위 서열에 변이가 생겨 항체가 더 이상 제대로 결합하지 못하게 되기 때문이다.
연구진은 계산적 단백질 디자인 방법으로 바이러스 항원에서 변이가 생기지 않는 부분에 강력하게 결합하는 항체를 개발했다. 결과적으로, 이번에 개발한 항체는 오미크론을 포함해 알려진 SARS-CoV-2의 모든 변이 바이러스뿐만 아니라 SARS-CoV-1, 천산갑 코로나 바이러스에도 강력한 결합력*을 보이며 우수한 중화 능력 지표**도 확인했다.
* picomolar(리터당 10-12 mole)에서 femtomolar (리터당 10-15 mole)의 결합력을 보임.
** Neutralization constant 50 (NC50) 가 0.10-8.3 nM로써 높은 중화능을 보임.
연구진이 개발한 항체는 미래에 출현할지 모르는 새로운 중증호흡기증후군 유발 코로나바이러스에도 대응할 수 있는 범용 코로나 치료항체 후보로 기대된다. 또한, 이번에 개발된 계산적 항체 디자인 기술은 항원의 특정 부위에 결합하는 항체를 발굴하는 새로운 방법으로서 그 응용성이 넓고 기술적 가치가 높다.
오병하 교수는 "이번에 개발한 항체는 아미노산 서열이 거의 바뀌지 않는 표면에 결합하기 때문에 향후 출현할 수 있는 신·변종 코로나바이러스에 즉각 대응할 수 있는 치료 물질이 될 수 있다는데 큰 의의가 있다ˮ라고 밝혔으며, 아울러, "이번 연구를 통해 개발한 계산적 항체 디자인 방법은 실험적으로는 얻기 어려운 항체를 개발하는데 널리 이용될 것으로 기대한다ˮ라고 밝혔다.
우리 대학 생명과학과 정보성 박사과정이 제1 저자로 참여한 이번 연구 결과는 항체 전문 학술지 ‘mAbs’에 게재됐다. 이번 연구는 연세대학교 조현수 교수 연구팀과 한국화학연구소 김균도 박사 연구팀도 참여했다. (관련 논문명: Computational design of a neutralizing antibody with picomolar binding affinity for all concerning SARS-CoV-2 variants)
참고로, 상기 논문 발표 후 오미크론이 새롭게 출현하였으며, 연구진은 개발한 중화항체가 이 변종에도 효과가 있음을 실험적으로 입증하였다.
한편 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업단과 한국과학재단 기초과학연구실 사업의 지원을 받아 수행됐다.
2022.02.04 조회수 9469
계산적 항체 디자인을 통한 범용성 코로나바이러스 중화항체 개발
우리 대학 생명과학과 오병하 교수 연구팀이 계산적 항체 디자인을 개발하고 이를 적용해 오미크론을 포함해 현재 유행 중인 모든 코로나19 변종 바이러스에 뛰어난 효과를 나타내는 중화항체*를 개발했다고 밝혔다.
*병원체가 신체에 침투했을 때 생화학적으로 미치는 영향을 중화하여 세포를 방어하는 치료용 항체.
코로나19 감염을 유발하는 바이러스로 알려진 SARS-CoV-2 바이러스*는 스파이크 당단백질 부위에 있는 수용체 결합 부위(이하 항원)를 인간 세포막에 붙어있는 hACE2(human Angiotensin Converting Enzyme2) 수용체에 결합시켜 세포 내로 침입하는 기전을 보인다. 이러한 기전에 착안해 세계 유수의 제약회사들의 연구진은 수용체 결합 부위에 붙는 중화항체 에테세비맙(Etesevimab), 밤라니비맙(Bamlanivimab) 등을 개발했다.
*현재 중증급성호흡기 증후군 팬데믹을 일으키고 있는 코로나바이러스. RNA 바이러스이며 바이러스 표면 스파이크 단백질을 통해 인간 ACE2 단백질과 결합하여 세포 내로 침투.
하지만, 이 항체들은 최초에 유행한 코로나바이러스에 효과적인 것과 다르게 알파, 베타, 델타 등과 같은 변이에는 중화능이 없거나 떨어지는 것으로 보고됐다. 변이 바이러스의 등장으로 기존 항체들의 중화능이 떨어지는 이유는 바이러스의 항체 인식부위 서열에 변이가 생겨 항체가 더 이상 제대로 결합하지 못하게 되기 때문이다.
연구진은 계산적 단백질 디자인 방법으로 바이러스 항원에서 변이가 생기지 않는 부분에 강력하게 결합하는 항체를 개발했다. 결과적으로, 이번에 개발한 항체는 오미크론을 포함해 알려진 SARS-CoV-2의 모든 변이 바이러스뿐만 아니라 SARS-CoV-1, 천산갑 코로나 바이러스에도 강력한 결합력*을 보이며 우수한 중화 능력 지표**도 확인했다.
* picomolar(리터당 10-12 mole)에서 femtomolar (리터당 10-15 mole)의 결합력을 보임.
** Neutralization constant 50 (NC50) 가 0.10-8.3 nM로써 높은 중화능을 보임.
연구진이 개발한 항체는 미래에 출현할지 모르는 새로운 중증호흡기증후군 유발 코로나바이러스에도 대응할 수 있는 범용 코로나 치료항체 후보로 기대된다. 또한, 이번에 개발된 계산적 항체 디자인 기술은 항원의 특정 부위에 결합하는 항체를 발굴하는 새로운 방법으로서 그 응용성이 넓고 기술적 가치가 높다.
오병하 교수는 "이번에 개발한 항체는 아미노산 서열이 거의 바뀌지 않는 표면에 결합하기 때문에 향후 출현할 수 있는 신·변종 코로나바이러스에 즉각 대응할 수 있는 치료 물질이 될 수 있다는데 큰 의의가 있다ˮ라고 밝혔으며, 아울러, "이번 연구를 통해 개발한 계산적 항체 디자인 방법은 실험적으로는 얻기 어려운 항체를 개발하는데 널리 이용될 것으로 기대한다ˮ라고 밝혔다.
우리 대학 생명과학과 정보성 박사과정이 제1 저자로 참여한 이번 연구 결과는 항체 전문 학술지 ‘mAbs’에 게재됐다. 이번 연구는 연세대학교 조현수 교수 연구팀과 한국화학연구소 김균도 박사 연구팀도 참여했다. (관련 논문명: Computational design of a neutralizing antibody with picomolar binding affinity for all concerning SARS-CoV-2 variants)
참고로, 상기 논문 발표 후 오미크론이 새롭게 출현하였으며, 연구진은 개발한 중화항체가 이 변종에도 효과가 있음을 실험적으로 입증하였다.
한편 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업단과 한국과학재단 기초과학연구실 사업의 지원을 받아 수행됐다.
2022.02.04 조회수 9469 -
 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12192
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12192 -
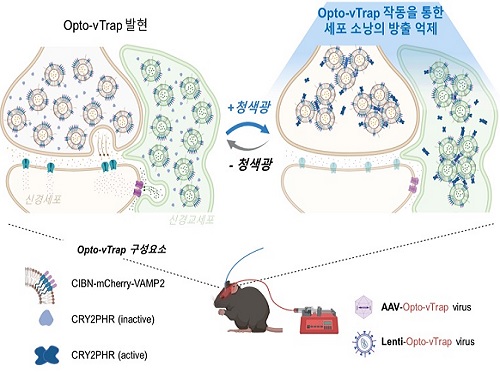 빛으로 뇌 기능, 행동, 감정을 자유롭게 조절한다
우리 대학 생명과학과 허원도 교수 연구팀은 빛으로 뇌 기능 및 행동을 자유자재로 조절하는 광유전학 기술인 ‘Opto-vTrap(옵토-브이트랩)’을 개발했다. 나아가 동물실험을 통해 뇌 활성 뿐 아니라 활동과 감정까지 조절할 수 있음을 확인했다.
뇌 활성은 신경세포와 신경교세포와 같은 뇌세포들이 서로 신호를 주고받으며 조절된다. 이 같은 상호작용은 뇌 세포 내 ‘소낭’안에 담긴 신경전달물질 분비를 통해 이루어진다. 소낭이 뇌 활성을 조절하는 사령관인 셈이다. 뇌 활성 조절은 뇌 연구를 위한 필수 기술이다. 뇌의 특정 부위나 세포의 활성을 촉진 및 억제해보면 특정 뇌 부위가 담당하는 기능, 여러 뇌 부위 간 상호작용의 역할, 특정 상황에서 다양한 뇌세포의 기능 등 특정 상황에서 뇌 작동이 어떠한 원리로 일어나는지 밝힐 수 있기 때문이다.
그러나 기존 뇌 활성 조절 기술은 원하는 시점에 특정 뇌세포의 활성을 자유롭게 조절하기 어려웠다. 지금까지는 세포 전위차 조절 방식을 사용하였는데, 이는 주변 환경의 산성도를 변화시키거나 원하지 않는 다른 자극을 유발할 뿐만 아니라 전위차에 반응하지 않는 세포에는 사용하지 못하는 한계가 있었다. 이번에 개발한 Opto-vTrap 기술은 세포 소낭을 직접 특이적으로 조절할 수 있어 원하는 시점에 다양한 종류의 뇌세포에서 이용이 가능하다.
연구진은 신경전달물질 분비를 직접 조절하고자 세포에 빛을 쪼이면 순간적으로 내부에 올가미처럼 트랩을 만드는 자체 개발 원천기술을 응용, 소낭에 적용했다. Opto-vTrap을 발현하는 세포나 조직에 빛(청색광)을 가하면 소낭 내 광수용체 단백질들이 엉겨 붙으며 소낭이 트랩 안에 포획되고 신경전달물질 분비가 억제된다. 요컨대 Opto-vTrap으로 소낭의 신호전달물질 분비를 직접 제어하여 뇌 활성을 자유롭게 조절하는 것이다. 연구진은 세포와 조직실험에서 나아가 Opto-vTrap 바이러스를 이용한 동물실험을 통해 뇌세포 신호전달 뿐만 아니라 기억·감정·행동도 조절 가능함을 확인하였다.
Opto-vTrap을 이용하면 뇌의 여러 부위간 복합적 상호작용 원리를 밝히고, 뇌세포 형태별 뇌 기능에 미치는 영향을 연구하는 데 유용하게 활용될 것으로 기대된다.
허원도 교수는 “Opto-vTrap은 신경세포와 신경교세포 모두에 잘 작동되기에 향후 다양한 뇌과학 연구 분야에 이용되리라 기대한다” 며 “앞으로 본 기술을 활용하여 특정 뇌세포의 시공간적 기능 연구를 진행하고자 한다.”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견연구과제 및 KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
이번 연구 결과는 뇌 과학 학술지 뉴런 (Neuron, IF:17.173) 에 12월 1일(수) 1시(한국시간) 게재됐다.
2021.12.03 조회수 10113
빛으로 뇌 기능, 행동, 감정을 자유롭게 조절한다
우리 대학 생명과학과 허원도 교수 연구팀은 빛으로 뇌 기능 및 행동을 자유자재로 조절하는 광유전학 기술인 ‘Opto-vTrap(옵토-브이트랩)’을 개발했다. 나아가 동물실험을 통해 뇌 활성 뿐 아니라 활동과 감정까지 조절할 수 있음을 확인했다.
뇌 활성은 신경세포와 신경교세포와 같은 뇌세포들이 서로 신호를 주고받으며 조절된다. 이 같은 상호작용은 뇌 세포 내 ‘소낭’안에 담긴 신경전달물질 분비를 통해 이루어진다. 소낭이 뇌 활성을 조절하는 사령관인 셈이다. 뇌 활성 조절은 뇌 연구를 위한 필수 기술이다. 뇌의 특정 부위나 세포의 활성을 촉진 및 억제해보면 특정 뇌 부위가 담당하는 기능, 여러 뇌 부위 간 상호작용의 역할, 특정 상황에서 다양한 뇌세포의 기능 등 특정 상황에서 뇌 작동이 어떠한 원리로 일어나는지 밝힐 수 있기 때문이다.
그러나 기존 뇌 활성 조절 기술은 원하는 시점에 특정 뇌세포의 활성을 자유롭게 조절하기 어려웠다. 지금까지는 세포 전위차 조절 방식을 사용하였는데, 이는 주변 환경의 산성도를 변화시키거나 원하지 않는 다른 자극을 유발할 뿐만 아니라 전위차에 반응하지 않는 세포에는 사용하지 못하는 한계가 있었다. 이번에 개발한 Opto-vTrap 기술은 세포 소낭을 직접 특이적으로 조절할 수 있어 원하는 시점에 다양한 종류의 뇌세포에서 이용이 가능하다.
연구진은 신경전달물질 분비를 직접 조절하고자 세포에 빛을 쪼이면 순간적으로 내부에 올가미처럼 트랩을 만드는 자체 개발 원천기술을 응용, 소낭에 적용했다. Opto-vTrap을 발현하는 세포나 조직에 빛(청색광)을 가하면 소낭 내 광수용체 단백질들이 엉겨 붙으며 소낭이 트랩 안에 포획되고 신경전달물질 분비가 억제된다. 요컨대 Opto-vTrap으로 소낭의 신호전달물질 분비를 직접 제어하여 뇌 활성을 자유롭게 조절하는 것이다. 연구진은 세포와 조직실험에서 나아가 Opto-vTrap 바이러스를 이용한 동물실험을 통해 뇌세포 신호전달 뿐만 아니라 기억·감정·행동도 조절 가능함을 확인하였다.
Opto-vTrap을 이용하면 뇌의 여러 부위간 복합적 상호작용 원리를 밝히고, 뇌세포 형태별 뇌 기능에 미치는 영향을 연구하는 데 유용하게 활용될 것으로 기대된다.
허원도 교수는 “Opto-vTrap은 신경세포와 신경교세포 모두에 잘 작동되기에 향후 다양한 뇌과학 연구 분야에 이용되리라 기대한다” 며 “앞으로 본 기술을 활용하여 특정 뇌세포의 시공간적 기능 연구를 진행하고자 한다.”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견연구과제 및 KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
이번 연구 결과는 뇌 과학 학술지 뉴런 (Neuron, IF:17.173) 에 12월 1일(수) 1시(한국시간) 게재됐다.
2021.12.03 조회수 10113 -
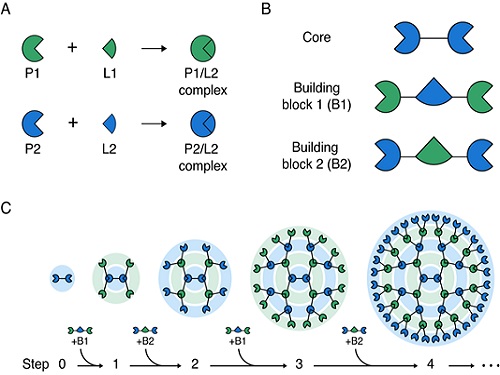 거대 단백질 구조체를 레고 블록 쌓듯 조립하는 기술 개발
우리 대학 생명과학과 김학성 교수와 배진호 박사팀이 거대 (초분자) 단백질을 레고 블록 쌓듯 조립할 수 있는 새로운 기술을 개발했다고 19일 밝혔다. 이 방법으로 단백질 구조체의 크기 및 작용기 수를 원하는 대로 조절할 수 있고 메가 달톤(dalton) 크기의 대칭형 거대 단백질 구조체를 조립할 수 있다. 거대 단백질 구조체는 효율적인 약물 전달, 다양한 백신 개발, 그리고 질병 진단에 활용될 것으로 기대된다.
이번 연구 성과는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science)' (IF: 16.806)에 2021년 11월 1일 字 온라인 발표됐다. (논문명: Dendrimer-like supramolecular assembly of proteins with a tunable size and valency through stepwise iterative growth)
자연계에는 매우 다양한 특성과 기능을 갖는 단백질이 존재하며 생명현상을 유지하는데 핵심 역할을 한다. 이러한 단백질 중에는 단량체가 큰 구조체 형태로 조립됐을 때만 정상적 기능을 수행하거나, 어떤 경우에는 조립된 경우가 단량체와 완전히 다른 특성을 나타내며, 심지어는 심각한 질병을 유발하는 경우도 많다.
예를 들어 바이러스의 껍질인 켑시드는 단백질 단량체가 조립(assembly)된 것이고, 치매는 아밀로이드 펩타이드나 타우(tau) 단백질이 파이브릴(fibril) 형태로 조립되면서 발생한다. 따라서, 거대(초분자) 단백질 구조체들의 조립 기작 이해는 단백질의 기능과 질병의 원인 규명 및 치료제 개발에 중요하다. 또한, 단백질 구조체는 뛰어난 생체 적합도 때문에 생명공학 및 의학 분야에서도 응용 가능성이 크다.
현재 많은 연구 그룹에서 자연계에 존재하는 단백질 구조체들의 조립 과정을 모방해 새로운 기능의 단백질 구조체 개발에 많은 연구를 진행하고 있다. 그러나 단백질의 구조적 다양성, 상이한 특성 및 큰 분자량 때문에 원하는 구조체를 자유자재로 조립하는 것은 아직도 어려운 과제로 남아 있다.
김학성 교수 연구팀은 두 종류의 빌딩(building) 블록 단백질을 코어(core) 단백질에 순차적으로 교대로 결합시킴으로써 간편하게 3차원 구조의 대칭형 거대 단백질 구조체를 조립하는 방법을 개발했다(그림 1). 즉, 서로 특이적으로 반응하는 두 쌍의 단백질과 리건드(P1/L1 과 P2/L2)를 이용해 코어(core) 단백질에 두 종류의 빌딩(building) 블록을 순차적, 반복적으로 결합함으로써 크기와 작용 기작 수를 조절하면서 메가 달톤 (Mega Dalton) 크기를 갖는 단백질 구조체를 쉽게 조립하였다.
개발된 구조체는 다양한 분야에 응용 가능하며 하나의 예로서, 이번 연구에서는 단백질 구조체에 박테리아 독소를 결합해 암세포 내로 고효율로 전달할 수 있었고, 결과적으로 암세포를 효과적으로 사멸했다(그림 2). 구조체 단백질의 특징인 다가 효과(avidity effect)로 인해 암 표적에 대한 결합력이 약 1,000배 이상 증가돼 암세포 사멸 효과가 획기적으로 증대됐고 이러한 특성은 백신 개발 및 질병 진단에도 응용될 수 있다.
제1 저자인 배진호 박사는 "이번 연구에서 개발된 거대(초분자) 단백질 구조체 조립 기술은 향후, 약물 전달, 백신 개발, 질병 진단 및 바이오센서 등을 포함한 광범위한 분야에서 새로운 플랫폼 기술로 활용될 수 있을 것ˮ이라고 말했다.
이번 연구는 한국 연구 재단의 중견 연구과제 (NRF-2021R1A2C201421811) 지원을 받아 수행됐다.
2021.11.19 조회수 10366
거대 단백질 구조체를 레고 블록 쌓듯 조립하는 기술 개발
우리 대학 생명과학과 김학성 교수와 배진호 박사팀이 거대 (초분자) 단백질을 레고 블록 쌓듯 조립할 수 있는 새로운 기술을 개발했다고 19일 밝혔다. 이 방법으로 단백질 구조체의 크기 및 작용기 수를 원하는 대로 조절할 수 있고 메가 달톤(dalton) 크기의 대칭형 거대 단백질 구조체를 조립할 수 있다. 거대 단백질 구조체는 효율적인 약물 전달, 다양한 백신 개발, 그리고 질병 진단에 활용될 것으로 기대된다.
이번 연구 성과는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science)' (IF: 16.806)에 2021년 11월 1일 字 온라인 발표됐다. (논문명: Dendrimer-like supramolecular assembly of proteins with a tunable size and valency through stepwise iterative growth)
자연계에는 매우 다양한 특성과 기능을 갖는 단백질이 존재하며 생명현상을 유지하는데 핵심 역할을 한다. 이러한 단백질 중에는 단량체가 큰 구조체 형태로 조립됐을 때만 정상적 기능을 수행하거나, 어떤 경우에는 조립된 경우가 단량체와 완전히 다른 특성을 나타내며, 심지어는 심각한 질병을 유발하는 경우도 많다.
예를 들어 바이러스의 껍질인 켑시드는 단백질 단량체가 조립(assembly)된 것이고, 치매는 아밀로이드 펩타이드나 타우(tau) 단백질이 파이브릴(fibril) 형태로 조립되면서 발생한다. 따라서, 거대(초분자) 단백질 구조체들의 조립 기작 이해는 단백질의 기능과 질병의 원인 규명 및 치료제 개발에 중요하다. 또한, 단백질 구조체는 뛰어난 생체 적합도 때문에 생명공학 및 의학 분야에서도 응용 가능성이 크다.
현재 많은 연구 그룹에서 자연계에 존재하는 단백질 구조체들의 조립 과정을 모방해 새로운 기능의 단백질 구조체 개발에 많은 연구를 진행하고 있다. 그러나 단백질의 구조적 다양성, 상이한 특성 및 큰 분자량 때문에 원하는 구조체를 자유자재로 조립하는 것은 아직도 어려운 과제로 남아 있다.
김학성 교수 연구팀은 두 종류의 빌딩(building) 블록 단백질을 코어(core) 단백질에 순차적으로 교대로 결합시킴으로써 간편하게 3차원 구조의 대칭형 거대 단백질 구조체를 조립하는 방법을 개발했다(그림 1). 즉, 서로 특이적으로 반응하는 두 쌍의 단백질과 리건드(P1/L1 과 P2/L2)를 이용해 코어(core) 단백질에 두 종류의 빌딩(building) 블록을 순차적, 반복적으로 결합함으로써 크기와 작용 기작 수를 조절하면서 메가 달톤 (Mega Dalton) 크기를 갖는 단백질 구조체를 쉽게 조립하였다.
개발된 구조체는 다양한 분야에 응용 가능하며 하나의 예로서, 이번 연구에서는 단백질 구조체에 박테리아 독소를 결합해 암세포 내로 고효율로 전달할 수 있었고, 결과적으로 암세포를 효과적으로 사멸했다(그림 2). 구조체 단백질의 특징인 다가 효과(avidity effect)로 인해 암 표적에 대한 결합력이 약 1,000배 이상 증가돼 암세포 사멸 효과가 획기적으로 증대됐고 이러한 특성은 백신 개발 및 질병 진단에도 응용될 수 있다.
제1 저자인 배진호 박사는 "이번 연구에서 개발된 거대(초분자) 단백질 구조체 조립 기술은 향후, 약물 전달, 백신 개발, 질병 진단 및 바이오센서 등을 포함한 광범위한 분야에서 새로운 플랫폼 기술로 활용될 수 있을 것ˮ이라고 말했다.
이번 연구는 한국 연구 재단의 중견 연구과제 (NRF-2021R1A2C201421811) 지원을 받아 수행됐다.
2021.11.19 조회수 10366 -
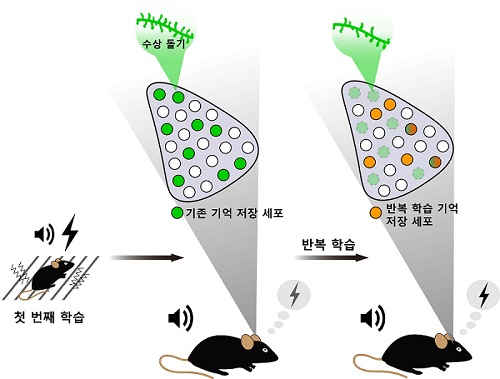 뉴런 교체에 의한 기억 저장 규명
우리 대학 생명과학과 한진희 교수 연구팀이 살아있는 생쥐 뇌에서 기억저장 뉴런(신경 세포)을 표지하고 추적, 관찰할 수 있는 기술을 이용해 같은 경험을 다시 할 때 원래 존재하던 오래된 기억 뉴런이 새로운 뉴런으로 교체됨을 규명했다고 3일 밝혔다.
연구팀은 `뉴런 스위칭'을 가능하게 하는 기작으로 기초과학연구원(IBS) 김은준 교수 연구팀과의 공동연구를 통해 이전에 경험했던 학습을 다시 하면 기존 기억 뉴런에서 시냅스 연결이 감소하는 반면, 새로 참여하는 뉴런에서는 시냅스 연결이 증가함을 규명했다.
이번 연구는 같은 기억은 같은 뉴런에 계속 저장됨으로써 경험이 누적될 수 있을 것이라는 기존의 통념과 달리, 같은 경험을 다시 할 때 뇌에서 오히려 뉴런들이 다이내믹하게 새로 교체됨을 처음으로 증명했다는 점에서 기존의 패러다임을 전환하는 중요한 학문적 의미가 있다.
뉴런 교체는 기억 업데이트의 중요한 기작으로 생각되며 노화, 퇴행성 뇌질환에서 기억상실을 해결할 수 있는 기술 개발에 대한 새로운 아이디어를 제시한다.
생명과학과 조혜연 박사가 제1 저자로 참여한 이번 연구는 셀 프레스(Cell Press) 그룹의 오픈 액세스(Open-access) 학술지 `커런트 바이올로지(Current Biology)'에 10월 22일 字 온라인판에 게재됐다. (논문명: Turnover of fear engram cells by repeated experience)
경험은 기억이라는 형태로 뇌에 저장되고 나중에 회상된다. 또 대부분의 기억은 반복적인 경험을 통해 뇌에서 유지되고 업데이트된다. 뇌에서 기억을 표상하는 물리적 단위가 존재하며 특정 신경 세포 집단(기억 엔그램) 이 기억을 인코딩한다는 사실이 많은 연구를 통해 밝혀졌다.
그렇다면 반복된 경험에 노출되었을 경우 기억을 저장하는 뉴런들에서 어떤 변화가 일어날까? 기존 연구를 통해 같은 학습의 반복으로 형성된 기억은 같은 신경 세포 집단을 통해 계속 저장되고 강화될 것으로 추측돼왔다. 하지만 실제로 신경 세포 수준에서 어떤 변화가 일어나는지 명확히 밝혀진 바가 없었다.
연구팀은 이번 연구에서 생쥐 뇌 편도체(amygdala) 영역에서 기억저장 세포를 표지하고 광유전학 기법으로 조절하는 기술을 이용해 기존의 통념과 달리 첫 학습 하루 후에 같은 학습을 반복했을 때 `같은' 기억이 전혀 다른 세포들을 통해 다시 저장되고 회상되는 현상을 발견했다. 반복 학습된 기억이 첫 번째 학습으로 형성된 기억 엔그램을 억제하는 동안에도 정상적으로 발현되는 것을 확인한 것이다.
반복 학습 후에 기존 엔그램에서 *시냅스 가소성이 감소한 것으로 보아, 경험이 반복되면 기존의 기억 엔그램이 기억 회로상에서 연결이 약해지기 때문에 기억 발현에 관여하지 않는다는 것을 알 수 있었다.
☞ 시냅스 가소성(Synaptic plasticity): 시냅스는 신경 세포 간의 정보가 전달되는 구조적인 장소를 말하는데, 시냅스는 그 활성 정도에 따라 구조와 기능이 지속적으로 변화 가능하며 이를 시냅스 가소성이라 부른다.
이처럼 기존 기억 엔그램이 반복 학습된 공포 기억에 필요하지는 않았지만 흥미롭게도 기존 기억 엔그램을 광유전학 기법으로 자극했을 땐 공포 반응이 나타났다. 기존 기억 엔그램의 연결이 약해졌음에도 불구하고 여전히 기억 정보를 간직한 채 `휴면 엔그램 (silent engram)'으로 존재한다는 것을 확인한 결과였다.
또한 연구팀은 반복 학습된 공포 기억이 두 번째 학습 때 활성화된 편도체 뉴런들에 새로 저장된다는 것을 보임으로써 같은 경험의 기억이 처음과 다른 세포 집단에 인코딩된다는 사실을 추가로 입증했다.
한진희 교수는 "이번 연구 결과는 기억은 고정돼 있는 것처럼 보이지만 뇌에서 그 기억을 저장하는 세포들은 다이내믹하게 스위칭 된다는 새로운 패러다임을 제시하는 중요한 발견이다ˮ며, "앞으로 기억 뉴런을 표적으로 해서 원하지 않는 기억 삭제 및 퇴행성 뇌질환에서 기억상실 억제, 복원을 가능하게 하는 미래 기억제어 기술 개발에 도움을 줄 것ˮ이라고 말했다.
한편, 이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
2021.11.03 조회수 9125
뉴런 교체에 의한 기억 저장 규명
우리 대학 생명과학과 한진희 교수 연구팀이 살아있는 생쥐 뇌에서 기억저장 뉴런(신경 세포)을 표지하고 추적, 관찰할 수 있는 기술을 이용해 같은 경험을 다시 할 때 원래 존재하던 오래된 기억 뉴런이 새로운 뉴런으로 교체됨을 규명했다고 3일 밝혔다.
연구팀은 `뉴런 스위칭'을 가능하게 하는 기작으로 기초과학연구원(IBS) 김은준 교수 연구팀과의 공동연구를 통해 이전에 경험했던 학습을 다시 하면 기존 기억 뉴런에서 시냅스 연결이 감소하는 반면, 새로 참여하는 뉴런에서는 시냅스 연결이 증가함을 규명했다.
이번 연구는 같은 기억은 같은 뉴런에 계속 저장됨으로써 경험이 누적될 수 있을 것이라는 기존의 통념과 달리, 같은 경험을 다시 할 때 뇌에서 오히려 뉴런들이 다이내믹하게 새로 교체됨을 처음으로 증명했다는 점에서 기존의 패러다임을 전환하는 중요한 학문적 의미가 있다.
뉴런 교체는 기억 업데이트의 중요한 기작으로 생각되며 노화, 퇴행성 뇌질환에서 기억상실을 해결할 수 있는 기술 개발에 대한 새로운 아이디어를 제시한다.
생명과학과 조혜연 박사가 제1 저자로 참여한 이번 연구는 셀 프레스(Cell Press) 그룹의 오픈 액세스(Open-access) 학술지 `커런트 바이올로지(Current Biology)'에 10월 22일 字 온라인판에 게재됐다. (논문명: Turnover of fear engram cells by repeated experience)
경험은 기억이라는 형태로 뇌에 저장되고 나중에 회상된다. 또 대부분의 기억은 반복적인 경험을 통해 뇌에서 유지되고 업데이트된다. 뇌에서 기억을 표상하는 물리적 단위가 존재하며 특정 신경 세포 집단(기억 엔그램) 이 기억을 인코딩한다는 사실이 많은 연구를 통해 밝혀졌다.
그렇다면 반복된 경험에 노출되었을 경우 기억을 저장하는 뉴런들에서 어떤 변화가 일어날까? 기존 연구를 통해 같은 학습의 반복으로 형성된 기억은 같은 신경 세포 집단을 통해 계속 저장되고 강화될 것으로 추측돼왔다. 하지만 실제로 신경 세포 수준에서 어떤 변화가 일어나는지 명확히 밝혀진 바가 없었다.
연구팀은 이번 연구에서 생쥐 뇌 편도체(amygdala) 영역에서 기억저장 세포를 표지하고 광유전학 기법으로 조절하는 기술을 이용해 기존의 통념과 달리 첫 학습 하루 후에 같은 학습을 반복했을 때 `같은' 기억이 전혀 다른 세포들을 통해 다시 저장되고 회상되는 현상을 발견했다. 반복 학습된 기억이 첫 번째 학습으로 형성된 기억 엔그램을 억제하는 동안에도 정상적으로 발현되는 것을 확인한 것이다.
반복 학습 후에 기존 엔그램에서 *시냅스 가소성이 감소한 것으로 보아, 경험이 반복되면 기존의 기억 엔그램이 기억 회로상에서 연결이 약해지기 때문에 기억 발현에 관여하지 않는다는 것을 알 수 있었다.
☞ 시냅스 가소성(Synaptic plasticity): 시냅스는 신경 세포 간의 정보가 전달되는 구조적인 장소를 말하는데, 시냅스는 그 활성 정도에 따라 구조와 기능이 지속적으로 변화 가능하며 이를 시냅스 가소성이라 부른다.
이처럼 기존 기억 엔그램이 반복 학습된 공포 기억에 필요하지는 않았지만 흥미롭게도 기존 기억 엔그램을 광유전학 기법으로 자극했을 땐 공포 반응이 나타났다. 기존 기억 엔그램의 연결이 약해졌음에도 불구하고 여전히 기억 정보를 간직한 채 `휴면 엔그램 (silent engram)'으로 존재한다는 것을 확인한 결과였다.
또한 연구팀은 반복 학습된 공포 기억이 두 번째 학습 때 활성화된 편도체 뉴런들에 새로 저장된다는 것을 보임으로써 같은 경험의 기억이 처음과 다른 세포 집단에 인코딩된다는 사실을 추가로 입증했다.
한진희 교수는 "이번 연구 결과는 기억은 고정돼 있는 것처럼 보이지만 뇌에서 그 기억을 저장하는 세포들은 다이내믹하게 스위칭 된다는 새로운 패러다임을 제시하는 중요한 발견이다ˮ며, "앞으로 기억 뉴런을 표적으로 해서 원하지 않는 기억 삭제 및 퇴행성 뇌질환에서 기억상실 억제, 복원을 가능하게 하는 미래 기억제어 기술 개발에 도움을 줄 것ˮ이라고 말했다.
한편, 이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
2021.11.03 조회수 9125