
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
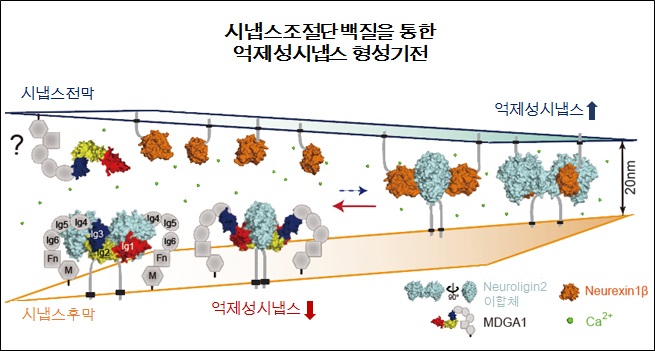
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
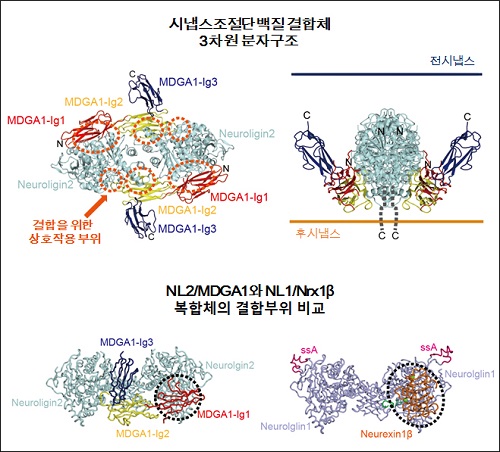
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
-
행사 김재철 AI대학원, ‘AI 기술 설명회 2025’ 개최
우리 대학 김재철AI대학원(원장 정송)에서 오는 5월 16일(금), 서울 코엑스에서 ‘KAIST 김재철AI대학원, AI 기술설명회 2025’를 개최한다. 이번 기술설명회는 KAIST가 연구 중인 핵심 원천 AI 기술을 산업계와 일반 대중에 소개함으로써 AI 기술의 확산과 산학협력 활성화를 목표로 기획되었다. 선별된 기술은 멀티모달 AI, 로보틱스, 대규모 언어모델(LLM), 생성형 AI(이미지 및 비디오의 이해와 생성) 등 폭넓은 분야에 걸친 최신 연구 성과가 발표될 예정이다. 오전 세션에서는 김재철AI대학원 최윤재 교수, 서민준 교수, 그리고 (주)크라우드웍스 양수열 CTO 등 국내 AI 분야 전문가들이 의료 인공지능, 로보틱스, 기업 내 데이터 학습을 위한 비전-언어 모델 등 최신 기술 동향을 주제로 초청 강연을 진행한다. 이어, 오후 세션에서는 김승룡 교수, 예종철 교수, 최재식 교수, 주재걸 교수, 신진우 교수 등 현재 진행 중인 최신 AI 연구
2025-05-09 -
연구 기후정책의 숨겨진 위험 규명, 탄소 줄고 독성물질 40% 증가 밝혀
2013년부터 시행된 미국 내 최대 규모의 온실가스 감축 정책으로 캘리포니아주의 탄소배출권 거래제도*가 있다. KAIST와 국제공동연구진은 이 제도가 예상치 못한 환경부작용을 초래하며 기업들의 독성물질 배출을 최대 40% 증가시켰다는 점을 처음으로 밝혀냈다. *탄소배출권 거래제도(Cap and Trade Program): 온실가스 배출 총량 상한(cap)을 설정하고 이를 기업들에게 자체 감축 노력을 통해 배출을 줄이거나 거래(trade)할 수 있는 제도임 우리 대학 기술경영학부 이나래 교수가 미네소타 주립대 아심 카울(Aseem Kaul) 교수와 공동연구를 통해서, 탄소배출권 거래제도가 온실가스 감축에는 기여했지만, 예상치 못한 또 다른 환경 문제를 유발할 수 있다는 점을 실증적으로 밝혔다. 탄소배출권 거래 제도는 시장 원리를 활용해 비용 효율적으로 온실가스를 줄이고, 동시에 경제적 유인을 제공함으로써 지속적인 환경 개선을 도모하는 것이 목적으로 만들어졌다. 연구팀은
2025-05-09 -
연구 KAIST-고려대, 심혈관 진단 정밀도 높이는 영상기술 개발 및 임상 성공
우리 대학 기계공학과 유홍기 교수팀이 고려대학교 구로병원 심혈관센터 김진원 교수팀과 협력해, 관상동맥 질환의 진단 정밀도를 혁신적으로 높일 수 있는 영상기술을 개발하고, 이를 세계 최초로 사람을 대상으로 한 임상시험에 성공했다. 이번 연구에서는 광간섭단층촬영(OCT)과 형광수명영상(FLIm)을 결합한 차세대 다중 모달 영상 기술을 실제 환자에게 적용해, 심장 혈관 속 동맥경화반*의 구조뿐만 아니라 그 내부의 생화학적 조성까지 실시간으로 정밀하게 파악할 수 있음을 입증했다. *동맥경화반: 콜레스테롤과 염증 세포 등이 동맥 벽에 쌓여 혈관이 좁아지게 만드는 병변. 기존 영상기술로는 경화반 내부의 복잡한 병변을 정확히 구분하거나 정량화하기 어려웠지만, OCT-FLIm 기술을 통해 염증, 치유반(손상 회복 흔적), 칼슘 침착 등 다양한 병리 정보를 정밀하게 구분할 수 있다. 특히, FLIm의 형광 수명 정보를 활용함으로써, 이러한 생화학적 특성이 환자의 임상 상태와 밀접하게 연관
2025-05-08 -
연구 "파킨슨병을 편집하다” 염증 RNA 편집 효소 세계 최초 발견
파킨슨병(PD)은 알파시누클린(α-synuclein) 단백질이 뇌세포 내에서 비정상적으로 응집되어 신경세포를 손상시키는 퇴행성 신경질환이다. KAIST 연구진은 파킨슨병의 핵심 병리 중 하나인 신경염증 조절에 있어 RNA 편집(RNA editing)이 중요한 역할을 한다는 사실을 세계 최초로 밝혀냈다. 우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 UCL 국립신경전문병원 연구소 및 프랜시스 크릭 연구소와의 공동 연구를 통해, 뇌를 보호하고자 염증 반응을 일으키는 교세포(astrocyte)에 대해 RNA 편집 효소인 에이다원(ADAR1)이 면역 반응을 조절하는 중요한 역할을 한다는 것을 밝혀내고 파킨슨병의 병리 진행에 핵심적인 역할을 한다는 사실을 입증했다. 최민이 교수 연구팀은 뇌 면역세포의 염증반응을 알아보고자 파킨슨 환자에게서 유래한 줄기세포를 이용해 뇌의 신경세포를 돕는 교세포와 신경세포로 구성된 세포 모델을 만들고, 파킨슨병의 원인이 된다고 알려진 알파
2025-04-28 -
행사 KAIST 제조AI빅데이터센터 – 미국 MIT MIMO, 글로벌 제조 혁신을 위한 차세대 AI 공동연구 착수
KAIST 제조AI빅데이터센터와 미국 MIT Machine Intelligence for Manufacturing and Operations(이하 MIT MIMO)는 미국 MIT에서 2025년 2월 12일(현지시간) “자가 적응 AI 기반 이차전지 모듈팩 통합 시스템 개발”에 대한 킥오프 미팅을 시작으로 국제공동연구를 본격적으로 시작했다. 이번 연구는 중소벤처기업부(이하 중기부)가 추진하는 2024년 전략기술 테마별 프로젝트(DCP, Deep-Tech Challenge Project)의 일환으로 진행된다. DCP 프로젝트는 중소·벤처기업이 고위험·고성과 R&D에 과감히 도전할 수 있도록 지원하는 대규모 연구개발 프로그램으로, 민·관 합동으로 최대 100억 원 규모의 연구개발 자금이 투입된다. 이번 프로젝트에는 혁신 중소·벤처기업 98개 기업이 지원하였으며, 중기부는 2024년 12월 글로벌 시장을
2025-02-13