%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B3%BC
-
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 358
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 358 -
 세계 최초 유전자 가위로 원하는 RNA ‘콕’ 집어 변형 성공
RNA 유전자 가위는 코로나바이러스와 같은 바이러스의 RNA를 제거하여 감염을 억제하거나 질병 원인 유전자 발현을 조절할 수 있어, 부작용이 적은 차세대 유전자 치료제로 크게 주목받고 있다. 우리 연구진은 세포 내 존재하는 수많은 RNA(유전 정보를 전달하고 단백질을 만드는 데 중요한 역할을 하는 분자) 중에서 원하는 RNA만을 정확하게 찾아서 아세틸화(화학 변형)할 수 있는 기술을 세계 최초로 개발했고, 이는 RNA 기반 치료의 새 장을 열 수 있는 핵심 기술이 될 것으로 기대된다.
우리 대학 생명과학과 허원도 석좌교수 연구팀이 최근 유전자 조절 및 RNA 기반 기술 분야에서 각광받는 RNA 유전자 가위 시스템(CRISPR-Cas13)을 이용해 우리 몸 안의 특정한 RNA에 아세틸화를 가할 수 있는 혁신적 기술을 개발했다고 10일 밝혔다.
RNA는 ‘화학 변형(chemical modification)’이란 과정을 통해 그 특성과 기능이 변화할 수 있다. 화학 변형이란 RNA 염기 서열 자체의 변함없이 특정 화학 그룹이 추가됨으로써 RNA의 성질과 역할을 변화시키는 유전자 조절 과정이다. 그중 하나가 시티딘 아세틸화(N4-acetylcytidine)라는 화학 변형인데, 지금까지는 이 화학 변형이 세포 내에서 어떤 기능을 수행하는지 정확히 알려져 있지 않았다. 특히, 인간 세포의 mRNA(단백질을 만드는 RNA)에 이 변형이 실제로 있는지, 어떤 역할을 하는지 등에 대한 논란이 이어졌다.
연구팀은 이러한 한계를 극복하기 위해 원하는 RNA만을 정밀하게 표적하는 유전자 가위인 Cas13에 RNA를 아세틸화시키는 NAT10의 고활성 변이체(eNAT10)를 결합한 ‘표적 RNA 아세틸화 시스템(dCas13-eNAT10)’을 개발했다. 즉, 원하는 RNA만 정확하게 골라서 아세틸화시키는 ‘표적 RNA 변형 기술’을 만든 것이다.
연구팀은 표적 RNA 아세틸화 시스템과 세포 내 특정 RNA를 찾아 안내하는 가이드 RNA에 의해 원하는 RNA에 아세틸화 화학 변형을 가할 수 있음을 증명했다. 이를 통해 아세틸화 화학 변형된 메신저 RNA (mRNA)에서 단백질 생산이 증가한다는 사실을 확인했다.
또한, 연구팀은 개발한 시스템을 이용해 RNA 아세틸화가 RNA를 세포핵에서 세포질로 이동시킨다는 사실을 최초로 밝혀냈다. 이번 연구는 아세틸화 화학 변형이 세포 내 RNA ‘위치 이동’도 조절할 수 있다는 가능성을 보여주는 결과다.
연구팀은 개발한 기술이 AAV(아데노-관련 바이러스)라는 유전자 치료에 널리 이용되는 운반체 바이러스를 통해 실험 쥐의 간에 전달하여 동물의 몸속에서도 정확히 RNA 아세틸화 조절이 가능할 수 있음을 입증했다. 이는 RNA를 화학 변형하는 기술이 생체 내 적용에 확장될 수 있음을 보여주는 최초의 사례다. 이는 RNA 기반 유전자 치료 기술로의 응용 가능성을 여는 성과로 평가받는다.
RNA 유전자가위를 활용한 코로나 치료기술과 빛으로 RNA 유전자가위 활성화 기술을 개발하였던 허원도 교수는 “기존 RNA 화학 변형 연구는 특정성, 시간성, 공간성 조절이 어려웠지만, 이번 기술은 원하는 RNA에 선택적으로 아세틸화를 가할 수 있어 RNA 아세틸화의 기능을 정확하고 세밀하게 연구할 수 있는 길을 열였다”며, “이번에 개발한 RNA 화학 변형 기술은 향후 RNA 기반 치료제 및 생체 내 RNA 작동을 조절하는 도구로 폭넓게 활용될 수 있을 것”이라고 전했다.
우리 대학 생명과학과 유지환 박사과정이 제1 저자로 수행한 이 연구는 국제 학술지 ‘네이처 케미컬 바이올로지 (Nature Chemical Biology)’에 2025년 6월 2일 자로 게재됐다.
(논문명: Programmable RNA acetylation with CRISPR-Cas13, Impact factor: 12.9, DOI: https://doi.org/10.1038/s41589-025-01922-3)
한편, 이번 연구는 삼성미래기술육성재단과 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2025.06.10 조회수 2148
세계 최초 유전자 가위로 원하는 RNA ‘콕’ 집어 변형 성공
RNA 유전자 가위는 코로나바이러스와 같은 바이러스의 RNA를 제거하여 감염을 억제하거나 질병 원인 유전자 발현을 조절할 수 있어, 부작용이 적은 차세대 유전자 치료제로 크게 주목받고 있다. 우리 연구진은 세포 내 존재하는 수많은 RNA(유전 정보를 전달하고 단백질을 만드는 데 중요한 역할을 하는 분자) 중에서 원하는 RNA만을 정확하게 찾아서 아세틸화(화학 변형)할 수 있는 기술을 세계 최초로 개발했고, 이는 RNA 기반 치료의 새 장을 열 수 있는 핵심 기술이 될 것으로 기대된다.
우리 대학 생명과학과 허원도 석좌교수 연구팀이 최근 유전자 조절 및 RNA 기반 기술 분야에서 각광받는 RNA 유전자 가위 시스템(CRISPR-Cas13)을 이용해 우리 몸 안의 특정한 RNA에 아세틸화를 가할 수 있는 혁신적 기술을 개발했다고 10일 밝혔다.
RNA는 ‘화학 변형(chemical modification)’이란 과정을 통해 그 특성과 기능이 변화할 수 있다. 화학 변형이란 RNA 염기 서열 자체의 변함없이 특정 화학 그룹이 추가됨으로써 RNA의 성질과 역할을 변화시키는 유전자 조절 과정이다. 그중 하나가 시티딘 아세틸화(N4-acetylcytidine)라는 화학 변형인데, 지금까지는 이 화학 변형이 세포 내에서 어떤 기능을 수행하는지 정확히 알려져 있지 않았다. 특히, 인간 세포의 mRNA(단백질을 만드는 RNA)에 이 변형이 실제로 있는지, 어떤 역할을 하는지 등에 대한 논란이 이어졌다.
연구팀은 이러한 한계를 극복하기 위해 원하는 RNA만을 정밀하게 표적하는 유전자 가위인 Cas13에 RNA를 아세틸화시키는 NAT10의 고활성 변이체(eNAT10)를 결합한 ‘표적 RNA 아세틸화 시스템(dCas13-eNAT10)’을 개발했다. 즉, 원하는 RNA만 정확하게 골라서 아세틸화시키는 ‘표적 RNA 변형 기술’을 만든 것이다.
연구팀은 표적 RNA 아세틸화 시스템과 세포 내 특정 RNA를 찾아 안내하는 가이드 RNA에 의해 원하는 RNA에 아세틸화 화학 변형을 가할 수 있음을 증명했다. 이를 통해 아세틸화 화학 변형된 메신저 RNA (mRNA)에서 단백질 생산이 증가한다는 사실을 확인했다.
또한, 연구팀은 개발한 시스템을 이용해 RNA 아세틸화가 RNA를 세포핵에서 세포질로 이동시킨다는 사실을 최초로 밝혀냈다. 이번 연구는 아세틸화 화학 변형이 세포 내 RNA ‘위치 이동’도 조절할 수 있다는 가능성을 보여주는 결과다.
연구팀은 개발한 기술이 AAV(아데노-관련 바이러스)라는 유전자 치료에 널리 이용되는 운반체 바이러스를 통해 실험 쥐의 간에 전달하여 동물의 몸속에서도 정확히 RNA 아세틸화 조절이 가능할 수 있음을 입증했다. 이는 RNA를 화학 변형하는 기술이 생체 내 적용에 확장될 수 있음을 보여주는 최초의 사례다. 이는 RNA 기반 유전자 치료 기술로의 응용 가능성을 여는 성과로 평가받는다.
RNA 유전자가위를 활용한 코로나 치료기술과 빛으로 RNA 유전자가위 활성화 기술을 개발하였던 허원도 교수는 “기존 RNA 화학 변형 연구는 특정성, 시간성, 공간성 조절이 어려웠지만, 이번 기술은 원하는 RNA에 선택적으로 아세틸화를 가할 수 있어 RNA 아세틸화의 기능을 정확하고 세밀하게 연구할 수 있는 길을 열였다”며, “이번에 개발한 RNA 화학 변형 기술은 향후 RNA 기반 치료제 및 생체 내 RNA 작동을 조절하는 도구로 폭넓게 활용될 수 있을 것”이라고 전했다.
우리 대학 생명과학과 유지환 박사과정이 제1 저자로 수행한 이 연구는 국제 학술지 ‘네이처 케미컬 바이올로지 (Nature Chemical Biology)’에 2025년 6월 2일 자로 게재됐다.
(논문명: Programmable RNA acetylation with CRISPR-Cas13, Impact factor: 12.9, DOI: https://doi.org/10.1038/s41589-025-01922-3)
한편, 이번 연구는 삼성미래기술육성재단과 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2025.06.10 조회수 2148 -
 짠 음식의 뇌종양 악화 유발 원인 세계 최초 밝혀
짠 음식을 자주 섭취하는 식습관이 건강에 해롭다는 것은 널리 알려진 사실이다. 그런데 최근 KAIST 연구진은 짠 음식이 뇌종양까지 악화시킬 수 있다는 사실을 세계 최초로, “왜 나빠지는지", "무엇이 그 과정을 유도하는지", "어떤 유전자가, 어떤 단백질이 작용하는지"까지 분자적 인과관계를 입증해 주목받고 있다.
우리 대학 생명과학과 이흥규 교수 연구팀이 고염식이 장내 미생물 구성을 변화시키고, 이로 인해 증식이 증대된 미생물에 의해 분비되는 대사물질인‘프로피오네이트(propionate)‘가 장내에 과도하게 축적되어 뇌종양을 악화시킨다는 사실을 밝혀냈다.
연구팀은 뇌종양 마우스 모델을 이용한 실험에서 이 같은 사실을 입증했다. 마우스에게 4주간 짠 사료를 섭취하게 한 뒤 종양세포를 주입하자 일반식이 그룹에 비해 생존율이 크게 낮아지고 종양 크기가 증가하는 것을 확인했다. 이어 항생제로 장내 미생물을 제거하거나, 무균 마우스에 분변(고염사료 섭취한 사람의 대변에 해당되는 마우스 분변 샘플) 미생물을 이식하는 실험에서도 유사한 뇌종양 악화 반응이 관찰되었다. 이는 장내 미생물 변화가 뇌종양 악화의 핵심 요인임을 보여주는 증거이다.
특히, 연구팀은 장내 미생물 중 박테로이드 불가투스(Bacteroides vulgatus)라는 균이 고염식이에 따라 증가하고, 이 균이 프로피오네이트(propionate)라는 효소(Pccb)의 발현을 높인다는 사실을 발견했다.
그 결과, 장내에서 프로피오네이트 농도가 비정상적으로 상승했으며, 이 물질은 뇌종양 세포에서 산소가 충분한데도 마치 부족한 것처럼 ‘저산소유도인자-1알파(HIF-1α)’를 활성화시켰다. 이는 다시 ‘형질전환성장인자-베타(TGF-β)’를 증가시켜 제1형 콜라겐(COL1A1)을 과하게 만들게 하여 종양 세포가 더 쉽게 퍼지고 악성도를 높이게 하였다.
이러한 분자적 기전은 실제 뇌종양 중 가장 악성도가 높은 교모세포종(Glioblastoma) 환자의 암세포 데이터 분석을 통해서 임상 적용 가능성을 제시하였다. 마우스와 인간 종양세포에서 공통적으로 발현된 관련 유전자들로 인해 환자의 생존율이 낮아짐을 보여주었다.
이흥규 교수는 “이번 연구는 짠 음식 섭취가 장내 미생물 생태계를 변화시키고, 그 결과 생성된 대사산물이 뇌종양을 악화시킬 수 있음을 세계 최초로 분자 수준에서 규명한 것”이라며, “향후 뇌종양 환자를 대상으로 한 식이 조절 연구와 장내 미생물 기반 치료 전략 개발의 기초 자료로 활용될 수 있을 것”이라고 밝혔다.
공동 제1 저자로는 KAIST 김채원 박사(현. 미국 하버드 의과대학 부속 보스턴 어린이병원 박사후연구원)와 김현진 박사(KAIST 생명과학연구소 박사후연구원)가 참여했으며, 연구 결과는 생의학 분야 권위 학술지인 저널 어브 익스페리멘탈 메디슨(Journal of Experimental Medicine)에 5월 22일 자에 게재됐다.
논문 : Gut dysbiosis from high-salt diet promotes glioma via propionate-mediated TGF-β activation https://doi.org/10.1084/jem.20241135
이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.06.02 조회수 1155
짠 음식의 뇌종양 악화 유발 원인 세계 최초 밝혀
짠 음식을 자주 섭취하는 식습관이 건강에 해롭다는 것은 널리 알려진 사실이다. 그런데 최근 KAIST 연구진은 짠 음식이 뇌종양까지 악화시킬 수 있다는 사실을 세계 최초로, “왜 나빠지는지", "무엇이 그 과정을 유도하는지", "어떤 유전자가, 어떤 단백질이 작용하는지"까지 분자적 인과관계를 입증해 주목받고 있다.
우리 대학 생명과학과 이흥규 교수 연구팀이 고염식이 장내 미생물 구성을 변화시키고, 이로 인해 증식이 증대된 미생물에 의해 분비되는 대사물질인‘프로피오네이트(propionate)‘가 장내에 과도하게 축적되어 뇌종양을 악화시킨다는 사실을 밝혀냈다.
연구팀은 뇌종양 마우스 모델을 이용한 실험에서 이 같은 사실을 입증했다. 마우스에게 4주간 짠 사료를 섭취하게 한 뒤 종양세포를 주입하자 일반식이 그룹에 비해 생존율이 크게 낮아지고 종양 크기가 증가하는 것을 확인했다. 이어 항생제로 장내 미생물을 제거하거나, 무균 마우스에 분변(고염사료 섭취한 사람의 대변에 해당되는 마우스 분변 샘플) 미생물을 이식하는 실험에서도 유사한 뇌종양 악화 반응이 관찰되었다. 이는 장내 미생물 변화가 뇌종양 악화의 핵심 요인임을 보여주는 증거이다.
특히, 연구팀은 장내 미생물 중 박테로이드 불가투스(Bacteroides vulgatus)라는 균이 고염식이에 따라 증가하고, 이 균이 프로피오네이트(propionate)라는 효소(Pccb)의 발현을 높인다는 사실을 발견했다.
그 결과, 장내에서 프로피오네이트 농도가 비정상적으로 상승했으며, 이 물질은 뇌종양 세포에서 산소가 충분한데도 마치 부족한 것처럼 ‘저산소유도인자-1알파(HIF-1α)’를 활성화시켰다. 이는 다시 ‘형질전환성장인자-베타(TGF-β)’를 증가시켜 제1형 콜라겐(COL1A1)을 과하게 만들게 하여 종양 세포가 더 쉽게 퍼지고 악성도를 높이게 하였다.
이러한 분자적 기전은 실제 뇌종양 중 가장 악성도가 높은 교모세포종(Glioblastoma) 환자의 암세포 데이터 분석을 통해서 임상 적용 가능성을 제시하였다. 마우스와 인간 종양세포에서 공통적으로 발현된 관련 유전자들로 인해 환자의 생존율이 낮아짐을 보여주었다.
이흥규 교수는 “이번 연구는 짠 음식 섭취가 장내 미생물 생태계를 변화시키고, 그 결과 생성된 대사산물이 뇌종양을 악화시킬 수 있음을 세계 최초로 분자 수준에서 규명한 것”이라며, “향후 뇌종양 환자를 대상으로 한 식이 조절 연구와 장내 미생물 기반 치료 전략 개발의 기초 자료로 활용될 수 있을 것”이라고 밝혔다.
공동 제1 저자로는 KAIST 김채원 박사(현. 미국 하버드 의과대학 부속 보스턴 어린이병원 박사후연구원)와 김현진 박사(KAIST 생명과학연구소 박사후연구원)가 참여했으며, 연구 결과는 생의학 분야 권위 학술지인 저널 어브 익스페리멘탈 메디슨(Journal of Experimental Medicine)에 5월 22일 자에 게재됐다.
논문 : Gut dysbiosis from high-salt diet promotes glioma via propionate-mediated TGF-β activation https://doi.org/10.1084/jem.20241135
이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.06.02 조회수 1155 -
 심리적 공포기억 조절 뇌 회로 최초 규명-트라우마 치료 새 전기
자연재해, 사고, 폭력 등 위협적인 상황은 뇌에 공포 기억을 남긴다. 하지만, 과도하거나 왜곡된 공포 기억 형성은 PTSD, 불안장애, 우울증 등 심각한 정신질환으로 이어질 수 있다. 그렇다면 신체적 고통을 직접 경험했을때의 공포와, 심리적 불안으로 겪은 고통의 기억은 뇌에서 어떻게 구분되며 조절될까? KAIST 연구진은 신체적 고통 없이 심리적 불안과 공포에 의한 공포 기억 형성에 특화된 뇌 회로를 세계 최초로 규명했으며, 이 회로를 타켓으로 한 맞춤형 트라우마 치료법 개발 가능성을 열었다.
우리 대학 생명과학과 한진희 교수 연구팀은 생쥐 모델을 이용한 실험을 통해, 감각적 고통 없이 심리적 위협만으로 유도되는 공포 기억의 형성을 조절하는 핵심 뇌 회로인 pIC-PBN회로*를 규명했다.
*pIC–PBN 회로: 후측 대뇌섬엽(pIC, posterior insular cortex)에서 외측 팔곁핵(PBN, parabrachial nucleus)으로 이어지는 하향 신경 경로로, 심리적 고통 정보를 전달하는 전용 회로임을 새롭게 밝혀냄
기존에는 뇌의 외측 팔곁핵(PBN)이 척수에서 통각 정보를 전달받는 통각 상행 경로의 일부로만 알려져 있었으나, 연구팀은 비통각적 위협 자극에 의해서도 PBN이 공포학습에 필수적으로 기능한다는 새로운 사실을 밝혔다.
이번 연구는 ‘정서적 고통’과 ‘신체적 고통’이 서로 다른 뇌 신경회로에 의해 처리된다는 사실을 세계 최초로 실험적으로 입증한 사례로 평가된다. 특히, 정서적 고통을 전달하는 데 특화된 신경 회로(pIC-PBN)를 명확히 제시함으로써, 신경과학 분야에서 큰 학술적 의의를 지닌다.
이번 연구의 제 1저자인 한준호 박사는 연구의 출발점을 이렇게 설명한다.
“저희 강아지 ‘레고’는 오토바이를 무서워한다. 실제로 부딪치진 않았지만 오토바이가 빠르게 다가온 경험 이후로 오토바이 소리만 들어도 겁을 먹는다. 사람도 마찬가지로. 사고를 실제로 겪지 않더라도, 사고가 날 뻔한 경험이나 자극적인 미디어 노출만으로도 공포 기억이 생기고, 결국 PTSD로 이어질 수 있다.”
이어 “지금까지 공포 기억에 관한 연구는 신체적 고통에 기반한 실험에 의존해 왔으나, 실제 인간의 공포 기억은 신체적 고통보다는 심리적 위협에 의해 형성되는 경우가 훨씬 많다. 그럼에도 불구하고 이러한 심리적 위협을 처리하는 뇌 회로에 대해서는 거의 알려진 바가 없었다.”
연구팀은 심리적 위협을 처리하는 뇌 회로를 알아보기 위하여 전기 자극이 아닌 시각적 위협 자극을 사용하는 새로운 공포 조건화 실험 모델을 개발했다.
생쥐는 포식자가 위에서 빠르게 접근하는 상황에서 본능적으로 공포 반응을 보이는데, 연구팀은 이를 활용해 천장 화면에 빠르게 커지는 그림자를 제시함으로써 생쥐가 포식자에게 공격당하는 듯한 위협을 경험하게 하였다. 이 실험을 통해, 통각 없이도 심리적 위협만으로 공포 기억이 형성될 수 있음을 입증했다.
이 새로운 행동 실험 모델과 함께, 연구팀은 신경세포의 활성을 정밀하게 조절하는 화학유전학 및 광유전학 기법을 활용하여, 외측 팔곁핵(PBN)이 시각적 위협만으로도 공포 기억이 형성된다는 사실을 규명하였고 나아가 연구팀은 PBN으로 정보를 전달하는 상위 뇌 영역을 분석했다. 이에 따라, 부정적 정서와 고통 처리에 중요한 역할을 하는 후측 대뇌섬엽(pIC)이 PBN과 직접 연결되어 있음이 밝혀졌다.
특히 시각적 위협 자극 이후, pIC에서 PBN으로 신호를 보내는 뉴런들이 활성화되며, 이 신호가 PBN 뉴런의 활성에 필수적인 역할을 한다는 사실도 확인되었다.
연구 결과, pIC–PBN 회로를 인위적으로 억제하면 시각적 위협에 따른 공포 기억 형성이 현저히 감소하지만, 선천적인 공포 반응이나 통각 기반의 공포 학습에는 영향을 주지 않는다는 점도 규명했다. 반대로 이 회로를 인위적으로 활성화하는 것만으로도 공포 기억이 유도되어, pIC–PBN 회로가 심리적 위협 정보를 처리하고 학습을 유도하는 핵심 경로임이 드러났다.
한진희 교수는“이번 연구는 PTSD, 공황장애, 불안장애 등 정서적 고통을 주 증상으로 하는 정신질환의 발병 메커니즘을 이해하고, 맞춤형 치료법을 개발하는 데 중요한 토대를 마련할 것”이라고 밝혔다.
생명과학과 한준호 박사 (제 1저자), 서보인 박사과정(제 2저자)이 수행한 논문은 국제 학술지 사이언스 어드밴시스(Science Advances)에 2025년 5월 9일 자 온라인 게재되었다.
※ 논문명 : Han, J., Suh, B., & Han, J. H. (2025). A top-down insular cortex circuit crucial for non-nociceptive fear learning. Science Advances (https://doi.org/10.1101/2024.10.14.618356)
※ 저자 정보 : Junho Han(KAIST, 제1저자), Boin Suh(KAIST, 제2저자), and Jin-Hee Han(KAIST, 교신저자)
본 연구는 과학기술정보통신부 뇌과학원천기술개발사업과 뇌기능규명조절기술개발사업의 지원을 받아 수행되었다.
2025.05.15 조회수 3078
심리적 공포기억 조절 뇌 회로 최초 규명-트라우마 치료 새 전기
자연재해, 사고, 폭력 등 위협적인 상황은 뇌에 공포 기억을 남긴다. 하지만, 과도하거나 왜곡된 공포 기억 형성은 PTSD, 불안장애, 우울증 등 심각한 정신질환으로 이어질 수 있다. 그렇다면 신체적 고통을 직접 경험했을때의 공포와, 심리적 불안으로 겪은 고통의 기억은 뇌에서 어떻게 구분되며 조절될까? KAIST 연구진은 신체적 고통 없이 심리적 불안과 공포에 의한 공포 기억 형성에 특화된 뇌 회로를 세계 최초로 규명했으며, 이 회로를 타켓으로 한 맞춤형 트라우마 치료법 개발 가능성을 열었다.
우리 대학 생명과학과 한진희 교수 연구팀은 생쥐 모델을 이용한 실험을 통해, 감각적 고통 없이 심리적 위협만으로 유도되는 공포 기억의 형성을 조절하는 핵심 뇌 회로인 pIC-PBN회로*를 규명했다.
*pIC–PBN 회로: 후측 대뇌섬엽(pIC, posterior insular cortex)에서 외측 팔곁핵(PBN, parabrachial nucleus)으로 이어지는 하향 신경 경로로, 심리적 고통 정보를 전달하는 전용 회로임을 새롭게 밝혀냄
기존에는 뇌의 외측 팔곁핵(PBN)이 척수에서 통각 정보를 전달받는 통각 상행 경로의 일부로만 알려져 있었으나, 연구팀은 비통각적 위협 자극에 의해서도 PBN이 공포학습에 필수적으로 기능한다는 새로운 사실을 밝혔다.
이번 연구는 ‘정서적 고통’과 ‘신체적 고통’이 서로 다른 뇌 신경회로에 의해 처리된다는 사실을 세계 최초로 실험적으로 입증한 사례로 평가된다. 특히, 정서적 고통을 전달하는 데 특화된 신경 회로(pIC-PBN)를 명확히 제시함으로써, 신경과학 분야에서 큰 학술적 의의를 지닌다.
이번 연구의 제 1저자인 한준호 박사는 연구의 출발점을 이렇게 설명한다.
“저희 강아지 ‘레고’는 오토바이를 무서워한다. 실제로 부딪치진 않았지만 오토바이가 빠르게 다가온 경험 이후로 오토바이 소리만 들어도 겁을 먹는다. 사람도 마찬가지로. 사고를 실제로 겪지 않더라도, 사고가 날 뻔한 경험이나 자극적인 미디어 노출만으로도 공포 기억이 생기고, 결국 PTSD로 이어질 수 있다.”
이어 “지금까지 공포 기억에 관한 연구는 신체적 고통에 기반한 실험에 의존해 왔으나, 실제 인간의 공포 기억은 신체적 고통보다는 심리적 위협에 의해 형성되는 경우가 훨씬 많다. 그럼에도 불구하고 이러한 심리적 위협을 처리하는 뇌 회로에 대해서는 거의 알려진 바가 없었다.”
연구팀은 심리적 위협을 처리하는 뇌 회로를 알아보기 위하여 전기 자극이 아닌 시각적 위협 자극을 사용하는 새로운 공포 조건화 실험 모델을 개발했다.
생쥐는 포식자가 위에서 빠르게 접근하는 상황에서 본능적으로 공포 반응을 보이는데, 연구팀은 이를 활용해 천장 화면에 빠르게 커지는 그림자를 제시함으로써 생쥐가 포식자에게 공격당하는 듯한 위협을 경험하게 하였다. 이 실험을 통해, 통각 없이도 심리적 위협만으로 공포 기억이 형성될 수 있음을 입증했다.
이 새로운 행동 실험 모델과 함께, 연구팀은 신경세포의 활성을 정밀하게 조절하는 화학유전학 및 광유전학 기법을 활용하여, 외측 팔곁핵(PBN)이 시각적 위협만으로도 공포 기억이 형성된다는 사실을 규명하였고 나아가 연구팀은 PBN으로 정보를 전달하는 상위 뇌 영역을 분석했다. 이에 따라, 부정적 정서와 고통 처리에 중요한 역할을 하는 후측 대뇌섬엽(pIC)이 PBN과 직접 연결되어 있음이 밝혀졌다.
특히 시각적 위협 자극 이후, pIC에서 PBN으로 신호를 보내는 뉴런들이 활성화되며, 이 신호가 PBN 뉴런의 활성에 필수적인 역할을 한다는 사실도 확인되었다.
연구 결과, pIC–PBN 회로를 인위적으로 억제하면 시각적 위협에 따른 공포 기억 형성이 현저히 감소하지만, 선천적인 공포 반응이나 통각 기반의 공포 학습에는 영향을 주지 않는다는 점도 규명했다. 반대로 이 회로를 인위적으로 활성화하는 것만으로도 공포 기억이 유도되어, pIC–PBN 회로가 심리적 위협 정보를 처리하고 학습을 유도하는 핵심 경로임이 드러났다.
한진희 교수는“이번 연구는 PTSD, 공황장애, 불안장애 등 정서적 고통을 주 증상으로 하는 정신질환의 발병 메커니즘을 이해하고, 맞춤형 치료법을 개발하는 데 중요한 토대를 마련할 것”이라고 밝혔다.
생명과학과 한준호 박사 (제 1저자), 서보인 박사과정(제 2저자)이 수행한 논문은 국제 학술지 사이언스 어드밴시스(Science Advances)에 2025년 5월 9일 자 온라인 게재되었다.
※ 논문명 : Han, J., Suh, B., & Han, J. H. (2025). A top-down insular cortex circuit crucial for non-nociceptive fear learning. Science Advances (https://doi.org/10.1101/2024.10.14.618356)
※ 저자 정보 : Junho Han(KAIST, 제1저자), Boin Suh(KAIST, 제2저자), and Jin-Hee Han(KAIST, 교신저자)
본 연구는 과학기술정보통신부 뇌과학원천기술개발사업과 뇌기능규명조절기술개발사업의 지원을 받아 수행되었다.
2025.05.15 조회수 3078 -
 손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 9785
손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 9785 -
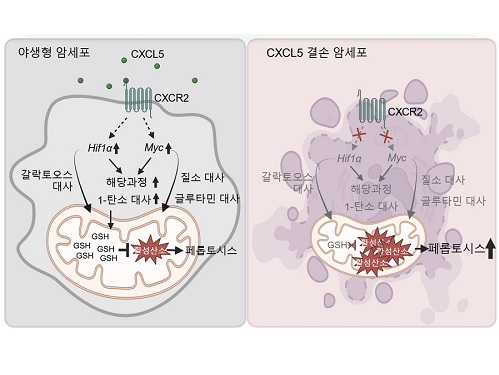 암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3149
암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3149 -
 코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17 조회수 3740
코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17 조회수 3740 -
 암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22 조회수 4517
암 발생 현상 등 유전자 발현 조절 원리 규명
다양한 암 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포의 활성화 과정 등을 근본적으로 일으키는 유전자 발현 조절 단백질의 핵심 유전자 발현 네트워크를 발견했다. 우리 연구진은 이 발견을 기초로 하여 혁신적인 치료 기술 개발에 활용 가능성을 높였다.
우리 대학 생명과학과 김세윤 교수, 이광록 교수, 조원기 교수 공동연구팀이 동물 세포의 유전자 발현을 조절하는 핵심적인 원리를 규명했다고 22일 밝혔다.
이노시톨 대사 효소에 의해 만들어지는 이노시톨 인산 대사체는 진핵 세포의 신호전달 시스템에 필요한 다양한 이차 신호전달물질로 작용하며 암, 비만, 당뇨, 신경계 질환들에 폭넓게 관여한다.
연구팀은 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자로 작용함을 규명했다.
포도당과 유사한 영양소로 알려진 이노시톨의 대사 반응에 핵심적으로 작용하는 효소인 IPMK 단백질(inositol polyphosphate multikinase)은 유전자 발현을 직접적으로 조절하는 기능을 가지고 있다. 특히 IPMK 효소는 동물 세포의 대표적인 전사 인자(transcription factor)인 혈청 반응 인자(serum response factor, 이하 SRF)에 의한 유전자 전사 과정에 중요하다고 보고된 바 있으나 작용하는 기전에 대하여 알려진 바는 없었다.
SRF 전사 인자는 최소 200~300여 개의 유전자 발현을 직접적으로 조절하는 단백질로서, 동물 세포의 성장과 증식, 세포 사멸, 세포의 이동성 등을 조절하며 심장과 같은 장기 발생에 필수적이다.
연구팀은 IPMK 단백질이 SRF 전사 인자와 직접적으로 결합한다는 사실을 발견하고 이를 통해 SRF 전사 인자의 3차원적 단백질 구조를 변화시킨다는 것을 밝혔다.
연구팀은 IPMK 효소에 의하여 활성화된 SRF 전사 인자를 통해 다양한 유전자들의 전사 과정이 촉진된다는 것을 밝혔다. 즉, IPMK 단백질은 SRF 전사 인자의 단백질 활성을 높이는 데 반드시 필요한 조절 스위치와 같은 역할을 수행하는 것임을 연구팀은 규명했다.
연구팀은 IPMK 효소와 SRF 전사 인자 사이의 직접적인 결합에 문제가 발생할 경우, SRF 전사 인자의 기능과 활성이 낮아져 유전자 발현에 심각한 장애가 발생한다는 점을 최종적으로 검증하였다.
특히 SRF 전사 인자가 가지고 있는 비정형 영역(Intrinsically disordered region, IDR)이 중요한 조절 부위라는 점을 밝힘으로써 비정형 단백질의 생물학적 중요성을 제시했다. 보통 단백질은 접힘을 통해 고유의 구조를 나타내지만 비정형 영역을 포함하게 되는 경우에는 특정한 단백질 구조가 관찰되지 않는다. 학계에서는 이러한 비정형 영역을 가지고 있는 단백질들을 비정형 단백질이라고 구분하고 어떠한 기능을 수행하는지 주목하고 있다.
김세윤 교수는 “이번 연구는 이노시톨 대사 시스템의 핵심 효소인 IPMK 단백질이 동물 세포의 핵심 유전자 발현 네트워크의 중요한 전사 활성화 인자이며 이를 증명하는 핵심 메커니즘을 제시한 중요한 발견”이라며, “SRF 전사 인자로부터 파생되는 다양한 암의 발생과 암전이 현상, 줄기세포로부터의 조직 분화 및 발생, 신경 세포 활성화 과정 등을 근본적으로 이해함으로써 혁신적인 치료 기술 개발 등에 폭넓게 활용되기를 바란다”라는 기대를 전했다.
이 연구는 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF=16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 7일 게재됐다. (논문명 : Single-molecule analysis reveals that IPMK enhances the DNA-binding activity of the transcription factor SRF) (doi: 10.1093/nar/gkae1281)
한편 이번 연구는 한국연구재단의 중견연구사업, 선도연구센터 지원사업, 글로벌 기초연구실 지원사업과 서경배과학재단, 삼성미래기술육성사업의 지원을 받아 수행됐다.
2025.01.22 조회수 4517 -
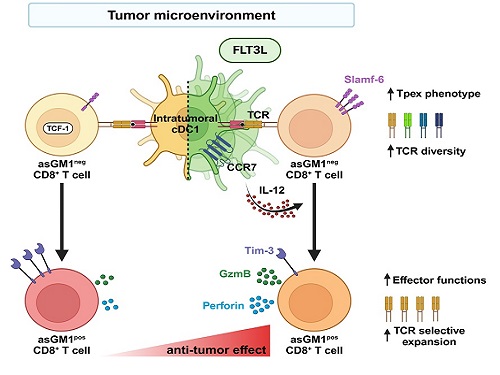 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3505
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3505 -
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4364
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4364 -
 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5847
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5847 -
 누구나 천연물 합성 경로 예측 가능하다
식물은 고착생활을 하면서 환경 스트레스에 대응하기 위해 진화적으로 다양하고 복잡한 천연물을 만들고 있다. 이 천연물들은 인류의 생존에도 필수적인 역할을 하고 있는데 미국식품의약국(FDA) 승인 저분자 약물의 30% 이상이 식물 천연물에 기초하고 있다는 사실이 이를 증명하고 있다. 한국 연구진이 딥러닝을 활용, 천연물의 역-생합성 경로를 예측하는 모델을 제시해 천연물 기반 의약품 대량 생산에 활용될 수 있도록 해 화제다.
우리 대학 생명과학과 김상규 교수 연구팀과 김재철AI대학원 황성주 교수 연구팀의 공동연구를 통해 천연물 생합성 경로를 예측하는 딥러닝 모델을 개발하고 부산대학교 박정빈 교수 연구팀과 협업을 통해 관심있는 누구나 모델을 활용할 수 있도록 인터넷 웹사이트(readretro.net)를 구축했다고 14일 밝혔다.
천연물 활용 및 대량 생산을 위해서는 생합성 경로를 밝히는 것이 필수적이다. 하지만 복잡한 구조를 가진 많은 약용 천연물의 생합성 경로가 잘 밝혀져 있지 않아 현재는 식물로부터 직접 추출해 사용하고 있다. 생합성 경로 연구는 도전적이지만 이를 밝히고 생합성 효소를 찾을 수 있다면 천연물의 활용 가치를 증진할 수 있다.
식물 천연물 생합성 경로 연구의 첫 단계는 식물이 어떻게 물질을 합성하는지 그 경로를 역추적(역합성 경로를 제시)하는 것으로 시작된다. 공동연구팀은 딥러닝을 활용해 천연물의 역-생합성 경로를 예측하는 모델을 제시했다. 이번 연구에서 연구팀은 발전된 역합성 모델과 생화학적 직관을 결합해 성공적으로 천연물 생합성 경로 예측을 수행하는 인공지능 모델을 개발했다.
연구팀은 개발한 인공지능의 이름을 ‘역합성을 읽어내는 모델’이라는 뜻을 담아 ‘리드레트로(READRetro)’라고 명명했다. 이 모델은 천연물 역합성을 예측하는 인공지능 모델 중 최고의 성능을 보이는 것으로 확인되었고 이를 개별 연구자들이 쉽게 활용할 수 있도록 구현했다는 데 의미를 가진다.
김상규 교수는 “식물이 어떻게 복잡한 천연물을 만들 수 있게 되었는지 이해하는 기초 연구에서부터 천연물 기반 의약품을 대량으로 생산하기 위한 합성생물학 연구 등에 활용이 기대된다. 추후 합성 경로를 매개하는 효소를 예측하거나 거대 분자의 역합성 예측 정확도를 높이는 연구를 실시할 계획이다” 라고 말했다. 또한 김 교수는 “이번 연구는 2022년 KAIST 인공지능연구원에서 주최한 멜팅 팟(Melting pot) 세미나에서 저와 황성주 교수가 발제자와 토론자로 만난 인연으로 시작됐다. KAIST가 표방하는 융합이 생화학자와 전산학자의 힘을 합쳐 이끌어 낸 좋은 연구로 큰 의미를 갖는다고 생각한다”고 강조했다.
생명과학과 김태인 석박사통합과정과 김재철AI대학원 이슬 석박사통합과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘뉴 파이톨로지스트(New Phytologist)'에 출판됐다. (논문명 : READRetro: natural product biosynthesis predicting with retrieval-augmented dual-view retrosynthesis).
한편 이번 연구는 KAIST POST-AI, 한국연구재단, 과학기술정보통신부 등의 지원을 받아 수행됐다.
2024.08.14 조회수 6076
누구나 천연물 합성 경로 예측 가능하다
식물은 고착생활을 하면서 환경 스트레스에 대응하기 위해 진화적으로 다양하고 복잡한 천연물을 만들고 있다. 이 천연물들은 인류의 생존에도 필수적인 역할을 하고 있는데 미국식품의약국(FDA) 승인 저분자 약물의 30% 이상이 식물 천연물에 기초하고 있다는 사실이 이를 증명하고 있다. 한국 연구진이 딥러닝을 활용, 천연물의 역-생합성 경로를 예측하는 모델을 제시해 천연물 기반 의약품 대량 생산에 활용될 수 있도록 해 화제다.
우리 대학 생명과학과 김상규 교수 연구팀과 김재철AI대학원 황성주 교수 연구팀의 공동연구를 통해 천연물 생합성 경로를 예측하는 딥러닝 모델을 개발하고 부산대학교 박정빈 교수 연구팀과 협업을 통해 관심있는 누구나 모델을 활용할 수 있도록 인터넷 웹사이트(readretro.net)를 구축했다고 14일 밝혔다.
천연물 활용 및 대량 생산을 위해서는 생합성 경로를 밝히는 것이 필수적이다. 하지만 복잡한 구조를 가진 많은 약용 천연물의 생합성 경로가 잘 밝혀져 있지 않아 현재는 식물로부터 직접 추출해 사용하고 있다. 생합성 경로 연구는 도전적이지만 이를 밝히고 생합성 효소를 찾을 수 있다면 천연물의 활용 가치를 증진할 수 있다.
식물 천연물 생합성 경로 연구의 첫 단계는 식물이 어떻게 물질을 합성하는지 그 경로를 역추적(역합성 경로를 제시)하는 것으로 시작된다. 공동연구팀은 딥러닝을 활용해 천연물의 역-생합성 경로를 예측하는 모델을 제시했다. 이번 연구에서 연구팀은 발전된 역합성 모델과 생화학적 직관을 결합해 성공적으로 천연물 생합성 경로 예측을 수행하는 인공지능 모델을 개발했다.
연구팀은 개발한 인공지능의 이름을 ‘역합성을 읽어내는 모델’이라는 뜻을 담아 ‘리드레트로(READRetro)’라고 명명했다. 이 모델은 천연물 역합성을 예측하는 인공지능 모델 중 최고의 성능을 보이는 것으로 확인되었고 이를 개별 연구자들이 쉽게 활용할 수 있도록 구현했다는 데 의미를 가진다.
김상규 교수는 “식물이 어떻게 복잡한 천연물을 만들 수 있게 되었는지 이해하는 기초 연구에서부터 천연물 기반 의약품을 대량으로 생산하기 위한 합성생물학 연구 등에 활용이 기대된다. 추후 합성 경로를 매개하는 효소를 예측하거나 거대 분자의 역합성 예측 정확도를 높이는 연구를 실시할 계획이다” 라고 말했다. 또한 김 교수는 “이번 연구는 2022년 KAIST 인공지능연구원에서 주최한 멜팅 팟(Melting pot) 세미나에서 저와 황성주 교수가 발제자와 토론자로 만난 인연으로 시작됐다. KAIST가 표방하는 융합이 생화학자와 전산학자의 힘을 합쳐 이끌어 낸 좋은 연구로 큰 의미를 갖는다고 생각한다”고 강조했다.
생명과학과 김태인 석박사통합과정과 김재철AI대학원 이슬 석박사통합과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘뉴 파이톨로지스트(New Phytologist)'에 출판됐다. (논문명 : READRetro: natural product biosynthesis predicting with retrieval-augmented dual-view retrosynthesis).
한편 이번 연구는 KAIST POST-AI, 한국연구재단, 과학기술정보통신부 등의 지원을 받아 수행됐다.
2024.08.14 조회수 6076