%EB%82%98%EB%85%B8%EB%B3%B5%ED%95%A9%EC%B2%B4
-
 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 10631
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 10631 -
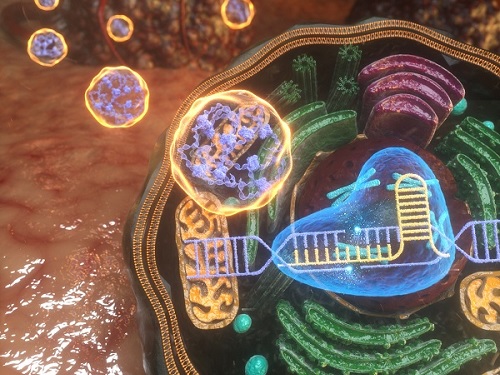 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12395
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12395 -
 빛 투과율 조절하는 능동형 광학 필름 개발
우리 대학 연구진이 기존 창호시스템을 교체하지 않고서도 투과율을 큰 폭으로 자유롭게 조절할 수 있는 에너지 절감형 스마트 윈도우 등으로 활용이 가능한 새로운 광학 필름 제작 기술을 개발했다.
우리 대학 신소재공학과 전석우 교수와 건설및환경공학과 홍정욱 교수·신소재공학과 신종화 교수 공동연구팀이 3차원 나노 복합체를 이용, 에너지의 효율적인 신축변형을 통해 세계 최고 수준의 가시광 투과율 조절이 가능한 능동형 광학 필름을 개발하는데 성공했다고 14일 밝혔다.
전석우 교수와 홍정욱 교수가 교신 저자로, 조동휘 박사과정 학생과 신라대학교 심영석 교수가 공동 1저자로 참여한 이번 연구는 재료 분야의 세계적인 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 4월 26일 字 온라인판에 게재됐다. (논문명: High-Contrast Optical Modulation from Strain-Induced Nanogaps at Three-Dimensional Heterogeneous Interfaces)
해당 연구진들은 정렬된 3차원 나노 네트워크에 기반한 신축성 나노 복합체를 이용해, 가시광 투과율을 최대 90%에서 16%까지 조절 가능한 넓은 면적의 광학 필름 제작에 필요한 원천 기술을 확보했다. 약 74%의 범위를 갖는 이는 평균적으로 46%의 범위를 가졌던 기존 2차원 필름의 수준을 훨씬 뛰어넘는 세계 최고 수준의 기술이다.
최근 제로 에너지 빌딩, 스마트 윈도우, 사생활 보호 등 에너지 저감/감성 혁신 응용에 대한 관심이 급증함에 따라, 능동형 광학 변조 기술이 주목받고 있다. 기존 외부 자극 (전기/열/빛 등)을 이용한 능동형 광학 변조 기술은 느린 반응속도와 불필요한 색 변화를 동반하고 낮은 안정성 등의 이유로 선글라스, 쇼케이스, 광고 등 매우 제한적인 분야에 적용돼왔기 때문에 현재 새로운 형태의 광학 변조 기술 개발이 활발히 진행 중이다.
에너지 효율적인 신축 변형을 이용한 광학 변조 기술은 비교적 간단한 구동 원리와 낮은 에너지 소비로 효율적으로 투과율을 제어할 수 있는 장점을 지녀 그동안 학계 및 관련 업계에서 집중적인 관심을 받아왔다. 그러나 기존 연구에서 보고된 광 산란 제어를 유도하는 구조는 대부분 광학 밀도가 낮은 2차원 표면 구조에 기반하기 때문에 좁은 투과율 변화 범위를 갖고, 물 등 외부 매질과 인접할 때 광학 변조기능을 잃는 문제를 가지고 있다. 특히, 비 정렬 구조에 바탕을 두고 있어 광학 변조 특성이 균일하지 못해서 넓은 면적으로 만들기도 힘들다.
연구팀은 정렬된 3차원 나노구조 제작에 효과적인 근접장 나노패터닝 (PnP, Proximity-field nanopatterning) 기술과 산화물 증착(증기를 표면에 얇은 막으로 입힘)을 정교하게 제어할 수 있는 원자층 증착법 (ALD, Atomic layer deposition)을 이용했다. 이에 주기적인 3차원 나노쉘 (nanoshell) 구조의 알루미나 (alumina)가 탄성중합체에 삽입된 신축성 3차원 나노복합체 필름을 현존하는 광학 변조 필름 중 가장 큰 면적인 3인치×3인치 크기로 제작하는 데 성공했다.
광학 필름을 약 60% 범위에서 당겨 늘리는 경우, 산화물과 탄성중합체의 경계면에서 발생하는 수없이 많고 작은 구멍에서 빛의 산란 현상이 발생하는데 연구진은 이를 이용해 세계 최고 수준의 가시광 투과율 조절 범위인 약 74%를 달성했다. 동시에 10,000회에 걸친 반복적인 구동 시험과 굽힘과 뒤틀림 등 거친 변형, 70℃ 이내 고온 환경에서의 구동, 물속에서의 구동 특성 등을 확인한 결과 높은 내구성과 안정성을 확인했다. 이와 함께 재료역학적‧광학적 이론 해석을 바탕으로 경계면에서 발생하는 광 산란 현상 메커니즘도 규명하는 데 성공했다.
전 교수 공동연구팀이 개발한 이 기술은 기존 창호 시스템 교체 없이도, 간단한 얇은 필름 형태로 유리 표면에 부착함으로써 투과율 조절이 가능한 에너지 절감형 스마트 윈도우로 활용이 가능하다. 이 밖에 두루마리 타입의 빔프로젝터 스크린 응용 등 감성 혁신적인 폭넓은 응용이 가능할 것으로 기대된다.
이번 연구는 한국연구재단 원천기술개발사업의 다부처 공동사업과 글로벌 프론티어 사업, 그리고 이공분야기초개발사업의 지원을 통해 수행됐다.
2020.05.14 조회수 23176
빛 투과율 조절하는 능동형 광학 필름 개발
우리 대학 연구진이 기존 창호시스템을 교체하지 않고서도 투과율을 큰 폭으로 자유롭게 조절할 수 있는 에너지 절감형 스마트 윈도우 등으로 활용이 가능한 새로운 광학 필름 제작 기술을 개발했다.
우리 대학 신소재공학과 전석우 교수와 건설및환경공학과 홍정욱 교수·신소재공학과 신종화 교수 공동연구팀이 3차원 나노 복합체를 이용, 에너지의 효율적인 신축변형을 통해 세계 최고 수준의 가시광 투과율 조절이 가능한 능동형 광학 필름을 개발하는데 성공했다고 14일 밝혔다.
전석우 교수와 홍정욱 교수가 교신 저자로, 조동휘 박사과정 학생과 신라대학교 심영석 교수가 공동 1저자로 참여한 이번 연구는 재료 분야의 세계적인 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 4월 26일 字 온라인판에 게재됐다. (논문명: High-Contrast Optical Modulation from Strain-Induced Nanogaps at Three-Dimensional Heterogeneous Interfaces)
해당 연구진들은 정렬된 3차원 나노 네트워크에 기반한 신축성 나노 복합체를 이용해, 가시광 투과율을 최대 90%에서 16%까지 조절 가능한 넓은 면적의 광학 필름 제작에 필요한 원천 기술을 확보했다. 약 74%의 범위를 갖는 이는 평균적으로 46%의 범위를 가졌던 기존 2차원 필름의 수준을 훨씬 뛰어넘는 세계 최고 수준의 기술이다.
최근 제로 에너지 빌딩, 스마트 윈도우, 사생활 보호 등 에너지 저감/감성 혁신 응용에 대한 관심이 급증함에 따라, 능동형 광학 변조 기술이 주목받고 있다. 기존 외부 자극 (전기/열/빛 등)을 이용한 능동형 광학 변조 기술은 느린 반응속도와 불필요한 색 변화를 동반하고 낮은 안정성 등의 이유로 선글라스, 쇼케이스, 광고 등 매우 제한적인 분야에 적용돼왔기 때문에 현재 새로운 형태의 광학 변조 기술 개발이 활발히 진행 중이다.
에너지 효율적인 신축 변형을 이용한 광학 변조 기술은 비교적 간단한 구동 원리와 낮은 에너지 소비로 효율적으로 투과율을 제어할 수 있는 장점을 지녀 그동안 학계 및 관련 업계에서 집중적인 관심을 받아왔다. 그러나 기존 연구에서 보고된 광 산란 제어를 유도하는 구조는 대부분 광학 밀도가 낮은 2차원 표면 구조에 기반하기 때문에 좁은 투과율 변화 범위를 갖고, 물 등 외부 매질과 인접할 때 광학 변조기능을 잃는 문제를 가지고 있다. 특히, 비 정렬 구조에 바탕을 두고 있어 광학 변조 특성이 균일하지 못해서 넓은 면적으로 만들기도 힘들다.
연구팀은 정렬된 3차원 나노구조 제작에 효과적인 근접장 나노패터닝 (PnP, Proximity-field nanopatterning) 기술과 산화물 증착(증기를 표면에 얇은 막으로 입힘)을 정교하게 제어할 수 있는 원자층 증착법 (ALD, Atomic layer deposition)을 이용했다. 이에 주기적인 3차원 나노쉘 (nanoshell) 구조의 알루미나 (alumina)가 탄성중합체에 삽입된 신축성 3차원 나노복합체 필름을 현존하는 광학 변조 필름 중 가장 큰 면적인 3인치×3인치 크기로 제작하는 데 성공했다.
광학 필름을 약 60% 범위에서 당겨 늘리는 경우, 산화물과 탄성중합체의 경계면에서 발생하는 수없이 많고 작은 구멍에서 빛의 산란 현상이 발생하는데 연구진은 이를 이용해 세계 최고 수준의 가시광 투과율 조절 범위인 약 74%를 달성했다. 동시에 10,000회에 걸친 반복적인 구동 시험과 굽힘과 뒤틀림 등 거친 변형, 70℃ 이내 고온 환경에서의 구동, 물속에서의 구동 특성 등을 확인한 결과 높은 내구성과 안정성을 확인했다. 이와 함께 재료역학적‧광학적 이론 해석을 바탕으로 경계면에서 발생하는 광 산란 현상 메커니즘도 규명하는 데 성공했다.
전 교수 공동연구팀이 개발한 이 기술은 기존 창호 시스템 교체 없이도, 간단한 얇은 필름 형태로 유리 표면에 부착함으로써 투과율 조절이 가능한 에너지 절감형 스마트 윈도우로 활용이 가능하다. 이 밖에 두루마리 타입의 빔프로젝터 스크린 응용 등 감성 혁신적인 폭넓은 응용이 가능할 것으로 기대된다.
이번 연구는 한국연구재단 원천기술개발사업의 다부처 공동사업과 글로벌 프론티어 사업, 그리고 이공분야기초개발사업의 지원을 통해 수행됐다.
2020.05.14 조회수 23176 -
 전상용 교수, 건선,아토피 치료용 펩타이드 개발
우리 대학 생명과학과 전상용 교수 연구팀이 피부 전달을 통해 건선을 치료할 수 있는 펩타이드 치료제를 개발했다.
연구팀은 수 년 전 발견한 펩타이드를 나노입자로 제작해 피부를 통해 전달함으로써 동물 모델에서 건선을 치료하는 데 성공했다.
김진용 박사가 1저자로 참여한 이번 연구는 나노분야 국제 학술지 ‘에이시에스 나노(ACS Nano)’ 6월 27일자 온라인 판에 게재됐다.(논문명 :Nanoparticle-Assisted Transcutaneous Delivery of a Signal Transducer and Activator of Transcription 3-Inhibiting Peptide Ameliorates Psoriasis-like Skin Inflammation)
건선은 대표적인 만성 염증성 피부질환으로 전 세계 성인의 약 3%가 앓고 있는 자가 면역질환 중 하나이다. 최근 건선의 원인에 STAT3라는 단백질이 핵심 역할을 한다는 사실이 밝혀졌다.
연구팀은 수 년 전 STAT3라는 단백질의 기능을 저하시킬 수 있는 펩타이드를 최초로 발견해 항암 치료제로 개발한 바 있다. 그러나 건선 피부는 각질층이 매우 두껍기 때문에 피부를 통해 펩타이드를 투과시켜 표적 약물 치료를 하는 데에는 기술적인 한계가 존재했다.
연구팀은 이번 연구에서 길이가 서로 다른 두 개의 인지질과 STAT3 억제 펩타이드가 특정 조건에서 약 30나노미터 크기의 매우 작은 원반 모양의 나노입자를 안정적으로 형성함을 발견했다.
연구팀은 특수 지질성분으로 이뤄진 제형(劑形)을 통해 수십 나노미터 크기의 원판형 나노입자로 이뤄진 STAT3 억제용 펩타이드를 제조했다.
연구팀이 개발한 STAT3 억제 펩타이드는 건선 피부를 가진 동물 모델에 투여했을 때 뛰어난 항염증 효과를 보였고, 건선 발병의 핵심 요소인 각질세포의 과증식과 염증성 싸이토카인인 IL-17 등의 분비를 막는 역할을 했다.
연구팀은 의과학대학원 김필한 교수와의 공동 연구를 통해 펩타이드가 피부 속으로 얼마나 깊이 투과되는지 관찰했고, 이를 통해 나노입자가 각질층을 통과해 진피층 상부까지 전달됨을 확인했다.
전상용 교수는 “STAT3 억제 앱타이드가 난치성 염증성 피부질환인 건선에 대해 우수한 치료 효과를 보이는 바이오 신약 후보물질이 될 수 있음을 확인했다.”며 “효율적인 피부 전달이 가능한 시스템을 구축했다는 점에서 큰 의미가 있으며 향후 임상 적용이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌연구실사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 앱타이드-지질 나노복합체의 건선 유발 생쥐 귀 모델에서의 치료효능 평가
그림2. 앱타이드-지질 나노복합체의 건선 유발 생쥐모델에서의 피부투과 효능 평가
2018.07.17 조회수 19142
전상용 교수, 건선,아토피 치료용 펩타이드 개발
우리 대학 생명과학과 전상용 교수 연구팀이 피부 전달을 통해 건선을 치료할 수 있는 펩타이드 치료제를 개발했다.
연구팀은 수 년 전 발견한 펩타이드를 나노입자로 제작해 피부를 통해 전달함으로써 동물 모델에서 건선을 치료하는 데 성공했다.
김진용 박사가 1저자로 참여한 이번 연구는 나노분야 국제 학술지 ‘에이시에스 나노(ACS Nano)’ 6월 27일자 온라인 판에 게재됐다.(논문명 :Nanoparticle-Assisted Transcutaneous Delivery of a Signal Transducer and Activator of Transcription 3-Inhibiting Peptide Ameliorates Psoriasis-like Skin Inflammation)
건선은 대표적인 만성 염증성 피부질환으로 전 세계 성인의 약 3%가 앓고 있는 자가 면역질환 중 하나이다. 최근 건선의 원인에 STAT3라는 단백질이 핵심 역할을 한다는 사실이 밝혀졌다.
연구팀은 수 년 전 STAT3라는 단백질의 기능을 저하시킬 수 있는 펩타이드를 최초로 발견해 항암 치료제로 개발한 바 있다. 그러나 건선 피부는 각질층이 매우 두껍기 때문에 피부를 통해 펩타이드를 투과시켜 표적 약물 치료를 하는 데에는 기술적인 한계가 존재했다.
연구팀은 이번 연구에서 길이가 서로 다른 두 개의 인지질과 STAT3 억제 펩타이드가 특정 조건에서 약 30나노미터 크기의 매우 작은 원반 모양의 나노입자를 안정적으로 형성함을 발견했다.
연구팀은 특수 지질성분으로 이뤄진 제형(劑形)을 통해 수십 나노미터 크기의 원판형 나노입자로 이뤄진 STAT3 억제용 펩타이드를 제조했다.
연구팀이 개발한 STAT3 억제 펩타이드는 건선 피부를 가진 동물 모델에 투여했을 때 뛰어난 항염증 효과를 보였고, 건선 발병의 핵심 요소인 각질세포의 과증식과 염증성 싸이토카인인 IL-17 등의 분비를 막는 역할을 했다.
연구팀은 의과학대학원 김필한 교수와의 공동 연구를 통해 펩타이드가 피부 속으로 얼마나 깊이 투과되는지 관찰했고, 이를 통해 나노입자가 각질층을 통과해 진피층 상부까지 전달됨을 확인했다.
전상용 교수는 “STAT3 억제 앱타이드가 난치성 염증성 피부질환인 건선에 대해 우수한 치료 효과를 보이는 바이오 신약 후보물질이 될 수 있음을 확인했다.”며 “효율적인 피부 전달이 가능한 시스템을 구축했다는 점에서 큰 의미가 있으며 향후 임상 적용이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌연구실사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 앱타이드-지질 나노복합체의 건선 유발 생쥐 귀 모델에서의 치료효능 평가
그림2. 앱타이드-지질 나노복합체의 건선 유발 생쥐모델에서의 피부투과 효능 평가
2018.07.17 조회수 19142