%EB%A6%AC%EA%B0%84%EB%93%9C
-
 메타버스 시대 이끌 초고해상도 화면 구현 패터닝 기술 개발
생동감 있는 색상, 높은 효율과 긴 수명을 자랑하는 양자점(Quantum Dot) 기반 디스플레이가 주목받고 있다. 특히, 친환경 인듐 포스파이드(InP) 양자점은 현재 TV와 스마트폰을 비롯한 다양한 디스플레이에 폭넓게 활용되고 있다. 그러나 다가오는 메타버스 시대를 현실감 있게 구현하기 위한 디스플레이 구현을 위해서는 초고해상도 양자점 패턴 제작 기술의 개발이 필수적이다.
우리 대학 신소재공학과 조힘찬 교수 연구팀이 신규 양자점 리간드*를 개발하여 InP 양자점의 초고해상도 패턴을 형성하는 동시에 소자 효율을 향상시키는 신기술을 개발했다고 13일 밝혔다.
*리간드: 양자점 표면에 결합하여 양자점을 보호하고 계면활성제 역할을 하는 물질.
InP 양자점은 외부 환경에 민감하여 패턴 형성 공정 중 광학적 특성이 크게 저하되는 한계가 있었다. 또한, 디스플레이 효율에 직결되는 리간드를 조절하는 과정에서도 광학적 특성이 손상되는 문제가 있었다. 따라서, 소재 고유의 특성을 유지하면서 초고해상도 패턴을 구현하고, 소자의 효율까지 높일 수 있는 기술 개발은 큰 도전 과제로 남아 있다.
이에, 조힘찬 교수 연구팀은 양자점의 광학적 특성을 보존하는 동시에 초고해상도 패턴 구현을 가능하게 하는 리간드를 개발하였다. 개발된 리간드는 빛에 의해 절단되어 길이가 짧아지는 특성을 보이는 물질로, 양자점 표면이 변화하면서 용해도 차이가 생겨 패턴 형성이 가능해지는 원리이다. 더불어 짧아진 리간드는 소자에서의 전기 전도도를 증가시켜 향상된 효율의 디스플레이를 구현할 수 있었다.
조힘찬 교수는 “이번에 개발한 광민감성 양자점 소재와 패터닝 기술은 기존 기술과 달리 초고해상도 패턴 제작과 양자점 박막의 전기 전도도 향상을 동시에 달성하여 차세대 양자점 LED 기반 디스플레이, 양자점 이미지 센서 등 다양한 미래 산업 분야에 실질적으로 적용될 수 있을 것으로 기대된다”라고 언급했다.
연구팀의 이재환 박사과정, 연성범 석박사통합과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘에이씨에스 에너지 레터스 (ACS Energy Letters)’에 12월 13일 온라인 게재됐으며, 1월 호 부록 표지(Supplementary Cover)로 출판될 예정이다.(논문명: Photocleavable Ligand-Induced Direct Photolithography of InP-Based Quantum Dots).
한편 이번 연구는 한국연구재단 및 중소벤처기업부의 지원을 받아 수행됐다.
2024.12.18 조회수 4860
메타버스 시대 이끌 초고해상도 화면 구현 패터닝 기술 개발
생동감 있는 색상, 높은 효율과 긴 수명을 자랑하는 양자점(Quantum Dot) 기반 디스플레이가 주목받고 있다. 특히, 친환경 인듐 포스파이드(InP) 양자점은 현재 TV와 스마트폰을 비롯한 다양한 디스플레이에 폭넓게 활용되고 있다. 그러나 다가오는 메타버스 시대를 현실감 있게 구현하기 위한 디스플레이 구현을 위해서는 초고해상도 양자점 패턴 제작 기술의 개발이 필수적이다.
우리 대학 신소재공학과 조힘찬 교수 연구팀이 신규 양자점 리간드*를 개발하여 InP 양자점의 초고해상도 패턴을 형성하는 동시에 소자 효율을 향상시키는 신기술을 개발했다고 13일 밝혔다.
*리간드: 양자점 표면에 결합하여 양자점을 보호하고 계면활성제 역할을 하는 물질.
InP 양자점은 외부 환경에 민감하여 패턴 형성 공정 중 광학적 특성이 크게 저하되는 한계가 있었다. 또한, 디스플레이 효율에 직결되는 리간드를 조절하는 과정에서도 광학적 특성이 손상되는 문제가 있었다. 따라서, 소재 고유의 특성을 유지하면서 초고해상도 패턴을 구현하고, 소자의 효율까지 높일 수 있는 기술 개발은 큰 도전 과제로 남아 있다.
이에, 조힘찬 교수 연구팀은 양자점의 광학적 특성을 보존하는 동시에 초고해상도 패턴 구현을 가능하게 하는 리간드를 개발하였다. 개발된 리간드는 빛에 의해 절단되어 길이가 짧아지는 특성을 보이는 물질로, 양자점 표면이 변화하면서 용해도 차이가 생겨 패턴 형성이 가능해지는 원리이다. 더불어 짧아진 리간드는 소자에서의 전기 전도도를 증가시켜 향상된 효율의 디스플레이를 구현할 수 있었다.
조힘찬 교수는 “이번에 개발한 광민감성 양자점 소재와 패터닝 기술은 기존 기술과 달리 초고해상도 패턴 제작과 양자점 박막의 전기 전도도 향상을 동시에 달성하여 차세대 양자점 LED 기반 디스플레이, 양자점 이미지 센서 등 다양한 미래 산업 분야에 실질적으로 적용될 수 있을 것으로 기대된다”라고 언급했다.
연구팀의 이재환 박사과정, 연성범 석박사통합과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘에이씨에스 에너지 레터스 (ACS Energy Letters)’에 12월 13일 온라인 게재됐으며, 1월 호 부록 표지(Supplementary Cover)로 출판될 예정이다.(논문명: Photocleavable Ligand-Induced Direct Photolithography of InP-Based Quantum Dots).
한편 이번 연구는 한국연구재단 및 중소벤처기업부의 지원을 받아 수행됐다.
2024.12.18 조회수 4860 -
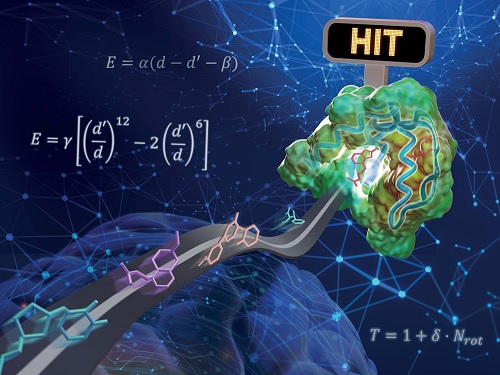 실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
2022.05.17 조회수 16187
실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
2022.05.17 조회수 16187 -
 원자 단층 촬영 기술로 나노입자 표면 리간드 분자의 3차원 분포 규명
우리 대학 신소재공학과 최벽파 교수 연구팀이 이화여자대학교 화학신소재공학과 이상헌 교수 연구팀과 공동연구를 통해 원자 단층 촬영 기술을 활용해 나노입자 표면에 존재하는 리간드 분자의 3차원 분포를 최초로 규명했다고 9일 밝혔다.
리간드(Capping ligand)는 금속 나노입자 합성 시 발생하는 유기 분자로서, 입자 간 응집을 방지할 뿐만 아니라 입자의 형태와 각종 특성까지 조절한다는 사실이 밝혀지며 나노입자의 합성 및 설계에 있어 그 중요성이 점점 더 커지고 있다.
신소재공학과 장규선 박사과정과 독일 막스 플랑크 연구소 김세호 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 커뮤니케이션즈(Nature Communications, IF: 14.919)' 7월 14일 字 온라인판에 게재됐다. (논문명: Three-dimensional atomic mapping of ligands on palladium nanoparticles by atom probe tomography)
복잡한 구조의 유기 분자로 이루어진 리간드의 공간적 분포를 분석하기 위해서는 원자단위의 공간 분해능과 경량 원소에 대한 높은 검출 민감도를 가지며 3차원 분석이 가능한 기술이 필요하다. 이러한 분석 기술의 부재로 인해 현재까지 나노입자 표면에 존재하는 리간드 분포를 3차원에서 관찰한 사례는 존재하지 않으며, 이로 인해 입자 합성과정에서 리간드의 거동은 상당 부분 미지의 영역으로 남아있다. 예를 들어, 할라이드 리간드인 브롬(Br) 이온의 경우 정육면체 형태의 금속 나노입자 형성을 촉진하는 것으로 알려져 있으나, 여러 논문에서 이와 다른 결과를 보고하고 있다.
최벽파 교수 연구팀은 원자 단층 촬영 현미경(Atom probe tomography)을 활용해 서로 다른 할라이드 리간드를 통해 합성된 두 종류의 팔라듐 나노입자 표면에 존재하는 세트리모늄 리간드(Cetrimonium chloride)의 3차원 분포를 원자단위에서 관찰하는 데 성공했다.
원자 단층 촬영 현미경은 아주 얇은 바늘 모양으로 가공된 시편 표면의 원자들을 고전압 또는 고에너지 펄스를 가해 차례차례 증발시켜 검출기에 충돌시키고, 검출기에 기록된 원자의 충돌 위치와 충돌 순서, 그리고 충돌 원자의 질량 대 전하 비를 이용해 시편의 3차원 원자 분포를 재구성하는 분석 기술이다.
이러한 원자 단층 촬영 기술은 3차원 원자단위 분석 및 화학적 정량 분석이 가능할 뿐 아니라, 옹스트롬(100억 분의 1미터) 단위의 공간 분해능과 모든 원소에 대해 동일한 ppm 단위의 우수한 검출 감도를 갖고 있어 최근 재료 분석 분야에서 큰 주목을 받고 있다.
연구팀은 리간드의 3차원 분포에 대한 단층 촬영 데이터로부터 각각의 나노입자 표면에 존재하는 세트리모늄 리간드의 밀도를 계산했다. 이를 통해 연구진은 세트리모늄 리간드와 할라이드 리간드 사이에 기존에 알려지지 않았던 상호작용이 존재하며, 이러한 서로 다른 리간드 사이의 상호작용이 나노입자의 최종 형태와 산화 저항 특성을 결정할 뿐 아니라 기존의 연구 결과들이 합치되지 않았던 원인이었음을 규명했다.
최벽파 교수는 "이번 연구는 기존에 상반됐던 연구 결과들을 모두 포용할 수 있는 실험적, 이론적 결과를 제시했다는 점에서 의의가 있다ˮ며, "해당 연구를 통해 얻은 결과는 나노입자 합성에 대한 근본적인 이해를 높이고, 우수한 특성을 가진 나노입자를 설계하는데 응용될 수 있으리라 기대한다ˮ고 밝혔다.
한편 이번 연구는 한국연구재단 과학기술분야 기초연구사업인 중견연구자지원사업의 지원을 통해 수행됐다.
2021.08.10 조회수 14890
원자 단층 촬영 기술로 나노입자 표면 리간드 분자의 3차원 분포 규명
우리 대학 신소재공학과 최벽파 교수 연구팀이 이화여자대학교 화학신소재공학과 이상헌 교수 연구팀과 공동연구를 통해 원자 단층 촬영 기술을 활용해 나노입자 표면에 존재하는 리간드 분자의 3차원 분포를 최초로 규명했다고 9일 밝혔다.
리간드(Capping ligand)는 금속 나노입자 합성 시 발생하는 유기 분자로서, 입자 간 응집을 방지할 뿐만 아니라 입자의 형태와 각종 특성까지 조절한다는 사실이 밝혀지며 나노입자의 합성 및 설계에 있어 그 중요성이 점점 더 커지고 있다.
신소재공학과 장규선 박사과정과 독일 막스 플랑크 연구소 김세호 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 커뮤니케이션즈(Nature Communications, IF: 14.919)' 7월 14일 字 온라인판에 게재됐다. (논문명: Three-dimensional atomic mapping of ligands on palladium nanoparticles by atom probe tomography)
복잡한 구조의 유기 분자로 이루어진 리간드의 공간적 분포를 분석하기 위해서는 원자단위의 공간 분해능과 경량 원소에 대한 높은 검출 민감도를 가지며 3차원 분석이 가능한 기술이 필요하다. 이러한 분석 기술의 부재로 인해 현재까지 나노입자 표면에 존재하는 리간드 분포를 3차원에서 관찰한 사례는 존재하지 않으며, 이로 인해 입자 합성과정에서 리간드의 거동은 상당 부분 미지의 영역으로 남아있다. 예를 들어, 할라이드 리간드인 브롬(Br) 이온의 경우 정육면체 형태의 금속 나노입자 형성을 촉진하는 것으로 알려져 있으나, 여러 논문에서 이와 다른 결과를 보고하고 있다.
최벽파 교수 연구팀은 원자 단층 촬영 현미경(Atom probe tomography)을 활용해 서로 다른 할라이드 리간드를 통해 합성된 두 종류의 팔라듐 나노입자 표면에 존재하는 세트리모늄 리간드(Cetrimonium chloride)의 3차원 분포를 원자단위에서 관찰하는 데 성공했다.
원자 단층 촬영 현미경은 아주 얇은 바늘 모양으로 가공된 시편 표면의 원자들을 고전압 또는 고에너지 펄스를 가해 차례차례 증발시켜 검출기에 충돌시키고, 검출기에 기록된 원자의 충돌 위치와 충돌 순서, 그리고 충돌 원자의 질량 대 전하 비를 이용해 시편의 3차원 원자 분포를 재구성하는 분석 기술이다.
이러한 원자 단층 촬영 기술은 3차원 원자단위 분석 및 화학적 정량 분석이 가능할 뿐 아니라, 옹스트롬(100억 분의 1미터) 단위의 공간 분해능과 모든 원소에 대해 동일한 ppm 단위의 우수한 검출 감도를 갖고 있어 최근 재료 분석 분야에서 큰 주목을 받고 있다.
연구팀은 리간드의 3차원 분포에 대한 단층 촬영 데이터로부터 각각의 나노입자 표면에 존재하는 세트리모늄 리간드의 밀도를 계산했다. 이를 통해 연구진은 세트리모늄 리간드와 할라이드 리간드 사이에 기존에 알려지지 않았던 상호작용이 존재하며, 이러한 서로 다른 리간드 사이의 상호작용이 나노입자의 최종 형태와 산화 저항 특성을 결정할 뿐 아니라 기존의 연구 결과들이 합치되지 않았던 원인이었음을 규명했다.
최벽파 교수는 "이번 연구는 기존에 상반됐던 연구 결과들을 모두 포용할 수 있는 실험적, 이론적 결과를 제시했다는 점에서 의의가 있다ˮ며, "해당 연구를 통해 얻은 결과는 나노입자 합성에 대한 근본적인 이해를 높이고, 우수한 특성을 가진 나노입자를 설계하는데 응용될 수 있으리라 기대한다ˮ고 밝혔다.
한편 이번 연구는 한국연구재단 과학기술분야 기초연구사업인 중견연구자지원사업의 지원을 통해 수행됐다.
2021.08.10 조회수 14890 -
 김지한 교수, 다공성 물질 내 가스 흡착량 증진 가능성 제시
〈 김 지 한 교수, 정 상 규 석사과정 〉
우리 대학 생명화학공학과 김지한 교수 연구팀이 결함공학을 통한 다공성 물질의 가스 흡착량 증진법을 개발했다.
정상규 석사과정이 1저자, UC 버클리 화학과의 Günther Thiele 박사후 연구원이 2저자로 참여한 이번 연구는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’11월 16일차 온라인 판에 게재됐다.
금속-유기 구조체(metal-organic framework, 이하 MOF)는 금속 클러스터와 유기 리간드의 규칙적인 배위결합을 통해 합성되는 결정체이며, 넓은 표면적과 수많은 공극을 지닌 물질로서 다양한 에너지 및 환경 관련 소재로 각광받고 있다.
하지만 다른 결정성 물질들과 마찬가지로 실제 MOF는 완벽한 결정성을 가질 수 없으며 여러 종류의 결함을 가지게 된다.
이러한 결함들 중 결정체 내 유기 리간드가 불규칙적으로 본래 자리에 결합되지 않은 상태를 뜻하는 리간드 공공결함은 실험적인 기법들을 통해 공공결함의 밀도가 조절될 수 있다고 알려져 있다.
연구팀은 기존 제시된 리간드 공공결함의 조절을 통한 결함 공학 기법을 특정 MOF 내 고립된 공극의 존재여부와 접목시켜 결함공학을 통한 가스 흡착 증진 가능성을 제시했다.
김지한 교수가 직접 개발한 그래픽 프로세서(GPU) 소프트웨어 코드로 초고속 스크리닝 기법을 활용해 실험적으로 합성된 12,000 가량의 MOF들로 부터 메탄 가스에 대해 상당한 부피의 고립공극을 가지는 MOF들을 계산적으로 선별했다.
고립 공극의 판별 작업에는 안정적 에너지 구간에 대한 플러드-필(flood-fill) 알고리즘이 사용됐으며 이는 마이크로소프트 그림판에서 흔히 접할 수 있는 ‘색 채우기’ 기능과 동일한 알고리즘이다. 이를 통해 무한히 연결된 주 공극구조만 판별해내고 연결되지 않고 고립돼 존재하는 공극의 존재여부를 판단했다.
이후 많은 양의 고립공극이 파악된 MOF들에 대해 리간드 공공결함을 가상으로 결정 구조 내 도입했으며 리간드가 없어지면서 기존의 고립돼 존재하던 공극들이 주 공극구조와 합쳐지도록 유도했다.
이러한 스크리닝 작업을 통해 연구팀은 리간드 공공결함이 도입되었을 시 상당한 메탄 가스의 흡착량 증진을 겪을 수 있는 13개의 MOF를 최종적으로 선별했으며, 불과 8.33% 이하의 리간드 결함이 존재했을 시에도 최대 55.6% 의 메탄 가스 흡착량 증진을 가질 수 있다는 것을 확인했다.
본 연구팀이 제시한 리간드 공공결함을 통해 기존에 활용되지 못하던 고립 공극을 주 공극구조에 연결시켜 새로이 활용하는 기법은 단순한 가스 흡착량 증진 외에도 혼합 가스의 선택적 흡착, 반 영구적 가스 포획 등 다양한 효과를 가져올 수 있다.
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 플러드-필 알고리즘을 설명하는 도해와 플러드-필 알고리즙을 통해 고립공극이 판별된 MOF의 예시
그림2. 본 연구에서 선별된 MOF 중 두 가지 MOF의 공공결함 도입 전과 후(좌, 우)의 흡착가능 공간 비교
2017.11.27 조회수 20347
김지한 교수, 다공성 물질 내 가스 흡착량 증진 가능성 제시
〈 김 지 한 교수, 정 상 규 석사과정 〉
우리 대학 생명화학공학과 김지한 교수 연구팀이 결함공학을 통한 다공성 물질의 가스 흡착량 증진법을 개발했다.
정상규 석사과정이 1저자, UC 버클리 화학과의 Günther Thiele 박사후 연구원이 2저자로 참여한 이번 연구는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’11월 16일차 온라인 판에 게재됐다.
금속-유기 구조체(metal-organic framework, 이하 MOF)는 금속 클러스터와 유기 리간드의 규칙적인 배위결합을 통해 합성되는 결정체이며, 넓은 표면적과 수많은 공극을 지닌 물질로서 다양한 에너지 및 환경 관련 소재로 각광받고 있다.
하지만 다른 결정성 물질들과 마찬가지로 실제 MOF는 완벽한 결정성을 가질 수 없으며 여러 종류의 결함을 가지게 된다.
이러한 결함들 중 결정체 내 유기 리간드가 불규칙적으로 본래 자리에 결합되지 않은 상태를 뜻하는 리간드 공공결함은 실험적인 기법들을 통해 공공결함의 밀도가 조절될 수 있다고 알려져 있다.
연구팀은 기존 제시된 리간드 공공결함의 조절을 통한 결함 공학 기법을 특정 MOF 내 고립된 공극의 존재여부와 접목시켜 결함공학을 통한 가스 흡착 증진 가능성을 제시했다.
김지한 교수가 직접 개발한 그래픽 프로세서(GPU) 소프트웨어 코드로 초고속 스크리닝 기법을 활용해 실험적으로 합성된 12,000 가량의 MOF들로 부터 메탄 가스에 대해 상당한 부피의 고립공극을 가지는 MOF들을 계산적으로 선별했다.
고립 공극의 판별 작업에는 안정적 에너지 구간에 대한 플러드-필(flood-fill) 알고리즘이 사용됐으며 이는 마이크로소프트 그림판에서 흔히 접할 수 있는 ‘색 채우기’ 기능과 동일한 알고리즘이다. 이를 통해 무한히 연결된 주 공극구조만 판별해내고 연결되지 않고 고립돼 존재하는 공극의 존재여부를 판단했다.
이후 많은 양의 고립공극이 파악된 MOF들에 대해 리간드 공공결함을 가상으로 결정 구조 내 도입했으며 리간드가 없어지면서 기존의 고립돼 존재하던 공극들이 주 공극구조와 합쳐지도록 유도했다.
이러한 스크리닝 작업을 통해 연구팀은 리간드 공공결함이 도입되었을 시 상당한 메탄 가스의 흡착량 증진을 겪을 수 있는 13개의 MOF를 최종적으로 선별했으며, 불과 8.33% 이하의 리간드 결함이 존재했을 시에도 최대 55.6% 의 메탄 가스 흡착량 증진을 가질 수 있다는 것을 확인했다.
본 연구팀이 제시한 리간드 공공결함을 통해 기존에 활용되지 못하던 고립 공극을 주 공극구조에 연결시켜 새로이 활용하는 기법은 단순한 가스 흡착량 증진 외에도 혼합 가스의 선택적 흡착, 반 영구적 가스 포획 등 다양한 효과를 가져올 수 있다.
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 본 연구에서 사용된 플러드-필 알고리즘을 설명하는 도해와 플러드-필 알고리즙을 통해 고립공극이 판별된 MOF의 예시
그림2. 본 연구에서 선별된 MOF 중 두 가지 MOF의 공공결함 도입 전과 후(좌, 우)의 흡착가능 공간 비교
2017.11.27 조회수 20347 -
 생명과학과 김재섭 교수팀, '생체시계 뇌신경망 교신 유전자'세계최초로 밝혀
2만5천여 종의 형질전환 초파리 이용, 새로운 생체시계 유전자 발견
수면장애, 생체리듬 장애로 인한 각종 생리질환 치료법 개발 활로 열어
우리 몸은 하루 24시간의 시각 주기를 기억해서 현재 시각이 아침인지 저녁인지 혹은 낮인지 밤인지를 스스로 아는 능력이 있다. 한국에 살던 사람이 미국에 가면 한국에서 기억된 시각주기 때문에 처음 며칠 동안은 밤에는 깨어 있다가 낮이 되면 졸리고 하는 것이 그 일예이다. 우리 몸이 이렇게 하루 24시간 주기의 시간 흐름을 아는 것은 대뇌 아래 시상하부에 존재하는 일부 신경세포가 시계의 기능을 하기 때문인데, 이 시계를 “생체시계”라고 부른다. 정상적으로 생활하던 사람을 하루 종일 어두운 곳에 두어도 아침 시간이 되면 잠에서 깨고, 끼니마다 배가 고파지며, 또 밤 시간이 되면 잠을 자는 이유도 이 생체시계 때문이다.
생체시계의 역할은 시상하부에 위치한 수십 개의 신경세포가 담당한다. 이 생체시계 신경세포 각각의 내부에서 작동하는 유전자들은 그 동안 잘 알려져 있었다. 그러나 정작 각각의 생체시계 신경세포가 어떻게 서로 교신하여 하나의 완벽하고 정교한 생체시계 신경망을 이루어 우리 몸의 시간을 지배하는 지는 베일에 쌓여 있었다. KAIST 생명과학과 김재섭(金在燮, 42) 교수팀이 바이오벤처 제넥셀과의 공동연구로 이번에 그 베일을 세계 최초로 벗겼다.
金 교수팀은 제넥셀이 구축한 2만5천여 종의 형질전환 초파리를 이용, 새로운 생체시계 유전자를 발견하였으며, 그 이름을 “한(Han)"이라고 명명하였다. 金 교수팀에 따르면 “한” 유전자로부터 만들어지는 단백질은 "피디에프(PDF)"라는 리간드 단백질의 수용체로 작용하며, 생체시계 신경 세포들의 표면에 존재한다. 생체시계 신경세포 중에서 마스터(master) 생체시계 신경세포가 하루 24시간의 주기에 따라 각기 다른 양의 “피디에프”를 분비한다. 그러면 뇌의 다른 부위에 존재하는 생체시계 신경세포들은 표면에 있는 “한” 수용체 단백질을 통해 이 신호를 받아서 자기의 생체시계 작동을 마스터 신경세포의 생체시계 시각과 동조화 시킨다. 이렇게 해서 생체시계 신경망을 담당하는 모든 신경세포들 안에 있는 생체시계는 동일한 시각으로 맞춰지게 된다. 즉, “피디에프”와 “한” 단백질을 이용한 생체시계 신경세포들 사이의 교신이 정확하게 이뤄져 생체시계의 시각 결정을 담당하는 모든 신경세포가 특정 시간을 모두 동일한 시간으로 인식하여 일사 분란하게 몸을 조절하는 것이다. 金 교수팀의 이번 연구결과는 뉴론(Neuron)誌 10월호(10.20 발행)에 게재된다. 뉴론誌는 셀지의 자매지로서 네이처 뉴로사이언스와 쌍벽을 이루는 신경과학 분야의 최고 권위지다.
김재섭 교수는 "학문적으로는 생체시계를 담당하는 뇌신경들이 어떻게 서로 교신 하는 지를 알 수 있게 되었으며, 의학적으로는 수면 장애와 생체리듬 장애로 인한 각종 생리 질환 치료법 개발에 새로운 길을 열게 되었다"고 이번 연구 성과의 의의를 밝혔다.
2005.10.20 조회수 21607
생명과학과 김재섭 교수팀, '생체시계 뇌신경망 교신 유전자'세계최초로 밝혀
2만5천여 종의 형질전환 초파리 이용, 새로운 생체시계 유전자 발견
수면장애, 생체리듬 장애로 인한 각종 생리질환 치료법 개발 활로 열어
우리 몸은 하루 24시간의 시각 주기를 기억해서 현재 시각이 아침인지 저녁인지 혹은 낮인지 밤인지를 스스로 아는 능력이 있다. 한국에 살던 사람이 미국에 가면 한국에서 기억된 시각주기 때문에 처음 며칠 동안은 밤에는 깨어 있다가 낮이 되면 졸리고 하는 것이 그 일예이다. 우리 몸이 이렇게 하루 24시간 주기의 시간 흐름을 아는 것은 대뇌 아래 시상하부에 존재하는 일부 신경세포가 시계의 기능을 하기 때문인데, 이 시계를 “생체시계”라고 부른다. 정상적으로 생활하던 사람을 하루 종일 어두운 곳에 두어도 아침 시간이 되면 잠에서 깨고, 끼니마다 배가 고파지며, 또 밤 시간이 되면 잠을 자는 이유도 이 생체시계 때문이다.
생체시계의 역할은 시상하부에 위치한 수십 개의 신경세포가 담당한다. 이 생체시계 신경세포 각각의 내부에서 작동하는 유전자들은 그 동안 잘 알려져 있었다. 그러나 정작 각각의 생체시계 신경세포가 어떻게 서로 교신하여 하나의 완벽하고 정교한 생체시계 신경망을 이루어 우리 몸의 시간을 지배하는 지는 베일에 쌓여 있었다. KAIST 생명과학과 김재섭(金在燮, 42) 교수팀이 바이오벤처 제넥셀과의 공동연구로 이번에 그 베일을 세계 최초로 벗겼다.
金 교수팀은 제넥셀이 구축한 2만5천여 종의 형질전환 초파리를 이용, 새로운 생체시계 유전자를 발견하였으며, 그 이름을 “한(Han)"이라고 명명하였다. 金 교수팀에 따르면 “한” 유전자로부터 만들어지는 단백질은 "피디에프(PDF)"라는 리간드 단백질의 수용체로 작용하며, 생체시계 신경 세포들의 표면에 존재한다. 생체시계 신경세포 중에서 마스터(master) 생체시계 신경세포가 하루 24시간의 주기에 따라 각기 다른 양의 “피디에프”를 분비한다. 그러면 뇌의 다른 부위에 존재하는 생체시계 신경세포들은 표면에 있는 “한” 수용체 단백질을 통해 이 신호를 받아서 자기의 생체시계 작동을 마스터 신경세포의 생체시계 시각과 동조화 시킨다. 이렇게 해서 생체시계 신경망을 담당하는 모든 신경세포들 안에 있는 생체시계는 동일한 시각으로 맞춰지게 된다. 즉, “피디에프”와 “한” 단백질을 이용한 생체시계 신경세포들 사이의 교신이 정확하게 이뤄져 생체시계의 시각 결정을 담당하는 모든 신경세포가 특정 시간을 모두 동일한 시간으로 인식하여 일사 분란하게 몸을 조절하는 것이다. 金 교수팀의 이번 연구결과는 뉴론(Neuron)誌 10월호(10.20 발행)에 게재된다. 뉴론誌는 셀지의 자매지로서 네이처 뉴로사이언스와 쌍벽을 이루는 신경과학 분야의 최고 권위지다.
김재섭 교수는 "학문적으로는 생체시계를 담당하는 뇌신경들이 어떻게 서로 교신 하는 지를 알 수 있게 되었으며, 의학적으로는 수면 장애와 생체리듬 장애로 인한 각종 생리 질환 치료법 개발에 새로운 길을 열게 되었다"고 이번 연구 성과의 의의를 밝혔다.
2005.10.20 조회수 21607