-
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01
조회수 667
-
 바이러스 면역반응‘켰다 껐다’단백질 스위치 발견
팬데믹 이후에도 다양한 신종 감염병이 출현하며 우리는 여전히 강력하고 지속적인 면역 방어를 요구하는 바이러스 위협에 직면해 있다. 동시에 과잉으로 면역 체계가 반응하면 오히려 몸의 조직을 해치는 부작용이 생기기도 한다. KAIST·국제 연구진이 이런 바이러스에 면역 반응을 조절하는 스위치 역할의 단백질을 찾아내는데 성공했다. 향후 감염병 대응과 자가면역질환 치료의 새로운 기반을 마련할 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 미국 플로리다주립대 차승희 교수 공동 연구팀이 세포 내 미토콘드리아에서 유래한 이중나선 RNA가 면역반응을 증폭시키는 메커니즘을 규명하고, 이를 조절하는 단백질 슬러프(SLIRP)가 바이러스 감염과 자가면역질환 양쪽에서 ‘면역 스위치’ 역할을 수행하는 것을 밝혀냈다.
자가면역질환은 면역 체계가 외부 침입자와 자기 조직을 구분하지 못하고 스스로를 공격하는 질환으로, 쉐그렌 증후군, 전신홍반루푸스 등으로 아직 명확한 발병 원인도 밝혀지지 않고, 효과적인 치료제도 드물다.
따라서 면역 과활성화를 유도하는 분자적 기전을 규명하고, 이를 조절할 수 있는 인자를 찾아내고자 생명화학공학과 김유식 교수 연구팀은 세포 내 기관에서 만들어지는 유전물질인 미토콘드리아 이중나선 RNA (mitochondrial double-stranded RNA, 이하 mt-dsRNA)에 주목했다.
엠티 디에스알엔에이(mt-dsRNA)는 바이러스 RNA와 유사하여 감염 바이러스가 없어도 우리 몸에서는 바이러스로 착각하고 면역반응을 유도할 수 있다는 점에 착안했다.
연구진은 면역 반응을 증폭시키는 단백질 슬러프를 발견하였고 실제로 다양한 자가면역질환 환자의 조직과 바이러스 자극을 모사한 실험 모델에서 슬러프 발현이 증가하는 것으로 확인했고, 반대로 슬러프를 억제했을 때는 면역반응이 현저히 감소되는것을 확인했다.
실험 결과, 슬러프가 면역 증폭의 핵심 인자임을 입증했고, 슬러프 단백질이 mt-dsRNA를 안정화시키고 축적시키는 역할을 하여, 이로 인해 면역반응이 증폭된다는 사실을 알아냈다.
이번 연구는 슬러프 단백질의 기능을 바이러스 감염 및 자가면역질환이라는 상반된 환경에서도 검증했다. 인간 베타 코로나바이러스 OC43과 뇌심근염 바이러스 EMCV에 감염된 세포에서 슬러프를 억제했을 때 항바이러스 반응이 감소하고, 바이러스 복제가 증가함을 확인했다.
반면, 대표적인 자가면역질환인 쉐그렌 증후군 환자의 혈액과 침샘 세포에서는 슬러프와 엠티 디에스알엔에이의 발현이 높게 나타났고, 슬러프를 억제했을 때 비정상적인 면역반응이 완화되는 경향도 관찰되었다.
이는 슬러프가 감염과 자가면역질환 모두에서 면역반응을 조절하는 중요한 분자 스위치라는 사실음 뒷받침한다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 슬러프 단백질이 엠티 디에스알엔에이(mt-dsRNA)를 기반으로 면역반응의 증폭을 유도하는 핵심 인자임을 규명했다ˮ면서 "특히, 슬러프가 자가면역질환과 바이러스 감염에서 공통적으로 작동하는 면역 조절자라는 점에서, 슬러프를 타깃으로 한 면역 균형 조절 전략이 다양한 질환에 적용될 수 있을 것으로 기대된다ˮ라고 말했다.
생명화학공학과 박사과정 구도영(제1저자), 석사과정 양예원 학생(제2저자)이 참여한 이번 연구는 국제학술지 `셀 리포츠 (Cell Reports)'에 지난 4월 19일 온라인 게재됐다.
※ 논문명 : SLIRP amplifies antiviral signaling via positive feedback regulation and contributes to autoimmune diseases https://doi.org/10.1016/j.celrep.2025.115588
※ 주저자: 구도영(KAIST, 제1저자), 양예원(KAIST, 제2저자), 차승희(플로리다 주립대, 교신저자), 김유식(KAIST, 교신저자)
이번 연구는 보건복지부의 공익적 의료기술연구사업과 미국 국립보건연구원 (NIH)의 연구과제(R01) 지원을 받아 수행됐다.
바이러스 면역반응‘켰다 껐다’단백질 스위치 발견
팬데믹 이후에도 다양한 신종 감염병이 출현하며 우리는 여전히 강력하고 지속적인 면역 방어를 요구하는 바이러스 위협에 직면해 있다. 동시에 과잉으로 면역 체계가 반응하면 오히려 몸의 조직을 해치는 부작용이 생기기도 한다. KAIST·국제 연구진이 이런 바이러스에 면역 반응을 조절하는 스위치 역할의 단백질을 찾아내는데 성공했다. 향후 감염병 대응과 자가면역질환 치료의 새로운 기반을 마련할 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 미국 플로리다주립대 차승희 교수 공동 연구팀이 세포 내 미토콘드리아에서 유래한 이중나선 RNA가 면역반응을 증폭시키는 메커니즘을 규명하고, 이를 조절하는 단백질 슬러프(SLIRP)가 바이러스 감염과 자가면역질환 양쪽에서 ‘면역 스위치’ 역할을 수행하는 것을 밝혀냈다.
자가면역질환은 면역 체계가 외부 침입자와 자기 조직을 구분하지 못하고 스스로를 공격하는 질환으로, 쉐그렌 증후군, 전신홍반루푸스 등으로 아직 명확한 발병 원인도 밝혀지지 않고, 효과적인 치료제도 드물다.
따라서 면역 과활성화를 유도하는 분자적 기전을 규명하고, 이를 조절할 수 있는 인자를 찾아내고자 생명화학공학과 김유식 교수 연구팀은 세포 내 기관에서 만들어지는 유전물질인 미토콘드리아 이중나선 RNA (mitochondrial double-stranded RNA, 이하 mt-dsRNA)에 주목했다.
엠티 디에스알엔에이(mt-dsRNA)는 바이러스 RNA와 유사하여 감염 바이러스가 없어도 우리 몸에서는 바이러스로 착각하고 면역반응을 유도할 수 있다는 점에 착안했다.
연구진은 면역 반응을 증폭시키는 단백질 슬러프를 발견하였고 실제로 다양한 자가면역질환 환자의 조직과 바이러스 자극을 모사한 실험 모델에서 슬러프 발현이 증가하는 것으로 확인했고, 반대로 슬러프를 억제했을 때는 면역반응이 현저히 감소되는것을 확인했다.
실험 결과, 슬러프가 면역 증폭의 핵심 인자임을 입증했고, 슬러프 단백질이 mt-dsRNA를 안정화시키고 축적시키는 역할을 하여, 이로 인해 면역반응이 증폭된다는 사실을 알아냈다.
이번 연구는 슬러프 단백질의 기능을 바이러스 감염 및 자가면역질환이라는 상반된 환경에서도 검증했다. 인간 베타 코로나바이러스 OC43과 뇌심근염 바이러스 EMCV에 감염된 세포에서 슬러프를 억제했을 때 항바이러스 반응이 감소하고, 바이러스 복제가 증가함을 확인했다.
반면, 대표적인 자가면역질환인 쉐그렌 증후군 환자의 혈액과 침샘 세포에서는 슬러프와 엠티 디에스알엔에이의 발현이 높게 나타났고, 슬러프를 억제했을 때 비정상적인 면역반응이 완화되는 경향도 관찰되었다.
이는 슬러프가 감염과 자가면역질환 모두에서 면역반응을 조절하는 중요한 분자 스위치라는 사실음 뒷받침한다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 슬러프 단백질이 엠티 디에스알엔에이(mt-dsRNA)를 기반으로 면역반응의 증폭을 유도하는 핵심 인자임을 규명했다ˮ면서 "특히, 슬러프가 자가면역질환과 바이러스 감염에서 공통적으로 작동하는 면역 조절자라는 점에서, 슬러프를 타깃으로 한 면역 균형 조절 전략이 다양한 질환에 적용될 수 있을 것으로 기대된다ˮ라고 말했다.
생명화학공학과 박사과정 구도영(제1저자), 석사과정 양예원 학생(제2저자)이 참여한 이번 연구는 국제학술지 `셀 리포츠 (Cell Reports)'에 지난 4월 19일 온라인 게재됐다.
※ 논문명 : SLIRP amplifies antiviral signaling via positive feedback regulation and contributes to autoimmune diseases https://doi.org/10.1016/j.celrep.2025.115588
※ 주저자: 구도영(KAIST, 제1저자), 양예원(KAIST, 제2저자), 차승희(플로리다 주립대, 교신저자), 김유식(KAIST, 교신저자)
이번 연구는 보건복지부의 공익적 의료기술연구사업과 미국 국립보건연구원 (NIH)의 연구과제(R01) 지원을 받아 수행됐다.
2025.05.14
조회수 3501
-
 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08
조회수 3096
-
 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10
조회수 3927
-
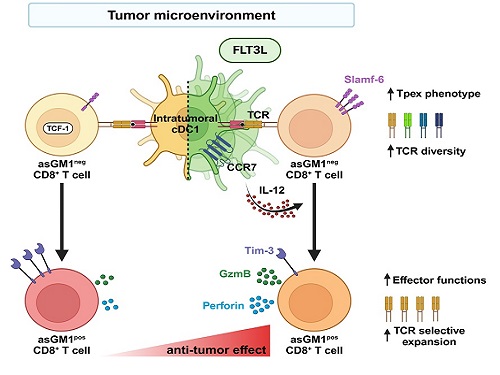 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07
조회수 3779
-
 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11
조회수 5097
-
 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06
조회수 6155
-
 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08
조회수 5525
-
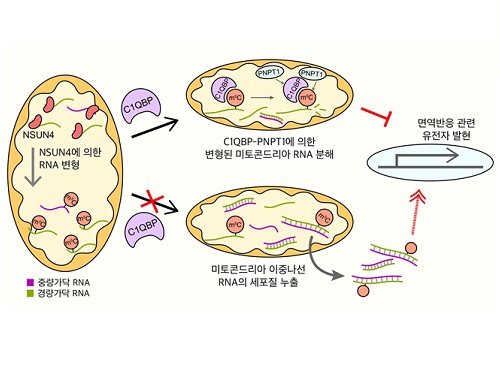 미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22
조회수 5497
-
 면역력이 더 높은 성별과 그 이유를 밝혀내다
남자와 여자가 생물학적으로 다른 점 중 하나는 면역력의 차이이다. 하지만 성별에 따른 면역반응을 조절하는 유전자와 생물학적 경로를 알아내는 것은 아직까지 과제로 남아있었다. 우리 연구진이 수컷 선충의 면역력을 높이는 단백질이 더 활성화됨을 밝혀내 화제다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강 장수 연구센터)이 *자가포식 활성화 정도가 성별에 따른 면역력 차이에 미치는 영향을 발견했다고 18일 밝혔다.
*자가포식(오토파지): 세포가 필요 없거나 손상된 세포 구성 성분을 스스로 제거하는 과정. 이 과정을 통해 세포의 항상성을 유지하고 외부 스트레스에 대응함.
연구진은 인간의 생명 현상을 연구하기 위한 중요한 모델 생물인 예쁜꼬마선충을 활용해 성별에 따른 면역반응의 차이를 연구했다. 연구진은 예쁜꼬마선충의 수컷이 자웅동체보다 다양한 병원균에 대해 더 높은 면역력을 보이며, 이는 자가포식에 중요한 전사 인자인 단백질(HLH-30/TFEB*) 이 높게 활성화되어서임을 밝혔다.
*HLH-30/TFEB (에이치엘에이치30/티페브)
단백질(HLH-30/TFEB)은 외부 스트레스에 대응한 자가포식을 향상해 병원균에 대한 저항력을 높여주는 중요한 단백질로, 수컷 선충의 경우 이 단백질이 더욱 활발하게 작동하여 면역력을 크게 높이는 것으로 나타났다.
이번 연구는 성별에 따른 자가포식 차이가 면역력에 미치는 영향을 규명함으로써, 감염성 질병 치료와 면역력 강화에 새로운 접근법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 “이번 연구는 성별에 따른 면역력 차이의 원인이 자가포식 활성화 정도에 있음을 밝혀낸 중요한 연구이며, 이를 통해 향후 인간을 비롯한 생명체의 면역반응을 제어하는 새로운 방법을 찾을 수 있을 것”이라고 연구의 중요성을 설명했다.
이번 연구는 생명과학과 손주연 석박사통합과정, 권수정 박사, 이기윤 석박사통합과정이 공동 제1 저자로 참여해 세계적인 과학학술지 ‘오토파지(Autophagy)’에 지난 7월 4일 날짜로 게재됐다.
(논문명: HLH-30/TFEB mediates sexual dimorphism in immunity in Caenorhabditis elegans)
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
면역력이 더 높은 성별과 그 이유를 밝혀내다
남자와 여자가 생물학적으로 다른 점 중 하나는 면역력의 차이이다. 하지만 성별에 따른 면역반응을 조절하는 유전자와 생물학적 경로를 알아내는 것은 아직까지 과제로 남아있었다. 우리 연구진이 수컷 선충의 면역력을 높이는 단백질이 더 활성화됨을 밝혀내 화제다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강 장수 연구센터)이 *자가포식 활성화 정도가 성별에 따른 면역력 차이에 미치는 영향을 발견했다고 18일 밝혔다.
*자가포식(오토파지): 세포가 필요 없거나 손상된 세포 구성 성분을 스스로 제거하는 과정. 이 과정을 통해 세포의 항상성을 유지하고 외부 스트레스에 대응함.
연구진은 인간의 생명 현상을 연구하기 위한 중요한 모델 생물인 예쁜꼬마선충을 활용해 성별에 따른 면역반응의 차이를 연구했다. 연구진은 예쁜꼬마선충의 수컷이 자웅동체보다 다양한 병원균에 대해 더 높은 면역력을 보이며, 이는 자가포식에 중요한 전사 인자인 단백질(HLH-30/TFEB*) 이 높게 활성화되어서임을 밝혔다.
*HLH-30/TFEB (에이치엘에이치30/티페브)
단백질(HLH-30/TFEB)은 외부 스트레스에 대응한 자가포식을 향상해 병원균에 대한 저항력을 높여주는 중요한 단백질로, 수컷 선충의 경우 이 단백질이 더욱 활발하게 작동하여 면역력을 크게 높이는 것으로 나타났다.
이번 연구는 성별에 따른 자가포식 차이가 면역력에 미치는 영향을 규명함으로써, 감염성 질병 치료와 면역력 강화에 새로운 접근법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 “이번 연구는 성별에 따른 면역력 차이의 원인이 자가포식 활성화 정도에 있음을 밝혀낸 중요한 연구이며, 이를 통해 향후 인간을 비롯한 생명체의 면역반응을 제어하는 새로운 방법을 찾을 수 있을 것”이라고 연구의 중요성을 설명했다.
이번 연구는 생명과학과 손주연 석박사통합과정, 권수정 박사, 이기윤 석박사통합과정이 공동 제1 저자로 참여해 세계적인 과학학술지 ‘오토파지(Autophagy)’에 지난 7월 4일 날짜로 게재됐다.
(논문명: HLH-30/TFEB mediates sexual dimorphism in immunity in Caenorhabditis elegans)
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
2024.07.18
조회수 5003
-
 세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22
조회수 7942
-
 DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.04
조회수 6309
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 667
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 667 바이러스 면역반응‘켰다 껐다’단백질 스위치 발견
팬데믹 이후에도 다양한 신종 감염병이 출현하며 우리는 여전히 강력하고 지속적인 면역 방어를 요구하는 바이러스 위협에 직면해 있다. 동시에 과잉으로 면역 체계가 반응하면 오히려 몸의 조직을 해치는 부작용이 생기기도 한다. KAIST·국제 연구진이 이런 바이러스에 면역 반응을 조절하는 스위치 역할의 단백질을 찾아내는데 성공했다. 향후 감염병 대응과 자가면역질환 치료의 새로운 기반을 마련할 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 미국 플로리다주립대 차승희 교수 공동 연구팀이 세포 내 미토콘드리아에서 유래한 이중나선 RNA가 면역반응을 증폭시키는 메커니즘을 규명하고, 이를 조절하는 단백질 슬러프(SLIRP)가 바이러스 감염과 자가면역질환 양쪽에서 ‘면역 스위치’ 역할을 수행하는 것을 밝혀냈다.
자가면역질환은 면역 체계가 외부 침입자와 자기 조직을 구분하지 못하고 스스로를 공격하는 질환으로, 쉐그렌 증후군, 전신홍반루푸스 등으로 아직 명확한 발병 원인도 밝혀지지 않고, 효과적인 치료제도 드물다.
따라서 면역 과활성화를 유도하는 분자적 기전을 규명하고, 이를 조절할 수 있는 인자를 찾아내고자 생명화학공학과 김유식 교수 연구팀은 세포 내 기관에서 만들어지는 유전물질인 미토콘드리아 이중나선 RNA (mitochondrial double-stranded RNA, 이하 mt-dsRNA)에 주목했다.
엠티 디에스알엔에이(mt-dsRNA)는 바이러스 RNA와 유사하여 감염 바이러스가 없어도 우리 몸에서는 바이러스로 착각하고 면역반응을 유도할 수 있다는 점에 착안했다.
연구진은 면역 반응을 증폭시키는 단백질 슬러프를 발견하였고 실제로 다양한 자가면역질환 환자의 조직과 바이러스 자극을 모사한 실험 모델에서 슬러프 발현이 증가하는 것으로 확인했고, 반대로 슬러프를 억제했을 때는 면역반응이 현저히 감소되는것을 확인했다.
실험 결과, 슬러프가 면역 증폭의 핵심 인자임을 입증했고, 슬러프 단백질이 mt-dsRNA를 안정화시키고 축적시키는 역할을 하여, 이로 인해 면역반응이 증폭된다는 사실을 알아냈다.
이번 연구는 슬러프 단백질의 기능을 바이러스 감염 및 자가면역질환이라는 상반된 환경에서도 검증했다. 인간 베타 코로나바이러스 OC43과 뇌심근염 바이러스 EMCV에 감염된 세포에서 슬러프를 억제했을 때 항바이러스 반응이 감소하고, 바이러스 복제가 증가함을 확인했다.
반면, 대표적인 자가면역질환인 쉐그렌 증후군 환자의 혈액과 침샘 세포에서는 슬러프와 엠티 디에스알엔에이의 발현이 높게 나타났고, 슬러프를 억제했을 때 비정상적인 면역반응이 완화되는 경향도 관찰되었다.
이는 슬러프가 감염과 자가면역질환 모두에서 면역반응을 조절하는 중요한 분자 스위치라는 사실음 뒷받침한다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 슬러프 단백질이 엠티 디에스알엔에이(mt-dsRNA)를 기반으로 면역반응의 증폭을 유도하는 핵심 인자임을 규명했다ˮ면서 "특히, 슬러프가 자가면역질환과 바이러스 감염에서 공통적으로 작동하는 면역 조절자라는 점에서, 슬러프를 타깃으로 한 면역 균형 조절 전략이 다양한 질환에 적용될 수 있을 것으로 기대된다ˮ라고 말했다.
생명화학공학과 박사과정 구도영(제1저자), 석사과정 양예원 학생(제2저자)이 참여한 이번 연구는 국제학술지 `셀 리포츠 (Cell Reports)'에 지난 4월 19일 온라인 게재됐다.
※ 논문명 : SLIRP amplifies antiviral signaling via positive feedback regulation and contributes to autoimmune diseases https://doi.org/10.1016/j.celrep.2025.115588
※ 주저자: 구도영(KAIST, 제1저자), 양예원(KAIST, 제2저자), 차승희(플로리다 주립대, 교신저자), 김유식(KAIST, 교신저자)
이번 연구는 보건복지부의 공익적 의료기술연구사업과 미국 국립보건연구원 (NIH)의 연구과제(R01) 지원을 받아 수행됐다.
2025.05.14 조회수 3501
바이러스 면역반응‘켰다 껐다’단백질 스위치 발견
팬데믹 이후에도 다양한 신종 감염병이 출현하며 우리는 여전히 강력하고 지속적인 면역 방어를 요구하는 바이러스 위협에 직면해 있다. 동시에 과잉으로 면역 체계가 반응하면 오히려 몸의 조직을 해치는 부작용이 생기기도 한다. KAIST·국제 연구진이 이런 바이러스에 면역 반응을 조절하는 스위치 역할의 단백질을 찾아내는데 성공했다. 향후 감염병 대응과 자가면역질환 치료의 새로운 기반을 마련할 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 미국 플로리다주립대 차승희 교수 공동 연구팀이 세포 내 미토콘드리아에서 유래한 이중나선 RNA가 면역반응을 증폭시키는 메커니즘을 규명하고, 이를 조절하는 단백질 슬러프(SLIRP)가 바이러스 감염과 자가면역질환 양쪽에서 ‘면역 스위치’ 역할을 수행하는 것을 밝혀냈다.
자가면역질환은 면역 체계가 외부 침입자와 자기 조직을 구분하지 못하고 스스로를 공격하는 질환으로, 쉐그렌 증후군, 전신홍반루푸스 등으로 아직 명확한 발병 원인도 밝혀지지 않고, 효과적인 치료제도 드물다.
따라서 면역 과활성화를 유도하는 분자적 기전을 규명하고, 이를 조절할 수 있는 인자를 찾아내고자 생명화학공학과 김유식 교수 연구팀은 세포 내 기관에서 만들어지는 유전물질인 미토콘드리아 이중나선 RNA (mitochondrial double-stranded RNA, 이하 mt-dsRNA)에 주목했다.
엠티 디에스알엔에이(mt-dsRNA)는 바이러스 RNA와 유사하여 감염 바이러스가 없어도 우리 몸에서는 바이러스로 착각하고 면역반응을 유도할 수 있다는 점에 착안했다.
연구진은 면역 반응을 증폭시키는 단백질 슬러프를 발견하였고 실제로 다양한 자가면역질환 환자의 조직과 바이러스 자극을 모사한 실험 모델에서 슬러프 발현이 증가하는 것으로 확인했고, 반대로 슬러프를 억제했을 때는 면역반응이 현저히 감소되는것을 확인했다.
실험 결과, 슬러프가 면역 증폭의 핵심 인자임을 입증했고, 슬러프 단백질이 mt-dsRNA를 안정화시키고 축적시키는 역할을 하여, 이로 인해 면역반응이 증폭된다는 사실을 알아냈다.
이번 연구는 슬러프 단백질의 기능을 바이러스 감염 및 자가면역질환이라는 상반된 환경에서도 검증했다. 인간 베타 코로나바이러스 OC43과 뇌심근염 바이러스 EMCV에 감염된 세포에서 슬러프를 억제했을 때 항바이러스 반응이 감소하고, 바이러스 복제가 증가함을 확인했다.
반면, 대표적인 자가면역질환인 쉐그렌 증후군 환자의 혈액과 침샘 세포에서는 슬러프와 엠티 디에스알엔에이의 발현이 높게 나타났고, 슬러프를 억제했을 때 비정상적인 면역반응이 완화되는 경향도 관찰되었다.
이는 슬러프가 감염과 자가면역질환 모두에서 면역반응을 조절하는 중요한 분자 스위치라는 사실음 뒷받침한다.
생명화학공학과 김유식 교수는 "이번 연구를 통해 슬러프 단백질이 엠티 디에스알엔에이(mt-dsRNA)를 기반으로 면역반응의 증폭을 유도하는 핵심 인자임을 규명했다ˮ면서 "특히, 슬러프가 자가면역질환과 바이러스 감염에서 공통적으로 작동하는 면역 조절자라는 점에서, 슬러프를 타깃으로 한 면역 균형 조절 전략이 다양한 질환에 적용될 수 있을 것으로 기대된다ˮ라고 말했다.
생명화학공학과 박사과정 구도영(제1저자), 석사과정 양예원 학생(제2저자)이 참여한 이번 연구는 국제학술지 `셀 리포츠 (Cell Reports)'에 지난 4월 19일 온라인 게재됐다.
※ 논문명 : SLIRP amplifies antiviral signaling via positive feedback regulation and contributes to autoimmune diseases https://doi.org/10.1016/j.celrep.2025.115588
※ 주저자: 구도영(KAIST, 제1저자), 양예원(KAIST, 제2저자), 차승희(플로리다 주립대, 교신저자), 김유식(KAIST, 교신저자)
이번 연구는 보건복지부의 공익적 의료기술연구사업과 미국 국립보건연구원 (NIH)의 연구과제(R01) 지원을 받아 수행됐다.
2025.05.14 조회수 3501 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 3096
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 3096 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 3927
선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 3927 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3779
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3779 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 5097
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 5097 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 6155
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 6155 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5525
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5525 미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22 조회수 5497
미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22 조회수 5497 면역력이 더 높은 성별과 그 이유를 밝혀내다
남자와 여자가 생물학적으로 다른 점 중 하나는 면역력의 차이이다. 하지만 성별에 따른 면역반응을 조절하는 유전자와 생물학적 경로를 알아내는 것은 아직까지 과제로 남아있었다. 우리 연구진이 수컷 선충의 면역력을 높이는 단백질이 더 활성화됨을 밝혀내 화제다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강 장수 연구센터)이 *자가포식 활성화 정도가 성별에 따른 면역력 차이에 미치는 영향을 발견했다고 18일 밝혔다.
*자가포식(오토파지): 세포가 필요 없거나 손상된 세포 구성 성분을 스스로 제거하는 과정. 이 과정을 통해 세포의 항상성을 유지하고 외부 스트레스에 대응함.
연구진은 인간의 생명 현상을 연구하기 위한 중요한 모델 생물인 예쁜꼬마선충을 활용해 성별에 따른 면역반응의 차이를 연구했다. 연구진은 예쁜꼬마선충의 수컷이 자웅동체보다 다양한 병원균에 대해 더 높은 면역력을 보이며, 이는 자가포식에 중요한 전사 인자인 단백질(HLH-30/TFEB*) 이 높게 활성화되어서임을 밝혔다.
*HLH-30/TFEB (에이치엘에이치30/티페브)
단백질(HLH-30/TFEB)은 외부 스트레스에 대응한 자가포식을 향상해 병원균에 대한 저항력을 높여주는 중요한 단백질로, 수컷 선충의 경우 이 단백질이 더욱 활발하게 작동하여 면역력을 크게 높이는 것으로 나타났다.
이번 연구는 성별에 따른 자가포식 차이가 면역력에 미치는 영향을 규명함으로써, 감염성 질병 치료와 면역력 강화에 새로운 접근법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 “이번 연구는 성별에 따른 면역력 차이의 원인이 자가포식 활성화 정도에 있음을 밝혀낸 중요한 연구이며, 이를 통해 향후 인간을 비롯한 생명체의 면역반응을 제어하는 새로운 방법을 찾을 수 있을 것”이라고 연구의 중요성을 설명했다.
이번 연구는 생명과학과 손주연 석박사통합과정, 권수정 박사, 이기윤 석박사통합과정이 공동 제1 저자로 참여해 세계적인 과학학술지 ‘오토파지(Autophagy)’에 지난 7월 4일 날짜로 게재됐다.
(논문명: HLH-30/TFEB mediates sexual dimorphism in immunity in Caenorhabditis elegans)
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
2024.07.18 조회수 5003
면역력이 더 높은 성별과 그 이유를 밝혀내다
남자와 여자가 생물학적으로 다른 점 중 하나는 면역력의 차이이다. 하지만 성별에 따른 면역반응을 조절하는 유전자와 생물학적 경로를 알아내는 것은 아직까지 과제로 남아있었다. 우리 연구진이 수컷 선충의 면역력을 높이는 단백질이 더 활성화됨을 밝혀내 화제다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강 장수 연구센터)이 *자가포식 활성화 정도가 성별에 따른 면역력 차이에 미치는 영향을 발견했다고 18일 밝혔다.
*자가포식(오토파지): 세포가 필요 없거나 손상된 세포 구성 성분을 스스로 제거하는 과정. 이 과정을 통해 세포의 항상성을 유지하고 외부 스트레스에 대응함.
연구진은 인간의 생명 현상을 연구하기 위한 중요한 모델 생물인 예쁜꼬마선충을 활용해 성별에 따른 면역반응의 차이를 연구했다. 연구진은 예쁜꼬마선충의 수컷이 자웅동체보다 다양한 병원균에 대해 더 높은 면역력을 보이며, 이는 자가포식에 중요한 전사 인자인 단백질(HLH-30/TFEB*) 이 높게 활성화되어서임을 밝혔다.
*HLH-30/TFEB (에이치엘에이치30/티페브)
단백질(HLH-30/TFEB)은 외부 스트레스에 대응한 자가포식을 향상해 병원균에 대한 저항력을 높여주는 중요한 단백질로, 수컷 선충의 경우 이 단백질이 더욱 활발하게 작동하여 면역력을 크게 높이는 것으로 나타났다.
이번 연구는 성별에 따른 자가포식 차이가 면역력에 미치는 영향을 규명함으로써, 감염성 질병 치료와 면역력 강화에 새로운 접근법을 제시했다는 점에서 의의가 크다.
연구를 주도한 생명과학과 이승재 교수는 “이번 연구는 성별에 따른 면역력 차이의 원인이 자가포식 활성화 정도에 있음을 밝혀낸 중요한 연구이며, 이를 통해 향후 인간을 비롯한 생명체의 면역반응을 제어하는 새로운 방법을 찾을 수 있을 것”이라고 연구의 중요성을 설명했다.
이번 연구는 생명과학과 손주연 석박사통합과정, 권수정 박사, 이기윤 석박사통합과정이 공동 제1 저자로 참여해 세계적인 과학학술지 ‘오토파지(Autophagy)’에 지난 7월 4일 날짜로 게재됐다.
(논문명: HLH-30/TFEB mediates sexual dimorphism in immunity in Caenorhabditis elegans)
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
2024.07.18 조회수 5003 세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22 조회수 7942
세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22 조회수 7942 DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.04 조회수 6309
DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.04 조회수 6309